Revmatická polymyalgie – je účinná biologická léčba?
Polymyalgia rheumatica – is the biological therapy effective?
Both polymyalgia rheumatica (PMR) and giant-cell arteritis (temporal arteritis, TA) relatively often affect people in old age, have an acute course and cause significant functional impairment. Manifestations of PMR can often resemble those of rheumatoid arthritis (RA). Thus, to differentiate these conditions may be uneasy. In terms of treatment, RA can be treated with chemical agents, disease modifying antirheumatic drugs and glucocorticoids as well as biological agents.Whereas in PMR, glucocorticoid therapy, associated with the side effect burden, is still the only successful treatment. The use of immunosuppressive therapy appears to be effective in patients with diminished response to glucocorticoids or an inability to use the adequate doses. Considering some common etiopathogenetic mechanisms of these two conditions the efficacy of disease modifying chemical and biological agents of rheumatoid arthritis has also been investigated in polymyalgia rheumatica.
Key words:
Polymyalgia rheumatica, biological therapy, glucocorticoids, anti-TNF therapy
Authors:
A. Pavelková
Authors‘ workplace:
Revmatologický ústav, Praha
Published in:
Čes. Revmatol., 21, 2013, No. 4, p. 183-188.
Category:
Rewiev
Overview
Revmatická polymyalgie (PMR) a případně i obrovsko-buněčná temporální arteritida (TA) postihují relativně často osoby ve vyšším věku a mají akutní průběh s výrazným funkčním postižením. Projevy PMR mohou často připomínat revmatoidní artritidu (RA) a odlišit tyto jednotky nemusí být jednoduché. Z hlediska léčby má RA kromě chemických, chorobu modifikujících léků a glukokortikoidů k dispozici i biologickou léčbu, zatímco u PMR je dosud jedinou úspěšnou terapií léčba glukokortikoidy, která s sebou nese i množství nežádoucích účinků. Použití imunosupresivní léčby se jeví jako účelné u nemocných se sníženou odpovědí na glukokortikoidy či při nemožnosti použití adekvátních dávek. Na základě některých společných etiopatogenetických mechanismů byla zkoumána i možnost úspěšného použití chorobu modifikujících chemických i biologických léků revmatoidní artritidy i u revmatické polymyalgie.
Klíčová slova:
Revmatická polymyalgie, biologická léčba, glukokortikoidy, anti-TNF therapy
Úvod
Polymyalgia revmatica je poměrně časté zánětlivé revmatické onemocnění postihující s vyšší incidencí nemocné nad 50 let věku. Často bývá spojena s obrovskobuněčnou temporální arteritidou. PMR je heterogenní onemocnění s výrazným dopadem na kvalitu života. Klinicky je u PMR přítomna symetrická bolest a ztuhlost pletence ramenního kloubu, méně často pletence pánevního, spolu s bolestí a ztuhlostí krční a dolní bederní páteře. Jsou časté i výrazné celkové příznaky – únava, teploty, nechutenství, nevýkonnost a jiné nespecifické projevy, stejně jako ranní ztuhlost přesahující trvání 30 minut. TA je systémová vaskulitida postihující nejčastěji temporální arterii, projevující se bolestí hlavy, místním zduřením v oblasti temporální arterie, bolestí a oslabením její pulzace. Komplikací tohoto onemocnění je postižení zraku, jako důsledek okluze orbitální arterie, které může vést ke slepotě. Obě tyto jednotky se mohou objevit současně, samostatně nebo jedna v druhou mohou přecházet a jejich přesný vztah zůstává dosud nejasný. PMR je 2–3krát častější onemocnění než TA. V laboratorním obraze u obou jednotek dominuje vysoká sedimentace erytrocytů (FW) a CRP (1). Neexistuje však žádný specifický laboratorní test pro tato onemocnění a diagnóza je založena zejména na klinických příznacích. Obě tyto choroby nezřídka recidivují.
Diagnostika
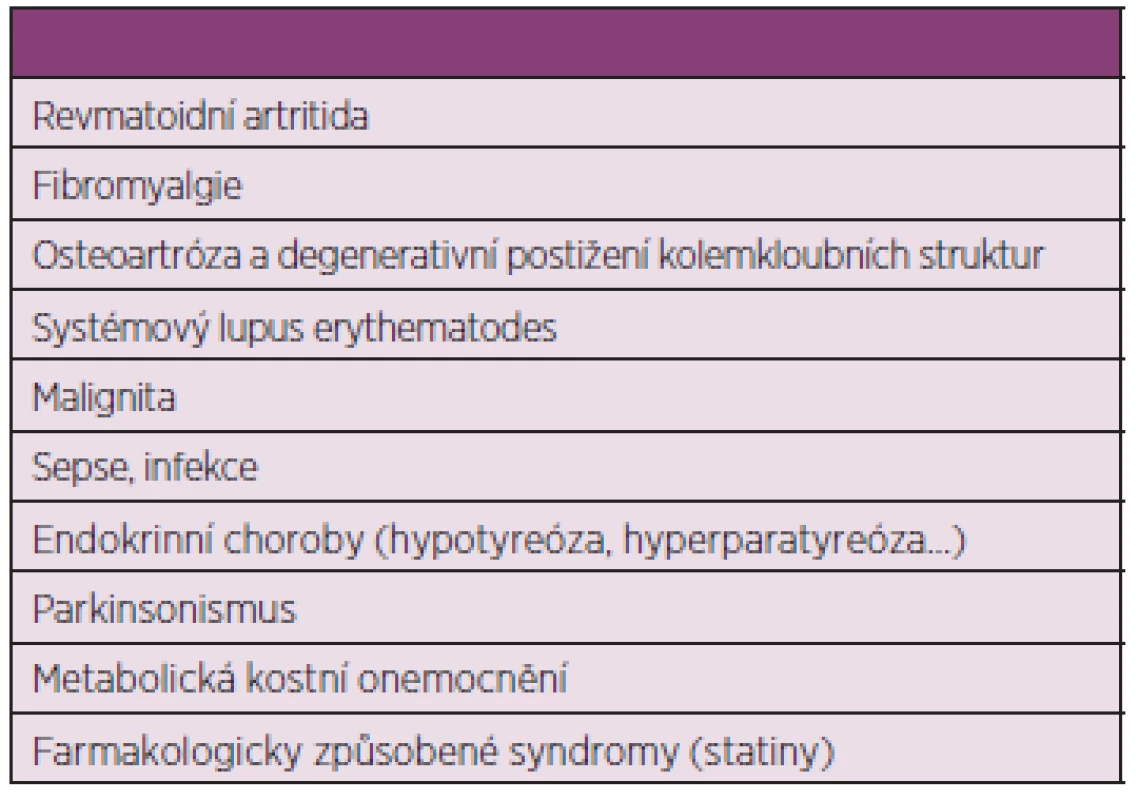
V roce 2012 byla navržena skupinou EULAR nová klasifikační kritéria pro PMR, která však neslouží pro diagnostické účely. Pomocí skórovacího systému hodnotí ranní ztuhlost, pletencovou bolest, absenci revmatoidních faktorů, sonografický nález. Určují senzitivitu a specificitu pro přítomnost PMR (2). Diagnostická kritéria jsou založena na přítomnosti určitých příznaků (pletencové bolesti, ranní ztuhlost delší než 45 minut, věk nad 50 let, trvání delší než 2 týdny, zvýšené reaktanty akutní fáze) a nepřítomnosti jiných onemocnění, která mohou PMR připomínat: tumor, infekce, zánětlivá revmatická onemocnění, fibromyalgie, hypotyreóza, léky způsobené onemocnění (např. myopatie při léčbě statiny), lokální kloubní postižení (rameno, kyčelní kloub) (3) tab. 1.
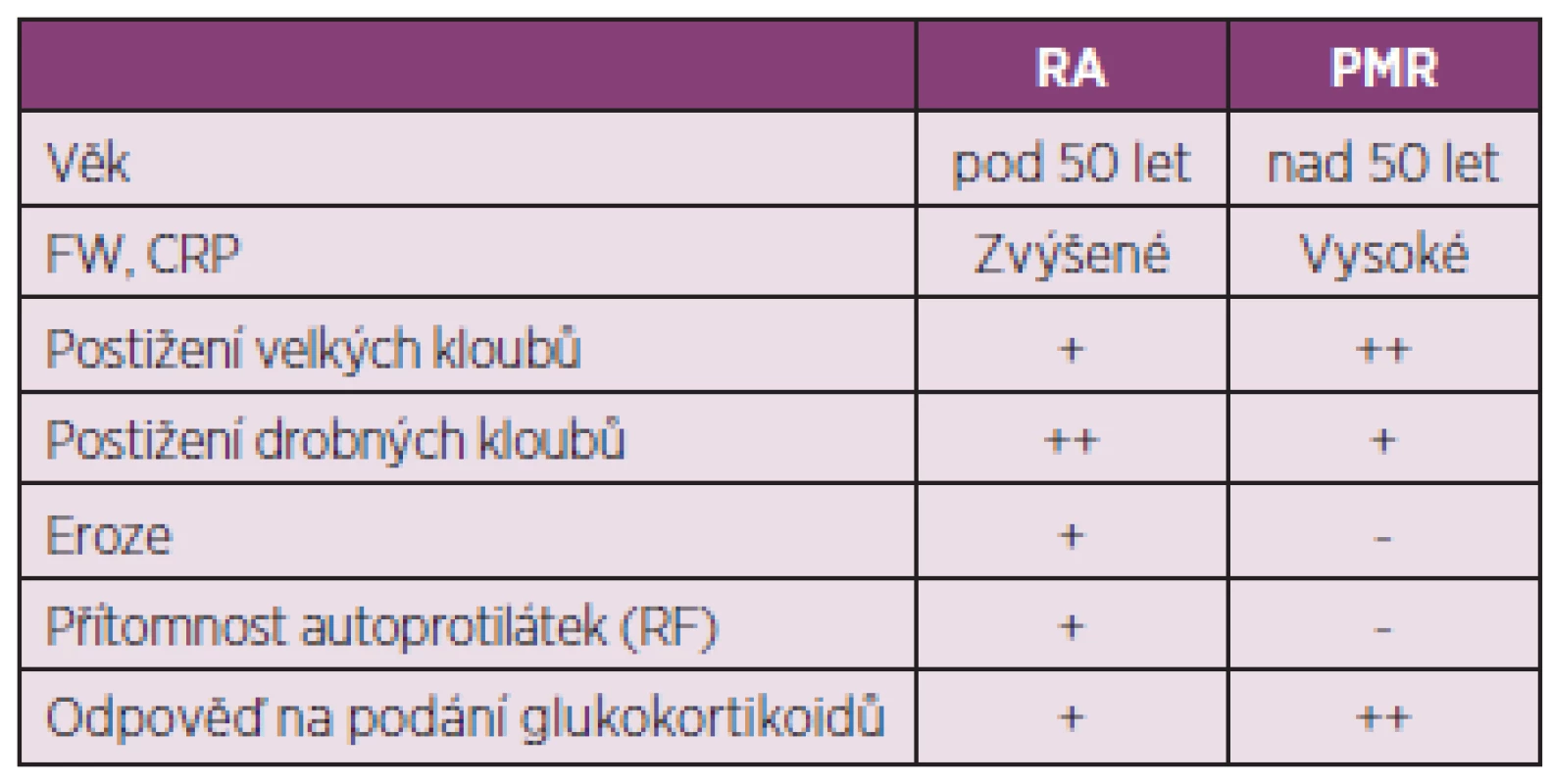
Diferenciální diagnostika PMR a RA není někdy jednoduchá (tab. 2). Až u čtvrtiny pacientů může být přítomna neerozivní periferní, častěji asymetrická, artritida kolenních i drobných kloubů. Také celkové příznaky a bolesti zejména ramenních kloubů nezřídka provázené synovitidou průkaznou při sonografickém vyšetření mohou někdy RA připomínat.(4) Ze zobrazovacích vyšetření zůstává nejpřínosnější vyšetření sonografické, MRI a PET. Nejčastějšími nálezy ze zobrazovacích vyšetření jsou bilaterální subakromiální burzitida, tenosynovitida dlouhé šlachy bicepsu a trochanterická burzitida (5).
Etiologie, patogeneze a epidemiologie
Etiologie PMR stejně tak jako RA zůstává nejasná. Jistě se spolupodílí vliv genetických rizikových faktorů a vliv prostředí. Z genetických faktorů se zdá důležitá přítomnost HLA-DR4. Nejčastější je toto onemocnění ve Skandinávii, méně časté ve Středomoří a vůbec nejnižší výskyt je popisován v arabských a asijských zemích. Z četných studií vyplývá i sezónní výskyt, což může souviset s infekčními faktory v prostředí. Ženy bývají stejně jako u RA postiženy dvakrát častěji než muži (2). Incidence tohoto onemocnění se pohybuje mezi 13–113/100 000 obyvatel nad 50 let.
U RA je stejně tak častější výskyt v Evropě a Severní Americe a nižší v jižních zemích, až třikrát častěji bývají postiženy ženy. Incidence se pohybuje mezi 10–50/ 100 000 obyvatel. Většina pacientů na rozdíl od PMR však onemocní mezi 35.–50. rokem věku. Vznik RA má také genetické pozadí, heretabilita s pohybuje okolo 40–60 %.
Etiopatogeneze a patofyziologie PMR také není zcela jasná. PMR odráží zánětlivý proces synoviálních membrán, burz a šlach. (6) Z oblasti buněčné imunity dochází k poklesu T-lymfocytů CD8+, které se aktivují a působí přímo cytotoxicky nebo prostřednictvím uvolněných proteolytických enzymů, které mají prozánětlivé účinky. V některých studiích byly nalezeny v intersticiu postižených svalů zvýšené hladiny prozánětlivých cytokinů – např. IL-6, TNF-alfa. Oba tyto cytokiny zvyšují hladiny reaktantů akutní fáze a působí nociceptivně (7). U aktivní PMR byly nalezeny zvýšené sérové hladiny IL-6, které jsou nejspíše produkovány v zánětlivě změněné tkáni. Léčba glukokortikoidy tuto zvýšenou hladinu rychle snižuje (8). V biopsii postižené temporální arterie bývají nalezeny imunofluorescenční metodou depozita IgG, IgM a IgA, v cévní stěně nacházíme infiltráty mononukleárů, T-lymfocytů CD4+ a makrofágů. Také při TA se vyskytují vyšší hladiny IL-6 (9).
U RA dochází k infiltraci synoviální membrány zánětlivými buňkami (B lymfocyty, T lymfocyty, makrofágy, synoviálními fibroblasty a neutrofily). Proliferace zánětlivé tkáně uvnitř kloubu vyvolá destrukci chrupavky a aktivované osteoklasty jsou zodpovědné za erozivní změny na kosti, typickými pro RA. Tyto erozivní změny v oblasti kloubů u PMR přítomny nejsou. V patogenezi RA se také uplatňují prozánětlivé cytokiny, TNF-alfa, IL-6, IL-17. Některé z nich dále působí na synoviální fibroblasty a makrofágy, stimulují sekreci dalších cytokinů, které působí na osteoklasty. Na persistenci chronického zánětu se podílejí i T a B lymfocty.
Terapie první volby – glukokortikoidy
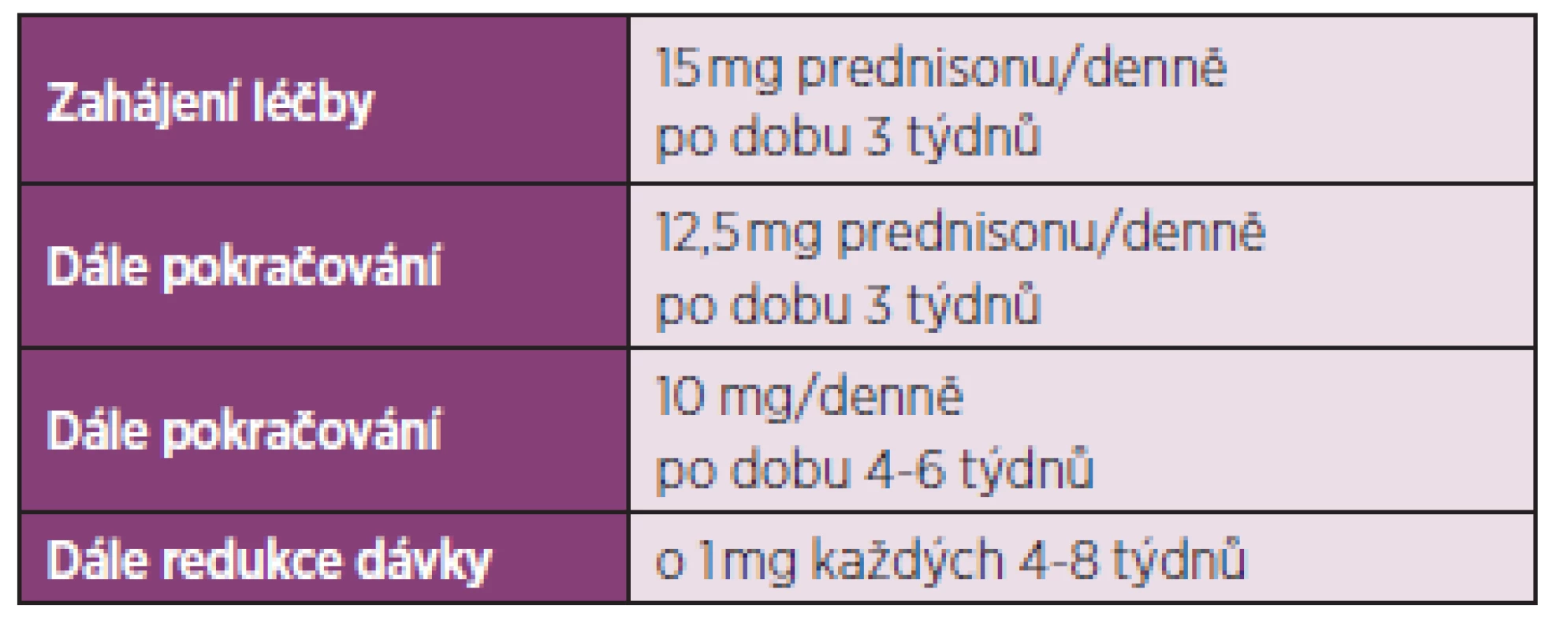
Z výše popsaných změn na úrovni cytokinů je patrné, že obě tyto jednotky mají mnoho společného. Zatímco chorobu modifikující léčba revmatoidní artritidy zahrnuje široké spektrum farmakoterapeutických postupů, u PMR byla jedinou účinnou léčbou dosud kortikoterapie, která vede k snížení reaktantů akutní fáze a vymizení příznaků onemocnění, avšak nese s sebou vzhledem k dlouhodobému podávání glukokortikoidů i četná rizika. Mezi nejzávažnější patří zejména osteoporóza, nárůst hmotnosti, Cushingův syndrom, postižení kůže, zvýšení krevního tlaku, steroidní diabetes, deprese, zvýšené riziko infekcí, katarakta, glaukom. Až 25–30 % nemocných má chronické recidivující onemocnění a léčbu je třeba ponechat dlouhodobě několik let. Až u 65 % nemocných s PMR léčených glukokortikoidy se vyvine minimálně jeden nežádoucí účinek. Mezi faktory, které zvyšují riziko vzniku nežádoucích účinků terapie, patří věk v době diagnózy, kumulativní dávka prednisonu minimálně 1800 mg a ženské pohlaví (10). Léčbu zahajujeme prednisonem v dávce 15 mg denně. V případě nedostatečného účinku je možné dávku zvýšit na 20 mg denně. Vyšší dávka je však spojena s vyšším výskytem nežádoucích účinků. Není-li účinek, je třeba revidovat diagnózu. V případě dobré odpovědi na léčbu glukokortikoidy je možné po několika týdnech zahájit jejich pozvolnou redukci (o 2,5 mg/měsíčně do dosažení dávky 10 mg/d). Při dobrém efektu a chybění známek aktivity je vhodné redukovat dávku o 1 mg každé 2 měsíce (11). Léčba však musí být individuální, měly by být zohledněny další faktory, jako přidružená onemocnění, závažnost příznaků, ale i přání pacienta. Britská revmatologická společnost navrhuje zahájení terapie 15 mg prednisonu po dobu 3 týdnů, pak snížení dávky na 12,5 mg po dobu 3 týdnů, dále podávání 10 mg po dobu 4–6 týdnů a dále snižování o 1 mg každé 4–8 týdnů – tab. 3 (3). Další autoři doporučují obdobné schéma, kde redukce dávky prednisonu by neměla být rychlejší než snižování o 1 mg měsíčně (12). Rozhodnutí o snižování dávky prednisonu by se mělo opírat o zmírnění klinických příznaků a snížení laboratorních zánětlivých parametrů (FW, CRP), CRP se jeví jako více senzitivní v detekci znovuvzplanutí choroby. Sérové hladiny IL-6 jsou nejvíce senzitivním markerem aktivity TA, avšak tento test se běžně nepoužívá (13). Léčba glukokortikoidy bývá nutná minimálně po dobu 1–2 let, což u starších nemocných spolu s komorbiditou ještě zvyšuje riziko nežádoucích účinků této terapie. Současné podávání nesteroidních antirevmatik (NSA) nepřináší oproti samostatné léčbě glukokortikoidy žádnou výhodu či možnost snížení jejich dávky, naopak dochází k nárůstu nežádoucích účinků. V léčbě TA je třeba počítat s vyšší iniciální dávkou glukokortikoidů (iniciální dávky se pohybují mezi 60–100 mg prednisonu denně).
Vzhledem k dlouhodobé léčbě glukokortikoidy v dávce nad 5 mg prednisonu denně se jako jeden z nejzávažnějších nežádoucích účinků jeví riziko vzniku glukokortikoidy indukované osteoporózy (GIOP). U těchto pacientů je třeba zahájit opatření k prevenci vzniku tohoto onemocnění (Doporučení České revmatologické společnosti) (14). Na počátku dlouhodobé léčby je třeba vyšetření denzitometrické (DXA), u všech pacientů zahájit suplementaci vitaminem D a kalciem, u pacientů s BMD nižší než -1,5 je vhodné podávat bisfosfonáty.
Imunosupresivní léčba u PMR
Chorobu modifikující léčba revmatoidní artritidy je zaměřena na redukci laboratorních i klinických známek zánětu, má zabránit ireverzibilním destruktivním změnám v oblasti kloubů, minimalizovat celkové a mimokloubní příznaky a udržet funkci. K dispozici máme konvenční chorobu modifikující léky (DMARDs) (např. methotrexát, leflunomid, sulfasalazin, hydroxychlorochin a ostatní), glukokortikoidy a tzv. biologické léky (etanercept, adalimumab, infliximab, abatacept, rituximab, golimumab, tocilizumab, certolizumab pegol). Methotrexát a podobně i leflunomid a sulfasalazin zpomalují rentgenovou progresi choroby (15). Podobně nižší dávky glukokortikoidů zpomalují rentgenovou progresi, avšak v menší míře než DMARDs. U RA používáme nejčastěji dávku 5–10 mg prednisonu denně perorálně, avšak velkým přínosem je i jejich intraartikulární podání. Mezi biologické léky tzv. první řady patří v ČR antagonisté tumor nekrotizujícího faktoru alfa (anti - TNF léky) – etanercept, infliximab, adalimumab, certolizumab pegol, golimumab, ostatní biologické léky mají jiný mechanismus účinku (abatacept, rituximab, tocilizumab). Účinnost biologické léčby u revmatoidní artritidy je vysoká z hlediska potlačení klinické a laboratorní zánětlivé aktivity, stejně tak jako rentgenové progrese.
Přidání imunosupresivní léčby ke glukokortikoidům u pacientů s PMR a ev. TA by bylo vhodné zejména u pacientů rezistentních na léčbu glukokortikoidy či u těch nemocných, kde je třeba dávku glukokortikoidů snížit zejména pro výskyt nežádoucích účinků.
Methotrexát a ostatní DMARDs
Z hlediska použití methotrexátu u PMR jsou data o současném použití prednisonu a methotrexátu s cílem snížení dávky prednisonu a zmírnění tak nežádoucích účinků léčby při jejich dlouhodobém podávání. Byla provedena dvojslepá studie se sledováním 57 nemocných s PMR po dobu 5 let. Ve skupině léčené kombinací MTX + prednison došlo k mírně výraznějšímu snížení FW a CRP oproti skupině léčené jen glukokortikoidy, avšak frekvence nežádoucích účinků byla v obou skupinách stejná (16). Mírný účinek methotrexátu v dávce 10–15 mg/týdně na průběh PMR a TA, snížení frekvence relapsů a snížení celkové dávky glukokortikoidů byl prokázán v novějším review, zejména u pacientů rezistentních na standardní léčbu glukokortikoidy (17). Další obsáhlá analýza léčby PMR zahrnovala 30 studií z databáze Cochran (z let 1957–2008). Tyto studie se však značně lišily designem, použitými kritérii PMR i sledovanými parametry. Z výsledků tohoto hodnocení vyplynulo, že zahájení léčby PMR prednisonem v dávce 15 mg denně bylo účinné u většiny nemocných a snižování dávky o 1 mg měsíčně vedlo k nižšímu počtu relapsů. Zahájení léčby současným podáváním methotrexátu v dávce 10 mg týdně a glukokortikoidů bylo v léčbě PMR účinné (18).
Také azathioprin byl v minulosti zkoušen ke snížení potřebné dávky prednisonu u PMR a obrovsko-buněčné arteritidy. Byla provedena roční dvojslepá studie u 31 pacientů s PMR, obrovsko-buněčnou arteritidou či obojím. Z hodnocení účinnosti po 52 týdnech byl statisticky významný rozdíl (p < 0,05) ve střední dávce prednisonu u skupiny léčené současně azathioprinem. Účinek byl patrný až po 52 týdnech, což je možné přisoudit pomalému nástupu účinku azathioprinu a byl provázen jeho vyšší toxicitou (19).
Jako další chorobu modifikující lék z arzenálu léčby RA byl zkoušen v indikaci PMR i leflunomid. Jednalo se o nemocné se závažnějším průběhem onemocnění a horší odpovědí na glukokortikoidy. Použití se týkalo menšího počtu nemocných v otevřeném designu (23 pacientů), kdy účinek léčby leflunomidem byl velmi dobrý s možností snížení dávky prednisonu u těchto nemocných a dobrou tolerancí léčby (20). K ověření tohoto účinku je však třeba provést prospektivní kontrolované studie.
Biologická léčba u PMR
Dalším krokem byla analýza účinků anti-TNF léčby u revmatické polymyalgie. Byla provedena analýza 99 pacientů s PMR léčených anti-TNF léky z databáze Pubmed z let 1994–2010. Tři ze studií se týkaly použití infliximabu a pět studií etanerceptu. Účinek byl patrný od 2 do 8 týdnů po zahájení léčby. Ve všech studiích bylo pozorováno snížení dávky prednisonu. Došlo ke klinickému zlepšení a minimálně 50% zlepšení zánětlivých parametrů. Tato analýza prokázala dobrý účinek anti-TNF léčby u pacientů s PMR (21). Další kontrolované sledování se týkalo monoterapie PMR etanerceptem a bylo zaměřené kromě účinku léčby i na koncentrace TNF a IL-6. 20 pacientů s PMR naivních na léčbu glukokortikoidy a 20 zdravých kontrol bylo sledováno i z hlediska funkce, ztuhlosti, FW a CRP. Primárním cílem bylo hodnocení změny skóre aktivity PMR (PMR-AS). U pacientů s PMR léčených etanerceptem došlo k signifikantnímu snížení PMR-AS o 24 % (95% CI 12–33 %). V ostatních parametrech (ranní ztuhlost, hodnocení bolesti pacientem, snížení FW a hladin IL-6) bylo hodnocení nesignifikantní (p > 0,05). Závěrem této studie bylo shrnutí, že etanercept zmírňuje aktivitu choroby u nemocných s PMR naivních na terapii glukokortikoidy, avšak účinek není výrazný, což ukazuje na menší roli TNF v patogenezi této choroby (22).
Pilotní studie s infliximabem v léčbě kortikoid-rezistentní a relabující PMR byla provedena již v roce 2003. Infliximab byl podáván v dávce 3 mg/kg v týdnu 0, 2 a 6 čtyřem pacientům. Byly hodnoceny klinické příznaky, FW a CRP hladiny IL-6 v období ročního sledování. U třech pacientů došlo ke klinické remisi již 2 týdny po podání první infuze, FW a CRP se normalizovaly, u dvou nemocných poklesly i sérové hladiny IL-6. U jednoho nemocného však perzistovala vysoká hladina IL-6 i při normální FW a CRP. Remise trvala i po vysazení infliximabu i prednisonu. Čtvrtý nemocný měl nadále trvající aktivitu onemocnění klinickou i laboratorní i přes pokles hladin IL-6 (23). Randomizovaná studie účinnosti infliximabu + prednisonu byla provedena u 51 nemocných s novou diagnózou revmatické polymyalgie. Byl podáván prednison v dávkách 0–15 mg/d spolu s infliximabem 3 mg/kg v týdnech 0, 2, 6, 14 a 22. Primárním cílem bylo hodnocení procenta pacientů bez relapsu v týdnu 52, sekundární procento nemocných s vysazeným prednisonem, procento relapsů a délka léčby prednisonem a kumulativní dávka prednisonu. V týdnu 52 se obě skupiny nelišily v žádném hodnoceném parametru. Tato studie tedy vyzněla kompletně negativně, zahrnovala však nové případy polymyalgie s vysokou odpovědí placebové skupiny (prednison + placebo) na tradiční léčbu glukokortikoidy (24).
Existují i kazuistiky nemocných se zánětlivým revmatickým onemocněním léčeným anti-TNF léčbou, kde bylo základní onemocnění dobře touto terapií kontrolováno. U těchto nemocných během léčby anti-TNF preparátem došlo k projevům PMR a TA s typickými klinickými i laboratorními příznaky a s dobrou odpovědí na léčbu glukokortikoidy. U nemocného s TA byly prokázány typické změny i histologicky. Zdá se tedy,že role TNF v patogenezi těchto onemocnění není klíčová (25).
Existují i potenciální možnosti použití rituximabu v léčbě PMR a obrovsko-buněčné arteritidy s recidivujícím průběhem či rezistentní na léčbu glukokortikoidy. Zatím jsou popsány jednotlivé případy (26). Další možnosti použití rituximabu se otevírají zejména u vaskulitid velkých cév (27). Bude třeba randomizovaných studií k průkazu snížení kumulativní dávky glukokortikoidů v léčbě těchto onemocnění.
Zvýšená sérová hladina IL-6 u PMR a TA vedla k myšlence o možnosti využití tocilizumabu u těchto onemocnění. Do sledování bylo zařazeno jen celkem 10 nemocných s refrakterní TA (7 pacientů), Takayasuovou arteritidou (2 pacienti) a PMR (1 pacient). Pacienti byli léčení tocilizumabem a glukokortikoidy průměrně 7,8 měsíců. U všech nemocných došlo ke klinické remisi během léčby tocilizumabem. Dávka prednisonu se snížila z počátečních 20,8 mg/d na 4,1 mg/d a sedimentace erytrocytů poklesla z 41,5 počátečních na 7 mm/h (p = 0,0001). Tato data ukazují na pozitivní účinek tocilizumabu v těchto indikacích, avšak sledování se týkalo jen malého množství nemocných (28).
Závěr
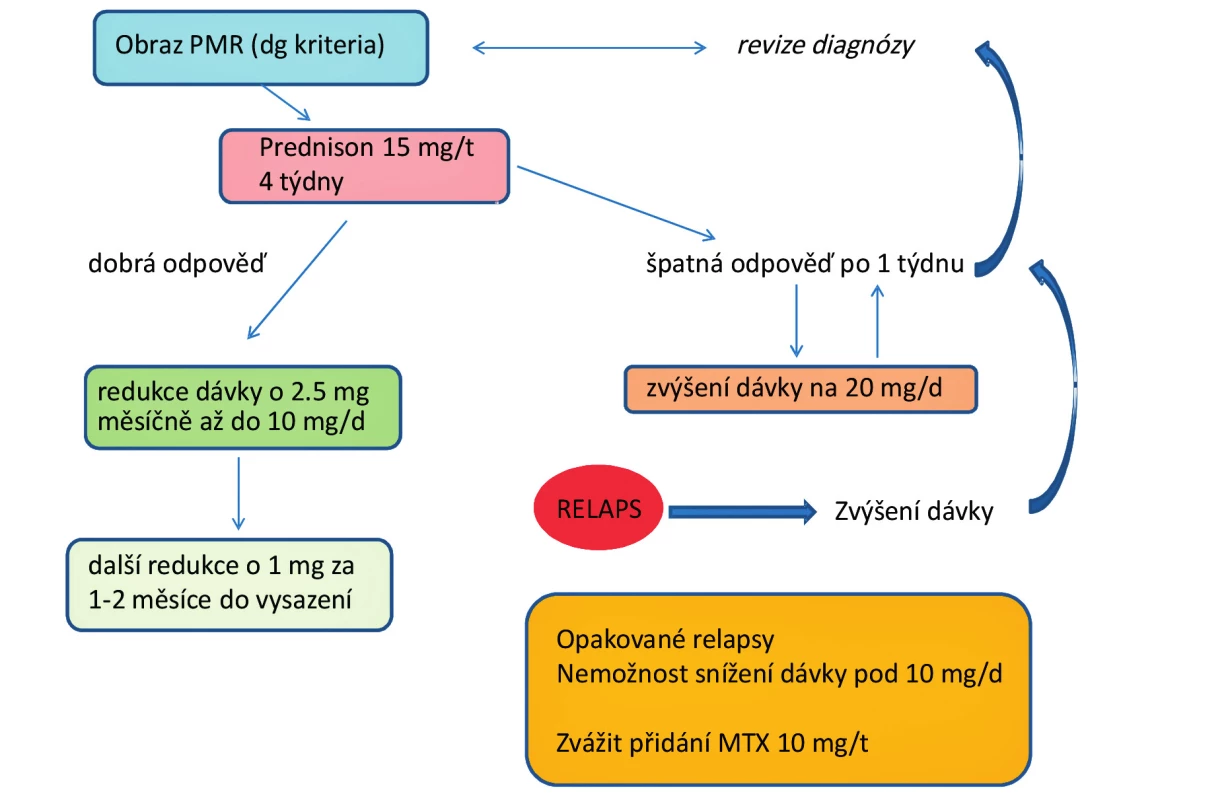
PMR je velmi heterogenní onemocnění s náhlým začátkem a výrazným dopadem na funkci. Léčba glukokortikoidy je účinná, avšak u řady pacientů protrahovaná a nese s sebou rizika četných nežádoucích účinků, které i vzhledem k vyššímu věku nemocných a současným komorbiditám mohou být i více než závažné. Onemocnění je provázeno i relativně častým relapsem. Snaha o snížení dávky glukokortikoidů a efektivní léčbu rezistentních případů vedla k použití imunosupresivní léčby tak, jak ji známe u RA. Z dostupných dat vyplývá, že je možné uvažovat o mírném účinku methotrexátu zejména u nemocných rezistentních na léčbu glukokortikoidy a s relabujícím onemocněním (obr. 1). Studie s glukokortikoidy v kombinaci s MTX ukázaly jistý efekt na snížení kumulativní dávky glukokortikoidů, avšak nikoliv na snížení jejich nežádoucích účinků. Otázkou zůstává účinnost anti-TNF terapie a eventuálně použití ostatních biologik (tocilizumabu, rituximabu…) v této indikaci. Prozatím jsou k dispozici určitá data o částečné účinnosti, avšak většinou ne z randomizovaných a kontrolovaných studií. K průkazu účinku biologik by bylo třeba provést a zhodnotit randomizované kontrolované studie s větším počtem pacientů.
Podpořeno projektem Ministerstva zdravotnictví koncepčního rozvoje výzkumné organizace 023728 (Revmatologický ústav)
Adresa pro korespondenci:
MUDr. Andrea Pavelková
Revmatologický ústav a Revmatologická klinika 1. LF UK v Praze
Na Slupi 4
128 50 Praha 2
andrea.pavelkova@post.cz
Sources
1. Salvarani C, Cantini F, Hunder G.C. Polymyalgia rheumatica and giant-cell arteritis. Lancet 2008; 372 : 234–245.
2. Dasgupta B, Cimmino MA, Maradit-Kramers H. 2012 provisional classification criteria for polymyalgia rheumatica: a European League Against Rheumatism/American College of Rheumatology collaborative initiative. Ann Rheum Dis 2012; 71(4): 482–492.
3. Dasgupta B, Borg F, Hassa N, et al. BSR and BHPR guidelines for the management of polymyalgia rheumatica. Oxford: Oxford University Press. 2009.
4. Nothnag T, Leeb BR. Diagnosis, differential diagnosis and treatment of polymyalgia rheumatica. Drug Aging 2006; 23 : 391–402.
5. Camellino D,Cimmino MA. Imaging of polymyalgia rheumatica: indications on its pathogenesis, diagnosis and prognosis. Rheumatology 2012; 51(1): 77–86.
6. Healey LA. Polymyalgia rheumatica is the reset of synovitid. J Clin Rheumatol 2006; 12 : 165–166.
7. Kreiner F, Langberg H, Galbo H. Increased muscle interstitial levels of inflammatory cytokines in polymyalgia rheumatica. Arthritis Rheum 2010; 62 : 3768–75.
8. Alvarez-Rodriguez L, Lopez-Hoyos M, Mata C, et al. Circulating cytokines in active polymyalgia rheumatica. Ann Rheum Dis 2010; 69 : 263–9.
9. Martinez-Taboada VM, Alvarez L,Ruiz Soto M. Giant cell arteritis and polymyalgia rheumatica: role of cytokines in the patogenesis and implications for treatment. Cytokine 2008; 44 : 207–220.
10. Gabriel S, Sunku J, Salvarani C, et al. Adverse outcomes of antiinflammatory therapy among patients of polymyalgia rheumatica. Arthritis Rheum 1997; 40 : 1873–8.
11. Pavelka K. Polymyalgia rheumatica – diagnostika a léčba: Postgraduální medicína 2011; 13 : 551–557.
12. Rheumatology Expert Group. Polymyalgia rheumatica and giant cell arteritis. In: Therapeutic Guidelines: rheumatology. Melbourne: Therapeutic Guidelines, 2010.
13. Weyand CM, Fulbright JW, Hunder GG, et al. Treatment of giant cell arteritis: interleukin-6 as a biologic marker of dinase activity. Arthritis Rheum 3 : 101, 2000.
14. Štěpán J. Léčba glukokortikoidy indukované osteoporózy. Farmakoterapie 2010; 6, 65–74.
15. Jones G,Halbert J,Crotty M, et al. The effect of treatment on radiological progression in rheumatoid arthritis: a systematic review of randomized placebo-controlled trials. Rheumatology (Oxford) 2003; 42 : 6–13.
16. Cimmino MA,Salvarani C, Macchioni P et al. Long-term follow-up of polymyalgia rheumatica patients treated with methotrexate and steroids. Clin Exp Rheumatol 2008; 26 : 395–400.
17. Spies CM, Burmester GR,Buttgereit F. Methotrexate treatment in large vessel vasculitis and polymyalgia rheumatica. Clin Exp Rheumatol 2010; 28(5 Suppl61): S172–7.
18. Hernandez-Rodriguez J, CidMC, Lopez-SotoA, Espigol-Frigolé G, BoschX. Tratment of polymyalgia rheumatica: a systemic review. Arch Intern Med 2009; 169 : 1839–50.
19. De Silva M,Hazleman BL. Azathioprine in giant cell arteritis/polymyalgia rheumatica: a double-blind study. Ann Rheum Dis 1986; 45 : 136–138.
20. Adizie T, Christidis D, Dharmapaliah C, et al. Efficacy and tolerability of leflunomide in difficult-to-treat polymyalgia rheumatica and giant cell arteritis: a case series. Int J Clin Pract 2012; 66 : 906–9.
21. Aikawa NE, Pereira RM, Lage L, et al. Anti-TNF therapy for polymyalgia rheumatica: report of 99 cases and review of the literature. Clin Rheumatol 2012; 31 : 579–9.
22. Kreiner F, Galbo H. Effect of etanercept in polymyalgia rheumatica: a randomized controlled trial. Arthritis Res Ther 2010; 12: R176.
23. Salvarani C, Cantini F, Niccoli L, et al. Treatment of refractory polymyalgia rheumatica with infliximab: a pilot study. J Rheumatol 2003; 30 : 760–3.
24. Salvarani C, Macchioni P, Manzini C, et al. Infliximab plus prednisone or placebo plus prednisone for the initial treatment of polymyalgia rheumatica: a randomized trial. Ann Intern Med 2007; 146 : 631–9.
25. Watson P, Gaston H. Response to ´Effect of etanercept in polymyalgia rheumatica: a randomized controlled trial´. Arthritis Res Ther 2011; 13 : 403.
26. Bhatia A, Ell P, Edwards J. Anti-CD20 monoclonal antibody (rituximab) as an adjunct in the treatment of giant cell arteritis. Ann Rheum Dis 2005; 64(7): 1099–1100.
27. Unizony S, Stone JH, Stone JR. New treatment strategies in large - vessel vasculitis. Curr Opin Rheumatol 2013; 25(1): 3–9.
28. Unizony S, Arias-Urdaneta L, Miloslavsky E, et al. Tocilizumab for the treatment of large vessel vasculitis (giant cell arteritis, Takayasu arteritis) and polymyalgia rheumatica. Arthritis Care Res 2012; 64 : 1720–9.
Labels
Dermatology & STDs Paediatric rheumatology RheumatologyArticle was published in
Czech Rheumatology

2013 Issue 4
Most read in this issue
- Revmatická polymyalgie – je účinná biologická léčba?
- Regulační T-lymfocyty jako nástroj suprese imunitního systému
- Biosimilars – současné poznatky o jejich zaměnitelnosti
- Cirkulující protein tepelného šoku 90 (HSP90) u pacientů s revmatoidní artritidou a axiální spondyloartritidou
