Účinnost a bezpečnost intraartikulární aplikace depotních glukokortikoidů u revmatických onemocnění
Efficacy and safety of intra-articular injection of depot corticosteroids in rheumatic diseases
Glucocorticoids play a very important role in the treatment of rheumatic diseases. In order to control the disease activity it is sometimes necessary to use relatively high doses of systemically administered glucocorticoids, which are associated with a number of serious side effects. Intra-articular or peri-articular steroid injections help manage pain and inflammatory conditions in a short time, minimizing these side effects. This work provides a summary of available intra-articular glucocorticoids and the comparison of their pharmacokinetics, pharmacodynamics, efficacy and safety in various rheumatic diseases and introduces triamcinolone hexacetonide, a synthetic glucocorticoid with a prominent anti-inflammatory and depot effect.
Key words:
Glucocorticoids, intra-articular, triamcinolone hexacetonide, rheumatoid arthritis, osteoarthritis, juvenile idiopathic arthritis
Authors:
R. Svobodová
Authors‘ workplace:
Revmatologický ústav Praha
Published in:
Čes. Revmatol., 23, 2015, No. 1, p. 22-32.
Category:
Rewiev
Overview
Glukokortikoidy hrají v terapii revmatických onemocnění velmi důležitou roli. Mnohdy je ale zapotřebí ke zvládnutí aktivity onemocnění poměrně vysokých dávek podávaných systémově, což s sebou přináší celou řadu závažných nežádoucích účinků. Aplikace glukokortikoidů intraartikulárně nebo periartikulárně pomáhá zvládnout bolestivé a zánětlivé stavy v krátkém čase za minimalizace těchto nežádoucích účinků. Práce přináší přehled dostupných intraartikulárních glukokortikoidů, porovnání jejich farmakokinetiky, farmakodynamiky, účinnosti a bezpečnosti u různých revmatických onemocnění a blíže seznámí s triamcinolonem hexacetonidem, syntetickým glukokortikoidem s výrazným protizánětlivým a depotním účinkem.
Klíčová slova:
Glukokortikoidy, intraartikulární, triamcinolon hexacetonid, revmatoidní artritida, osteoartróza, juvenilní idiopatická artritida
Úvod
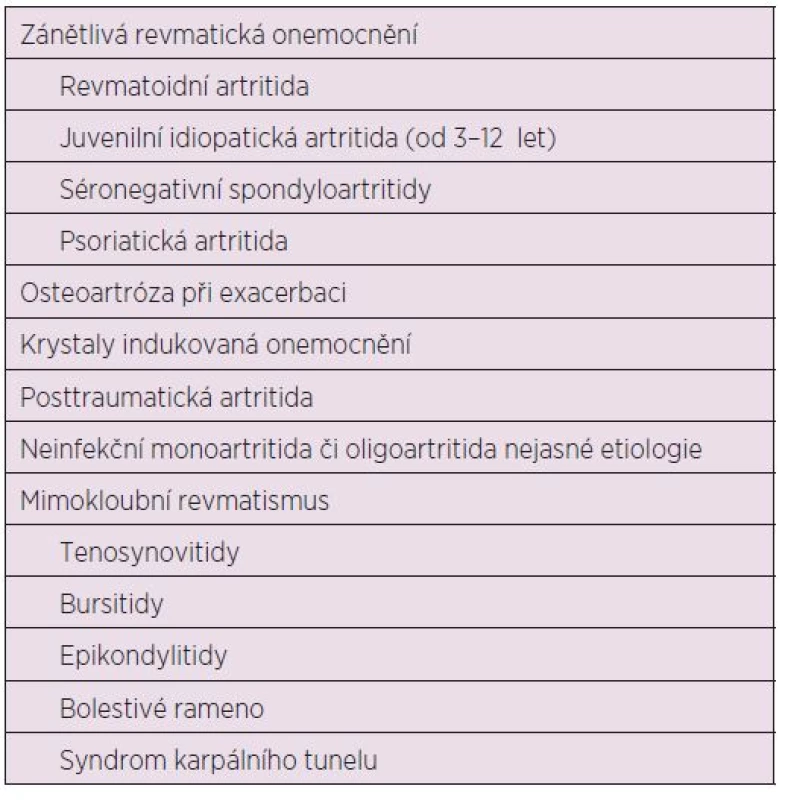
Intraartikulární aplikace (i.a.) glukokortikoidů (GK) je všeobecně rozšířený způsob lokální léčby bolestivých kloubů. Má výhodu místního účinku nad systémovým. Hlavní indikací pro i.a. injekce GK je bolest způsobená převážně zánětem a/nebo degenerativními změnami kloubů. Proto jsou používány jak u osteoartrózy a dnavé artritidy, tak u celé řady zánětlivých autoimunitních revmatických onemocnění, jako je revmatoidní artritida, juvenilní idiopatická artritida, séronegativní spondyloartritida, psoriatická artritida a další. Kromě intraartikulární aplikace je možná i aplikace periartikulární k ovlivnění synovitid, tenosynovitid, burzitid a epikondylitid. Aplikovány mohou být do všech velkých, středních, ale i malých kloubů, nicméně nejčastěji opichovanými klouby jsou klouby kolenní (1).
První zpráva o tomto způsobu terapie byla publikována již v roce 1951 Hollanderem (2), kdy byla srovnávána i.a. účinnost kortizonu a hydrokortizonu v sérii více než 100 000 injekcí u 4 000 pacientů. Později v 60. letech byly vyvinuty estery hydrokortizonu a následně i prednisolonu, triamcinolonu a dexametazonu, které jsou účinnější než přípravky samotné a které jsou používány dodnes (3, 4, 5, 6). Některé přípravky jsou složené ze dvou sloučenin (5, 6). Od začátku 60. let probíhaly klinické studie, které hodnotily a porovnávaly farmakokinetiku a farmakodynamiku těchto přípravků a dále jejich účinnost a bezpečnost u dětí i dospělých u celé řady revmatických onemocnění. V současné době jsou v České republice k i.a. aplikaci používány přípravky s obsahem betametazonu (betametazon dipropionát/betametazon sodium fosfát = Diprophos), metylprednisolonu (methylprednisolon acetát = Depo-Medrol) a triamcinolonu (triamcinolon acetonid = Triam a triamcinolon hexacetonid = Lederlon), ale poslední dva jmenované nemají registraci a proto jsou pouze na zvláštní dovoz.
Charakteristika intraartikulárních glukokortikoidů
Glukokortikoidy jsou steroidní hormony tvořené kůrou nadledvin, tvorbu řídí přední lalok hypofýzy pomocí adrenokortikotropního hormonu (ACTH). Hlavními představiteli jsou kortisol a kortikosteron. Chemickým základem glukokortikoidů, stejně jako dalších steroidů, je steranové jádro (cyklopentanoperhydrofenantren) složené ze 17 uhlíků. První GK vyvinuté pro intraartikulární injekce byly substance rozpustné ve vodě. Sice lokálně zmírňovaly zánět, ale vlivem rychlé absorpce do krevního oběhu docházelo k poměrně silným nežádoucím účinkům a krátké době působení v kloubu, proto bylo nutné časné opakování aplikace. To však zase vedlo k nežádoucím účinkům místním. Průlomem v intraartikulární terapii byl objev krystalických suspenzí, které mají výhodu dlouhodobého lokálního působení, jsou jen pomalu vstřebávány a oproti hydrokortisonu jsou účinnější. Nejvíce se však v poslední době v i.a. terapii prosazují esterifikované GK. Tyto esterifikované substance jsou tzv. „prodrugs“ a musí být po uvolnění z krystalického depa nejdříve hydrolyzovány do účinné formy.
Přípravek Diprophos je kombinací rozpustného a málo rozpustného esteru betametazonu (BM). Rozpustná sůl – betametazon-fosfát je zodpovědný za okamžitý účinek, protože se po aplikaci rychle vstřebává z místa vpichu. Betametazon-dipropionát, ester, který je jen málo rozpustný, se absorbuje z místa aplikace pozvolna a způsobuje dlouhodobější účinek.
Depo-Medrol obsahuje metylprednisolon-acetát (MPA), který vykazuje vlastnosti GK metylprednisolonu (MP), ale je také méně rozpustný a obtížněji se biotransformuje, což má za následek též dlouhodobější účinek. 4 mg metylprednisolonu má stejný protizánětlivý účinek jako 20 mg hydrokortizonu.
Triamcinolon hexacetonid (TH) vzniká esterifikací mateřské substance triamcinolonu acetonidu (TA) na pozici atomu C21 s terciálním metylbutyrátem. Ten je příčinou požadovaného výrazného depotního efektu (7). Triamcinolon acetonid (volný alkohol) je vlastní účinná látka. Tato substance je možná k aplikaci v neesterifikované formě, má však nevýhodu, že účinek nastupuje okamžitě a přetrvává mnohem kratší dobu, protože zde není předřazen aktivující hydrolyzační krok. GK používané v současnosti se neodlišují pouze svými farmakokinetickými vlastnostmi, ale také svou afinitou k receptoru (8) (tab. 1).
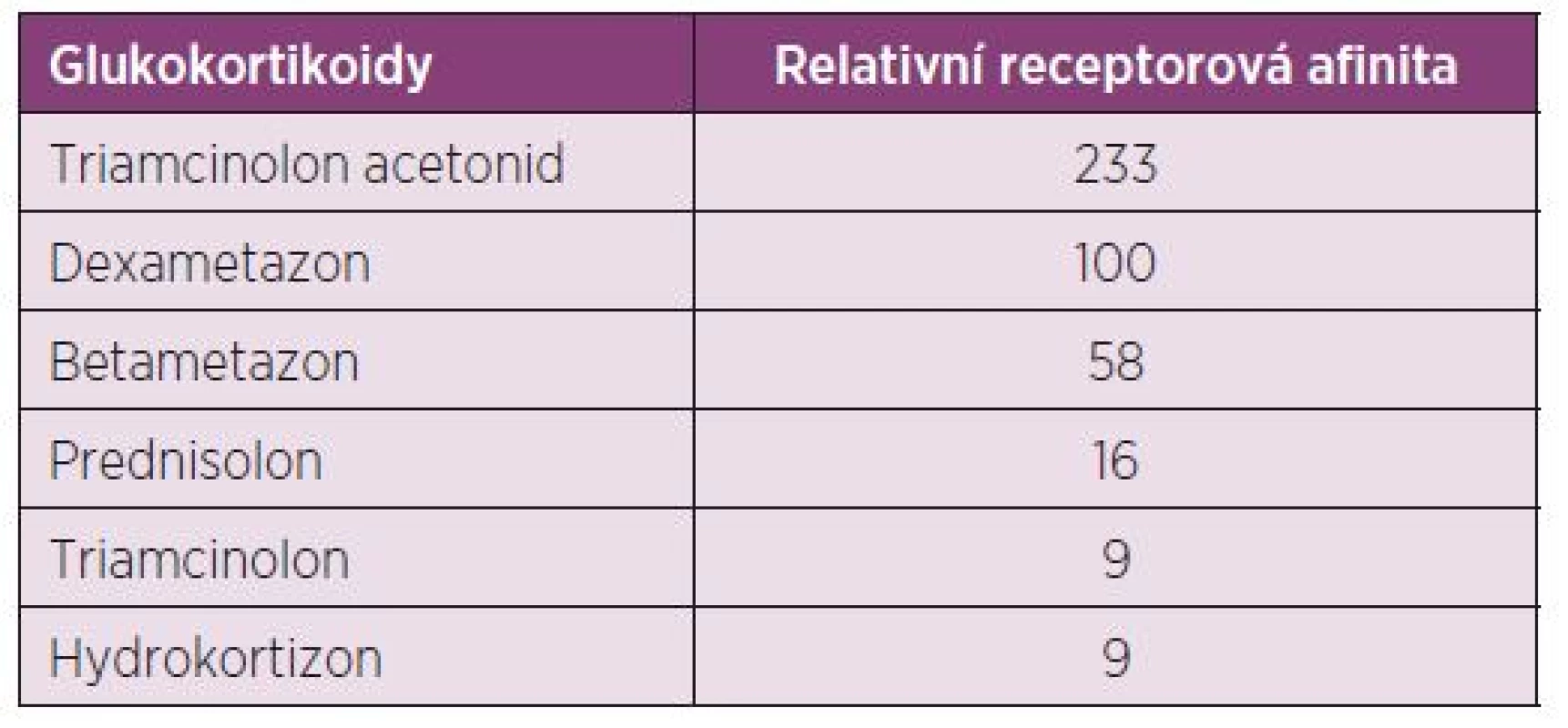
Je žádoucí, aby se substance v kloubu nacházely pokud možno co nejdéle ve vysoké koncentraci, avšak aby po přechodu do krevního oběhu došlo k jejich rychlé inaktivaci. Zatímco dexametazon a betametazon setrvává v systémové cirkulaci dlouho, je TH rychle odbourán na inaktivní metabolity. Díky tomu lze počítat pouze s jeho nepatrnými systémovými nežádoucími účinky (9).
Farmakokinetika a farmakodynamika intraartikulárních glukokortikoidů
Po aplikaci 40 nebo 80 mg MPA do kolenního kloubu u pacientů s revmatoidní artritidou (RA) byly časné hladiny MP v krvi pozorovány již za 30 minut s maximem hladin po 2–12 hodinách (nejčastěji po 4–8 h) a ke kompletní clearance z krve došlo za 5 dní (10). Maximální sérová koncentrace a plocha pod křivkou byly mnohem vyšší po aplikaci stejné dávky rozdělené do obou kolenních kloubů než do kloubu jednoho. Podobné hladiny byly pozorovány i u pacientů s osteoartrózou (OA). Absorpce z kolenního kloubu je rychlejší po evakuaci synoviálního výpotku, zatímco při aplikaci do kolene s výpotkem byly hladiny MP v séru měřitelné za delší dobu (11). Po aplikaci depotního BM do kolenního kloubu byla maximální hladina v séru za 30 minut a biologický poločas byl 2 hodiny. Maximální hladiny triamcinolonu byly naměřeny po aplikaci 20 mg TH do kolenního kloubu u pacientů s RA za 8 hodin bez rozdílu, zda se pacienti po aplikaci pohybovali či dodržovali klidový režim (12). TH měl mírně delší průměrnou dobu setrvání v kloubu (až 6 dní) ve srovnání s TA (3,2 – 4,3 dny). Kompletní absorpce byla nalezena u obou, ale míra absorpce byla různá. Po 3 dnech bylo absorbováno pouze 35–40 % TH ve srovnání 58–67 % TA, kompletní absorpce TH i TA byla pozorována za více než 2–3 týdny po aplikaci. TH má menší rozpustnost a je absorbován pomaleji než TA a tak si udržuje synoviální hladiny po delší dobu a vytváří nižší systémové hladiny kortikoidů. Potlačení endogenního hydrokortizonu korelovalo s exogenními hladinami steroidů (13). Průměrný čas různých i.a. GK přípravků v kolenním kloubu byl 6, 3,8, 2,8 a 2,6 dní pro TH, TA, BM acetát a MPA (14). S tímto průměrným časem také dobře koreluje trvání klinického účinku jednotlivých i.a. přípravků. Většinu GK aplikovaných injekčně již nelze po měsíci v kloubu prokázat, že se však jejich účinek rozvíjí i dále, je přisuzováno déle přetrvávajícímu vlivu GK na genom a tím na syntézu bílkovin (15).
Mechanismus účinku
Vzhledem k lipofilní struktuře difundují GK buněčnou membránou. Po kontaktu s cytosolickými receptory ovlivní jejich konformační změnu a takto aktivovaný receptor může ovlivňovat genovou expresi. Snižuje se tvorba prozánětlivých mediátorů a zvyšuje tvorba protizánětlivých proteinů. Dochází k potlačení zánětu, ustupuje bolest a výpotek, normalizuje se synoviální prostředí. Zmírňuje se nadměrná kolagenová syntéza. Všechny uvedené faktory pak vedou ke zlepšení pohyblivosti kloubu (15). Celkově i.a. GK snižují sedimentaci erytrocytů ještě 28 dní po injekci (16).
Klinické využití
I.a. aplikace GK je doporučována Českou revmatologickou společností (ČRS) (17) i Evropskou ligou proti revmatismu (EULAR) (18) v terapii revmatoidní artritidy zvláště u pacientů, kteří celkově dobře odpověděli na léčbu chorobu modifikujícími léky (DMARDs), ale mají přetrvávající reziduální kloubní aktivitu. U pacientů s revmatoidní artritidou i.a. injekce TH u monoartritidy kolene, ale i aplikace do více kloubů, vykazuje signifikantně lepší výsledky v ovlivnění bolesti, otoku a ranní ztuhlosti než systémové podání TA (19,20). Aplikace 1 ml MPA a TH u 30 pacientů s oboustrannou gonitidou vedlo ke většímu zlepšení v míře bolesti po TH než po MPA v 1. týdnu, ale za 14 dní nebyl signifikantní rozdíl mezi přípravky (21). Zlepšení skóre bolesti po aplikaci TH do kolenního kloubu se synovitidou přetrvávalo ještě ve 13,5. týdnu a zlepšení výpotku a rozsahu hybnosti ještě ve 3 měsících (22). Recentní studie Axelsena u pacientů s časnou RA léčených metotrexátem a i.a. 20 mg TH prokázala účinné snížení synovitidy, osteitidy a tenosynovitidy a zpomalení kostní a kloubní destrukce hodnocené pomocí magnetické rezonance (MR) po roce sledování (23). Relaps synovitidy kolenního kloubu po aplikaci 20 mg TH nastal do 6 měsíců u pacientů, kteří měli větší rentgenové poškození kloubu a vyšší hladiny vaskulárního endoteliálního růstového faktoru v synoviální tekutině (24).
U osteoartrózy je i.a. aplikace GK uváděna pozitivně v 11 ze 13 publikovaných doporučení (25). Lepší účinnost TH než BM ve smyslu snížení bolesti trvající až 4 týdny po aplikaci do kolenního kloubu publikoval Bellamy v roce 2009 v Cochranské databázi (26). Lepší účinnost triamcinolonu než BM a MP v ovlivnění bolesti i délce účinnosti byla potvrzena i ve 2009 systematických přehledech studií (27). Po aplikaci TA do kolenního kloubu s Bakerovou cystou došlo ke zmenšení otoku kolene po 4 týdnech a k poklesu bolesti na vizuální analogové škále (VAS) a u více než poloviny pacientů (66 %) došlo ke zlepšení rozsahu pohybu ve sledovaném kloubu (28). Některé studie prokazovaly signifikantně lepší efekt TH u nemocných s přítomným s kloubním výpotkem, kterým byla synoviální tekutina aspirována v době punkce (29), ale ne všechny studie toto potvrdily (30). Nelze tedy považovat přítomnost výpotku za jednoznačně prediktivní faktor příznivé odpovědi na léčbu. Podstatně méně dokladů o účinnosti i.a. aplikace GK je u koxartrózy. Byly provedeny jen dvě randomizované studie, z nichž jedna byla zcela negativní a druhá prokázala krátkodobý symptomatický účinek (25). Určitá evidence svědčí o tom, že cíleně prováděné i.a. opichy pod ultrazvukovou kontrolou u koxartrózy mají lepší výsledky než necíleně prováděné aplikace. Byly provedeny i pozitivní otevřené studie s i.a. aplikací u bolestivé rhizartrózy. V randomizované kontrolované studii ke zhodnocení účinku i.a. aplikace TH oproti placebu do karpometakarpálních kloubů prokázaly obě skupiny zlepšení v celkovém hodnocení pacientem i lékařem, ale nebyly signifikantní rozdíly v hodnocení bolesti a ztuhlosti mezi oběma skupinami (31). Přes rozporné výsledky je aplikace i.a. GK součástí doporučení ČRS i Americké revmatologické společnosti (ACR) pro léčbu OA (32, 33).
Nejvíce dokladů o účinnosti i.a. aplikace GK je u pacientů s juvenilní idiopatickou artritidou. Zde jsou i.a. GK součástí základní terapie u mono nebo oligoartrikulární formy tohoto onemocnění. TH vykazuje mnohem větší a dlouhodobější účinnost oproti TA. TH ve stejné, ale i poloviční dávce než TA při aplikaci do kolenního kloubu u gonitidy prokazuje signifikantně trvalejší účinek v 6, 12 i ve 24 měsících (34). Průměrný čas relapsu artritidy byl více než 10 měsíců u pacientů léčených TH a méně než 8 měsíců ve skupině léčené TA (35, 36). TH mnohem efektivněji snižuje průměrný obvod kolenního kloubu, zvyšuje jeho flexi a má trvalejší účinek (37) než BM. Mnohem delší remise byla prokázána též po aplikaci TH v dávce 0,7 mg/kg než po MP v dávce 1,5 mg/kg (38). TH se zdá být nejúčinnějším léčebným přípravkem zejména pokud se týká délky účinku. Průměrná doba účinku je obecně 12,5 měsíců, i když jsou rozdíly mezi studiemi (52 % kloubů v remisi v 1 roce, 20 % po 2 letech a 7 % za 3 roky). Trvání účinku je všeobecně delší u pacientů s časným nebo přetrvávajícím oligoartikulárním typem onemocnění, kratší u onemocnění se systémovým začátkem, bez ohledu na to, jaký je jeho další průběh. Účinek byl delší při aplikaci dávky GK nejméně 1 mg/kg s nejdelší odpovědí pro TH, kratší po TA a nejkratší po MPA. Ideální dávka TH je 1–1,5 mg/kg (39). Riziko relapsu synovitidy bylo vyšší u pacientů s vysokým C-reaktivním proteinem (CRP) a negativními antinukleárními protilátkami (40). Účinnost i.a. GK u JIA byla prokázána nejen při aplikaci do kolenních kloubů, ale i kloubů temporomandibulárních (41) nebo subtalárních, kdy u většiny (89 %) pacientů došlo ke zlepšení rozsahu pohybu. Průměrná doba zlepšení byla 1,2 ± 0,9 let. Zlepšení bylo vyšší u pacientů, kteří obdrželi léčbu do roka od stanovení diagnózy (42). Časné a opakované užití i.a. GK je spojeno s menším rozdílem délky končetin u malých dětí s oligoartikulární formou JIA (43). I.a. GK by tedy měly být považovány za primární iniciální léčebnou možnost u oligo - a zvláště monoartikulárního typu onemocnění a preferovány pro léčbu jednoho nebo několika neúplně odpovídajících kloubů i v jiných podtypech JIA před změnou nebo přidáváním dalších chorobu modifikujících léků nebo biologickou terapií (44). Bylo zjištěno, že jeden miligram triamcinolonu má přibližně pětinásobný protizánětlivý účinek než stejné množství hydrokortizonu (45).
U dnavé artritidy je aplikace i.a. GK efektivní v terapii akutních dnavých záchvatů. U pacientů s těžkými nebo prolongovanými záchvaty dnavé artritidy, kteří mají horší toleranci nebo kontraindikaci nesteroidních antirevmatik (NSA), může aspirace a injekce GK do kloubu postiženého dnavou artritidou zkrátit ataku záchvatu nebo může pomoci kontrolovat chronickou pyrofosfátovou artropatii (46). Aplikace i.a. GK je součástí doporučení ČRS i EULARu pro léčbu tohoto onemocnění (47, 48).
Lokální injekce GK při synovitidě nebo entezitidě u pacientů se séronegativní spondyloartritidou (SpA) jsou plně indikovány (49, 50). Aplikace i.a. GK po periferních kloubů postižených zánětem vykazuje stejné účinky jako u pacientů s RA. Aplikace do sakroiliakálních (SI) kloubů je obtížná pro jejich anatomickou strukturu, lepších výsledků je dosaženo při aplikaci GK pod rentgenovou či MR kontrolou. Je jen málo informací o účinnosti a snášenlivosti GK do SI kloubů u pacientů se sakroiliitidou. Tři nekontrolované (51, 52, 53) a jedna kontrolovaná klinická studie prokázaly subjektivní zmírnění bolestí a snížení spotřeby NSA (54). Novější kontrolovaná studie Hanlye, ve které byl aplikován TH v dávce 40 mg do každého SI kloubu pod CT kontrolou, prokázala jen přechodné zlepšení ve ztuhlosti, bolesti, hybnosti páteře a celkového zdraví, které bylo nejvýraznější od 1 do 3 měsíců. V 6 měsících byl stav stejný jako před aplikací GK (55).
Intraartikulární aplikace GK u psoriatické artritidy je užitečná u lokalizovaných forem tohoto onemocnění (oligo/monoartritida, entezitida, daktylitida) a u akutních vzplanutí jinak dobře kontrolovaných polyartikulárních forem. V případě daktylitid se glukokortikoid aplikuje do šlachové pochvy, případně do okolí šlachy (56, 57).
V systematickém přehledu použití GK v periartikulární aplikaci byl prokázán účinek ve zlepšení pohybu ramene po aplikaci do subakromiálního prostoru (60). Recentní metaanalýzy (58, 59) i.a. GK při tendinitidě ramene a lokte ukazují na velmi dobrou snášenlivost i účinnost ve srovnání s jinými druhy terapie (fyzioterapie, placebo) v ovlivnění bolesti a funkce, ale tento účinek není dlouhodobý ani lepší než terapie NSA.
Nežádoucí účinky
Bezpečnost i.a. aplikace TA do kolenních kloubů každé 3 měsíce byla prokázána v dlouhodobém dvouletém sledování (61). Nejčastějším nežádoucím účinkem i.a. GK je lokální kožní nebo podkožní atrofie (39), pravděpodobně proto, že dochází k úniku GK mezi jehlou a podkožní tkání (62). Dále bylo pozorováno zarudnutí v obličeji průměrně za 19 hodin po injekci a přetrvávající až 36 hodin, a bylo asociováno s ženským pohlavím (63). Dále se mohou objevit intraartikulární (64, 65) a periartikulární kalcifikace (66) a příležitostně kožní lipoatrofie okolo místa vpichu injekce do kloubu. Někdy lze pozorovat brzy po i.a. aplikaci zhoršení bolesti, tzv. postinjekční exacerbaci. Další nežádoucí reakcí může být vznik přechodné krystalové artritidy. Popisována je též osteonekróza kyčelního kloubu nejspíše z důvodu katabolického účinku GK (67). Frekvence kloubní infekce po i.a. injekci kolísá mezi 1/3000 až 1/100000 dle různých zdrojů. Hlavní příčinou bývá nedostatečná aseptická technika aplikace (68, 69). Též byla ojediněle pozorována anafylaktická reakce po i.a. aplikaci TA do ramenního kloubu (70,71). TA a TH mají minimální až nulový mineralokortikoidní účinek (72), takže po jejich aplikaci nebyly popsány otoky ani edém (1). Protože dochází k pronikání GK do systémové cirkulace, dochází někdy ke zhoršení diabetu. Z důvodu vzniku osteonekrózy se nedoporučuje aplikace více než čtyř intraartikulárních injekcí do jednoho kloubu za rok (17, 18).
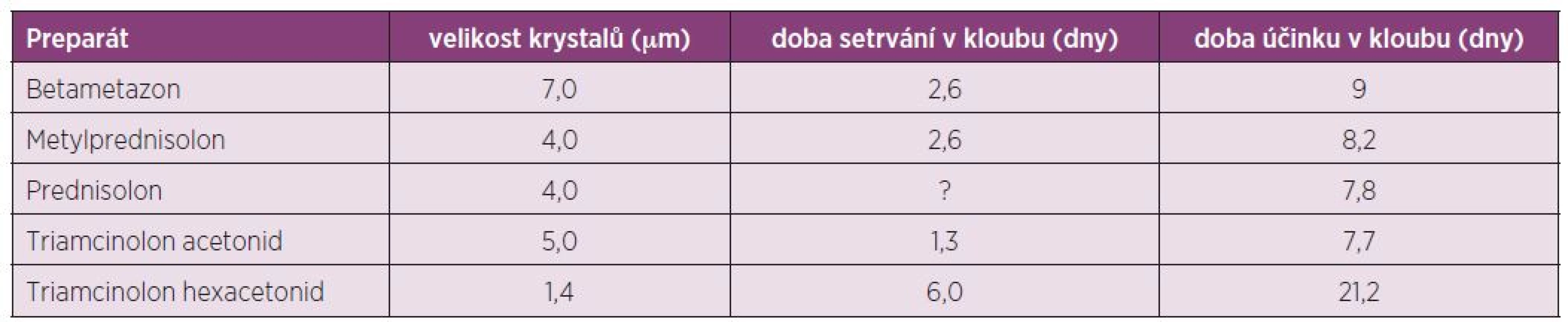
Triamcinolon hexacetonid (Trispan) je syntetický glukokortikoid s výrazným protizánětlivým a depotním účinkem. Je vlastně „prodrug“ triamcinolonu acetonidu a teprve ve tkáni je konvertován na aktivní formu. Ester hexacetonidu na C-21 je ve formě mikrokrystalické suspenze téměř nerozpustný ve vodě. Vysoká lipofilie této substance zaručuje dlouhé setrvání v místě injekce a tím nízkou systémovou cirkulaci a následkem toho méně systémových vedlejších účinků. Má celkově delší biologický poločas – retenční čas je 6 dní vs 3,2–4,3 dny TA a tím dlouhodobý účinek na tkáň (několik týdnů až měsíců). Trispan je krystalický GK, jehož krystaly mají rhomboický (kosočtverečný) tvar (obr. 1) o průměru menším než 1,4 µm, což jsou nejmenší krystaly ze všech kortikoidů (tab. 2). Doporučení pro i.a. aplikaci je velikost krystalů < 2,0 µm. Proto navození krystaly indukované synovitidy je málo pravděpodobné (oproti jehlovitým tvarům).

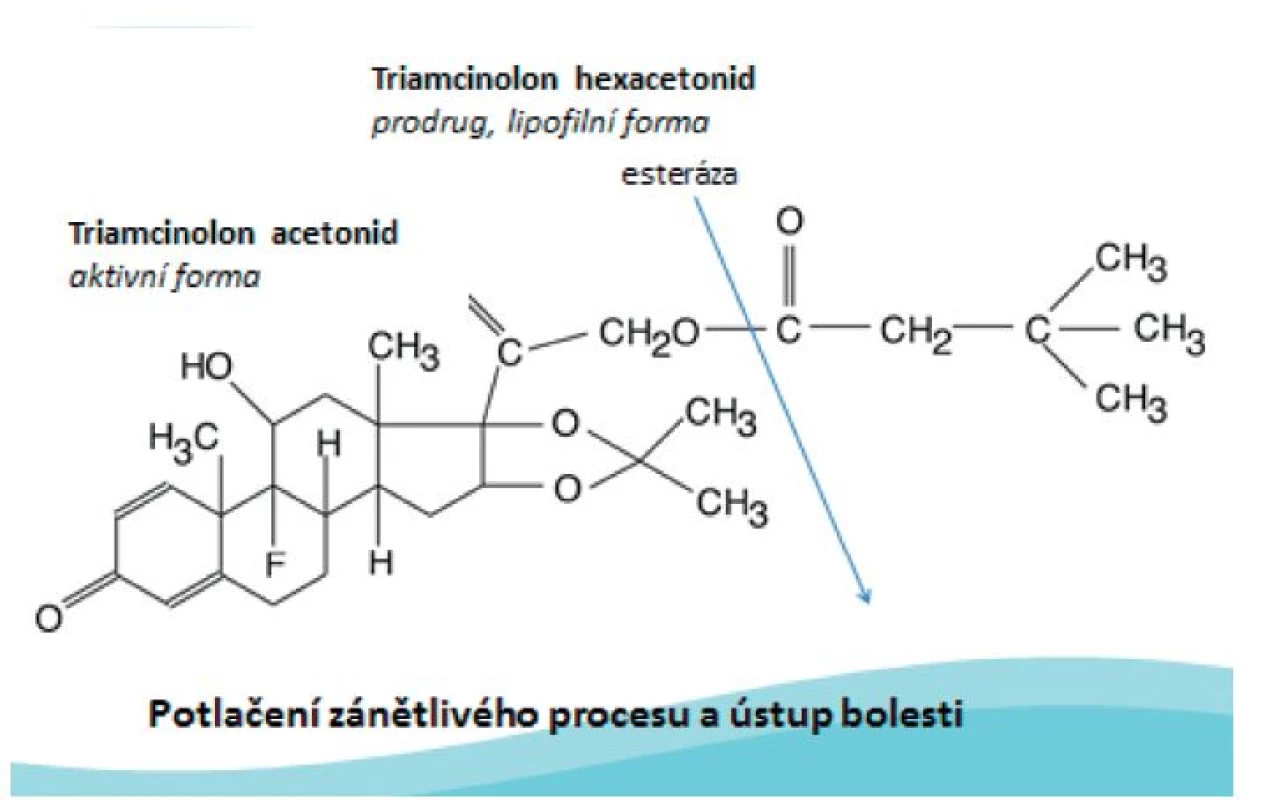
Mechanismus účinku: Po i.a. injekci je TH uvolňován z krystalického depa. Ester je tkáňovými enzymy (esterázami) rozštěpen na aktivní produkt – triamcinolon acetonid. Poté se aktivní sloučenina naváže na glukokortikoidní receptory a dochází k utlumení syntézy prozánětlivých mediátorů a zvýšení produkce protizánětlivých proteinů a tím k potlačení zánětlivého kloubního procesu (obr. 2).
Protizánětlivý účinek je dobře prozkoumán na pacientech s RA. 20 mg TA signifikantně snižuje hladiny sérových cytokinů IL-2, IL-4, IL-6, IL-7, IL-17 a TNFα 3 hodiny po injekci (73). I.a. TH snižuje expresi citrulinovaných proteinů, monoklonálních protilátek F95 a peptidylarginine deiminasy 4 (PAD 4) v synovii kloubů (74) a snižuje hladinu synoviálních T-lymfocytů bez ovlivnění počtu makrofágů (75). Snížením exprese RANKL v synovii současně se snížením poměru RANKL:osteoprotegerin dochází k potlačení markerů kostní destrukce a tím k potlačení tvorby kloubních erozí (76).
Předností TH je tedy jeho dlouhodobé působení, které je dáno unikátní esterifikací, která způsobuje jeho vysokou lipofilitu. Proto účinek přípravku nastupuje obvykle do 24 hodin po podání a běžně trvá 4 až 6 týdnů. Nízký výskyt systémových nežádoucích účinků je dán vysokou koncentrací a dlouhou dobou setrvání TH (díky lipofilitě) v místě aplikace a tím následně nízkou plazmatickou hladinou. Díky drobným rhomboidním krystalům s velikostí pouze 1,4 µm je TH dobře lokálně snášen. Je potřeba jen 50 % dávky ve srovnání s TA, může být aplikován dětem od 3 let. Je mísitelný s lokálními anestetiky, např. 1% až 2% roztokem lidokain hydrochloridu, ale měl by být natažený do stříkačky před natažením anestetika.
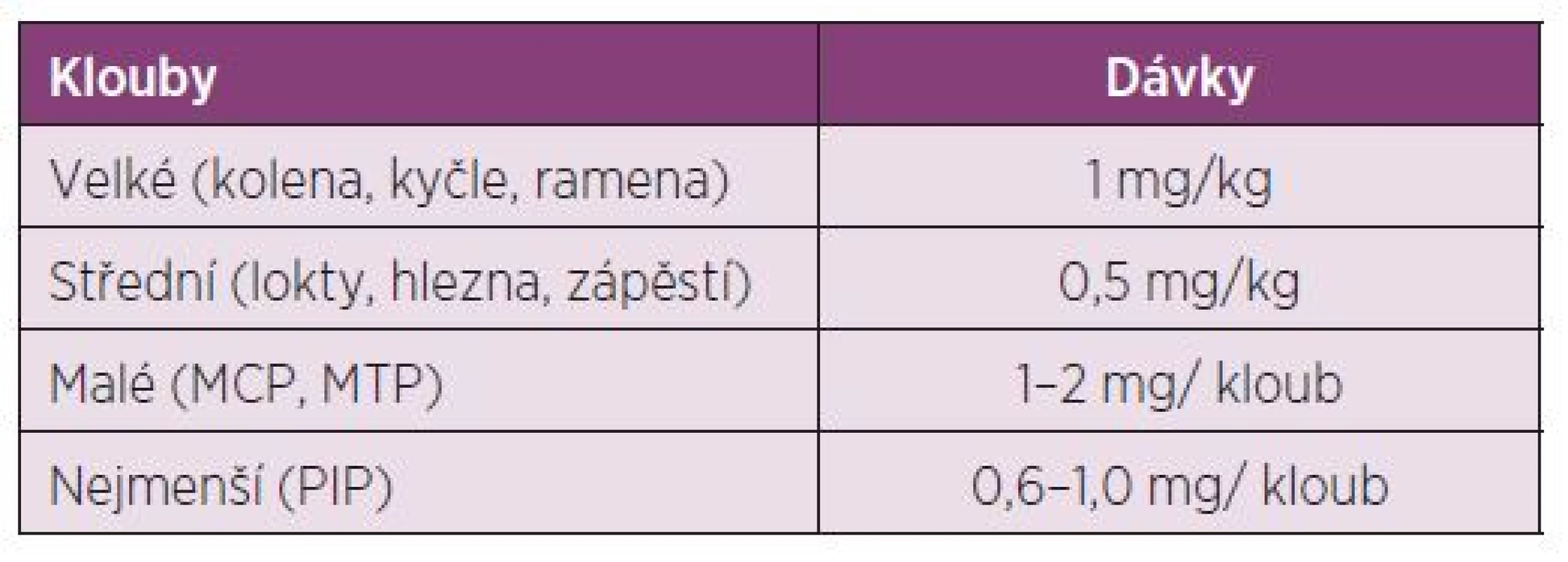
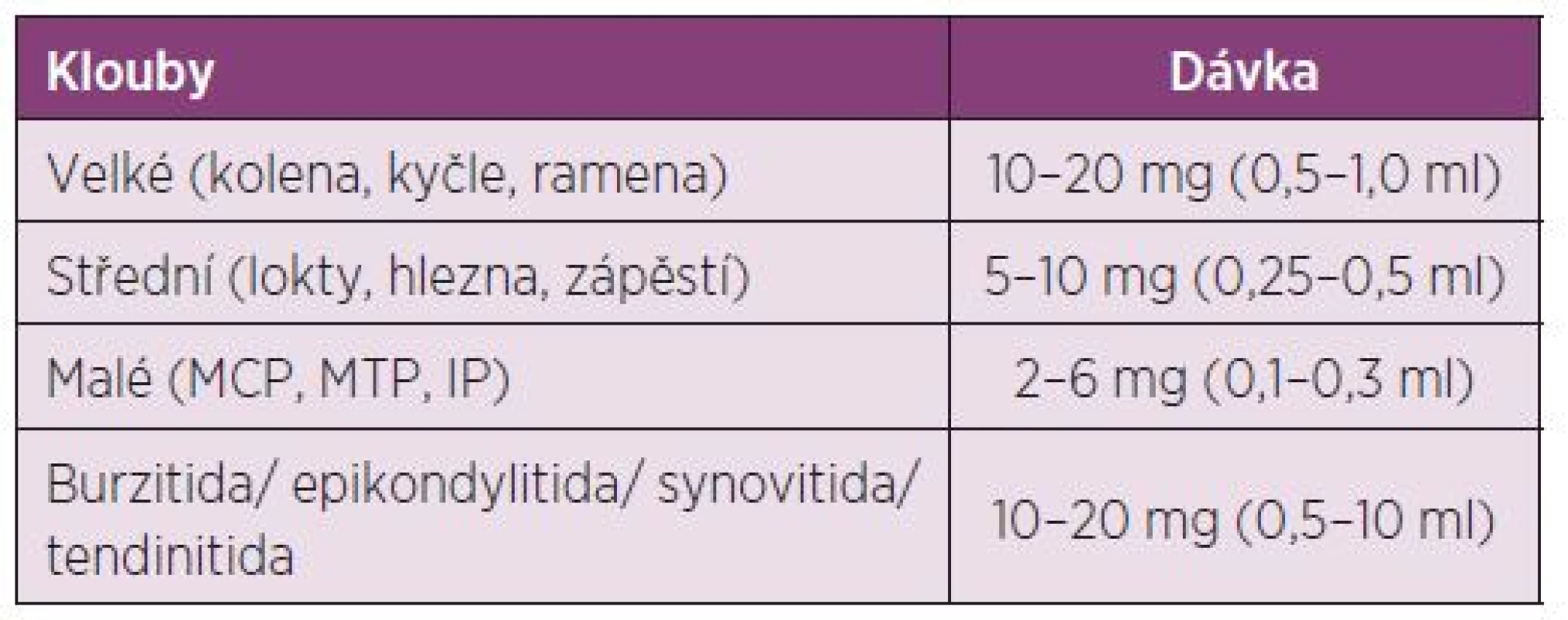
Dávkování u dětí: Děti vyžadují vyšší intraartikulární dávky než dospělí ve vztahu k povrchu těla. Před aplikací je u dětí do 10 ti let doporučena lokální anestesie u jednotlivých injekcí (tab. 3).
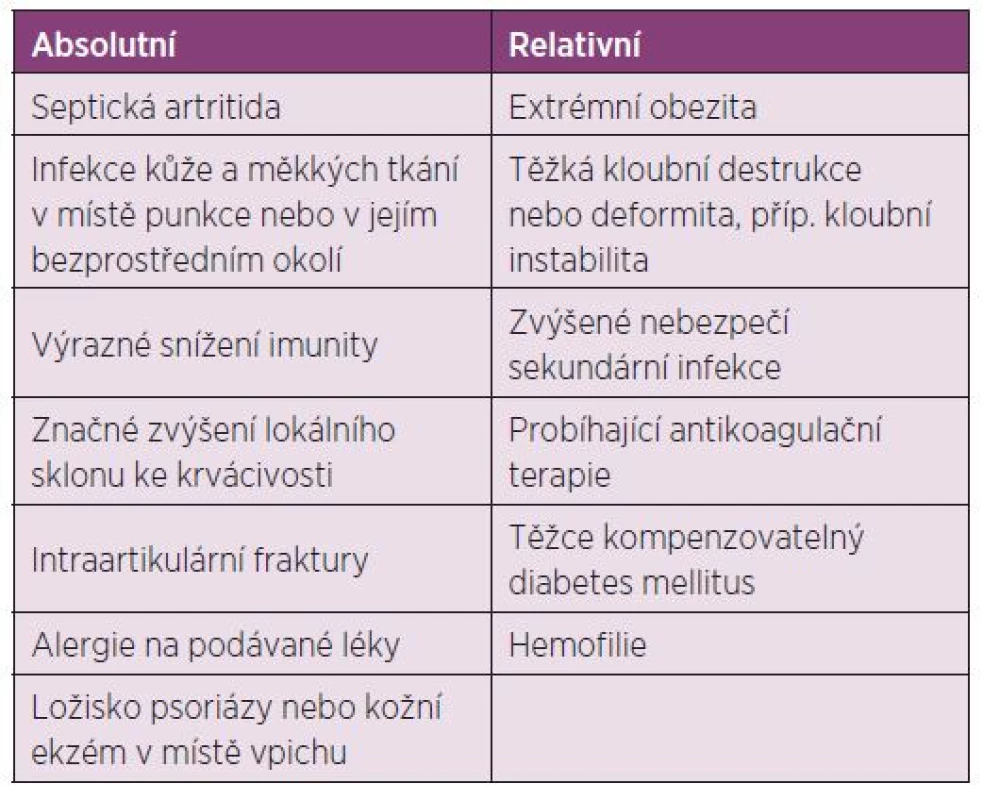
Dávkování u dospělých: Před i.a. aplikací TH je doporučeno provést aspiraci výpotku z kloubu (77). Další dávku můžeme aplikovat dle klinického stavu, ale minimální interval mezi aplikacemi je potřeba dodržovat 3–4 týdny a při jedné návštěvě aplikovat injekci maximálně do dvou kloubů. Nedoporučuje se aplikace víc než 4 injekcí do jednoho kloubu za rok (17, 18) (tab. 4). Indikace a kontraindikace intraartikulární aplikace GK jsou uvedeny v tabulkách číslo 5 a 6.
Diskuse
Klinické studie prokazují, že i.a. aplikace TA a TH jsou stále efektivní a cenné v terapii RA (78), různých forem JIA (79) a OA (80,33). Nacházejí ale své uplatnění i při malých nebo středních kloubních poranění (81). I.a. injekce TA a TH mají příznivější farmakokinetický i farmakodynamický profil. Jsou kompletně absorbovány z místa aplikace a jejich hladiny jsou detekovatelné v plazmě více než 2 týdny. TH je absorbován pomaleji než TA díky jeho nižší rozpustnosti. U pacientů s JIA jsou schopny navodit kompletní remisi trvající více než 6 měsíců. TH je mnohem účinnější než TA u pacientů s RA. Snižuje populaci T-lymfocytů a TNFα bez ovlivnění makrofágů, snižuje citrulinované proteiny, monoklonální protilátky F59 a PAD 4 v synovii a tím vykazuje výrazné protizánětlivé, imunomodulační a klinické účinky, které představují pozitivní chorobu-modifikující terapeutický efekt v léčbě RA. U osteoartrózy TA i TH zlepšují rozsah pohybu a snižují bolest v intervenovaném kloubu. Celkem mají lepší bezpečnostní profil, zvláště při i.a. aplikaci, avšak při aplikaci mimokloubní do měkkých tkání mohou více než MPA vyvolávat kožní atrofie vzhledem k jejich výraznějším katabolickým vlastnostem.
Malé množství kvalitních randomizovaných klinických studií s i.a. aplikací GK, malá velikost vzorků, variabilní metodologické vlastnosti a různorodost sledovaných parametrů však brání stanovit jednoznačné závěry k návodu léčby. Nicméně, založeno na současných znalostech, můžeme vyvodit následující závěry: 1. Užití TH by mělo být upřednostňováno před MP při artritidě kolenního kloubu (RA nebo OA) pro jeho rychlejší nástup účinku (úroveň evidence: 1B). 2. U pacientů s JIA je užití TH upřednostňováno před jinými GK (TA, BM) při aplikaci do kolenních kloubů, zápěstí a hlezen vzhledem k jeho schopnosti udržet déle remisi a rychlejšímu nástupu účinku (úroveň evidence: 1B). 3. Zdá se, že TA a MP jsou stejně účinné při aplikaci do kolenních a ramenních kloubů (úroveň evidence: 1B) (82). Na základě doporučení pro klinickou praxi založené na údajích z literatury a zkušenostech expertů by tedy měl být TH preferován před ostatními GK pro i.a. aplikaci s dodržením klidového režimu intervenovaného kloubu 24hodinové po aplikaci (68).
Závěr
I.a. glukokortikoidy se staly nedílnou součástí revmatologické praxe v terapii dospělých i dětí s různými kloubními i mimokloubními zánětlivými nebo bolestivými stavy. Poskytují místní okamžitý účinek a podporují účinek systémové terapie. Mnohem častěji vykazují velmi rychlou úlevu od bolesti a otoku kloubů na rozdíl od většiny systémové terapie.
Triamcinolon hexacetonid pro svoji dlouhodobější účinnost než přípravky s obsahem metylprednisolonu a betametazonu a tím nižší potřebu opakované aplikace má významnou úlohu v lokální terapii celé řady revmatických onemocnění u dospělých i dětských pacientů.
V současné době je přípravek s obsahem TH dovážen do České republiky pouze na zvláštní dovoz, což omezuje a komplikuje jeho dostupnost v ambulantní praxi. V nejbližší době bude dostupný triamcinolon hexacetonid v lékárnách pod firemním názvem Trispan, což zjednoduší jeho použití.
Adresa pro korespondenci:
MUDr. Radka Svobodová
Revmatologický ústav Praha 2
Na Slupi 4
128 50 Praha
tel. 234 075 229
e-mail: svobodova.r@revma.cz
Sources
1. Habib GS et al. Systemic effects of intra–artricular corticosteroids. Clin Rheumatol 2009; 28 : 749–56.
2. Hollander JL, Brown EM, Jessar RA et al. Hydrocortisone and cortisone injected into arthritis joint: comparative effects and use of hydrocortisone as a local antiarthritis agent. JAMA 1951; 147 : 16329–35.
3. Schwartz S. Intra-articular administration of triamcinolone acetonide: a preliminary report. N Y State J Med 1960; 60 : 3422–5.
4. Kendall PH. Triamcinolone hexacetonide. A new corticosteroid for intra-articular therapy. Ann Phys Med 1967; 9 : 55–8.
5. Norcross BM, Winter JA. Methylprednisolone acetate: a single preparation suitable for both intra–articular and systemic use. N Y State J Med 1961; 61 : 552–61.
6. Roberts HJ. Local injection of a preparation containing two betamethasone esters in the treatment of noninfectious musculoskeletal disorders. J Am Geriatr Soc 1965; 13 : 275–91.
7. Möllmann HW, Armbruster B, Barth J et al. Analysis of shape, grain size distribution and aggregation of crystals in glucocorticoid-depot preparations. Analyse von Form, Korngrößenverteilung und Aggregation der Kristalle in Glukokortikoid-Depotpräparaten. Akt Rheumatol 1990; 15(3): 101–24.
8. Rohdewald P, Möllmann HW, Hochhaus G. Rezeptoraffinitäten handelsüblicher Glukokortikoide zum Glukokortikoid–Rezeptor der menschlichen Lunge. Atemw.-Lungenkrkh 1984; 10 (9); 484–89.
9. Hochhaus G, Möllmann H, Barth J. Glukokortikoide für den intraartikulären Einsatz: Pharmakodynamische Charakterisierung durch Rezeptorbindungsstudien. Akt Rheumatol 1990; 15; 66–69.
10. Armstrong RD, English J, Gibsn T et al. Serum methylprednisolone levels following intra–articular injection of methylprednisolone acetate. Ann Rheum Dis 1981; 40 : 571–4.
11. Bertouch JV, Sallustio BC, Mefflin BJ et al. A comparison of plasma methylprednisolone concentrations following intraarticular injection in patients with rheumatoid arthritis and osteoarthritis. Aust N Z Med 1983; 13 : 583–5.
12. Weitof T, Ronnblom L. Glucocorticoid resorption and influence on the hypothalamic-pituitary-adrenal axis after intra-articular treatment of the knee in resting and mobile patients. Ann Rheumatol Dis 2006; 65 : 955–7.
13. Derendorf H, Mollmann H, Gruner A et al. Pharmacokinetics and pharmacodynamics of glucocorticoid suspensions after intra-articular administration. Clin Pharmacol Ther 1986; 39 : 313–7.
14. Younes M, Neffati F, Touzi M et al. Systemic effects of epidural and intra-articular glucocorticoid injections in diabetic and non–diabetic patients. Joint Bone Spine 2007; 74 : 472–6.
15. Hatz H. Lokale intraartikuläre Diagnostik und Therapie – Synovia-Analyse und Injektionstechniken der Gelenke Gebundene Ausgabe – August 2009.
16. Emkey RD, Lindsay R, Lyssy J et al. The systemic effect of intra-articular administration of corticosteroid on markers of bone formation and bone resorption in patients with rheumatoid arthritis. Arthritis Rheum 1996; 39(2): 277–82.
17. Pavelka K, Vencovský J. Doporučení České revmatologické společnosti pro léčbu revmatoidní artritidy. Čes Revmatol 2010; 18 (4): 182–91.
18. Smolen JS, Landewé R, Breedveld FC et al. EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease–modifying antirheumatic drugs: 2013 update. Ann Rheum Dis 2014; 73 : 492–509.
19. Konai MS, Vilar Furtado RN, Dos Santos MF et al. Monoartricular corticosteroid injection versus systemic administration in the treatment of rheumatoid arthritis patients: a randomized double-blind controlled study. Clin Exp Rheumatol 2009; 27(2): 214–21.
20. Furtado R et al. Polyartricular corticosteroid injection versus systemic administration in treatment of rheumatoid arthritis patients: a randomized controlled study. J Rheumatol 2005; 32 : 1691–8.
21. Bird HA, Ring EFJ, Bacon PA. Termographic and clinical comparison of 3 intra-articular steroid preparation in rheumatoid arthritis. Ann Rheum Dis 1979; 38(1): 36–9.
22. Blyth T, Stirling A, Coote J et al. Injection of the rheumatoid knee does intra-articular methotrexate or rifampicin add to the benefits of triamcinolone hexacetonide. Br J Rheumatol 1998; 37(7): 770–2.
23. Axelsen MB, Eshed I, Horslev-Petersen K et al. A treat-to-target strategy with methotrexate and intra-articular triamcinolone with or without adalimumab effectively reduces MRI synovitis, osteitis and tenosynovitis and halts structural damage progression in early rheumatoid arthritis: results from the OPERA randomized controlled trial. Ann Rheum Dis 2014; doi:10.1136/annrheumdis–2013–204537.
24. Weitoft T, Rönnelid J, Knight A et al. Outcome predictors of intra-articular glucocorticoid treatment for knee synovitis in patients with rheumatoid arthritis – a prospective cohort study. Arthritis Res Ther 2014; 16: R129
25. Zhang W, Moskowitz RW, Nuki G et al. OARSI recommendations for the management of hip and knee osteoarthritis, Part bII. OARSI evidence based, expert consensus guidelines. Osteoarthr Cartil 2008; 16 : 137–62.
26. Bellamy N, Campbell J, Welch V et al. Intraarticular corticosteroid for treatment of osteoarthritis of the knee (Review). The Cochrane Collaboration 2009.
27. Cheng OT et al. Evidence based knee injections for the management of arthritis. Pain Med 2012; 13(6): 740–53.
28. Acebes JC, Sanchez–Pernaute O, Diaz–Oca A et al. Ultrasonographic assessment of Baker´s cysts after intra-articular corticosteroid injection in knee osteoarthritis. J Clin Ultrasound 2006; 34(3): 113–7.
29. Gaffney K, Ledingham J, Perry JD. Intra-articular triamcinolone hexacetonide in knee osteoarthritis: factors influencing the clinical response. Ann Rheum Dis 1995; 54(5): 378–81.
30. Pyne D, Ioannou Y, Mootoo R et al. Intra–articular steroids in knee osteoarthritis. A comparative study of triamcinolone hexacetonide and methylprednisolone acetate. Clin Rheumatol 2004; 23(2): 116–20.
31. Meenagh GK, Patton J, Kynes C et al. A randomized controlled trial of intra–articular corticosteroid injection of the carpometacarpal joint of the thumb in osteoarthritis. Ann Rheum Dis 2004; 63(10): 1260–3.
32. Pavelka K. Doporučení České revmatologické společnosti pro léčbu osteoartrózy kolenních, kyčelních a ručních kloubů. Čes. Revmatol 2012; 20 (3): 138–57.
33. Hochberg MC, Altman RD, April KT et al. American College of Rheumatology 2012 recommendations for the use of nonpharmacologic and pharmacologic therapies in osteoarthritis of the hand, hip, and knee. Arthritis Care Res (Hoboken) 2012; 64(4): 465–74.
34. Zulian F, Martini G, Gobber D et al. Triamcinolone acetonide and hexacetonide intra-articular treatment of symmetrical joints in juvenile idiopathic arthritis: a double-blind trial. Rheumatology 2004; 43(10): 1288–91.
35. Eberhard BA, Sison MC, Gottleib BS et al. Comparison of the intraarticular effectiveness of triamcinolone hexacetonide and triamcinolone acetonide in treatment of juvenile rheumatoid arthritis. J Rheumatol 2004; 31(12): 2507–12.
36. Zulian F, Martini G, Gobber D et al. Comparison of intra-articular triamcinolone hexacetonide and triamcinolone acetonide in oligoarticular juvenile idiopathic arthritis. Rheumatology (Oxford) 2003; 42(10): 1254–9.
37. Balogh Z, Ruzsonyi E. Triamcinolone hexacetonide versus betamethazone. A double-blind comparative study of the long-term effects of intra-articular steroids in patients with juvenile chronic arthritis. Scand J Rheumatol 1988; 67 : 80–2.
38. Honkanen VEA, Rautonen JK, Pelkonen PM. Intra-articular glucocorticoids in early juvenile chronic arthritis. Acta Paediatr 1993; 82(12): 1072–4.
39. Bloom BJ, Alario AJ, Miller LC. Intra-articular corticosteroid therapy for juvenile idiopathic arthritis: report of an experimental cohort and literature review. Rheumatol Int 2011; 31 : 749–56.
40. Lanni S, Bertamino M, Consolaro A et al. Outcome and predicting factors of single and multiple intra-articular corticosteroid injections in children with juvenile idiopathic arthritis. Rheumatology 2011; 50 : 1627–34.
41. Stoll ML, Good J, Sharpe T et al. Intra-articular corticosteroid injections to the temporomandibular joints are safe and appear to be effective therapy in children with juvenile idiopathic arthritis. J Oral Maxillofac Surg 2012; 70(8): 1802–7.
42. Cahill AM, Cho SS, Baskin KM et al. Benefit of fluoroscopically guided intra-articular long-acting corticosteroid injection for subtalar arthritis in juvenile idiopathic arthritis. Pediatr Radiol 2007; 37(6): 544–8.
43. Sherry DD, Stein LD, Reed AM et al. Prevention of leg lenght discrepancy in young children with panciarticular juvenile rheumatoid arthritis by treatment with intraarticular steroids. Arthritis Rheum 1999; 42 : 2330–4.
44. Ringold S, Weiss PF, Beukelman T et al. 2013 update of the 2011 American College of Rheumatology recommendations for the treatment of juvenile idiopathic arthritis: recommendations for the medical therapy of children with systemic juvenile idiopathic arthritis and tuberculosis screening among children receiving biologic medications. Arthritis Rheum 2013; 65(10): 2499–512.
45. Blyth T, Hunter JA, Stirling A. Pain relief in the rheumatoid knee after steroid injection. A single-blind comparison of hydrocortisone succinate, and triamcinolone acetonide or hexacetonide. Br J Rheumatol 1994; 33(5): 461–3.
46. Gray RG, Tenenbaum J, Gottlieb NL. Local corticosteroid treatment in rheumatic disorders. Semin Arthritis Rheum 1981; 10 : 231–54.
47. Pavelka K. Doporučení České revmatologické společnosti pro léčbu dnavé artritidy. Čes. Revmatol 2012; 20 : 82–92.
48. Sivera F, Andrés M, Carmona L et al. Multinational evidence–based recommendations for the diagnosis and management of gout: integrating systematic literature review and expert opinion of a broad panel of rheumatologists in the 3e initiative. Ann Rheum Dis 2013;0 : 1–8.
49. Pavelka K. Doporučení České revmatologické společnosti pro léčbu ankylozující spondylitidy. Čes. Revmatol 2012; 20(1): 4–11.
50. Braun J, Berg R, Baraliakos X et al. 2010 update of the ASAS/EULAR recommendations for the management of ankylosing spondylitis. Ann Rheum Dis 2011; 70 : 896–904.
51. Maugars Y, Mathis C, Vilon P et al. Corticosteroid injection of the sacroiliac joint in patients with seronegative spondylarthropathy. Arthritis Rheum 1992; 35 : 564–8.
52. Braun J, Bollow M, Seyrekbasan F et al. Computed tomography guided corticosteroid injection of the sacroiliac joint in patient with spondylarthropathy with sacroiliitis: clinical outcome and follow-up by dynamic magnetic resonance imaging. J Rheumatol 1996; 23 : 659–64.
53. Bollow M, Braun J, Taupitz M et al. CT–guided intraarticular corticosteroid injection into the sacroiliac joints in patients with spondylarthropathy: indication and follow-up with contrast enhanced MRI. J Comput Assist Tomogr 1996; 20 : 512–21.
54. Maugars Y, Mathis C, Berthelot J–M et al. Assessment of the efficacy of sacroiliac corticosteroid injections in spondylarthropathies: a double–blind study. Br J Rheumatol 1996; 35 : 767–70.
55. Hanly JG, Mitchell M, MacMillan L et al. Efficacy of sacroiliac corticosteroid injections in patients with inflammatory spondylarthropathy: results of a 6 month controlled study. J Rheumatol 2000; 27 : 719–22.
56. Štolfa J, Vencovský J, Pavelka K. Doporučené postupy České revmatologické společnosti pro léčbu psoriatické artritidy Čes. Revmatol 2012; 20 (1):13–18.
57. Gossec L, Smolen JS, Gaujoux–Viala C. European League Against Rheumatism recommendations for the management of psoriatic arthritis with pharmacological therapies. Ann Rheum Dis 2012;71 : 4–12.
58. Gaujoux–Viala C, Dougados M, Gossec L. Efficacy and safety of steroid injections for shoulder and elbow tendonitis. A metaanalysis of randomized control trials. Ann Rheum Dis 2009; 68 : 1843–9.
59. Buchbinder R, Green S, Youd JM. Corticosteroid injections for shoulder pain. Cochrane Database Syst Rev 2003;(1).
60. Green S, Buchbinder R, Glazier R et al. Systematic review of randomized controlled trials of interventions for painful shoulder: selection criteria, outcome assessment, and efficacy. BMJ 1998; 316 : 354–60.
61. Raynauld JP, Buckland–Wright C, Ward R et al. Safety and efficacy of long–term intraarticular steroid injections in osteoarthritis of the knee: a randomized, double–blind, placebo–controlled trial. Arthritis Rheum 2003; 48 : 370–7.
62. Gottlieb NL, Penneys NS, Brown Jr HE. Periarticular perilymphatic skin atrophy after intra-articular corticosteroid injections. JAMA 1978; 240 : 559–60.
63. Pattrick M, Doherty M. Facial flushing after intra-articular injection of steroid. BMJ 1987; 295(6610): 1380.
64. Job–Deslandre C, Menkes CJ. Complication of intra–articular injections of triamcinolone hexacetonide in chronic arthritis in children. Clin Exp Rheumatol 1990; 8(4): 413–6.
65. Sparling M, Malleson P, Wood B et al. Radiographic follow-up of joints injected with triamcinolone hexacetonide for the management of childhood arthritis. Arthritis Rheum 1990; 33(6): 821–6.
66. Breit W, Frosch M, Meyer U et al. A subgroup–specific evaluation of the efficacy of intra–articular triamcinolone hexacetonide in juvenile chronic arthritis. J Rheumatol 2000; 27(11): 2696–702.
67. Laroche M, Arlet J, Mazieres B. Osteonecrosis of the femoral and humeral heads after intra-articular corticosteroid injections. J Rheumatol 1990; 17 : 549–51.
68. Holland C, Jaeger L, Smentkowski U et al. Septic and aseptic complications of corticosteroid injections. Dtsch Arztebl Int 2012; 109(24): 425–30.
69. Seror P, Pluvinage P, d´Andre FL et al. Frequency of sepsis after local corticosteroid injection (an inquiry on 1160000 injections in rheumatological private practice in France). Rheumatology 1999; 38(12): 1272–4.
70. Larson LG. Anaphylactic shock after IA administration of triamcinolone acetonide in a 35–year–old female. Scan J Rheumatol 1989; 18(6): 441–2.
71. Karh J, Yang WH. An anaphylactic reaction to intra-articular triamcinolone a case report and review of the literature. Ann Allergy Asthma Immunol 2003;90(2):254–8.
72. Melby JC. Systemic corticosteroid therapy: pharmacology and endocrinologic considerations. Ann Intern Med 1974; 81(4): 505–12.
73. Alex P, Szodoray P, Arthur E et al. Influence of intra-articular corticosteroid administration on serum cytokines in rheumatoid arthritis. Clin Rheum 2007; 26(5): 845–8.
74. Makrygiannakis D, Revu S, Engstrom M et al. Local administration of glucocorticoid decreases synovial citrullination in rheumatoid arthritis. Arthritis Res Ther 2012; 14(1): R20
75. af Klint E, Grundtman C, Engstrom M et al. Intra-articular glucocorticoid treatment reduces inflammation in synovial cell infiltrations more efficiently than in synovial blood vessels. Arthritis Rheum 2005; 53(12): 3880–9.
76. Makrygiannakis D, af Klint E, Catrina SB et al. Intraarticular Corticosteroids Decrease Synovial RANKL Expression in Inflammatory Arthritis. Arthritis Rheum 2006; 54(5): 1463–72.
77. Weitoft T1, Uddenfeldt P. Importance of synovial fluid aspiration when injecting intraarticular corticosteroids. Ann Rheum Dis 2000; 59(3): 233–5.
78. Dernis E, Ruyssen–Witrand A, Mouterde G et al. Use of glucocorticoids in rheumatoid arthritis – Practical modalities of glucocorticoid therapy: Recommendations for clinical practice based on data from the literature and expert opinion. Joint Bone Spine 2010; 77 : 451–7.
79. Hashkes PJ, Laxer RM. Medical treatment of juvenile idiopathic arthritis. JAMA 2005; 294(13): 1671–84.
80. McAlindon TE, Bannuru RR, Sullivan MC et al. OARSI guidelines for the non-surgical management of knee osteoarthritis. Osteoarthritis Cartil 2014; 22(3): 363–88.
81. Scherer J, Rainsford KD, Kean CA et al. Pharmacology of intra-articular triamcinolone. Inflammopharmacol 2014; 22 : 201–17.
82. Garg N, Perry L, Deodhar A. Intra–articular and soft tissue injections, a systematic review of relative efficacy of various corticosteroids. Clin Rheumatol 2014; 33(12): 1695–706.
Labels
Dermatology & STDs Paediatric rheumatology RheumatologyArticle was published in
Czech Rheumatology

2015 Issue 1
-
All articles in this issue
- Polymorfismus C677T genu pro methylentetrahydrofolát reduktázu je spojen se změnou léčebné odpovědi na methotrexát v populaci revmatoidní artritidy Východočeského regionu
- Perspektivy léčby osteoartrózy
- Účinnost a bezpečnost intraartikulární aplikace depotních glukokortikoidů u revmatických onemocnění
- Systémový lupus erythematodes – kazuistika neobvyklého případu s krvácivými projevy
- Czech Rheumatology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Účinnost a bezpečnost intraartikulární aplikace depotních glukokortikoidů u revmatických onemocnění
- Perspektivy léčby osteoartrózy
- Systémový lupus erythematodes – kazuistika neobvyklého případu s krvácivými projevy
- Polymorfismus C677T genu pro methylentetrahydrofolát reduktázu je spojen se změnou léčebné odpovědi na methotrexát v populaci revmatoidní artritidy Východočeského regionu
