Úskalí diagnostiky ANCA asociovaných vaskulitid – kazuistika
L. Pitfalls of diagnosis of ANCA-associated vasculitis – case report
ANCA-associated vasculitides (AAV) are a group of rare, autoinflammatory diseases with the presence of serum autoantibodies against neutrophil cytoplasm. Inflammation of the small vessels (polyangiitis) with granulomas and tissue necrosis represents the underlying mechanism of the disease. Renal involvement is one of the most severe clinical manifestations of AAV and often presents with rapidly progressive glomerulonephritis (RPGN). We describe a case of a patient suffering from granulomatosis with polyangiitis with renal involvement, whose first renal biopsy was negative. Despite that, the patient was intensely treated with glucocorticoids, cyclophosphamide, and azathioprine. Due to the progression of renal symptoms, a second biopsy was performed, and active glomerulonephritis was confirmed. Based on the described case, we would like to highlight that despite the negative results of the first kidney biopsy, the patient suffered from a severe and progressive form of the disease with renal involvement that required rituximab treatment to reach remission.
Keywords:
ANCA – ANCA associated vasculitis – glomerulonephritis – renal biopsy – rituximab
Authors:
M. A. Sokalska-Jurkiewicz 1; M. Kment 2; R. Ryšavá 3; L. Šedová 1
Authors‘ workplace:
Revmatologický ústav Praha
1; Institut klinické a experimentální medicíny, Praha
2; Klinika nefrologie 1. LF UK a VFN, Praha
3
Published in:
Čes. Revmatol., 28, 2020, No. 4, p. 248-252.
Category:
Case Report
Overview
ANCA asociované vaskulitidy (AAV) je skupina vzácných, autoimunitních zánětlivých onemocnění s přítomností protilátek proti cytoplazmě neutrofilů (ANCA) v séru. Podstatou nemocí je zánět malých cév (polyangiitida) s tvorbou granulomů a vznikem nekrózy. Postižení ledvin je jednou s nejzávažnějších klinických manifestaci AAV a často má formu rychle progredující glomerulonefritidy. V článku popisujeme případ pacienta s projevy granulomatózy s polyangiitidou s postižením ledvin, u kterého vstupní biopsie ledviny neprokázala přítomnost glomerulonefritidy. Pacient byl přes to intenzivně léčen glukokortikoidy, cyklofosfamidem a azathioprinem. Vzhledem k progresi močového nálezu byla provedena rebiopsie, která tentokrát již prokázala aktivní glomerulonefritidu. Terapeuticky byl podán rituximab s dobrým efektem. V této kazuistice se poukazuje na to, že i přes úvodní negativní výsledek biopsie u pacienta došlo k vývoji závažné, rychle progredující glomerulonefritidy, nereagující na terapii cyklofosfamidem a vyžadující podání rituximabu k dosažení remise.
Klíčová slova:
ANCA – ANCA asociované vaskulitidy – glomerulonefritida – renální biopsie – rituximab
ÚVOD
ANCA asociované vaskulitidy (AAV) je skupina závažných, vzácných, autoimunitních zánětlivých onemocnění s typickou přítomností protilátek proti cytoplazmě neutrofilů (ANCA) v séru. Podstatou nemocí je zánět malých cév (polyangiitida) s tvorbou granulomů a vznikem nekróz patrných v histopatologickém nálezu. Roční výskyt AAV se pohybuje mezi 13 a 20 novými případy na milion obyvatel, nemoc postihuje obě pohlaví obdobně s možnou mírnou preferencí mužů a vrchol incidence je mezi pátou a šestou dekádou života (1). Obecný princip etiopatogeneze AAV je obdobný jako u ostatních autoimunitních nemocí a spočívá v kombinaci vlivu zevních faktorů (např. infekční agens, léky, konzervující látky, znečištění ovzduší) a genetické dispozice. Na buněčné úrovni mají významnou patogenetickou úlohu ANCA protilátky, které jsou silným aktivátorem neutrofilů. Po aktivaci uvolňují tyto buňky prozánětlivé cytokiny, lytické enzymy a reaktivní kyslík (2). Navíc dle recentních literárních zdrojů aktivované neutrofily intenzivně tvoří neutrofilní extracelulární pasti (NETs), které vedou k poškození malých cév a zároveň stimulují další tvorbu ANCA protilátek (2).
Do skupiny AAV patří granulomatóza s polyangiitidou (GPA), eozinofilní granulomatóza s polyangiitidou (EGPA), mikroskopická polyangiitida (MPA) a léky indukovaná AAV.
Tyto nemoci mají značný sklon k relapsům a špatnou prognózu. V generalizované systémové formě AAV postihují dýchací cesty a ledviny, ale zánětlivé změny se mohou objevit prakticky v každém orgánu, což vede ke vzniku velmi pestrého klinického obrazu nemoci.
Postižení ledvin je jednou s nejzávažnějších klinických manifestaci AAV. Objevuje se častěji u MPA (90 %), GPA (80 %) a méně často u EGPA (45 %) (3). Často se projevuje jako rychle progredující glomerulonefritida (RPGN) s nálezem hematurie s dysmorfními erytrocyty a erytrocytárními válci, proteinurie a poklesem renálních funkcí. Pro RPGN je příznačná přítomnost srpků (crescents). Synonymem pro RPGN je označení srpkovitá glomerulonefritida s přítomností alespoň 50 % srpků v renální biopsii a poklesem glomerulární filtrace (4). V případě GPA je postižení ledvin přítomné ihned při první manifestaci nemoci u 17 % pacientů a je obvykle asymptomatické (5). Bez terapie může snadno vést k finálnímu selhání ledvin s nutností trvalé dialyzační léčby (6).
POPIS PŘÍPADU
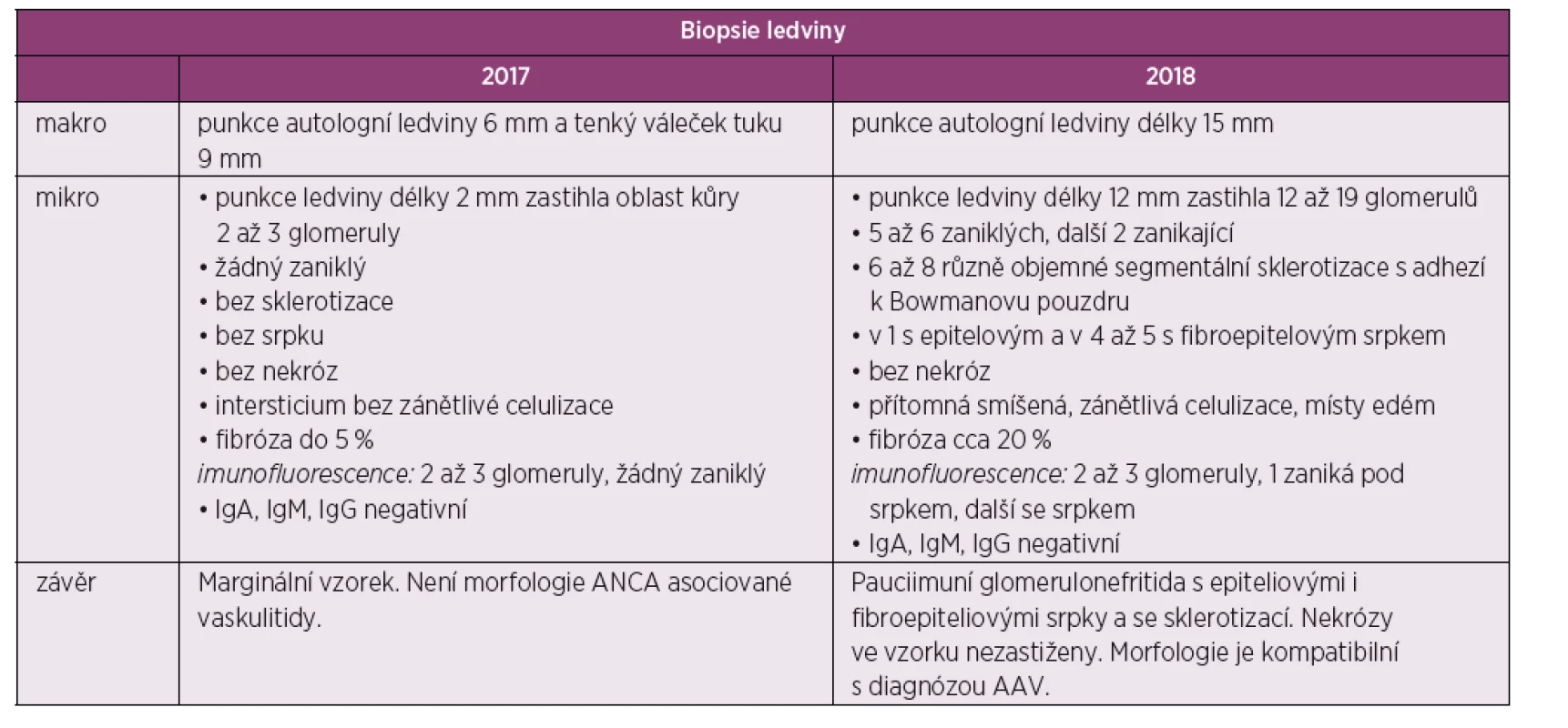
Pacient, 56 let, bez závažné osobní anamnézy, exkuřák (10 balíčko-roků) se dostavil k vyšetření k praktickému lékaři pro dlouhodobé stěhovavé artralgie a 3 měsíce trvající artritidy, postihující hlavně klouby dolních končetin. Na podkladě klinického obrazu byla vyslovená suspekce na lymeskou boreliózu a pacient absolvoval čtyřtýdenní kúru doxycyklinem zcela bez efektu. S odstupem byly vyšetřené protilátky proti Borrelia spp. s negativním výsledkem. Následně došlo ke vzniku ústních ulcerací, drobné purpury na dolních končetinách, rozvoji febrilních špiček, únavy, konjunktivitidy a byla zjištěná významná elevace CRP. Se suspekcí na autoimunitní onemocnění byl pacient odeslán k hospitalizaci do Revmatologického ústavu v Praze. Za hospitalizace se stav pacienta postupně horšil, přetrvávaly febrilie, únava, ústní ulcerace a polyartritida, nově se objevila polakisurie. Laboratorně přetrvávaly vysoké reaktanty akutní fáze (sedimentace erytrocytů 101 mm/ hodinu, sérový C-reaktivní protein 250 mg/l, sérový ferritin 1300 µg/l),dále byla zjištěna pozitivita revmatoidního faktoru, ANCA protilátek – anti-PR3 (c-AN-CA), leuko - a erytrocyturie s proteinurii 3,5 g/den). Na podkladě provedených vyšetření bylo vysloveno podezření na AAV s postižením ledvin. Úvodní renální funkce byly v normě. V rámci diferenciální diagnostiky byl proveden základní onkologický screening a bylo pátráno po infekčních fokusech. Proto byla během hospitalizace provedená extrakce dvou kariézních zubů se známkami infekce u kořene na panoramatickém snímku.
Následně pacient byl indikován k renální biopsii a přeložen na nefrologickou kliniku, kde byla provedená punkce levé ledviny. Biopsie nebyla bohužel dosti reprezentativní (malý vzorek) a zastihla jen několik glomerulů bez srpků, bez nekróz či postižení intersticia (obr. 1, tab. 1). I přes tento negativní nález byl stav po konzultaci s nefrology hodnocen jako AAV charakteru granulomatózy s polyangiitidou (GPA), a to na podkladě přítomnosti ústních ulcerací, konjunktivitidy, polyartritidy, purpury dolních končetin, močového nálezu (erytrocyturie a proteinurie), febrilií a pozitivity ANCA protilátek PR3. Následně byla zahájená terapie glukokortikoidy: byly podány tři pulzy methylprednisolonu po 500 mg 3 dny po sobě a bylo pokračováno v perorálním prednisonu v dávce 70 mg/den. Jíž po podání methylprednisolonu došlo k promptnímu poklesu reaktantů akutní fáze a zlepšení klinického stavu pacienta. Dále se pokračovalo v léčbě šesti pulzy cyklofosfamidu v dávce 15 mg/kg tělesné hmotnosti v intenzifikovaném režimu (první tři pulzy po 2 týdnech, další tři pulzy po 3 týdnech) a bylo započato v redukci dávek prednisonu. Pacient se zároveň současně s pulzy cyklofosfamidu zúčastnil klinického hodnocení s avacopanem (blokátor receptoru pro složku komplementu C5a) (7).
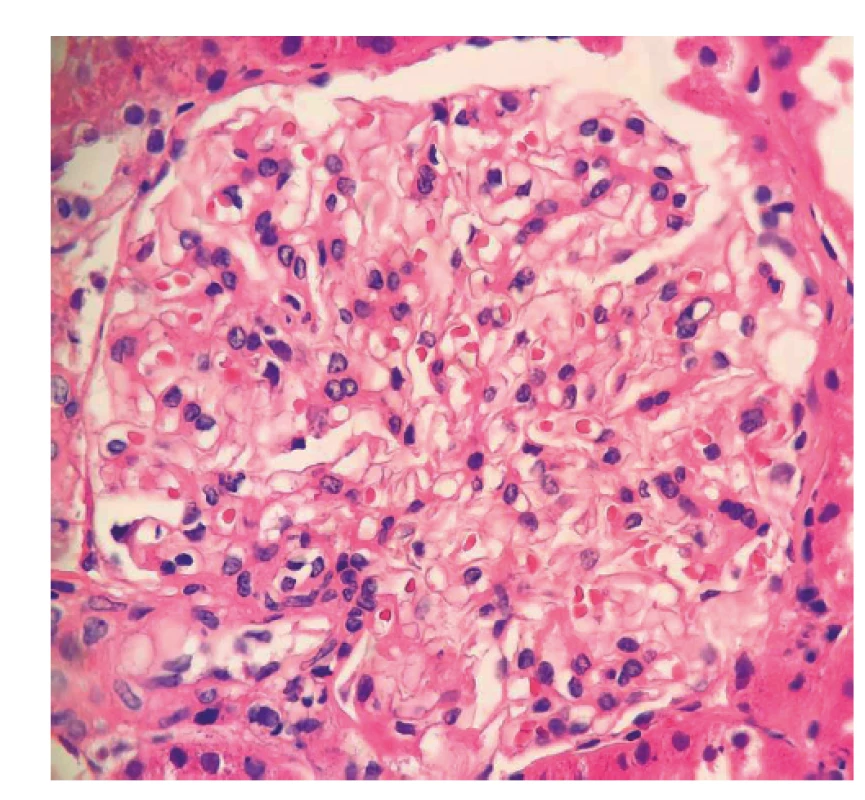
Již před druhým pulzem cyklofosfamidu jsme zaznamenali pokles renálních funkcí. Poškození ledvin progredovalo i přes další pulzy cyklofosfamidu (celkem šest pulzů), proto bylo po konzultaci nefrologa zastaveno snižování dávek glukokortikoidů (pacient ponechán na 20 mg prednisonu denně) a byl nasazen inhibitor angiotenzin konvertujícího enzymu.
Po ukončení pulzní terapie cyklofosfamidem byla zahájena terapie azathioprinem v dávce 112,5 mg/den. I přes tuto intenzivní léčbu došlo k relapsu onemocnění s horečkou a elevací reaktantů akutní fáze. Laboratorně přetrvávala významná proteinurie (8 g/den) a dále se horšily renální funkce (pokles glomerulární filtrace na 0,74 ml/s/1,7). Po dohodě s nefrologem byla zopakována renální biopsie k ujasnění, zda se jedná o aktivní glomerulonefritidu či o trvalé neaktivní poškození po proběhlé vaskulitidě. Ve vzorku ledvinné tkáně, získaném při rebiopsii, byla patrná aktivní glomerulonefritida – pauciimunní glomerulonefritida s epitelovými i fibroepitelovými srpky a se sklerotizací, nekrózy ve vzorku nebyly zastiženy (srpky 6/19 glomerulů, 5–6/19 zaniklých glomerulů, 2/19 zanikající, 6–8 glomerulů se sklerotizací) (obr. 2, tab. 1). Stav byl hodnocen jako selhání terapie cyklofosfamidem a byl podán rituximab – dvě infuze po 1000 mg v odstupu 14 dnů. Podání rituximabu vedlo k pozvolnému poklesu proteinurie, vymizení ANCA protilátek a zlepšení renálních funkci. Terapie byla zopakována v šestiměsíčních intervalech ještě 2krát. Pacient setrvává v trvalé remisi i přes významnou redukci dávek glukokortikoidů (5 mg/den). Reaktanty akutní fáze jsou nízké, renální funkce zlepšené, proteinurie je nízká a ANCA protilátky negativní.
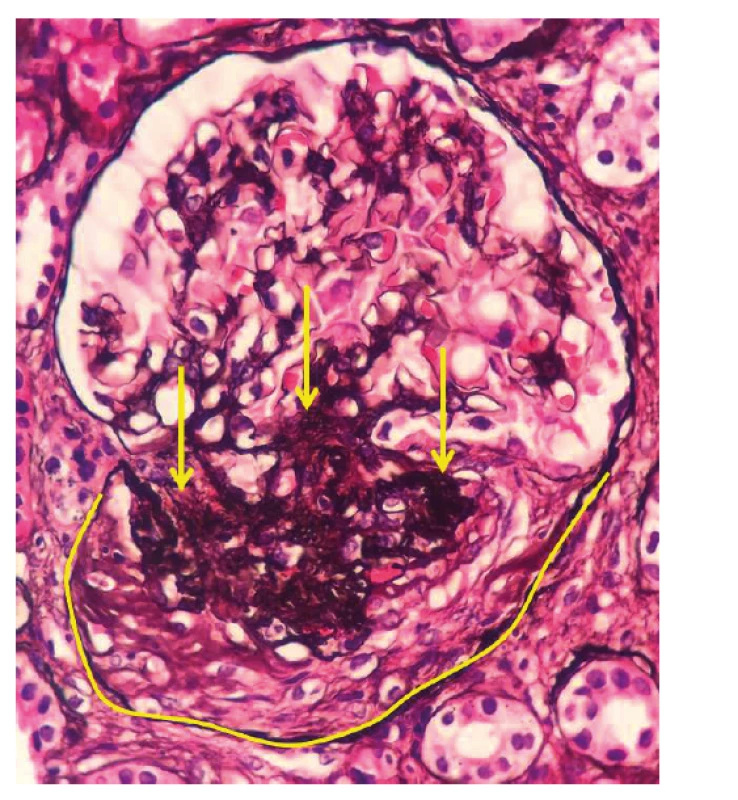
DISKUZE
Plně vyjádřená granulomatóza s polyangiitidou (GPA) postihuje horní dýchací cesty, dolní dýchací cesty a ledviny. V klinické praxi jsou navíc časté limitované formy GPA (8). Diagnostika AAV je velmi obtížná a zároveň je její časné stanovení klíčem k úspěšné terapii. Diagnostická kritéria neexistují. Nemoc lze diagnostikovat na podkladě klasického klinického obrazu a průkazu zánětlivého procesu při histopatologickém vyšetření postižených orgánů (dýchací cesty, ledviny, kůže). V roce 1990 ACR navrhlo klasifikační kritéria GPA, která byla postavena na původním popisu nemoci dle Godmana a Churga z roku 1954 (9). Potvrzení diagnózy si vyžádá splnění dvou z těchto čtyř kritérií:
zánětlivé změny v ústní nebo nosní dutině (ústní ulcerace nebo epistaxe)
přítomnost nodozit, infiltrátů čí kavernózních změn v oblasti plicních polí
mikrohematurie nebo erytrocytární válce v močovém sedimentu
granulomatózní změny v bioptickém vzorku (10)
Nelze ale zapomenout, že se jedná o kritéria klasifikační, nikoliv diagnostická. V roce 2017 bylo vyvinuto další úsilí o tvorbu kritérii, které byly vstupně prezentované v průběhu konference EULAR 2018, ale dosud nebyly ještě plně validované (11). Popsaný nemocný kritéria z roku 1990 úvodně splnil (ulcerace v dutině ústní a mikrohematurie), ale k potvrzení diagnózy bylo nutné získat histopatologický průkaz vaskulitidy. Renální biopsie je zlatým standardem v diagnostice AAV vaskulitid s postižením ledvin (12). Její úloha je obzvlášť důležitá v případech, kde není kompletně vyjádřen charakteristický pulmorenální syndrom, právě jako tomu bylo u popsaného pacienta. Nepřítomnost typických změn v bioptickém vzorku ledviny nesvědčila pro diagnózu GPA či jiné vaskulitidy. Přesto byla zahájena intenzivní imunosupresivní terapie, což se s odstupem času ukázalo být správnou volbou s ohledem na velmi agresivní průběh onemocnění. Přímé informace o úplně negativním výsledku biopsie ledviny při aktivní ANCA asociované glomerulonefritidě nejsou v literatuře dostupné. Po odečtení pozitivních biopsií od celkového počtu provedených získáváme informaci o tom, že negativní nález při biopsii ledvin není častý (cca 1–2 % případů) a týká se hlavně pacientů v počáteční fázi onemocnění nebo případů, kdy byla získána tkáň s malým množstvím glomerulů (13). U popsaného pacienta byla biopsie provedená v krátkém intervalu od vzniku prvních projevů nemoci a byla získána jen periferní část ledviny s malým množstvím glomerulů (marginální vzorek – 2 mm 2 až 3 glomeruly), což bylo nejspíše důvodem nevýtěžnosti vyšetření. Za reprezentativní se v případě renální biopsie považuje vzorek s alespoň 10 glomeruly.
Dle literatury je rebiopsie, vzhledem k její zátěži pro pacienta, nejčastěji prováděna pro známky akutní vaskulitidy (suspektní relaps onemocnění) nebo pro rychlý pokles renálních funkcí (13). V popsaném případu nastaly obě situace a pomocí rebiopsie byla zjištěna aktivní glomerulonefritida, což vedlo k eskalaci terapeutického postupu s dobrým efektem.
ZÁVĚR
ANCA asociované vaskulitidy je skupina potenciálně letálních, multiorgánových, autoimunitních zánětlivých onemocnění s velmi pestrým klinickým obrazem a typickou přítomností protilátek proti cytoplazmě neutrofilů (ANCA) v séru. Obtížnost diagnostiky těchto nemocí odpovídá lokalizaci a rozsahu zánětlivých změn. Biopsie ledvin má významnou úlohu v diagnostickém procesu AAV, ale její negativní výsledek při podezření podloženým typickým klinickým obrazem, by neměl být důvodem pro odklad zahájení agresivní imunosupresivní terapie. Tato kazuistika jasně ukazuje, že i přes úvodní negativní výsledek biopsie došlo u pacienta k vývoji závažné glomerulonefritidy nereagující na terapii cyklofosfamidem a vyžadující podání rituximabu k dosažení remise. Trvá-li klinické a laboratorní podezření na aktivní a závažnou formu onemocnění, není vhodné léčbu odkládat ani v případě negativní biopsie dominantně postiženého orgánu; zde je vždy nutné mít na paměti, že biopsie nám dává obraz jen o ložiskových změnách postiženého orgánu v místě biopsie (na jiném místě mohou být změny velmi aktivní) a její výtěžnost vždy závisí na reprezentativnosti odebraného vzorku.
Poděkování patří lékařům z Kliniky nefrologie 1. LF UK a VFN za spolupráci na diagnostice a úspěšné terapii popsaného nemocného.
Konflikt zájmů: žádný.
adresa pro korespondenci:
MUDr. Magdalena Agnieszka
Sokalska-Jurkiewicz, Ph.D.
Revmatologický ústav a Klinika revmatologie 1. LF UK
Na Slupi 4, 128 50 Praha 2
e-mail: sokalska@revma.cz
Sources
1. Tsalouchos A, Salvadori M. Epidemiology and pathogenesis of ANCA-associated vasculitis. In: Zahoorullah S. Reviews in Imunology. In-Press SM Group Open Access eBooks 2018; 1–24.
2. Nakazawa D, Masuda S, Tomaru U, Ishizu A. Pathogenesis and therapeutic interventions for ANCA-associated vasculitis. Nat Rev Rheumatol 2019; 15 : 91–101.
3. Jennette JC, Falk RJ. Small-vessel vasculitis. N Engl J Med 1977; 337 : 1512–1523.
4. Zakyianov O, Vachek J, Tesař V. Rychle progredující glomerulonefritidy (srpkovité glomerulonefritidy). Kardiol Rev Int Med 2014; 16(1): 62–66.
5. Hoffman GS, Kerr GS, Leavitt RY, Hallahan CW, Lebovics RS, Travis WD, et al. Wegener granulomatosis: an analysis of 158 patients. Ann Intern Med 1992; 116(6): 488–498.
6. Rowaiye OO, Kusztal M, Klinger M. The kidneys and ANCA-associated vasculitis: from pathogenesis to diagnosis. Clin Kidney J 2015; 8(3): 343–350.
7. Jayne DRW, Bruchfeld AN, Harper L, Schaier M, Venning MC, Hamilton P, et al. Randomized Trial of C5a Receptor Inhibitor Avacopan in ANCA-Associated Vasculitis. JASN 2017; 28 (9): 2756–2767.
8. Kubaisi B, Samra KA, Foster CS. Granulomatosis with polyangiitis (Wegener’s disease): An updated review of ocular disease manifestations. Intractable Rare Dis Res 2016; 5(2): 61–69.
9. Godman CC, Churg J. Wegener’s granulomatosis: Pathology and review of the literature. AMA Arch Pathol 1954; 58 : 533–553.
10. Leavitt RY, Fauci AS, Bloch DA, Michel BA, Hunder GG, et al. The American College of Rheumatology 1990 criteria for the classification of Wegener‘s granulomatosis. Arthritis Rheum 1990; 33 : 1101–1107.
11. Robson J, Grayson P, Ponte C, Suppiah R, Craven A, Khalid S, et al. OP0021 Draft classification criteria for the anca associated vasculitides. Ann Rheum Dis 2018; 77 : 60–61.
12. Berden AE, Ferrario F, Christiaan Hagen E, Jayne DR, Jennette JC, Joh K, et al. Histopathologic Classification of ANCA-Associated Glomerulonephritis. JASN 2010; 21 : 1628–1636.
13. Aasarød K, Bostad L, Hammerstrøm J, Jørstad S, Iversen BM. Renal histopathology and clinical course in 94 patients with Wegener’s granulomatosis. Nephrology Dialysis Transplantation 2001; 16(5): 953–960.
Labels
Dermatology & STDs Paediatric rheumatology RheumatologyArticle was published in
Czech Rheumatology

2020 Issue 4
-
All articles in this issue
-
Něco staré končí,
něco nové začíná…. - The opinion of the Czech Society of Rheumatology on the treatment of rheumatic diseases and vaccination in the context of SARS-CoV-2 infection
- Clinical experience in the long-term treatment of axial spondyloarthritis with secukinumab
- Validation of Czech versions of questionnaires assessing functional impairment in patients with systemic sclerosis: Scleroderma Health Assessment Questionnaire (SHAQ), Cochin Hand Functional Scale (CHFS), Mouth Handicap in Systemic Sclerosis (MHISS), UCLA Scleroderma Clinical Trial Consortium Gastrointestinal Tract 2.0 (UCLA SCTC GIT 2.0)
-
Low-dose computed tomography with tin filtration for the diagnosis of sacroiliitis –
our first experience - Cardiotoxicity of cyclophosphamide in the treatment of microscopic polyangiitis – case report
- L. Pitfalls of diagnosis of ANCA-associated vasculitis – case report
-
Něco staré končí,
- Czech Rheumatology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- L. Pitfalls of diagnosis of ANCA-associated vasculitis – case report
- Validation of Czech versions of questionnaires assessing functional impairment in patients with systemic sclerosis: Scleroderma Health Assessment Questionnaire (SHAQ), Cochin Hand Functional Scale (CHFS), Mouth Handicap in Systemic Sclerosis (MHISS), UCLA Scleroderma Clinical Trial Consortium Gastrointestinal Tract 2.0 (UCLA SCTC GIT 2.0)
- The opinion of the Czech Society of Rheumatology on the treatment of rheumatic diseases and vaccination in the context of SARS-CoV-2 infection
- Clinical experience in the long-term treatment of axial spondyloarthritis with secukinumab
