HIV infekce – historie, patogeneze, klinické manifestace
HIV infection – History, Pathogenesis and Clinical Manifestations
In spite of principal efforts of physicians and researchers HIV infection remains a worldwide problem for 30 years since first cases discovery. It presents a versatile difficult problem – pathogenesis, therapy incl. possible vaccination procedures. Untreated HIV infection is a multisystemic and progressive disease resulting in almost all cases in death of patient due to immune system failure. The disease(s) principle, i.e. infection attacking immune system and leading to its gradual elimination is critical for all therapeutic efforts particularly by the fact that one can only restrictively rely on organism natural immune mechanisms at time of positive response to therapy. The current progress in therapeutic approaches changes disease features in developed countries at the same time – the rate of treated patients with “classical” course of disease as described in this article is decreased and rare manifestations presented previously in a limited way due to short survival rates of infected patients could be manifested more frequently in the contrary. This article reviews basic data and facts on HIV infection pathogenesis as presents an overview of systemic symptoms associated with AIDS with impact on skin involvement and course of other skin disorders. However this review describes only the most important specifications to understand such topic which is very extensive in every aspect. To understand further details readers are referred to other specialized literature related to HIV-AIDS.
Key words:
HIV infection – pathogenesis – clinical manifestations
:
M. Salavec 1; V. Boštíková 2
; P. Boštík 3,4
:
Katedra dermatovenerologie, LF UK Hradec Králové, Klinika nemocí kožních a pohlavních, FN Hradec Králové, přednosta doc. MUDr. Karel Ettler, CSc.
1; Katedra epidemiologie, Fakulta vojenského zdravotnictví, Univerzity obrany, Hradec Králové, vedoucí doc. MUDr. Roman Chlíbek, Ph. D.
2; Centrum pokročilých studií, Fakulta vojenského zdravotnictví Univerzity obrany, Hradec Králové, náčelník doc. MUDr. Pavel Boštík, Ph. D.
3; Klinika infekčních nemocí, LF UK a FN Hradec Králové, přednosta MUDr. Stanislav Plíšek, Ph. D.
4
:
Čes-slov Derm, 86, 2011, No. 2, p. 67-81
:
Reviews (Continuing Medical Education)
Infekce virem HIV zůstává i přes zásadní úsilí zdravotníků a výzkumných pracovníků téměř po 30 letech od objevení prvních případů problémem, který se ukazuje být obtížným ze všech možných stran – tj. patogeneze, terapie a možné vakcinace. Neléčená HIV infekce je onemocnění progresivní a multisystémové, které téměř ve všech případech vede k smrti pacienta v důsledku selhání imunitního systému. Podstata onemocnění, tj. infekce napadající imunitní systém a vedoucí k jeho postupnému vyřazení, je kritická pro veškeré terapeutické snahy zejména tím, že se lze pouze ve velmi omezené míře spolehnout na vlastní imunitní mechanismy organismu ve chvíli, kdy dochází k pozitivní reakci na terapii. Současně s tím ale rozvoj terapeutických možností v současné době mění obraz onemocnění v rozvinutých zemích, kdy se snižuje podíl léčených nemocných s „klasickým” průběhem onemocnění tak, jak je popsán zde, ale naopak se mohou začít vyskytovat některá vzácnější postižení, která se dříve vyskytovala omezeně díky kratšímu dožití infikovaných pacientů. Tento přehled shrnuje základní fakta z oblasti patogeneze HIV infekce a obsahuje stručný přehled systémových postižení spojených s AIDS, kde větší pozornost je věnována hlavně dermatologickým postižením. Nicméně souhrn vybírá pouze nejdůležitější údaje pro pochopení dané problematiky, která je v každém svém aspektu velmi široká, a k pochopení dalších detailů jsou čtenáři odkázáni na specializovanou odbornou literaturu věnující se AIDS.
Klíčová slova:
HIV infekce – patogeneze – klinické projevy
HISTORIE A EPIDEMIOLOGIE HIV
První informace, které signalizovaly nástup do té doby neznámého onemocnění se objevily na počátku 80. let minulého století. První krátká zpráva v MMWR popisovala náhlý nárůst incidence pneumonie způsobené Pneumocystis jiroveci (tehdy P. carini) mezi homosexuálními muži na západním pobřeží USA [62]. Následovaly další zprávy popisující obdobné pneumonie, další oportunní infekce a Kaposiho sarkom na východním pobřeží USA a u dalších skupin obyvatel [38, 56, 77]. Článek v časopisu Science dva roky poté [4] první identifikoval jako možného původce těchto stavů nový virus ze skupiny retrovirů, který byl posléze nazván Human Immunodeficiency Virus-1 (HIV-1) [14] a později zařazen spolu s HIV-2, Simian Immunodeficiency Virus (SIV) u primátů a imunodeficit vyvolávajícími viry některých dalších zvířat do samostatné podskupiny lentivirů. HIV-1 je RNA virus obsahující 2 kopie jednořetězcové RNA dlouhé 9 kilobazí a obsahující 9 genů kódujících 15 různých proteinů [25, 53]. V současné době jsou rozeznávány tři hlavní skupiny HIV-1: M (main), N (new) a O (outlier). Viry ze skupiny M jsou zodpovědné za více než 95 % infekcí celosvětově a dále se dělí na 9 podskupin, tzv. „clades”, značené A až K [35]. Při dalším zkoumání původu virů HIV se ukázalo, že oba viry – HIV-1 i HIV-2 – byly vneseny do lidské populace mezidruhovým přenosem z opic. Tedy HIV-2 se vyvinul přenosem SIV z opic mangabejů (Cercocebus torquatus atys) a HIV-1 přenosem šimpanzího SIV (Pan troglodytes) v subsaharské Africe [31, 71]0. Je zajímavé, že u těchto a mnoha dalších „přirozených” opičích hostitelů SIV infekce probíhá asymptomaticky a k úmrtí zvířat nedochází, přestože u některých, jako jsou třeba právě mangabejové, dochází k masivní kontinuální replikaci viru [8, 73]. Důvodem, proč se SIV nazývá virem opičí imunodeficience, je potom fakt, že když je tento virus přenesen na vnímavého hostitele, jako je např. makak (Macaca mulatta), způsobí onemocnění velmi podobné lidskému AIDS, jen s rychlejším průběhem [44].
Diverzita HIV-1 je dána tím, že každá z jednotlivých virových skupin vznikla samostatným přenosem opice-člověk [40]. Během dalšího výzkumu směřujícího k co nejpřesnějšímu datování mezidruhového přenosu byl objeven izolát z roku 1959 od pacienta z oblasti Leopoldville v Konžské demokratické republice jasně ukazující, že infekce HIV-1 kolovala v lidské populaci již před tímto rokem [84]. Poměrně nedávná studie dalšího izolátu HIV-1 ze vzorku z roku 1960 z této oblasti ovšem ukázala na základě precizní fylogenetické analýzy, že diverzita mezi izoláty z roku 1959 a 1960 je tak velká, že první společný předchůdce virů skupiny M se dostal do lidské populace dávno předtím, pravděpodobně mezi lety 1902–1921, ale ne později než v roce 1933 [82].
Poslední zpráva UNAIDS udává, že ke konci roku 2009 bylo celosvětově 33,3 miliónů lidí infikovaných HIV, z toho 2,6 miliónu byly nové infekce za rok 2009, a 1,8 miliónu infikovaných v tomto roce na AIDS zemřelo [76]. V ČR poslední údaje z Národní referenční laboratoře SZÚ uvádějí k říjnu 2010 celkem 1825 HIV pozitivních, z toho 351 v symptomatické fázi AIDS [74].
Tato data ukazují, že virus, který se původně dostal do lidské populace několika jednotlivými mezidruhovými přenosy, dokázal za 80–90 let způsobit pandemii zásadního významu s tím, že k podstatnému rozšíření a identifikaci došlo až v posledních 30 letech.
PATOGENEZE
Prvními identifikovanými postiženými, jak bylo zmíněno výše, byli homosexuálové, u nichž docházelo k přenosu sexuálními praktikami, a jednou z dalších skupin hemofilici, kde byly na vině HIV pozitivní krevní deriváty [61]. Tyto případy ilustrují způsob přenosu viru, který se dostává do organismu buď v krvi a jejích derivátech, nebo dalšími sekrety (např. sperma, vaginální sekrety). Vstup do organismu je zejména „přímým” přístupem do cirkulace (intravenózní injekce u uživatelů drog, kožní a slizniční defekty a expozice krvi při sexuálním styku atd.) a infekce cílových buněk (makrofágy, CD4 T lymfocyty), nebo pomocí buněk imunitního systému, které jsou schopné virus na sliznicích vázat a transportovat jej dále. V tomto směru je možné uvést například slizniční dendritické buňky, které na membráně exprimují C-lecitin DC-SIGN, který je schopný vázat HIV viriony a transportovat jej přes slizniční povrch [27]. Zatímco v úvodu pandemie byl homosexuální styk hlavní cestou přenosu, v současné době je v rozvinutých zemích zodpovědný za méně než 50 % nových infekcí a v oblastech s vysokou prevalence HIV je heterosexuální přenos zodpovědný za více než 70 % případů sexuálně přeneseného HIV [26].
Tyto rozdílné mechanismy přenosu ale nakonec vedou k transportu viru do lymfatických uzlin, kde dochází k následné masivní infekci dalších makrofágů a CD4 T lymfocytů. Dalšího rozvoj HIV-1 infekce je charakterizován masivní replikací viru v buňkách imunitního systému, zejména v CD4+ T lymfocytech, a jejich následná eliminace v důsledku imunitní reakce odstraněním imunitními efektory, v důsledku apoptózy, nebo i dalšími mechanismy. Jako efektory se uplatňují především antigen specifické CD8+ cytotoxické T lymfocyty (CTL).
Ukázalo se, že virus potřebuje k fúzi s buňkou nejen CD4 receptor, ale i koreceptor z rodiny G-protein-coupled-receptors, z nichž první byly objeveny CCR5 a CXCR4 [17, 55]. Tyto receptory jsou přirozenými receptory pro chemokiny, jako MIP-a a RANTES, a tyto chemokiny nebo jejich deriváty mohou blokovat vazbu virů imunodeficience na buňky [9]. Tyto dva koreceptory určují také takzvaný „tropismus“ viru, tj. které buňky daný virový kmen přednostně infikuje. Ty kmeny HIV-1, které mají preferenci pro makrofágy, přednostně využívají CCR5, zatímco ty, které infikují přednostně T lymfocyty využívají CXCR4. Tento tropismus není samozřejmě absolutní, protože makrofágotropní kmeny využívající CCR5 infikují i T buňky, ale změna tropismu směrem k využití CXCR4, ke které často dochází při diverzifikaci viru masivní replikací v organismu, znamená špatnou prognózu, protože vede ke zvýšení cytopatického efektu a masivnímu úbytku CD4+ T buněk. Infekce virem HIV má několik zásadních specifik. Přestože bylo zjištěno, že alespoň u některých subtypů HIV-1 dochází u 80 % případů k přenosu viru jednoho genotypu [39], při masivní replikaci v organismu hostitele dojde a k široké diverzifikaci virové populace. K tomuto jevu dochází jednak spontánně díky náchylnosti virového enzymu reverzní transkriptázy k chybám v přepisu genomu, a jednak v důsledku selekčních tlaků imunitního systému a popřípadě i terapie [81].
Dalším specifikem infekce HIV je integrace virového genomu do genomu hostitelské buňky. Ve fázi latence buňky integrovanými provirovými sekvencemi existují v rezervoárech, které jsou těžce přístupné imunitnímu systému i antiretrovirové terapii [7].
Dalšími důležitými faktory HIV-1 infekce je modulace přímo determinant imunitního systému a funkcí buněčných efektorů. Sem by patřila například schopnost viru snižovat v infikované buňce expresi determinant hlavního histokompatibilního systému – HLA [42], modifikace virových proteinů snižující jejich dostupnost pro imunitní systém [83] a další.
Teprve studie z nedávné doby ale objevily dva zcela zásadní patogenetické mechanismy zodpovědné za tak masivní depleci CD4 lymfocytů a dysfunkci imunitního systému. Za prvé je to chronická hyperaktivace CD4+ T lymfocytů vedoucí jednak k jejich dysfunkci a apoptóze, a jednak ke zvýšení exprese CCR5 receptoru vedoucí ke zvýšení počtu permisivních cílových buněk pro infekci virem [52]. Dalším zásadním momentem je masivní eliminace T lymfocytů v lymfatických orgánech, a to zejména v lymfatickém systému střeva (GALT) [10]. Data z opičích modelů ukázala, že záhy po infekci v akutní fázi je až 20 % CD4+ T lymfocytů v GALT infikováno [80] a u dalších 60 % neinfikovaných CD4+ T lymfocytů v GALT dochází k hyperaktivaci vedoucí k apoptóze. To vše vede k časné destrukci těchto lymfatických struktur, která je zásadní pro další vývoj patologických změn imunitního sytému.
O úloze protilátek při imunitní reakci u HIV-1 infekce se stále ještě diskutuje. V iniciálních fázích infekce k indukci protilátek dochází, ty však nemívají neutralizační charakter. Dalším problémem je zvyšující se variabilita viru během infekce (viz výše) v oblastech antigenních epitopů, která nastává paradoxně i v důsledku tlaku imunitního systému a vede k obměně antigenních epitopů a tím snížení afinity původních protilátek pro nové epitopy. Teprve v pozdějších stadiích onemocnění se objevují protilátky neutralizační, které jsou většinou specifické pro danou virovou variantu. Povzbuzující výsledky z poslední doby nicméně dokumentují, že u některých jednotlivců může dojít v pozdějších stadiích infekce k indukci protilátek, které jsou schopné neutralizovat širokou škálu variant nejen v rámci jednoho „clade”, ale také v dalších podskupinách [2].
Je zajímavé, že alespoň u některých opičích přirozených hostitelů SIV k podobným zásadním efektům na imunitní systém nedochází, přestože se virus intenzivně replikuje a dosahuje hladin srovnatelných s hladinami HIV-1 u infikovaných osob [3, 8, 78]. Například mangabejové tyto vysoké hodnoty virémie dlouhodobě tolerují a dochází u nich pouze k velmi pozvolnému úbytku CD4+ T lymfocytů. K infekci GALT sice dochází, ale ta nevede k masivnímu úbytku lymfocytů a po akutní fázi se stav normalizuje. Studium těchto opičích modelů v porovnání s SIV infikovanými makaky, kteří onemocní AIDS, přinášelo a přináší důležité poznatky ohledně patogeneze, vakcinačních i dalších podpůrných postupů pro infekci HIV.
ONEMOCNĚNÍ AIDS – KLINICKÁ STADIA
Při déletrvající neléčené HIV infekci dochází k postupné destrukci imunitního systému a v důsledku toho k zvýšenému nebezpečí infekce dalšími patogeny, tzv. oportunním infekcím (OI). Název sám napovídá, že toto jsou infekce, ke kterým dochází v prostředí imunologické suprese. Postup HIV infekce je obvykle monitorován sledováním počtu CD4 lymfocytů. Pokles pod 500 CD4 lymfocytů/ul obvykle charakterizuje progresi onemocnění a určitou úroveň imunosuprese. Pokles pod 200/μl indikuje vážné nebezpečí OI a je sám o sobě (při HIV pozitivitě) definujícím kritériem AIDS. Je nutné si v tomto kontextu uvědomit rozdíl mezi HIV infekcí a AIDS. HIV infekce může probíhat různě dlouho, aniž by došlo k manifestaci klinických příznaků definujících AIDS. Neléčená HIV infekce je chronická a progresivní. Probíhá ve 3 stadiích – primární infekce, chronická latentní infekce a klinický AIDS. Po přenosu viru do organismu nastává fáze akutní, primární infekce [51]. Ta je z jedné strany ohraničena momentem infekce a ze strany druhé momentem indukce detekovatelných protilátek. Většina pacientů v této fázi pociťuje symptomy různé intenzity, popisované jako „sérokonverzní nemoc” (viz dále). Typickými příznaky, které mohou trvat dny až týdny, jsou únava, lymfadenopatie, bolesti hlavy, vyrážka, bolesti kloubů, anorexie, nausea, zvracení, průjem a u některých pacientů i příznaky OI, jako slizniční kandidóza, zřejmě z přechodné imunosuprese [32]. Možné jsou i neurologické manifestace typu meningitidy, encefalitidy, periferních neuropatií a myelopatie. Po počáteční fázi „eklipsy”, kdy se virus replikuje lokálně a není detekovatelný v krvi, nastává fáze masivní replikace viru v lymfatických orgánech až do dosažení „peak virémie”. V důsledku toho dochází k rapidní depleci CD4 T lymfocytů, jejichž hodnoty se nicméně posléze vracejí směrem k normálu, i když předinfekčních hodnot často nedosáhnou. Současně s tím jsou postupně indukovány specifické protilátky a CTL, jejichž vzestup koinciduje se snižováním hladiny virémie na tzv. „set-point”, kdy infekce přechází do chronické fáze. Z diagnostického hlediska je nutné si uvědomit, že během eklipsy není infekce detekovatelná žádným dostupným způsobem. Následně je možné prokazovat virovou RNA, ale protilátky jsou stale negativní, a až ke konci akutní fáze je možné prokazovat protilátky standardními testy (obr. 1 a 2).


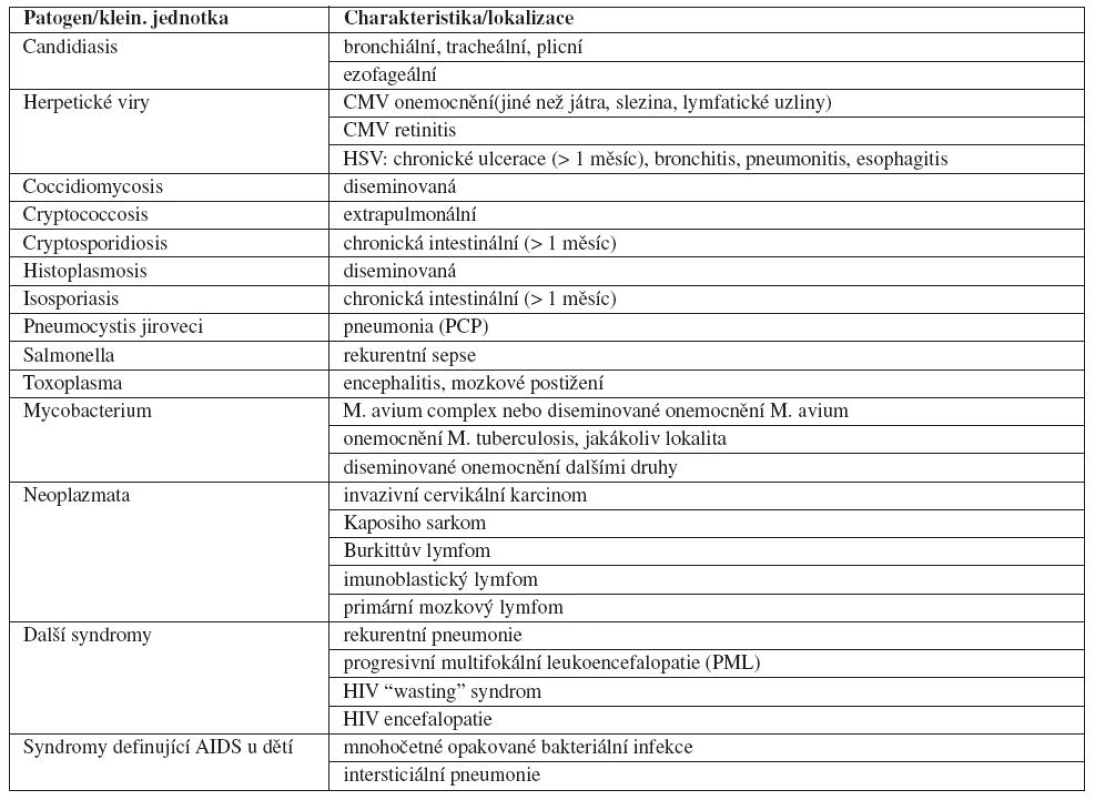
Zatímco fáze primární infekce je relativně přesně ohraničena, následující fáze latence má individuální průběh v řádu jednotek až desítek let, kde medián se pohybuje zhruba okolo 10 let. Na začátku tohoto období dochází k jakési rovnováze mezi virovou replikací a imunitním systémem, která je posléze pomalu či rychleji narušována. To se projevuje pozvolným poklesem hodnot CD4 lymfocytů a pozvolným vzestupem virové replikace. Ve chvíli, kdy dojde k takové poruše imunitního systému, že se začnou projevovat příznaky typické pro AIDS jak byly definovány CDC [1], začíná fáze onemocnění AIDS (tab. 1). AIDS je definováno jako HIV pozitivita a přítomnost alespoň jednoho dalšího onemocnění určujícího AIDS a nebo, jak bylo zmíněno výše, HIV pozitivita a počet CD4 buněk pod 200/μl (nebo méně než 14 % lymfocytů) jsou samy o sobě definujícími kritérii pro AIDS i v nepřítomnosti jakýchkoliv dalších symptomů. Další klinické rozdělení AIDS na stadia, založené na sledování klinických příznaků při absenci laboratorních vyšetření vyvinuté WHO, ukazuje tabulka 2 [64].
![Kategorizace stadií HIV infekce podle klinických příznaků (podle [1])](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/48baae076cd32f360d889d07f8787006.jpg)
TERAPIE HIV INFEKCE/AIDS
Cílem antiretrovirové terapie je dosažení co nejefektnější virologické a imunologické odpovědi. Virologická odpověď znamená, že dojde k inhibici replikace viru a v důsledku toho ke snížení hladiny viru v krvi, virové nálože. Imunologická odpověď pak spočívá v tom, že dojde ke zlepšení funkcí imunitního systému, nárůstu počtu CD4 T lymfocytů atd. Obě tyto odpovědi většinou jdou ruku v ruce, nicméně existují i případy, kdy např. snížení replikace viru nevede k očekávanému zlepšení imunitních ukazatelů.
Specifická antiretrovirová terapie se zaměřuje na inhibici jednotlivých fází replikačního cyklu viru. Zasahuje buď do klíčových enzymů HIV (reverzní transkriptáza, proteinázy, integrita), nebo brání vstupu viru do buňky (inhibitory vstupu, inhibitory fúze).
- Inhibitor vstupu (blokátor koreceptorů) – maraviroc (Celsentri)
- Inhibitor fúze – enfuvirtid (Fuzeon)
- Inhibice enzymu reverzní transkriptázy (RT) – ta
zajišťuje přepis virové RNA do DNA a jeden
z prvních kroků nutných jednak pro replikaci viru, jednak pro
integraci viru do genomu hostitele. Tyto inhibitory jsou:
- a) nukleosidové (NRTI)/nukleotidové (NtRTI) – kompetují s normálními nukleotidy a zastavují jejich inkorporaci do vznikající DNA. např. zidovudine (Retrovir, AZT), tenofovir (Viread), emtricitabine (Emtriva) aj.;
- b) nenukleosidové (NNRTI) – inhibují RT vazbou na jiné než nukleotid-vazebné místo, např. efavirenz (Stocrin) aj.;
- Inhibitor integrázy – enzym zajišťující integraci provirové DNA do hostitelské DNA, raltegravir (Isentress)
- Inhibitory proteázy – enzymy, které umožňují závěrečnou kompletaci a maturaci nového viriounu, např. atazanavir (Reytaz), lopinavir (Kaletra), nelfinavir (Viracept) aj.
V jednotlivých kategoriích existuje v současné době více antivirotik, která je možné použít. Základem současné terapie však je využití kombinací preparátů z různých skupin, což jednak vede k inhibici virového cyklu na více místech, ale zejména tento postup zabraňuje vzniku a selekci virových mutant rezistentních na jednotlivá antivirotika. Tato kombinační terapie se nazývala Highly-Active-Anti-Retroviral-Therapy (HAART), nověji pak cART (combination-AntiRetroviral-Therapy). Některé preparáty jsou již vyráběny ve smíšené formě v jedné tabletě (např. Atripla – tenofovir + emtricitabine + efavirenz), což umožňuje jednodušší dávkování a zvyšuje pravděpodobnost „adherence“ k léčbě, zvláště u problémovějších pacientů. Dávkování a problematika zahajovaní či přerušení terapie jsou záležitostí v rozsahu odborných monografií. Podobně je tomu v případě doporučených terapií pro možné oportunní infekce či další syndromy charakteristické pro AIDS. V souvislosti s terapií je však dobré zmínit, že někteří pacienti, zejména ti s velmi nízkými počty CD4 lymfocytů a těch s mykobakteriální infekcí (méně než 50/ul), mohou po zahájení terapie vyvinout příznaky syndromu „zánětlivé imunitní rekonstituce“ (Immune-Reconstitution-Inflammatory-Syndrome, IRIS). Mechanismem tohoto syndromu je nejspíše reakce podobná hypersenzitivitě IV. typu vyvíjející se po náhlém odstranění imunosupresivního účinku vysokých hladin viru. Symptomy mohou zahrnovat lymfadenitidu, uveitidu, plicní infiltráty, Gravesovu chorobu, zvýšení nitrolebního tlaku a další a mohou být velmi těžké až smrtelné. Těžké případy IRIS tak paradoxně vyžadují dočasnou imunosupresivní léčbu, např. glukokortikoidy. Poslední modalita, na kterou by se nemělo při ošetřování HIV pozitivního nemocného zapomínat, je prevence v podobě vakcinace v době, kdy je imunitní odpověď ještě dostačující, a to zejména proti hepatitidám A a B, chřipce a pneumokokům.
KLINICKÉ MANIFESTACE HIV/AIDS SE ZAMĚŘENÍM NA DERMATOLOGICKOU PROBLEMATIKU
Infekce působené retroviry vedou u lidí podle svého rozdílného typu (HTLV – human T-cell leukaemia virus a HIV – human immunodefficiency virus) k chorobným stavům, které se z hlediska kožních projevů od sebe značně liší.
Diagnóza kožních onemocnění či nedostatečná a pomalá odpověď na standardní terapii u řady dermatologických jednotek mohou vést k samotné diagnóze HIV infekce v časných stadiích. Některé kožní změny jsou jedinečné a až patognomonické pro HIV infekci, jako např. Kaposiho sarkom. S progresí klinického průběhu infekce HIV se objevuje stále více klíčových kožních změn, které mohou upozornit na přítomnost HIV infekce.
Kožní onemocnění se vyskytují u více než 90 % HIV pozitivních pacientů. Kožní příznaky mohou mnohdy být i prvním projevem HIV infekce.
Po expozici viru se zpravidla za 2–4 týdny u 50–90 % infikovaných jedinců může objevit soubor příznaků, který je označován jako „Akutní retrovirový syndrom“ (ARS). Nejčastěji se manifestuje jako „mononucleosis-like syndrom“ či flu-like syndrom“. Objevuje se horečka, zvětšení žláznatých struktur, cefalea, bolesti kloubů a svalů a dokonce nausea a zvracení. Tyto změny jsou provázeny výsevem rubeoli - a morbiliformních kožních změn (až u 50 % jedinců) v lokalizaci na horní části trupu, na horních končetinách, ve dlaních a na ploskách [49]. Někdy změny kožní připomínají i pityriasis rosea Gibert (s límcovitým šupením). Subjektivně výsevy nesvědí. Změny mohou být přítomny i na orální sliznici. Povrchové eroze na sliznicích se mohou manifestovat obtížemi typu dysfagie či retrosternálně lokalizované bolesti [65]. V tomto období dochází k mohutné replikaci viru, lze prokázat antigen p24 a vysokou hladinu HIV RNA. Posléze se objevují protilátky anti-HIV. Výše uvedené změny nemůžeme považovat za HIV specifické, v diferenciální diagnostice přichází v úvahu celá řada virových kožních exantémů. Obecně lze říci, že neinfekční kožní změny nevykazují výpovědní hodnotu z hlediska progrese či stupně imunosuprese u HIV infekce, mohou ale působit jako specifické markery stadia HIV onemocnění. Výskyt eozinofilní folikulitidy je téměř vždy vázán na pokles CD4+ lymfocytů pod 200/ml.
Kožní nálezy jsou převážně působeny nedostatečností v obranných mechanismech poškozeného imunitního systému. Dělíme je na:
- a) neoplastické,
- b) infekční,
- c) neinfekční změny.
ad a) Kaposiho sarkom (KS) je multifokální systémové onemocnění projevující se maligními vaskulárními nádory. Náhle zvýšení výskytu KS v 80. letech minulého století bylo jedním z prvních signálů nového onemocnění AIDS. Rozlišují se 4 klinické varianty KS [79]:
- Klasický (idiopatický) – u osob z východní Evropy a Středomoří, s častějším výskytem u mužů a věkem nad 50 let (viz např. kazuistika autorů Procházkové et al. z roku 2008, [63]), s klinickými projevy převážně na dolních končetinách.
- Endemický (africký) – u obyvatel centrální Afriky, u mladších dospělých jedinců.
- Iatrogenní KS – postihující imunosuprimované osoby (transplantační výkony).
- KS sdružený s HIV infekcí – s výskytem především u homosexuálních mužů.
Nejčastějším typem v současnosti je KS sdružený s HIV infekcí u mužů s homosexuální orientací. Od zavedení kombinované antiretrovirové terapie výskyt KS poklesl o více než 90 %. Za původce všech forem KS je považován lidský herpetický virus 8 (HHV8). Klinicky se KS projevuje tvorbou červených makul různé intenzity v liniích štěpitelnosti kůže, později s infiltrativním růstem za vzniku papulí, které progredují do tmavě fialových uzlíků nebo plošných lézí [79]. Umístěny jsou nejčastěji symetricky bilaterálně na dolních končetinách, kde způsobují otoky, ale mohou se vyskytovat kdekoliv na kůži těla včetně obličeje. Počty i velikosti lézí jsou velmi variabilní. Podle míry agresivního chování se KS rozlišuje na lokalizovaný, lokálně agresivní (nedestruktivní) a generalizovaný lymfadenopatický KS [79].
KS sdružený s HIV infekcí se nejprve manifestuje výsevem mnohočetných nodulů na horní polovině těla, hlavě a na krku s tendencí postupné diseminace na kůži i na sliznicích [79].
Kaposiho sarkom může postihnout i sliznice a vnitřní orgány (plíce, gastrointestinální systém). Izolované postižení vnitřních orgánů bez postižení kůže je vzácné [79]. Viscerální projevy jsou udávány u 72 % nemocných s pokročilou formou HIV infekce, zejména je pak postižen gastrointestinální systém a lymfatické uzliny nebo plíce. S HIV asociovaný KS má špatnou prognózu – dochází ke generalizaci projevů a vývoji oportunních infekcí, které jsou příčinou úmrtí postižených [43]. Klíčové pro diagnózu KS je histologické vyšetření. Ačkoliv jde o léze vaskulární povahy, nedochází k excesivnímu krvácení při odběru vyšetřovaného vzorku při dodržení určitých pravidel: neodebíráme léze lokalizované ve spodních partiích dolních končetin, anestezie je zajištěna aplikací xylokainu s epinefrinem 1 : 100 000 nejméně 5 minut před biopsií, biopsie je provedena až do subkutánní tukové tkáně a doporučuje se provedení sutury [49]. Snahy o odstranění kožních lézí KS zahrnují lokální radioterapii, kryodestrukci nebo intralezionální aplikaci cytostatik (vinblastin) a interferonu α. V éře zavedení HAART terapie (od léta 1996) došlo k dramatickému poklesu incidence a prevalence KS (stejně jako některých dalších infekčních i neinfekčních jednotek, např. molluscum contagiosum, herpes simplex a herpes zoster i seborrhoická dermatitida). Přítomnost KS by měla být považována za možný projev HIV infekce a vést k indikaci sérologických vyšetření HIV protilátek, v českých podmínkách pak zejména u homosexuálních mužů [79]. Diferenciálně diagnosticky přichází v úvahu řada kožních jednotek od hemangiomů, granuloma annulare, pyogenní granulomy až po projevy bacilární angiomatózy, angiosarkomů či kožní lymfomů.
Nápadně častý je výskyt B a T lymfomů, z nichž obě formy mohou být provázeny i kožními projevy. Z ostatních kožních malignit jeví zvýšenou frekvenci výskyt bazaliomů a spinocelulárních karcinomů. Průběh melanomu u nemocných s AIDS má výrazně horší prognózu než u imunokompetentních jedinců v běžné populaci.
ad b) Imunodeficientní stav predisponuje nemocné jedince ke kožním infekcím, jež jsou vyvolávány jak viry, tak bakteriemi nebo patogenními houbami včetně kvasinek. I když samotný infekční projev na kůži je morfologicky shodný s projevem dané infekce na kůži imunokompetentních jedinců, u osob HIV pozitivních je vždy rozsah postižení a možnost recidiv závažnější.
Z virových infekcí dominuje výskyt rekurentních HSV (herpes simplex virus) infekcí a generalizovaných VZV (varicella – zoster virus) projevů. V některých případech se může projevit rezistence HSV či VZV infekcí na terapii acyklovirem. Chronická perzistující HSV infekce je infekcí stanovující diagnózu AIDS podle definičního indexu CDC (Center for Disease Control) v Atlantě, USA [49]. V období, kdy je imunitní systém jedince ještě relativně intaktní, jsou projevy HSV infekcí podobné projevům u osob bez HIV infekce. Z klinického hlediska by měly být všechny ulcerativní změny, zejména v krajině perianální, ale i ulcerace neodpovídající na terapii kdekoliv na trupu považovány za projev HSV infekce. U závažně imunosuprimovaných jedinců dochází k tvorbě rozsáhlých, krustami povleklých erozí (2–10 cm v průměru). V perianální a periorální lokalizaci bývají léze bolestivé. HSV infekce jsou manifestovány i v oblasti periunguální (HSV-2). Tzanckův stěr z okraje léze barvený Giemsou či metylénovou modří a s průkazem mnohojaderných obřích epiteliálních buněk je diagnosticky průkazný. Lze užít i kultivační a fluorescenční techniky. V terapii je indikován orální acyklovir. U imunosuprimovaných jedinců s chronickými lézemi je doporučeno podávání v dávkách 200–400 mg 5krát denně do odhojení, s následnou chronickou supresivní terapií 400 mg 2krát denně k prevenci recidiv. Alternativně lze užít famcyklovir 250 mg 3krát denně nebo valacyklovir 100 mg 2krát denně. Ojediněle může HSV infekce indukovat vznik nekrotizující folikulitidy s papulózními projevy (0,2–1,0 cm) a pevně lpící centrální krustou. U případů s rezistencí k acyklovirové terapii (thymyidin-kináza negativní HSV-2) lze doporučit foscarnet [49].
VZV infekce jsou časté především v podmínkách středně těžkého imunodeficitu, ale mohou se vyskytnout i v časné fázi HIV infekce. Infekce je manifestována obvykle onemocněním typu herpes zoster. Tyto projevy se objevují asi 1 rok před vývojem sooru a vlasaté leukoplakie a jsou považovány za důležitý časný projev s podezřením HIV infekce u rizikových jedinců [49]. Výsevy VZV symptomů bývají zčásti hemoragické, nekrotické a subjektivně bolestivé. Puchýře a krusty přetrvávají obvykle 2 týdny, nekrotické léze (hojení jizvením) až 6 týdnů. U 20–25 % HIV pozitivních osob jsou uváděny recidivy VZV infekce [11, 16]. Diseminace nejsou příliš časté a chronické VZV diseminace jsou v klinickém obraze představovány rozsáhlými erytematózními ulceracemi nebo hyperkeratotickými verukózními lézemi [15]. VZV původci z verukózních lézí vykazují často rezistenci k terapii acyklovirem u nemocných s AIDS s předchozí chronickou či prolongovanou perorální léčbou acyklovirem [36, 45]. V terapii je indikován acyklovir podaný co nejdříve a způsob aplikace závisí na stavu imunity a rozsahu zosterové infekce (u lehčích klinických manifestací podávaný v dávce 800 mg 5krát denně po 5 dnů per os, jinak až 30 mg/kg, 3krát denně i. v., např. při signifikantní imunosupresi CD4 < 200/μl + plus přítomnosti dalších známek imunitní represe, např. přítomnost lymfomu, při diseminaci či spoluúčasti viscerálního systému, při postižení oční větve trojklanného nervu). Časná terapie brání rozvoji závažných nekrotických forem a mírní bolestivost. Nicméně se zdá, že terapie acyklovirem nesnižuje riziko postherpetické neuralgie [49], v současné době se ovšem tyto komplikace vyskytují ojediněle. V terapii nezapomínáme na lokální péči a podávání analgetik. U HIV pozitivních osob s absencí primární VZV infekce může dojít k výsevu varicelly. Tato varicella je podkladem celoživotní imunity, nicméně latentní virus může být příčinou pozdějšího vývoje herpes zoster. Klinicky jsou projevy varicelly závažnější než u HIV negativních jedinců, může dojít i k viscerálnímu postižení (HIV infikované děti) a byla zjištěny i fatální případy [59]. Předchozí VZV infekce i přítomnost anti-VZV protilátek neznamená ochranu před vznikem varicelly. I přes terapii acyklovirovými deriváty může dojít k recidivám či přetrvávání varicelly, což může souviset s obtížností v dosažení optimálních sérových hladin acykloviru při orální terapii [36]. Terapie varicelly je zajištěna perorálním podáním acykloviru (800 mg 5krát denně po dobu 10–14 dnů) u osob, které nevykazují obtíže, vykazují normální hrudní RTG a u kterých nejsou symptomy viscerálního postižení. U HIV pozitivních dětí a nekomplikované varicelly jsou doporučeny dávky 1000–3000 mg/m2 per os s pečlivým sledováním a eventuálním přechodem na parenterální aplikaci acykloviru. Orální terapie acyklovirem může totiž predisponovat pacienty k následným chronickým kožním infekcím VZV díky dosažení nižších sérových hladin acykloviru. Intravenózní aplikace je doporučována v dávkách 10 mg/kg/po 8 hodinách. Terapie má být ukončena až po úplném odhojení změn [36].
Infekce molluscum contagiosum se objevuje asi u 10–30 % HIV infikovaných jedinců [72]. V časné fázi jde o mírné projevy infekce s lokalizací na obličeji včetně víček, v anogenitální oblasti, ale i na trupu a na končetinách. Jednotlivé i mnohočetné papulky jsou velikosti špendlíkové hlavičky až hrášku, barvy kůže nebo zažloutlé, nebolestivé, často s typickou centrální vkleslinkou. Při signifikantní imunosupresi (CD4 < 200/μl) se objevuje tendence k proliferaci změn a dochází k diseminaci projevů, počty lézí převyšují hodnotu 100. Diseminovaná infekce je kožním markerem pokročilých HIV infekcí (CD4 < 50/ml) a projevy jsou lokalizovány dokonce i na slizniční části rtů a na spojivkách. Obrovská ložiska mohou být mylně považována za bazocelulární karcinom. Odstranění molusek či užití kryoterapie může zlepšit stav, úplné odhojení je však zřídkakdy možné.
Infekce lidskými papiloma viry (HPV) jsou svými projevy obdobné infekcím u non-imunkompromitovaných jedinců. Špičatá kondylomata jsou nejčastěji lokalizována v anogenitální oblasti. Diferenciálnědiagnostiky přichází v úvahu kondylomy syfilitické a spinaliom. Vzácně se u HIV pozitivních osob objevují extenzivní infekce HPV napodobující epidermodysplasia verruciformis. V terapii jsou doporučovány přístupy obdobné přístupům i HIV negativních osob s HPV infekcemi, výsledky nejsou nicméně uspokojivé a časté jsou i relapsy. Ve většině případů se nelze obejít bez chirurgické excize.Vzhledem k faktu, že s HPV infekcí jsou asociovány dysplazie a karcinomy děložního čípku a že anorektální krajina je též považována za „transformační zónu“, mohou se u homosexuálních mužů s análním stykem (tzv. bowenoidní papule s asociací high risk HPV 16 sérotypu) objevit cytologicky prokazatelné dysplastické změny [22, 57]. HPV byly izolovány z materiálu anorektálních karcinomů u homosexuálních mužů [24]. Terapie anorektálně lokalizovaných verukózních změn je velmi obtížná, užívá se podophyllin i kyselina trichloroctová po dobu nejméně 6 týdnů. Lze užít i metody chirurgické a kauterizaci. U žen jsou často prokazatelné dysplastické změny na děložním čípku, proto v rámci dispenzární péče je pravidelně prováděno kolposkopické vyšetření s cytodiagnostikou.
Pro HIV pozitivní jedince je unikátním projevem tzv. vlasatá leukoplakie lokalizovaná na laterální straně a špičce jazyka. Tyto bělavé plaky jsou projevem EBV (Epstein-Barrové virus) infekce. Mylně může být tato jednotka považována za soor neboli moučnivku, působenou kvasinkami.
Mezi bakteriální infekce ze skupiny Staphylococcus pyogenes aureus se řadí projevy impetiga (krytba puchýřů brzy praská, objevují se typické žlutavé krusty), folikulitidy (ochlupená část trupu, třísla, axily, vousatá část; projevy zejména na trupu často svědí), furunkulózy, karbunklů, až stavů označovaných jako celullitis a ekthyma (povrchové ulcerace s lpícími krustami a purulentní sekrecí). Staphylococcus aureus je nejčastější bakteriální infekcí u HIV pozitivních jedinců. Až 50 % jedinců jsou nosiči tohoto původce v nazofaryngeální oblasti. Průnik infekce do hloubky určuje způsob terapie stafylokových infekcí. U povrchových změn kožních volíme antistafylokoková antibiotika (dicloxacillin), hluboké bakteriální infekce vyžadují dlouhotrvající terapii. Doporučují se i kombinace antibiotik, zejména penicilináza-rezistentních penicilinů či cefalosporinů 1. generace s rifampicinem [49], indikovány jsou i antiseptické roztoky, lokálně aplikovaná antibiotika (klindamycin 1% – Dalacin T liq., erytromycin 2% – Eryfluid sol.).
Častá bakteriémie spojovaná s přítomností Bartonella henselae a Bartonella quintana může přejít do smrtící sepse (původně termín bacilární angiomatóza). Infekce Bartonellou byly původně považovány za primárně kožní postižení, nicméně časté je i postižení sleziny, lymfatických uzlin, jater, plic a CNS. Kožní léze jsou manifestovány změnami připomínajícími pyogenní granulomy – papule až noduly s tendencí ke krvácení. Prominující vaskulární změny tvořící papulózní eflorescence jsou často chybně diagnostikovány jako Kaposiho sarkom. Onemocnění má chronický charakter. Diagnózu lze potvrdit histologickým vyšetřením bioptického vzorku. Terapie spočívá v podání erytromycinu či doxycyklinu v plných antibiotických dávkách nejméně po dobu 8 týdnů [49].
U některých pacientů se manifestují chronické ulcerace a macerovaný kožní povrch. Tyto stavy mohou být navozeny infekcemi Pseudomonas aeruginosa.
Mykobakteriální infekce Mycobacterium avium-intracellulare a Mycobacterium tuberculosis, které se běžně vyskytují u HIV infikovaných jedinců velmi ojediněle indukují kožní léze. Mohou se objevit chronické sinusy nad postiženými lymfatickými uzlinami, chronické ulcerace nebo hemoragické makuly [58].
Mykotické afekce lze rozdělit na infekce typu soor, intertrigózní mykotické afekce (kvasinkové /Candida/ i dermatofytické afekce) a infekce nohou, nehtů a paronychia. Klinické obrazy odpovídají symptomům u HIV negativních jedinců.
Infekce vyvolané houbami postihují často nehtové ploténky v podobě onychomykotických změn na všech prstech nohou i rukou a jsou velice torpidní vůči jinak účinné antimykotické terapii. Téměř u všech HIV pozitivních jedinců nacházíme různé projevy oidiomycetické (kandidové) infekce. V případě postižení ústní sliznice je nebezpečí rychlého šíření na sliznice dýchacích cest a gastrointestinálního traktu.
Nejčastější mykotickou infekcí u HIV infikovaných osob bývá soor – moučnivka. Projevuje se ve formě tzv. angulární cheilitidy (fisury, macerace, erytém v koutcích ústních).
Postižení vyžaduje nasazení lokální, ale i systémové léčby ketokonazolem, flukonazolem, imidazolem nebo itrakonazolem. V lokální terapii se někdy využívají kombinované preparáty s kortikoidy, lokálně aplikované.
Celá řada systémových mykotických infekcí je spojována s HIV infekcí: kryptokokóza, histoplasmóza, sporotrichóza, aspergilóza, kokcidiomykóza, aktinomykóza aj. Signifikantní kožní projevy se objevují ale pouze u prvních čtyř jmenovaných jednotek. Kožní léze se u kryptokokózy objevují před postižením CNS nebo současně s ním. Lokalizovány jsou kdekoliv na kůži jako perlovité, průsvitné papulky, které připomínají moluska. Projevy jsou známkou diseminované infekce a jsou indikací k vyšetření CNS. Diseminovaná histoplasmóza (není problémem v Evropě, pozn. recenzenta) může být provázena výsevem růžových, mnohdy exulcerujících papul až hrbolů na trupu a na akrech končetin. Většina těchto infekcí představuje spíše reaktivaci předchozí histoplasmózy s diseminací. Kožní postižení se objevuje asi u 10 % HIV onemocnění s diseminovanou histoplasmózou [54]. Histologie prokazuje granulomatózní přeměnu. Původce je prokazatelný speciálním barvením (methenamin stříbra). Sporotrichóza je u HIV negativních jedinců manifestována jako onemocnění kůže a spádových drénujících uzlin. K diseminaci dochází zřídka. U HIV pozitivních osob může vést diseminovaná infekce sporotrichózou k vývoji asymptomatické plicní infekce s hematogenním rozsevem do kůže a kloubů. Diagnóza je potvrzena biopsií a kultivačním vyšetřením. Kožní aspergilóza se objevuje jako primární či sekundární infekce. Primární infekce je spojována s lokálním traumatem kožního povrchu (intravenózní katétry) při neutropenii. Kožní léze jsou přítomny v podobě erytematózní indurace s povrchově sedící pustulkou, hemoragickou ulcerací nebo změnami podobnými projevům molluscum contagiosum. Všechny tyto infekce vyžadují systémovou terapii amphotericinem B, itrakonazolem [49].
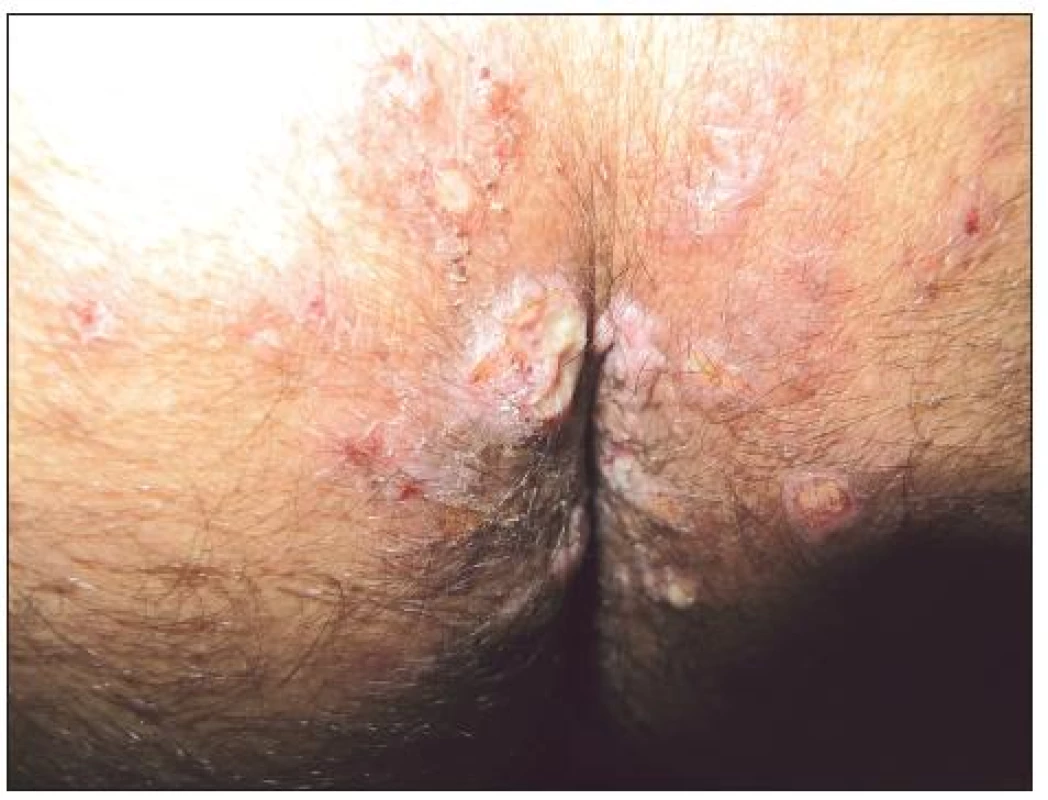
Zvláštní pozornost zahrnují i sexuálně přenášené infekce, zejména syfilis. Kožní manifestace primární a sekundární získané syfilis nebývají identické s infekcemi u HIV negativních osob. HIV infekce může urychlit vývoj syfilitického onemocnění a syfilis naopak významně ovlivnit progresi HIV infekce. Alterována je imunitní odpověď za projevů opožděné protilátkové reaktivity či (vzácně) dokonce negativity treponémových i netreponémových testů [33, 75]. Primární získaná syfilis může být demonstrována větším počtem primárních lézí, prodlouženým hojením i přetrváváním těchto změn [68]. Exantémy sekundárního stadia mohou vykazovat nodulo-ulcerativní charakteristiky. Z klinických symptomů vedle klasických projevů (obr. 3 – Condylomata lata u HIV pozitivního pacienta) byla popsána palmoplantární keratodermie jako projev sekundární syfilis [66]. Častěji bývají popisovány i oční a ušní manifestace syfilis u HIV pozitivních pacientů [68]. Postižení CNS se může objevit podstatně dříve, a to dokonce u primární syfilis [6]. Doporučovaná terapeutická schémata nemusí být dostatečná v terapii a v prevenci CNS postižení: Poukazuje se i na možnost časných relapsů CNS postižení i po standardní terapii, pravděpodobně díky kombinaci alterované buněčné imunitní odpovědi při HIV infekci a nedostatečným hladinám účinného léčiva v CNS [6]. Jarisch-Herxheimerova reakce při terapii syfilis bývá častější. Před započetím terapie neurosyfilitické infekce musí být řádně vyšetřen mozkomíšní mok u všech HIV pozitivních osob s latentní syfilis delší než 1 rok nebo neznámé délky trvání.
CDC v Atlantě (USA) vypracovala směrnice pro léčbu syfilis u HIV infikovaných osob [13] s doporučením terapie časné formy syfilis za užití 2,4 mil. j. benzathine penicilinu podaného jednorázově i. m., jiní navrhují opakované podání stejné dávky téhož léku v týdenních intervalech, celkem 2–3 týdny. Mozkomíšní mok by však měl být vyšetřen u každé časné infekce syfilis, máme-li podezření na postižení CNS. U nemocných s udávanou alergií na penicilin se doporučuje hospitalizace s pokusem o desenzibilizaci a následnou penicilinovou terapii (eventuálně podání doxycyklinu 200 mg denně po 2 týdny, nikoliv však u neurosyfilis). Erytromycinová terapie (ani terapie azithromycinem) není doporučena [49, 68]. Je nutná sérologická kontrola pacientů netreponémovými testy kvantitativně v 1., 2. a 3. měsíci, a poté ve 3měsíčních intervalech až do uspokojivých výsledků séroreakcí. Nedojde-li k příslušnému poklesu titrů, musíme zvážit opakování vyšetření mozkomíšního moku. V České republice se doporučuje 14denní terapie Prokain G penicilinem 1,5 mil. IU i. m. 1krát denně, s následnou aplikací 2 x 1,5 mil. IU benzathin benzylpenicilinu i. m. jednorázově. U neurosyfilis se doporučuje terapie krystalickým G penicilinem (2–4 mil. j. i. v. po 4 hod.) nebo prokain G penicilinem i. m. (až 2,4 mil. j. denně), s podáním probenecidu (není v ČR registrován) [68]. U asymptomatické i symptomatické neurosyfilis HIV pozitivních jedinců by neměl být k terapii indikován benzathin penicilin.
Nejsou známy údaje o správné terapii HIV infikovaných jedinců s latentní syfilis (nutná lumbální punkce k vyloučení postižení CNS) a normálním nálezem v mozkomíšním moku. V těchto případech se ale doporučuje aplikace benzathin penicilinu v dávce 2,4 mil. j. ve 3 následujících týdnech, v České republice 1,5 mil. IU benzathin benzylpenicillinu do každé hýždě ve 3 následujících týdnech [68]. Vždy jsou doporučovány časté sérologické kontroly k monitorování terapeutické odpovědi. Sérologická odpověď může být pomalejší než u pacientů s časnou syfilis [49].
ad c) Mezi neinfekční kožní změny řadíme seboroickou dermatitidu, eozinofilní folikulitidu, extrémní suchost kůže (xerosis), ichtyotické změny a nápadně rychlé šedivění vlasů. Řada dalších běžných neinfekčních dermatologických jednotek (atopický ekzém, psoriasis, urtikariální pruritické papuly, porphyria cutanea tarda, fotosenzitivita aj.) může vykazovat specifické rysy v klinické symptomatologii, v rozsahu a závažnosti při volbě vhodné terapie.
Xeróza bývá typicky lokalizována na předních plochách dolních končetin, může se ale šířit na další okrsky kůže [37]. Zhoršení je pozorováno v zimních měsících, kdy se mohou připojit i výsevy erytematózních papulek a jemné šupení na zadní straně paží a dolních končetin. HIV infikovaní pacienti s atopickou diatézou jsou k těmto změnám predisponováni. Častá hygiena za užití antibakteriálních mýdel může stav těchto změn prohloubit.
Ichtyotické změny ve smyslu získané ichthyózy jsou manifestovány u pokročilých HIV infekcí. Tyto jsou změny jsou asociovány s tzv. „wasting“ syndromem (devastační syndrom) a lokalizují se také v dlaních a na ploskách [49].
Seboroická dermatitida je nejčastější kožní onemocnění HIV infikovaných osob. Manifestuje se v typických seborrhoických lokalizacích (kštice, centrální část obličeje). U HIV pozitivních osob bývá průběh závažnější. Studie v časných fázích epidemie prokázaly až 83% prevalenci seborrhoické dermatitidy u pokročilých HIV infekcí a 42% prevalenci u symptomatické HIV infekce [48]. Jiné studie uvádějí ale u pokročilých HIV infekcí nižší údaje mezi 25–45 % [20, 29]. U menšího počtu pacientů lze diagnostikovat nejzávažnější formy, které se svými projevy lokalizují v typických predilekcích (obličej a kštice), ale i rozsáhlým postižením intertriga ve formě sytě červených ložisek krytých jemnými šupinami. Může dojít i k šíření změn z intertriginózních prostor na trup a na šíji. Pruritus bývá mírného stupně [47]. Klinicky bývají změny v intertrigu označovány jako sebopsoriasis, klinicky jsou identické se změnami u inverzní psoriázy. Mírné formy jsou léčeny stejnou terapií jako seborrhoické dermatitidy u HIV negativních pacientů, tj. deriváty imidazolu, dehtu a slabě působícími kortikoidy lokálně.
Též klinické projevy psoriázy u HIV infikovaných pacientů jsou obdobné projevům u HIV negativní populace. Je ale udávána vyšší incidence postižení inverzních lokalizací a psoriatická erytrodermie není – zejména u pokročilých HIV infekcí – vzácná [18]. V terapii jsou užívány deriváty dehtu, steroidy, fotochemoterapie PUVA, anthralinové deriváty, retinoidy i metotrexát. Užití potentních kortikoidů aplikovaných lokálně na velké plochy však může vést k systémové absorpci, adrenální supresi a snad i k celkové imunosupresi, tedy jevům u HIV infekce nežádoucím. Lokální aplikace steroidů dále i zvyšuje riziko kožních infekcí. Někteří autoři udávají vývoj Kaposiho sarkomů a zhoršení HIV infekce při užití UVB fototerapie. PUVA redukuje počty atypických T lymfocytárních infiltrátů v kůži a může dokonce eliminovat cirkulující atypické T lymfocyty, bezpečnost PUVA terapie ale nebyla dosud u HIV infikovaných pacientů stanovena. Standardní terapie nízkodávkovaným metotrexátem může být spojována s progresivní imunosupresí u HIV infikovaných [18]. Užití retinoidů systémově je omezeno přítomností hepatitis B infekce u HIV pozitivních pacientů, nicméně řada takových pacientů vykázala dobrou odpověď na tuto formu terapie psoriázy [19].
Někteří autoři prokázali zlepšení klinických projevů psoriázy při užití azidothymidinu (závislost na dávce AZT) v terapii HIV infekce [37, 19, 69]. Po nasazení HAART (Highly Active Antiretroiviral Therapy) se podle zkušeností odborníků zabývajících se problematikou HIV infekcí v České republice výrazně zlepšily projevy psoriázy u HIV infikovaných pacientů (pozn. recenzenta).
Zda je skutečná incidence Reiterova syndromu zvýšená u HIV infekce, nebo zda HIV infekce usnadní vývoj či exacerbaci Reiterova syndromu, není známo. Podpůrné faktory k rozvoji Reiterova syndromu, jako jsou urogenitální sexuálně přenášená onemocnění a infekční onemocnění gastrointestinálního traktu, jsou totiž běžná u HIV infikovaných osob. Kožní změny jsou manifestovány postižením dlaní a plosek (superficiální pustule s přeměnou v keratotické papulky, které splývají za vzniku difuzních, šupících se ložisek – tzv. keratoderma blenorrhagicum), dystrofickými změnami nehtových plotének a výsevem zarudlých plak ve tříslech a v axilách, jakož i postižení orální (lingua geographica) či genitální sliznice (balanitis circinata). Terapie kožních změn u HIV asociovaného Reiterova syndromu je identická jako u psoriázy (retinoidy, metotrexát relativně kontraindikován) [5, 49].
Eozinofilní folikulitida není u HIV infikovaných jedinců podmíněna bakteriálními původci. Typicky se manifestuje u HIV infikovaných s počty CD4+ lymfocytů pod 200/μl, takže představuje důležitý kožní marker specifického stadia HIV onemocnění. Klinicky jde o intenzivně svědící, edematózní až urtikariální papule a pustulky s výsevy na trupu a/nebo v obličeji. Vyšetřením materiálu z biopsie se zjistí eozinofilní infiltrát. Terapie bývá obtížná – bylo zkoušeno užití UV fototerapie, itrakonazolu, permethrinu s rozdílnou odpovědí na léčbu [49]. U některých pacientů došlo ke zlepšení po metronidazolu.
U HIV infikovaných dětí i dospělých může dojít k manifestaci atopického ekzému. Terapeutická doporučení jsou shodná s léčbou u neinfikovaných jedinců.
Běžným kožním projevem u HIV pozitivních pacientů jsou urtikariální pruritické papuly, které nejsou specifické v etiologii. Mohou být asociovány s kousnutím hmyzem (blechy, komáři – papulózní urtikárie). Scabies se manifestuje též typickým způsobem s výsevem svědících papulek v predilekčních lokalizacích svrabu. S progresí HIV infekce narůstá rozsah postižení a svrab pak bývá i refrakterní k terapii [70]. Bezpečnou terapií zůstává aplikace permethrinu, 5% krému v lokálním užití [49]. U pacientů s pokročilou HIV infekcí může dojít i k vývoji norské varianty svrabu [23]. Tato forma může znamenat i letální ohrožení (sepse), poněvadž představuje vstupní bránu pro řadu bakteriálních patogenů [28]. Byly popsány i lokalizované formy svrabu u pacientů s HIV infekcí, např. atypická lokalizovaná forma pod obrazem scabies vesiculosa [41] či lokalizované formy scabies norwegica s hyperkeratotickými změnami na ploskách, dlaních a na genitálu.
V literatuře jsou výjimečně zmínky o fotosenzitivitě HIV infikovaných jedinců. Nicméně Maurer [49] udává, že tento typ reaktivity není neobvyklý. Dochází k výsevu erytematózních ložisek a plaků na kůži v UV exponovaných okrscích (dorza rukou, extenzory předloktí, laterální partie šíje a obličej). V pozadí stojí většinou UV-B typ záření. Na vzniku se mohou podílet i často užívané léky u HIV pozitivních osob, jako např. nesteroidní protizánětlivé léky (NSAID). V případě fotosenzitivní reakce se doporučuje aplikace kortikoidů, sunscreenů a dodržení zásad fotoprotekce.
U HIV infikovaných jedinců se uvažovalo i o asociaci HIV a porphyria cutanea tarda (PCT) [34, 46]. Někteří nemocní vykazují familiární formy, další pak sporadické formy PCT. Řada nemocných, geneticky vnímavých k PCT, manifestuje vývoj PCT teprve po expozici hepatotoxickým agens (etanol) či hepatotoxicky působícím lékům, které interferují s enzymem uroporfyrinogen dekarboxyláza (např. estrogeny). Také přítomnost hepatidy (zejména hepatitis C) může být spouštěcím faktorem rozvoje PCT [21].
Konečně z hlediska kožních změn je třeba podotknout, že podávání Zidovudinu (AZT) v terapii HIV infekce může vést u osob s tmavou pletí (Hispánci, černošská populace) k pigmentačním změnám kůže a sliznic [30]. Objevují se hyperpigmentace nehtů (nejprve modravé zbarvení, může přejít až v tmavě černé), ústní sliznice i kůže (exponovaná kůže UV a oblasti s mechanickou zátěží). Hyperpigmentace jdou na vrub zvýšené melanogenezi, ne díky ukládání účinného léku, a jejich stupeň je závislý na dávce AZT.
Řada účinných látek užívaných v rámci HAART terapie může sama o sobě vést ke vzniku kožních změn. Nejčastější hypersenzitivní kožní reakce vyvolává např. abacavir (Ziagen), efavirenz (Stocrin), nevirapine (vitamine) dokonce až u 37 % osob (pozn. recenzenta). Také u řady proteázových inhibitorů může být výsev exantému závažnou komplikací terapie. Užívání indinaviru (Crixivan) se může projevit suchou kůží či abnormitami nehtů, vzácností nebyla dříve ani alopecie. Hyperpigmentace dlaní a nehtů můžeme pozorovat při dlouhodobém užívání emtricitabinu (Emtriva). Alergické kožní projevy u HIV infikovaných jsou velmi časté. Jako alergeny se uplatňují i nejrůznější antibiotika penicilinová, zvláště ampicilin, antituberkulotika, chemoterapeutika – cotrimoxazol a jiné sulfonamidy, nesteroidní antirevmatika a další.
ZÁVĚR
Z vývoje pandemie AIDS a výsledků usilovného vědeckého bádání je zřejmé, že vyřešit tento problém nebude tak jednoduché, jak se zpočátku zdálo. Úsilí na poli vývoje vakcín proti HIV naráží na mnoho problémů, zejména diverzita virových izolátů, nejasné koreláty imunity – tj. jakou imunitní odpověď by vakcína měla indukovat a v neposlední řadě neobjasněnost přesné patogeneze onemocnění. Dvě velké vakcinační studie AIDSVAX a STEP byly ukončeny, aniž by přinesly pozitivní výsledky [12, 50, 60]. Pouze jediná studie z nedávné doby uskutečněná v Thajsku vykázala určitou úspěšnost [67]. V oblasti terapie bylo dosaženo částečných úspěchů, kdy současné cART kombinace jsou schopné zásadně prodloužit přežití HIV infikovaných pacientů, jejich vedlejší účinky jsou již méně závažné než u prvních preparátů, ale stale vyžadují celoživotní léčbu a nevedou k eradikaci viru. Hledají se proto nové postupy, které by jako „pomocné” modality při terapii antivirotiky pozitivně modulovaly imunitní systém, aby byl např. následně schopen kontrolovat virus bez další terapie, nebo které by přispěly k eradikaci latentních rezervoárů a další. Jisté úspěchy byly zaznamenány v oblasti profylaktického podávání antivirotik jedincům ohroženým infekcí – např. při poranění HIV pozitivním materiálem, peripartální podání HIV pozitivním matkám pro zamezení infekce novorozence, a dokonce preventivní podávání v rizikových skupinách při nebezpečí infekce. Přesto je nutné věnovat další intenzivní úsilí k objasnění zejména všech důležitých detailů patogeneze, imunitních mechanismů vedoucích alespoň ke kontrole viru (když už úplná eradikace/sterilizující imunita je zřejmě těžce dosažitelná) a dalších aspektů HIV/AIDS, aby bylo možno zabránit dalšímu šíření pandemie HIV.
Použité zkratky:
AIDS – Aquired immunodefficiency syndrom, získaný syndrom imunitní nedostatečnosti
ATL – Adult T-cell leukemia/lymphoma, T buněčný lymfom dospělých
AZT – azidothymidin, nukleozidový inhibitor reverzní transkriptázy
cART – combination Anti Retroviral Therapy, kombinovaná antiretrovirová terapie
CCR5 – beta chemokoinový receptor typu 5 ze skupiny membránových proteinů
CDC – Center for Disease Control, Centrum pro kontrolu chorob, Atlanta, Georgia, USA
CXCR4 – alfa chemokinový receptor typu 4, tzv. fusin, chemotaktická aktivita pro lymfocyty
CMV – cytomegalovirus
CNS – centrální nervový systém
CTL – cytotoxické T lymfocyty
EBV – Epstein-Barr virus, virus Epstein-Barrové, human herpesvirus 4 (HHV-4), asociován s vlasatou leukoplakií, původce infekční mononukleózy
GALT – Gut associated lymphoid tissue, lymfatický systém střeva
HAART – Highly-Active-Anti-Retroviral-Therapy, vysoce aktivní antiretrovirová terapie
HHV8 – Human Herpes Virus 8, HHV-8, humánní herpetický virus 8
HIV – Human immunodefficency virus, virus lidské imunitní nedostatečnosti
HLA – Human leukocyte antigen, označení hlavního histokompatibilního komplexu u lidí
HPV – Human papilloma virus, lidský papilloma virus
HTLV – Human T-cell leukaemia virus, lidský T buněčný leukemický virus
HSV – Herpes simplex virus
IRIS – Immune-Reconstitution-Inflammatory-Syndrome
KS – Kaposiho sarkom
MMWR – Morbidity and Mortality Weekly Report (periodikum s daty o infekčních a chronických onemocněních hlášených státními a teritoriálními zdravotnickými zařízeními)
NSAID – Non-steroidal anti-inflammatory drug, nesteroidní, protizánětlivé léky
PCP – Pneumocystis carinii, pneumonie
PCT – Porphyria cutanea tarda, pozdní kožní porfyrie
PML – Progresivní multifokální leukoencefalopatie
PUVA – fotochemoterapie s užitím psoralenů/fotosenzibilizátory/ a UV-A záření
RANTES – Regulated upon Activation, Normal T-cell Expressed, and Secreted, chemotaktický cytokin
SIV – Simian Immunodeficiency Virus, virus imunitní nedostatečnosti u primátů
UNAIDS – The Joint United Nations Programme on HIV/AIDS (globální programy boje proti AIDS, globální statistiky)
VZV – Varicella-zoster virus
Podporováno grantem GAČR P304-10-1161.
Do redakce došlo dne 31. 1. 2011.
Kontaktní
adresa:
MUDr. Miloslav Salavec, CSc.
Klinika
nemocí kožních a pohlavních LF UK
FN
Hradec Králové
Sokolská
581
500
05 Hradec Králové
e-mail:
salavmil@fnhk.cz
DOŠKOLOVÁNÍ LÉKAŘŮ – KONTROLNÍ TEST
TEST HIV/AIDS
1. Hlavní cestou přenosu HIV infekce je v současnosti:
a) heterosexuální přenos
b) homosexuální přenos
c) přenos infikovanou krví a krevními deriváty
d) přenos z matky na plod
2. Infekce HIV vede k:
a) masivní depleci CD4+ lymfocytů
b) k mírné depleci CD4+ lymfocytů
c) počty CD4 nejsou infekcí ovlivněny
d) počty CD4+ lymfocytů se zvyšují
3. Vysoké riziko oportunních infekcí je laboratorně definováno:
a) zvýšením CD4+ lymfocytů > 500/l
b) snížením CD4+ lymfocytů < 500/l
c) snížením CD4+ lymfocytů < 200/l
d) zvýšením CD4+ lymfocytů > 200/l
4. Průběh neléčené HIV infekce je rozdělen do:
a) 2 stadií
b) 3 stadií
c) 4 stadií
d) není dělen na stadia
5. Akutní primární infekce se neprojevuje:
a) únavou
b) lymfadenopatií
c) bolestmi kloubů
d) kožním exantémem
e) úporným kašlem
6. K syndromu zánětlivé imunitní rekonstituce (IRIS) dochází po zahájení terapie:
a) u všech HIV pozitivních léčených jedinců
b) u nemocných s velmi nízkým počtem CD4+
lymfocytů
c) u nemocných s vysokým počtem CD4+
lymfocytů
d) u nemocných s mykotickými afekcemi
7. Pro HIV/AIDS infekci je z kožního hlediska patognomonický nález:
a) Kaposiho varioliformních erupcí
b) multiformní exsudativní erytém
c) Kaposiho sarkom
d) tuberculosis cutis luposa
8. Léze Kaposiho sarkomu jsou velmi často lokalizovány:
a) na dolních končetinách
b) na kůži obličeje
c) na trupu
d) na horních končetinách
9. Diseminované infekce molluscum contagiosum u HIV lze pokládat za:
a) kožní marker pokročilé HIV infekce (CDR+ <
50/l)
b) nemají samy o sobě výpovědní hodnotu
c) poukazují na stabilizovaný stav imunitního
systému
d) značí dobrou odpověď na zavedenou terapii
10. Infekce Bartonellou u HIV/AIDS jsou:
a) výlučně kožní infekcí
b) mohou postihnout i orgánové systémy
c) jsou identické s projevy Kaposiho sarkomu
d) nelze je léčit antibiotiky
11. Mezi neinfekční kožní změny u HIV infekce neřadíme:
a) seboroickou dermatitidu
b) tvorbu strií
c) xerózu
d) rychlé šedivění vlasů
Pozn. Správným zodpovězením otázek kontrolního testu získáte 6 kreditů kontinuálního vzdělávání lékařů ČLK, které budou zasílány redakcí jedenkrát ročně po uzavření ročníku časopisu. Správné odpovědi na otázky kontrolního testu budou uveřejněny v příštím čísle časopisu. Odpovědi posílejte na adresu redakce (Dermatovenerologická klinika 1. LF UK a VFN, U Nemocnice 2, 128 00 Praha 2) vždy nejpozději do jednoho měsíce od vydání daného čísla.
Odpovědi na otázky kontrolního testu publikovaném v č. 1/2011:
Arenbergerová M.: Úspěšná léčba těžké formy hidradentitis suppurativa pomocí adalimumabu
Správné odpovědi: 1c, 2a,b,c,d, 3a, 4c, 5a,b, 6b,c, 7d, 8b,c 9d, 10b
Sources
1. 1993 revised classification system for HIV infection and expanded surveillance case definition for AIDS among adolescents and adults. MMWR Recomm Rep. 1992, 41, p. 1–19.
2. ALTER, G., MOODY, M. A. The humoral response to HIV-1: new insights, renewed focus. J. Infect. Dis., 2010, 202, Suppl 2, p. S315–322.
3. ANSARI, A. A., ONLAMOON, N., BOSTIK, P., MAYNE, A. E., GARGANO, L., PATTANAPANYASAT, K. Lessons learnt from studies of the immune characterization of naturally SIV infected sooty mangabeys. Front. Biosci., 2003, 8, p. 1030–1050.
4. BARRE-SINOUSSI, F., CHERMANN, J. C., REY, F. et al. Isolation of a T-lymphotropic retrovirus from a patient at risk for acquired immune deficiency syndrome (AIDS). Science, 1983, 220, p. 868–871.
5. BELZ, J., BRENEMAN, D. L., NORDLUND, J. J., SOLINGER, A. Successful treatment of a patient with Reiter’s syndrome and acquired immunodeficiency syndrome using etretinate. J. Am. Acad. Dermatol., 1989, 20, 5, p. 898–903.
6. BERRY, C. D., HOOTON, T. M., COLLIER, A. C., LUKEHART, S. A. Neurologic relapse after benzathine penicillin therapy for secondary syphilis in a patient with HIV infection. N. Engl. J. Med., 1987, 316, 25, p. 1587–1589.
7. BLANKSON, J. N., PERSAUD, D., SILICIANO, R. F. The challenge of viral reservoirs in HIV-1 infection. Annu. Rev. Med., 2002, 53, p. 557–593.
8. BOSTIK, P., DODD, G. L., ANSARI, A. A. CD4+ T cell signaling in the natural SIV host – implications for disease pathogenesis. Front. Biosci., 2003, 8, p. 904–912.
9. BOSTIK, P., VILLINGER, F., BRICE, G. T. et al. Expression and in vitro evaluation of rhesus macaque wild type (wt) and modified CC chemokines. J. Med. Primatol., 1998, 27, 2–3, p. 113–120.
10. BRENCHLEY, J. M., SCHACKER, T. W., RUFF, L. E. et al. CD4+ T cell depletion during all stages of HIV disease occurs predominantly in the gastrointestinal tract. J. Exp. Med., 2004, 200, 6, p. 749–759.
11. BUCHBINDER, S. P., KATZ, M. H., HESSOL, N. A. et al. Herpes zoster and human immunodeficiency virus infection. J. Infect. Dis., 1992, 166, 5, p. 1153–1156.
12. BUCHBINDER, S. P., MEHROTRA, D. V., DUERR, A. et al. Efficacy assessment of a cell-mediated immunity HIV-1 vaccine (the Step Study): a double-blind, randomised, placebo-controlled, test-of-concept trial. Lancet, 2008, 372, p. 1881–1893.
13. Centers for Disease C. Recommendations for diagnosing and treating syphilis in HIV-infected patients. MMWR (Morb Mortal Wkly Rep.), 1988, 37, 39, p. 600–602, 607–608.
14. COFFIN, J., HAASE, A., LEVY, J. A.et al. Human immunodeficiency viruses. Science, 1986, 232, p. 697.
15. COHEN, P. R., GROSSMAN, M. E. Clinical features of human immunodeficiency virus-associated disseminated herpes zoster virus infection – a review of the literature. Clin. Exp. Dermatos., 1989, 14, 4, p. 273–276.
16. COLEBUNDERS, R., MANN, J. M., FRANCIS, H. et al. Herpes zoster in African patients: a clinical predictor of human immunodeficiency virus infection. J. Infect. Dis., 1988, 157, 2, p. 314–318.
17. DRAGIC, T., LITWIN, V., ALLAWAY, G. P. et al. HIV-1 entry into CD4+ cells is mediated by the chemokine receptor CC-CKR-5. Nature, 1996, 381, p. 667–673.
18. DUVIC, M., JOHNSON, T. M., RAPINI, R. P., FREESE, T., BREWTON, G., RIOS, A. Acquired immunodeficiency syndrome-associated psoriasis and Reiter’s syndrome. Arch. Dermatol., 1987, 123, 12, p. 1622–1632.
19. DUVIC, M., RIOS, A., BREWTON, G. W. Remission of AIDS-associated psoriasis with zidovudine. Lancet, 1987, 2, p. 627.
20. EISENSTAT, B. A., WORMSER, G. P. Seborrheic dermatitis and butterfly rash in AIDS. N. Engl. J. Med., 1984, 311, p. 189.
21. FARGION, S., PIPERNO, A., CAPPELLINI, M. D. et al. Hepatitis C virus and porphyria cutanea tarda: evidence of a strong association. Hematology, 1992, 16, 6, p. 1322–1326.
22 FRAZER, I. H., MEDLEY, G., CRAPPER, R. M., BROWN, T. C., MACKAY, I. R. Association between anorectal dysplasia, human papillomavirus, and human immunodeficiency virus infection in homosexual men. Lancet, 1986, 2, p. 657–660.
23. FUNKHOUSER, M. E., OMOHUNDRO, C., ROSS, A., BERGER, T. G. Management of scabies in patients with human immunodeficiency virus disease. Arch. Dermatol., 1993, 129, 7, p. 911–913.
24. GAL, A. A., MEYER, P. R., TAYLOR, C. R. Papillomavirus antigens in anorectal condyloma and carcinoma in homosexual men. JAMA, 1987, 257, 3, p. 337–340.
25. GALLO, R., WONG-STAAL, F., MONTAGNIER, L., HASELTINE, W. A., YOSHIDA, M. HIV/HTLV gene nomenclature. Nature, 1988, 333, p. 504.
26. GAYLE, H. An overview of the global HIV/AIDS epidemic, with a focus on the United States. AIDS, 2000, 14, Suppl 2, S8–17.
27. GEIJTENBEEK, T. B., KWON, D. S., TORENSMA, R. et al. DC-SIGN, a dendritic cell-specific HIV-1-binding protein that enhances trans-infection of T cells. Cell, 2000, 100, 5, p. 587–597.
28. GLOVER, A., YOUNG, L., GOLTZ, A. W. Norwegian scabies in acquired immunodeficiency syndrome: report of a case resulting in death from associated sepsis. J. Am. Acad. Dermatol., 1987, 16, 2, p. 396–399.
29. GOODMAN, D. S., TEPLITZ, E. D., WISHNER, A., KLEIN, R. S., BURK, P. G., HERSHENBAUM, E. Prevalence of cutaneous disease in patients with acquired immunodeficiency syndrome (AIDS) or AIDS-related complex. J. Am. Acad. Dermatol., 1987, 17, 2, p. 210–220.
30. GREENBERG, R. G., BERGER, T. G. Nail and mucocutaneous hyperpigmentation with azidothymidine therapy. J. Am. Acad. Dermatol., 1990, 22, 2, p. 327–330.
31. HAHN, B. H., SHAW, G. M., DE COCK, K. M., SHARP, P. M. AIDS as a zoonosis: scientific and public health implications. Science, 2000, 287, p. 607–614.
32. HARE, C. B. Clinical overview of HIV disease. 2009.
33. HICKS, C. B., BENSON, P. M., LUPTON, G. P., TRAMONT, E. C. Seronegative secondary syphilis in a patient infected with the human immunodeficiency virus (HIV) with Kaposi sarcoma. A diagnostic dilemma. Ann. Intern. Med., 1987, 107, 4, p. 492–495.
34. HOGAN, D., CARD, R. T., GHADIALLY, R., McSHEFFREY, J. B., LANE, P. Human immunodeficiency virus infection and porphyria cutanea tarda. J. Am. Acad. Dermatol., 1989, 20, 1, p. 17–20.
35. HU, D. J., DONDERO, T. J., RAYFIELD, M. A. et al. The emerging genetic diversity of HIV. The importance of global surveillance for diagnostics, research, and prevention. JAMA, 1996, 275, 3, p. 210–216.
36. JACOBSON, M. A., BERGER, T. G., FIKRIG, S. et al. Acyclovir-resistant varicella zoster virus infection after chronic oral acyclovir therapy in patients with the acquired immunodeficiency syndrome (AIDS). Ann. Intern. Med., 1990, 112, 3, p. 187–191.
37. KAPLAN, M. H., SADICK, N., McNUTT, N. S., MELTZER, M., SARNGADHARAN, M. G., PAHWA, S. Dermatologic findings and manifestations of acquired immunodeficiency syndrome (AIDS). J. Am. Acad. Dermatol., 1987, 16, 3, p. 485–506.
38. Kaposi’s sarcoma and Pneumocystis pneumonia among homosexual men – New York City and California. MMWR (Morb Mortal Wkly Rep), 1981, 30, 25, p. 305–308.
39. KEELE, B. F., GIORGI, E. E., SALAZAR-GONZALEZ, J. F. et al. Identification and characterization of transmitted and early founder virus envelopes in primary HIV-1 infection. Proc. Natl. Acad. Sci. USA, 2008, 105, 21, p. 7552–7557.
40. KEELE, B. F., VAN HEUVERSWYN, F., LI, Y. et al. Chimpanzee reservoirs of pandemic and nonpandemic HIV-1. Science, 2006, 313, p. 523–526.
41. KODET, O., LACINA, L., BENÁKOVÁ, N., VELČEVSKÝ, P., ŠTORK, J. Klinický případ: svědivé papulovezikuly na nohou. Čes-slov Derm, 85, 2010, 1, s. 33–36.
42. LE GALL, S., ERDTMANN, L., BENICHOU, S. et al. Nef interacts with the mu subunit of clathrin adaptor complexes and reveals a cryptic sorting signal in MHC I molecules. Imunity, 1998, 8, 4, p. 483–495.
43. LEMLICH, G., SCHWAM, L., LEBWOHL, M. Kaposi’s sarcoma and acquired immunodeficiency syndrome. Postmortem findings in twenty-four cases. J. Am. Acad. Dermatol., 1987, 2, p. 319–325.
44. LETVIN, N. L., EATON, K. A., ALDRICH, W. R. et al. Acquired immunodeficiency syndrome in a colony of macaque monkeys. Proc. Natl. Acad. Sci. USA, 1983, 80, 9, p. 2718–2722.
45. LINNEMANN, C. C., JR., BIRON, K. K., HOPPENJANS, W. G., SOLINGER, A.M. Emergence of acyclovir-resistant varicella zoster virus in an AIDS patient on prolonged acyclovir therapy. AIDS, 1990, 4, 6, p. 577–579.
46. LOBATO, M. N., BERGER, T. G. Porphyria cutanea tarda associated with the acquired immunodeficiency syndrome. Arch. Dermatos., 1988, 124, 7, p. 1009–1010.
47. MAHE, A., SIMON, F., COULIBALY, S., TOUNKARA, A., BOBIN, P. Predictive value of seborrheic dermatitis and other common dermatoses for HIV infection in Bamako, Mali. J. Am. Acad. Dermatol., 1996, 34, 6, p. 1084–1086.
48. MATHES, B. M., DOUGLASS, M. C. Seborrheic dermatitis in patients with acquired immunodeficiency syndrome. J. Am. Acad. Dermatol., 1985, 13, 6, p. 947–951.
49. MAURER, T. A., BERGER, T. G. Dermatologic Manifestations of HIV. 1998,
http://hivinsite.ucsf.edu/InSite?page=kb-04-01-01S1X.
50. McELRATH, M. J., DE ROSA, S. C., MOODIE, Z. et al. HIV-1 vaccine-induced immunity in the test-of-concept Step Study: a case-cohort analysis. Lancet, 2008, 372, p. 1894–1905.
51. McMICHAEL, A. J., BORROW, P., TOMARAS, G. D., GOONETILLEKE, N., HAYNES, B. F. The immune response during acute HIV-1 infection: clues for vaccine development. Nat. Rev. Immunol., 2010, 10, 1, p. 11–23.
52. MEHANDRU, S., POLES, M. A., TENNER-RACZ, K. et al. Primary HIV-1 infection is associated with preferential depletion of CD4+ T lymphocytes from effector sites in the gastrointestinal tract. J. Exp. Med., 2004, 200, 6, p. 761–770.
53. MUESING, M. A., SMITH, D. H., CABRADILLA, C. D., BENTON, C. V., LASKY, L. A., CAPON, D. J. Nucleic acid structure and expression of the human AIDS/lymphadenopathy retrovirus. Nature, 1985, 313, p. 450–458.
54. MYERS, S. A., KAMINO, H. Cutaneous cryptococcosis and histoplasmosis coinfection in a patient with AIDS. J. Am. Acad. Dermatol., 1996, 34, 5, p. 898–900.
55. OBERLIN, E., AMARA, A., BACHELERIE, F. et al. The CXC chemokine SDF-1 is the ligand for LESTR/fusin and prevents infection by T-cell-line-adapted HIV-1. Nature, 1996, 382, p. 833–835.
56. Opportunistic infections and Kaposi’s sarcoma among Haitians in the United States. MMWR (Morb Mortal Wkly Rep), 1982, 31, 26, p. 353–354, 360–351.
57. PALEFSKY, J. M., GONZALES, J., GREENBLATT, R. M., AHN, D. K., HOLLANDER, H. Anal intraepithelial neoplasia and anal papillomavirus infection among homosexual males with group IV HIV disease. JAMA, 1990, 263, 21, p. 2911–2916.
58. PENNEYS, N. S., HICKS, B. Unusual cutaneous lesions associated with acquired immunodeficiency syndrome. J. Am. Acad. Dermatol., 1985, 13, 5, p. 845–852.
59. PERRONNE, C., LAZANAS, M., LEPORT, C. et al. Varicella in patients infected with the human immunodeficiency virus. Arch. Dermatol., 1990, 126, 8, p. 1033–1036.
60. PITISUTTITHUM, .P, GILBERT, P., GURWITH, M. et al. Randomized, double-blind, placebo-controlled efficacy trial of a bivalent recombinant glycoprotein 120 HIV-1 vaccine among injection drug users in Bangkok, Thailand. J. Infect. Dis., 2006, 194, 12, p. 1661–1671.
61. Pneumocystis carinii pneumonia among persons with hemophilia A. MMWR (Morb Mortal Wkly Rep.) 1982, 31, 27, p. 365–367.
62. Pneumocystis pneumonia – Los Angeles. MMWR (Morb Mortal Wkly Rep.), 1981, 30, 21, p. 250–252.
63. PROCHÁZKOVÁ, I., KRAJSOVÁ, I., ŠTORK, J., BĚLOHRADSKÁ, H., VELENSKÁ, Z., LACINA, L. Klinický případ: Diseminované lividní makulopapuly a ložiska. Čes--slov Derm, 2008, 83, 6, s. 315–318.
64. Proposed World Health Organization staging system for HIV infection and disease: preliminary testing by an international collaborative cross-sectional study. The WHO International Collaborating Group for the Study of the WHO Staging System. AIDS, 1993, 7, 5, p. 711–718.
65. RABENECK, L., POPOVIC, M., GARTNER, S. et al. Acute HIV infection presenting with painful swallowing and esophageal ulcers. JAMA, 1990, 263, 17, p. 2318–2322.
66. RADOLF, J. D., KAPLAN, R. P. Unusual manifestations of secondary syphilis and abnormal humoral immune response to Treponema pallidum antigens in a homosexual man with asymptomatic human immunodeficiency virus infection. J. Am. Acad. Dermatol., 1988, 18, 2, Pt 2, p. 423–428.
67. RERKS-NGARM, S., PITISUTTITHUM, P., NITAYAPHAN, S. et al. Vaccination with ALVAC and AIDSVAX to prevent HIV-1 infection in Thailand. N. Engl. J. Med., 2009, 361, 23, p. 2209–2220.
68. ROZEHNALOVÁ, Z., HERCOGOVÁ, J., JILICH, D., MACHALA, L., ROZSYPAL, H. Koinfekce syfilis a HIV. Čes--slov Derm, 2009, 84, 5, s. 278–283.
69. RUZICKA, T., FROSCHL, M., HOHENLEUTNER, U., HOLZMANN, H., BRAUN-FALCO, O. Treatment of HIV-induced retinoid-resistant psoriasis with zidovudine. Lancet, 1987, 2, p. 1469–1470.
70. SADICK, N., KAPLAN, M. H., PAHWA, S. G., SARNGADHARAN, M. G. Unusual features of scabies complicating human T-lymphotropic virus type III infection. J. Am. Acad. Dermatol., 1986, 15, 3, p. 482–486.
71. SHARP, P. M., BAILES, E., CHAUDHURI, R. R., RODENBURG, C. M., SANTIAGO, M. O., HAHN, B. H. The origins of acquired immune deficiency syndrome viruses: where and when? Philos. Trans. R. Soc. Lond. B. Biol. Sci., 2001, 356, p. 867–876.
72. SCHWARTZ, J. J, MYSKOWSKI, P. L. Molluscum contagiosum in patients with human immunodeficiency virus infection. A review of twenty-seven patients. J. Am. Acad. Dermatol., 1992, 27, 4, p. 583–588.
73. SODORA, D. L., ALLAN, J. S., APETREI, C. et al. Toward an AIDS vaccine: lessons from natural simian immunodeficiency virus infections of African nonhuman primate hosts. Nat. Med., 2009, 15, 8, p. 861–865.
74. SZÚ. Roční zprávy o výskytu a šíření HIV/AIDS v ČR, 2010.
75. TIKJOB, G., RUSSEL, M., PETERSEN, C. S., GERSTOFT, J, KOBAYASI, T. Seronegative secondary syphilis in a patient with AIDS: identification of Treponema pallidum in biopsy specimen. J. Am. Acad. Dermatol., 1991, 24, 3, p. 506–508.
76. UNAIDS. UNAIDS report on the global AIDS epidemic, 2010.
77. Unexplained immunodeficiency and opportunistic infections in infants – New York, New Jersey, California. MMWR (Morb Mortal Wkly Rep), 1982, 31, 49, p. 665–667.
78. VANDEWOUDE, S, APETREI, C. Going wild: lessons from naturally occurring T-lymphotropic lentiviruses. Clin. Microbiol. Rev., 2006, 19, 4, p. 728–762.
79. VAŇOUSOVÁ, D., JILICH, D., MACHALA, L., HÓSOVÁ, L., POCK, L., ROZSYPAL, H., STAŇKOVÁ, M., HERCOGOVÁ, J. Úskalí diagnostiky Kaposiho sarkomu sdruženého s HIV infekcí. Klin. Onkol., 2010, 23, 5, s. 285–292.
80. VEAZEY, R. S., DEMARIA, M., CHALIFOUX, L. V. et al. Gastrointestinal tract as a major site of CD4+ T cell depletion and viral replication in SIV infection. Science, 1998, 280, p. 427–431.
81. WALKER, B. D., KORBER, B. T. Immune control of HIV: the obstacles of HLA and viral diversity. Nat. Immunol., 2001, 2, 6, p. 473–475.
82. WOROBEY, M., GEMMEL, M., TEUWEN, D. E. et al. Direct evidence of extensive diversity of HIV-1 in Kinshasa by 1960. Nature, 2008, 455, p. 661–664.
83. WYATT, R., SODROSKI, J. The HIV-1 envelope glycoproteins: fusogens, antigens, and immunogens. Science, 1998, 280, p. 1884–1888.
84. ZHU, T., KORBER, B. T., NAHMIAS, A. J., HOOPER, E., SHARP, P. M., HO, D. D. An African HIV-1 sequence from 1959 and implications for the origin of the epidemic. Nature, 1998, 391, p. 594–597.
Labels
Dermatology & STDs Paediatric dermatology & STDsArticle was published in
Czech-Slovak Dermatology

2011 Issue 2
Most read in this issue
- HIV infection – History, Pathogenesis and Clinical Manifestations
- Generalized Drug Eruption Following Iomeprol Coronarography
- Genetics of Atopic Dermatitis
- Môže Scedosporium apiospermum spôsobiť onychomykózu?
