Liekové hypersenzitívne reakcie: klasifikácia a patogenéza (1. časť)
Drug Hypersensitivity Reactions: Classification and Pathogenesis (Part 1)
Drug hypersensitivity reactions (DHRs) represent 15% of all adverse drug reactions. Various mechanisms, resulting in miscellaneous clinical pictures, are involved in the genesis of these reactions. DHRs can be classified by different classifications based e. g. on the timing of the symptoms appearance or types of immune mechanisms.
Currently increasingly used classification is based on the mode of action of drugs leading to immune/inflammatory cell stimulation. We recognize three kinds of DHRs according to the mechanism of cell stimmulation: allergic reaction mediated by hapten-carrier complex, reaction triggered by pharmacological interaction of the drug with immune receptors and pseudo-allergic reaction, in which drug stimulates or inhibits receptors or enzymes of inflammatory cells.
None of these classifications is ideal and is not able to explain or to link to the nature of the disease, pathomechanisms, clinical pictures, cross-reactivity or optimal treatments, because the interactions between the drug and the immune system are far more complex than previously anticipated. Except for the classification and pathogenesis of DHRs, clinical presentations and variabilities of immediate-type hypersensitivity reactions and delayed-type hypersensitivity reactions are mentioned in this article, including DRESS (Drug Reaction with Eosinophilia and Systemic Symptoms), SJS (Stevens - Johnson syndrome), TEN (Toxic Epidermal Necrolysis) and AGEP (Acute Generalized Exanthematous Pustulosis) and the most common culprit drugs. DHRs are an important public health issue due to their potential risk of life-threatening anaphylaxis and severe cutaneous adverse reactions.
Keywords:
clinical picture – classification – drug hypersensitivity – allergic reaction – non-allergic reaction – p-i concept
Authors:
J. Nemšovská
Authors‘ workplace:
Dermatovenerologická klinika LF UK a UNB, Bratislava, prednostka prof. MUDr. Mária Šimaljaková, PhD., MPH, MHA
Published in:
Čes-slov Derm, 94, 2019, No. 3, p. 99-106
Category:
Reviews (Continuing Medical Education)
Overview
Liekové hypersenzitívne reakcie (DHRs; Drug hypersensitivity reactions) predstavujú 15 % všetkých nežiaducich účinkov liekov. Pri ich vzniku sa uplatňujú rôzne mechanizmy, ktoré vedú k rozmanitým klinickým obrazom. DHRs sa môžu deliť podľa rôznych klasifikácií, napr. podľa času nástupu symptómov alebo podľa účasti imunitných mechanizmov. V súčasnosti sa do popredia dostáva delenie podľa spôsobu, akým dochádza k stimulácii imunitných a zápalových buniek. Podľa mechanizmu aktivácie buniek rozlišujeme 3 typy DHRs: alergickú reakciu spúšťanú komplexom haptén-nosič, reakciu založenú na farmakologickej interakcii lieku s imunitnými receptormi buniek a pseudoalergickú reakciu vznikajúcu v dôsledku stimulácie alebo inhibície receptorov a enzýmov zápalových buniek. Žiadna z uvedených klasifikácií nie je ideálna, nevysvetľuje a ani nevedie k podstate ochorenia, patomechanizmu, klinickému obrazu, skríženej reaktivite ani k optimálnej liečbe, lebo interakcie medzi liekom a imunitným systémom sú omnoho zložitejšie a komplexnejšie, ako sa doteraz predpokladalo. Okrem klasifikácie a patogenézy je v článku uvedený aj klinický obraz a variabilita liekových hypersenzitívnych reakcií skorých a neskorých, zahŕňajúcich DRESS (Drug Reaction with Eosinophilia and Systemic Symptoms/), SJS (Stevens-Johnsonov syndróm), TEN (toxickú epidermálnu nekrolýzu) a AGEP (akútnu generalizovanú exantematóznu pustulózu), spolu s uvedením najčastejších príčinných liekov. DHRs sú vzhľadom na potenciálne riziko vzniku život ohrozujúcej anafylaxie či ťažkých kožných nežiaducich reakcií vážnym medicínskym problémom.
Klíčová slova:
hypersenzitivita na lieky – klasifikácia – alergické reakcie – nealergické reakcie – p-i koncept – klinický obraz
ÚVOD DO PROBLEMATIKY
Liekové hypersenzitívne reakcie (Drug hypersensitivity rections; DHRs) patria do veľkej skupiny nežiaducich účinkov liekov (NÚL). Frekvencia výskytu DHRs sa za posledných desať rokov zvýšila a v súčasnosti predstavujú 15 % všetkých NÚL [3, 26]. Pri ich vzniku sa uplatňujú rôzne mechanizmy, ktoré vedú k rozmanitým klinickým obrazom v rôznom časovom odstupe od podania lieku. Významnou mierou ovplyvňujú morbiditu a mortalitu populácie a sú vážnym medicínskym aj ekonomickým problémom.
KLASIFIKÁCIA LIEKOVÝCH HYPERSENZITÍVNYCH REAKCIÍ
DHRs tvoria klinicky a funkčne heterogénnu skupinu reakcií, ktoré sa môžu deliť podľa rôznych klasifikácií. Podľa času nástupu symptómov rozlišujeme reakcie skoré, ktoré sa prejavia do 1 hodiny a neskoré, s objavením sa príznakov po 1 hodine od aplikácie lieku. Podľa účasti imunitných mechanizmov ich delíme na alergické a nealergické, v prípade alergických reakcií na reakcie sprostredkované protilátkami a reakcie sprostredkované bunkami, alebo sa využíva klasické delenie reakcií podľa Coombsa a Gella. Podľa závažnosti priebehu môžeme DHRs deliť na reakcie mierne a reakcie závažné, život ohrozujúce, medzi ktoré patrí anafylaktický šok a ťažké kožné nežiaduce reakcie (SCARs; Severe cutaneous adverse reactions) s prípadným orgánovým postihnutím. V súčasnosti sa do popredia dostáva delenie podľa spôsobu, akým dochádza k stimulácii imunitných alebo zápalových buniek. Podľa mechanizmu aktivácie buniek rozlišujeme 3 typy DHRs: alergickú reakciu spúšťanú komplexom haptén-nosič, reakciu založenú na farmakologickej interakcii lieku s imunitnými receptormi buniek a pseudoalergickú reakciu vznikajúcu v dôsledku stimulácie alebo inhibície receptorov a enzýmov zápalových buniek. Žiadna z uvedených klasifikácií nie je ideálna, nevysvetľuje a ani nevedie k podstate ochorenia, patomechanizmu, klinickému obrazu, skríženej reaktivite ani k optimálnej liečbe, lebo interakcie medzi liekom a imunitným systémom sú omnoho zložitejšie a komplexnejšie ako sa doteraz predpokladalo [21, 23].
Liekové hypersenzitívne reakcie alergického typu
DHR alergického typu, označovaná aj ako reakcia typu haptén-nosič, prípadne haptén-proteín, predstavuje skutočnú liekovú alergickú reakciu. Lieky nie sú dostatočne veľké na vyvolanie imunitnej odpovede. Aby mohla malá molekula, tzv. haptén, vyvolať imunitnú odpoveď, musí byť kovalentne naviazaná na endogénny proteínový nosič, za vzniku nového antigénu (komplex haptén-nosič). Niektoré lieky vystupujú ako prohaptény, molekuly, ktoré sú schopné kovalentnej väzby s proteínom až po predchádzajúcom spracovaní, ktoré vedie k vzniku reaktívneho metabolitu [7].
Nový antigén stimuluje bunky nešpecifickej aj špecifickej imunity. Aktivácia buniek nešpecifickej imunity, ako sú napr. bunky prezentujúce antigén, vedie k indukcii expresie CD40 a iných kostimulačných molekúl na povrchu týchto buniek. K aktivácii dochádza priamou interakciou lieku s receptormi rozpoznávajúcimi patogény (Pattern recognition receptors; PRRs) alebo prostredníctvom indukcie endogénneho aktivátora. Kovalentná väzba hapténu s proteínovým nosičom zabezpečí jeho stabilitu počas intracelulárneho spracovania bunkami prezentujúcimi antigén. Výsledkom spracovania sú malé peptidy, ktoré sú prezentované špecifickým receptorom T lymfocytov (TCR; špecifický receptor T lymfocytu pre antigén) prostredníctvom HLA molekúl. Malé peptidy vznikajúce spracovaním konkrétneho alergénu (komplexu haptén-nosič) predstavujú zmes rôznych konjugátov haptén-peptid, ktoré sa môžu viazať na rôzne HLA molekuly. Výsledná imunitná odpoveď aktivovaná haptén--nosič komplexom tak nie je viazaná len na jeden typ HLA molekuly, ako je to napr. pri reakciách založených na farmakologickej interakcii lieku s imunitnými receptormi buniek (viď nižšie). Komplex haptén-nosič stimuluje ako odpoveď vrodenú, tak aj odpoveď adaptívnu, sprostredkovanú špecifickými receptormi T a B lymfocytov a vedie k rozvoju komplexnej imunitnej odpovede, súčasťou ktorej môže byť tvorba protilátok, cytotoxické reakcie, tvorba a uvoľňovanie cytokínov a aktivácia zápalových buniek [24].
Alergické reakcie prebiehajú v dvoch fázach, senzibilizačnej a elicitačnej. Prvá fáza je bezpríznaková a trvá priemerne 7–25 dní. Symptómy sa objavujú až pri opätovnom kontakte pacienta s príčinným liekom, pričom množstvo alergénu potrebného pre vznik symptómov v elicitačnej fáze je podstatne nižšie ako množstvo potrebné k senzibilizácii pacienta. Lieky môžu viesť k akémukoľvek zo štyroch typov reakcií podľa klasifikácie Coombsa a Gella, ale v praxi sa najčastejšie stretávame s I. a IV. typom [21].
Skoré reakcie I. typu sú sprostredkované IgE proti-látkami, ktoré sa tvoria počas senzibilizačnej fázy a následne sa viažu prostredníctvom vysoko afinitného Fc receptora na povrch mastocytov a bazofilných leukocytov. Kontakt protilátok so zodpovedajúcim antigénom (alergénom) vedie k degranulácii buniek a k uvoľneniu preformovaných a následnej syntéze novo-vytvorených mediátorov. Rozlišujeme dve formy degranulácie. Tzv. postupná degranulácia je charakterizovaná tvorbou malých vezikúl vznikajúcich zo sekrečných granúl obsahujúcich mediátory, ktoré sa rýchlo premiestňujú k plazmatickej membráne. Je sprevádzaná expresiou aktivačných molekúl CD203c na povrchu aktivovaných buniek. Počas anafylaktickej degranulácie dochádza k fúzii celých sekrečných granúl s plazmatickou membránou buniek a k uvoľneniu ich obsahu do extracelulárneho priestoru. Je sprevádzaná expresiou CD63 molekúl na povrchu buniek [18]. U senzibilizovaného pacienta sa v klinickom obraze, ktorý sa rozvíja do 6 hodín od opätovného podania lieku, môže objaviť svrbenie, urtikária, angioedém, bronchospazmus, v najzávažnejších prípadoch anafylaktický šok [25].
Neskoré reakcie IV. typu sú sprostredkované T lym-focytmi a podľa typu zúčastnených cytokínov, cyto-toxických mediátorov a bunkových subtypov rozli-šujeme v súčasnosti 4 podtypy reakcií. Pri podtype IV. a sa v patomechanizme uplatňujú Th1 lymfocyty, monocyty a makrofágy, z cytokínov je to IFN-γ a TNF-α. Symptómy, ktorých podkladom je monocytový zápal, vznikajú u senzibilizovaného pacienta 1–21 dní od začiatku podávania lieku. Príkladom je tuberkulínová reakcia alebo alergická kontaktná dermatitída (v kombinácii s podtypom IV. c) [21].
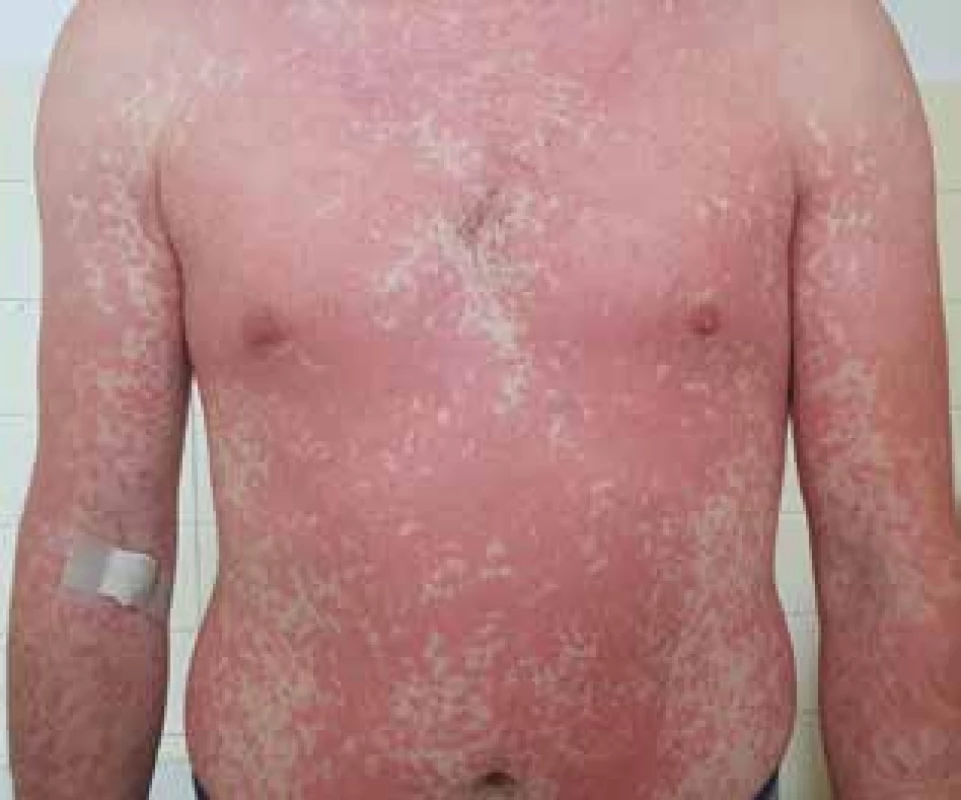
Pri podtype IV. b vedie sekrécia IL-4, IL-5 a IL-13 Th2 lymfocytmi k eozinofilnému zápalu. V klinickom obraze senzibilizovaného pacienta vzniká makulopapulózny exantém jeden a viac dní (1–14) od začiatku užívania lieku a v prípade liekmi vyvolaného hypersenzitívneho syndrómu s eozinofíliou (DRESS; Drug Reaction with Eosinophilia and Systemic Symptoms) sa symptómy objavia 2–6 týždňov od nasadenia lieku (obr. 1, 2) [21, 26].

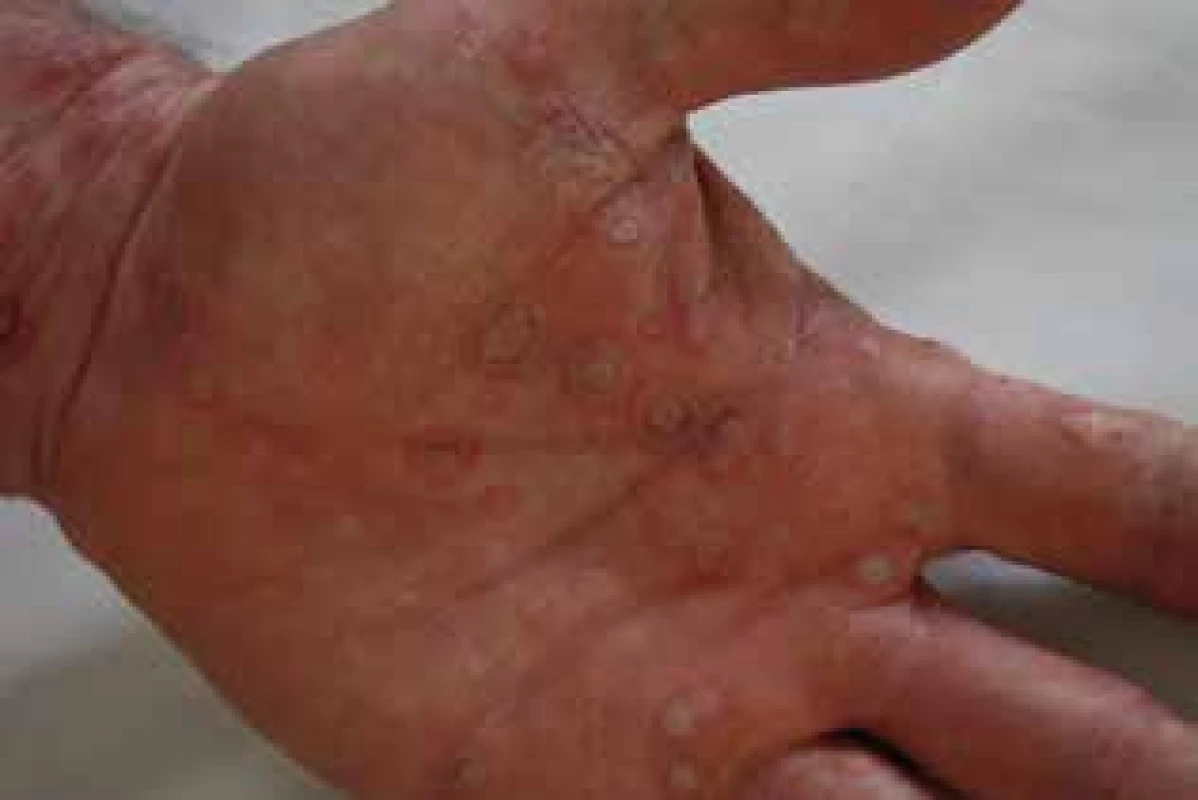
Pri podtype IV. c sa uplatňujú cytotoxické T lymfocyty, ktoré prostredníctvom perforínu, granzýmu B, granulyzínu alebo interakcie medzi FasL (Fas ligand, transmembránový proteín) a Fas (receptor pre FasL) vedú k apoptóze keratinocytov. Príkladom je fixný liekový exantém, ktorý môže u senzibilizovaného pacienta vzniknúť 1–2 dni od začatia liečby, v prípade Stevens-Johnsonovho syndrómu (SJS) alebo toxickej epidermálnej nekrolýzy (TEN) je to 4–28 dní od začiatku terapie (obr. 3). Granulyzín, cytolytický proteín, produkovaný cytotoxickými T lymfocytmi a NK (Natural Killers) bunkami, sa ukazuje byť kľúčovou cytotoxickou molekulou zodpovednou za diseminovanú nekrózu keratinocytov. K deštrukcii cieľovej bunky vedie vytvorením dier v bunečnej membráne. Je dokázaná signifikantná korelácia medzi množstvom granulyzínu v tekutine vezikúl a závažnosťou priebehu SJS a TEN, ako aj jeho zvýšená hladina v sére pacientov pred objavením sa kožných symptómov [10]. IV. c podtyp sa spolupodieľa aj na vzniku alergickej kontaktnej dermatitídy.
Pri podtype IV. d T lymfocyty produkujú CXCL8 (označovaný aj ako IL-8, zodpovedný za chemotaxiu neutrofilov) a GM-CSF (faktor stimulujúci granulocytové a makrofágové kolónie), ktoré vedú k neutrofilnému zápalu a k rozvoju akútnej generalizovanej exantematóznej pustulózy (AGEP), 1–12 dní od pridania lieku do terapie senzibilizovaného pacienta [21, 26].
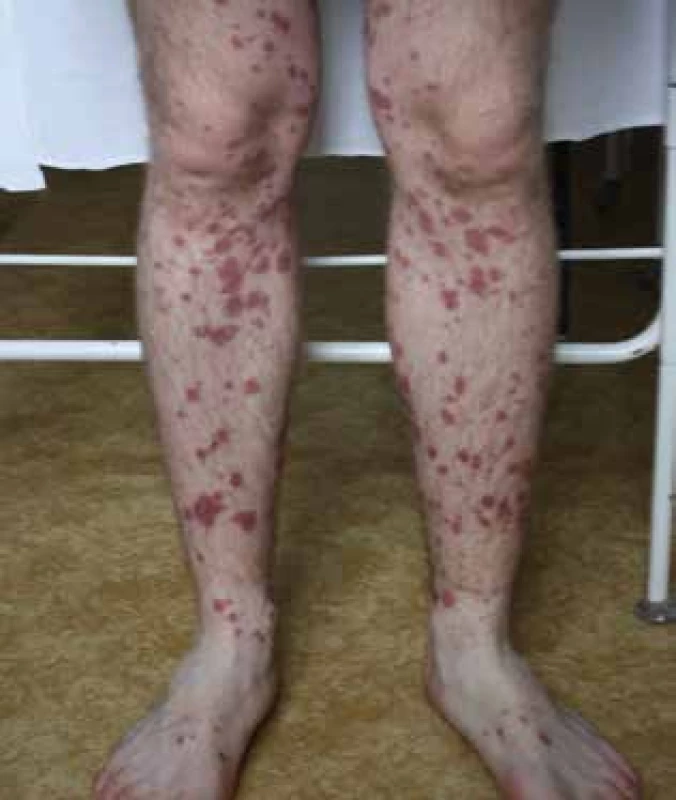
S II. a III. typom hypersenzitívnych reakcií sa v praxi stretávame oveľa zriedkavejšie. Reakcie môžu byť sprostredkované IgG a IgM protilátkami alebo aktiváciou komplementu. Pri II. type sa rozvíja na protilátkach závislá cytotoxicita, ktorá vedie u senzibilizovaných pacientov k cytopéniam (anémii, leukopénii, trombocytopénii) 5–15 dní od začatia liečby. V klinickom obraze III. typu reakcií sa v dôsledku vzniku a ukladania imunokomplexov môže v elicitačnej fáze objaviť sérová choroba alebo oneskorená urtikária 1–8 dní od začatia liečby, prípadne vaskulitída alebo Artushova reakcia 1–21 dní od opätovného pridania lieku v liečbe (obr. 4) [2, 15, 21].
Liekové hypersenzitívne reakcie nealergického typu
Všetky ostatné reakcie, pri ktorých liek nevedie ku komplexnej imunitnej odpovedi a prejavy vznikajú v dôsledku farmakokinetiky lieku, radíme medzi hypersenzitívne reakcie nealergického typu, označované aj ako reakcie anafylaktoidné [5]. V posledných rokoch sa táto skupina ochorení zvykne deliť na reakcie založené na farmakologickej interakcii lieku s imunitnými receptormi buniek, ako sú HLA alebo TCR, tzv. p-i koncept (pharmacological interaction with immune receptor) a reakcie, pri ktorých sú zápalové bunky stimulované priamou interakciou lieku s receptormi alebo enzýmami týchto buniek, tzv. pseudoalergické reakcie [23].
Pri p-i reakciách sa niektoré lieky priamo reverzibilne viažu na imunitné receptory buniek. Ide o nekovalentné väzby typu van der Waalsových síl, vodíkových väzieb či elektrostatických interakcií, preto na vyvolanie tohto typu reakcií musí byť príčinný liek, prípadne jeho metabolit, naviazaný na správnu časť TCR alebo HLA. Napríklad sulfametoxazol sa môže priamo viazať na CDR3 región TCR, ktorý je zodpovedný za interakciu s komplexom peptid-HLA, prípadne sa môže naviazať na CDR2 región TCR a viesť k jeho alogénnej alterácii. Následná zmena štruktúry TCR tak môže zvýšiť jeho afinitu k určitým komplexom peptid-HLA [30]. V prípade väzby lieku na HLA molekulu môže dôjsť k zmene samotnej HLA, ktorá nadobudne charakter cudzej HLA, čo vedie k imunitnej odpovedi podobnej reakcii štepu proti hostiteľovi, alebo väzba lieku mení špecificitu väzbového potenciálu HLA [11].
Každý jedinec má viac 1011 rôznych TCR a v ľudskej populácii sa vyskytuje viac ako 10 000 odlišných alel HLA I. triedy a viac ako 3000 alel HLA II. triedy, čo vedie k predpokladu relatívne vysokej pravdepodob-nosti stimulácie buniek liekmi práve touto cestou. Pre p-i reakcie je typická indukcia T-bunkovej reakcie, ale bez liekmi indukovanej B-bunkovej reakcie. Následkom stimulácie T lymfocytov dochádza k sekrécii typických cytokínov alebo k bunkami sprostredkovanej cytotoxicite [22]. V klinickom obraze môžu tieto reakcie viesť k makulopapulóznym prejavom, liekmi indukovanému poškodeniu pečene, AGEP, SJS, TEN a DRESS.
Riziko výskytu tohto typu reakcií stúpa u pacientov, ktorí sú nositeľmi určitých rizikových alel a početné štúdie potvrdili silnú asociáciu medzi niektorými HLA alelami a vznikom závažných liekových hypersenzitívnych reakcií indukovaných abakavirom, karbamazepínom a alopurinolom. Alela HLA-B*57 : 01 je u väčšiny etnických populácií asociovaná s výskytom DRESS, po zahájení liečby abakavirom. Pri HLA-B*15 : 02 je v ázijskej populácii pozorovaná silná asociácia so vznikom SJS alebo TEN pri užívaní karbamazepínu. V ázijskej a kaukazskej populácii sa HLA-B*58 : 01 alela spája s výskytom DRESS, či výskytom SJS alebo TEN, po zahájení liečby alopurinolom [20, 21, 28].
Pseudoalergické reakcie majú v klinickom obraze symptómy veľmi podobné symptómom vzniknutým pri alergických reakciách, ale k ich vzniku nie je potrebná predchádzajúca senzibilizácia s následnou tvorbou protilátok špecifických pre alergén alebo tvorbou senzibilizovaných T lymfocytov. Symptómy sú indukované priamou stimuláciou alebo inhibíciou receptorov a enzýmov zápalových buniek liekmi. Patomechanizmus reakcií je tak veľmi heterogénny a klinický obraz závisí od typu aktivovaných buniek. Aktivácia mastocytov vedie k urtikárii, angioedému alebo anafylaxii, aktivácia eozinofilov k akútnemu astmatickému ataku alebo rinitíde. Frekvencia výskytu pseudoalergických reakcií je minimálne taká častá, ako frekvencia výskytu reakcií sprostredkovaných IgE protilátkami [21, 23].
Medzi lieky, ktoré sú najčastejšie zodpovedné za vznik tohto typu reakcií patria nesteroidové antireumatiká (NSAIDs; Nonsteroidal anti-inflammatory drugs). Pri týchto liekoch sú pseudoalergické reakcie spôsobené inhibíciou cyklooxygenázy 1, čo vedie k zmenám v metabolizme kyseliny arachidónovej, k zníženej produkcii prostaglandínov a k zvýšenej syntéze leukotriénov [19]. U pacientov s už existujúcim eozinofilným zápalom, ako je chronická rinosinusitída, bronchiálna astma alebo chronická spontánna urtikária, môžu nesteroidové antireumatiká zvýrazniť zápal a viesť k exacerbácii týchto ochorení. Tieto pseudoalergické reakcie sa delia na reakcie s kožnými symptómami a reakcie s respiračnými symptómami. Reakcie s kožnými symptómami typu urtikárie alebo angioedému delíme na dve podskupiny. Do prvej podskupiny patria pacienti so známou anamnézou urtikárie alebo angioedému, kde NSAID vedú k exacerbácii ochorenia tzv. NECD (NSAID-exacerbated cutaneous disease). Druhú podskupinu tvoria reakcie, pri ktorých NSAID indukujú urtikáriu alebo angioedém u pacientov bez predchádzajúcich ťažkostí, ide o reakcie typu NIUA (NSAID-induced urticaria/angioedema). Je pozorované, že u mnohých pacientov s týmto typom hypersenzitívnej reakcie sa v budúcnosti objaví chronická urtikária [32]. Reakcie s respiračnými symptómami vznikajú u pacientov s pre-existujúcim respiračným ochorením na podklade eozinofilného zápalu, najčastejšie chronickou rinosinusitídou, bronchiálnou astmou, príp. nosovými polypmi, kde NSAID vedú k exacerbácii ochorenia. Medzi najčastejšie klinické prejavy NERD (NSAID-exacerbated respiratory disease) patrí rinorea, obturácia nosovej sliznice a bronchospazmus [1, 15]. Je zaujímavé, že na vyvolanie symptómov u pacientov s NERD stačia signifikantne nižšie dávky NSAID ako u pacientov s NECD a NIUA, napr. 30 mg acetylosalicylovej kyseliny u pacientov s NERD v porovnaní s 500 mg acetylosalicylovej kyseliny u pacientov s NECD a NIUA [32].
Mnohé ďalšie lieky, ako kontrastné látky, myorelaxanciá, chinolóny alebo vankomycín, napriek tomu, že nezasahujú do metabolizmu prostaglandínov, vedú k vzniku pseudoalergických reakcií. Mechanizmus priamej degranulácie mastocytov a bazofilných leukocytov je pri vankomycíne spúšťaný prostredníctvom od kalcia závislej aktivácie fosfolipázy C a fosfolipázy A2 [9]. Účinok ďalších liekov môže byť sprostredkovaný cez mastocytový receptor MRGPRX2 (MAS-related G protein-coupled receptor-X2), ktorý, ako sa ukazuje, má rozhodujúci význam pri priamej, na protilátkach IgE nezávislej, stimulácii mastocytov [16]. Väčšina pseudoalergických reakcií je mierna, typu akútnej urtikárie, zriedkavejšie môžu symptómy vyústiť do celkovej anafylaktoidnej reakcie, ktorá môže byť fatálna. Klinický obraz a liečba anafylaktických a anafylaktoidných reakcií je rovnaká, rozdielny je mechanizmus, ktorý vedie k degranulácii buniek. Rozdiely sú aj v skríženej reaktivite medzi liekmi a v preventívnych postupoch medzi oboma typmi reakcií. Pseudoalergické reakcie sú nepredvídateľné, dávkovo závislé a môžu sa objaviť už po prvom podaní lieku [24].
KLINICKÝ OBRAZ A VARIABILITA LIEKOVÝCH HYPERSENZITÍVNYCH REAKCIÍ
Skoré reakcie sa objavujú v priebehu niekoľkých minút, maximálne hodín po expozícii lieku. V klinickom obraze môže byť prítomné svrbenie, urtikária, angio-edém, bronchospazmus, v najzávažnejších prípadoch anafylatický šok. Medzi skoré reakcie patria reakcie imuno-logické, ktoré môžu byť sprostredkované IgE protilátkami alebo iným typom protilátok a neimunologické reakcie. Incidencia skorých DHRs sa udáva medzi 0,04 a 3,1 %. Najčastejšou príčinou skorých DHRs sú NSAIDs a beta-laktámové antibiotiká [9]. Za relatívne často sa vyskytujúce reakcie vznikajúce pri úvode do celkovej anestézie bývajú zodpovedné myorelaxanciá, celkové anestetiká a antibiotiká [12].
NSAIDs môžu byť príčinou imunologických, ale oveľa častejšie neimunologických reakcií. Podľa posledných odporučení Európskej akadémie pre alergológiu a klinickú imunológiu (EAACI; European Academy of Allergy and Clinical Academy) medzi nealergické reakcie, označované aj ako hypersenzitívne reakcie so skríženou reaktivitou, patria vyššie opísané reakcie NERD (NSAID-exacerbated respiratory disease), NECD (NSAID-exacerbated cutaneous disease), NIUA (NSAID-induced urticaria/angioedema). Skrížená reaktivita medzi jednotlivými NSAIDs nie je v prípade tohto typu reakcií spôsobená rovnakou štruktúrou liekov ale rovnakým mechanizmom účinku, a to inhibíciou cyklooxygenázy 1. Druhú skupinu tvoria imunologické reakcie, tzv. reakcie bez skríženej reaktivity, ktoré zahŕňajú reakciu spúšťanú IgE protilátkami SNIUAA (single NSAID-induced urticaria/angioedema or anaphylaxis) a T bunkami spúšťanú reakciu SNIDR (single NSAID-induced delayed reaction), ktorá patrí medzi neskoré reakcie. Reakcia typu SNIUAA je najzriedkavejším typom hypersenzitívnej reakcie vyvolanej NSAID a najčastejším príčinným liekom je metamizol a deriváty kyseliny propiónovej: ibuprofen, ketoprofen a naproxen. V klinickom obraze SNIDR sa zväčša stretávame s makulopapulóznym exantémom a fixnou liekovou erupciou, v prípade lokálnej aplikácie liekov s kontaktným ekzémom. Život ohrozujúce ťažké kožné nežiaduce reakcie sa vyskytujú zriedkavo. Skrížená reaktivita medzi jednotlivými NSAIDs je pri imunologických reakciách založená na rovnakej alebo podobnej štruktúre lieku, preto v prípade alergickej reakcie na konkrétne NSAID bývajú vo všeobecnosti ostatné NSAIDs dobre tolerované [32].
Skoré imunologické reakcie nemediované IgE protilátkami bývajú spúšťané IgG protilátkami alebo aktiváciou komplementu. Patomechanizmus tohto typu reakcií nie je doteraz plne objasnený, ale ukazuje sa, že najdôležitejším mediátorom v prípade reakcií mediovaných IgG protilátkami je PAF (Plateled activating factor) a príkladom sú reakcie vyvolané niektorými biologikami alebo aplikáciou intravenóznych imunoglobulínov. Reakcie spúšťané aktiváciou komplementu sú pozorované napr. u hemodialyzovaných pacientov pri použití novej dialyzačnej membrány. Aktivácia komplementu zohráva úlohu aj v patomechanizme reakcií vyvolaných podaním infúzie dextranu [18].
Ako ukazujú posledné výskumy a práce, aj v prípade skorých DHRs môžu zohrávať úlohu genetické faktory. Bola napr. opísaná asociácia medzi skorými reakciami vyvolanými beta-laktámovými antibiotikami a polymorfizmom génov prozápalových cytokínov (IL-4, IL-13, IL-10, IL-18, TNF), NOD (nucleotide-binding oligomerization domain), cytokínového receptora IL-4R, či niektorých génov HLA II. triedy (HLA-DRA) [8, 17].
Neskoré reakcie vznikajú ako prejav bunkami sprostredkovanej alergie alebo sú založené na farmakologickej interakcii lieku s imunitnými receptormi buniek. Objavujú sa po niekoľkých hodinách, častejšie však po viacerých dňoch až týždňoch od podania lieku. Symptómy neskorých reakcií varírujú od miernych makulopapulóznych prejavov, kontaktnej dermatitídy, fixného liekového exantému, cez orgánové postihnutie ako je bronchiálna astma, nefritída, hepatitída, až po život ohrozujúce ťažké kožné nežiaduce reakcie (SCAR; severe cutaneous adverse reactions). Medzi SCAR patrí DRESS, SJS, TEN, AGEP.
DRESS (Drug Reaction with Eosinophilia and Systemic Symptoms) syndróm je vážne, potenciálne život ohrozujúce ochorenie, charakterizované kožnými prejavmi, hematologickými abnormalitami, lymfadenopatiou a orgánovým postihnutím. Mortalita sa pohybuje okolo 10 %. Ochorenie je známe aj pod názvom DIHS (Drug--Induced Hypersensitivity Syndrome), prípadne sa zvykne označovať podľa príčinného lieku. Podľa väčšiny autorov v prípade DRESS a DIHS ide o synonymá, pomenúvajúce rovnaké ochorenie. Japonskí autori opisujú DIHS ako závažnejšiu formu DRESS syndrómu s typickou reaktiváciou HHV-6 (Human herpesvirus-6) [29]. Medzi najčastejšie príčinné lieky patria aromatické antiepileptiká (karbamazepín, fenytoín), alopurinol, antivirotiká (abakavir), sulfonamidy a sulfóny. Symptómy ochorenia sa objavujú 2–6 týždňov od nasadenia lieku. Patrí k nim zvýšená teplota (> 38 ˚C), makulózny, najčastej-šie morbiliformný, neskôr makulopapulózny výsev začínajúci na tvári, ktorý sa šíri kaudálne, s možnosťou prechodu do erytrodermie alebo exfoliatívnej dermatitídy s postihnutím slizníc. Opuchy bývajú prítomné najmä na tvári [14]. Z orgánov je najčastejšie postihnutá pečeň (51–84 % pacientov) a obličky (10–57 % pacientov). Pľúca sú tretím najfrekventovanejšie postihnutým orgánom (5–25 % pacientov) a poškodenie prebieha pod obrazom intersticiálnej pneumónie, pleuritídy až akútneho respiračného distres syndrómu. Laboratórne nálezy odpovedajúce postihnutiu jednotlivých orgánov sa kombinujú so špecifickými hematologickými abnormalitami. Typická je výrazná leukocytóza s eozinofíliou a prítomnosťou atypických lymfocytov (> 5 %). Pre ochorenie je charakteristická lymfadenopatia, vyžadujúca odlíšenie tohto pseudolymfómu od skutočného malígneho lymfómu [13].
SJS (Stevens-Johnsonov syndróm) a TEN (toxická epidermálna nekrolýza) sa objavujú väčšinou 4–28 dní od zahájenia liečby. Na rozdiel od DRESS/DIHS je pre SJS a TEN charakteristické závažnejšie postihnutie slizníc, v krvnom obraze nie je prítomná eozinofília ani atypické leukocyty. SJS je charakterizovaný výsevom atypických terčovitých prejavov s centrálnym pľuzgierom alebo eróziou, ktoré sú lokalizované primárne na trupe. Ochorenie nepresahuje 10 % telesného povrchu. Typicky sú postihnuté sliznice a môžu byť prítomné celkové prejavy ako teplota, bolesti kĺbov a svalov, orgánové komplikácie sú zriedkavé. TEN je najťažšou formou s plošným cárovitým odlučovaním epidermy a postihnutých slizníc, pričom prejavy postihujú viac ako 30 % telesného povrchu. Celkový stav je ťažký, komplikovaný možným vznikom glomerulonefritídy, pneumónie či hepatitídy. Tzv. prechodný stav medzi SJS a TEN (SJS/TEN) označuje ochorenie s rozsahom 10–29 % telesného povrchu [27]. Mortalita ochorenia je vo všeobecnosti okolo 25 %, pri SJS je to 10 %, pri SJS/TEN 30 % a pri TEN až 50 % [9]. Medzi najčastejšie príčinné lieky patria sulfonamidy, aromatické antikonvulzíva, alopurinol a oxikamové NSAIDs. Z novších prípravkov sú to niektoré lieky používané v cielenej protinádorovej terapii (nivolumab, ipilimumab) [4].
Incidencia AGEP (akútnej generalizovanej exantematóznej pustulózy) je 1–5 prípadov na milión a mortalita je okolo 4 %. Ochorenie vzniká najčastejšie v súvislosti s užívaním aminopenicilínov, chinolónov, antimalarík a terbinafínu, 1–3 (maximálne 12) dni od ich nasadenia do liečby [9]. Pre klinický obraz je charakteristický náhly výsev drobných sterilných pustúl na erytematóznom a mierne edematóznom podklade. Prvé prejavy bývajú lokalizované v axilárnej a inguinálnej oblasti odkiaľ sa rýchlo šíria na trup a končatiny. Pustuly nie sú viazané na folikuly. Postihnutie vnútorných orgánov je vzácne, v krvnom obraze je prítomná neutrofília, slizničné prejavy bývajú v 20–25 %. Ochorenie môže byť sprevádzané teplotou a malátnosťou [6].
V patogenéze DHRs môžu okrem genetických faktorov zohrávať úlohu aj environmentálne faktory a vírusové infekcie. Je známe, že ľudský herpes vírus typu 6 (HHV-6; Human herpesvirus-6) je asociovaný s DRESS/DIHS. Reaktivácia HHV-6 u pacientov s DRESS/DIHS môže zvýšiť T-bunkovú aktivitu iniciovanú liekovou erupciou a viesť k syntéze prozápalových cytokínov, zahŕňajúcich TNF-α a IL-6, čo naopak môže modifikovať priebeh T-bunkami spúšťanej odpovede [9]. Pri reakciách založených na farmakologickej interakcii lieku s imunitným receptorom môžu niektoré vírusové infekcie ako EBV, CMV či HIV znížením aktivačného prahu T lymfocytov viesť k preaktivácii a uľahčiť tým ich následnú aktiváciu. Navyše, vírusy môžu byť zdrojom exogénnych peptidov, ktoré sa môžu uplatňovať pri prezentácii alergénu a ovplyvňovať interakcie medzi HLA, TCR a liekom [31]. Medzi známe kofaktory DHRs patrí aj stres, námaha, konzumácia alkoholu či expozícia UV žiareniu [2].
POROVNANIE JEDNOTLIVÝCH TYPOV LIEKOVÝCH HYPERSENZITÍVNYCH REAKCIÍ
Porovnaním imunitných odpovedí organizmu v rámci jednotlivých typov DHRs je zrejmé, že skutočnú liekovú alergickú reakciu predstavujú reakcie alergického typu, s tvorbou nového antigénu, ktorý vedie k rozvoju komplexnej imunitnej odpovede. P-i reakcie sú založené na priamej interakcii lieku alebo jeho metabolitu s imunitnými receptormi buniek, ktorá indukuje T-bunkovú reakciu ale bez B-bunkovej reakcie. Pseudoalergické reakcie vznikajú v dôsledku stimulácie alebo inhibície receptorov a enzýmov zápalových buniek. Pri reakciách nealergického typu zohrávajú hlavnú úlohu farmakologické vlastnosti lieku spolu s individuálnou predispozíciou pacienta.
Senzibilizácia je nevyhnutná v prípade reakcií alergického typu, na rozdiel od DHRs nealergického typu. Pri reakciách sprostredkovaných IgE protilátkami je senzibilizačná fáza bezpríznaková a symptómy sa objavujú až pri opätovnom kontakte s príčinným liekom. Pri neskorých reakciách sprostredkovaných T-bunkami, v prípade vzniku dostatočného počtu reaktívnych T lymfocytov v koži alebo v iných postihnutých orgánoch, môže elicitačná fáza priamo nasledovať fázu senzibilizačnú. P-i reakcie síce nevyžadujú primárnu senzibilizáciu, ale symptómy ochorenia sa objavujú s určitou latenciou, ktorá je potrebná pre aktiváciu dostatočného počtu T lymfocytov. Pseudoalergické reakcie sa môžu objaviť už pri prvom podaní lieku, pričom nie je potrebná primárna senzibilizácia ani bunková expanzia.
Symptómy reakcií spúšťaných IgE protilátkami sa naj-častejšie objavujú do jednej hodiny od podania lieku, symptómy pseudoalergických reakcií do 6 hodín. Prejavy neskorých reakcií vznikajú po 6 hodinách, častejšie však po viacerých dňoch až týždňoch od podania lieku.
DHRs bývajú označované ako reakcie nezávislé od dávky lieku. Je známe, že na vyvolanie anafylaktickej reakcie stačí veľmi malé množstvo alergénu, a to je podstatne nižšie ako jeho množstvo potrebné na senzibilizáciu pacienta. Napriek faktu, že anafylaktická reakcia sa môže objaviť už po minimálnych dávkach lieku, proces desenzibilizácie jasne poukazuje na skutočnosť, že s úvodnými veľmi nízkymi dávkami lieku môže byť desenzibilizácia v mnohých prípadoch úspešná. Na vyvolanie symptómov anafylaktoidnej reakcie je potrebné väčšie množstvo alergénu v porovnaní s reakciou anafylaktickou. Pri p-i reakciách je rovnako nutná vyššia koncentrácia alergénu, aby sa aktivoval dostatočný počet T lymfocytov a spustila T-bunková odpoveď. Uvedené poukazuje na skutočnosť, že pre vyvolanie DHRs, vrátane anafylaktických reakcií, má dávka lieku rozhodujúci význam a jej zníženie môže pôsobiť preventívne [23].
Pri liekových hypersenzitívnych reakciách sa často stretávame so skríženou reaktivitou. Pri alergických reakciách vzniká na podklade podobnej chemickej štruktúry liekov a ich afinity k zodpovedajúcim imunitným receptorom. Skrížene reagujúce lieky majú vo všeobecnosti nižšiu afinitu k receptorom ako liek, ktorý senzibilizáciu vyvolal. Pri p-i reakciách je skrížená reaktivita závislá na farmakologických vlastnostiach lieku a jeho schopnosti väzby na TCR a HLA receptory. Pri pseudoalergických reakciách sa na receptor MRGPRX2 môže viazať štrukturálne heterogénna skupina liekov so spoločným chemickým motívom. Rovnako aj štrukturálne odlišné NSAIDs môžu viesť k vzniku liekových hypersenzitívnych reakcií a to na podklade ich rovnakého mechanizmu účinku [21].
Prehlásenie o konflikte záujmov
Autor v súvislosti s témou práce v posledných 12 mesiacoch nespolupracoval so žiadnou farmaceutickou firmou.
Do redakce došlo dne 16. 5. 2019.
Adresa pro korespondenci:
MUDr. Jana Nemšovská, MPH, MHA
Dermatovenerologická klinika LF UK a UNB
Mickiewiczova 13
813 69 Bratislava
Slovenská republika
e-mail: jana.nemsovska@sm.unb.sk
Sources
1. BLUMENTHAL, K. G., LAI, K. H., HUANG, M. et al. Adverse and Hypersensitivity Reactions to Prescription Nonsteroidal Anti-Inflammatory Agents in a Large Health Care system. J. Allergy Clin. Immunol. Pract., 2017 Jan 18. pii: S2213-2198(16)30669-9. doi: 10.1016/j.jaip.2016.12.006.
2. BROCKOW, K., PRZYBILLA, B., ABERER, W. et al. Guideline for the diagnosis of drug hypersensitivity reactions. Allergo J. Int., 2015, 24(3), p. 94–105.
3. CASTELLS GUITART, M. C. Rapid drug desensitization for hypersensitivity reactions to chemotherapy and monoclonal antibodies in the 21st century. J. Invesig. Allergol. Clin. Immunol., 2014, 24(2), p. 72–79.
4. DIKA, E., RAVAIOLI, G. M., FANTI, P. A. et al. Cutaneous adverse effects during ipilimumab treatment for metastatic melanoma: a prospective study. Eur. J. Dermatol., 2017, 27(3), p. 266–270.
5. FARNAM, K., CHANG, C., TEUBER, S. et al. Non-allergic drug hypersensitivity reactions. Int. Arch. Allergy Immunol., 2012, 159(4), p. 327–345.
6. FELDMEYER, L., HEIDEMEYER, K., YAWALKER, N. Acute Generalized Exanthematous Pustulosis: Pathogenesis, Genetic, Background, Clinical Variants and Therapy. Int. J. Mol. Sci., 2016, 17(8), p. 1214.
7. GARON, S. L., PAVLOS, R. K., WHITE, K. D. et al. Pharmacogenomics of off-target adverse drug reactions. Br. J. Clin. Pharmacol., 2017, 83(9), p. 1896–1911.
8. GUEANT, J. L., ROMANO, A., CORNEJO-GARCIA, J. A. et al. HLA-DRA variants predict penicillin allergy in genomewide fine-mapping genotyping. J. Allergy Clin. Immunol., 2015, 135(1), p. 253–259.
9. CHEN, CH. B., ABE, R., PAN, R. Y. et al. An Updated review of the Molecular Mechanisms in Drug Hypersensitivity. J. Immunol. Res., 2018, ID 6431694, 22 pages. Dostupné na www: https://doi.org/10.1155/2018/6431694 .
10. CHUNG, W. H., HUNG, S. I., YANG, J. Y. et al. Granulysin is a key mediator for disseminated keratinocyte death in Stevens-Johnson syndrome and toxic epidermal necrolysis. Nat. Med., 2008, 12, p. 1343–1350.
11. ILLING, P. T., VIVIAN, J. P., DUDEK, N. L. et al. Immune self-reactivity triggered by drug-modified HLA-peptide repertoire. Nature, 2012, 484, p. 554–558.
12. IMMATTEO, M., KESKIN, T., JERSCHOW, E. Evaluation of periprocedural hypersensitivity reactions. Ann. Allergy Asthma Immunol., 2017, 119(4), p. 349.e2–355.e2.
13. KARÁSEK, D., VYMĚTAL, J., CIBÍČKOVÁ, L. et al. DRESS syndrom vzniklý při léčbě alopurinolem. Klin. Farmakol. Farm., 2014, 28(4), p. 152–157.
14. KOVÁČOVÁ, S. DIHS – liekmi indukovaný hypersenzitívny syndróm. Dermatol. Prax, 2014, 8(2), p. 40–64.
15. MAYORGA, C., CELIK, G., ROUZAIRE, P. et al. In vitro tests for drug hypersensitivity reactions: an ENDA/EAACI Drug Allergy Interest Group position paper. Allergy, 2016, 71, p, 1103–1134.
16. McNEIL, B. D., PUNDIR, P., MEEKER, S. et al. Identification of a mast-cell-specific receptor crucial for pseudo-allergic drug reactions. Nature, 2015, 519, p. 237–241.
17. MING, L., WEN, Q., QIAO, H. L., DONG, Z. M. Interleukin-18 and IL18-607A/C and – 137G/C gene polymorphisms in patients with penicillin allery. J. Int. Med. Res., 2011, 39(2), p. 388–398.
18. MONTANEZ, M. I., MAYORGA, G., BOGAS, G. et al. Epidemiology, mechanisms, and diagnosis of drug-induced anaphylaxis. Front. Immunol., 2017, 9, p. 614.
19. MUNOZ-CANO, R., OICADO, C., VALERO, A., BARTRA, J. Mechanisms of anaphylaxis beyond IgE. J. Invesig. Allergol. Clin. Immunol., 2016, 26(2), p. 73–82.
20. NEGRINI, S., BECQUEMONT, L. Pharmacogenetics of hypersensitivity drug reactions. Therapie, 2017 Jan 3. pii: S0040-5957(16)31285-9. doi: 10.1016/j.therap.2016.12.009.
21. NEMŠOVSKÁ, J., ŠVECOVÁ, D. Hypersenzitívne reakcie vyvolané liekmi. Dermatol. Prax, 2017, 11(3), p. 112–116.
22. PICHLER, W. J., BEELER, A., KELLER, M. et al. Pharmacological Interaction of Drugs with Immune Receptors: The p-i Concept. Allergol. Int., 2006, 55, p. 17–25.
23. PICHLER, W. J., HAUSMANN, O. Classification of Drug Hypersensitivity into Allergic, p-i, and Pseudo-Allergic Forms. Int. Arch. Allergy Immunol., 2016, 171, p. 166–179.
24. PICHLER, W. J., NAISBIITT, D. J., KEVIN PARK, B. Immune patomechanism of drug hypersensitivity reactions. J. Allergy Clin. Immunol., 2011, 127(3), p. S74–S81.
25. ROMANO, A., TORRES, M. J., CASTELLS, M. et al. Diagnosis and management of drug hypersensitivity reactions. J. Allergy Clin. Immunol., 2011, 127(3), p. S67–S73.
26. SCHERER, K., BROCKOW, K., ABERER, W. Desensitization in delayed drug hypersensitivity reactions – an EAACI position paper of Drug Allergy Interest Group. Allergy, 2013, 68(7), p. 844–852.
27. ŠTORK, J. et al. Dermatovenerologie. První vydání. Galén. Karolinum. Praha. 2008, ISBN 978-80-7262-371-6 (Galén), ISBN 978-80-246-1360-4.
28. TORRES, M. J., ROMANO, A., CELIK, G. et al. Approach to the dignosis of drug hypersensitivity reactions: similarities and differences between Europe and North America. Clin. Transl. Allergy, 2017, 7, p. 7–25.
29. USHIGOME, Y., KANO, Y., HIRAHARA, K., SHIOHARA, T. Human herpesvirus 6 reactivation in drug-induced hypersensitivity sndrome and DRESS validation score. Am. J. Med., 2012, 125(7), p. 9–10.
30. WATKINS, S., PICHLER, W. J. Sulfamethoxazol induces a switch mechanism in T cell receptors containing TCRVβ20-1, altering pHLA recognition. PLoS One, 2013, 8(10), article e76211.
31. WHITE, K. D., CHUNG, W. H., HUNG, S. J. et al. Envolving models of the immunopathogenesis of T cell-mediated drug allergy: the role of host, pathogens, and drug response. J. Allergy Clin. Immunol., 2015, 136(2), p. 219–234.
32. WÖHRL, S. NSAID hypersensitivity – recommendations for diagnostic work up and patient management. Allergo. J. Int., 2018, 27(4), p. 114–121.
Labels
Dermatology & STDs Paediatric dermatology & STDsArticle was published in
Czech-Slovak Dermatology
2019 Issue 3
-
All articles in this issue
- Liekové hypersenzitívne reakcie: klasifikácia a patogenéza (1. časť)
- KONTROLNÍ TEST
- Juvenilní dermatomyozitida – klinický případ
- Klinický případ: Noduly na distálních článcích prstů ruky u kojence
- Pigmentovaná varianta morbus Bowen v agminátním uspořádání – popis případu
- Odborné akce 2019
- CHRONICKÁ KOPŘIVKA
- Zápis ze schůze výboru ČDS Praha 7. 3. 2019
- Zápis ze schůze výboru ČDS Praha 2. 5. 2019
- Zpráva z Annual Meeting AAD (Americká akademie dermatovenerologie) Washington, D. C. (USA), 1.–5. 3. 2019
- Doc. MUDr. Dušan Buchvald, CSc. – jubilant
- Czech-Slovak Dermatology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- CHRONICKÁ KOPŘIVKA
- Juvenilní dermatomyozitida – klinický případ
- Liekové hypersenzitívne reakcie: klasifikácia a patogenéza (1. časť)
- Pigmentovaná varianta morbus Bowen v agminátním uspořádání – popis případu
