Inzulinóm – príčina recidivujúcich hypoglykémií u 16-ročného pacienta
Insulinoma – the Cause of Relapsing Hypoglycemia in a 16-year Patient
The authors present the case of a 16-year boy with 1.5-year history of tonic-clonic seizures with unconsciousness caused by hypoglycemia associated with insulinoma. In admission of the patient to the clinic the glycemia levels were in the range of 2.2 – 6.1 mmol/l, values of C-peptide and insulin were increased (1948.9 pmol/l and 26.74 IU/ml, respectively). In oral glucose tolerance test (oGTT) the concentrations of C-peptide were in the range of 1158 – 4526 pmol/l, the level of insulin was 5.7 – 80.1 mU/l, glucose concentration was in the area of glucose tolerance disorder, the levels of TSH were elevated (6.3 mIU/l). The presence of insulinoma became suspected. CT examination and octreotide scan were negative as far as tumorous changes were concerned. The executed endoscopic ultrasonographic examination confirmed the finding of two foci in pancreas, of which the first one was not precisely localized in the region between head and body of pancreas with the size of 19 x 20 mm, the second focus was localized in the area in the area of tail (left extremity). In the patient distal spleen saving pancreatectomy was performed. Histological examination of the resected part of pancreas unambiguously confirmed the diagnosis of well differentiated endocrine tumor of pancreas of 16 mm size. Immunochemical examination of the tumor confirmed among others neuroendocrine differentiation confirmed by insulin expression as well.
The patient was dismissed after three-month hospitalization into home treatment. Nine months after the operation the glucose levels were in the physiological range, the concentrations of insulin as well as C-peptide after oGTT were also normal. The level of TSH was higher than normal (4.28 mIU/l). The clinical picture was characterized by loss of body weight from 95 kg upon admission to present 67kg body weight (stature of 170 cm).
Key words:
insulinoma, child age, hypoglycemia
:
M. Brndiarová 1
; M. Čiljaková 1; E. Hyrdelová 1; R. Hyrdel 2; J. Janík 3; K. Macháleková 4; Peter Bánovčin 1
:
Klinika detí a dorastu, Jesseniova lekárska fakulta Univerzity Komenského, Martinská fakultná nemocnica, Martin
prednosta prof. MUDr. P. Bánovčin, CSc.
1; Interná klinika – Gastroenterologická, Jesseniova lekárska fakulta Univerzity Komenského, Martinská fakultná nemocnica, Martin
prednosta prof. MUDr. R. Hyrdel, CSc.
2; Klinika transplantačnej a cievnej chirurgie, Jesseniova lekárska fakulta Univerzity Komenského, Martinská fakultná nemocnica, Martin
prednosta doc. MUDr. Ľ. Laca, PhD., mim. prof.
3; Ústav patologickej anatómie, Jesseniova lekárska fakulta Univerzity Komenského, Martinská fakultná nemocnica, Martin
prednosta prof. MUDr. L. Plank, CSc.
4
:
Čes-slov Pediat 2009; 64 (3): 115-119.
:
Case Report
Autori prezentujú kazuistiku 16-ročného chlapca s 1,5-ročnou anamnézou tonicko-klonických kŕčov s bezvedomím podmienených hypoglykémiami pri inzulinóme.
Pri prijatí chlapca na kliniku sa hladiny glykémie pohybovali v rozmedzí od 2,2–6,1 mmol/l, hodnoty C-peptidu a inzulínu (1948,9 pmol/l, 26,74 IU/ml) boli zvýšené. Pri orálnom glukózo-tolerančnom teste (oGTT) sa koncentrácie C-peptidu pohybovali v rozmedzí 1158–4526 pmol/l, hladina inzulínu 5,7–80,1 mU/l, koncentrácie glukózy boli v pásme poruchy glukózovej tolerancie, hladiny TSH boli zvýšené (6,31 mIU/l). Bolo vyslovené podozrenie na prítomnosť inzulinómu. CT vyšetrenie a oktreotidový scan boli negatívne v zmysle tumoróznych zmien. Realizované endoskopické ultrasonografické vyšetrenie potvrdilo nález dvoch ložísk v pankrease, z ktorých prvé bolo nepresne lokalizované v oblasti medzi hlavou a telom pankreasu s veľkosťou 19 x 20 mm, druhé ložisko bolo lokalizované v oblasti chvosta. U pacienta bola vykonaná distálna slezinu zachovávajúca pankreatektómia. Histologickým vyšetrením resekovanej časti pankreasu sa jednoznačne potvrdila diagnóza dobre diferencovaného endokrinného tumoru pankreasu veľkosti 16 mm. Imunohistochemicky bola v nádore okrem potvrdenia neuroendokrinnej diferenciácie dokázaná aj expresia inzulínu.
Pacient bol prepustený po trojmesačnej hospitalizácii do domáceho ošetrenia. Po 9 mesiacoch od operácie sa u pacienta hladina glykémie pohybovala vo fyziologickom rozmedzí, koncentrácie inzulínu aj C-peptidu po oGTT boli tiež v norme. Hladina TSH bola vyššia (4,28 mIU/l). V klinickom obraze pacient schudol (súčasná hmotnosť 67 kg, pri prijatí hmotnosť 95 kg pri výške 170 cm), kŕče sa neopakovali.
Kľúčové slová:
inzulinóm, detský vek, hypoglykémia
Úvod
Pankreatické endokrinné tumory (PET) tvoria približne 5 % všetkých primárnych pankreatických nádorov [1]. Aj keď väčšina PET sú sporadické neoplazmy, časť z nich môže byť súčasťou rôznych hereditárnych syndrómov, najčastejšie mnohopočetnej endokrinnej neoplázie typu 1 (MEN1), von Hippel-Lindau syndrómu alebo neurofibromatózy typu 1 [2].
PET vznikajú z plne diferencovaných endokrinných buniek alebo pluripotentnej bunky, ktorá má schopnosť diferencovať sa do rôznych endokrinných bunkových typov. Väčšina PET si ponecháva sekrečné vlastnosti a môže sa v klinickom obraze prejaviť syndrómom z nadprodukcie špecifického hormonálneho produktu. Funkčné endokrinné nádory pankreasu tvoria približne 65–75 % všetkých prípadov PET. Funkčné nádory sa zvyčajne vďaka klinickému prejavu nájdu skôr a teda majú v čase diagnózy menšie rozmery [3]. Takmer 60–70 % nádorov je menších ako 1,5 cm v priemere a 40 % menších ako 1 cm [4]. Medzi dôležité prognostické faktory PET patrí aj schopnosť a stupeň endokrinnej aktivity, keďže na základe typu produkovaného hormónu možno určiť dignitu týchto tumorov [5].
Medzi významné PET patria najmä inzulinómy. Inzulinómy sú jedným z najčastejších typov funkčných nádorov. Incidencia týchto nádorov je 1 až 4/1 000 000 s najčastejším výskytom v tretej až šiestej dekáde života [6]. Až 90 % týchto nádorov je benígnych, sú lokalizované v pankrease s rovnakou distribúciou v oblasti hlavy, tela, chvosta pankreasu [4].
U detí je organický hyperinzulinizmus veľmi zriedkavý, najčastejšie sa vyskytuje vo forme nezidioblastózy [6]. Nezidioblastóza je charakterizovaná lokálnym alebo difúznym zmnožením beta buniek ostrovčekov. Medzi difúzne zmnoženie buniek patrí syndróm poruchy zrenia beta buniek Langerhansových ostrovčekov a hyperplázia beta buniek. Lokálne zmnoženie predstavuje adenóm pankreasu.
Kazuistika
Pacient bol prijatý na našu kliniku vo veku 16 rokov s anamnézou 1,5 roka trvajúcich recidivujúcich hypoglykemických stavov spojených s tonicko-klonickými kŕčmi a bezvedomím. V rodine sa okrem karcinómu pečene u starého otca nevyskytli žiadne iné závažnejšie ochorenia. Až do mája v roku 2006, kedy bol pozorovaný prvý záchvat (v úvode záchvatu pacient malátny, prestáva komunikovať, prítomná triaška, neskôr kŕče rúk, postupne tonicko-klonické kŕče celého tela, bezvedomie, pozáchvatová somnolencia, úprava stavu vedomia), nemal chlapec žiadne zdravotné problémy. Neurológ odporučil EEG (elektroencefalografia), kde neboli zachytené priekazné epileptiformné prejavy. Stav bol hodnotený ako epilepsia a bola indikovaná antiepileptická liečba. Aj napriek liečbe dochádzalo k recidívam generalizovaných tonicko-klonických kŕčov, prevažne v ranných hodinách.
Vzhľadom k zachyteniu hypoglykémie počas jedného zo záchvatov v decembri roku 2006 bol pacient vyšetrený endokrinológom. Na základe opakovaného stanovenia hypoglykémií a hyperinzulinizmu bolo vyslovené podozrenie na inzulinóm. Počítačová tomografia (CT) pankreasu, ani oktreotidový scan však tumor nepotvrdili. Pre pretrvávanie ťažkostí bola v júni 2007 realizovaná magnetická rezonancia (NMR) mozgu s negatívnym výsledkom. Pacient bol nastavený na liečbu diazoxidom (Proglicém® v dávke 75 – 50 – 75 – 150 mg à 6 hodín) s nutnosťou dodržiavania režimových stravovacích opatrení a self-monitoringu glykémií.
Pri prijatí na našu kliniku v októbri 2007 sa glykémie pohybovali v rozmedzí od 2,2–6,1 mmol/l aj napriek liečbe a podávaniu glukózy. Hodnoty C-peptidu a inzulínu (1948,9 pmol/l, 26,74 IU/ml) boli zvýšené (odber pri hypoglykémii 2,4 mmol/l). Pri oGTT (orálny glukózo-tolerančný test) sa koncentrácie C-peptidu pohybovali v rozmedzí 1158–4526 pmol/l, hladina inzulínu 5,7–80,1 mU/l, koncentrácie glukózy boli v pásme poruchy glukózovej tolerancie. Boli prítomné zvýšené hladiny TSH (tyreotropný hormón) (6,31 mIU/l). Hypokorticizmus a deficit rastového hormónu sme vylúčili odberom vzorky krvi polhodinu po hypoglykémii. V krvi pacienta došlo pri hypoglykémii k ich dostatočnému vzostupu.
Klinickým a laboratórnym vyšetrením sme vylúčili pridružené ochorenie v rámci MEN1 (hladiny ionizovaného kalcia sa pohybovali vo fyziologickom rozmedzí, nebola prítomná hyperparatyreóza). Hodnoty beta HCG (choriogonadotropný hormón) boli 0,66 mIU/ml. Sonografické vyšetrenie nadobličiek bolo bez patologického nálezu. Doplnili sme endoskopické ultrasonografické vyšetrenie s nálezom dvoch ložísk v pankrease, z ktorých prvé bolo nepresne lokalizované v oblasti medzi hlavou a telom pankreasu s veľkosťou 19 x 20 mm, zatiaľ čo druhé ložisko bolo lokalizované v oblasti chvosta.
V diferenciálnej diagnostike bol zvažovaný aj lalôčik pankreasu alebo akcesórna slezina. NMR pankreasu nepotvrdilo ložiskové zmeny. Aj napriek kontinuálnemu podávaniu 10% glukózy a monitoringu glykémií sa počas hospitalizácie nepodarilo zabrániť opakovaným hypoglykémiám s generalizovanými tonicko-klonickými kŕčmi. V rámci spresnenia lokalizácie suspektného inzulinómu bol zrealizovaný intraarteriálny kalciový test, ktorý bol však neúspešný pre vrodenú anomáliu venózneho systému pacienta (tenké vv. femorales communes). Pri angiografickom vyšetrení abdominálnych ciev neboli odhalené evidentné patologické zmeny.
Vzhľadom ku klinickému obrazu, výsledkom biochemických vyšetrení nasvedčujúcich prítomnosť inzulinómu aj napriek nejednoznačným záverom zobrazovacích vyšetrení bol indikovaný chirurgický postup verifikácie prítomnosti inzulinómu. Pri chirurgickej explorácii a štandardnej revízii bola palpačne zistená rezistencia v tele pankreasu v blízkosti mezenterických ciev o priemere asi 2 cm (obr. 1). Nález bol potvrdený peroperačnou ultrasonografiou (obr. 2). Pre tesný kontakt s hlavným pankreatickým vývodom bola možná len resekčná liečba v podobe distálnej, slezinu zachovávajúcej pankreatektómie.
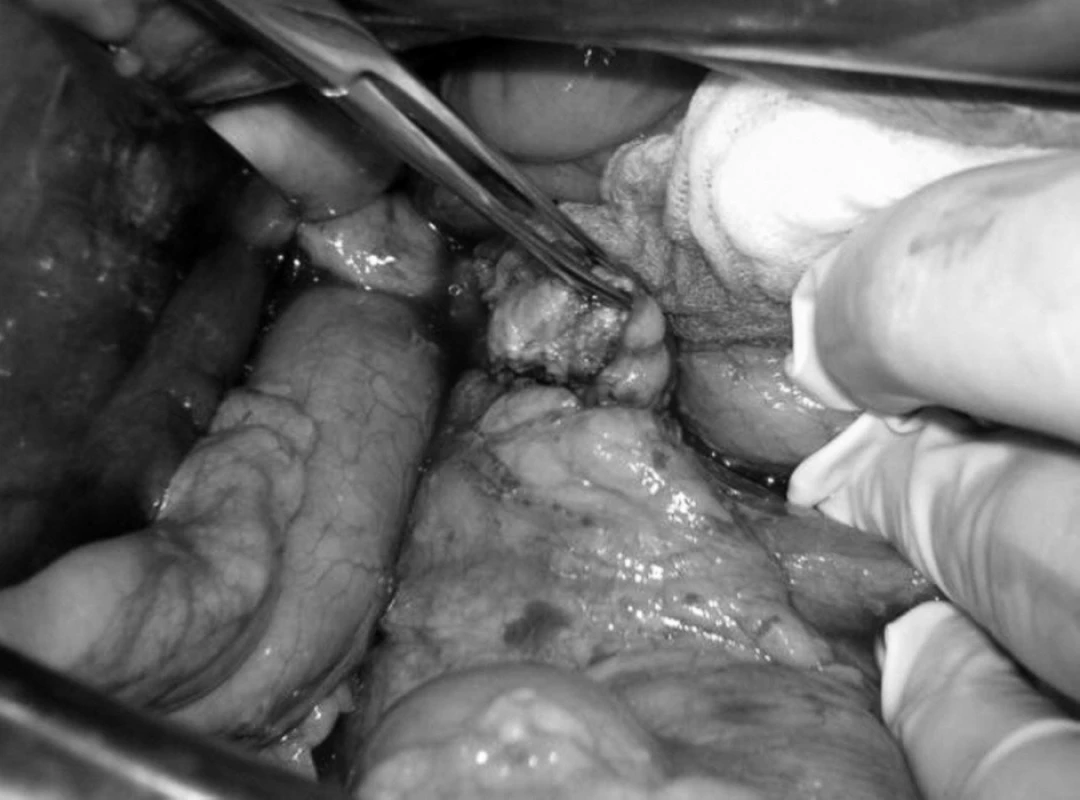
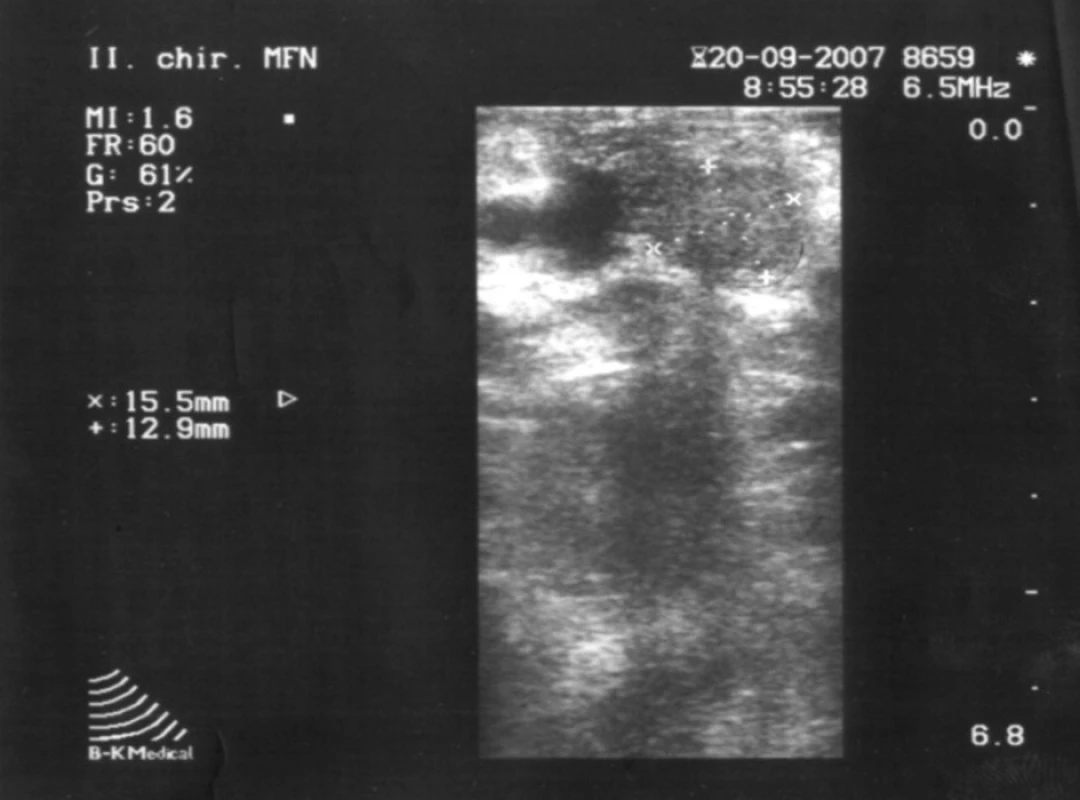
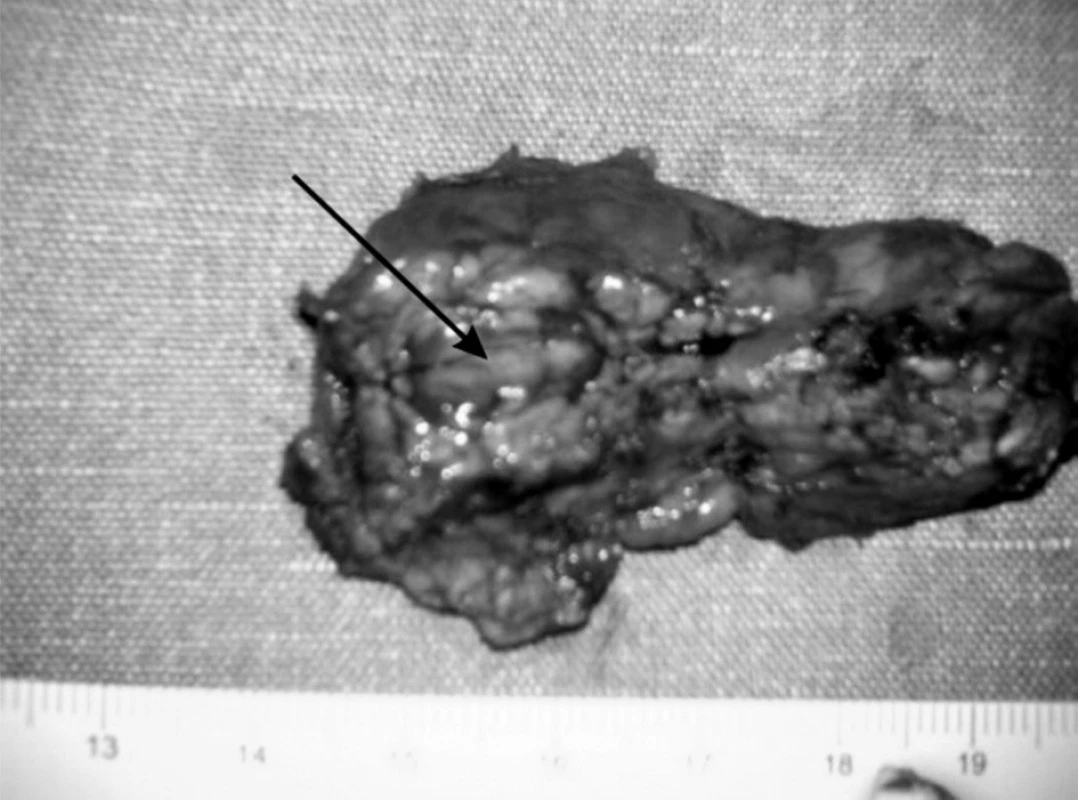
V resekovanom tkanive pankreasu bol prítomný tumor hnedočervenej farby, ktorý bol peroperačnou histológiou vyhodnotený ako neuroendokrinný nádor (obr. 3). Po odstránení tumoru peroperačne stúpla glykémia o viac ako o 2 mmol/l. V rámci predoperačnej prípravy sa pacientovi podávala antibiotická profylaxia a sandostatín.
Pooperačný priebeh bol komplikovaný aj napriek liečbe vznikom akútnej pankreatitídy, laboratórne boli prítomné ľahká elevácia amyláz (1,03–1,85 µkat/l) a transamináz (AST 2,46, ALT 3,15 µkat/l), vysoké hladiny CRP (185,6; 232 mg/l) a leukocytóza s prevahou neutrofilov (79,1 %). U pacienta následne došlo ku vývoju obojstranného fluidothoraxu.
Diagnóza pankreatitídy bola potvrdená CT vyšetrením s nálezom akútnej pseudocysty a hroziacej pankreatickej fistuly. Pseudocysta bola drénovaná, pričom drén odvádzal hematínový obsah s bielymi vločkami, laboratórne bola potvrdená vysoká hladina amyláz (300,1 µkat/l). Kultiváciou obsahu pseudocysty sa zachytili gram negatívne nefermentujúce paličky, gram pozitívne difteroidné paličky, Stenotrophomonas maltophília. Po opakovaných preplachoch pseudocysty, punkcii fluidothoraxu, cielenej antibiotickej a medikamentóznej liečbe došlo k postupnej úprave klinického stavu, poklesu teplôt, normalizácii laboratórnych parametrov a úprave glykémií, kde sa hodnoty pohybovali vo fyziologickom rozmedzí.
Histologickým vyšetrením resekovanej časti pankreasu bola jednoznačne potvrdená diagnóza dobre diferencovaného endokrinného tumoru pankreasu s entrapovanými duktulárnymi štruktúrami, ktorý v resekovanom tkanive dosahoval maximálnu veľkosť 16 mm. Endokrinné bunky vykazovali iba mierny stupeň celulárnej a nukleárnej atypie a mitotická aktivita nepresahovala 1 mitózu na 10 veľkých zorných polí. Proliferačná aktivita, hodnotená ako Ki-67 index, bola menej ako 1 % pozitívnych buniek. Nádor vykazoval relatívne ohraničený rast bez tvorby väzivového puzdra na periférii, s nálezom ojedinelej nepravidelnej infiltrácie do priľahlého tkaniva pankreasu. Angioinvázia nebola pozorovaná v nádore ani jeho okolí. Imunohistochemicky bola v nádore okrem potvrdenia neuroendokrinnej diferenciácie dokázaná aj expresia inzulínu.
Päť mesiacov po operácii sa u pacienta v laboratórnych parametroch hladina glykémie pohybovala vo fyziologickom rozmedzí, koncentrácie inzulínu aj C-peptidu po oGTT boli tiež v norme. Hladina TSH bola vyššia (4,28 mIU/l). Kŕče sa už neopakovali. Po 9 mesiacoch od operácie okrem zvýšených hladín TSH (5,49 mIU/l) sú hladiny glykémie v norme, hladiny C-peptidu a inzulínu po oGTT sú vo fyziologickom rozmedzí. V klinickom obraze pacient schudol (súčasná hmotnosť 67 kg, pri prijatí hmotnosť 95 kg pri výške 170 cm), kŕče sa neopakovali.
Diskusia
Hypoglykémia je charakterizovaná poklesom hladiny glukózy v krvi pod referenčné hodnoty pre daný vek. Etiológia vzniku hypoglykémie je mimoriadne pestrá. Hyperinzulinizmus patrí medzi časté príčiny perzistentnej alebo rekurentnej hypoglykémie v detskom veku [2, 3]. Pri hyperinzulinizme dochádza k hypoglykémii, ktorá sa klinicky prejaví prítomnosťou neuroglykopenických a adrenergných symptómov, ktoré sú ovplyvnené vekom pacienta. Zatiaľ čo neuroglykopenické prejavy sú sprostredkované priamym nedostatkom glukózy, adrenergné prejavy sú spôsobené zvýšenou aktivitou autonómneho nervového systému. Hypoglykémia sa klinicky môže manifestovať aj prítomnosťou neurologických prejavov (tonicko-klonické kŕče, myoklónie). Chybne diagnostikovaní pacienti môžu byť preto liečení antikonvulzívnou liečbou alebo na psychiatrických oddeleniach bez zlepšenia stavu [7].
Diagnostika inzulinómu pankreasu je pomerne zložitá, keďže väčšina inzulinómov je malá a lokalizovaná intraparenchymálne. Z biochemických testov sa využíva stanovenie glykémie, zvýšených hladín C-peptidu a inzulínu najčastejšie pri orálnom glukózo-tolerančnom teste. Hladový test sa všeobecne pokladá za najvhodnejší na potvrdenie endogénneho hyperinzulinizmu. Cieľom je vyprovokovať u pacienta hypoglykémiu, spôsobenú autonómnou sekréciou inzulínu. Možno ho doplniť cvičením, ktorým sa u pacientov s inzulinómom zvýrazní pokles glykémie. Len u pacientov s inzulinómom sa bude vyskytovať počas testu neadekvátne vysoká hladina IRI (imunoreaktívny inzulín) v sére vyjadrená hodnotou indexu IRI (mU/l) k aktuálnej hodnote plazmatickej glukózy. Hodnota indexu nad 5,5 je patognomická pre diagnózu inzulinómu [6].
Z neinvazívnych zobrazovacích metód využívame v diagnostike ultrasonografiu, CT (natívne a postkontrastné zobrazenie), NMR. Endoskopická ultrasonografia (EUS) pankreasu spája výhody endoskopie a transabdominálnej ultrasonografie pri minimalizácii nevýhod. Hlava pankreasu sa vyšetruje cez duodenum, telo a chvost cez zadnú stenu žalúdka. V EUS obraze má inzulinóm pankreasu charakter ohraničeného, obyčajne oválneho, hypoechogénneho, homogénneho tumoru. EUS vyšetrenie by malo ozrejmiť vzťah tumoru k okolitým orgánom, cievam a popísať prípadnú lymfadenopatiu. Literárne zdroje uvádzajú, že EUS je najsenzitívnejšia vyšetrovacia metóda na odhalenie pankreatických nádorov menších ako 2 cm. Podľa viacerých autorov sa citlivosť v týchto prípadoch blíži k 100 % [8, 9]. Ak je teda dôvodné klinické podozrenie na tumor pankreasu, potom je endoskopická ultrasonografia pankreasu plne indikovaná aj v prípade síce negatívneho nálezu na CT alebo NMR, ale biochemicky a klinicky jednoznačne dokázaného inzulinómu.
Invazívne zobrazovacie metódy, ktoré používame v diagnostike inzulinómu, sú angiografia, oktreotidový scan a intraarteriálny selektívny kalciový test (IASCT). Oktreotidový scan sa častejšie používa v diagnostike gastrinómu, pri inzulinóme môže byť toto vyšetrenie často negatívne. IASCT je založený na selektívnej aplikácii 10% kalciumglukonátu do hornej mezenterickej, gastroduodenálnej a splenickej artérie s následným odberom krvi na IRI a C-peptid v pravidelných časových intervaloch z ľavej a pravej hepatálnej vény. Na základe hormonálneho gradientu je možné stanoviť lokalizáciu inzulinómu bez ohľadu na jeho veľkosť, čo je veľkou výhodou tohto vyšetrenia [6].
Ardengha a spol. [10] porovnávali možnosti diagnostiky inzulinómu pomocou EUS, CT, NMR a peroperačnej ultrasonografie u 30 pacientov. Pomocou EUS bolo diagnostikovaných 86,6 %, podľa CT 33 %, NMR 40 % a peroperačnej ultrasonografie 90,9 % nádorov. Laparoskopická ultrasonografia (LUS) môže vopred určenú lokalizáciu tumoru potvrdiť a určiť vzťah tumoru a vývodu, aj rozhodnúť o enukleačnom alebo resekčnom výkone alebo o potrebe výkon konvertovať. LUS dovoľuje opakovanou peroperačnou kontrolou počas laparoskopickej enukleácie tumoru šetriť tkanivo pankreasu [1]. Definitívna diagnóza neuroendokrinných nádorov je realizovaná histologickým a imunohistochemickým vyšetrením.
Chirurgická liečba nádorov pankreasu dosahuje 90% úspešnosť riešenia problému pri nádoroch pankreasu, a preto je v súčasnosti považovaná za metódu voľby v liečbe nádorového ochorenia pankreasu [11]. Medikamentózna liečba je rezervovaná pre pacientov s inoperabilnými nádormi pankreasu a umožňuje stabilizáciu pacienta pred samotným výkonom. Chirurgická liečba inzulinómu v súčasnosti využíva dva možné prístupy, a to laparoskopický prístup a klasickú otvorenú cestu – laparotómiu. Laparoskopicky môžeme realizovať tri rôzne chirurgické výkony, a to enukleáciu tumoru, distálnu pankreatektómiu so zachovaním sleziny alebo so splenektómiou. Najčastejšou komplikáciou chirurgickej liečby je vytvorenie pankreatickej fistuly. Laparoskopický chirurgický prístup je realizovaný hlavne u benígnych nádoroch pankreasu a cystách, pri nádoroch umiestnených v tele a chvoste pankreasu [12, 13].
Záver
U detí je organický hyperinzulinizmus veľmi zriedkavý. Prítomnosť inzulinómu sa v klinickom obraze často prejavuje netypickými príznakmi (tonicko-klonické kŕče s bezvedomím), ktoré môžu poukazovať na iné ochorenie. Je dôležité, aby pri opakujúcich sa kŕčových stavov bola vyšetrená hladina glukózy a bolo doplnené aj endokrinologické vyšetrenie.
Jednoznačne prítomnosť inzulinómu potvrdia biochemické testy (opakujúca sa hypoglykémia, zvýšené hladiny inzulínu, IRI, C-peptidu počas hypoglykémie). Ak sú klinický obraz a biochemické parametre podozrivé z prítomnosti inzulinómu, je u pacienta indikovaná endoskopická ultrasonografia pankreasu.
Došlo: 28. 6. 2008
Přijato: 30. 8. 2008
MUDr. Miroslava Brndiarová
Klinika detí a dorastu UK JLF a MFN
Kollárova 2
036 59 Martin
Slovenská republika
e-mail: mirkabdc@gmail.com
Sources
1. Macháleková K, Kajo K. Bioptická diagnostika pankreatických endokrinných tumorov. Onkológia 2007;2(6): 345–348.
2. Klimstra DS, Adsay NV. Benign and malignant tumors of the pancreas. In: Odze RD. Surgical Pathology of the GI Tract, Liver, Biliary Tract, and Pancreas. Saunders, 2004 : 699–736.
3. De Lellis RA, Lloyd RV, Heitz PU, et al. World Health Organization Classification of Tumours. Pathology and Genetics of Tumours of Endocrine Organs 2004 : 320.
4. McLean A. Endoscopic ultrasound in the detection of pancreatic islet cell tumours. Cancer Imaging 2004;4 : 84–91.
5. Graeme-Cook F. Neuroendocrine tumors of the GI tract and appendix. In: Odze RD. Surgical Pathology of the GI Tract, Liver, Biliary Tract, and Pancreas. Saunders, 2004 : 483–504.
6. Božíková J, Hyrdel R. Inzulinóm. In: Jurgoš Ľ, Kužela L, Hrušovský Š, et al. Gastroenterológia. 1 vyd. Bratislava: VEDA, 2006 : 593–595.
7. Strong VE, Shifrin A, Inabnet WB. Rapid intraoperative insulin assay: a novel method to differentiate insulinoma from nesidioblastosis in the pediatric patient. Annals of Surgical Innovation and Research 2007;1 : 6.
8. Rosch T, Lorenz R, Braig C, et al. Endoscopic ultrasound in pancreatic tumor diagnosis. Gastrointest. Endosc. 1991;37 : 347–352.
9. Legmann P, Vignaux O, Dousset B, et al. Pancreatic tumors: comparison of dual-phase helical CT and endoscopic sonography. J. Roentgenol. 1998;170 : 1315–1322.
10. Ardengh JC, Valiati LH, Geocze S. Identification of insulinomas by endoscopic ultrasonography. Rev. Assoc. Med. Bras. 2004;50(2): 167–171.
11. Kaczirek K, Asari R, Scheuba C, et al. Organic hyperinsulinism and endoscopic surgery. Wien Klin. Wochenschr. 2005;117(1–2): 19–25.
12. Lo CY, Chan WF, Lo CM, et al. Surgical treatment of pancreatic insulinomas in the era of laparoscopy. Surg. Endosc. 2004;18(2): 297–302.
13. Dai MH, Zhao YP, Liao Q, et al. Surgical treatment of pancreatic insulinoma by laparoscopy. Zhonghua Wai Ke Za Zhi. 2006;44(3): 165–168.
Labels
Neonatology Paediatrics General practitioner for children and adolescentsArticle was published in
Czech-Slovak Pediatrics

2009 Issue 3
- What Effect Can Be Expected from Limosilactobacillus reuteri in Mucositis and Peri-Implantitis?
- The Importance of Limosilactobacillus reuteri in Administration to Diabetics with Gingivitis
-
All articles in this issue
- Czech Pediatric Society in 2009
- Wiskott-Aldrich Syndrome – Disease Requiring Early Transplantation of Hemopoietic Stem Cells
- Insulinoma – the Cause of Relapsing Hypoglycemia in a 16-year Patient
- Disorder of Growth and Development in a Boy with X-bound Ichthyosis, Protracted Delivery and Low Level of Estriol in the Mother during Pregnancy
- Food-induced Anaphylaxis in Children
- Paediatrician and Therapy of Orofacial Clefts
- The Risk of Child Obesity
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Insulinoma – the Cause of Relapsing Hypoglycemia in a 16-year Patient
- Wiskott-Aldrich Syndrome – Disease Requiring Early Transplantation of Hemopoietic Stem Cells
- Disorder of Growth and Development in a Boy with X-bound Ichthyosis, Protracted Delivery and Low Level of Estriol in the Mother during Pregnancy
- Food-induced Anaphylaxis in Children
