ECMO (extrakorporální membránová oxygenace) v léčbě respiračního a oběhového selhání u novorozenců a dětí
ECMO (Extracorporeal Membrane Oxygenation) in the therapy of respiration and circulation failure in newborns and children
Extracorporeal membrane oxygenation (ECMO) is used for extracorporeal support of heart and/or lung function by means of a mechanical device. ECMO belongs to a complex of highly specialized care provided to patients with circulatory and/or ventilatory failures after all conventional therapeutic methods had failed.
We present an overview of ECMO and demonstrate its usefulness in newborns and children treated with this invasive rescue method at our center.
Key words:
ECMO, respiratory failure, circulatory failure, mechanical ventilation
:
V. Vobruba 1; O. Černá 1; D. Lorenčík 1; P. Pokorná 1; P. Srnský 1; V. Rohn 3; I. Vykydal 3; F. Mlejnský 3; J. Fichtl 3; G. Hodková 3; D. Nikitinský 3; J. Janota 4
; T. Tláskal 5; T. Matějka 5; M. Rygl 6; prof. MUDr. Jan Bělohlávek, Ph.D. 2
:
Klinika dětského a dorostového lékařství VFN a 1. LF UK, Praha
přednosta prof. MUDr. J. Zeman, DrSc.
1; II. interní klinika VFN a 1. LF UK, Praha
přednosta prof. MUDr. A. Linhart, DrSc.
2; II. chirurgická klinika kardiovaskulární chirurgie VFN a 1. LF UK, Praha
přednosta doc. MUDr. J. Lindner, CSc.
3; Novorozenecké oddělení, FTNsP, Praha
primář doc. MUDr. J. Janota, Ph. D.
4; Dětské kardiocentrum FN Motol, Praha
přednosta MUDr. J. Škovránek, CSc.
5; Klinika dětské chirurgie FN Motol, Praha
přednosta prof. MUDr. J. Šnajdauf, DrSc.
6
:
Čes-slov Pediat 2012; 67 (Suppl 1): 6-12.
:
Original Papers
Extrakorporální membránová oxygenace (ECMO) patří mezi metody mimotělní podpory funkce srdce a plic prostřednictvím mechanického zařízení. ECMO patří do komplexu vysoce specializované péče vyhrazené nemocným s oběhovým a ventilačním selháním, kde všechny konvenční i nekonvenční léčebné metody selhaly.
V práci je uvedena základní problematika ECMO a je prezentován soubor novorozenců a dětí léčených touto invazivní záchrannou metodou na našem pracovišti.
Klíčová slova:
ECMO, respirační selhání, oběhové selhání, umělá plicní ventilace
ÚVOD
Akutní respirační selhání v dětském věku (acute respiratory failure – ARF) je častým důvodem k přijetí na jednotku intenzivní péče. I při zařazení relativně nových léčebných postupů, jako je např. umělá plicní ventilace (UPV) s použitím nízkých dechových objemů [1], vysokofrekvenční oscilační ventilace (HFOV) [2], léčba surfaktantem [3, 4], selektivní plicní vazodilatace pomocí inhalovaného oxidu dusnatého (iNO) [5] a zařazení pronačního protokolu [6, 7], zůstává mortalita u pediatrických pacientů poměrně vysoká a pohybuje se v rozmezí 18–35 % [8–10]. Při selhání uvedených léčebných možností přichází v úvahu použití mimotělní membránové oxygenace (ECMO – extrakorporální membránová oxygenace). Při této metodě je krev derivována ze žilního systému extrakorporálně do oxygenátoru, kde je okysličena a zároveň je částečně eliminován oxid uhličitý. Okysličená krev se vrací zpět buď do venózní části řečiště (veno-venózní způsob – V-V), nebo do arteriální části řečiště (veno-arteriální způsob – V-A).
Na ECMO jako na úspěšnou podporu ventilace a oběhu bylo prvně upozorněno v práci Hilla a kol. v roce 1972 [11]. Zkušenosti s extrakorporální membránovou oxygenací v léčbě respiračního a oběhového selhání u novorozenců publikovali Barlett a kol. v roce 1976 [12]. V roce 1989 byla založena Extracorporeal Life Support Organization (ELSO) jako dobrovolná studijní skupina složená ze zástupců center používajících mimotělní podpory, která organizuje centrální databázi všech center, koordinuje prospektivní studie, vydává doporučené postupy a podílí se na edukačních programech.
Zatímco indikační kritéria k zahájení ECMO podpory jsou celkem přesně stanovena v novorozeneckém věku (tab. 1) [13], u dětí jsou omezena na doporučení zahájit uvedenou léčbu, pokud nemocný vyžaduje agresivní ventilační podporu nebo jde o oběhové selhání nereagující na správně vedenou léčbu. Recentní studie jednoznačně prokázaly horší výsledky přežití dětí s prodlužující se dobou předchozí UPV [14].
![Neonatální vstupní a vylučovací kritéria k ECMO podpoře [13].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/f658e027882a3660b79b93c72b8775c2.png)
Nejčastějšími novorozeneckými diagnózami, které vedou k ECMO podpoře, jsou masivní aspirace mekonia (MAS), perzistující plicní hypertenze novorozence (PPHN), vrozená brániční kýla (CDH – congenital diphragmatic hernia), respiratory distress syndrom (RDS), pneumonie a sepse [15]. Z pediatrických diagnóz to jsou virové a bakteriální pneumonie, ARDS, sepse, myokarditidy a některé vrozené srdeční vady. Nezanedbatelný je počet dětí, u kterých bylo zahájeno ECMO z důvodů srdeční zástavy (ECPR – extracorporeal cardiopulmonary resuscitation). Významnou měrou stoupá počet chronicky nemocných dětí léčených pomocí ECMO (renální selhání, chronické plicní postižení, vrozené srdeční vady, jaterní selhání a onkohematologická problematika) [14].
Přežití pacientů léčených mimotělní membránovou oxygenací je nejvyšší v novorozeneckém věku, zatímco u dětí a dospělých jsou výsledky horší. Nižší přežití je i u jedinců s přítomnou komorbiditou [14].
Léčba extrakorporální membránovou oxygenací u novorozenců a dětí nebyla v posledních letech v České republice dostupná. ECMO bylo na našem pracovišti prvně provedeno v říjnu 2010 a do srpna 2011 bylo tímto způsobem léčeno 6 dětí. Předložená práce shrnuje základní problematiku ECMO terapie u novorozenců a dětí a prezentuje přehled pacientů léčených uvedenou metodou na JIRP KDDL VFN a 1. LF UK v období X/2010 – III/2011.
METODIKA A SOUBOR PACIENTŮ
Přístupy a způsoby provedení mimotělní membránové oxygenace
V následujícím textu je uveden přehled nejběžnějších způsobů prováděných u novorozenců a dětí.
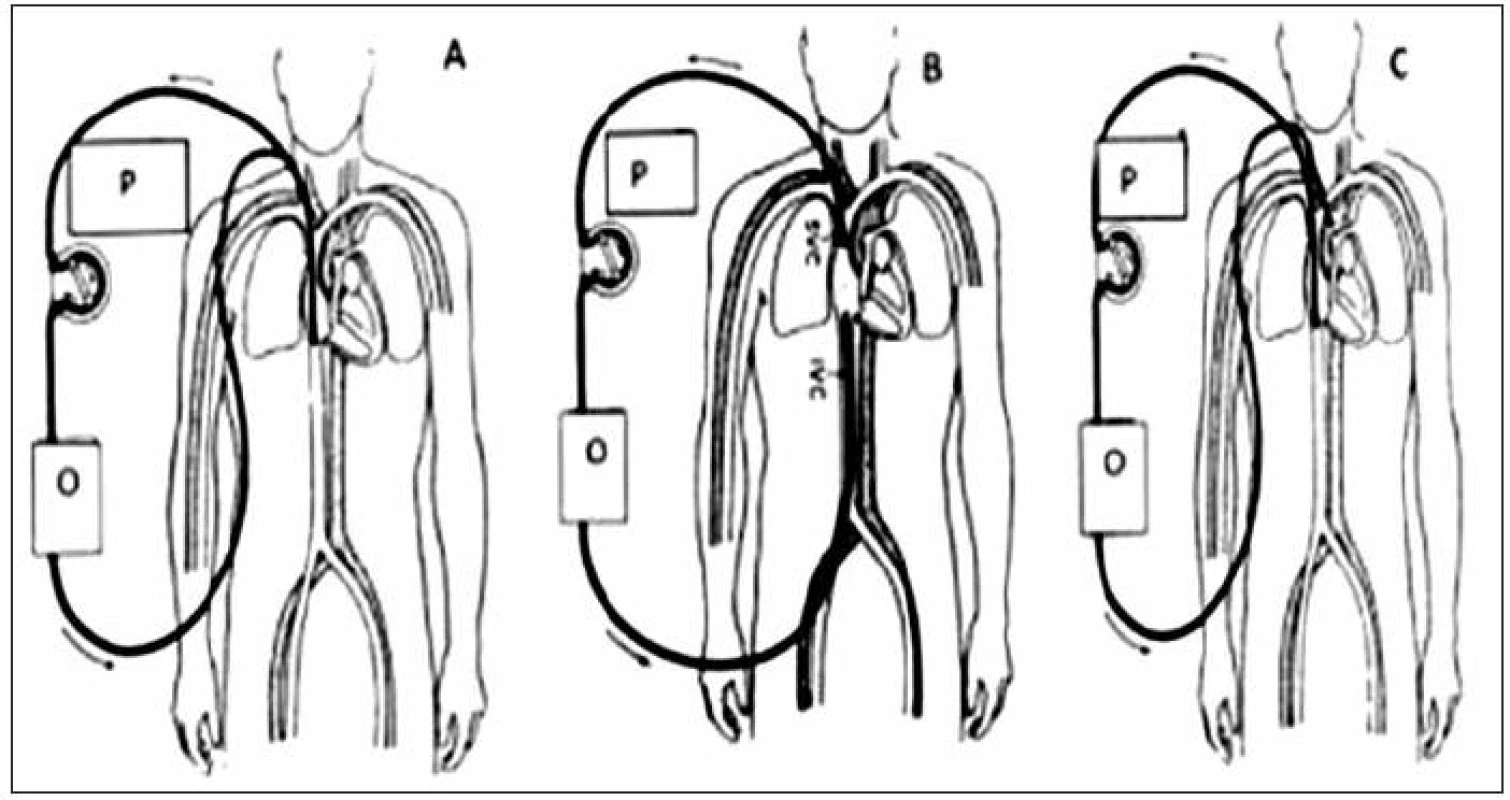
Veno-venózní způsob (V-V ECMO)
Krev je drénována pumpou z pravé síně do oxygenátoru a okysličená se vrací zpět do pravé síně. Přístup a kanylace se liší podle velikosti nemocného. U dětí do 20 kg hmotnosti je dávána přednost jednocestné kanylaci. Prakticky výhradně chirurgickým přístupem je preparována v. jugularis interna l. dx. a touto cestou je zaveden dvoucestný katétr o síle 12–14 F (podle hmotnosti nemocného) do pravé síně. Derivační otvory katétru jsou umístěny v distálním a proximálním konci, návratové otvory by měly být umístěny proti trikuspidálnímu ústí. U dětí s hmotností větší než 20 kg je podobně jako u dospělých možné použít dvojcestný přístup cestou v. femoralis a v. jugularis interna l. dx. Směr průtoku může být obousměrný, ale většinou je krev nasávána cestou v. femoralis a vracena do v. jugularis.
Veno-arteriální způsob (V-A ECMO)
Krev je z pravé síně odváděna do oxygenátoru a okysličená se vrací do aorty. U dětí s hmotností do 10 kg je jako venózní přístup nejčastěji volena v. jugularis interna, u větších dětí je možné zvolit i v. femoralis. Okysličená krev se vrací u dětí s hmotností do 10 kg cestou a. carotis communis do aorty, u větších lze použít i a. femoralis a vracet krev do descendentní aorty. Za příhodných okolností je možné po ukončení mimotělní podpory provést rekonstrukci cévy a zachovat tak její průchodnost. To je důležité zejména v případě kanylace a. carotis communis. Punkční technika je možná u větších dětí [16].
Volba způsobu mimotělní podpory
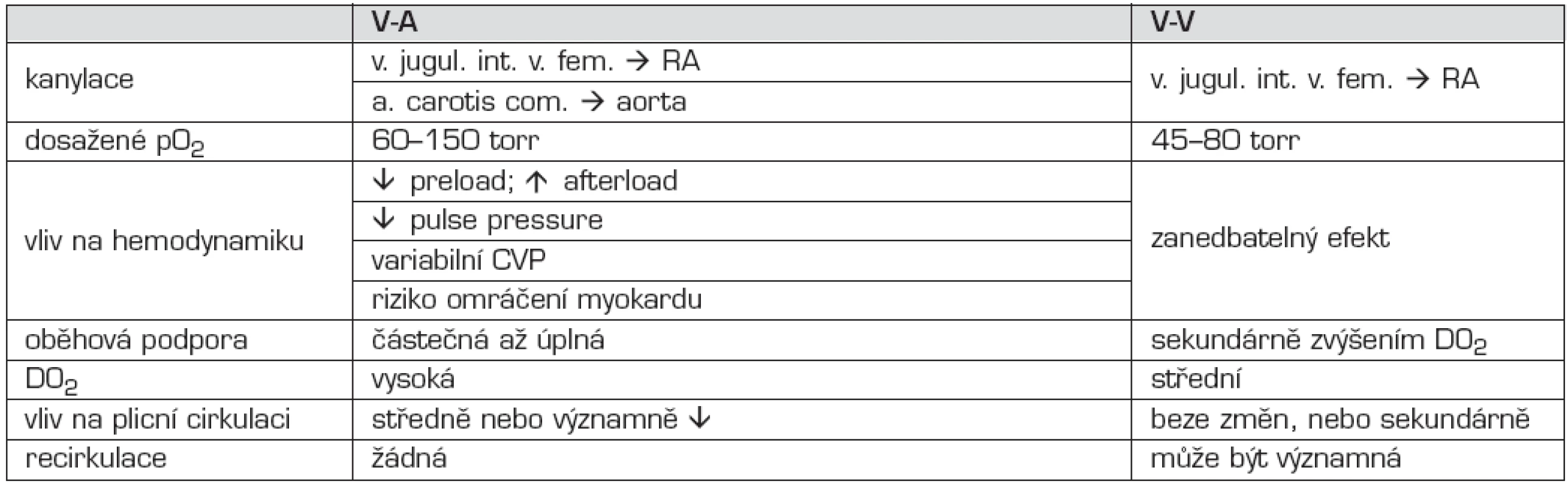
Způsob mimotělní podpory je volen podle klinického stavu nemocného. V-A ECMO je indikováno především při oběhovém selhání nebo v případě kombinace oběhového a ventilačního selhání. V-A způsob zajišťuje vysokou dodávku kyslíku do organismu (DO2), snižuje preload a zvyšuje afterload. Snižuje pulse pressure a vliv na hodnoty centrálního žilního tlaku jsou proměnlivé. Podle rychlosti průtoku krve může být oběhová podpora částečná až kompletní (kardiopulmonální bypass). V-V ECMO je indikováno u pacientů s dominujícími příznaky respiračního selhání. V-V ECMO minimálně ovlivňuje hemodynamiku, nemá vliv na pulse pressure, DO2 je středně vysoká. Výraznou komplikací může být faktor recirkulace oxygenované krve při malpozici ECMO kanyly, jejímž důsledkem je snížená DO2. Srovnání jednotlivých modalit ukazuje tabulka 2.
Součásti okruhu
Okruh pro ECMO je tvořen soustavou hadic, pumpou, ohřívačem a oxygenátorem. V současné době se většinou používají centrifugální pumpy, kde pohybující se rotor v magnetickém poli vytváří průtok a generuje negativní tlak zajišťující dostatečnou žilní drenáž odpovídající klidovému srdečnímu výdeji. Pozitivní tlak za pumpou vzniká v důsledku průtočného odporu, který klade oxygenátor, hadicový okruh a vlastní katétr. S rostoucím průtokem krve stoupá i tlak v návratové větvi. Používají se membránové oxygenátory (polymetylpenten) s vysoce hemokompatibilním povrchem. Velikost oxygenátoru je volena podle povrchu těla pacienta. Fakultativní součástí okruhu je monitorovací systém, který přímo analyzuje hodnoty pH, pO2, pCO2, SVO2 a K+. Celý okruh určený pro ošetřování novorozenců a menších dětí má poměrně velký objem (cca 350 ml), proto je nutné ho před připojením dětského pacienta předplnit erytrocytárním koncentrátem a mraženou plazmou (tzv. priming).
Antikoagulace
Kontakt krve s cizím materiálem, i když jde o vysoce biokompatibilní a heparinem potažené (coated) materiály, působí aktivaci koagulační kaskády. Vysoký průtok krve sice částečně zmenšuje riziko vytváření krevních koagul, přesto je heparinizace nezbytností. Nejčastěji se používá kontinuálně podávaný nefrakcionovaný heparin. Monitorovaným parametrem účinnosti antikoagulační léčby je ACT (activated clotting time, aktivovaný koagulační čas) s cílovou hodnotou 180–200 s. Přesnější je monitorování hodnoty aPTT (aktivovaného parciálního tromboplastinového času), kde je žádoucí hodnota 60–90 s. Hodnoty trombocytů by se měly pohybovat nad 50 x 109/l. Pokles pod uvedenou hodnotu je indikací k transfuzi trombocytárního koncentrátu [17].
Nastavované parametry
Průtok krve se pohybuje mezi 80–120 ml/kg/min. Frakce kyslíku se nastavuje podle potřeby. Průtok plynu je rozhodující pro eliminaci oxidu uhličitého. Většinou se pohybuje v rozmezí 0,6–1,2 l/min.
Nastavení ventilačních parametrů při ECMO podpoře
Nastavení se liší podle varianty ECMO. V-A podpora umožní významně snížit ventilační režim a přejít na tzv. „resting mode“ (Pin = 20 cmH2O; PEEP = 8–10 cmH2O; DF = 10–15/min; FiO2 <0,4) [18]. U V-V podpory nemusí být ve všech případech oxygenační a eliminační funkce zcela nahrazena a je nezbytné ponechat konvenční ventilační režim. Přesto je snahou ho nastavit tak, aby ventilace byla co nejméně traumatizující a přitom byla zajištěna dostatečná oxygenace a ventilace.
Odvykání od ECMO podpory
Odvykání od ECMO podpory se liší u V-V a V-A přístupu. V případě V-V podpory z indikace respirační insuficience jsou známkou zlepšení funkce plic lepší hodnoty krevních plynů při neměnném nastavení ECMO parametrů a ventilačního režimu. Funkční zlepšení je většinou provázeno i zlepšujícím se morfologickým nálezem na rtg nebo CT plic. Podílejí-li se plíce z 70–80 % na výměně plynů a pacient je cirkulačně stabilní, je snižována jak frakce kyslíku, tak průtok plynů oxygenátorem. Ve chvíli, kdy se koncentrace blíží 21 % a nemocný toleruje konvenční ventilační režim a je nadále hemodynamicky stabilní, je možné ECMO podporu ukončit. V případě V-A podpory se naopak snižuje průtok krevní pumpou a trvají-li známky stabilizace cirkulace (je dosažen pokles průtoku krve pumpou na 20–30 % výchozí hodnoty), lze uvažovat o ukončení ECMO podpory. Je zastavena pumpa a zároveň jsou naloženy svorky na obě ramena okruhu. Následně je nezbytné odstranit katétr, neboť riziko tromboembolické příhody je vysoké. Pokud to stav dovolí, je výhodné provést rekonstrukci cév, zejména a. carotis communis [19].
Odvykání od ECMO podpory je v obou případech náročné a především finální rozhodnutí o ukončení a odpojení okruhu je obtížné, protože v případě zhoršení stavu je znovunapojení velmi komplikované, nebo zcela nemožné. Proto je zvláště v případě V-A podpory vhodné podrobné sledování hemodynamických parametrů (především reakce pravostranných oddílů ve smyslu kontraktilní funkce pravé komory, vývoje plicní hypertenze, ale i funkce levé komory, minutového výdeje a smíšené žilní saturace) v reakci na snižující se hemodynamickou podporu mimotělním oběhem a v případě intolerance (např. nárůst plicní hypertenze při snížení podpory) odvykání pozastavit nebo odložit.
Od října 2010 do srpna 2011 doby bylo na naše pracoviště odesláno 8 pacientů indikovaných odesílajícím pracovištěm k ECMO podpoře. Přehled pacientů je uveden v tabulce 3. Ve dvou případech šlo o novorozence, pět zbývajících dětí bylo v kojeneckém věku. U 6 pacientů bylo ECMO zahájeno. U 2 zbývajících dětí ECMO indikováno nebylo. V jednom případě šlo o bulózní formu bronchopulmonální dysplazie, která byla v konečné fázi zvládnuta konzervativně. Ve druhém případě se podařilo zlepšit oxygenační a oběhové parametry v krátkém časovém období tak, že už mimotělní podpora nebyla indikována.
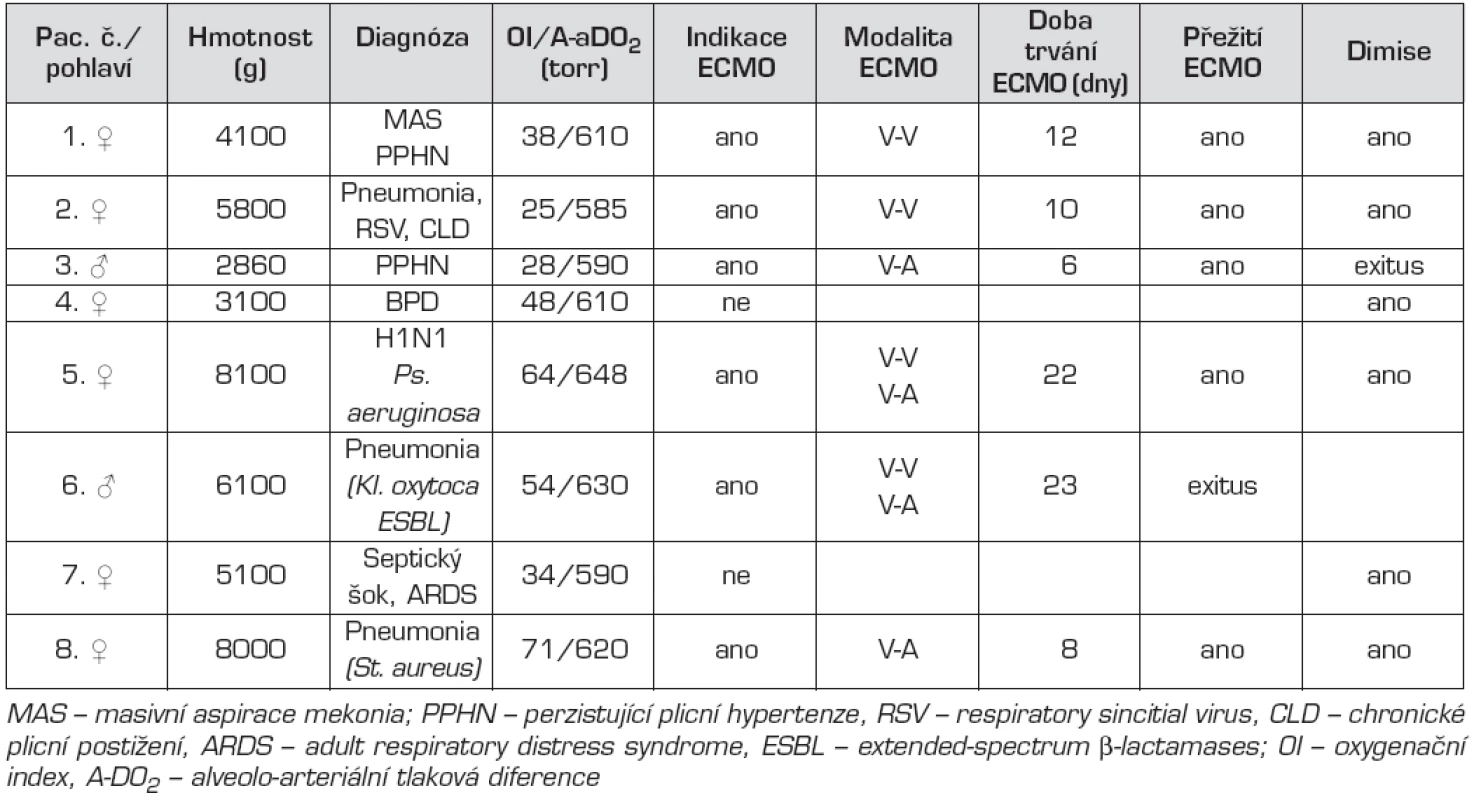
Ve 2 případech (pacienti č. 1 a 2) bylo provedeno V-V ECMO, u jednoho pacienta (č. 3) s těžkou formou perzistující plicní hypertenze byla zahájena V-A podpora. Chlapec zemřel jeden týden po úspěšném ukončení ECMO za příznaků recidivy těžké plicní hypertenze nezvládnutelné komplexní medikamentózní terapií. Histologická diagnostika příčin plicní hypertenze dosud probíhá. U pacientů č. 5 a 6 byla zprvu zvolena V-V modalita, pro známky progredující oběhové nedostatečnosti bylo nutné po 2 týdnech konvertovat na V-A způsob. Pacient č. 6 zemřel při ECMO podpoře. Příčinou byla těžce probíhající nekrotizující pneumonie (Klebsiella oxytoca ESBL). Všichni přeživší byli propuštěni domů a jsou při průběžném sledování po plicní stránce v pořádku. U pacienta č. 5 se jako komplikace objevila polyneuropatie kriticky nemocných a další intenzivní rehabilitační péče je nezbytná.
Schválení indikace k ECMO podpoře probíhá na našem pracovišti týmově. Po splnění vstupních kritérií musí se zahájením ECMO souhlasit většina pediatrických intenzivistů a následné zahájení schvaluje hlavní koordinátor ECMO programu, kardiochirurg, perfuzionista a dětský intenzivista. Po písemném souhlasu všech jmenovaných a souhlasu zákonných zástupců nemocného je pacient indikován k zahájení mimotělní membránové oxygenace.
Statistické hodnocení souboru vzhledem k četnosti nebylo provedeno.
DISKUSE
ECMO je život zachraňující metoda používaná v léčbě těžkého respiračního a oběhového selhání. Přežití pacientů léčených uvedenou metodou se pohybuje ve skupině novorozenců s respiračním selháním kolem 85 %, s kardiální příčinou 61 %. U ECMO indikovaného z důvodů kardiopulmonální resuscitace je přežití 63 %. U dětí jsou výsledky méně optimistické. Přežití u respiračního selhání je 65 %, u kardiálního 64 % a u ECPR 53 % [14]. Jsou to však pacienti, u kterých se predikovaná mortalita blíží 100 %.
V našem souboru byli dva novorozenci s nejčastější diagnózou, pro které je ECMO zahájeno. V prvním případě šlo o masivní aspiraci mekonia při těžké asfyxii. Masivní aspirace mekonia léčená ECMO má podle literárních údajů velmi dobrou prognózu přežití, až 97 % [20]. Prodělaná asfyxie není sama o sobě kontraindikací zahájení ECMO [21]. V časném stadiu po porodu, resp. v době indikace ECMO, nelze predikovat další neurologický vývoj. Podle některých prací je proto ECMO indikováno. V našem případě bylo u dítěte monitorováno EEG pomocí integrované amplitudy (aEEG), které vykázalo normalizaci ve 36. hodině života, což je širší pozitivní prediktivní hodnota pro neurologický vývoj. Proto bylo ECMO při splnění respiračních kritérií 7. den u pacientky zahájeno. U druhého novorozence důvodem pro připojení k ECMO byla perzistující plicní hypertenze, což je rovněž častá indikace. Stav byl V-A ECMO velmi rychle zvládnut a známky plicní hypertenze ustoupily. Po dekanylaci však došlo opět k rozvoji PPHN, stav se již nepodařilo i přes intenzivní medikamentózní a ventilační podporu zvládnout a znovunapojení ECMO z důvodu nevratné příčiny nebylo indikováno. Příčina zatím zůstává nejasná a vyšetření pokračuje. Ani u jednoho novorozence jsme nezaznamenali popisovanou komplikaci ve formě intrakraniálního krvácení. U dvou kojenců jsme museli původní V-V způsob konvertovat na V-A, což je podle některých prací nepříznivý prediktivní údaj [10]. Důvodem pro zahájení V-V podpory bylo těžké respirační selhání při nevýznamné oběhové nestabilitě. Ani u jednoho z těchto pacientů jsme však nemohli po zahájení ECMO zásadně snížit parametry ventilačního režimu a snížit tak riziko rozvoje plicního biotraumatu. U pacienta č. 6 se základní dg. nekrotizující pneumonie (Klebsiella oxytoca ESBL) došlo k rozvoji oboustranného těžkého barotraumatu, které se nepodařilo ani chirurgickým ošetřením zvládnout a chlapec exitoval. Zůstává k diskusi, zda u takto závažných plicních postižení by nebylo vhodné i při oběhové stabilitě zahájit přímo V-A ECMO. Jednotlivé kazuistiky jsou předmětem samostatného sdělení v tomto čísle (Černá O. et al, s. 13–17).
V recentní literatuře je patrný stoupající počet dětí s komorbiditou léčených pomocí ECMO, podle materiálů ELSO jde až o 46 % případů. Nejvyšší přežití bylo zjištěno u dětí s chronickým plicním postižením a u myokarditid (59 %, resp. 43 %). Naopak nejhorší výsledky přežití měli nemocní s jaterním selháním a děti po transplantaci kostní dřeně (16 %, resp. 5 %) [14]. Zejména u fulminantně probíhajících myokarditid je nutné indikaci ECMO terapie pečlivě zvážit. Na jedné straně je to způsob, jak překlenout kritický stav až do úpravy srdečních funkcí (bridge to recovery). V opačném případě, kdy je myokard nezvratně poškozen, by měla následovat transplantace (bridge to transplantation) [22]. V českém odborném písemnictví nejsou literární údaje o užití ECMO u dětí s komorbiditou.
ZÁVĚR
V práci je podán stručný přehled problematiky ECMO v léčbě respiračního a oběhového selhání u novorozenců a dětí. Je prezentován vlastní soubor pacientů za období posledních 7 měsíců. Naše zkušenosti lze shrnout do následujících bodů.
- Jde o vysoce specializovanou péči, kterou lze provádět na dobře vybaveném pracovišti, které dokáže zajistit ECMO jak u dospělých, tak i u dětí. (Ve VFN bylo do současné doby ECMO použito u 51 pacientů, z toho u 6 dětí.)
- Péče o dítě léčené mimotělní oxygenací je komplexní a multioborová.
- Velmi důležitá je péče nelékařského personálu, přítomnost 1 sestry/1 ECMO pacienta, trvalá přítomnost perfuzionisty.
- Včasnost indikace překladu pacienta k ECMO je klíčová. Včasné zahájení ECMO může zabránit nevratnému poškození plic v důsledku agresivního ventilačního režimu.
- Léčba je relativně nákladná. U většiny dětí přesáhla cena léčby 1 milion korun (zahraniční literární údaje uvádějí finanční náklady na ECMO terapii v rozmezí 50 000–100 000 $)[23].
- Je potěšující, že v České republice po několika letech absence je opět možné provádět ECMO i u novorozenců a dětí.
Práce vznikla částečně s podporou VZ 64165.
Došlo: 20. 6. 2011
Přijato: 10. 10. 2011
MUDr. Václav Vobruba
Klinika dětského a dorostového lékařství VFN a 1. LF UK
Ke Karlovu 2
121 09 Praha 2
e-mail: vaclav.vobruba@vfn.cz
Sources
1. Ventilation with lower tidal volumes as compared with traditional tidal volumes for acute lung injury and the acute respiratory distress syndrome. The Acute Respiratory Distress Syndrome Network. N Engl J Med 2000; 342 : 1301–1308.
2. Arnold JH, Anas NG, Luckett P, et al. High-frequency oscillatory ventilation in pediatric respiratory failure: A multicenter experience. Crit Care Med 2000; 28 : 3913–3919.
3. Willson DF. Effect of exogenous surfactant (calfactant) in pediatric acute lung injury: A randomized controlled trial (vol. 293, pg 470, 2005). JAMA – Journal of the American Medical Association 2005; 294 : 900–900.
4. DiCarlo JV, Pon S, Jefferson L, et al. Surfactant and pediatric acute lung injury – reply. JAMA – Journal of the American Medical Association 2005; 294 : 899–899.
5. Sokol J, Jacobs SE, Bohn D. Inhaled nitric oxide for acute hypoxic respiratory failure in children and adults: A meta-analysis. Anesthesia and Analgesia 2003; 97 : 989–998.
6. Curley MA, Thompson JE, Arnold JH. Effects of early and repeated prone positioning pediatric patients with acute lung injury (ALI). Crit Care Med 1999; 27: A125–A125.
7. Curley MA, Hibberd PL, Fineman LD, et al. Effect of prone positioning on clinical outcomes in children with acute lung injury: a randomized controlled trial. JAMA 2005; 294 : 229–237.
8. Flori HR, Glidden DV, Rutherford GW, et al. Pediatric acute lung injury: prospective evaluation of risk factors associated with mortality. Am J Respir Crit Care Med 2005; 171 : 995–1001.
9. Erickson S, Schibler A, Numa A, et al. Acute lung injury in pediatric intensive care in Australia and New Zealand: a prospective, multicenter, observational study. Pediatr Crit Care Med 2007; 8 : 317–323.
10. Zimmerman JJ, Akhtar SR, Caldwell E, et al. Incidence and outcomes of pediatric acute lung injury. Pediatrics 2009; 124 : 87–95.
11. Hill JD, O’Brien TG, Murray JJ, et al. Prolonged extracorporeal oxygenation for acute post-traumatic respiratory failure (shock-lung syndrome). Use of the Bramson membrane lung. N Engl J Med 1972; 286 : 629–634.
12. Barlett RH, Gazzaniga AB, Jefferies MR, et al. Extracorporeal membrane oxygenation (ECMO) cardiopulmonary support in infancy. Trans Am Soc Artif Intern Organs 1976; 22 : 80–93.
13. Van Meurs K, Lally KP, PeekG, et al. Extracorporeal Cardiopulmonary Support in Critical Care. 3rd ed. ELSO, 2005 : 1–273.
14. Zabrocki LA, Brogan TV, Statler KD. Extracorporeal membrane oxygenation for pediatric respiratory failure: Survival and predictors of mortality. Crit Care Med 2011; 39 : 364–370.
15. Schaible T, Hermle D, Loersch F, et al. A 20-year experience on neonatal extracorporeal membrane oxygenation in a referral center. Intens Care Med 2010; 36 : 1229–1234.
16. Reickert CA, Schreiner RJ, Bartlett RH, et al. Percutaneous access for venovenous extracorporeal life support in neonates. J Pediat Surg 1998; 33 : 365–369.
17. Muntean W. Coagulation and anticoagulation in extracorporeal membrane oxygenation. Artificial Organs 1999; 23 : 979–983.
18. Van Meurs K, Lally KP, Peek G, et al. Extracorporeal Cardiopulmonary Support in Critical Care. 3rd ed. ELSO, 2005, 1–371.
19. Moulton SL, Lynch FP, Cornish JD, et al. Carotid-artery reconstruction following neonatal extracorporeal membrane oxygenation. J Pediat Surg 1991; 26 : 794–799.
20. Karimova A, Brown K, Ridout D, et al. Neonatal extracorporeal membrane oxygenation: practice patterns and predictors of outcome in the UK. Arch Dis Child Fetal Neonatal Ed 2009; 94: F129–F132.
21. Massaro A, Rais-Bahrami K, Chang T, et al. Therapeutic hypothermia for neonatal encephalopathy and extracorporeal membrane oxygenation. J Pediatr 2010; 157 : 499–501.
22. Rajagopal SK, Almond CS, Laussen PC, et al. Extracorporeal membrane oxygenation for the support of infants, children, and young adults with acute myocarditis: a review of the Extracorporeal Life Support Organization registry. Crit Care Med 2010; 38 : 382–387.
23. Van Meurs K, Lally KP, Peek G, et al. Extracorporeal Cardiopulmonary Support in Critical Care. 3rd ed. ELSO, 2005 : 1–204.
Labels
Neonatology Paediatrics General practitioner for children and adolescentsArticle was published in
Czech-Slovak Pediatrics

2012 Issue Suppl 1
- What Effect Can Be Expected from Limosilactobacillus reuteri in Mucositis and Peri-Implantitis?
- The Importance of Limosilactobacillus reuteri in Administration to Diabetics with Gingivitis
-
All articles in this issue
- Extracorporeal Membrane Oxygenation – some history, present state and mainly the future
- ECMO (Extracorporeal Membrane Oxygenation) in the therapy of respiration and circulation failure in newborns and children
- ECMO (Extracorporeal Membrane Oxygenation) in the therapy of respiration and circulation failure in newborns and children: case reports
-
Terminálne zlyhanie obličiek u detí na Slovensku
Epidemiológia z Európskej perspektívy - Diagnosis and management of pediatric cataract
- Brain demyelination in children with Crohn’s disease
- Foreign body in the gastrointestinal tract – a case report and current diagnostic and therapeutic recommendations
- Syndrome of family abused by the child in children’s obesitology outpatient’s department
- The folic acid and neural tube defects – from past to present
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Diagnosis and management of pediatric cataract
- Foreign body in the gastrointestinal tract – a case report and current diagnostic and therapeutic recommendations
- ECMO (Extracorporeal Membrane Oxygenation) in the therapy of respiration and circulation failure in newborns and children
- The folic acid and neural tube defects – from past to present
