Diagnostika primární ciliární dyskineze
Diagnostics of primary ciliary dyskinesia
Examination technique in the diagnosis of primary ciliary dyskinesia is not entirely uniform throughout the world. A process designed and used in FNM involves a thorough patient history including evaluation of clinical index, cilia examination using high-speed videomicroscopy, nasal NO, ciliary ultrastructural examination by electron microscopy, and possibly genetic testing. Every single step of the examination process has its informative value, however, must always be evaluated in the context of the results of other tests.
Key words:
primary ciliary dyskinesia, clinical index, high-speed videomicroscopy, electron microscopy
Authors:
P. Šimůnková 1,2; J. Uhlík 2; T. Svobodová 1; J. Djakow 3; P. Pohunek 1
Authors‘ workplace:
Pediatrická klinika 2. LF UK a FN Motol, Praha
přednosta prof. MUDr. J. Lebl, CSc.
1; Ústav histologie a embryologie 2. LF UK, Praha
přednosta MUDr. J. Uhlík, Ph. D.
2; Oddělení chronické resuscitační a intenzivní péče pro děti, Nemocnice Hořovice
primář MUDr. D. Blažek
3
Published in:
Čes-slov Pediat 2016; 71 (2): 104-110.
Category:
Review
Overview
Vyšetřovací postup při diagnostice primární ciliární dyskineze není ve světě zcela jednotný. Ve FNM navržený a používaný postup zahrnuje důkladné zpracování anamnézy včetně vyhodnocení klinického indexu, vyšetření řasinek pomocí vysokorychlostní videomikroskopie, nazální NO, vyšetření ultrastruktury řasinek pomocí elektronové mikroskopie a eventuálně genetické vyšetření. Každý jednotlivý krok vyšetřovacího procesu má svou výpovědní hodnotu, nicméně musí být vždy hodnocen v kontextu výsledků ostatních vyšetření.
Klíčová slova:
primární ciliární dyskineze, klinický index, vysokorychlostní videomikroskopie, elektronová mikroskopie
Úvod
Primární ciliární dyskineze (PCD) patří do skupiny onemocnění zvaných ciliopatie. Řasinky (lat. cilia) všech třech typů (primární, nodální a pohyblivé) se účastní mnoha dějů v organismu včetně embryogeneze a z toho také vyplývá heterogenita těchto onemocnění. Genetický defekt pohyblivých řasinek vyústí v PCD. Prevalence se pohybuje od 1 : 10 000 až k 1 : 30 000 v závislosti na geografické lokalitě. Podle některých autorů je PCD po cystické fibróze druhou nejčastější příčinou bronchiektázií v dětském věku, v některých studiích je řazena až na 4. místo po CF, aspiračních syndromech a defektech imunity [1].
Vrozená porucha funkce řasinek se u značného počtu pacientů projeví ihned po porodu novorozeneckou respirační tísní [2, 3] s přechodnou potřebou oxygenoterapie či jiné dechové podpory. Mnohdy lze u dítěte již v novorozeneckém období pozorovat sekreci z nosu (tzv. novorozeneckou rýmu), která nevymizí a provází dítě až do dospělosti. Již v prvním roce života se mohou objevit opakované záněty středouší či chronická sekretorická otitida, které mohou postupně vyústit v poruchu sluchu a opožděný vývoj řeči. Dyskineze vede ke stagnaci hlenu také v dolních dýchacích cestách. Porušená mukociliární clearance vede k opakovaným zánětům, často i s projevy průduškové obstrukce. Mnohdy jsou tyto děti sledovány s diagnózou průduškového astmatu a někdy vedeny až jako obtížně léčitelné astma. K dalším častým příznakům patří opakované pneumonie.
Diagnostika PCD
Nejdůležitějším krokem je správné zpracování anamnézy, z níž vyplývá indikace screeningového vyšetření. Situs viscerum inversus či jiná forma heterotaxie je vyjádřena u 40–50 % pacientů s PCD a přibližně 25 % dětí se situs viscerum inversus má PCD. Dyskineze může být spojena i se srdečními vadami, jako jsou transpozice velkých tepen, defekty septa či jiné komplexní vady [4]. Kašel a rýma jako důsledek alterace mukociliární clearance jsou příznakem každodenním. Při absenci zahlenění přetrvávajícího po většinu dnů v roce je diagnóza PCD sporná.
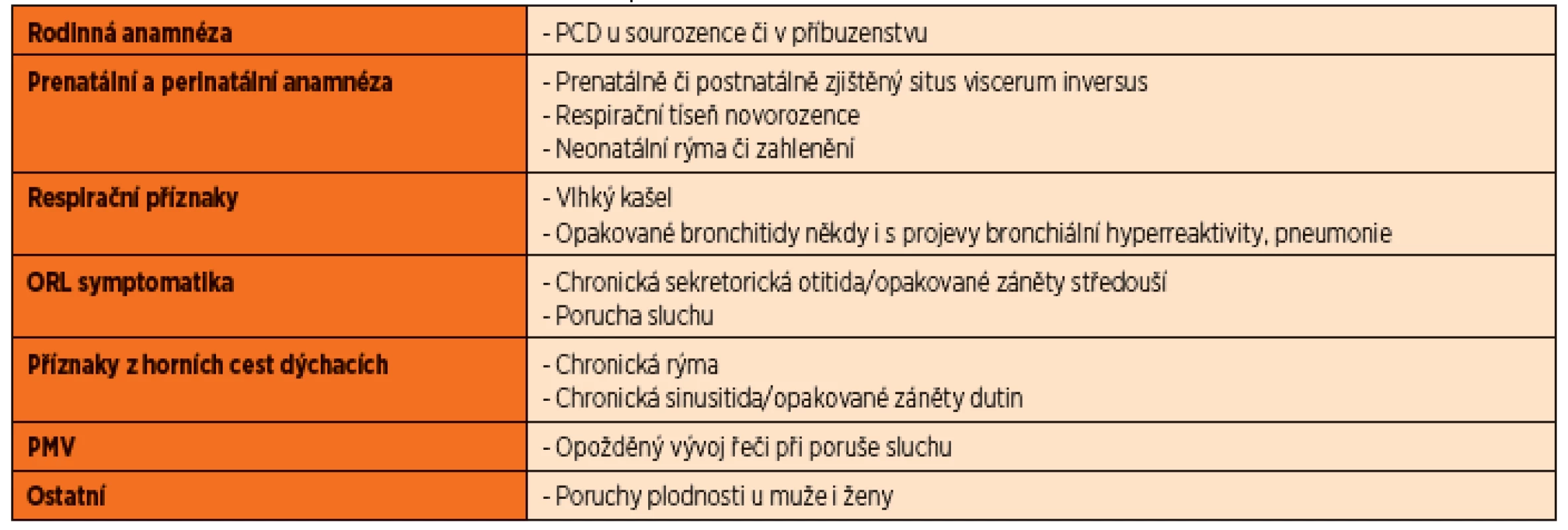
Klinický index
Na základě ověřených anamnestických dat lze vypočítat klinický index rizika [5]. Tento index byl navržen na Pediatrické klinice FN Motol jako pomůcka při hodnocení stupně rizika diagnózy PCD a vodítko pro indikaci diagnostických testů. Je nezbytné, aby byl index vyhodnocen lékařem na základě pečlivého zhodnocení klinických údajů pacienta. Dotazník obsahuje 7 bodů a je zaměřen na klinické obtíže provázející PCD (tab. 2).
Vyhodnocení indexu (tab. 3) je relevantní zejména u pacientů starších tří let. Je zřejmé, že novorozenec s podezřením na PCD pro situs viscerum inversus, RDS a neonatální rýmu bude mít nízký klinický index (2), jelikož neměl čas vyvinout jiné klinické obtíže, ale k vyšetření je zcela jistě indikován. Pokud je riziko vyšší nebo rovné třem, indikujeme po vyloučení ostatních příčin (viz níže) u pacienta provedení diagnostických testů.

Diagnostické testy
Na základě anamnézy a vyhodnocení klinického indexu přistupujeme k vyšetření ve specializovaném centru. Indikace k odeslání pacienta k vyšetření by měla být pečlivě zvážena. Před odesláním pacienta je třeba vyloučit ORL etiologii obtíží (syndrom zadní rýmy, adenoidní vegetace), CF, chorobu z gastroezofageálního refluxu s extra-ezofageálními příznaky, poruchu imunity. Sekundární změny motility řasinek, které mohou vznikat vlivem vnějších příčin, jako např. infekční onemocnění, chemické vlivy prostředí, alergie, lze obvykle odlišit opakovaným vyšetřením v odstupu 4–6 týdnů; někdy je třeba takové vyšetření provést i vícekrát.
Vysokorychlostní videomikroskopie
Prvním krokem a zároveň stěžejním bodem při diagnostice PCD je vyšetření pohybu řasinek pomocí vysokorychlostní videomikroskopie (high-speed-videomicroscopy – HSVM). Principem vyšetření je pozorování řasinek pokrývajících apikální povrchy buněk respiračního epitelu. V období před odběrem je nutné se vyvarovat použití lokálních léčiv s obsahem vazokonstrikčních látek, které způsobují poruchu funkce řasinek. Pacient by měl být v době odběru ideálně alespoň 1 měsíc bez známek akutního respiračního infektu.
Odběr je velice rychlý, bez premedikace a bez lokální anestezie, není k němu třeba speciální příprava pacienta. Epitel je odebírán pomocí cytologického kartáčku (délka 10 mm, délka štětinek 2 mm) do živného roztoku (složení viz tab. 4), ve kterém jsou řasinky schopné pohybu ještě 6 až 8 hodin po odběru. Odběr provádíme z jednoho nosního vchodu, kartáček směřujeme mediálně mírně kaudálně, ideálně pod concha nasalis inferior. Zadopředním a částečně kroutivým pohybem provedeme epiteliální stěr, kartáček s materiálem ponoříme do živného roztoku (1–2 ml) v plastové zkumavce, poté odebraný materiál vytřepeme rychlými pohyby z kartáčku. Je důležité mít roztok o správné teplotě. Čím nižší je teplota, tím nižší je frekvence pohybu řasinek a naopak [6]. Jelikož se roztok uchovává v lednici, je vhodné zkumavky s roztokem nechat před vyšetřením 30 minut temperovat na pokojovou teplotu.

Pohyb řasinek je velice rychlý, proto není možné při pozorování pod jednoduchým optickým mikroskopem bez vysokorychlostní videokamery spolehlivě zhodnotit charakter pohybu. Vysokorychlostní kamerou připojenou na mikroskop s proměnnou ohniskovou vzdáleností při zvětšení 1000–2000x natáčíme videa o délce 1–2 s. Videomikroskopem Keyence®, který je používán ve FN Motol, pořizujeme 250 snímků za sekundu. Takto natočíme 5–10 lemů a pozorujeme zpomalený videozáznam. K záznamu vybíráme nejlépe zachované úseky epitelu o délce alespoň 4–5 buněk. Samostatné buňky nehodnotíme, jsou často dyskinetické i u zdravých jedinců.
Prvním krokem při vyhodnocení záznamu je určení frekvence pohybu. V každém nahraném lemu vyšetřující zaznamená počet cyklů, které reprezentativní skupina řasinek provede za 250 snímků (tj. za 1 sekundu), což odpovídá frekvenci v Hz. Průměr těchto hodnot se rovná frekvenci v pozorovaném vzorku. Normální frekvence se pohybuje mezi 7–13 Hz, pozorujeme-li řasinky při pokojové teplotě, a 11–20 Hz při teplotě 37 °C. Patologická je jak nízká, tak vysoká frekvence, nicméně samotná hypokineze či hyperkineze není patognomická pro PCD. Vždy (pokud nejde o kompletní akinezi) musí být přítomen patologický vzorec pohybu.
Zásadní součástí hodnocení HSVM je rozpoznání fází vlny pohybu řasinky. Typický cyklus pohybu řasinky se skládá z dopředné fáze (forward stroke), která zajišťuje kontakt řasinky s hlenem a posouvá ho vpřed, a zpětné fáze (recovery stroke, backward sweep), kdy se řasinka vrací do původní polohy, aniž by přišla do kontaktu s vrstvou hlenu.
Při vyšetření je třeba posoudit i pohyb při pohledu shora (tzv. overhead projection), jedině tak odhalíme patologický pohyb cirkulárního či eliptického charakteru, který se vyskytuje například při poruše radiálních struktur řasinek.
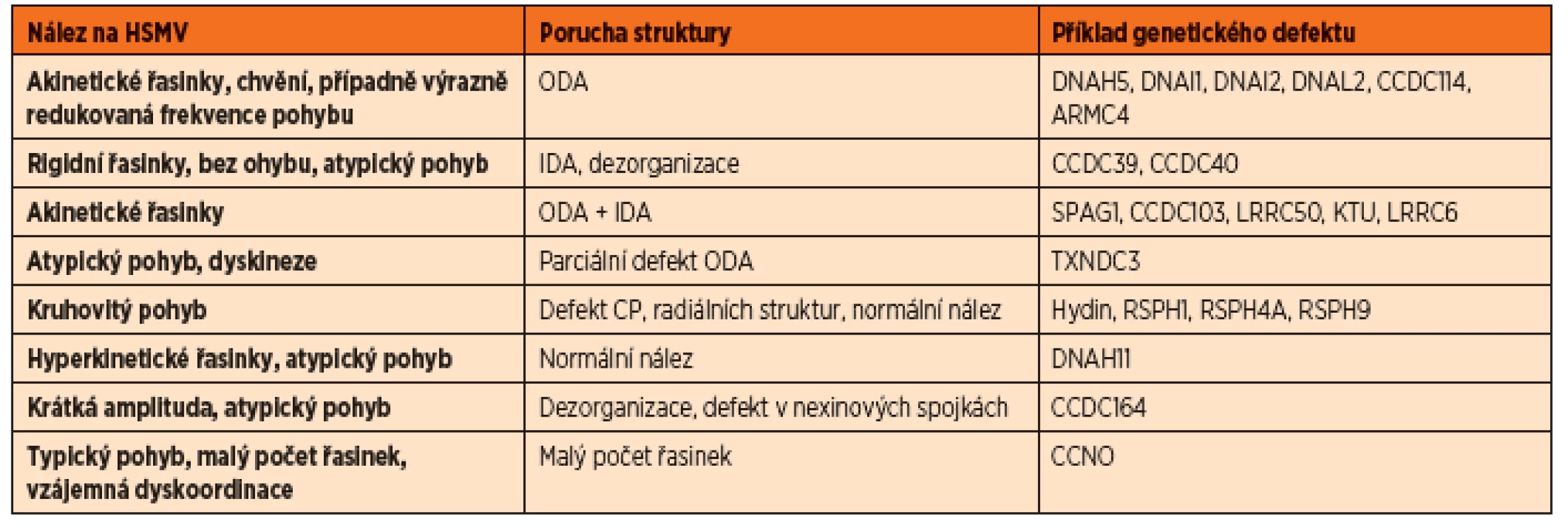
Primární ciliární dyskineze je onemocněním heterogenním, což se projeví i na velkém množství možných patologií při vyšetření hybnosti řasinek. Nejlépe odhalitelnou poruchou je defekt vnějších dyneinových ramének (ODA) i vnitřních dyneinových ramének (IDA). Video zobrazí zcela statické akinetické řasinky. Při izolované poruše ODA někdy můžeme pozorovat chvění některých řasinek nebo i lineární pohyb některých řasinek vždy s extrémně nízkou frekvencí (do 3 Hz). Defekt IDA je zodpovědný za poruchu charakteru pohybu, zkrácení amplitudy, rigiditu řasinky, poruchu v rozlišení fází forward a recovery stroke. Některé genetické defekty nemají svůj korelát odhalitelný v ultrastruktuře řasinek, ta je pak hodnocena jako normální. Příkladem je genetický defekt DNAH11, který typicky způsobuje hyperkinetický atypický pohyb. Při nově popsané mutaci CCNO jsou viditelné dobře hybné řasinky, které jsou ale na apikálním povrchu buněk ve velmi malém počtu a jsou vzájemně dyskoordinované, mukociliární clearance je tedy neefektivní.
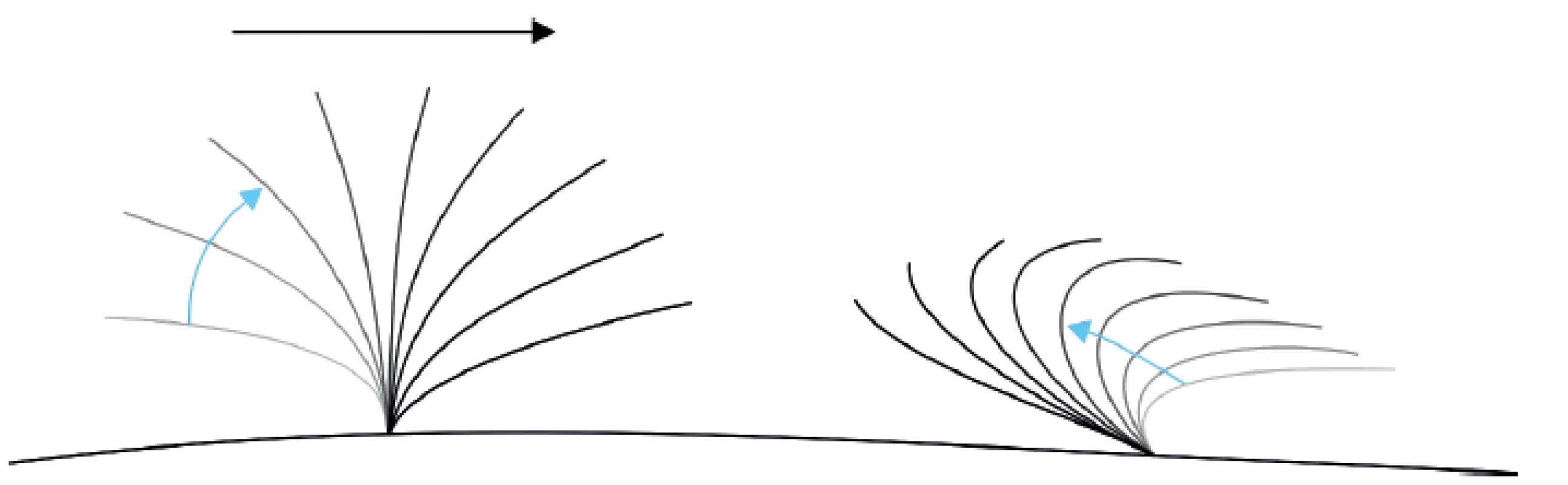
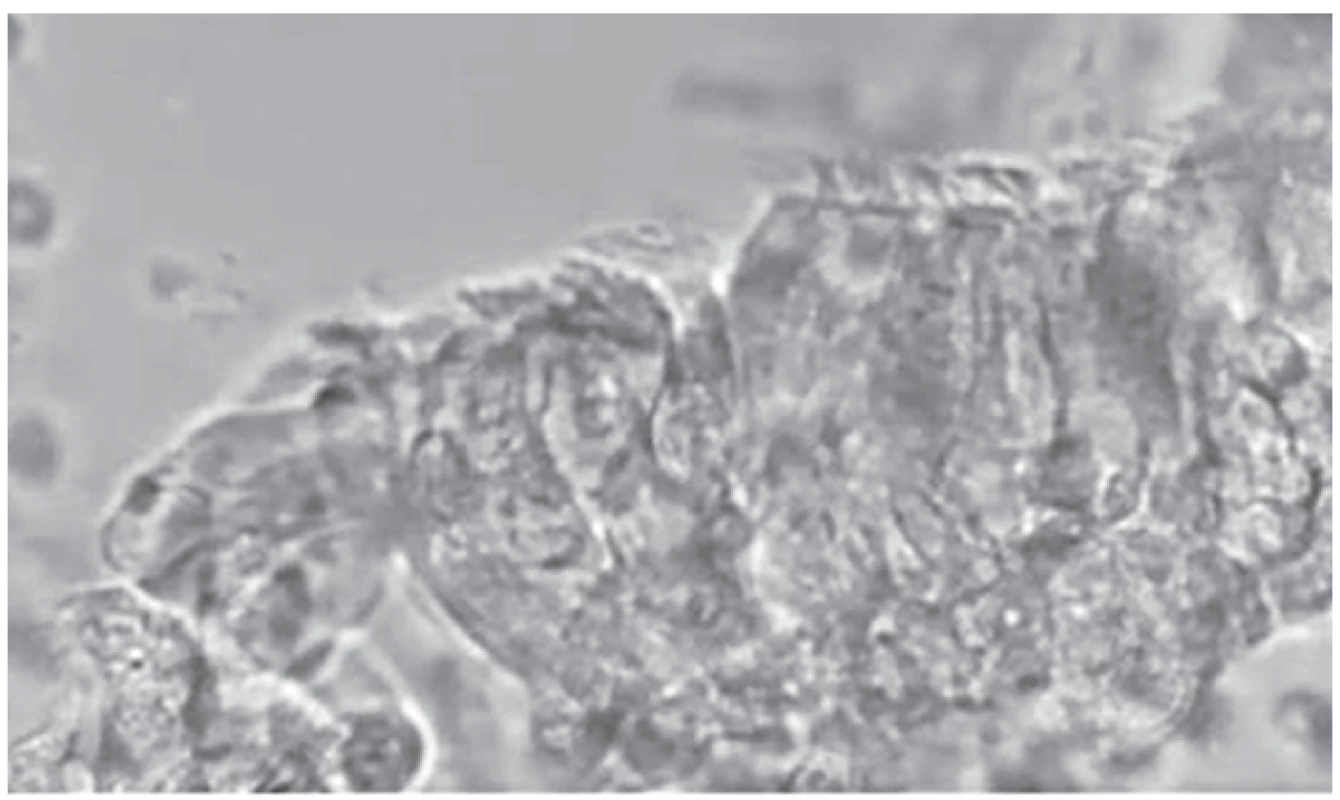
V mnohých případech je nález na HSVM sporný – řasinky jsou hybné, ale charakter pohybu není úplně normální, není však ani zcela charakteristický pro PCD. Taková situace nejčastěji nastává při sekundárním poškození řasinek. Pro sekundární dyskinezi hovoří stav, kdy je porucha hybnosti v různých částech vzorku odlišná. Takový nález však vyžaduje kontrolu s odstupem, především při suspektní anamnéze. Pokud je anamnéza velice suspektní, opakujeme vyšetření i při drobných odchylkách od normy, jelikož jsou známy i genetické mutace, jejichž nález na HSVM je velice nenápadný.
Další možností, jak vyloučit sekundární příčinu dyskineze, je vyšetření řasinek v buněčných kulturách. Řasinkové buňky pacienta jsou pěstovány v laboratorních podmínkách, tedy s vyloučením sekundárních činitelů způsobujících atypie při pohybu. Případná porucha hybnosti při pozorování pomocí HSVM bude tedy vždy způsobena příčinou vnitřní – genetickou. Toto vyšetření není v současnosti k dispozici nikde v České republice pro jeho náročnost i relativní vzácnost jeho indikace.
Nazální NO
Vyšetření motility řasinek obvykle doplňujeme vyšetřením nosního oxidu dusnatého (NO). Vyšetření lze provést u pacientů, kteří jsou schopni 45 s dýchat pouze ústy, tedy přibližně od 3 let věku v závislosti na spolupráci dítěte. Vyšetření provádíme na přístroji Aerocrine NIOX. Produkce NO v nosních dutinách u pacientů s PCD je obvykle velmi nízká [7, 8]. Patogeneze tohoto jevu je prozatím neznámá, studie na toto téma nejsou jednotné. Test je zařazen jako screeningový, jeho význam je však v současnosti nutno brát jako doplňkový k dalším testům, především HSVM a vyšetření ultrastruktury řasinek. Koncentrace NO ve vzduchu odsávaném z nosu je sice u většiny pacientů s PCD nízká (<100 ppb – cut off používaný při diagnostice ve FNM), jsou však známy případy [8], kdy je produkce nazálního NO i u pacientů s PCD normální či vysoká. Nízké hodnoty nazálního NO však nejsou typické jen pro PCD. Mohou se objevit i při cystické fibróze, aplazii paranazálních dutin, chronické sinusitidě a některých dalších chorobách.
Vyšetření elektronovou mikroskopií (EM)
Dalším krokem při vyšetření řasinek respiračního epitelu je zhodnocení jejich ultrastruktury. K elektronové mikroskopii přistupujeme při suspektním nálezu na HSVM a pozitivní anamnéze po vyloučení jiné příčiny obtíží. Zpracování vzorků a vyhodnocení je časově náročně, indikováni jsou tedy jen pečlivě vybraní pacienti. Vyšetření rozhodně nepatří na první místo v diagnostickém postupu.
Materiál ke zpracování pro vyšetření EM lze získat dvojím způsobem. Buňky respiračního epitelu odebereme buď z nosní sliznice stejně jako na HSVM, nebo lze získat materiál endobronchiální biopsií provedenou při bronchoskopii. Obě metody mají své výhody a hodí se pro různé situace. Odběr z nosu je šetrnější vůči pacientovi, není třeba anestezie, je to vyšetření minimálně invazivní. Materiál však často není dostatečně objemný, zpracování je náročnější, vyhodnocení je také složitější a zabere více času. Bioptický vzorek bronchiální sliznice má výhodu v zachování integrity odebrané tkáně, takže získáme informaci nejen o ultrastruktuře řasinek. Hodnotit lze i vzájemnou orientaci řasinek, lze přehlédnout celý epitel včetně pohárkových buněk, změřit tloušťku bazální membrány a často i posoudit hlubší vrstvy sliznice včetně přítomnosti buněk zánětu. Pacient, u kterého zvažujeme diagnózu PCD, bývá téměř vždy indikován k vyšetření flexibilní bronchoskopií k současnému odběru vzorků mikrobiálního osídlení, posouzení stavu sliznice, množství a kvality hlenu, podle potřeby k terapeutické bronchiální toaletě a posouzení eventuálních anatomických změn. Z těchto důvodů v naprosté většině případů ve FN Motol volíme odběr při bronchoskopii.
Pokud se provádí odběr v bezprostřední blízkosti laboratoře, která bude vzorky zpracovávat, fixujeme odebrané vzorky bronchiální sliznice v 5% pufrovaném glutaraldehydu (např. v 0,1 M kakodylátovém pufru o pH 7,2) a okamžitě předáváme ke zpracování pro elektronovou mikroskopii. Pokud je nutný transport vzorků, volíme nižší koncentraci pufrovaného glutaraldehydu (obvykle 2,5%) a vzorek pošleme do laboratoře tak, aby ho bylo možné zpracovat během 24 hodin, přičemž ho chráníme před extrémními teplotami. Volíme-li odběr kartáčkovou biopsií nosní sliznice, fixujeme vždy 2,5% pufrovaným glutaraldehydem. Konečné zhodnocení ultrastruktury řasinek vyžaduje zkušeného histologa. K vyslovení validního závěru je nutné shlédnout a zdokumentovat stovky příčných řezů jednotlivých řasinek z různých částí vzorku, z různých etáží délky řasinek, a zhodnotit apikální cytoplazmu řasinkových buněk. Na příčném řezu (obr. 3) se hodnotí celková organizace axonematu, přítomnost centrálního páru mikrotubulů a všech devíti periferních dubletů a eventuální nadpočetné či chybějící mikrotubuly, přítomnost a celistvost vnějších a vnitřních dyneinových ramének a radiálních struktur.
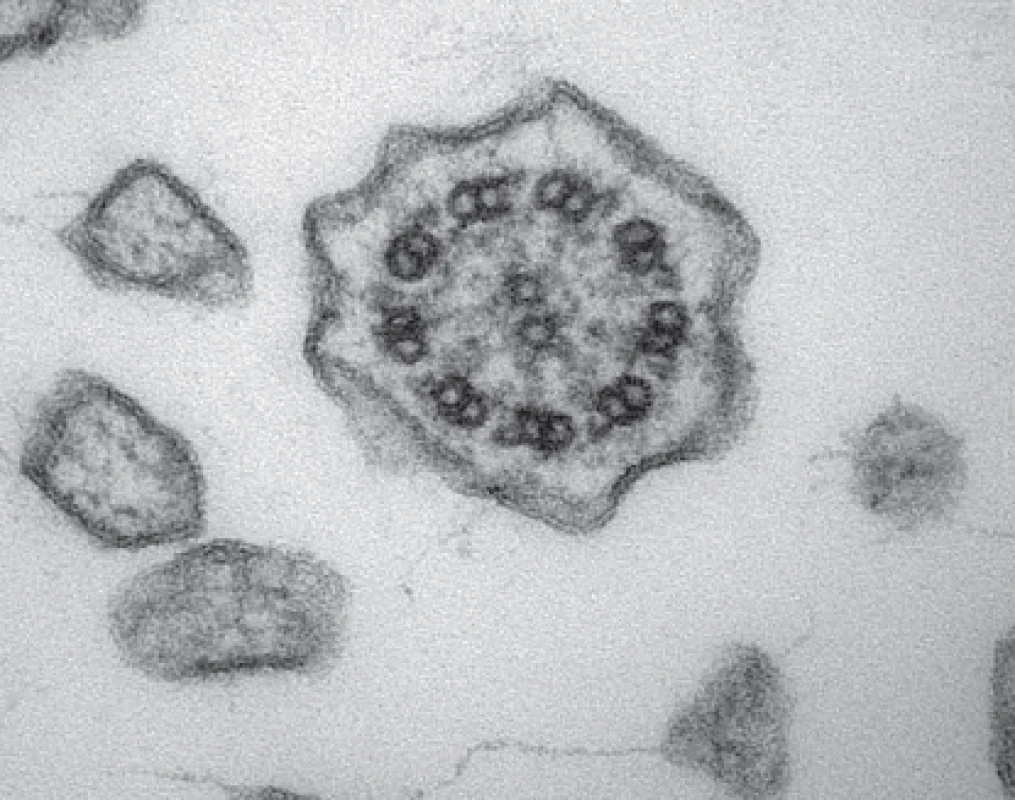
Závěrem vyšetření je celkové zhodnocení nálezu a vyjádření k ultrastruktuře řasinek, která může být normální, patologická ve smyslu primární ciliární dyskineze, nebo patologická ve smyslu sekundárních změn v ciliárním aparátu. Je nutné zdůraznit, že normální ultrastruktura řasinek PCD nevylučuje. Je známo, že až 30 % pacientů má variantu PCD, která se neprojevuje defektem ultrastruktury [10] (tab. 5), porucha je čistě funkční a není při vyšetření elektronovou mikroskopií zachytitelná.
Genetika
V současné době je známo asi 30 genů, jejichž mutace způsobují poruchu ciliárních funkcí. V budoucích letech se očekává nárůst tohoto čísla. Proto je i při maximálním využití všech dnešních možností genetická diagnostika náročná. Přesnou genetickou diagnózu je v dnešní době možné stanovit jen asi u dvou třetin pacientů s PCD. Ke stanovení je pak často nutné kombinovat možnosti klasického Sangerova sekvenování s postupy sekvenování nové generace. Při znalostech klinického průběhu, nálezu HSVM a elektronové mikroskopie je možné vyšetřit pouze kandidátní geny v závislosti na možnostech centra.
Závěr
Primární ciliární dyskineze je heterogenní onemocnění, jehož diagnostika má mnohá úskalí. Neexistuje jediný samostatný test, který by diagnózu potvrdil nebo vyloučil. Při vyšetření je třeba zkušený tým zdravotníků a podrobná znalost klinického průběhu onemocnění. Konečná diagnóza se opírá o soubor informací získaných při odběru anamnézy a z provedených vyšetření. Anamnézu i jednotlivá vyšetření je vždy třeba hodnotit ve vzájemném kontextu, výpovědní hodnota jednotlivých samostatně provedených vyšetření je obecně nízká. Soustředění všech diagnostických modalit do jednoho centra je tudíž téměř nutností.
Přehled použitých zkratek
PCD – primární ciliární dyskineze
HSVM – vysokorychlostní videomikroskopie; high-speed-videomicroscopy
nNO – nazální oxid dusnatý
IDA – vnitřní dyneinová raménka, inner dynein arms
ODA – vnější dyneinová raménka, outer dynein arms
CP – centrální pár
EM – elektronová mikroskopie
BSK – bronchoskopie
CF – cystická fibróza

Poděkování
Autoři děkují doc. MUDr. Ondřeji Rybníčkovi, Ph.D., za velmi cenné připomínky a podněty při zpracování rukopisu.
Práce byla podpořena projektem (Ministerstva zdravotnictví) koncepčního rozvoje výzkumné organizace 00064203 (FN Motol).
Tento text vychází z práce v rámci projektu BEAT-PCD (COST Action 1407), podporovaného z COST (European Cooperation in Science and Technology).
Došlo: 7. 1. 2016
Přijato: 28. 1. 2016
MUDr. Petra Šimůnková
Ústav histologie a embryologie 2. LF UK
Plzeňská 221/130
150 00 Praha 5
e-mail: petra.simunkova@lfmotol.cuni.cz
Sources
1. Brower KS, Del Vecchio MT, Aronoff SC. The etiologies of non-CF bronchiectasis in childhood: a systematic review of 989 subjects. BMC Pediatrics 2014; 14 (4). doi: 10.1186/s12887-014-0299-y.
2. Hosie PH, Fitzgerald DA, Jaffe A, et al. Presentation of primary ciliary dyskinesia in children: 30 years‘ experience. J Paediatr Child Health 2015; 51 (7): 722–726.
3. Mullowney T, Manson D, Kim R, et al. Primary ciliary dyskinesia and neonatal respiratory distress. Pediatrics 2014;134 (6): 1160–1166.
4. Kennedy MP, Omran H, Leigh, et al. Congenital heart disease and other heterotaxic defects in a large cohort of patients with primary ciliary dyskinesia. Circulation 2007; 115 : 2814–2821.
5. Djakow J, Svobodová T, Pohunek P. Primární ciliární dyskineze. Pediatr praxi 2013; 14 (6): 368–371.
6. Humphries S. A physical explanation of the temperature dependence of physiological processes mediated by cilia and flagella. Proceedings of the National Academy of Sciences 2013; 110 (36): 14693–14698.
7. Corbelli R. Nasal nitric oxide measurements to screen children for primary ciliary dyskinesia. Chest 2004; 126 (4): 1054–1059.
8. Collins SA, Gove K, Walker W, Lucas JSA. Nasal nitric oxide screening for primary ciliary dyskinesia: systematic review and meta-analysis. Eur Respir J 2014; 44 (6): 1589–1599.
9. Papon JF, Coste A, Roudot-Thoraval F, et al. A 20-year experience of electron microscopy in the diagnosis of primary ciliary dyskinesia. Eur Respir J 2010; 35 (5): 1057–1063.
Labels
Neonatology Paediatrics General practitioner for children and adolescentsArticle was published in
Czech-Slovak Pediatrics

2016 Issue 2
- What Effect Can Be Expected from Limosilactobacillus reuteri in Mucositis and Peri-Implantitis?
- The Importance of Limosilactobacillus reuteri in Administration to Diabetics with Gingivitis
-
All articles in this issue
- Psychosociální aspekty nespecifických střevních zánětů u dětí
- Školy při nemocnicích a dalších zdravotnických zařízeních
- Význam stanovovania nazálneho oxidu dusnatého u detí – prvé skúsenosti
- Čo sa môže skrývať za diagnózou atypickej cystickej fibrózy?
- Neketotická hyperglycinémie: případ závažné kongenitální hypotonie diagnostikovaný magnetickou rezonancí
- Hlboká venózna trombóza u dieťaťa s nefrotickým syndrómom
- Záhadná erupce na břiše
- Infekce způsobené Shiga toxin-produkujícími Escherichia coli u dětí
- Diagnostika primární ciliární dyskineze
- Primární bifázický synoviální sarkom jazyka u kojence: Kazuistika vzácného onemocnění s přehledem literatury
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Infekce způsobené Shiga toxin-produkujícími Escherichia coli u dětí
- Čo sa môže skrývať za diagnózou atypickej cystickej fibrózy?
- Neketotická hyperglycinémie: případ závažné kongenitální hypotonie diagnostikovaný magnetickou rezonancí
- Školy při nemocnicích a dalších zdravotnických zařízeních

