Infekce způsobené Shiga toxin-produkujícími Escherichia coli u dětí
Shiga toxin-producing Escherichia coli infections in children
Shiga toxin-producing Escherichia coli (STEC) are an important cause of diarrhea and the major cause of typical form of hemolytic-uremic syndrome (HUS) worldwide. Manifestation of STEC infection can be diverse, from uncomplicated diarrhea through hemorrhagic colitis, to a serious systemic disease – HUS, that is the most common cause of acute kidney injury, especially in young children.
Due to possible progression of diarrhea to life-threatening illness, all physicians treating patients with diarrhea should get familiar with the epidemiology, pathogenesis and clinical symptomes of infection caused by the organism.
This article describes the history, epidemiology, pathogenesis, clinical aspects, and diagnostic methods of STEC infections.
Key words:
Shiga toxin-producing E. coli (STEC), hemolytic-uremic syndrome (HUS), STEC-HUS/typical HUS/classical form of HUS/diarrhea positive HUS/D+HUS, diagnosis, epidemiology, clinical symptoms
Authors:
L. Karnišová 1; F. Fencl 1; M. Marejková 2; M. Malina 1; J. Zieg 1; K. Bláhová 1
Authors‘ workplace:
Pediatrická klinika 2. LF UK a FN Motol, Praha
přednosta prof. MUDr. J. Lebl, CSc.
1; Národní referenční laboratoř pro E. coli a shigely, Státní zdravotní ústav, Praha
vedoucí ing. M. Marejková, Ph. D.
2
Published in:
Čes-slov Pediat 2016; 71 (2): 98-103.
Category:
Review
Overview
Shiga toxin-produkující Escherichia coli (STEC) jsou celosvětovými původci průjmového onemocnění a nejčastější příčinou vzniku hemolyticko-uremického syndromu (HUS) u dětí. Manifestace infekce STEC je různorodá. Zahrnuje průjmová onemocnění různé tíže, od nekomplikovaného průjmu přes hemoragickou kolitidu, až po rozvoj závažného systémového onemocnění – HUS, který patří mezi nejčastější příčiny akutního poškození ledvin zejména u malých dětí.
Vzhledem k možné progresi průjmu v život ohrožující stav by měli být všichni lékaři ošetřující pacienty s průjmovým onemocněním obeznámeni s epidemiologií, patogenezí a klinickými příznaky infekce způsobené těmito bakteriemi.
Článek pojednává o historii, epidemiologii, klinických aspektech a diagnostice infekcí STEC.
Klíčová slova:
Shiga toxin-produkující E. coli (STEC), hemolyticko-uremický syndrom (HUS), STEC-HUS/typický HUS/klasická forma HUS/diarrhea pozitivní HUS/D+HUS, diagnostika, epidemiologie, klinické příznaky
Úvod
Escherichia coli je běžným komenzálem tlustého střeva člověka a teplokrevných živočichů, ale určité kmeny mohou vyvolat lidská onemocnění jak střevní, tak mimostřevní. Shiga toxin-produkující E. coli (STEC) jsou jedním ze závažných patogenů způsobujících gastrointestinální onemocnění a jsou také považovány za nejčastější původce hemolyticko-uremického syndromu (HUS) u dětí. Avšak ne všechny kmeny STEC jsou patogenní pro člověka. STEC vyvolávající onemocnění u lidí se též označují jako enterohemoragické E. coli (EHEC) na základě jejího prvního záchytu u pacientů s hemoragickou kolitidou, v článku pro lepší srozumitelnost je používaný obecně termín STEC.
HUS vyvolaný STEC (synonyma – typický HUS/klasická forma HUS/diarrhea pozitivní HUS/D + HUS) se vyvíjí jako systémová komplikace průjmu v důsledku toxémie po absorpci Shiga toxinu (Stx) ze střeva do krevního oběhu a je charakterizován klinickou triádou – mikroangiopatická hemolytická anémie, trombocytopenie a akutní renální poškození [1]. Může mít závažný průběh vyžadující intenzivní péči. Asi u 70 % pacientů je nutné podání transfuze a ve 40–50 % případů je nezbytné zahájit některou eliminační metodu, průměrná doba léčby je 10 dnů [2].
Pro STEC je charakteristická schopnost produkce cytotoxinů, Shiga toxinů, které inhibují proteosyntézu eukaryotických buněk. První souvislost mezi E. coli produkující Shiga toxiny a rozvojem HUS popsali v Kanadě v roce 1983 Karmali a spol., kdy ve vzorcích stolice osmi dětí s HUS vykultivovali kmeny E. coli produkující toxin, který způsoboval ireverzibilní poškození buněčné linie Vero (proto dřívější označení toxinu jako Verotoxin, VT) [3]. Bezprostředně poté Riley a spol. publikovali výsledky studie dvou epidemií, které byly spojeny s konzumací hamburgerů z nedostatečně tepelně upraveného hovězího masa. U většiny pacientů se rozvinula závažná hemoragická kolitida a ve stolicích a vzorku masa byl kultivačně prokázán do té doby neobvyklý sérotyp E. coli O157:H7 [4]. V témže roce popsali O´Brien se spolupracovníky souvislost mezi toxigenitou E. coli O157:H7 a Shigelly dysenteriae typu 1. Vzhledem ke skutečnosti, že aktivita Verotoxinu byla neutralizována protilátkami proti Shiga toxinu S. dysenteriae, byly hlavní faktory virulence STEC později přejmenovány z Verotoxinů na Shiga toxiny (Stx), které se užívají jako synonyma [5]. Podle současné nomenklatury existují dva hlavní typy toxinů, Stx1a a Stx2a [6]. Stx1a je většinou přítomen u kmenů STEC izolovaných od pacientů s nekomplikovaným průjmem a je téměř identický se Shiga toxinem S. dysenteriae typu 1. Stx2a je obecně virulentnější, vykazuje vyšší cytotoxicitu vůči endoteliím, a proto bývá významně častěji identifikován u STEC izolovaných od pacientů s HUS [1, 7].
Epidemiologie
V současné době je známo přes 400 sérotypů STEC, z nichž více než 100 bylo popsáno ve spojení s lidským onemocněním a lze je tedy klasifikovat jako EHEC. Celosvětově nejvíce rozšířeným sérotypem STEC je O157:H7, který byl po dlouhou dobu považován za jediný sérotyp STEC způsobující typickou formu HUS (D+HUS, STEC-HUS). Během doby byly však v souvislosti s rozvojem HUS izolovány i další sérotypy STEC, tzv. non-O157:H7 STEC, z nich nejčastější jsou O103:H2, O111:H8, O145:H28/25 a O26:H11 [8, 9, 10]. Posledně jmenovaný je nejčastěji zastoupeným sérotypem STEC vyvolávající HUS v České republice [1, 11].
Většina infekcí vyvolaných STEC se vyskytují jako sporadické případy. Byly ovšem popsány i epidemie průjmového onemocnění a HUS vyvolaných STEC (tab. 1) [12]. Poslední a dosud největší epidemie STEC co do počtu případů HUS propukla v roce 2011 v Německu a postihla i další státy Evropy a USA. Původcem byla enteroagregativní E. coli O104:H4 s produkcí Stx2a [13] a zdrojem infekce byly epidemiologicky potvrzeny kontaminované klíčky pískavice. Infikováno bylo 3862 osob, z nichž u 855 se rozvinul HUS a 53 pacientů zemřelo. Od jiných epidemií se lišila vysokou frekvencí progrese do HUS (ve více než 20 % případů), častým výskytem neurologických komplikací, vysokou mortalitou a vyšší frekvencí onemocnění u dospělých (88 % infikovaných byli dospělí, v 68 % to byly ženy) [14].
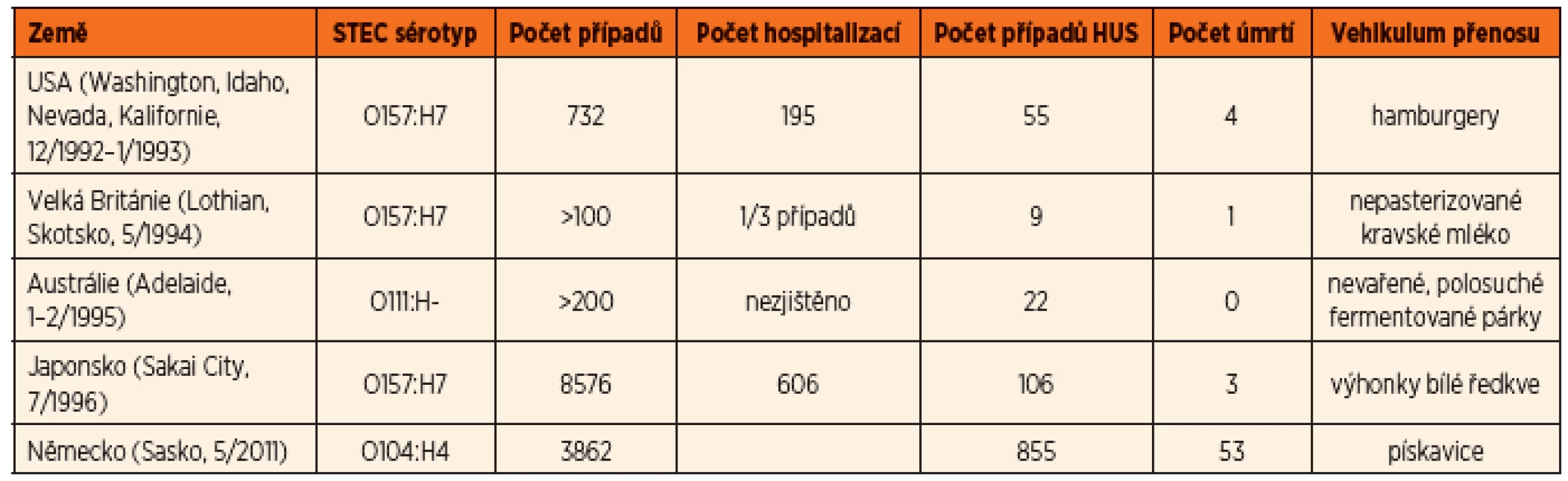
Již 5 let po první literární zprávě o E. coli O157:H7 v Kanadě a USA [3, 4], tj. v roce 1988, byla v České republice zaznamenána první menší epidemie onemocnění E. coli O157:H7 v České Lípě (5 dětí s HUS, věk 4–20 měsíců, 1 úmrtí) [15, 16]. Další hromadný výskyt HUS byl evidován v létě 1995 v okresech Teplice a Ústí nad Labem (4 případy HUS u dětí ve věku od 10 měsíců do 3 let), kdy byla izolována STEC O157:H7 a jako vehikulum infekce se prokázalo nepasterizované kozí mléko [17, 18]. Celkový výskyt HUS s laboratorně potvrzenou infekcí STEC se v České republice pohybuje od roku 2012 kolem 4–5 případů ročně. Na rozdíl od zahraniční literatury, kde je popisován výskyt krve ve stolici u 90 % pacientů s typickým HUS [1], se krev ve stolici vyskytuje v České republice pouze u 60 % pacientů s HUS [11]. U infekcí STEC bez progrese do HUS je procento krvavých průjmů v ČR nižší, kolem 40 % [19].
Zdroje infekce STEC
Nejdůležitějším rezervoárem STEC je zažívací trakt přežvýkavců, jde nejčastěji o hovězí dobytek [20], ale i kozy, ovce, jeleny a jiná hospodářská a lesní zvířata [21], kteří jsou asymptomatičtí a vylučují bakterie stolicí (obr. 1). Tepelnou úpravou stravy (teplota >70 ˚C) lze STEC eradikovat, proto k přenosu infekce STEC může dojít zejména konzumací kontaminovaných a nedostatečně tepelně upravených živočišných produktů (hamburgery, nepasterizované mléko a mléčné výrobky). Z výsledků nedávné české studie vyplývá, že syrové maso z tuzemských chovů nepředstavuje v současnosti významný zdroj infekcí STEC [22]. K nákaze může dále dojít požitím kontaminované vody, kontaminové syrové zeleniny a ovoce (hlávkový salát, špenát, výhonky pískavice, jahody, nepasterizovaný jablečný džus). Vzhledem k nízké infekční dávce (<50 bakterií) je vzácně možný i fekálně-orální přenos z člověka na člověka (zejména zařízení s nízkými hygienickými standardy) a ze zvířete na člověka (nejčastěji návštěva farmy, ZOO).
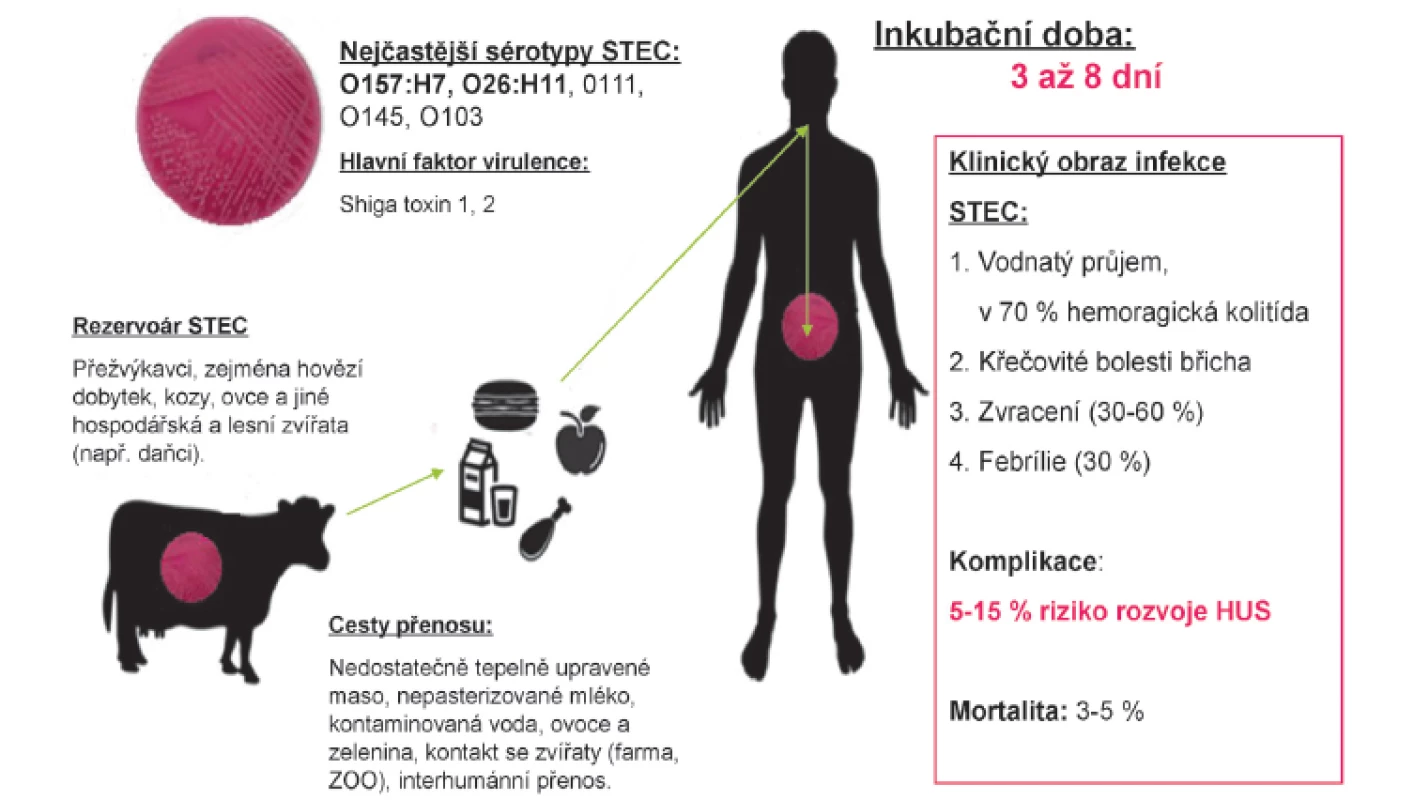
Doba vylučování STEC u lidí se u nekomplikovaného onemocnění uvádí v průměru 13 dnů, u případů s HUS až 21 dnů. V ČR byla popsána doba nosičství až více než 20 dnů při nekomplikovaném průjmovém onemocnění vyvolaném STEC O157. Výskyt onemocnění je vyšší v teplých měsících s maximem od června do září [1, 11, 19].
Patofyziologie infekce STEC
Dosud nejsou plně objasněny příčiny rozdílného klinického průběhu daného onemocnění, zejména fakto-ry vedoucí k rozvoji HUS jen u malého procenta pacientů infikovaných STEC. Na této variabilitě se nejpravděpodobněji podílejí jak faktory hostitele, tak i patogenu.
Po pozření kontaminované potravy dochází ke kolonizaci střeva bakteriemi (ileum, kolon), následně k poškození mikroklků enterocytů s rozvojem průjmu až obrazu hemoragické kolitidy (edém, hyperémie a hemoragie, exsudace fibrinu, nekróza mukóz, tvorba pseudomembrán). Hlavním faktorem virulence jsou Shiga toxiny (Stx1a, Stx2a), složené z enzymaticky aktivní podjednotky A a z 5 vazebných podjednotek B. Mezi další toxiny, které se spolupodílí na vzniku onemocnění a především na rozvoji HUS, patří EHEC hemolysin (EHEC-Hly), cytoletální distendující toxin (CdtV), cytotoxin subtilása (SubAB), Serine proteasa (EspP) a další, jejichž úloha dosud není plně objasněna [23].
Stx se ze střeva vstřebává do cirkulace a pravděpodobně pomocí polymorfonukleárů se dostává k cílovým orgánům, kde se svojí B-podjednotkou váže na specifické Gb3 receptory (globotriaosylceramidový receptor, CD77), především na endoteliálních buňkách (nejvíce v ledvinách, střevě a CNS), tubulárních, mezangiálních buňkách a podocytech. Rozmístění receptorů v organismu pak vysvětluje lokalizaci možných mikrovaskulárních lézí. Již 30 minut po navázání toxinu na Gb3 receptor dochází pomocí enzymaticky aktivní A-podjednotky k inaktivaci ribozomů, inhibici proteosyntézy a apoptóze buněk. Kromě toho také dochází k aktivaci celé řady prozánětlivých a protrombotických faktorů: zvyšuje se lokální koncentrace zánětlivých cytokinů (IL-1, IL-2, IL-8), tumor nekrotizujícího faktoru (TNF-alfa), zvyšuje se uvolňování protrombotických faktorů, jako např. inhibitoru aktivátoru plazminogenu (PAI-1), trombomodulinu a jiných. Stx také ovlivňuje regulační proteiny komplementového systému, váže faktor H, čímž dochází k redukci jeho kofaktorové aktivity na buněčném povrchu. Způsobuje sníženou expresi inhibitoru komplementu CD59 na povrchu endotelu glomerulů a tubulárních buněk. To má za následek dysregulaci a snazší aktivaci alternativní cesty komplementu [24, 25]. Důsledkem všech změn je vznik trombotické mikroangiopatie s endoteliální dysfunkcí, tvorbou fibrinových mikrotrombů, což vede k postižení jednotlivých orgánů a následně k rozvoji klinických projevů HUS [26].
Klinický obraz STEC infekce
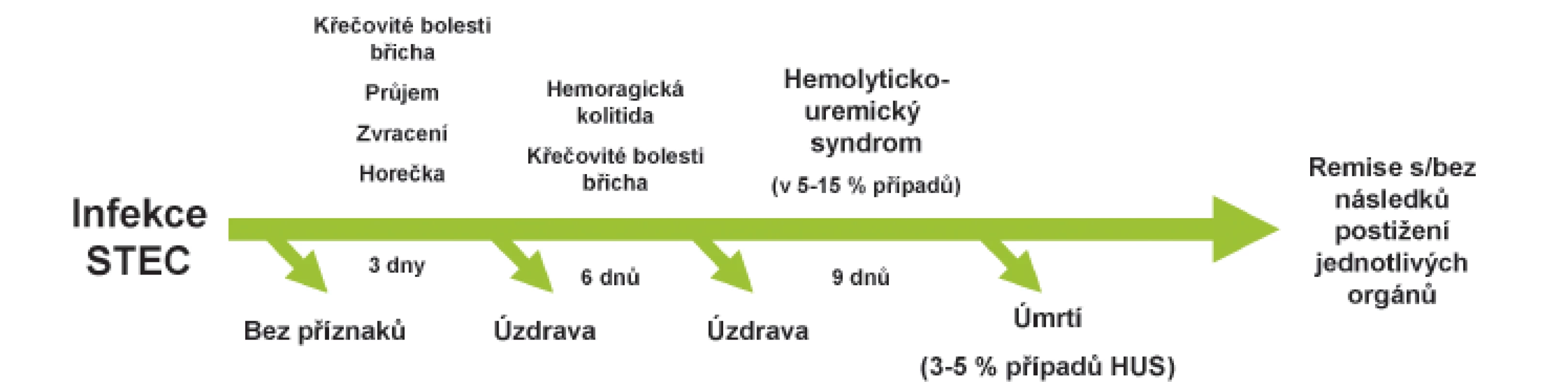
Infekce bakteriemi STEC mohou vyvolat široké spektrum klinických příznaků zahrnující asymptomatické nosičství, nekomplikovaný vodnatý průjem, hemoragickou kolitidu až rozvoj HUS. Inkubační doba onemocnění je většinou 3–8 dnů (obr. 2). Typickým projevem nákazy je křečovitá bolest břicha provázející vodnatý průjem, který ve 2/3 případů během 3 dnů přechází v hemoragickou kolitidu. Na rozdíl od průjmů vyvolaných jinými invazivními patogeny, je ve stolici přítomna masivní příměs krve. Komplikací průjmu může být invaginace, prolaps rekta, paralytický ileus a v ojedinělých případech může dojít až k perforaci střeva. Zvracení je přítomné na začátku onemocnění pouze ve 30–60 % případů a průběh onemocnění bývá obvykle afebrilní (horečka bývá pouze u 30 % infikovaných). Většina nakažených se spontánně uzdraví do 10 dnů, avšak u malého procenta pacientů může infekce vést k rozvoji život ohrožujícího onemocnění. U sporadických případů se riziko rozvoje STEC-HUS pohybuje mezi 5–15 %, v průběhu některých epidemií však bylo popsáno riziko až 20 % a více (např. epidemie E. coli O104:H4 v Německu, 2011) [1, 27].
STEC-HUS je jednou z nejčastějších příčin akutního poškození ledvin (APL) v batolecím a předškolním věku. Vzniká na podkladě Stx-indukované trombotické mikroangiopatie s následným rozvojem hemolytické anémie, trombocytopenie a mikrovaskulární trombózy vedoucí k ischemickému postižení orgánů, zejména ledvin a mozku. Onemocnění postihuje nejčastěji děti ve věku od 1 do 5 let s incidencí 0,5–2/100 000 obyvatel/rok, s maximem incidence u dětí do 5 let (2–3/100 000 dětí/rok) [28].
Klinické příznaky HUS se plně rozvinou během 5–10 dnů od začátku gastrointestinálních symptomů (obr. 3). Jsou charakterizovány náhle vzniklou anémií s nápadnou bledostí, často dušností a únavou. Ve třetině případů je přítomen subikterus až ikterus. Příznaky plynoucí z trombocytopenie, jako krvácení do kůže ve formě petechií a zvýšená tvorba modřin, jsou méně časté. Hlavními známkami poškození ledvin jsou i přes dostatečnou rehydrataci při průjmovém onemocnění oligurie až anurie doprovázené otoky a hypertenzí (4.–10. den trvání průjmu, rozmezí 1–10 dnů). Vzhledem k pokrokům v léčbě akutního poškození ledvin je mortalita onemocnění nízká a v akutní fázi onemocnění se pohybuje mezi 3–5 % [29]. I když u většiny pacientů dojde ke spontánní remisi onemocnění za 1–3 týdny, u 20–25 % dětí přetrvává po překonání akutní fáze různě závažná renální symptomatologie, která může vyústit i několik let po prodělaném onemocnění v chronické selhání ledvin s nutností dialýzy a následně v transplantaci ledvin. Extrarenální manifestace (postižení CNS, kardiovaskulárního systému, plic) jsou příčinou vyšší morbidity a hlavní příčinou úmrtí [2]. Ke vzácným pozdním následkům se řadí diabetes mellitus, žlučové kameny, neurologické postižení [30].
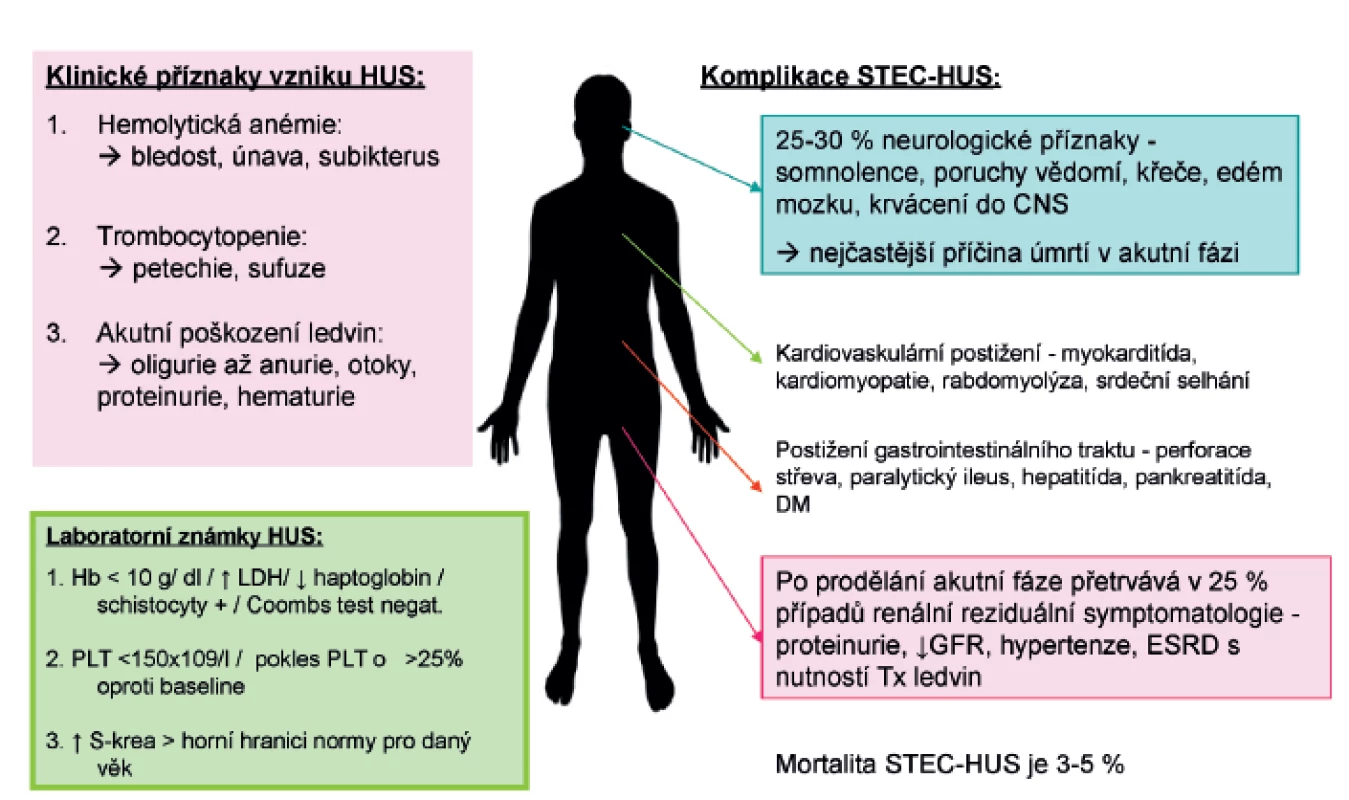
Z laboratorních nálezů při rozvoji STEC-HUS stojí v popředí trombocytopenie (počet destiček <150x109/l, je možný pokles až ke 30x109/l a méně), neimunní hemolytická mikroangiopatická anémie (Coombs test negativní, pokles hemoglobinu v rozmezí 50–100 g/l) se schistocyty a hyperazotémie (zvýšená hladina urey, kreatininu nad horní hranici normy pro daný věk). Odrazem hemolýzy je zvýšená hladina laktátdehydrogenázy (LD), nekonjugovaná hyperbilirubinémie, nízký či nedetekovatelný haptoglobin, může být přítomna elektrolytová dysbalance (zejména hyponatrémie, hypo/hyperkalémie) i mírná elevace jaterních transamináz. V některých případech je známkou aktivace komplementu pokles hladin C3 a C4 složky, koagulační testy jsou obvykle normální. Mezi prokázané negativní prognostické faktory patří doba trvání anurie, délka dialyzační léčby, CNS symptomatologie, hypertenze, vyšší věk, atypické formy HUS. K laboratorním negativním prognostickým faktorům se v literatuře dále uvádí leukocytóza, vyšší hladina LD, prolongovaná anémie a trombocytopenie [1, 2].
Mikrobiologická diagnostika STEC
Úspěšná izolace a identifikace kmene STEC ve stolici pacienta s příznaky HUS hraje důležitou roli v rozlišení typické formy onemocnění (STEC-HUS) od jiných atypických forem HUS a tím umožní zvolení vhodného léčebného postupu, který se významně liší u různých forem daného onemocnění (např. symptomatická terapie u typického HUS, eculizumab a plazmaferéza u atypické formy).
Také rychlá detekce STEC ve stolici pacienta a subtypizace stx genu je důležitá v určení rizika progrese průjmového onemocnění v HUS (Stx1a vs. Stx2a). Proto při podezření na STEC infekci (vodnatý průjem s křečovitými bolestmi břicha, často afebrilní a s příměsí krve ve stolici do tří dnů od nástupu příznaků u dětí do 5 let věku, kontakt se zvířetem – farma, ZOO, pití nepasterizovaného mléka, konzumace nedostatečně tepelně upraveného masa, neomyté zeleniny či ovoce především vlastní produkce) je vhodné co nejdříve zaslat výtěr z rekta na kultivaci. Jelikož většina mikrobiologických laboratoří kultivační nález E. coli ve stolici dále sérotypizuje (a tím v první fázi rozezná potenciální STEC od jiných kmenů E. coli) pouze u pacientů mladších než 3 roky, je nutné na žádance zdůraznit, že u pacienta je podezření na infekci STEC.
Následně jsou kmeny suspektních STEC (nejčastěji E. coli séroskupin O157, O103, O111, O145, O26) zasílány k průkazu či ověření Stx do Národní referenční laboratoře pro Escherichia coli a shigely Státního zdravotního ústavu podle vyhlášky „O systému epidemiologické bdělosti pro vybrané infekce“.
Izoláty E. coli zmiňovaných séroskupin, u kterých nejsou Stx prokázany a pocházejí od pacientů s nekomplikovaným průjmem (tj. bez příměsí krve a je počátečním stadiem jak EPEC, tak STEC infekce), se zpravidla označí jako enteropatogenní E. coli (EPEC). V případě izolace Stx-negativních kmenů výše uvedených séro-skupin od pacientů s HUS nebo krvavým průjmem se s vysokou pravděpodobností jedná o STEC, které ztratily Stx-kodující geny během infekce nebo během kultivace in vitro [29, 31, 32].
Vzhledem k tomu, že množství bakterií od počátku onemocnění klesá, v době rozvoje HUS může kvantita patogenu ve stolici poklesnout natolik, že STEC již nemusí být běžně dostupnými metodami používanými v klinických mikrobiologických laboratořích detekovatelná. Proto je nutné u pacientů ve stadiu HUS analyzovat celý vzorek stolice (ve velikosti 2–3 lískových oříšků, nikoliv rektální výtěr), a to použitím specifických a citlivých postupů, které jsou dostupné v NRL pro E. coli a shigely. Tím se zvýší pravděpodobnost úspěšného nálezu STEC u pacienta s HUS, která se ve světové literatuře uvádí kolem 70 % [1, 11].
V prevenci dalšího šíření onemocnění hraje roli včasné vyhledávání zdroje infekce a blízkých kontaktů nemocného, často ve spolupráci s krajskými hygienickými stanicemi (KHS) a veterinárními lékaři.
Závěr
I když kmeny STEC nepatří v České republice mezi nejčastější bakteriální vyvolavatele průjmového onemocnění, vyskytují se pouze desítky případů ročně, představují tyto infekce závažný zdravotnický problém a je jim potřeba věnovat zvýšenou pozornost. Kromě toho, že jsou schopny vyvolat rozsáhlé epidemie [30], mohou být původci průjmových onemocnění s progresí v život ohrožující nemoc. V případě diagnostiky onemocnění HUS je nutné co nejdříve odeslat vzorek stolice do NRL k detekci kmene STEC. Tím se odliší typický HUS od jiných atypických forem tohoto onemocnění, při kterých jsou voleny jiné terapeutické postupy. Vzhledem k riziku pozdních následků selhání ledvin po prodělání akutní fáze HUS je nutná dlouhodobá dispenzarizace pacientů v nefrologické ambulanci.
Jelikož se jedná o alimentární onemocnění, prevence STEC infekcí spočívá hlavně v prevenci přenosu infekce dodržováním zásad hygieny. Důležitá je také infor-movanost pacientů v ambulantní praxi o možných rizicích konzumace nedostatečně tepelně upravených potravin, nepasterizovaných mléčných výrobků a kontaktu s hospodářskými zvířaty zejména u malých dětí. Důležitost monitorování infekcí STEC je v sou-ladu s prioritami European Centre for Disease Prevention and Control (ECDC) a European Food Safety Authority (EFSA).
Došlo: 3. 11. 2015
Přijato: 29. 1. 2016
MUDr. Lucia Karnišová
Pediatrická klinika 2. LF UK
a FN Motol
V Úvalu 84
150 06 Praha 5
e-mail: lucia.karnisova@fnmotol.cz
Sources
1. Tarr PI, Gordon CA, Chandler WL. Shiga-toxin-producing Escherichia coli and haemolytic uraemic syndrome. Lancet 2005; 365 (9464): 1073–1086.
2. Garg AX, Suri RS, Barrowman N, et al. Long-term renal prognosis of diarrhea-associated hemolytic uremic syndrome: a systematic review, meta-analysis, and meta-regression. JAMA 2003; 290 : 1360–1370.
3. Karmali MA, Steele BT, Petric M, Lim C. Sporadic cases of haemolytic-uraemic syndrome associated with faecal cytotoxin and cytotoxin-producing Escherichia coli in stools. Lancet 1983; 1 : 619–620.
4. Riley LW, Remis RS, Helgerson SD, et al. Hemorrhagic colitis associated with a rare Escherichia coli serotype. N Engl J Med 1983; 308 : 681–685.
5. O’Brien AO, Lively TA, Chen ME, et al. Escherichia coli O157:H7 strains associated with haemorrhagic colitis in the United States produce a Shigella dysenteriae 1 (SHIGA) like cytotoxin. Lancet 1983; 1 : 702.
6. Scheutz F, Teel LD, Beutin L, et al. Multicenter evaluation of a sequence-based protocol for subtyping Shiga toxins and standardizing Stx nomenclature. J Clin Microbiol 2012; 50 (9): 2951–2963.
7. Bielaszewska M, Mellmann A, Bletz S, et al. Entero-hemorrhagic Escherichia coli O26:H11/H: a new virulent clone emerges in Europe. Clin Infect Dis 2013; 56 : 1373–1381.
8. Mellmann A, Bielaszewska M, Köck R, et al. Analysis of collection of hemolytic uremic syndrome-associated enterohemorrhagic Escherichia coli. Emerg Infect Dis 2008; 14 (8): 1287–1290.
9. Luna-Gierke RE, Griffin PM, Gould LH, et al. Outbreaks of non-O157 Shiga toxin-producing Escherichia coli infection: USA. Epidemiol Infect 2014; Jan 7 : 1–11.
10. Käppeli U, Hächler H, Giezendanner N, et al. Human infections with non-O157 Shiga toxin-producing Escherichia coli, Switzerland, 2000–2009. Emerg Infect Dis 2011; 17 (2): 180–185.
11. Marejková M, Bláhová K, Janda J, et al. Enterohemorrhagic Escherichia coli as causes of Hemolytic Uremic Syndrome in the Czech Republic. PLoS ONE 2013; 8 (9): e73927. doi:10.1371/journal.pone 0073927.
12. Bláhová K, Fencl F. Kazuistiky z pediatrie. 1. vyd. Praha: Mladá fronta, 2014 : 1–197. Aeskulap. ISBN 978-80-204-3392-3.
13. Bielaszewska M, Mellmann A, Zhang W, et al. Characterisation of the Escherichia coli strain associated with an outbreak of haemolytic uraemic syndrome in Germany, 2011: a microbiological study. Lancet Infect Dis 2011; 11 (9): 671–676.
14. Frank C, Werber D, Cramer JP, et al. Epidemic profile of Shiga-toxin-producing Escherichia coli O104:H4 outbreak in Germany. N Engl J Med 2011; 365 (19): 1771–1780.
15. Bielaszewská M, Janda J. Microbiological aspects of infection with verotoxin-producing E.coli strains in children with the hemolytic-uremic syndrome. Cesk Epidemiol Mikrobiol Imunol 1989 Jul; 38 (4): 237–244.
16. Srámková L, Bielaszewská M, Janda J, et al. Vero cytotoxin-producing strains of Escherichia coli in children with haemolytic uraemic syndrome and diarrhoea in Czechoslovakia. Infection 1990 Jul-Aug; 18 (4): 204–209.
17. Bielaszewska M, Janda J, Blahová K, et al. Verocytotoxin-producing Escherichia coli in children with hemolytic uremic syndrome in the Czech Republic. Clin Nephrol 1996 Jul; 46 (1): 42–44.
18. Bielaszewska M, Janda J, Bláhová K, et al. Human Escherichia coli O157:H7 infection associated with the consumption of unpasteurized goat‘s milk. Epidemiol Infect 1997 Dec; 119 (3): 299–305.
19. Marejková M, Petráš P. Enterohemoragické Escherichia coli jako původci průjmu v České republice, 1965–2013. Epidemiol Mikrobiol Imunol 2014; 63 (3): 173–183.
20. Alexa P, Konstantinova L, Zajacova-Sramkova Z. Faecal shedding of verotoxigenic Escherichia coli in cattle in the Czech Republic. Veterinární Medicina 2011; 56 (4): 149–155.
21. Karch H, Tarr PI, Bielaszewska M. Enterohaemorrhagic Escherichia coli in human medicine. Int J Med Microbiol 2005; 295 (6–7): 405–418.
22. Koláčková I, Házová K, Skočková A, et al. Výskyt shigatoxigenních kmenů Escherichia coli u prasat a skotu na jatkách v ČR v roce 2013. Klin Mikrobiol Infect Lek 2014; 20 (2): 36–39.
23. Bielaszewska M, Karch H. Consequences of enterohaemorrhagic Escherichia coli infection for the vascular endothelium. Thromb Haemost 2005 Aug; 94 (2): 312–318.
24. Orth D, Khan AB, Naim A, et al. Shiga toxin activates complement and binds factor H:evidence for an active role of complement in hemolytic uremic syndrome. J Immunol 2009; 182 (10): 6394–6400.
25. Ehrlenbach S, Rosales A, Posch W, et.al. Shiga toxin 2 reduces complement inhibitor CD59 expression on human renal tubular epithelial and glomerular endothelial cells. Infect Immun 2013; 81 (8): 2678–2685.
26. Obrig TG. Escherichia coli Shiga toxin mechanisms of action in renal disease. Toxins (Basel) 2010; 2 (12): 2769–2794.
27. Bláhová K. Hemolyticko-uremický syndrom. Vnitř Lék 2004; 50 : 519–525.
28. Noris M, Remuzzi G. Hemolytic uremic syndrome. J Am Soc Nephrol 2005; 16 (4): 1035.
29. Milford D. The hemolytic uremic syndromes in the United Kingdom. In: Kaplan BS, Trompeter RS, Koale JL (eds). Hemolytic Uremic syndrome and Thrombotic Thrombocytopenic Purpura. New York: Marcel Dekker, 1992 : 39–59.
30. Zieg J, Blahova K, Dusek J, et al. Hemolyticko-uremicky syndrom. Pediatr praxi 2011; 12 (2): 102–104.
31. Bielaszewska M, Köck R, Friedrich AW, et al. Shiga toxin-mediated hemolytic uremic syndrome: time to change the diagnostic paradigm? PLoS One 2007 Oct 10; 2 (10): e1024.
32. Liptáková A, Siegfried L, Podracká Ľ, et al. Detection of Shiga toxins, intimin and enterohaemolysin in Escherichia coli strains isolated from children in eastern Slovakia. Folia Microbiol (Praha) 2002; 47 (2): 185–189.
Labels
Neonatology Paediatrics General practitioner for children and adolescentsArticle was published in
Czech-Slovak Pediatrics

2016 Issue 2
- What Effect Can Be Expected from Limosilactobacillus reuteri in Mucositis and Peri-Implantitis?
- The Importance of Limosilactobacillus reuteri in Administration to Diabetics with Gingivitis
-
All articles in this issue
- Psychosociální aspekty nespecifických střevních zánětů u dětí
- Školy při nemocnicích a dalších zdravotnických zařízeních
- Význam stanovovania nazálneho oxidu dusnatého u detí – prvé skúsenosti
- Čo sa môže skrývať za diagnózou atypickej cystickej fibrózy?
- Neketotická hyperglycinémie: případ závažné kongenitální hypotonie diagnostikovaný magnetickou rezonancí
- Hlboká venózna trombóza u dieťaťa s nefrotickým syndrómom
- Záhadná erupce na břiše
- Infekce způsobené Shiga toxin-produkujícími Escherichia coli u dětí
- Diagnostika primární ciliární dyskineze
- Primární bifázický synoviální sarkom jazyka u kojence: Kazuistika vzácného onemocnění s přehledem literatury
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Infekce způsobené Shiga toxin-produkujícími Escherichia coli u dětí
- Čo sa môže skrývať za diagnózou atypickej cystickej fibrózy?
- Neketotická hyperglycinémie: případ závažné kongenitální hypotonie diagnostikovaný magnetickou rezonancí
- Školy při nemocnicích a dalších zdravotnických zařízeních