Získaná kardiovaskulární onemocnění u Turnerova syndromu
Acquired cardiovascular disease in Turner syndrome
Turner syndrome (TS) is the most common chromosomal disorder in women, which is caused by absence or structural abnormality of X chromosome with classical traits that include growth retardation, gonadal dysgenesis and infertility.
Acquired cardiovascular disease is a major cause of premature morbidity and mortality in TS. Congenital heart disease and acquired cardiovascular disease can reduce life expectancy by up to 13 years. Ischemic heart disease, stroke and aortic dissection belong to acquired cardiovascular disease with high prevalence.
This review is focused on issues of risk factors for acquired cardiovascular disease such as arterial hypertension, glucose metabolism disorders, dyslipidemia and obesity in patients with TS. The main point of this review is arterial hypertension, its prevalence in TS, diagnostic and appropriate therapeutic approaches.
Key words:
Turner syndrome, acquired cardiovascular disease, hypertension, ABPM, ascending aortic dilation, aortic dissection, glucose metabolism disorders, dyslipidemia, obesity
Authors:
S. Kaprálová 1; J. Zapletalová 1; R. Vrtěl 2; E. Klásková 1
Authors‘ workplace:
Dětská klinika Fakultní nemocnice a Lékařské fakulty Univerzity Palackého, Olomouc
1; Ústav lékařské genetiky Fakultní nemocnice a Lékařské fakulty Univerzity Palackého, Olomouc
2
Published in:
Čes-slov Pediat 2017; 72 (1): 54-62.
Category:
Review
Overview
Turnerův syndrom (TS) je nejčastější chromozomální aberací u žen. Jeho příčinou je absence nebo strukturální abnormalita jednoho X chromozomu. Klinicky se nejčastěji manifestuje poruchou růstu a gonadální dysgenezí s infertilitou.
Získaná kardiovaskulární onemocnění představují u nositelek s TS jednu z nejdůležitějších příčin předčasné mortality a morbidity a společně s vrozenými srdečními vadami vedou ke zkrácení očekávané délky života nejméně o 13 let. Mezi získaná kardiovaskulární onemocnění s vysokou prevalencí patří zejména ischemická choroba srdeční, cévní mozková příhoda a aortální disekce.
Přehledový článek je zaměřen na problematiku rizikových faktorů pro získaná kardiovaskulární onemocnění u TS, jako je arteriální hypertenze, poruchy glukózového metabolismu, dyslipidémie a obezita. Zvýšená pozornost je věnována arteriální hypertenzi, její prevalenci, diagnostickým možnostem a vhodným terapeutickým postupům.
KLÍČOVÁ SLOVA:
Turnerův syndrom, získaná kardiovaskulární onemocnění, hypertenze, ABPM, dilatace ascendentní aorty, disekce aorty, poruchy glukózového metabolismu, dyslipidémie, obezita
ÚVOD
Turnerův syndrom (TS) patří mezi nejčastější chromozomální abnormality. Postihuje tři procenta plodů ženského pohlaví a vyskytuje se s četností 50 : 100 000 živě narozených děvčátek ročně [1, 2]. Nejčastějším typem chromozomální odchylky je u TS chybění jednoho X chromozomu (45,X). Příčinou ztráty je nondisjunkce během meiotického nebo mitotického (postzygotického) dělení. Strukturální abnormality X chromozomu jsou méně časté a vznikají v důsledku chromozomálních zlomů při meiotickém dělení. Tak vzniká např. izochromozom z dlouhých ramének - iXq nebo ring chromozom - rX, případně může chybět dlouhé (Xq-) nebo krátké (Xp-) raménko X chromozomu. Tyto abnormality mohou postihovat všechny buňky nebo jen jejich část ve formě chromozomální mozaiky (např. 45,X/46,XX nebo 46,XiXq/45,X). Výjimečně může být přítomen Y chromozom (45,X/46,XY) nebo jeho část [3, 4]. Přestože je u poloviny případů TS při cytogenetickém vyšetření zjištěna monozomie chromozomu X (45,X), předpokládá se, že se ve skutečnosti jedná o skryté mozaiky. Podle některých autorů je čistá monozomie (45,X) neslučitelná se životem [5, 6] a 99 % plodů s tímto karyotypem je spontánně potraceno v časné fázi gravidity [7].
Důsledkem numerické nebo strukturální abnormality X chromozomu je absence určitých genů, které jsou důležité pro fyziologický vývoj jedince. Vzhledem k tomu, že i u ženy s normálním karyotypem (46,XX) dochází k inaktivaci jednoho z X chromozomů ve formě Baarova tělíska (tzv. proces lyonizace), dalo by se předpokládat, že absence jednoho z X chromozomů u TS nebude mít nepříznivý dopad na vývoj ženského organismu. Ovšem i inaktivovaný X chromozom zůstává ve své tzv. pseudoautozomální oblasti (PAR) aktivní. Geny v těchto úsecích (PAR 1 na krátkém raménku a PAR 2 na dlouhém raménku) X chromozomu jsou nadále transkribovány a chovají se jako geny na autozomech. Ztráta jedné z jejich alel vede k patologickým příznakům. Mezi geny pseudoautozomální oblasti řadíme SHOX gen, který zodpovídá za vývoj lidského skeletu, především za růst dlouhých kostí. Dalším diskutovaným genem této oblasti je lymfogenní gen, jehož absence způsobuje atypické utváření lymfatických cest vedoucí k městnání lymfy, jež je příčinou vrozených vad měkkých tkání a vnitřních orgánů. Předpokládaný lokus pro tento gen je v pseudoautozomální oblasti na krátkém raménku – Xp11.4 [8]. Dalším mechanismem vlivu haploinsuficience genů na X chromozomu na fenotyp TS je genomický imprinting, který vychází z paternálního původu intaktního X chromozomu. Imprinting patrně ovlivňuje především neurokognitivní funkce. Podle některých studií se dá předpokládat, že zachování maternálního X chromozomu je spojeno s vyšším výskytem kardiovaskulárních onemocnění a kožních duplikatur podél krku [9].
Mezi klasické fenotypické projevy TS patří progredující růstová retardace nejčastěji disproporcionálního – mezomelického typu, provázená skeletálními odchylkami (cubiti valgi, Madelungova deformita předloktí, zkrácení metakarpálních kůstek, anomálie struktur formujících střední ucho). Gonadální dysgeneze vede u většiny dívek k absenci vývoje sekundárních pohlavních znaků, k primární amenoree a k infertilitě. Poruchy vývoje lymfatického systému jsou příčinou typických rysů TS, jako jsou lymfedémy na dorzech rukou a nohou (časté u novorozenců), štítovitý hrudník, nízká vlasová hranice, kožní duplikatury podél krku (tzv. pterygia colli). Prenatálně vzniklá porucha lymfatické drenáže mezi ductus thoracicus a jugulárními a podklíčkovými žilami je podle Clarkovy teorie příčinou vrozených vad srdce a velkých cév [10]. Ovlivněn je u TS i neurokognitivní vývoj, ženy a dívky s TS mohou mít potíže s prostorovou představivostí, krátkodobou pamětí a koncentrací. V etiologii těchto změn se zřejmě uplatňuje fenomén genomického imprintingu [11]. TS není spojován s mentální retardací vyjma pacientek s ring chromozomem.
Pacientky s monozomií X a se strukturálními abnormalitami X chromozomu mají klinické projevy závažnější, naopak pacientky s chromozomální mozaikou mohou mít fenotyp méně nápadný. U nich může být diagnóza TS stanovena až v dospělosti na základě jejich infertility (ženy s minoritní chromozomální mozaikou nebo s delecí dlouhého raménka X chromozomu) [12]. Podle některých autorů existuje až 30 % žen s nerozpoznanou diagnózou TS [2]. Tato skutečnost nepříznivě ovlivňuje kvalitu jejich života, protože nemohou včas využít všechny postupy včasné moderní diagnostiky a léčby a tím je jejich morbidita a mortalita ve srovnání s běžnou populací významně vyšší [2].
KARDIOVASKULÁRNÍ POSTÍŽENÍ U TURNEROVA SYNDROMU
Kardiovaskulární postižení u nosiček TS lze rozdělit na vrozené srdeční vady (VSV) a na získaná kardiovaskulární onemocnění (KVS onemocnění). Obě skupiny významným způsobem zvyšují jejich morbiditu a mortalitu.
Vrozené srdeční vady
VSV se vyskytují u 22–70 % pacientek s TS [4]. K jejich rozpoznání významně přispělo zařazení magnetické rezonance (MRI) srdce a hrudní aorty do vyšetřovacího algoritmu. Mezi nejčastější patří bikuspidální aortální chlopeň (BAV), která se vyskytuje u 15–30 % pacientek s TS, a koarktace aorty (CoA) vyskytující se až v 17 % případů [4]. Mezi méně známé vrozené srdeční vady, které začaly být popisovány díky MRI srdce a hrudní aorty, patří parciální anomální návrat plicních žil (PAPVD) vyskytující se ve 13–15 % a perzistující levostranná horní dutá žíla (LSVC) v 8–13 % případů [4]. Podobně i nález elongace transverzálního aortálního oblouku (ETA – elongated transverse arch of the aorta) se sifonovitým prohnutím oblouku v místě aortálního istmu (tzv. kinking) je považován za vrozenou anomálii aorty, kterou má téměř polovina pacientek s TS [13].
Stanovení diagnózy abnormálního aortálního oblouku je podle autora Ho založeno na kvalitativním, vizuálním posouzení morfologie aortálního oblouku [13]. Recentně se diskutuje o využití kvantitativní a objektivnější metody popisující morfologii aortálního oblouku, která je založena na určení relativní pozice nejvyššího bodu trans-verzálního oblouku aorty při zobrazení na MRI, tzv. bod AoHP [14]. AoHP bod leží v průsečíku přímky proložené středem ascendentní a descendentní aorty na úrovni pravé větve plicnice (horizontální přímka) a přímky vertikální proložené nejvyšším bodem aortálního oblouku. Průsečík těchto přímek je vyjádřen procentuálně na horizontální přímce, kdy bod na ascendentní aortě označuje 0 % a bod na descendentní aortě 100 % (obr. 1). Za normální oblouk aorty se považuje AoHP bod ležící mezi 43 % a 62 % [14]. U TS se mohou vyskytovat i běžnější VSV jako defekty septa síní nebo komor, perzistující Botallova dučej, pulmonální nebo aortální stenóza [4, 15]. Monozomie (45,X) je spojena s vyšším výskytem vrozených srdečních vad [16]. Na celkové mortalitě TS se vrozené srdeční vady podílejí osmi procenty [17].
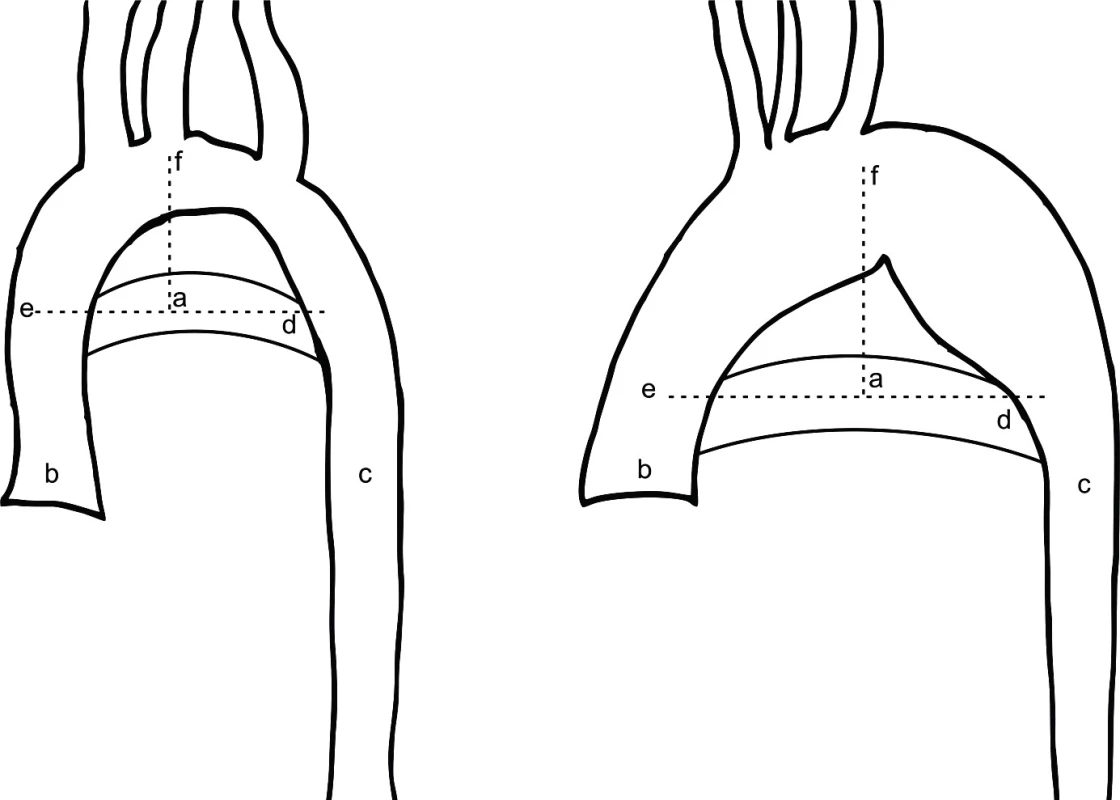
Získaná kardiovaskulární onemocnění
Mezi nejčastější získaná kardiovaskulární onemocnění řadíme aortální disekci, ischemickou chorobu srdeční (ICHS) a cévní mozkovou příhodu (CMP). Dívky a ženy s TS jsou vystaveny až dvakrát vyššímu riziku vzniku ICHS ve srovnání s běžnou populací a jsou ohroženy až trojnásobně vyšší mortalitou na podkladě ICHS a CMP [18, 19]. Disekce aorty je u nich až stonásobně častější než u běžné populace a ve většině případů má fatální následky [20].
Rizikové faktory pro získaná kardiovaskulární onemocnění u Turnerova syndromu
Ke vzniku získaných KVS onemocnění přispívá řada rizikových faktorů, které se uplatňují i u běžné populace. Patří k nim hypertenze, poruchy glukózového metabolismu včetně diabetes mellitus 2. typu, dyslipidémie a obezita nebo nadváha. Striktní dělení na získaná a vrozená KVS onemocnění není u TS jednoduché. Řada rizikových faktorů se vyskytuje v populaci pacientek s TS ve vyšší míře. Jedním z důvodů vyššího výskytu by mohla být genetická (vrozená) dispozice, která se manifestuje až v průběhu života. Za účelem přehlednosti je dělení na vrozená a získaná KVS onemocnění stále běžně používáno.
Získaná kardiovaskulární onemocnění u TS se posunují oproti běžné populaci do mladších věkových kategorií a významně navyšují celkovou morbiditu a mortalitu pacientek (na mortalitě se podílí 41 %) [17]. Se zvýšeným rizikem disekce aorty se můžeme u TS setkat již ve druhé věkové dekádě, zvýšená incidence cévní mozkové příhody je zaznamenána od třetího decenia a infarkt myokardu se objevuje již kolem padesátého roku věku [4].
1. Hypertenze u Turnerova syndromu
- Prevalence hypertenze u Turnerova syndromu
Arteriální hypertenze je u pacientek s TS významným rizikovým faktorem pro vznik ICHS, CMP i pro disekci aorty. Většina studií zabývající se krevním tlakem (TK) u pacientek s TS potvrdila vyšší výskyt hypertenze ve srovnání s běžnou populací [21]. Velká část pacientek ale diagnóze hypertenze uniká a pouze 4–22 % pacientek je adekvátně léčeno [22, 23].
Prevalence hypertenze je u dospělých žen s TS udávána v rozmezí 13–58 %, toto velké rozpětí zřejmě plyne z různých kritérií pro definici hypertenze [21]. Rozdíly v prevalenci mohou vznikat i použitím různých metod měření, hodnoty TK ovlivňuje životní styl a rasa [21]. V dětské populaci TS je prevalence rovněž velmi široká od 0 %, udávaná autory korejské studie, až po 40% záchyt hypertenze v USA [22, 24]. Tyto rozdíly nejsou dány rozdílnou definicí hypertenze, protože ve všech pediatrických studiích je užíváno percentilového vyjádření krevního tlaku ve vztahu k pohlaví, věku a výšce [21]. Rozdíly v prevalenci by mohly být vysvětleny vlivem rasy, odlišným životním stylem či variabilitou karyotypu.
I v běžné populaci je výskyt hypertenze ovlivněn rasou. Za rizikovou populaci je považována negroidní rasa, podle některých zdrojů je udávána až dvojnásobně vyšší prevalence hypertenze ve srovnání s rasou bílou [25]. Sedavý způsob života s nadměrným přísunem energeticky bohatých potravin vedoucí k nadváze nebo obezitě rovněž přispívá ke zvýšenému riziku rozvoje hypertenze nejen ve vyspělých zemích. V indické studii zahrnující adolescenty byla prokázána zvyšující se prevalence hypertenze v souvislosti s narůstajícím body mass indexem (BMI) [26]. V neposlední řadě se diskutuje i o vlivu karyotypu na výskyt hypertenze. Bylo prokázáno, že pacientky se strukturální aberací X chromozomu nebo s chromozomálním mozaicismem mají vyšší riziko získaných KVS onemocnění [16]. Toto tvrzení podporuje i recentní polská studie, ve které byla prokázána vyšší incidence hypertenze u pacientek s chromozomální mozaikou ve srovnání s monozomií (45,X) [27]. Naproti tomu existuje studie, která vztah mezi karyotypem a výskytem hypertenze neprokázala, ale výsledky studií jsou limitovány malým počtem pacientů [28].
- Patogenetické mechanismy hypertenze u Turnerova syndromu
Primární a sekundární forma hypertenze se u pacientek s TS do určité míry prolíná a striktní dělení má spíše edukativní než praktický význam.
Patogenetické mechanismy primárního (esenciálního) typu hypertenze jsou pravděpodobně multifaktoriální a zatím stále nejsou kompletně objasněny. Uvažuje se o neadekvátní aktivaci osy renin-angiotenzin-aldosteron (RAA osa), o zvýšeném oxidativním stresu, zánětu, narušení vazodilatačních mechanismů nebo zvýšené aktivitě sympatického nervového systému [29, 30, 31]. Na zvýšeném tonu sympatiku se podle některých autorů podílí nedostatek estrogenů při ovariální dysgenezi, estrogeny navíc plní za normálních okolností i roli antioxidantů [32]. U poloviny pacientek s TS je v dospělosti prokázána zvýšená zánětlivá aktivita s elevací C-reaktivního proteinu, která může vést k endoteliální dysfunkci a v konečném důsledku přispívat ke vzniku arteriální hypertenze [33, 34]. Dalším možným mechanismem je funkční a strukturální narušení cévní stěny vedoucí k její snížené poddajnosti [35, 36].
Za příčiny sekundární formy hypertenze u TS jsou považovány vrozené vady srdce (koarktace aorty) nebo ledvin. Nově zvažovaným rizikovým faktorem pro hypertenzi je i abnormálně utvářený aortální oblouk (ETA), v jehož důsledku by mohlo dojít k narušení funkce baroreceptorů nebo k abnormálnímu proudění pulzní vlny v aortě [14]. Za sekundární typ arteriální hypertenze považujeme také vysoký TK vlivem obstrukční spánkové apnoe (OSA), která je u pacientek s TS způsobena anatomicky úzkým prostorem v oblasti hltanu [37].
- Změny diurnální variability krevního tlaku u Turnerova syndromu
Aktuální hodnota TK je ovlivněna řadou proměnných, jako jsou polohou těla, míra fyzické a psychické zátěže, abúzus alkoholu či jiných drog. Za fyziologických okolností jsou hodnoty krevního tlaku v průběhu celého dne ovlivňovány také diurnální variabilitou, která je geneticky zakódovaná. Systolický i diastolický krevní tlak dosahuje nejnižších hodnot mezi půlnocí a čtvrtou hodinou ranní, jedná se o tzv. noční dipping. Na tento noční pokles navazuje ranní vzestup TK spojený s probouzením, změnou polohy a zahájením běžných denních úkonů. Maximálních hodnot TK dosahujeme od šesté hodiny ranní do deseti hodin dopoledne a další peak nastupuje odpoledne mezi šestnáctou a osmnáctou hodinou [38]. S tímto cyklem korespondují i hladiny plazmatických katecholaminů (adrenalin a noradrenalin) a kortizolu [39]. Algoritmus, kterým určujeme míru nočního dippingu, je vyjádřen vzorcem: [1-střední systolický TK během noci//střední systolický TK během dne] x 100, za patologickou hodnotu se považuje pokles o 10 % a méně [21].
Charakteristickým nálezem u pacientek s TS je absence fyziologického nočního poklesu TK, tzv. noční non-dip-ping. Dívky s TS jsou až v 57 % non-dippeři [40]. Noční non-dipping může být první známkou následného rozvoje arteriální hypertenze. Je prokázáno, že absence nočního poklesu TK je spojena s časnějším rozvojem aterosklerózy [41], a že nezávisle na hodnotách TK během dne určuje míru budoucího rizika kardiovaskulární příhody [42]. Jedinou možností, jak toto narušení diurnálního rytmu TK zachytit, je využití 24hodinové monitorace krevního tlaku (ABPM).
- Praktická doporučení pro diagnostiku hypertenze u Turnerova syndromu
Diagnostické postupy u arteriální hypertenze byly dlouhou dobu u žen s TS nejednotné. Jeden z přístupů doporučoval pouze jednorázové měření TK, za hraniční hodnotu byl považován systolický tlak 140 mmHg u pacientek s trikuspidální aortální chlopní, v případě chlopně bikuspidální byl za uspokojivou hodnotu považován systolický tlak pod 120 mmHg [43]. Druhý přístup do diagnostického algoritmu zapojil 24hodinovou monitoraci krevního tlaku v případě, že jednorázově naměřená hodnota TK dosáhla 130/80 mmHg a více [44].
De Groote a její kolektiv vytvořili na základě předchozích doporučení nové praktické postupy pro diagnostiku a léčbu arteriální hypertenze u TS, které ovšem nejsou oficiálním stanoviskem Evropské kardiologické společnosti (ESC). Během měření TK by mělo být respektováno několik obecně platných zásad. První měření TK by mělo být provedeno na obou pažích, za referenční by se měla považovat paže, na které byl naměřen vyšší TK. Měření by mělo standardně proběhnout v klidu, alespoň dvakrát v odstupu několika minut a s adekvátní velikostí manžety. TK u dívek s TS vyjadřujeme percentily ve vztahu k věku, pohlaví a výšce [21].
Jednorázové měření TK by mělo být provedeno u žen a dívek s TS alespoň jednou ročně. V případě, že pacientka nemá hodnoty TK při jednorázovém měření v pásmu hypertenze a zároveň nemá další rizikové faktory (VSV nebo dilatace aorty), je doporučeno provést první ABPM v době předání pacientky z péče dětského kardiologa do rukou kardiologa pro dospělé [21]. Pokud ale dívka s TS má VSV nebo dilataci aorty, je doporučeno zahájit pravidelné monitorování ABPM v desátém roce věku [45]. Indikací k ABPM u dospělých žen s TS by měla být vždy hodnota TK při jednorázovém měření 130/80 mmHg a více [21]. ABMP by měla být opakována každých pět let z důvodu možného záchytu nočního non-dippingu nebo noční formy hypertenze. U žen s VSV, těžkou hypertenzí s orgánovým postižením nebo dalšími KVS rizikovými faktory by měla být frekvence opakování 24hodinové monitorace krevního tlaku vyšší [21]. Pozitivní přínos zařazení ABPM do diagnostického algoritmu dokumentují výsledky recentní studie, ve které byl záchyt hypertenze užitím ABPM pětinásobný ve srovnání s jednorázovým měřením TK [28]. Zároveň ABPM eliminuje fenomén hypertenze bílého pláště.
Součástí diagnostického procesu by mělo být pátrání po sekundárních příčinách hypertenze. Pomocí echokardiografie nebo MRI hrudní aorty vyloučení CoA nebo ETA, laboratorními metodami a duplexní ultrasonografií vyloučení renovaskulárního nebo renoparenchymového typu hypertenze. Při klinickém podezření by měla být vyloučena dysfunkce štítné žlázy nebo OSA [21].
U pacientek s těžkou hypertenzí (tj. nad 99. percentil) je doporučeno aktivně pátrat po orgánovém postižení. Mezi vyšetření by měla být zahrnuta echokardiografie posuzující hypertrofii levé komory, vyšetření očního pozadí k vyloučení retinopatie, posouzení renálních funkcí a duplexní ultrasonografické vyšetření karotických tepen [21].
- Praktická doporučení pro léčbu hypertenze u Turnerova syndromu
Terapeutický přístup k hypertenzi u dospělých žen s TS se odvíjí od výsledků ABPM s ohledem na přítomnost srdečních vad nebo dalších rizikových faktorů pro získaná KVS onemocnění. Léčba je založena nejen na farmakologické intervenci, ale i na režimových opatřeních (obr. 2) [21].
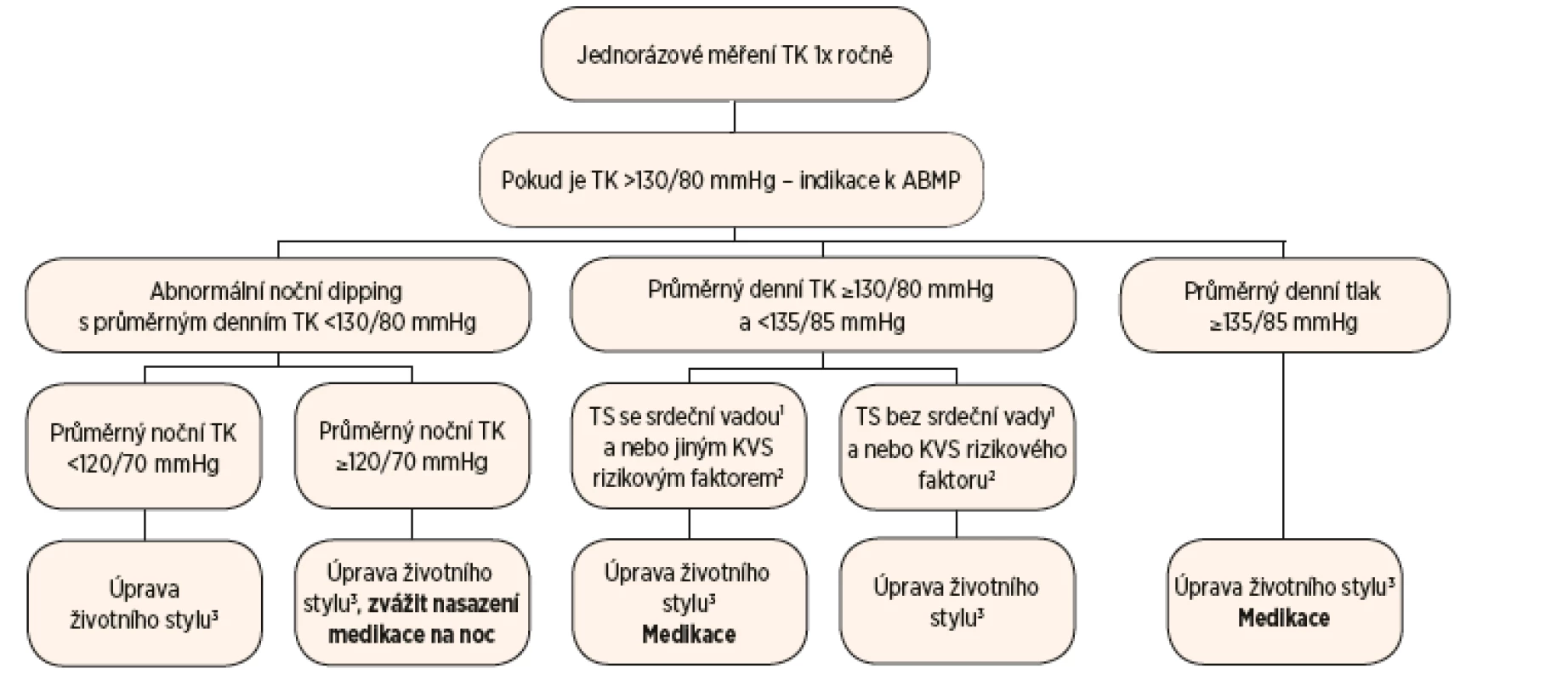
Dívkám s TK mezi 90. a 95. percentilem jsou doporučena režimová opatření (pravidelná pohybová aktivita, úprava jídelníčku, dostatek spánku), rozmezí 95. a 99. percentilu vyžaduje opakované kontroly TK. Pokud je TK nad 99. percentilem, měla by být zahájena léčba obdobnými lékovými skupinami jako u dospělých žen s TS [21].
Léčba hypertenze u pacientek s TS je většinou zahajována betablokátory, očekává se obdobný pozitivní efekt této lékové skupiny na vývoj aortální dilatace jako u pacientů s Marfanovým syndromem [21]. Dalším benefitem betablokátorů je úprava tachykardie, která se u pacientek s TS vyskytuje na podkladě zvýšeného tonu sympatiku [30]. V případě kontraindikací k nasazení betablokátorů se jako vhodná alternativa jeví inhibitory angiotenzin konvertujícího enzymu (ACE-I) anebo sartany, které mohou zacílit na jeden ze zvažovaných patogenetických mechanismů hypertenze u TS, a to na zvýšenou aktivitu RAA osy [21].
- Vliv růstového hormonu a hormonální substituce na krevní tlak u Turnerova syndromu
Vliv růstového hormonu (GH – growth hormon) na hodnoty TK u TS je rozporuplný. Holandská studie porovnávající efekt různých dávek GH u dívek s TS prokázala pokles diastolického krevního tlaku pouze u skupiny léčené vysokými dávkami GH (2,7 mg/m2/den) po dobu několika let, hodnoty systolického krevního tlaku ovlivněny nebyly [46]. Pokles diastolického TK nebyl permanentní, přetrvával do pěti let po ukončení terapie GH [47]. Naopak podávání standardních dávek GH (1,3–2,0 mg/m2/den) nemělo na hodnoty systolického ani diastolického TK žádný vliv [46].
Příznivý vliv substituční terapie estrogeny na hodnoty TK není jednoznačně prokázán. Některé studie naznačily pokles diastolického TK během hormonální substituční léčby, ale jsou zapotřebí longitudinální studie, které by tento efekt potvrdily [36, 48].
- Hypertenze a aortální dilatace/disekce u Turnerova syndromu
Aortální disekce je závažnou a často fatální komplikací TS s incidencí 618 : 100 000 pacientek ročně [49]. Na celkové mortalitě se disekce aorty podílí osmi procenty [50]. Hypertenze je považována za významný a za jediný ovlivnitelný rizikový faktor pro disekci aorty, u více než poloviny pacientek s disekcí byla hypertenze prokázána [51]. Mezi další rizikové faktory řadíme vrozené srdeční vady. Zejména bikuspidální aortální chlopeň, jejíž přítomnost byla prokázána až u 95 % případů aortálních disekcí [52], koarktace aorty byla popsána u 89 % pacientek s disekcí [15].
Za další významný rizikový faktor pro disekci aorty je považována aortální dilatace, která se může u dívek s TS objevit již od šestého roku věku (ve 20–30 % případů) [53]. Aortální dilatace má u žen s TS progresivní charakter a je urychlena v případě současně se vyskytující bikuspidální aortální chlopně [54]. Diagnostika aortální dilatace transtorakální echokardiografií není vzhledem k častým abnormalitám hrudníku u pacientek s TS jednoduchá. Zlatým standardem v diagnostice dilatace aorty a BAV je v dnešní době MRI srdce a hrudní aorty. Pro hodnocení dilatace ascendentní aorty u TS užíváme indexovaného aortálního rozměru (ASI – aortic size index), což je průměr ascendentní aorty vztažený k tělesnému povrchu. Za 95. percentil se považuje hodnota 2,0 cm/m2 a za 99. percentil 2,5 cm/m2 [49].
Obecně se doporučuje provést MRI srdce a hrudní aorty ve věku, kdy již není nutná k vyšetření analgosedace, ovšem pouze za předpokladu, že je echokardiografický nález v normě. Pokud je již v dětském věku podezření na aortální dilataci z transtorakálního echokardiografického vyšetření, je vhodné zvážit provedení MRI bez ohledu na nutnost analgosedace. Pacientky s ASI nad 2,5 cm/m2 je doporučeno odeslat na kardiochirurgické pracoviště ke zvážení chirurgické intervence. V případě ASI 2 cm/m2 je doporučeno opakování MRI srdce a hrudní aorty každý rok. Pokud je ASI pod 95. percentilem a jsou přítomny další rizikové faktory pro disekci, mělo by být MRI vyšetření prováděno každé tři roky. Jestliže má žena s TS normální rozměry aorty bez rizikových faktorů pro disekci, je dostačující provést kontrolní MRI ve věku odpovídající v běžné populaci menopauze [55].
I když v současné době nejsou k dispozici jednoznačná česká ani evropská doporučení týkající se kardiologického sledování pacientek s TS, a to včetně frekvence provádění MRI srdce a hrudní aorty, považujeme za racionální provést toto vyšetření u všech pacientek v okamžiku, kdy již není nutná analgosedace. Kontrolní MRI indikujeme při předání pacientky do péče kardiologa pro dospělé. Výsledky vyšetření s pacientkou před předáním vždy podrobně zkonzultujeme a zajistíme předání konkrétnímu kardiologovi pro dospělé.
V případě kombinace dilatace aorty a hypertenze začínají být lékovou skupinou první volby ACE-I. U pacientů s Marfanovým syndromem významně zpomalují progresi aortální dilatace, zřejmě ovlivněním metabolismu transformačního růstového faktoru beta (TGF beta) [56]. Vyšší produkce TGF beta byla prokázána u pacientů s bikuspidální aortální chlopní [57]. U pacientek s TS zatím studie chybí.
U 10–25 % pacientek s disekcí nebyl prokázán žádný výše zmíněný rizikový faktor [19, 51]. Diskutuje se proto o vaskulopatii vázané k TS, která by ke vzniku disekce mohla sama o sobě vést. K tomu přispívá také fakt, že kromě aorty jsou u TS dokumentovány dilatace i jiných velkých arterií (brachiální nebo karotické tepny) [34].
Riziko vzniku aortální disekce významně narůstá u žen s TS v případě gravidity. Spontánně otěhotní pouze dvě procenta [58], ale díky současným metodám asistované reprodukce prostřednictvím darovaného oocytu se možnost otěhotnět otevírá daleko většímu počtu žen s TS. Jedna z největších metaanalýz čítající soubor 85 žen s potvrzenou disekcí aorty při TS zahrnuje sedm gravidních žen, přičemž pouze jedna přežila po kardiochirurgické intervenci [51]. Mateřská mortalita u TS v důsledku aortální disekce je odhadována na 2 % [59]. Polovina případů aortální disekce se odehraje v třetím trimestru gravidity nebo v průběhu porodu vlivem zvýšeného srdečního výdeje [60]. U těhotných žen s TS je pro vznik aortální disekce stejně jako mimo graviditu velmi významným rizikovým faktorem hypertenze. Ženy s TS by měly být před plánovanou graviditou vyšetřeny kompletně kardiologem včetně monitorace krevního tlaku prostřednictvím ABPM. V případě potvrzení hypertenze je doplněno ultrasonografické vyšetření ledvin a renálních arterií k vyloučení renovaskulární formy hypertenze. V případě, že není hypertenze ani při adekvátní terapii pod kontrolou, je gravidita kontraindikována [61]. K terapii hypertenze během gravidity žen s TS jsou doporučeny léky ze skupiny betablokátorů, efekt terapie je nutné opakovaně hodnotit prostřednictvím ABPM. Podle francouzské gynekologicko-porodnické společnosti je ke zvážení využití betablokátorů dokonce i v případě, že se u gravidní ženy s TS hypertenze neprokáže [61].
2. Hraniční poruchy glukózové homeostázy a diabetes mellitus u Turnerova syndromu
Pacientky s TS jsou ve zvýšeném riziku rozvoje poruch glukózového metabolismu ve smyslu zvýšené glykémie nalačno (IFG), porušené glukózové tolerance (IGT) nebo diabetes mellitus 2. typu (DM 2. typu). Výsledky orálního glukózového tolerančního testu (oGTT) prokázaly u 25–78 % žen s TS IGT [62]. Výskyt IFG nebyl významně vyšší ve srovnání s běžnou populací [62]. Výskyt diabetes mellitus 2. typu je u pacientek s TS až čtyřnásobně častější než v běžné populaci [1].
Za příčinu vzniku DM 2. typu u TS byla dlouho považována pouze zvýšená inzulinová rezistence [63]. Poslední studie ukazují, že roli hraje i snížená funkce beta buněk pankreatických ostrůvků, která je zpočátku vyrovnána zvýšenou inzulinovou senzitivitou, ta se ale postupně snižuje, až dojde k rozvinutí diabetes mellitus, podobně jako u pacientů s MODY diabetem [64].
Vliv růstového hormonu na metabolismus glukózy je rozporuplný, výsledky některých studií ukazují, že vede ke zhoršení inzulinové senzitivity [65].
3. Dyslipidémie u Turnerova syndromu
Více než polovina pacientek s TS má po 21. roce věku hypercholesterolémii a její incidence s věkem narůstá [66], zvýšené bývají i hladiny triacylglycerolů (TAG) [67]. Hladiny HDL cholesterolu jsou naopak až u čtvrtiny pa-cientek nižší ve srovnání s běžnou populací [1]. Podle Rosse je dyslipidémie důsledkem ovariální dysgeneze s deficitem estrogenů [68]. Na vzniku dyslipidémie se pravděpodobně podílí i jiné, dosud ne zcela objasněné patogenetické mechanismy.
Jedna ze studií věnující se TS a dyslipidémii prokázala u více než 50 % žen hypercholesterolémii, i přestože byly adekvátně substituovány estrogeny a měly normální funkci štítné žlázy [66]. Navíc ženy s TS na rozdíl od zdravých žen v menopauze nebo žen s ovariální dysfunkcí jiné etiologie mají výrazně „aterogennější“ lipidový profil [69]. Vliv podávání GH na lipidogram u TS se zdá být příznivý, jeho účinkem dochází ke snížení celkového cholesterolu a LDL cholesterolu při současném navýšení hladin HDL cholesterolu, ale i TAG [67].
4. Nadváha a obezita u Turnerova syndromu
Viscerální tuková tkáň je považována za metabolicky velmi aktivní, přispívající ke vzniku inzulinové rezistence a DM 2. typu. U žen s TS je prokázáno při magnetické rezonanci vyšší procento celkového tělesného tuku než u kontrolní skupiny zdravých žen. Tuková tkáň je uložena zejména ve viscerální oblasti [70]. Dívky s TS mají oproti kontrolám významně větší obvod pasu [71]. Složení těla se při léčbě růstovým hormonem mění příznivě, dochází k úbytku celkového tělesného tuku [65].
ZÁVĚR
Dívky a ženy s TS jsou celoživotně zatíženy zvýšenou morbiditou a mortalitou ve srovnání s běžnou populací. Více než polovina celkové mortality je přičítána vrozeným a získaným kardiovaskulárním onemocněním. V poslední době dochází ke zvýšenému zájmu odborné veřejnosti zejména o získaná kardiovaskulární onemocnění a jejich rizikové faktory.
Hypertenze je považována za významný rizikový faktor nejen pro ICHS a CMP, ale zejména pro disekci aorty, kde je jediným ovlivnitelným rizikovým faktorem. Časná diagnostika, zahájení adekvátní terapie a pravidelné kontroly TK jsou pro pacientky s TS zásadní. Vzhledem k tomu, že dlouhou dobu nebyla k dispozici konzistentní doporučení, v roce 2015 skupina autorky De Groote vytvořila praktická doporučení pro diagnostický a terapeutický algoritmus arteriální hypertenze u pacientek s TS. Důležité je zařazení 24hodinové monitorace krevního tlaku do diagnostických postupů. Touto metodou je možný záchyt nočního non-dippingu, který může být první známkou rozvoje arteriální hypertenze.
Součástí celoživotního sledování pacientek s TS by mělo být i hodnocení ukazatelů glukózového metabolismu, lipidogramu a tělesné hmotnosti jako dalších rizikových faktorů pro získaná KVS onemocnění. Důležitá je mezioborová spolupráce v péči o pacientky s Turnerovým syndromem a jejich pečlivá edukace.
Došlo: 26. 10. 2016
Přijato: 12. 1. 2017
MUDr. Sabina Kaprálová
Dětská klinika FN
a Lékařské fakulty Univerzity Palackého
I. P. Pavlova 6
779 00 Olomouc
e-mail: sabina_s@email.cz
Sources
1. Elsheikh M, Conway GS, Wass JAHDDB. Turner’s syndrome in adults. Endocr Rev 2002; 23 : 120–140.
2. Stochholm K, Juul S, Juel K, et al. Prevalence, incidence, diagnostic delay, and mortality in Turner syndrome. J Clin Endocrinol Metab 2006; 91 : 3897–3902.
3. Zapletalová J, Šnajderová M, Lebl J. Turnerův syndrom v dětství a v adolescenci. Remedia 2012; 22 : 199–205.
4. Mortensesn KH, Andersen NH, Gravholt CH. Cardiovascular phenotype in Turner syndrome – Integrating cardiology, genetics, and endocrinology. Endocrine Reviews 2012; 33 : 677–714.
5. Held KR, Kerber S, Kaminsky E, et al. Mosaicism in 45, X Turner syndrome: does survival in early pregnancy depend on the presence of two sex chromosomes? Hum Genet 1992; 88 : 288–294.
6. Fernandéz R, Méndez J, Pásaro E. Turner syndrome: a study of chromosomal mosaicism. Hum Genet 1996; 98 : 29–35.
7. Hassold TJ. Chromosome abnormalities in human reproductive wastage. Trends Genet 1986; 2 : 105–110.
8. Boucher CA, Sargnet CA, Ogata T, et al. Breakpoint analysis of Turner patients with partial Xp deletions: implications for the lymphoedema gene location. J Med Genet 2001; 38 : 591–598.
9. Chu CE, Donaldson MD, Kelnar CJ, et al. Possible role of imprinting in the Turner phenotype. J Med Genet 1994; 31 : 840–842.
10. Clark EB. Neck web and congenital heart defects: a pathogenic association in 45 X-0 Turner syndrome? Teratology 1984; 29 : 355–361.
11. Bondy CA. Genomic imprinting in Turner syndrome. In: Gravholt CH, Bondy CA, et al. Welness for Girls and Women with Turner Syndrome. Amsterdam: Elsevier, 2006 : 21–25.
12. Klásková E, Tüdös Z, Sobek A, et al. Low-level 45,X/46XX mosaicism is not associates with congenital heart disease and thoracic aorta dilatation: prospective magnetic resonance imaging and ultrasound study. Ultrasound Obstet Gynecol 2015; 45 : 722–727.
13. Ho VB, Bakalov VK, Cooley M, et al. Major vascular anomalies in Turner syndrome: prevalence and magnetic resonance angiographic feature. Circulation 2004; 110 : 1694–1700.
14. De Groote K, Devos D, Van Herck K, et al. Abnormal aortic arch morphology in Turner syndrome patients is a risk factor for hypertension. Heart Vessels 2015; 30 : 618–625.
15. Sybert VP. Cardiovascular malformations and complications in Turner sydrome. Pediatrics 1998; 101 : 11–17.
16. Gravholt CH, Juul S, Naerra RW, et al. Morbidity in Turner syndrome. J Clin Epidemiol 1998; 51 : 147–158.
17. Schoemaker NJ, Swerdlow AJ, Higgins CD, et al. Mortality in women with Turner syndrome in Great Britain: a national cohort study. J Clin Endocrinol Metab 2008; 93 : 4735–4742.
18. Gravholt CH. Epidemiological, endocrine and metabolic features in Turner syndrome. Eur J Endocrinol 2004; 151 : 657–687.
19. Bondy CA. Congenital cardiovascular disease in Turner syndrome. Congenit Heart Dis 2008; 3 : 2–15.
20. Gravholt CH, Landin-Wilhelmsen K, Stoccholm K, et al. Clinical and epidemiological description of aortic dissection in Turner’s syndrome. Cardiol Young 2006; 16 : 430–436.
21. De Groote K, Demulier L, De Backer J, et al. Arterial hypertension in Turner syndrome: a review of the literature and a practical approach for diagnosis and treatment. J Hypertens 2015; 33 : 1342–1351.
22. Lopez L, Arheart KL, Colan SD, et al. Turner syndrome is an independent risk factor for aortic dilatation in the young. Pediatrics 2008; 121 : 1622–1627.
23. Landin-Wilhelmsen K, Bryman I, Wilhelmsen L. Cardiac malformations and hypertension, but not metabolic risk factors, are common in Turner syndrome. J Clin Endocrinol Metab 2001; 86 : 4166–4170.
24. Lee SH, Jung JM, Song MS, et al. Evaluation of cardiovascular anoma-lies in patients with asymptomatic Turner syndrome using multidetector computed tomography. J Korean Med Sci 2013; 28 : 1169–1173.
25. Snieder H, Harshfield GA, Treiber FA. Heritability of blood pressure and hemodynamics in African - and European-American youth. Hypertension 2003; 41 : 1196–1201.
26. Goel M, Pal P., Arawal A, et al. Relationship of body mass index and other life style factors with hypertension in adolescents. Ann Pediatr Cardiol 2016; 9 (1): 29–34.
27. Poprawski K, Michalski M, Lawniczak M, et al. Cardiovascular abnormalities in patients with Turner syndrome according to karyotype. Pol Arch Med Wewn 2009; 119 : 453–460.
28. Fudge EB, Constantacos C, Fudge JC, et al. Improving detection of hypertension in girls with Turner syndrome using ambulatory blood pressure monitoring. Horm Res Paediatr 2014; 81 : 25–31.
29. Nathwani NC, Unwin R, Brook CG, et al. Blood pressure and Turner syndrome. Clin Endocrinol 2000; 52 : 363–370.
30. Gravholt CH, Hansen KW, Erlandsen M, et al. Nocturnal hypertension and impaired sympathovagal tone in Turner syndrome. J Hypertens 2006; 24 : 353–360.
31. Zuckerman-Levin N, Zinder O, Greenberg A, et al. Physiological and catecholamine response to sympathetic stimulation in Turner syndrome. Clin Endocrinol 2006; 64 : 410–415.
32. Maric-Bilkan C, Gilbert EL, Ryan MJ. Impact of ovarian function on cardiovascular health in women: focus on hypertension. Int J Womens Health 2014; 6 : 131–139.
33. Gravholt CH, Mortensen KH, Andersen NH, et al. Coagulation and fibrinolytic disturbances are related to carotid intima thickness and arterial blood pressure in Turner syndrome. Clin Endocrinol 2012; 76 : 649–665.
34. Ostberg JE, Donald EA, Halcox JP, et al. Vasculopathy in Turner syndrome: arterial dilatation and intimal thickening without endothelial dysfunction. J Clin Endocrinol Metab 2005; 90 : 5161–5166.
35. Baguet JP, Douchin S, Pierre H, et al. Structural and functional abnormalities of large arteries in the Turner syndrome. Heart 2005; 91 : 1442–1446.
36. Mortensen KH, Hansen KW, Erlandsen M, et al. Ambulatory arterial stiffness index in Turner syndrome: the impact of sex hormone replacement therapy. Horm Res 2009; 72 : 184–189.
37. Eklund M, Kotilainen J, Evalathi M, et al. Cephalometric analysis of pharyngeal airway space dimensions in Turner syndrome. Eur J Orthod 2012; 34 : 219–225.
38. Štejfa M, et al. Kardiologie. 2. vyd. Praha: Grada, 1998 : 1–500.
39. Souček M, Kára T, et al. Klinická patofyziologie hypertenze. 2. vyd. Praha: Grada Publishing, 2002 : 1–654.
40. Nathwani NC, Unwin R, Brook CGD, et al. Blood pressure and Turner syndrome. Clin Endocrinol 2000; 52 : 363–370.
41. Vasunta RL, Kesäniemi YA, Ylitalo A, et al. Non-dipping pattern and carotid atherosclerosis in a middle-aged population: OPERA study. Am J Hypertens 2012; 25 : 60–66.
42. Staessen JA, Thijs L, Fagard R, et al. Predicting cardiovascular risk using conventional vs ambulatory blood pressure in older patients with systolic hypertension. JAMA 1999; 282 : 539–546.
43. Conway GS, Band M, Doyle J, et al. How do you monitor the patient with Turner‘s syndrome in adulthood. Clin Endocrinol 2010; 73 : 696–699.
44. Turtle EJ, Sule AA, Bath LE, et al. Assessing and addressing cardiovascular risk in adults with Turner syndrome. Clin Endocrinol 2013; 78 : 639–645.
45. Wuhl E, Witte K, Soergel M, et al. Distribution of 24-h ambulatory blood pressure in children: normalized reference values and role of body dimensions. J Hypertens 2002; 20 : 1995–2007.
46. van der Berg J, Bannink EM, Wielopolski PA, et al. Cardiac status after childhood growth hormone treatment of Turner syndrome. J Clin Endocrinol Metab 2008; 93 : 2553–2558.
47. Bannink EM, van der Palen RI, Mulder PG, et al. Long-term follow-up of GH-treated girls with Turner syndrome: BMI, blood pressure, body proportions. Horm Res 2009; 71 : 336–342.
48. Elsheikh M, Bird R, Casadei B, et al. The effect of hormone replacement therapy on cardiovascular hemodynamics in women with Turner’s syndrome. J Clin Endocrinol Metab 2000; 85 : 614–618.
49. Matura LA, Ho VB, Rosing DR, et al. Aortic dilatation and dissection in Turner syndrome. Circulation 2007; 116 : 1663–1670.
50. Swerdlow AJ, Hermon C, Jacobs PA, et al. Mortality and cancer incidence in persons with numerical sex chromosome abnormalities: a cohort study. Ann Hum Genet 2001; 65 : 177–188.
51. Carlson M, Silberbach M. Dissection of the aorta in Turner syndrome: two cases and review of 85 cases in the literature. J Med Genet 2007; 44 : 745–749.
52. Carlson M, Airhart N, Lopez L, et al. Moderate aortic enlargement and bicuspid aortic valve are associated with aortic dissection in Turner syndrome: report of the International Turner Sydrome Aortic Dissection Registry: Circulation 2012; 126 : 2220–2226.
53. Chalard F, Ferey S, Teinturier C, et al. Aortic dilatation in Turner syndrome: the role of MRI in early recognition. Pediatr Radiol 2005; 35 : 323–326.
54. Mortensen KH, Hjerrild BE, Stochholm K. Dilatation of the ascending aorta in Turner syndrome – a prospective cardiovascular magnetic resonance study. J Cardiovasc Magn Reson 2011; 13 : 24.
55. Turtle EJ, Sule AA, Webb DJ, et al. Aortic dissection in children and adolescents with Turner syndrome: risk factors and management recommendations. Arch Dis Child 2015; 100 : 662–666.
56. Brooke BS, Habashi JP, Judge DP, et al. Angiotensin II blockade and aortic-root dilatation in Marfan’s syndrome. N Engl J Med 2008; 358 : 2787–2795.
57. Forte A, Della Corte A, Grossi M, et al. Early cell changes and TGF beta pathway alterations in the aortopathy associated with bicuspid aortic valve stenosis. Clin Sci 2013; 124 : 97–108.
58. Hovatta O. Pregnancies in women with Turner’s syndrome. Ann Med 1999; 31 : 106–110.
59. Chevalier N, Letur H, Lelannou D, et al. Materno-fetal cardiovasculat complications in Turner syndrome after oocyte donation: insufficient prepregnancy screening and pregnancy follow-up are associated with poor outcome. J Clin Endocrinol Metab 2011; 92 : 260–267.
60. Karnis MF, Zimon AE, Lalwani SI, et al. Risk of death in pregnancy achieved throught oocyte donation in patients with Turner syndrome: a national survey. Fertil Steril 2003; 80 : 498–501.
61. Cabanes L, Chalas C, Christin-Maitre S, et al. Turner syndrome and pregnancy: clinical practice. Recommendations for the management of patients with Turner syndrome before and during pregnancy. Eur J Obstet Gynecol Reprod Biol 2010; 152 : 18–24.
62. Gravholt CH, Naerra RW, Nyholm B, et al. Glucose metabolism, lipid metabolism, and cardiovascular risk factors in adult Turner’s syndrome. The impact of sex hormone replacement. Diabetes Care 1998; 21 : 1062–1070.
63. Caprio S, Boulware S, Diamond M, et al. Insulin resistance: an early metabolic defect of Turner syndrome. J Clin Endocrinol Metab 1991; 72 : 832.
64. Bakalov VK, Cooley MM, Quon MJ, et al. Impaired insulin secretion in the Turner metabolic syndrome. J Clin Endocrinol Metab 2004; 89 : 3516.
65. Gravholt CH, Naerraa RW, Brixen K, et al. Short-term growth hormone treatment in girls with Turner syndrome decreases fat mass and insulin sensitivity: a randomized, double-blind, placebo-controlled, crossover study. Pediatrics 2002; 110 : 889–896.
66. Garden AS, Diver MJ, Fraser WD. Undiagnosed morbidity in adult women with Turner’s syndrome. Clin Endocrinol 1996; 45 : 589–593.
67. Elsheikh M, Conway GS. The impact of obesity on cardiovascular risk factors in Turner’s syndrome. Clin Endocrinol 1998; 49 : 447–450.
68. Ross JL, Feuillan P, Long LM, et al. Lipid abnormalities in Turner syndrome. J Pediatr 1995; 126 : 242–245.
69. Van PL, Bakalov VK, Bondy CA. Monosomy for the X-chromosome is associated with an atherogenic lipid profile. J Clin Endocrinol Metab 2006; 91 : 2867–2870.
70. Gravholt CH, Hjerrild BE, Mosekilde L. Body composition is distinctly altered in Turner syndrome: relations to glucose metabolism, circulating adipokones, and endothelial adhesion molecules. Eur J Endocrinol 2006; 155 : 583–592.
71. O’Gorman CS, Syme C, Lang J, et al. An evaluation of early cardiometabolic risk factors in children and adolescents with Turner syndrome. Clin Endocrinol 2013; 78 : 907–913.
Labels
Neonatology Paediatrics General practitioner for children and adolescentsArticle was published in
Czech-Slovak Pediatrics

2017 Issue 1
- What Effect Can Be Expected from Limosilactobacillus reuteri in Mucositis and Peri-Implantitis?
- The Importance of Limosilactobacillus reuteri in Administration to Diabetics with Gingivitis
-
All articles in this issue
- Diagnostický a terapeutický postup u detských pacientov s prvou nekomplikovanou infekciou horných močových ciest
- Recidivující infekce močových cest – přínos diagnostiky a léčby dysfunkční mikce
- Včasná antibiotická terapia a riziko renálneho jazvenia u detí s prvou nekomplikovanou infekciou močových ciest
- Haemophilus diseases in ENT in children before and after the introduction of Haemophilus influenzae type b vaccine
- Nezvyčajná príčina hyperkalciémie u pacientky s primárne kortikorezistentným nefrotickým syndrómom – kazuistika
- Kvalita spánku detí a adolescentov s diabetes mellitus 1. typu
- Funkcia štítnej žľazy u obéznych detí
- Recidivující krvácení do trávicího ústrojí
- General Movements – vyšetření nezralého nervového systému
- Získaná kardiovaskulární onemocnění u Turnerova syndromu
- Febrilní křeče: doporučený postup pro vyšetření dítěte s nekomplikovanými febrilními křečemi. Adaptovaný doporučený postup American Academy of Pediatrics
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Haemophilus diseases in ENT in children before and after the introduction of Haemophilus influenzae type b vaccine
- Recidivující krvácení do trávicího ústrojí
- General Movements – vyšetření nezralého nervového systému
- Febrilní křeče: doporučený postup pro vyšetření dítěte s nekomplikovanými febrilními křečemi. Adaptovaný doporučený postup American Academy of Pediatrics
