Syndrom Noonanové z pohledu dětského kardiologa
Noonan syndrome from a paediatric cardiologistˇs perspective
Noonan syndrome (NS) represents a genetic disorder associated with a high prevalence of cardiovascular disease, especially pulmonary valve stenosis, hypertrophic cardiomyopathy, atrial septal defect, and atrioventricular canal. These cardiac defects could be the first symptoms which lead to the suspicion of NS. Even if diagnosis of NS is based on clinical criteria, the molecular testing plays a key role in establishing genotype/phenotype correlation and enables better stratification of the cardiovascular risk in the future. More than 50% of patients with Noonan syndrome harbor PTPN11 pathogenic variant.
Keywords:
molecular genetic testing – hypertrophic cardiomyopathy – Noonan syndrome – pulmonary valve stenosis – ECG changes
Authors:
E. Klásková
Authors‘ workplace:
Dětská klinika, Lékařská fakulta Univerzity Palackého a Fakultní nemocnice, Olomouc
Published in:
Čes-slov Pediat 2020; 75 (4): 227-331.
Category:
Overview
Noonanové syndrom (NS) patří mezi geneticky podmíněná onemocnění spojená s vysokou prevalencí srdečních vad, zejména stenózy chlopně plicnice, hypertrofické kardiomyopatie, defektu síňového septa a defektu atrioventrikulárního septa. Tyto vady mohou být prvním symptomem, který vede k podezření na NS. I když je diagnóza NS založena na splnění klinických kritérií, molekulárně genetické vyšetření hraje klíčovou roli v určení korelace genotypu a fenotypu a do budoucna umožní přesnější stratifikaci kardiovaskulárního rizika. Více než 50 % nositelů NS má prokázánu patogenní variantu v genu PTPN11.
Klíčová slova:
Noonanové syndrom – stenóza chlopně plicnice – hypertrofická kardiomyopatie – EKG změny – molekulárně genetické vyšetření
ÚVOD
Noonanové syndrom (NS) patří mezi relativně častá geneticky podmíněná onemocnění s prevalencí 1 na 1000‒2500 živě narozených [1], se zpravidla autosomálně dominantní dědičností. Z pohledu kardiologa je NS zajímavý nápadně častým výskytem kardiovaskulárních onemocnění. U většiny jedinců s NS pozorujeme faciální dysmorfii (trojúhelníkovitý obličej, ptóza víček, hypertelorismus, nízce nasedající uši a širší krk). Dalšími příznaky mohou být malý vzrůst, vrozené srdeční vady (VSV) nebo kardiomyopatie (KMP), známky abnormálního utváření lymfatického systému (periferní lymfedém, aplazie/absence ductus thoracicus, hypoplazie inguinálních a iliackých lymfatických cév) [2], mírná mentální retardace, kryptorchismus a abnormality skeletu a urogenitálního traktu. Klinický obraz NS je variabilní, nápadnost dysmorfických rysů se mění i s věkem a při pátrání po dalších rodinných příslušnících s NS může být užitečné posouzení fotek z dětství.
NS byl poprvé popsán v roce 1962 americkou kardioložkou Jacqueline A. Noonanovou na konferenci Midwest Society for Pediatric Research v Cincinnati. V souboru 835 dětí s VSV zaznamenala 9 pacientů (6 chlapců a 3 dívky) s pulmonální stenózou, malým vzrůstem, hypertelorismem a lehkým mentálním opožděním [3]. V roce 1968 stejná autorka publikovala větší soubor 19 pacientů, 12 mužského a 7 ženského pohlaví, jejichž fenotyp byl nápadně podobný Turnerovu syndromu, nebyl však vázán výhradně na ženské pohlaví a na rozdíl od Turnerova syndromu byla nejčastější VSV stenóza chlopně plicnice [4]. Typickými extrakardiálními znaky byly hypertelorismus, krátká šíje, nízce nasedající uši, malý vzrůst, přičemž hraniční nebo snížená inteligence byla popsána v polovině případů. V roce 1965 byl tento syndrom pojmenován Opitzem a spoluautory po své objevitelce [5].
KORELACE MEZI KARDIOVASKULÁRNÍM GENOTYPEM A FENOTYPEM
Cesta k objasnění genetické příčiny NS byla dlouhá. S rozvojem cytogenetických metod byla v roce 1959 objevena asociace mezi Turnerovým syndromem a monosomií chromosomu X [6], avšak genetická příčina podobného fenotypu u pacientů mužského pohlaví s tzv. „male Turner syndrome“ zůstávala nejasná. Noonanová byla pak první, kdo popsal „turnerovský“ fenotyp u dívek s normálním ženským karyotypem. Vzhledem k familiárnímu výskytu u části jedinců s NS, výskytu u obou pohlaví a normálnímu karyotypu Noonanová vyslovila hypotézu, že by se mohlo jednat o familiární onemocnění s multifaktoriální dědičností.
Podle současných znalostí NS patří mezi tzv. RASopatie, což je skupina onemocnění způsobených zárodečnými mutacemi v genech signalizační dráhy RAS/MAPK (mitogen activated protein kinase). Mezi tato onemocnění patří NS, neurofibromatóza typu 1, Legiův syndrom, Costellův syndrom, jejichž fenotyp se částečně překrývá. Dosud byla u NS a jemu fenotypicky blízkých jednotek identifikována řada kauzálních genů (PTPN11, SOS1, RAF1, RIT1, BRAF, KRAS, NRAS, MEK1, RRAS, CBL, SHOC2) a diagnóza NS tak může být molekulárně geneticky potvrzena u 70‒75 % pacientů [7]. Z molekulárně genetického hlediska se jedná zejména o mutace typu missense, popř. malé intragenové delece/inserce/duplikace. Dědičnost je zpravidla autosomálně dominantní, byly však identifikovány formy NS s autosomálně recesivním přenosem [8].
NS je nejčastěji způsoben mutacemi v genech PTPN11 (39 - 56% případů), SOS1 (10‒21 %), RAF1 (5‒9 %) a KRAS (5‒6 %) [9]. Z kardiologického hlediska je zajímavé, že některé z těchto mutací ovlivňují specificky distribuci VSV u jejich nositelů. Mutace genu PTPN11 jsou charakteristické vyšším výskytem pulmonální stenózy a nižší prevalencí hypertrofické kardiomyopatie (HKMP). Patogenní varianta v genu PTPN11 je z 80 % zodpovědná za případy NS se stenózou chlopně plicnice nebo defektem síňového septa, a naopak nositelé této mutace mají snížené riziko hypertrofické KMP (6 % versus 26 %) ve srovnání s těmi, kteří tuto mutaci nemají. Podobně pacienti s NS a defektem atrioventrikulárního septa jsou predominantně nosiči této mutace. Patogenní varianty genu RAF1 vykazují silnou pozitivní asociaci s HKMP a negativní s valvární stenózou plicnice. Patogenní varianta v genu RIT1 zvyšuje riziko jak HKMP, tak pulmonální stenózy. Mutace v genu SOS1 vedou častěji k postižení pulmonální chlopně ve srovnání s PTPN11.
KARDIOVASKULÁRNÍ PROJEVY NOONANOVÉ SYNDROMU
Z kardiologického hlediska bylo zajímavé, že všichni pacienti popsaní už v první publikaci Jacqueliny Noonanové měli prokázánu vrozenou srdeční vadu (VSV), avšak jiného spektra než u Turnerova syndromu ‒ v 90 % případů se jednalo o valvární stenózu plícnice, v 10 % o hemodynamicky významnou perzistující tepennou dučej vyžadující chirurgickou intervenci. Vedlejšími kardiologickými nálezy bez nutnosti intervence byly už v této původní práci defekt síňového septa a parciální anomální návrat plicních žil do horní duté žíly. Noonanová rovněž poprvé popsala charakteristické změny na EKG, zejména výrazný sklon osy srdeční doprava, který neodpovídal závažnosti pulmonální stenózy. Tato publikace vyvolala zájem dětských kardiologů o tuto problematiku a vedla k dalšímu výzkumu v této oblasti [4].
Podle současných znalostí se VSV, KMP nebo jejich kombinace vyskytují až u 90 % nositelů NS (tab. 1) [7]. Některé z těchto vad mohou být v okamžiku stanovení diagnózy klinicky němé, nebo zejména v případě hypertrofické KMP se mohou manifestovat až v pozdějším věku a je nezbytné po nich cíleně pátrat.

Postižení kardiovaskulárního systému patří mezi diagnostická kritéria pro stanovení klinické diagnózy NS. U pacientů s typickou faciální dysmorfií je požadována přítomnost jednoho velkého kritéria nebo dvou kritérií malých, u jedinců se suspektní faciální dysmorfií jsou vyžadována dvě velká nebo tři malá kritéria. Mezi velká kritéria patří stenóza chlopně plicnice, hypertrofická KMP a/nebo změny na EKG typické pro NS, ke splnění malého kritéria stačí přítomnost jakékoliv jiné srdeční vady [10].
Stenóza chlopně plicnice u pacientů s Noonanové syndromem
Stenóza chlopně plicnice představuje vůbec nejčastější vrozenou srdeční vadu u NS. Její závažnost může být různá ‒ přibližně u 60 % pacientů se setkáváme s lehkou stenózou, u 10 % se středně závažnou a v 30 % s hemodynamicky významnou vadou. V případě lehké stenózy chlopně plicnice se většinou jedná o neprogredující vadu, která jen zřídka vyžaduje intervenci v průběhu života. Zajímavé je, že přibližně polovina těchto dětí má další přidruženou VSV, která ale už intervenci může vyžadovat ‒ defekt síňového septa typu secundum, defekt komorového septa, perzistující Botallova dučej, dysplastická aortální chlopeň, prolaps mitrální chlopně, periferní stenózy větví plicnice a HKMP [11]. Pacienti se středně závažnou či závažnou pulmonální stenózou vyžadují intervenci v 50‒100 % případů. Chlopeň je často dysplastická, s fúzí komisur a dysplastickými cípy chlopně (obr. 1). Důsledkem této nepříznivé anatomie dochází často k selhání perkutánní balónkové valvuloplastiky a vada má být až v 65 % řešena chirurgickým zákrokem, zpravidla chirurgickou valvulotomií [12]. I u těchto pacientů je častým nálezem další asociovaná VSV ‒ především defekt síňového septa,
Fig. 1. Echocardiographic 2D scan of a dysplastic pulmonary valve causing mild pulmonary valve stenosis (arrow) in infant with NS; parasternal short view.

Z pohledu dětského kardiologa je zajímavá práce, která se zabývala prevalencí NS v populaci dětí se stenózou pulmonální chlopně [13]. V této retrospektivní studii zahrnující 204 dětí byl klinicky potvrzen NS u 6 % pacientů a molekulárně genetickým vyšetřením byla následně nalezena kauzální mutace u 58 % případů NS. Nejčastější příčinou NS byly mutace v genu PTPN11 u 58 %, v genu NF1 u 17 %, zbývající pacienti měli prokázánu mutaci v genech KRA, BRAF a RAF1 u 8 %. HCMP byla zjištěna u 33 % dětí s NS, nebyla však přítomna u žádného z pacientů s izolovanou stenózou chlopně plicnice bez NS. Výsledkem této studie je doporučení, aby pacientům s valvární stenózou plicnice byla věnována zvýšená pozornost a pokud vykazují i mírné známky faciální dysmorfie, nebo v případě dalších přidružených kardiálních či extrakardiálních vad typických pro NS, byli odesláni ke genetické konzultaci a konzultaci a bylo u nich zváženo molekulárně genetické vyšetření.
Defekt atrioventrikulárního septa u pacientů s Noonanové syndromem
Tato VSV byla pozorována až u 15 % dětí s NS [7]. Pro děti s touto VSV je typická parciální forma defektu AV septa, která zahrnuje defekt síňového septa typu primum spolu s rozštěpem předního cípu mitrální chlopně (obr. 2). Tyto defekty mohou být asociovány se subaortální stenózou, netypickým utvářením mitrální chlopně (padákovitá deformita, zdvojené mitrální ústí).
Fig. 2. Echocardiographic 2D and CFM scans of partial atrioventricular canal; an arrow
shows the primum part of the atrial septum.

Kompletní forma defektu atrioventrikulárního septa je u NS vzácná [14], v populaci se mnohem častěji spojuje s nejčastějšími trisomiemi s dominancí Downova syndromu [15]. Nejčastější příčinou NS u dětí s antrioventikulárním kanálem byly mutace v genu PTPN11. Vzhledem k tomu, že familiární výskyt této VSV je velmi vzácný, je vhodné zvážit molekulárně genetické vyšetření na RASopatie, pokud je tato VSV přítomna u více rodinných příslušníků.
Hypertrofická kardiomyopatie u pacientů s Noonanové syndromem
HKMP patří mezi časté nálezy u dětí s NS a postihuje 10‒30 % nositelů NS [7]. Podobně jako stenóza chlopně plicnice může být prvním symptomem, který vede k podezření na NS. Z dat získaných z The National Australian Childhood Cardiomyopathy Study, do které bylo zahrnuto 80 dětí s HKMP diagnostikovanou ve věku 0 ‒ 10 let (medián 0,48 roků), vyplývá, že 30 % dětí s HKMP diagnostikovanou v dětství mělo zároveň NS [16]. Medián délky sledování těchto dětí byl 15,7 roku. Děti s NS měly horší prognózu než děti bez NS. Během jednoho roku od stanovení diagnózy HKMP zemřelo nebo podstoupilo transplantaci srdce 14 % dětí s HKMP, v podskupině s NS 20 %.
Další studie vycházející z dat z Pediatric Cardiomyopathy Registry [17] srovnávala 74 pacientů s NS a HKMP diagnostikovaných ve věku 0‒18 let s kontrolní skupinou 792 pacientů s idiopatickou nebo familiární formou HKMP. HKMP byla u dětí s NS stanovena ve věku <6 měsíců v 51 % ve srovnání s 28 % v kontrolní skupině a měly iniciálně častěji známky srdečního selhávání ‒ 24 % oproti 9 %. Časná mortalita dětí s NS a KMP byla v prvním roce od stanovení diagnózy 22 %, mortalita během prvních 3 let od sledování byla 26 % ve srovnání s 11 % v kontrolní skupině. Vyšší mortalita dětí s NS byla dána nižším věkem při manifestaci HKMP a vyšší incidencí srdečního selhání ve srovnání s kontrolní skupinou. Děti s NS měly častěji koncentrickou formu HKMP (42 % versus 35 %) a obstrukci výtokového traktu levé komory (30 % versus 9 %). Pouze u 73 % dětí s NS byla tato diagnóza známa před nebo v okamžiku stanovení diagnózy HKMP. U 23 % dětí s NS a HKMP byla přítomna nejméně jedna další VSV kromě HKMP, nejčastěji pulmonální stenóza a defekt síňového septa typu secundum.
EKG změny typické pro Noonanové syndrom
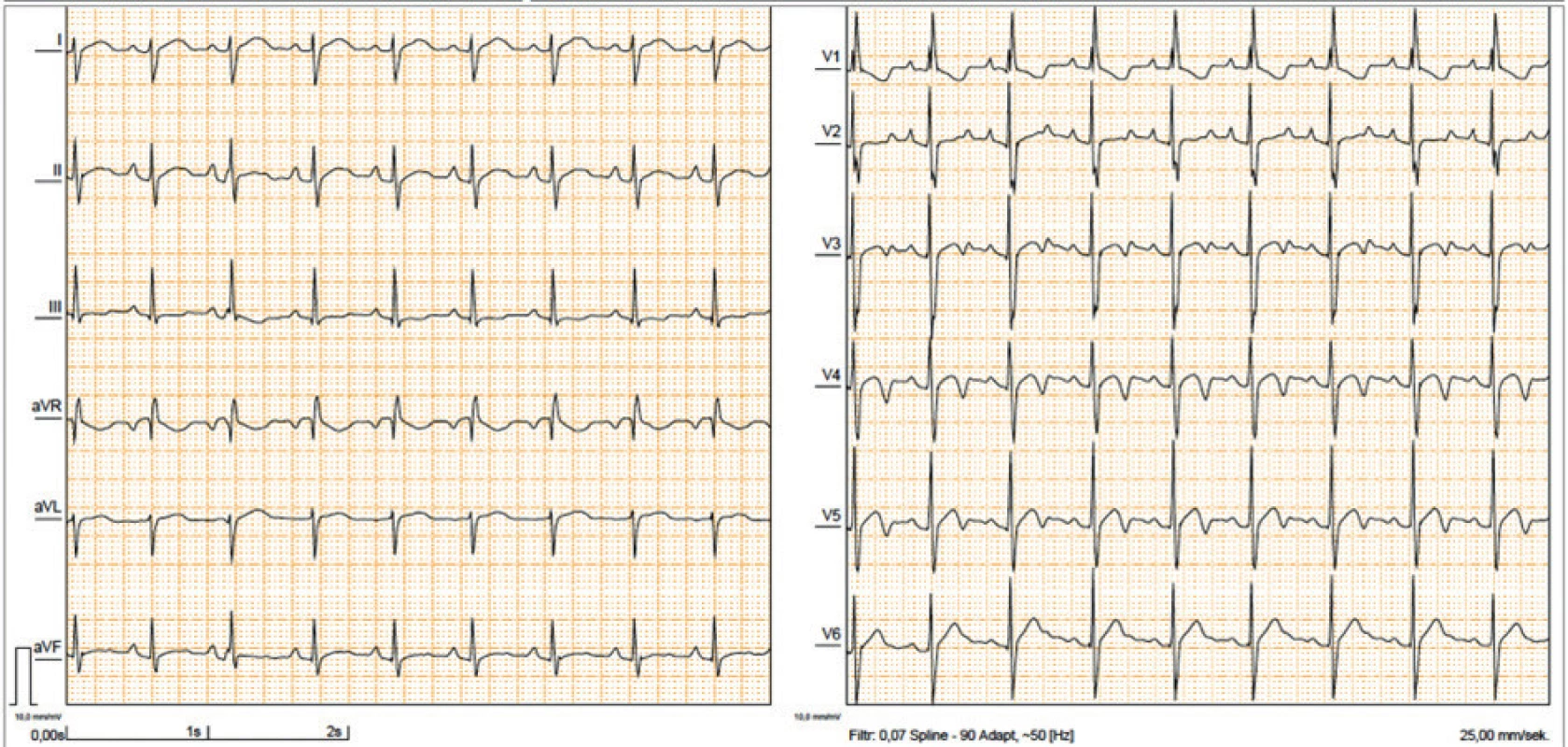
Již v první publikaci Noonanové byly popsány atypické změny na EKG u 7 dětí s pulmonální stenózou, jednalo se o významnou deviaci osy srdeční doprava, která neodpovídala hemodynamické závažnosti asociované VSV. Jiní autoři [18] naopak popsali sklon osy srdeční doleva, abnormální poměr R/S v levém prekordiu a abnormální kmity Q (obr. 4). U nositelů mutace RAF1 se vzácně mohou objevit běhy síňové tachykardie. Atypické EKG se vyskytuje u více než 50 % nositelů NS a řadí se mezi velká klinická kritéria [10]. Příčina těchto změn nebyla dosud objasněna a nelze je vysvětlit asociovanou VSV.
Fig. 3. Echocardiographic 2D scan showing an concentric form of hypertrophic cardiomyopathy in a 13yr old girl; parasternal short view.

Fig. 4. ECG in 6yr old girl with NS with NS showing a right axis deviation which does not correlate with the mild pulmonary valve stenosis.
DOPORUČENÍ PRO KARDIOLOGICKÉ SLEDOVÁNÍ PACIENTŮ SE SYNDROMEM NOONANOVÉ
Podle doporučení The Noonan Syndrome Support Group publikovaných v roce 2010 [2] je u všech pacientů s nově zjištěným NS indikováno kardiologické vyšetření včetně EKG i echokardiografického vyšetření. U pacientů s normálním kardiologickým nálezem má být toto vyšetření opakováno každých 5 let s ohledem na riziko pozdější manifestace HKMP. Toto sledování má pokračovat i v dospělém věku. Pacienti s VSV nebo HKMP mají být sledování individuálně v závislosti na závažnosti kardiologického nálezu.
ZÁVĚR
Pacienti s NS představují populaci s vysokou prevalencí VSV a HKMP, které zásadním způsobem ovlivňují jejich mortalitu a morbiditu. Výskyt konkrétních srdečních vad koreluje do značné míry s typem kauzální mutace. U dětí s nově diagnostikovanou HKMP, stenózou chlopně plicnice a defektem atrioventrikulárního septa je vždy nutné myslet na možnost NS a zvážit odeslaní dítěte ke genetické konzultaci. Vzhledem k relativně nízké prevalenci tohoto syndromu je doporučeno kardiologické sledování ve specializovaných terciárních centrech.
Doc. MUDr. Eva Klásková, Ph.D.
Dětská klinika
Lékařská fakulta Univerzity Palackého
a Fakultní nemocnice
I. P. Pavlova 6
779 00 Olomouc
e-mail: Eva.Klaskova@fnol.cz
Sources
1. Mendez HM, Opitz JM. Noonan syndrome: a review. Am J Med Genet 1985; 21 : 493–506.
2. Romano AA, Allanson JE, Dahlgren J, et al. Noonan syndrome: Clinical features, diagnosis, and management guidelines. Pediatrics 2010; 126 : 746–759.
3. Noonan JA, Ehmke DA. Associated noncardiac malfomations in children with congenital heart disease. J Pediatr 1963; 63 : 468–470.
4. Noonan JA, Lexington K. Hypertelorism with Turner phenotype. A new syndrome with associated congenital heart disease. Am J Dis Child 1968; 116 (4): 373–380.
5. Opitz JM, Summitt RL, Sarto GE. Noonan‘s syndrome in girls: A genocopy of Ullrich-Turner syndrome. J Pediatr 1965; 67 : 968.
6. Ford CE, Jones KW, Polani DE, et al. A sex-chromosome anomaly in a case of gonadal dysgenesis (Turner‘s syndrome). Lancet 1959; 7075 (1): 711–713.
7. Linglart L, Gelb BD. Congenital heart defects in Noonan syndrome: Diagnosis, management, and treatment. Am J Med Genet Part C 2020; 1–8.
8. Johnston JJ, Smagt van der JJ, Rosenfeld JA. Autosomal recessive Noonan syndrome associated with biallelic LZTR1 variants. Genet Med 2018; 20 (10): 1175–1185.
9. Pierpont ME, Digillio MC. Cardiovascular disease in Noonan syndrome. Curr Opin Pediatr 2018; 30 (5): 601–608.
10. Burgt van der I, Berends E, Lommen E, et al. Clinical and molecular studies in a large dutch – Family with Noonan syndrome. Am J Med Genet 1994; 53 (2): 187–191.
11. Colquitt LC, Noonan JA. Cardiac findings in Noonan syndrome on long-term follow-up. Congenit Heart Dis 2014; 9 (2): 264–273.
12. Holzmann J, Tibby SM, Rosenthal E, et al. Results of balloon pulmonary valvoplasty in children with Noonan´s syndrome. Cardiol Young 2018; 28 (5): 647–652.
13. Anderson K, Cnota J, James J, et al. Prevalence of Noonan spectrum disorders in a pediatric population with valvar pulmonary stenosis. Congenit Heart Dis 2019; 14 (2): 264–273.
14. Digilio MC, Lepri FR, Dentici ML, et al. Atrioventricular canal defect in patients with RASopaties. Eur J Hum Genet 2013; 21 : 200–204.
15. Pavlicek J, Gruszka T, Polanska S, et al. Parents’ request for termination of pregnancy due to a congenital heart defect of the fetus in a country with liberal interruption laws. J Matern-Fetal Neo Med 2019; 1–9.
16. Alexander PMA, Nugent AW, Daubeney PEF, et al. Long-term outcomes of hypertrophic cardiomyopathy diagnosed during childhood. Results from a National Population-Based Study. Circulation 2018; 138 : 29–36.
17. Wilkinson JD, Lowe AM, Salbert BA, et al. Outcomes in children with Noonan syndrome and hypertrophic cardiomyopathy: A study from the Pediatric Cardiomyopathy Registry. Am Heart J 2012; 164 : 442–448.
18. Raaijmakers R, Noordam C, Noonan JA. Are ECG abnormalities in Noonan syndrome characteristic for the syndrome? Eur J Pediatr 2008; 167 : 1363–1367.
Labels
Neonatology Paediatrics General practitioner for children and adolescentsArticle was published in
Czech-Slovak Pediatrics

2020 Issue 4
- What Effect Can Be Expected from Limosilactobacillus reuteri in Mucositis and Peri-Implantitis?
- The Importance of Limosilactobacillus reuteri in Administration to Diabetics with Gingivitis
-
All articles in this issue
- Dětský růst v zrcadle času – a věčný třetí percentil
- Analýza dat z celostátního registru pacientů léčených růstovým hormonem REPAR
- Význam acidolabilní podjednotky (ALS) v etiologii a v diagnostice malého vzrůstu
- Syndrom Noonanové a další RASopatie: Etiologie, diagnostika a terapie
- Syndrom Noonanové z pohledu dětského kardiologa
- Prenatální fenotyp RASopatií
- Etiologie a diagnostika poruchy růstu u dětí, které se narodily malé na svůj gestační věk (SGA) s přetrvávající malou výškou v dětství (SGA-SS)
- Růstové databáze a registry – cesta k poznání fyziologických účinků růstového hormonu
- Porucha růstu u 11leté dívky s diabetem
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Syndrom Noonanové a další RASopatie: Etiologie, diagnostika a terapie
- Etiologie a diagnostika poruchy růstu u dětí, které se narodily malé na svůj gestační věk (SGA) s přetrvávající malou výškou v dětství (SGA-SS)
- Syndrom Noonanové z pohledu dětského kardiologa
- Prenatální fenotyp RASopatií
