Aktuální diagnostická kritéria neonatální sepse a systémové zánětlivé odpovědi u plodu a novorozence
Current diagnostic criteria of neonatal sepsis and systemic inflammatory response in the fetus and the newborn
Neonatal sepsis (NS) is one of the most serious complications of the neonatal period with high mortality and severe long-term morbidity. Neonatal sepsis is currently also very often the cause of litigations between the child's legal guardians and health care providers. Adequate diagnosis and early therapy of NS are essential factors that can affect the child´s prognosis. However, optimal management of NS depends not only on the exact assessment of available clinical and laboratory data of the newborn, but also on the precise analysis of the course of pregnancy and childbirth.
In this comprehensive paper, authors present the complex issue of NS, the basic classification of neonatal sepsis, current definitions of NS, recommended clinical and laboratory procedures in the diagnosis of NS, fetal inflammatory response syndrome (FIRS), systemic inflammatory response syndrome (Systemic Inflammatory Response Syndrome, SIRS) in the neonate and the new organ failure scoring system.
Keywords:
Neonatal sepsis – Systemic inflammatory response syndrome – definition – diagnosis
Authors:
K. Boráková 1; Z. Straňák 1,2
Authors‘ workplace:
Ústav pro péči o matku a dítě, Praha
1; 3. lékařská fakulta, Univerzita Karlova, Praha
2
Published in:
Čes-slov Pediat 2021; 76 (1): 46-54.
Category:
Review
Overview
Neonatální sepse (NS) je jednou z nejzávažnějších komplikací novorozeneckého období s vysokou mortalitou a závažnou dlouhodobou morbiditou. Neonatální sepse je momentálně velmi často také příčinou soudních sporů mezi zákonnými zástupci dítěte a poskytovateli zdravotní péče. Adekvátní diagnostika a včasná terapie NS jsou zásadními faktory, které ovlivňují prognózu dítěte. Optimální management NS však nezávisí pouze na exaktním posouzení dostupných klinických a laboratorních dat u novorozence, ale i na precizní analýze průběhu těhotenství a porodu.
V souborném referátu autoři prezentují komplexní problematiku NS, základní dělení novorozeneckých sepsí, aktuální definice NS, doporučené klinické a laboratorní postupy v diagnostice NS, syndromu zánětlivé odpovědi plodu (Fetal Inflammatory Response Syndrome, FIRS), syndromu systémové zánětlivé odpovědi (Systemic Inflammatory Response Syndrome, SIRS) u novorozence a nový skórovací systém orgánového selhání.
Klíčová slova:
neonatální sepse – syndrom systémové zánětlivé odpovědi – definice – diagnostika
INCIDENCE NOVOROZENECKÉ SEPSE
Incidence novorozenecké sepse významně koreluje s gestačním stářím novorozenců – s klesajícím gestačním stářím se zvyšuje prevalence infekce. Incidence potvrzené časné sepse (EOS) u donošených novorozenců se udává v rozvinutých zemích přibližně 0,5/1000 živě narozených novorozenců, u novorozenců pod 34. gestační týden 6/1000, u novorozenců s porodní hmotností pod 1500 g 15–25/1000 živě narozených [1]. Incidence pozdní sepse (LOS) u nezralých novorozenců vyžadujících dlouhodobou intenzivní péči se pohybuje v rozmezí 11–30 % [2]. Zavedení inovativních a preventivních opatření v perinatologii a neonatologii vedlo k mírnému poklesu výskytu infekcí na jednotkách intenzivní péče novorozenců, ale novorozenecká sepse zůstává nadále závažným problémem a hlavní příčinou novorozenecké mortality a morbidity.
SPECIFICKÉ FAKTORY NEONATÁLNÍ SEPSE
Sepse je v současné době definována u dospělých pacientů jako život-ohrožující orgánová dysfunkce způsobená dysregulovanou odpovědí organismu hostitele na přítomnost infekce [3]. Nová definice klade důraz na diagnostiku známek orgánové dysfunkce. Závažnost orgánové dysfunkce je kvantifikována skórovacím systémem SOFA (Sequential Organ Failure Assessment). Skórovací systém reflektuje i závažnost syndromu systémové zánětlivé odpovědi (Systemic Inflammatory Response Syndrome, SIRS). Vzhledem k tomu, že SIRS může vzniknout i jako odpověď na neinfekční inzult, je pro adekvátní terapii sepse nutná přesná detekce mikroorganismu, který vyvolává infekci (tzn. průkaz přítomnosti mikroorganismu v primárně sterilních tělních tekutinách – krev, mozkomíšní mok, moč, synoviální tekutina apod.).
Definice a diagnostika neonatální sepse je, na rozdíl od dospělé populace, velmi obtížná s ohledem na: 1. problematickou detekci mikroorganismu, 2. absenci konsenzuální definice SIRS vzhledem k vysoké variabilitě klinických symptomů a laboratorních nálezů, 3. absenci skórovacího systému pro posouzení orgánového selhání, 4. existenci řady neinfekčních faktorů, které ovlivňují vznik SIRS u novorozenců v perinatálním období, 5. potencionální pre-existenci syndromu zánětlivé odpovědi plodu (Fetal Inflammatory Response Syndrome, FIRS) z infekčních i neinfekčních příčin a 6. gestační stáří novorozenců, které je signifikantním faktorem pro senzitivní a specifická kritéria FIRS, SIRS a sepse u novorozenců [4–6].
V současné době neexistuje konsensuální definice neonatální sepse. Nejčastěji je používána kombinace pozitivní hemokultury (prokázaná sepse) a systémové zánětlivé odpovědi (klinická sespse) – viz tabulka 1 [7].
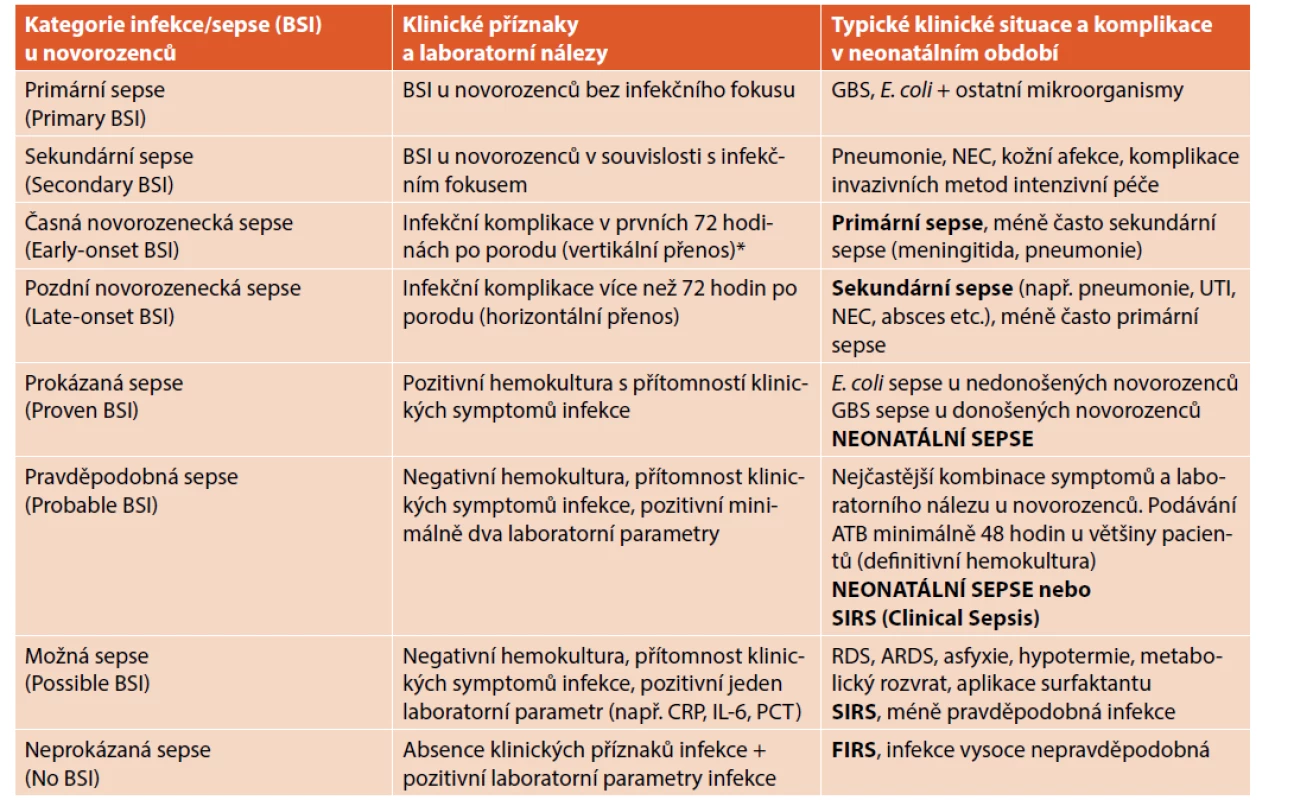
Vysvětlivky: ARDS – acute respiratory distress syndrome (syndrom dechové tísně u donošených a/nebo mírně nedonošených novorozenců),
BSI – bloodstream infection (pozitivní hemokultura), GBS – streptokoky skupiny B, RDS – syndrom dechové tísně, NEC – nekrotizující enterokolitida,
UTI – infekce močových cest
Poznámka: Významu laboratorních parametrů je věnována práce: Biomarkery v diagnostice neonatální sepse.
Nejobtížnějším obdobím pro diagnostiku sepse je prvních 24–48 hodin po narození, kdy můžeme identifikovat řadu infekčních a neinfekčních příčin, které mají uniformní laboratorní a klinický obraz. Multifaktoriální příčiny klinických a laboratorních změn (*) jsou zobrazeny ve schématu 1.
Hvězdička (*) vyjadřuje období diagnostiky časné novorozenecké sepse a potencionálně multifaktoriální charakter diagnostikovaných
změn.

Systémová zánětlivá odpověď plodu
(Fetal Inflammatory Response Syndrome, FIRS)
Systémová zánětlivá odpověď plodu (FIRS) vzniká v průběhu intrauterinního vývoje plodu zejména jako následek infekčního inzultu (tzv. mikrobiální invaze do amniální dutiny). Existují však i neinfekční příčiny FIRS (viz graf 1). FIRS je definován jako zvýšená hodnota interleukinu 6 v krvi plodu (IL-6 >11 pg/ml) a/nebo přítomností histologické chorioamnionitidy a funisitidy. Postnatální diagnostika FIRS může být provedena stanovením koncentrace IL-6 v pupečníkové krvi odebrané po porodu plodu nebo histopatologickým vyšetřením placenty, pupečníku a plodových obalů. Histopatologickým obrazem FIRS je nález zánětu pupečníku a/nebo perivaskulární infiltrace na choriové plotně. FIRS je asociován se signifikantně zvýšeným rizikem časné novorozenecké sepse a závažnými neonatálními komplikacemi (syndrom dechové tísně, pneumonie, intraventrikulární krvácení, periventrikulární leukomalacie, nekrotizující enterokolitida, bronchopulmonální dysplazie).
Vysoce rizikovým faktorem vzniku FIRS je předčasný odtok plodové vody před termínem (Preterm Premature Rupture of Membrane, PPROM). Přítomnost a délka PPROM je důležitým parametrem v managementu EOS [8, 9].
Klasifikace neonatální sepse
Novorozeneckou sepsi rozdělujeme podle období manifestace sepse, prokázaného a/nebo neprokázaného vyvolavatele sepse (tzn. pozitivní nález mikroorganismů v primárně sterilních tělních tekutinách) a změn klinických a laboratorních parametrů.
Podle období manifestace rozdělujeme neonatální sepsi na časnou a pozdní. Časná novorozenecká sepse (Early-Onset Sepsis, EOS) je nejčastěji definována rozvojem klinických příznaků sepse v prvních 72 hodinách po porodu. Přenos mikroorganismů, které způsobují EOS je ve většině případů vertikální (tzn. z matky na dítě v průběhu těhotenství a/nebo porodu). V některých případech mohou EOS způsobovat i mikroorganismy získané během porodu, ale s klinickou manifestací až do 7. dne života (typicky GBS sepse) [7].
Diagnostika a adekvátní terapie EOS však zůstává nadále jednou z nejzávažnějších a nejobtížnějších oblastí neonatální intenzivní péče.
Pozdní novorozenecká sepse (Late-Onset Sepsis, LOS) je infekční komplikace, která vzniká po 72 hodinách života horizontálním přenosem mikroorganismů z prostředí nebo od kontaktů.
S ohledem na senzitivitu vyšetření hemokultury (viz dále) je nejčastěji u novorozenců diagnostikována pravděpodobná sepse (ve světové literatuře se používá termín „clinical sepsis“). Kategorie neonatální sepse včetně typických příkladů jsou uvedeny v tabulce 1. Možná a neprokázaná sepse jsou velmi časté (zvláště u nedonošených novorozenců) a jsou také nejčastějším důvodem neodůvodněné antibiotické terapie.
Vyšetření hemokultury – problematika stanovení bakteriémie
(bloodstream infection, BSI)
Pozitivní hemokultura je u novorozenců (na rozdíl od dětí a dospělých) diagnostickým předpokladem sepse. Výhodou hemokultury je její vysoká specificita, nevýhodou relativně velmi nízká senzitivita (40–88 %) a dlouhá doba kultivace [10, 11]. Nízká senzitivita koreluje s množstvím odebrané krve a celkovou bakteriémií, která může být redukována předchozí ATB terapií (včetně potencionálního efektu intrapartálně podávaných ATB matce). Pro optimální výpovědní hodnotu hemokultury je u novorozenců doporučováno odebrat 1 ml krve k mikrobiologickému vyšetření [7]. Většinu patogenů je možné detekovat do 48 hodin od začátku kultivace. Při negativitě kultivace a laboratorních známek infekce je možné ukončení ATB terapie.
Racionální ATB terapie je jedním z klíčových aspektů terapie neonatální sepse. Incidence potvrzené časné sepse s pozitivní hemokulturou je relativně nízká (0,4–0,8/1000 živě narozených termínových novorozenců ve vyspělých zemích), ale 6–16x více dětí je podle několika studií publikovaných od roku 2012 léčeno ATB pro sepsi s negativním mikrobiologickým výsledkem [12, 13]. Důvody pro vysoký počet sepsí s negativní hemokulturou nejsou jasné (nejednotná diagnostická kritéria sepse, insuficientní odběr a zpracování vzorku krve, neinfekční etiologie SIRS, přítomnost atypických mikroorganismů – kvasinky, viry) [14, 15].
Nevýhody hemokultury by mohly být vyřešeny zavedením moderních molekulárních metod do klinické praxe: stanovení mikrobiální DNA pomocí metody polymerase chain reaction (PCR). Molekulární metody představují potencionálně rychlejší, senzitivnější a specifičtější cestu k identifikaci mikroorganismů. Recentní publikace prezentují validní výsledky (tzn. shodu s výsledkem hemokultury) při použití multiplex real-time PCR u LOS, které jsou k dispozici během 4 hodin [16]. Bohužel i tyto metody mají určitá úskalí (potencionální kontaminace – především koaguláza negativními Stafylokoky a nemožnost odlišení živých a mrtvých bakterií s vyšší hodnotou falešně pozitivních výsledků). V současné době jsou považovány pouze za doplňkové vyšetření v diagnóze novorozenecké sepse.
Syndrom systémové zánětlivé odpovědi
(Systemic Inflammatory Response Syndrome, SIRS)
V současné době je pozitivita hemokultury diagnostickým markerem novorozenecké sepse. Splnění této mikrobiologické podmínky je v kontrastu s funkční definicí sepse v pediatrii a dospělé medicíně, kde pozitivita kultivace není stěžejní pro stanovení diagnózy sepse [3, 17]. U dospělých byla sepse definována jako systémová zánětlivá odpověď hostitele (Systemic Inflammatory Response Syndrome, SIRS) v přítomnosti infekčního agens, přičemž SIRS je definován jako odpověď organismu na závažné inzulty infekční i neinfekční povahy. Ke splnění definice SIRS je nutná přítomnost minimálně dvou z definovaných kritérií týkajících se změn tělesné teploty, akce srdeční, dechové frekvence a změn v bílém krevním obraze [18]. Adaptovaná definice pro pediatrickou populaci vycházela z definice SIRS pro dospělé.
V roce 2002 byla v rámci International Pediatric Sepsis Consensus Conference formulována definice SIRS a sepse pro děti podle věkových skupin od novorozenců po adolescenty. Sepse byla definována jako závažný stav systémové zánětlivé odpovědi (SIRS) organismu v reakci na přítomnost infekce (podezřelé, prokázané) u novorozenců nad 37. gestační týden. Definice SIRS pro pediatrické pacienty se od původní definice pro dospělé liší v několika bodech a musí být přítomna minimálně 2 ze 4 uvedených kritérií, z nichž 1 musí být abnormální tělesná teplota nebo počet leukocytů. (Kritéria: 1. tělesná teplota >38,5 °C nebo <36 °C, 2. leukocytóza nebo leukopenie – dle věkové normy nebo >10 % nezralých neutrofilů, 3. tepová frekvence >2 SD normy pro daný věk a u dětí do 1 roku i bradykardie pod 10. percentil déle než 30 min při absenci externích stimulů nebo vlivem medikace, 4. dechová frekvence >2 SD normy pro daný věk nebo potřeba umělé plicní ventilace pro akutní respirační selhání nesouvisející s nervosvalovým onemocněním nebo celkovou anestezií) [19]. Hodnocené parametry SIRS definice pro pediatrickou populaci ale nemají dostatečnou výpovědní hodnotu u novorozenců. Retrospektivní analýza (Hofer et al., 2010) prokázala, že při splnění kritérií SIRS nebyly zachyceny 2/3 donošených a 1/3 nedonošených novorozenců s EOS a pozitivní hemokulturou. Následně ve studii z roku 2012, kdy byla hodnocena použitelnost kritérií SIRS a sepse u donošených a nedonošených novorozenců s diagnózou EOS a LOS, byly získány obdobné výsledky. Definice SIRS a sepse v této studii korelovala lépe s LOS, ale špatně s EOS (falešná negativita u 2/3 donošených a 1/4 nedonošených novorozenců) [20–22]. Výsledky studií logicky vedly k potřebě vytvoření nové definice SIRS a sepse u novorozenců.
V roce 2010 byla pediatrickým výborem Evropské agentury pro léčivé přípravky (European Medicines Agency, EMA) vytvořena kritéria sepse samostatně pro novorozence a děti po novorozeneckém období („Expert Meeting on Neonatal and Pediatric Sepsis Consensus 2010 Criteria“), která by měla umožnit zařadit novorozence do klinických studií týkajících se novorozenecké sepse podle jednotné definice. Pro splnění definice byla navrhována přítomnost minimálně 2 klinických příznaků (teplotní nestabilita, ventilační či kardiovaskulární nestabilita, kožní příznaky, gastrointestinální symptomy) a minimálně 2 laboratorních parametrů z definovaných (leukocytóza/leukopenie, I/T >0,2, trombocytopenie <100 x 109/l, CRP >15 mg/l nebo PCT >2 ng/ml, glukózová intolerance, metabolická acidóza) (viz tab. 2) [23]. Přesnost a spolehlivost EMA kritérií v případě diagnostiky novorozenecké sepse však nebyla podpořena validními daty.
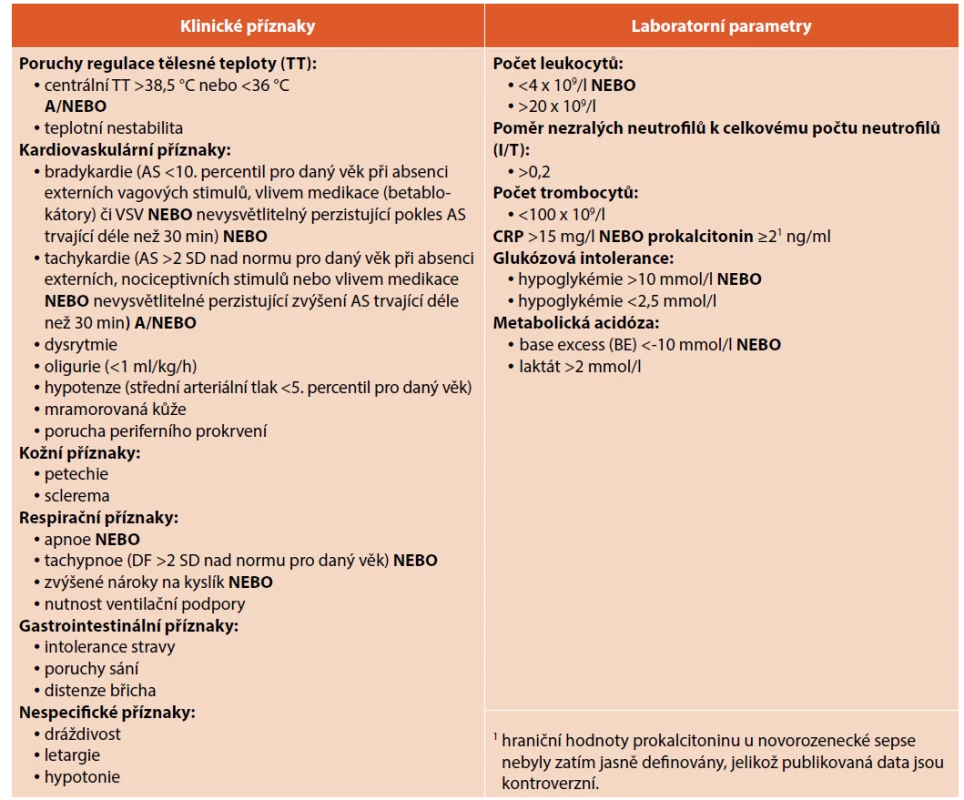
Prospektivní multicentrická studie publikovaná v roce 2019 (Tuzun et al.) zhodnotila diagnostickou významnost těchto EMA kritérií v případě prokázané novorozenecké sepse. Studie na souboru 245 novorozenců (>34. gestační týden) analyzovala významnost jednotlivých znaků. Senzitivita, specificita a přesnost EMA kritérií pro sepsi byly 44,2 % (95% CI: 34,9–53,9), 64,4 % (95% CI: 55,6–72,5) a 55,1 % (95% CI: 46,6–59,4). Výsledky této studie ukázaly, že EMA kritéria mají pouze limitovanou schopnost rozlišit infekční a neinfekční komplikace u novorozenců [24]. Výhodou EMA kritérií pro klinickou praxi je relativně jednoduchý výběr klinických a laboratorních parametrů a možnost jejich opakovaného stanovení v průběhu sledování novorozence.
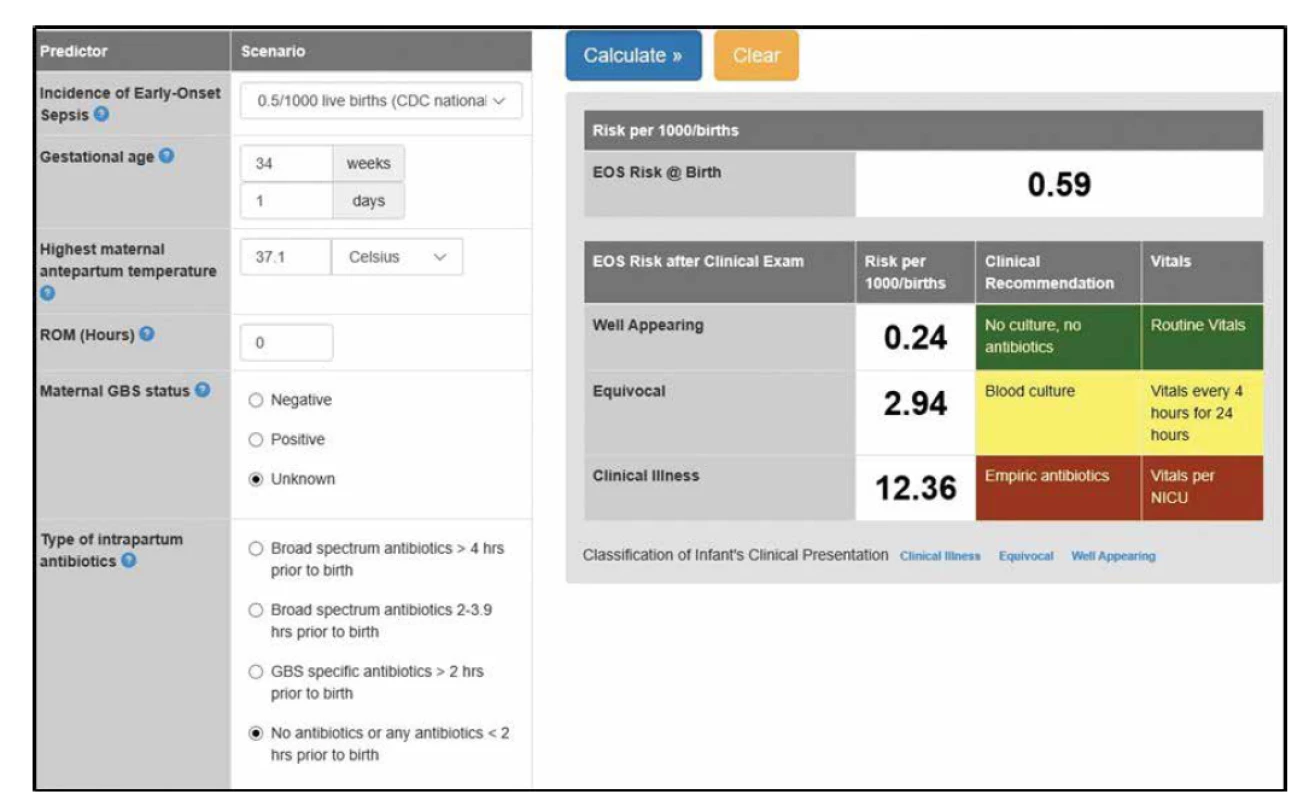
Perinatální rizikové faktory časné novorozenecké sepse – Early-Onset Sepsis Risk Calculator [25]
V případě diagnostiky a terapie EOS je nutné kromě hodnocení klinického stavu a laboratorních markerů posoudit perinatální rizikové faktory EOS, které jsou signifikantně asociované s vyšším rizikem EOS: předčasný odtok plodové vody, předčasný nástup děložní aktivity, horečka u rodičky v průběhu porodu, dlouhodobý odtok plodové vody u donošených novorozenců, výsledky kultivací u matky (pochva, cervix, moč, amniová tekutina) a patologický biofyzikální profil plodu (snížená pohybová aktivita plodu, patologický kardiotokografický nález). Důležitým parametrem je podávání antibiotik matce (zvl. dodržování postupů profylaxe GBS sepse). Zavedením intrapartální antibiotické profylaxe (zvl. u GBS pozitivních matek a/nebo matek s předčasným odtokem plodové vody) klesla incidence časné novorozenecké sepse, přesto je nutné správně detekovat novorozence s vysokým rizikem EOS a naplánovat další diagnosticko-terapeutický postup (terapie vs. monitoring a běžná péče).
Aktualizovaná doporučení AAP (American Academy of Pediatrics) z roku 2019 zohledňují diferencovaný postup podle gestačního stáří novorozenců (porod před a po 35. gestačním týdnu) a aktuální mikrobiologické a epidemiologické situace. Pro novorozence >35. týden těhotenství je navrhován stratifikovaný přístup podle kalkulovaného rizika EOS – The Neonatal Early-Onset Sepsis Risk Calculator (obr. 1). Kalkulátor umožňuje na základě jednoduše definovaných klinických, anamnestických a epidemiologických parametrů zhodnocení rizika EOS včetně doporučeného postupu (empirické podávání antibiotik, monitoring, odběr hemokultury) [17]. Cílem stratifikace je rozlišit, které děti jsou v nízkém riziku infekce a které (navzdory klinické nestabilitě v časném postnatálním období) by mohly být ušetřeny neindikované ATB terapie. Děti narozené předčasně císařským řezem z důvodu mateřské indikace (např. preeklampsie) nebo jiné neinfekční příčiny (např. placentární insuficience) při absenci děložní aktivity mají relativně nízké riziko EOS. U těchto dětí není standardně doporučeno okamžité zahájení empirické ATB terapie (pokud není na základě jiných známek podezření na infekci). Druhou skupinou jsou děti narozené předčasně a zařazené do tzv. rizikové skupiny na základě prenatálních a intrapartálních komplikací (viz tab. 3). Implementace EOS kalkulátoru do rutinní klinické praxe prokázala podstatnou redukci neindikované a/nebo sporně indikované ATB terapie bez změny v neonatální mortalitě a morbiditě [1, 16, 26, 27].
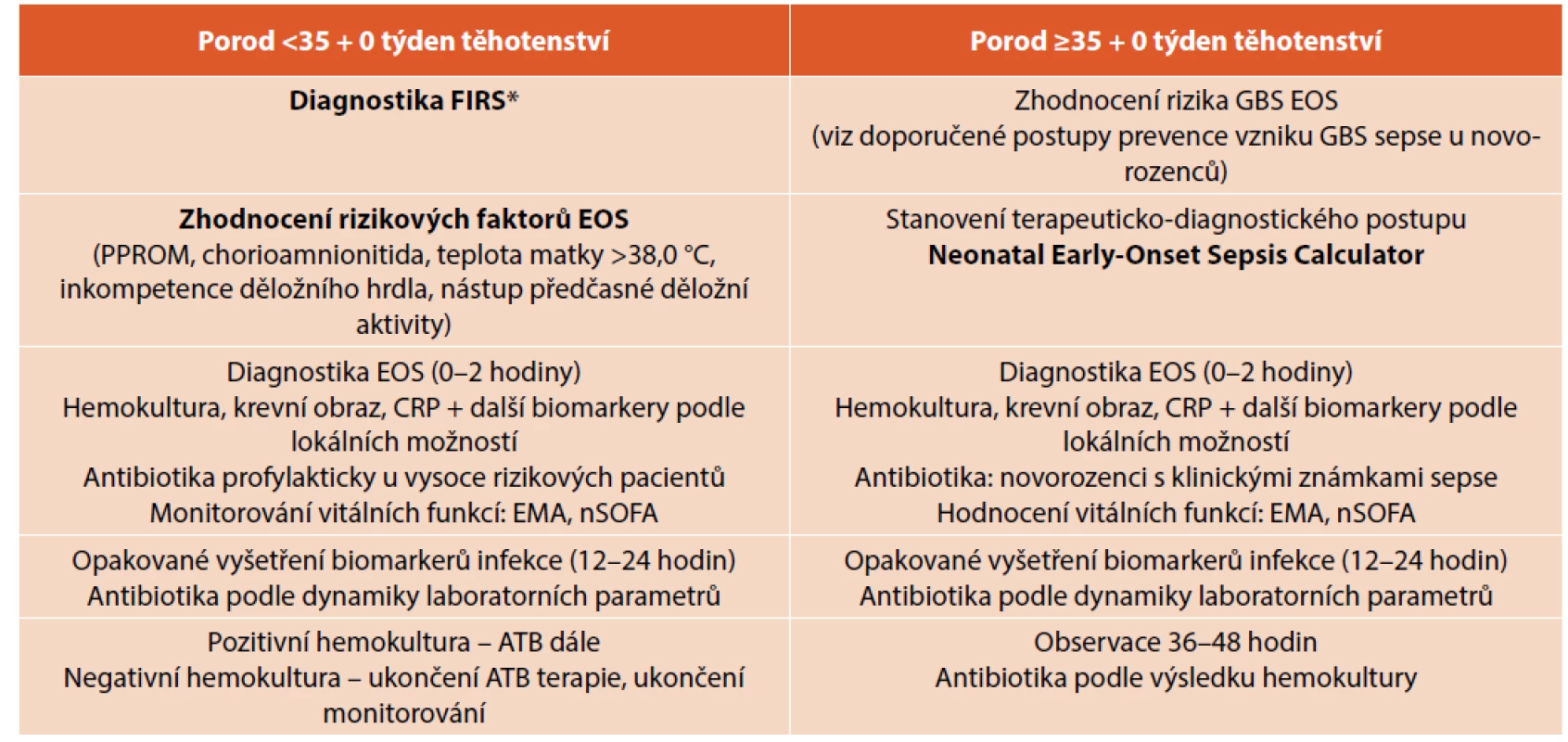
Skórovací systém orgánové dysfunkce – Neonatal Sequential Organ Failure Assessment
Současná aktualizovaná definice sepse pro dospělé (Sepsis-3) z roku 2016 klasifikuje sepsi jako „život ohrožující stav s orgánovou dysfunkcí způsobený dysregulovanou odpovědí hostitele na infekci“. K posouzení závažnosti orgánové dysfunkce se u dospělých používá skóre orgánového selhání (Sequential Organ Failure Assessment, SOFA) ke stanovení rizika mortality [Singer]. Přítomnost orgánové dysfunkce demonstruje komplexní povahu a závažnost sepse přesněji než jen označení „infekce s doprovodnou zánětlivou odpovědí“, protože SIRS může reflektovat i přiměřenou adaptivní odpověď organismu hostitele [28].
Existují snahy podobný přístup aplikovat i v neonatologii (Polin a Wynn) a stanovit tzv. neonatologická SOFA kritéria (nSOFA, tab. 4) k definici orgánové dysfunkce v této populaci, která by predikovala závažnost onemocnění a mortalitu u novorozenců se sepsí [28]. Cílem práce (Wynn et al.) nebylo primárně stanovení definice sepse, ale zhodnocení orgánové dysfunkce v predikci mortality se sekundárním efektem: vytvoření univerzální definice sepse. V retrospektivní studii autoři hodnotili orgánové selhání u novorozenců s letální LOS a zdravotní záznamy převedli do nSOFA skóre (6 hodnocených oblastí, skóre 0–3) k predikci mortality u předčasně narozených novorozenců. U dospělých zvýšení SOFA skóre o ≥2 body je asociováno s mortalitou vyšší než 10 %, AUC pro mortalitu je 0,76. V této studii byl prokázán podobný výsledek pro předčasně narozené novorozence. Výsledky potvrzují, že systém nSOFA by mohl být využitý podobně jako SOFA u dospělých a má potenciál sjednotit celosvětově data týkající se novorozenecké sepse z různých kohort pacientů. Samozřejmostí je však nutnost ověření nSOFA systému ještě u EOS a dalších skupin novorozenců [28, 29].
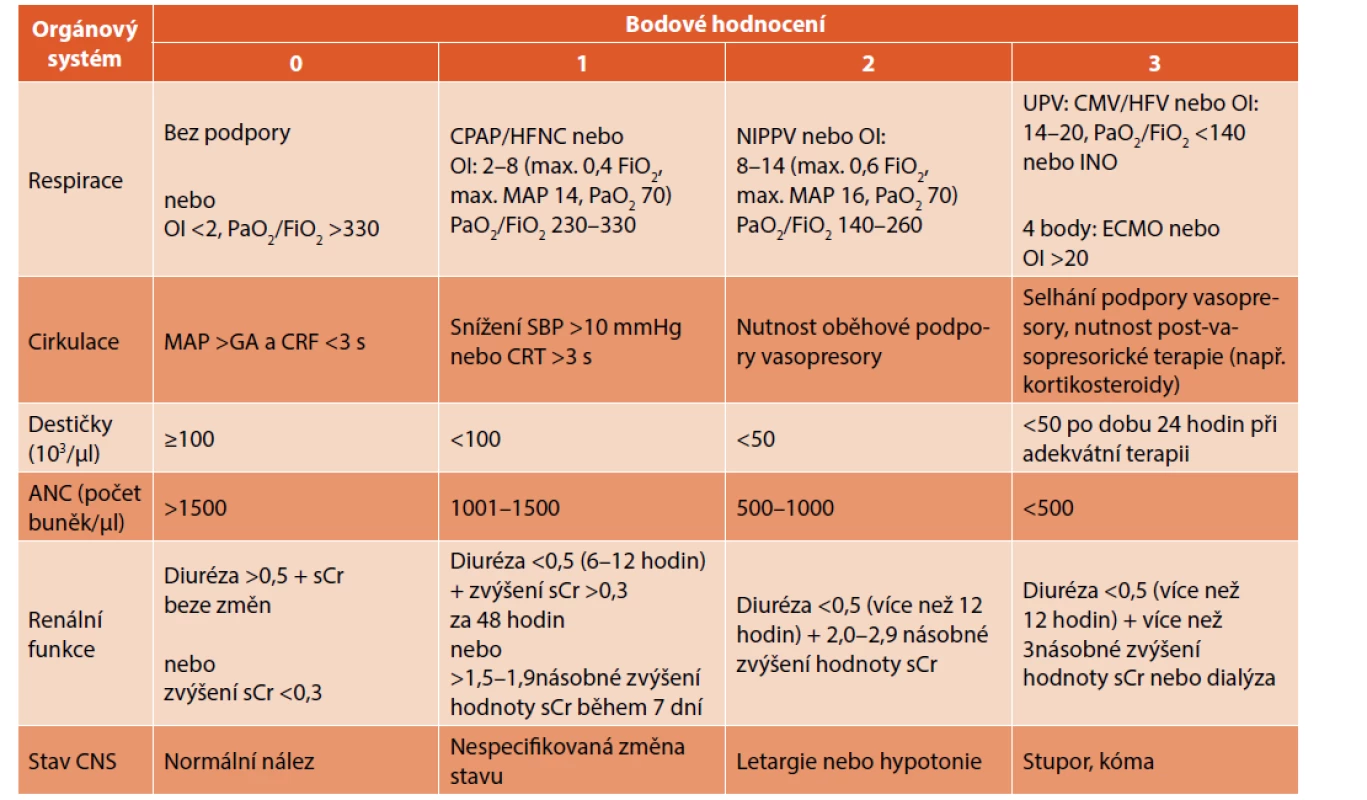
ECMO – extracorporeal membrane oxygenation (mimotělní membránová oxygenace), HFNC – high-flow nasal cannula (distenční terapie s použitím
vysokého průtoku plynu), HFV – high-frequency ventilation (vysokofrekvenční ventilace), INO – inhalace oxidu dusnatého, MAP (respirace) – mean
airway pressure (střední tlak v dýchacích cestách), MAP (cirkulace) – mean arterial pressure (střední arteriální tlak), NIPPV – nasal intermittent positive
pressure ventilation (neinvazivní umělá plicní ventilace s použitím nostril), OI – oxygenační index, SBP – systolic blood pressure (systolický tlak),
sCr – hodnoty kreatininu v séru (mg/dl).
Poznámka: Hodnoty diurézy jsou vyjádřeny v ml/kg/hodinu.
ZÁVĚR
Současná diagnostika novorozenecké sepse je založena na kombinaci klinických příznaků, laboratorních markerů a pozitivní hemokultury. V případě negativní hemokultury je nutná precizní klasifikace orgánové dysfunkce a posouzení infekční a/nebo neinfekční etiologie orgánové dysfunkce a SIRS. Negativní biomarkery neonatální sepse nevylučují infekci (viz publikace Z. Straňák: Biomarkery v diagnostice neonatální sepse).
Diagnostika časné novorozenecké sepse (EOS) je jednou z nejproblematičtějších situací v péči o novorozence. Posouzení perinatálních faktorů je důležité pro určení rizika EOS. Klinický nález a laboratorní změny je nutné posuzovat u EOS v čase, laboratorní vyšetření je nutné opakovat v prvních 24 hodinách s ohledem na biologické poločasy biomarkerů infekce. Vyšetření hemokultury je indikované u všech pacientů s rizikem EOS. U novorozenců nad 35. týden těhotenství je vhodné používat kalkulátor rizika EOS. U novorozenců s podezřením na pozdní novorozeneckou sepsi je vhodné používat skórovací systém orgánové dysfunkce nSOFA. Empirická antibiotická terapie je indikovaná u vysoce rizikových novorozenců a/nebo novorozenců s vysoce suspektními příznaky sepse. Antibiotickou terapie ukončujeme po 36–48 hodinách v případě negativní hemokultury, zlepšení klinického stavu a negativních biomarkerů infekce.
Práce byla podpořena výzkumným projektem NV 17-31403A.
Došlo: 10. 6. 2020
Přijato: 14. 9. 2020
Adresa pro korespondenci:
MUDr. Kristýna Boráková
Ústav pro péči o matku a dítě
Podolské nábřeží 157
147 00 Praha 4
e-mail: kristyna.borakova@upmd.eu
Sources
1. Puopolo KM, Benitz WE, Zaoutis TE. Management of neonates born at ≤34 6/7 weeks’ gestation with suspected or proven early-onset bacterial sepsis. Pediatrics 2018; 142 (6): e20182896.
2. Zach J. Sepse. In: Janota J, Straňák Z. Neonatologie. Praha: Mladá fronta, 2013 : 408–418.
3. Singer M, Deutschman CS, Seymour CW, et al. The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3) JAMA 2016; 315 (8): 801–810.
4. Camacho-Gonzalez A, Spearman PW, Stoll BJ. Neonatal infectious diseases: evaluation of neonatal sepsis. Pediatr Clin North Am 2013; 60 (2): 367–389.
5. van den Hoogen A, Gerards LJ, Verboon-Maciolek MA, et al. Long-term trends in the epidemiology of neonatal sepsis and antibiotic susceptibility of causative agents. Neonatology 2010; 97 : 22–28.
6. Puopolo KM, Eichenwald EC. No change in the incidence of ampicillin-resistant, neonatal, early-onset sepsis over 18 years. Pediatrics 2010; 125: e1031–e1038.
7. Shane AL, Sánchez PJ, Stoll BJ. Neonatal sepsis. Lancet 2017; 390 (10104): 1770–1780.
8. Ebenebe C, Hesse F, Blohm M, et al. Diagnostic accuracy of interleukin-6 for early-onset sepsis in preterm neonates. J Matern Fetal Neonatal Med 2019; 1–6.
9. Hofer N, Kothari R, Morris N, et al. The fetal inflammatory response syndrome is a risk factor for morbidity in preterm neonates. Am J Obstet Gynecol 2013; 209 : 542. e1–11.
10. INIS Collaborative Group, Brocklehurst P, Farrell B, et al. Treatment of neonatal sepsis with intravenous immune globulin. N Engl J Med 2011; 365 (13): 1201–1211 (reference k senzitivitě hemokultury – 40 %).
11. Kasper DC, Altiok I, Mechtler TP, et al. Molecular detection of late-onset neonatal sepsis in premature infants using small blood volumes: proof-of-concept. Neonatology 2013; 103 (4): 268–273 (reference k senzitivitě hemokultury – 88 %).
12. Fjalstad JW, Stensvold HJ, Bergseng H, et al. Early-onset sepsis and antibiotic exposure in term infants: A Nationwide Population-based Study in Norway. Pediatr Infect Dis J 2016; 35 (1): 1–6 (reference k podávání ATB).
13. Stocker M, van Herk W, El Helou S, et al. Procalcitonin-guided decision making for duration of antibiotic therapy in neonates with suspected early-onset sepsis: a multicentre, randomised controlled trial (NeoPIns). Lancet 2017; 390 (10097): 871–881 (reference k podávání ATB).
14. Weston EJ, Pondo T, Lewis MM, et al. The burden of invasive early-onset neonatal sepsis in the United States, 2005–2008. Pediatr Infect Dis J 2011; 30 : 937–941.
15. Borghesi A, Tzialla C, Decembrino L, et al. New possibilities of prevention of infection in the newborn. J Matern Fetal Neonatal Med 2011; 24 (Suppl 2): 28–30.
16. Klingenberg C, Kornelisse RF, Buonocore G, et al. Culture-negative early-onset neonatal sepsis – at the crossroad between efficient sepsis care and antimicrobial stewardship. Front Pediatr 2018; 6 : 285.
17. Puopolo KM, Benitz WE, Zaoutis TE. Management of neonates born at ≥35 0/7 weeks‘ gestation with suspected or proven early-onset bacterial sepsis. Pediatrics 2018; 142 (6). pii: e20182894.
18. Bone RC, Balk RA, Cerra FB, et al. Definitions for sepsis and organ failure and guidelines for the use of innovative therapies in sepsis. The ACCP/SCCM Consensus Conference Committee. American College of Chest Physicians/Society of Critical Care Medicine. Chest 1992; 101 (6): 1644–1655 (reference k SIRS).
19. Goldstein B, Giroir B, Randolph A. International pediatric sepsis consensus conference: definitions for sepsis and organ dysfunction in pediatrics. Pediatr Crit Care Med 2005; 6 (1): 2–8.
20. Wynn JL. Defining neonatal sepsis. Curr Opin Pediatr 2016; 28 (2): 135–40.
21. Hofer N, Müller W, Resch B. Systemic inflammatory response syndrome (SIRS) definition and correlation with early-onset bacterial infection of the newborn. Arch Dis Child Fetal Neonatal Ed 2010; 95 (2): F151–F151.
22. Hofer N, Müller W, Resch B. Definitions of SIRS and sepsis in correlation with early and late onset neonatal sepsis. J Pediatr Intensive Care 2012; 1(1): 17–23.
23. European Medicines Agency. Report on the Expert Meeting on Neonatal and Paediatric Sepsis. 2010; EMA London; https://www.ema.europa.eu/en/documents/report/report-expert-meeting-neonatal-paediatric-sepsis_en.pdf.
24. Tuzun F, Ozkan H, Cetinkaya M, et al. Is European Medicines Agency (EMA) sepsis criteria accurate for neonatal sepsis diagnosis or do we need new criteria? PLoS One 2019; 6; 14 (6): e0218002. doi: 10.1371/journal.pone.0218002.
25. Neonatal Early-Onset Sepsis Calculator, Kaiser Permanente Research: https://neonatalsepsiscalculator.kaiserpermanente.org.
26. Stoll BJ, Hansen NI, Bell EF, et al. Trends in care practices, morbidity, and mortality of extremely preterm neonates, 1993–2012. JAMA 2015; 314 (10): 1039–1051.
27. Simonsen KA, Anderson-Berry AL, Delair SF, et al. Early-Onset Neonatal Sepsis. Clin Microbiol Rev 2014; 27 (1): 21–47.
28. Wynn JL, Polin RA. Progress in the management of neonatal sepsis: the importance of a consensus definition. Pediatr Res 2018; 83 (1–1): 13–15. doi: 10.1038/pr.2017.224. Epub 2017 Oct 11.
29. Wynn JL, Polin RA. A neonatal sequential organ failure assessment score predicts mortality to late-onset sepsis in preterm very low birth weight infants. Pediatr Res 2019; doi: 10.1038/s41390-019-0517-2. Epub 2019 Aug 08.
Labels
Neonatology Paediatrics General practitioner for children and adolescentsArticle was published in
Czech-Slovak Pediatrics

2021 Issue 1
- What Effect Can Be Expected from Limosilactobacillus reuteri in Mucositis and Peri-Implantitis?
- The Importance of Limosilactobacillus reuteri in Administration to Diabetics with Gingivitis
-
All articles in this issue
- Česko-slovenská pediatrie v roce 2021
-
Syndrom multisystémové zánětlivé odpovědi asociovaný s COVID-19 u dětí
Doporučený postup České pediatrické společnosti ČLS JEP - Our experience with pediatric inflammatory multisystem syndrome associated with COVID-19 (PIMS-TS)
- Acute myocarditis in adolescents
- Předčasně narozené dítě
- The secular trend of the physical growth and development of boys and girls aged 6 to 14 years over the past 120 years in the Czech lands
- Child with VACTERL association – management, diagnostics and treatment of oropharyngeal dysphagia
- Current diagnostic criteria of neonatal sepsis and systemic inflammatory response in the fetus and the newborn
- DĚDIČNÉ NÁDOROVÉ SYNDROMY V DĚTSKÉ ONKOLOGII
- Biomarkers in the diagnosis of neonatal sepsis
- Ophthalmoscopy in acute pediatric care
- Prof. MUDr. Jan Janda, CSc., osmdesátiletý
- Doc. MUDr. Jozef Hoza, CSc. – 80 let
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Child with VACTERL association – management, diagnostics and treatment of oropharyngeal dysphagia
- Current diagnostic criteria of neonatal sepsis and systemic inflammatory response in the fetus and the newborn
- Acute myocarditis in adolescents
- Our experience with pediatric inflammatory multisystem syndrome associated with COVID-19 (PIMS-TS)
