Hantavírusová hemoragická horúčka s renálnym syndrómom – prvé prípady u detí na Slovensku
Hantavirus hemorrhagic fever with renal syndrome – first pediatric cases in Slovakia
Infections caused by hantaviruses are rare in child patients, although their incidence has increased worldwide in last few years. In Europe is the most common representative the Puumala virus which causes nefropathia epidemica, milder form of hemorrhagic fever with renal syndrome. The disease initially manifests itself mainly by fever, cephalea, backpain or abdominal pain. Gradually acute renal injury develops due to acute tubulointerstitial nephritis. There is no specific therapy yet, the basis is still symptomatic treatment. Most patients are fully cured, some may experience residually decreased glomerular filtration or secondary hypertension. We present three cases of children with acute renal failure caused by confirmed hantavirus infection.
Keywords:
hantavirus – nefropathia epidemica – acute renal injury – acute tubulointersticial nephritis – Hemorrhagic fever with renal syndrome
Authors:
B. Thomková; M. Chocholová; Ľ. Kováčiková; Ľ. Podracká
Authors‘ workplace:
Detská klinika Lekárska fakulta UK a Národný ústav detských chorôb, Bratislava, Slovenská republika
Published in:
Čes-slov Pediat 2021; 76 (2): 113-118.
Category:
Case Report
Overview
Infekcie spôsobené hantavírusom sa v pediatrickej populácii vyskytujú zriedkavo, ale celosvetovo ich incidencia v ostatných rokoch narastá. V Európe je najčastejším vyvolávateľom Puumala vírus spôsobujúci ľahšiu formu hemoragickej horúčky s renálnym syndrómom, známu ako nefropatia epidemica. V úvode ochorenia dominujú febrility, cefalea, lumbalgie či bolesti brucha. Postupne dochádza k rozvoju akútneho poškodenia obličiek na podklade akútnej tubulointersticiálnej nefritídy. Špecifická liečba zatiaľ neexistuje, základom je symptomatická terapia. Väčšina pacientov sa plne vylieči, u niektorých možno sledovať reziduálne zníženú glomerulovú filtráciu, prípadne rozvoj sekundárnej hypertenzie. V príspevku uvádzame zaujímavé kazuistiky troch detí s akútnym zlyhaním obličiek vyvolaným hantavírusovou infekciou.
Klíčová slova:
hantavírus – nefropatia epidemica – akútne renálne poškodenie – akútna tubulointersticiálna nefritída – hemoragická horúčka s renálnym syndrómom
ÚVOD
Hantavírusy sú RNA vírusy z čeľade Bunyaviridae. Hlavným prenášačom infekcie sú hlodavce, ktoré vylučujú vírus močom, stolicou aj slinami. Vstupnou bránou infekcie sú dýchacie cesty. Inkubačná doba ochorenia je zvyčajne 10 až 25 dní. Nákazou sú ohrození predovšetkým farmári, lesníci a ľudia pracujúci v zvieracích útulkoch či stajniach. Prípady prenosu hantavírusu z človeka na človeka nie sú známe [1]. Incidencia hantavírusových infekcií má v ostatných rokoch stúpajúci charakter [2], u detí sa však stále považujú za veľmi zriedkavé. Z geografického hľadiska je najvyššia prevalencia ochorenia v ázijských krajinách a v Číne. V Európe sa ročne vyskytuje 9000 prípadov hantavírusovej hemoragickej horúčky s renálnym syndrómom. Najväčšími endemickými oblasťami sú európska časť Ruska, Fínsko a Švédsko [3].
Rod hantavírusov sa skladá z dvoch hlavných skupín, a to tzv. hantavírusov starého a nového sveta. Hantavírusy starého sveta sú kauzálnym patogénom hemoragickej horúčky s renálnym syndrómom (HFRS). Patria sem Amur vírus, Seoul vírus, Hantaan vírus, Dobrava vírus, Tula vírus a v Európe najčastejšie sa vyskytujúci Puumala vírus (PUUV). Ten je hlavným etiologickým agensom vzniku nefropatie epidemica (NE), ľahšej formy HFRS. Na Slovensku je priemerná prevalencia ochorenia 0,84 %, ale líši sa medzi jednotlivými regiónmi [4]. Najčastejšie je zastúpený Puumala a Dobrava vírus [4]. Hantavírusy tzv. nového sveta spôsobujú hantavírusový pľúcny syndróm (HPS).
V článku uvádzame tri vzácne kazuistiky detí s hantavírusovou infekciou spojenou s akútnym poškodením obličiek. Ide o prvé prípady dokumentovanej hantavírusovej infekcie u detí na Slovensku.
KAZUISTIKA 1
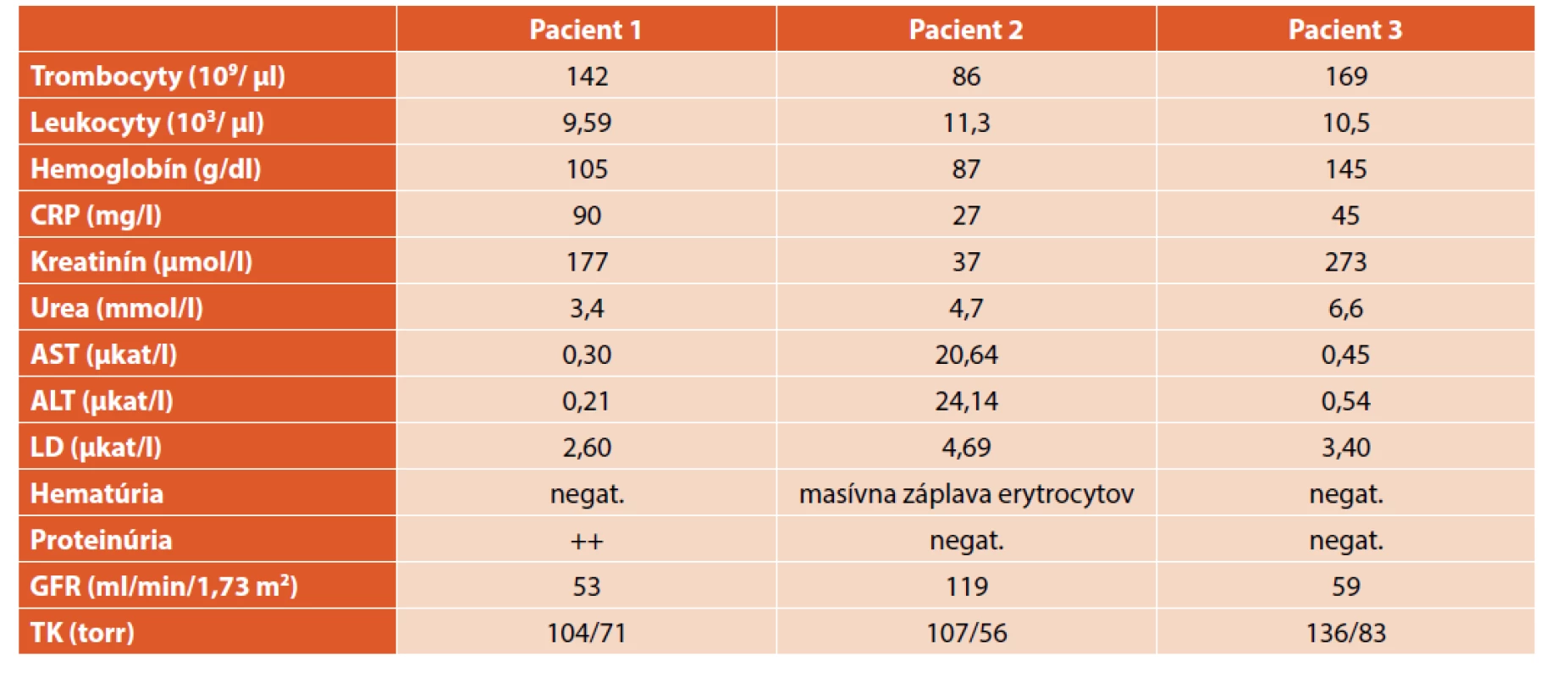
V prvej kazuistike prezentujeme 14-ročné dievča s anamnézou prekonaných dvoch infekcií močových ciest. Očkovaná je podľa očkovacieho kalendára, epidemiologická anamnéza je negatívna. Je študentka základnej školy, býva s rodičmi v rodinnom dome, nemajú žiadne domáce zvieratá, ale často sa chodí hrávať s bratom do stodoly. Pacientka prichádza na vyšetrenie pre vysoké niekoľko týždňov trvajúce febrility, cefaleu a vertigo. Pri prijatí je v objektívnom náleze akútna rinofaryngitída a známky ľahkej dehydratácie. Krvný tlak pod 90. percentilom vzhľadom na pohlavie, vek a výšku, koža bez patologických eflorescencií. V laboratórnom obraze dominuje vysoká zápalová aktivita (FW 135/nemerateľné hodnoty, IL6 55 pg/ml, CRP 90 mg/l), v krvnom obraze normocytová normochrómna anémia s Hbg 79 g/dl, trombocyty sú v úvode v norme, ale počas hospitalizácie sa postupne rozvíja trombocytopénia (415..142×109/l krvi), hodnoty IgG 13,1 g/l, IgM 3,12 g/l. RTG hrudníka a paranazálnych dutín je negatívne, ORL nález nevysvetľuje príčinu febrilného stavu, USG brucha je bez priekaznej patológie. Empiricky sa začala liečba cefalosporínmi III. generácie (cefotaxim). Pre cefaleu a horný meningeálny syndróm bola indikovaná lumbálna punkcia s negatívnym likvorovým nálezom. EEG záznam bol bez patologických grafoelementov, na MRI mozgu sa znázornil hypoplastický sinus transversus a sigmoideus, MRI angiografia mozgových ciev vylúčila vaskulitídu či trombózu. Ani opakovanými kultivačnými a sérologickými vyšetreniami sa neidentifikoval etiologický agens, hemokultúry boli sterilné.
Pre nezlepšujúci sa klinický stav sa pristúpilo k extenzívnej diferenciálnej diagnostike. Imunofenotypizácia periférnej krvi nepreukázala patologické bunky, panel autoprotilátok bol negatívny, systém komplementu bez aktivácie. Stolica na kalprotektín aj okultné krvácanie negatívna. Teploty pretrvávali napriek kombinácii antibiotík. Na celotelovom PET/CT sa zobrazili obojstranne zväčšené obličky s nešpecifickými prejavmi nefritídy a pacientka bola preložená na dodiferencovanie stavu na našu kliniku. V laboratórnom obraze dominovali známky non-oligurického akútneho poškodenia obličiek. Diuréza 2 l/deň, nevýrazná proteinúria do 0,35 g/l sprevádzaná vzostupom sérového kreatinínu do maxima 177 µmol/l a poklesom eGFR na 53 ml/min/1,73 m2 (tab. 1). V močovom sedimente boli prítomné leukocyty, kultivácia sterilná. Histomorfologické vyšetrenie renálneho tkaniva svedčilo pre akútnu tubulointersticiálnu nefritídu s difúznym zápalovým infiltrátom lymfocytov, plazmocytov a polymorfonukleárnych leukocytov (obr. 1). Glomeruly nevykazovali patomorfologické zmeny, bazálne membrány mali normálnu hrúbku a štruktúru, pedicely podocytov zachované, bez zjavných elektrón-denzných depozitov.
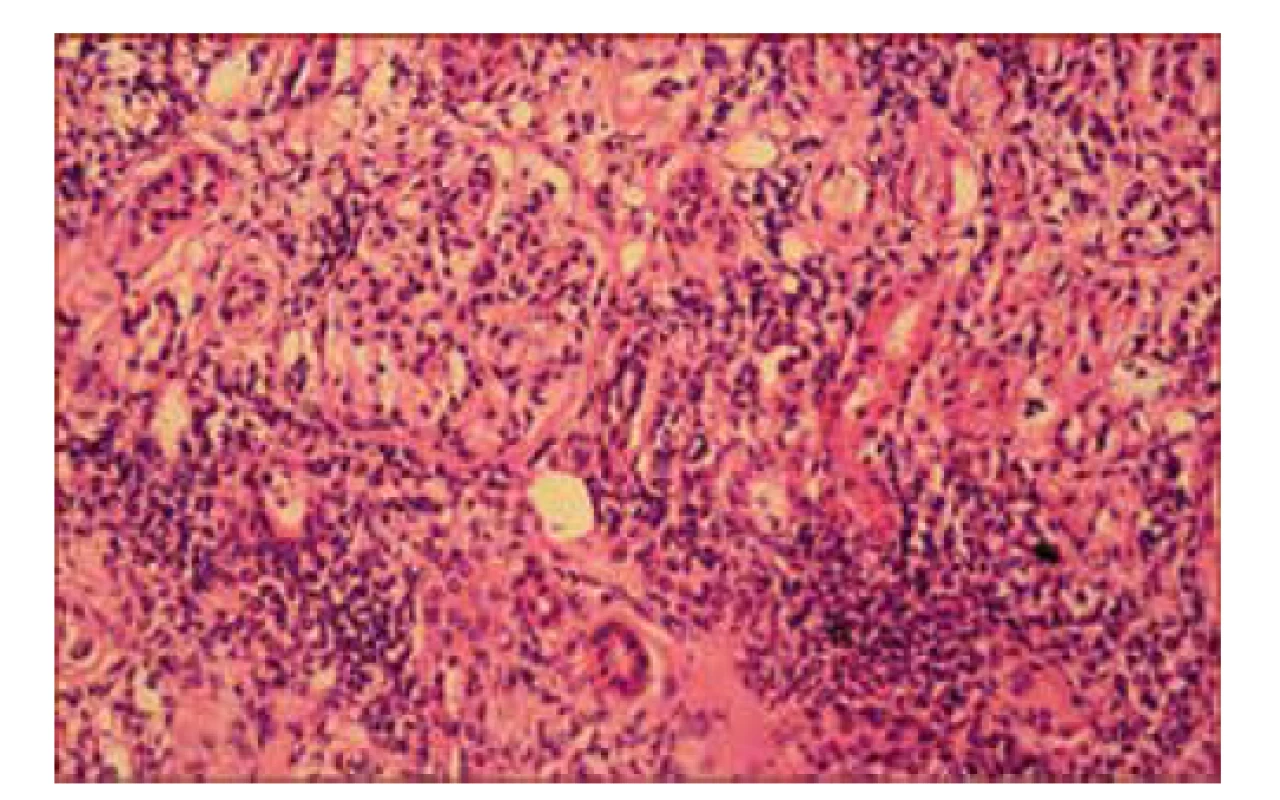
Pacientke sme nasadili kortikosteroidy, ktoré viedli k poklesu zápalovej aktivity, zlepšeniu celkového klinického stavu aj úprave GFR. Sérologickým vyšetrením sa dokázali pozitívne špecifické IgM protilátky proti hantavírusu, IgG protilátky boli negatívne. Dva mesiace po nasadení kortikoidov sa pridružila svetloplachosť, rezanie a začervenanie očí. Oftalmologické vyšetrenie predného segmentu potvrdilo suponovanú akútnu uveitídu, preto sa pridali lokálne kortikoidy. Na základe výskytu akútnej tubulointersticiálnej nefritídy asociovanej s uveitídou sme stav prehodnotili ako TINU syndróm (tubulointersticiálna nefritída a uveitída) indukovaný hantavírusovou infekciou. Ide o extrémne vzácnu koincidenciu Puumala infekcie s TINU syndrómom
KAZUISTIKA 2
V druhej kazuistike predstavujeme 7,5-ročného chlapca s juvenilnou idiopatickou artritídou na chronickej liečbe metotrexátom. Dieťa je riadne očkované, výskyt infekčného ochorenia v okolí rodičia negujú. Bývajú v rodinnom dome, majú dvoch psov. Pri cielených otázkach matka udáva, že v škole prebehla plošná deratizácia kvôli premnoženým myšiam. Chlapec prichádza na hospitalizáciu pre pretrvávajúce bolesti brucha lokalizované do oblasti epigastria, febrility do 39,5 °C, vracanie a malátnosť. Pri vstupnom vyšetrení bol nápadný periorbitálny edém, oligúria a makroskopická hematúria. Sonograficky boli parenchymatózne orgány brušnej dutiny aj retroperitonea bez zjavnej patológie. V laboratórnom obraze dominovala nonimunitná hemolytická anémia (Hbg 87 g/dl, trombocyty 86×109/l, LDH 18,5 µkat/l, Coombsove testy negat.), nízka zápalová aktivita (CRP 27,2 mg/l) a elevácia aminotransferáz (AST 1,54 µkat/l, ALT 4,54 µkat/l, GMT v norme). Estimovaná glomerulová filtrácia bola 119 ml/min/1,73 m2, C3 zložka komplementu 0,74 g/l, C4 0,13 g/l (tab. 1). Stav sme hodnotili ako sekundárnu trombotickú mikroangiopatiu indukovanú bližšie neidentifikovanou infekciou. Na infúznej rehydratačnej liečbe sa pozvoľne obnovila diuréza, poklesli aminotransferázy a laktátdehydrogenáza, upravil sa močový nález. Prekvapením bol sérologický dôkaz špecifických protilátok IgM aj IgG pre hantavírus. Šesť mesiacov po prekonaní infekcie je pacient bez subjektívnych ťažkostí a hypertenzie, upravili sa laboratórne parametre, moč je negatívny, kontrolné sérologické vyšetrenie sa nerobilo.
KAZUISTIKA 3
V tretej kazuistike opisujeme prípad 16-ročného chlapca po kompletnej anatomickej korekcii pre D-transpozíciu veľkých ciev. Chlapec bol inak zdravý, riadne očkovaný, s negatívnou epidemiologickou anamnézou. Bývajú v byte, nemajú doma žiadne zvieratá, ale matka udáva, že v škole pozorovali hlodavce. Pediater ho odoslal na hospitalizáciu pre bolesti hlavy, lumbalgie a nauzeu s opakovaným vracaním. Pri prijatí na detské oddelenie bol afebrilný, udával palpačnú citlivosť v ľavom mezogastriu s pásovitým šírením. Dyzurické ťažkosti neudával, diuréza bola primeraná, stolica redšej konzistencie. Vo vstupných laboratórnych parametroch mal CRP 29 mg/l, FW 6/14 resp. 45/65, v krvnom obraze leukocyty 10,9×109/l, Hbg 153 g/l, HTK 0,438 %, trombocyty 198×109/l, vnútorné prostredie v norme. Pre zvýšený kreatinín (232 resp. 273 µmol/l) a známky akútneho renálneho zlyhania bol pacient preložený na našu kliniku. Diuréza bola výdatná (3,5 l/24 hodín), močový nález chudobný, sediment bez hematúrie a zmnožených elementov, mikroalbuminúria 79 mg/deň. Krvný tlak pod 95. percentilom vzhľadom na pohlavie, vek a výšku. Glomerulová filtrácia meraná klírensom endogénneho kreatinínu zodpovedala 59 ml/min/1,73 m2, tubulárna resorpcia 95 % (tab. 1). Na rehydratačnej a nefroprotektívnej liečbe došlo k poklesu sérového kreatinínu z maxima 273 na 108 µmol/l, preto sme renálnu biopsiu neindikovali a stav uzavreli ako non-oligurické akútne renálne zlyhanie na podklade tubulointersticiálnej nefritídy. Sérologické vyšetrenie potvrdilo pozitívne špecifické IgM protilátky proti hantavírusom, IgG protilátky mali hraničnú hodnotu. Rok po prekonaní HFRS je pacient bez klinických ťažkostí, má primeraný krvný tlak a normálne renálne parametre.
DISKUSIA
V článku opisujeme tri vzácne kazuistiky pediatrických pacientov s rozvojom akútneho renálneho zlyhania na podklade hantavírusovej infekcie. Ide o prvé tri dokumentované prípady detí s HFRS na Slovensku, z nich u dvoch išlo o raritné klinické prejavy ochorenia. Hoci ide o malý súbor, je zrejmé, že endemická nefropatia nemá uniformný klinický obraz. V jednom prípade hantavírusová infekcia indukovala sekundárnu trombotickú mikroangiopatiu, u druhého dieťaťa bola asociovaná s TINU syndrómom. Slovensko a Česko patria ku krajinám so sporadickým výskytom hantavírusovej infekcie. Prvé správy o troch diagnostikovaných prípadoch ochorenia u detí v Čechách publikovali Dušek a spol. už v roku 2006. U všetkých troch detí mala Puumala nefropatia mierny priebeh a podobne ako u našich chorých sa klinicky manifestovala akútnym renálnym zlyhaním s obrazom intersticiálnej nefritídy [5].
Hantavírusy sú endotelotrofické vírusy, pre väčšinu buniek ľudského tela nie sú cytopatické [6]. Replikujú sa v makrofágoch a endotelových bunkách, do hostiteľských buniek vstupujú cez povrchové integríny [7]. V patogenéze hantavírusovej nefropatie sa kľúčová úloha prisudzuje poškodeniu vaskulárneho endotelu so zvýšením permeability cievnej steny mediovanej najmä bradykinínom [8]. Účasť v imunitnej patogenéze sa pripisuje aj aktivácii systému komplementu klasickou aj alternatívnou cestou, pričom stupeň komplementovej aktivácie odráža závažnosť klinickej prezentácie [1, 6]. Zložky C3 a C5 komplementu interferujú viacerými molekulovými mechanizmami s kaskádou koagulácie a fibrinolýzy, čo vysvetľuje hematologické abnormality a vaskulárne poškodenie pri hantavírusovej infekcii. Podporuje to raritný prípad nášho pacienta z druhej kazuistiky, ktorý mal rozvinutý laboratórny obraz neimunitnej trombotickej mikroangiopatie s makroskopickou hematúriou a renálnym poškodením. Indikácia renálnej biopsie pri hantavírusovej nefropatii je otázna a zvažuje sa individuálne.
Charakteristickým histologickým nálezom je difúzna infiltrácia interstícia a peritubulárneho okolia imunokompetentnými bunkami, rôzny stupeň tubulárnej nekrózy a intersticiálne krvácanie. Korešponduje s tým morfologický obraz akútnej tubulointersticiálnej nefritídy s bohatým zastúpením polymorfonukleárov, lymfocytov a plazmatických buniek u našej pacientky, ktorá mala prolongovanú renálnu dysfunkciu sprevádzanú výraznou systémovou zápalovou reakciou a uveitídou. Hoci infekcia môže byť potenciálny rizikový faktor podporujúci vznik TINU syndrómu, len v ojedinelých prípadoch sa dokázal špecifický infekčný agens asociovaný s TINU syndrómom ako EBV infekcia, TBC či reaktivácia varicella zoster infekcie [9]. Z tohto pohľadu je naša pacientka vôbec prvý opísaný prípad TINU syndrómu u dieťaťa s potvrdenou hantavírusovou infekciou.
Hantavírusová infekcia v drvivej väčšine postihuje dospelých, iba 10 % zo všetkých prípadov tvoria deti. Klinický obraz plne rozvinutého HFRS prebieha v 5 fázach (obr. 2), u niektorých jedincov však môže prebehnúť asymptomaticky či atypicky. Asociácia závažných klinických prípadov s určitými HLA alelami poukazuje na úlohu hostiteľskej imunitnej odpovede pri intenzite rozvoja ochorenia [10]. Deti majú zvyčajne ľahší priebeh, čo môže zvádzať k mylnému či neskorému stanoveniu diagnózy.
![Päť fáz plne rozvinutej hemoragickej horúčky s renálnym syndrómom.
Pri nefropatia epidemica, spôsobenej Puumala vírusom, sú fázy
menej zjavné, niektoré sa ani neprejavia [6].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image_pdf/7e7f962f2c1d46e7e5478e4493484547.png)
Nefropatia epidemica spôsobená najčastejším európskym sérotypom Puumala začína náhle vysokými febrilitami, bolesťami hlavy, brucha a chrbta, niekedy môže byť prítomná nauzea či vracanie. Tieto (ne)špecifické symptómy sú najčastejšou klinickou manifestáciou hantavírusovej infekcie u detí, čo názorne ilustrujú aj kazuistiky troch našich pacientov.
Viac ako polovica pacientov s Puumala infekciou má v úvode tranzientnú trombocytopéniu, petechiálny enantém, spojivkové krvácanie či petechiálny rash v oblasti hrudníka. Trombocytopéniu bez petechiálneho krvácanie sme pozorovali u dvoch našich pacientov. U dievčaťa s TINU syndrómom sprevádzal febrilný výstup diskrétny exantém bez hemoragickej zložky. Je zaujímavé, že ani jedno dieťa z českého súboru nemalo trombocytopéniu [5]. Obličky sú častým cieľovým orgánom. Typickým močovým nálezom je proteinúria a až u 85 % chorých mikroskopická hematúria. Stupeň proteinúrie a vysoká koncentrácia NGAL-u v moči predpovedá závažnosť akútneho poškodenia obličiek [11]. Až dva z troch dospelých pacientov v akútnom štádiu vyžadujú dialýzu, u detí je potreba dialýzy zriedkavá. Dokumentuje to nemecká retrospektívna kohorta 22 detí s HFRS, z ktorej ani v jednom prípade nebola indikovaná hemodialýza [12]. Aj v súbore našich a českých detí bolo akútne poškodenie obličiek mierneho stupňa, diuréza zachovaná a renálne funkcie sa po adekvátnej liečbe upravili.
Hantavírusovú infekciu potvrdí sérologické vyšetrenie pomocou ELISA s detekciou vysokých titrov špecifických IgM protilátok, čo sme použili aj u všetkých našich pacientov. Limitáciou vyšetrenia v našom laboratóriu je, že sa identifikuje len hantavírus, bez určenia sérotypov. Exaktnou metódou na identifikáciu vírusu je PCR vyšetrenie priamo z bioptického materiálu. V diferenciálnej diagnostike treba vylúčiť iné infekcie spojené s akútnym poškodením obličiek, ako je leptospiróza, z neinfekčných príčin treba myslieť na liekové poškodenie, hemolyticko-uremický syndróm či masívnu infiltráciu interstícia pri myeloproliferatívnych a lymfoproliferatívnych ochoreniach.
Neexistuje špecifická antivírusová liečba proti hantavírusom. Niektorí autori uvádzajú zníženú mortalitu pri liečbe ribavirinom [7]. Základným pilierom v akútnej fáze je symptomatická terapia pozostávajúca z včasnej rehydratačnej a protišokovej liečby, v nutných prípadoch je indikovaná hemodialýza. Pri analgetickej liečbe cefaley a lumbalgii sa treba vyvarovať použitiu nesteroidných antiflogistík. Kortikosteroidy nie sú rutinne indikované, môžu sa zvážiť pri histologicky potvrdenej intersticiálnej nefritíde. Dušek a spol. indikovali kortikoidy všetkým trom pacientom v čase, keď nebola ešte známa etiológia intersticiálnej nefritídy. Kortikoterapia bola efektívna rovnako ako u našej pacientky a viedla k rýchlej úprave renálnych funkcií.
Vo svete už existujú aj vakcíny proti niektorým sérotypom ako Hantaan River vírusu či Seoul, a mnohé ďalšie vakcíny sú predmetom prebiehajúcich klinických štúdii. Klinická fáza rekonvalescencie z hantavírusovej infekcie môže trvať aj niekoľko týždňov, väčšina pacientov po prekonanom ochorení nemá trvalé následky. Potvrdzuje to fínska kohorta 36 dospelých s Puumala hantavírusom indukovanou akútnou intersticiálnou nefritídou [13].
ZÁVER
Hantavírusy sa vyskytujú vo všetkých geografických oblastiach sveta, aj keď na území Slovenska sú sporadické. V Európe sa najčastejšie stretávame s Puumala vírusom, ktorý nevedie k plne rozvinutému obrazu HFRS a častejšie sa spája s miernejším priebehom ochorenia – ako sme pozorovali aj u našich pacientov. Hoci nemožno poprieť dôležitosť epidemiologickej anamnézy, negatívna anamnéza infekciu hantavírusom nevylučuje. Náš súbor demonštruje, že napriek zriedkavému výskytu hantavírusových infekcií v detskom veku, treba pri akútnom renálnom poškodení a prolongovanej horúčke neznámeho pôvodu myslieť aj na HFRS.
Došlo 20. 5. 2020
Přijato 11. 8. 2020
Korespondující autor:
Prof. MUDr. Ľudmila Podracká, CSc.
Detská klinika LFUK a NÚDCH
Limbová 1
833 40 Bratislava
Slovenská republika
e-mail: podracka12@yahoo.com
Sources
1. Muranyi W, Bahr U, Zeier M, et al. Hantavirus infection. J Amer Soc Nephrol 2005; 16 (12): 3669–3679. doi: https://doi.org/10.1681/ASN.2005050561.
2. Vaheri A, Henttonen H, Voutilainen L, et al. Hantavirus infections in Europe and their impact on public health [online]. Rev Med Virol 2013; 23 : 35–49. Dostupné online: https://doi.org/10.1002/rmv.1722.
3. Avšic-Županc T, Sakdisa A, Korva M. Hantavirus infections. Clin Microbiol Infect 2019; 21: e6-e16.
4. Sibold C, Meisel H, Lundkvist Å, et al. Short report: simultaneous occurrence of Dobrava, Puumala, and Tula hantaviruses in Slovakia. Am J Trop Med Hyg 1999; 61 : 409–411.
5. Dušek J, Pejcoch M, Kolsky A, et al. Mild course of Puumala nephropathy in children in an area with sporadic occurerence Hantavirus infection. Pediat Nephrol 2007; 21 (12): 1889–1992.
6. Ferluga D, Vizjak A. Hantavirus nephropathy. J Am Soc Nephrol 2008; 19 : 1653–1658.
7. Prasad N, Novak JE, Patel MR. Kidney diseases associated with parvovirus B19. Adv Chronic Kidney Dis. 2019; 26 (3): 207–219.
8. Taylor SL, Wahl-Jensen V, Copeland AM, et al. Endothelial cell permeability during hantavirus infection involves factor xii-dependent increased activation of the Kallikrein-Kinin System. PLoS Pathol 2013; 9 (7): e1003470. doi: https://doi.org/10.1371/journal.ppat.1003470.
9. Okafor OL, Hewins P, Murray PI, et al. Tubulointerstitial nephritis and uveitis (TINU) syndrome: a systematic review of its epidemiology, demographic and risk factors. Orphanet J rare Dis 2017; 12 : 128.
10. Mustonen J, Partanen J, Kanerva M, et al. Genetic susceptibility to severe course of nephropathia epidemica caused by Puumala hantavirus. Kidney Int 1996; 49 : 217.
11. Mustonen J. Renal involvement in hantavirus infections. 2018. Dostupné online: https://www.uptodate.com/contents/renal-involvement-in-hantavirus-infections?source=history_mobile
12. Echterdiek F, Kitterer D, Alscher DM, et al. Clinical course of hantavirus-induced nephropathia epidemica in children compared to adults in Germany – analysis of 317 patients [online].
Pediatric Nephrology, 14 March 2019. Dostupné online: https://www.ncbi.nlm.nih.gov/pubmed/30874941.
13. Miettinen MH, Mäkela SM, et al. Ten-year prognosis of Puumala hantavirus-induced acute interstitial nephritis. Kidney Int 2006; 69 : 2043–2048.
Labels
Neonatology Paediatrics General practitioner for children and adolescentsArticle was published in
Czech-Slovak Pediatrics

2021 Issue 2
- What Effect Can Be Expected from Limosilactobacillus reuteri in Mucositis and Peri-Implantitis?
- The Importance of Limosilactobacillus reuteri in Administration to Diabetics with Gingivitis
-
All articles in this issue
- Dorostové lékařství
- Látkové a nelátkové závislosti v adolescencii
- Intoxikácie v adolescencii za rok 2019 konzultované s Národným toxikologickým informačným centrom
- Je čas rozísť sa s pediatrom – prestup pediatrických pacientov do starostlivosti všeobecného lekára pre dospelých
- Dôležitosť dlhodobého sledovania pacientov s nefropatiou
- Vývoj antropometrických parametrů moravských dětí v předškolním věku
- Postižení štítné žlázy po alogenní transplantaci kmenových buněk krvetvorby v dětském věku a v adolescenci, zkušenosti z 30 let sledování
- Předčasně narozené dítě
- Pleomorfní adenom v dětském věku
- Hantavírusová hemoragická horúčka s renálnym syndrómom – prvé prípady u detí na Slovensku
- Dysthymie jako méně známá forma deprese: klinický obraz a léčba
- Nadváha jako následek covidové izolace Lázně Luhačovice kombinují léčbu s redukčním režimem
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Dysthymie jako méně známá forma deprese: klinický obraz a léčba
- Látkové a nelátkové závislosti v adolescencii
- Hantavírusová hemoragická horúčka s renálnym syndrómom – prvé prípady u detí na Slovensku
- Dorostové lékařství
