Mentální anorexie z pohledu endokrinologa
Anorexia nervosa from an endocrinologist's point of view
Anorexia nervosa is a complex psychiatric-metabolic-endocrine disease that has the highest mortality rate among psychiatric diseases. Almost all organs and systems are altered by this disease. Changes in the endocrine system mostly represent the body‘s adaptation to starvation, and after regaining the necessary weight and fat mass, they are spontaneously adjusted. However, it does not apply to all changes. There is a disorder of the hypothalamic-pituitary axis with manifestations of hypogonadotropic hypogonadism, hypercortisolemia, resistance to growth hormone, thyroid dysfunction, hyponatremia and hypooxytocinemia. The production of antidiuretic hormone can also be altered, and a bone metabolism disorder can be diagnosed relatively early and often persists even after recovering from anorexia nervosa. Recently, changes in the intestinal microbiome, lipid metabolism, cytokine production disorders with the development of autoimmunity, and immune function disorders have also been described.
Keywords:
anorexia nervosa, osteoporosis, hypothalamic dysfunction, euthyroid sick syndrome, food intake regulation
Authors:
Novotná Dana 1; Móriová Barbora 2
Authors‘ workplace:
Pediatrická klinika, Fakultní nemocnice Brno a Masarykova univerzita
1; Psychiatrická klinika, Fakultní nemocnice Brno a Masarykova univerzita
2
Published in:
Čes-slov Pediat 2023; 78 (S3): 11-16.
Category:
Comprehensive Report
doi:
https://doi.org/10.55095/CSPediatrie2023/060
Overview
Mentální anorexie je komplexní psychiatricko-metabolicko-endokrinní onemocnění, které má z psychiatrických onemocnění nejvyšší úmrtnost. Při mentální anorexii dochází k alteraci téměř všech orgánů a systémů. Změny endokrinního systému představují většinou adaptaci organismu na hladovění a po znovunabytí potřebné hmotnosti a tukové hmoty dochází k jejich spontánní úpravě. Ale neplatí to pro všechny změny. Dochází k poruše hypothalamo-hypofyzární osy s projevy hypogonadotropního hypogonadismu a hyperkortizolemie, k rezistenci k růstovému hormonu, poruše tyroidální funkce, hyponatremii a hypooxytocinemii. Může být narušena i produkce antidiuretického hormonu a poměrně brzy lze diagnostikovat poruchu kostního metabolismu, která často přetrvává i po vyléčení mentální anorexie. V poslední době byly popsány i změny ve střevním mikrobiomu, v lipidovém metabolismu, poruchy produkce cytokinů s rozvojem autoimunity a poruchy imunitních funkcí.
Klíčová slova:
mentální anorexie, osteoporóza, hypothalamická dysfunkce, euthyroid sick syndrom, regulace příjmu potravy
Úvod
Mentální anorexie (MA) je jednou z variant poruch příjmu potravy. Jde primárně o psychiatrické onemocnění, které vede k narušení regulace příjmu potravy vedoucímu k omezování energetického příjmu záměrnou restrikcí stravy a/nebo purgativnímu chování (zvracení, užívání laxativ). Současně je u pacientů výrazně narušen sebeobraz nabádající k dalšímu hubnutí. Schopnost regulovat příjem potravy a následný úbytek hmotnosti je spojován s příjemnými prožitky, dojmy silné vůle a kontroly. Naopak porušení této schopnosti a asketického chování s sebou nese pocit viny, selhání a sebenenávisti.(1)
Epidemiologie
Četnost poruch příjmu potravy je nejvyšší ve vyspělých zemích Evropy a Ameriky a nejčastěji se projeví u dívek v adolescentním věku. V posledních letech obecně narůstá četnost psychických onemocnění a mezi nimi i poruch příjmu potravy, což bývá také dáváno do souvislosti s epidemií covidu-19. Výskyt závažné deprese a suicidálního chování vzrostl mezi lety 2017 a 2020 v České republice na trojnásobek a prevalence úzkostné poruchy se v populaci téměř zdvojnásobila.(2)
Prevalence poruch příjmu potravy za posledních pět let vzrostla téměř o dvě třetiny, v nejvyšší míře v adolescentní populaci, a jejich manifestace se posouvá do mladšího věku. Zajímavá je také souvislost epidemie covidu-19 a záchytu pacientek v závažnějším stavu a s vyšší četností rehospitalizace než v období před epidemií (obr. 1).(3) Celosvětově se prevalence poruch příjmu potravy mezi lety 2000 a 2018 zvýšila z 3,5 na 7,8 %.(4) Výrazný úbytek hmotnosti vede k poruše vnitřního prostředí a rozvoji závažných endokrinologických poruch. MA v důsledku závažných somatických komplikací, které mohou postihnout téměř každý orgán, vykazuje nejvyšší mortalitu ze všech psychiatrických onemocnění (10 %), pacienti umírají v průměru v 25 letech. Mortalita je dvojnásobná oproti ostatním psychiatrickým diagnózám a desetinásobně vyšší ve srovnání s obecnou populací. Nezanedbatelnou příčinou mortality je také suicidální jednání, které souvisí s četnými psychiatrickými komorbiditami. Riziko sebevražd je až 200násobně zvýšené.(5)
Endokrinní poruchy
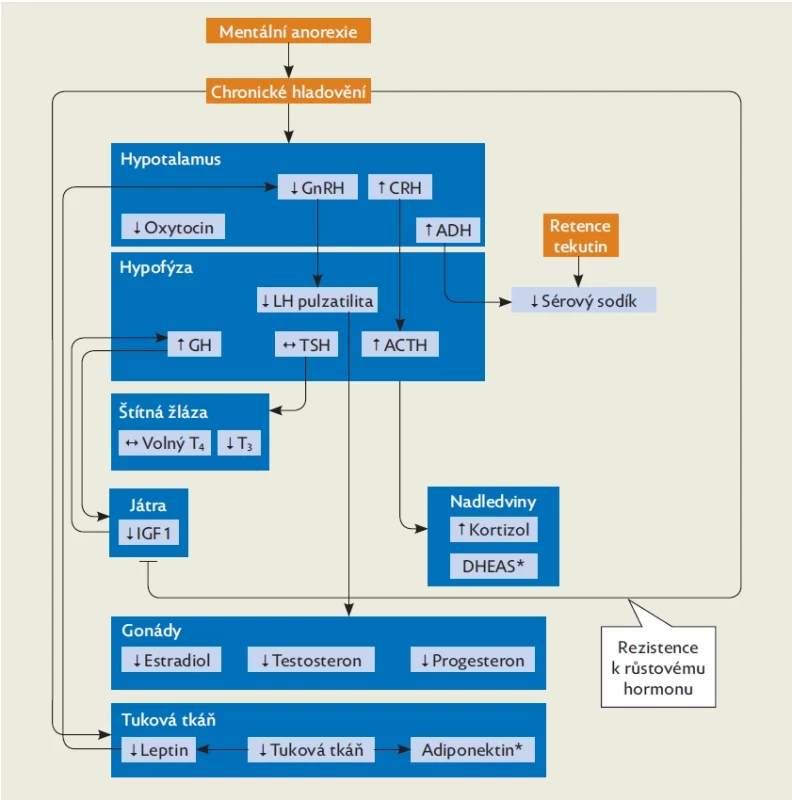
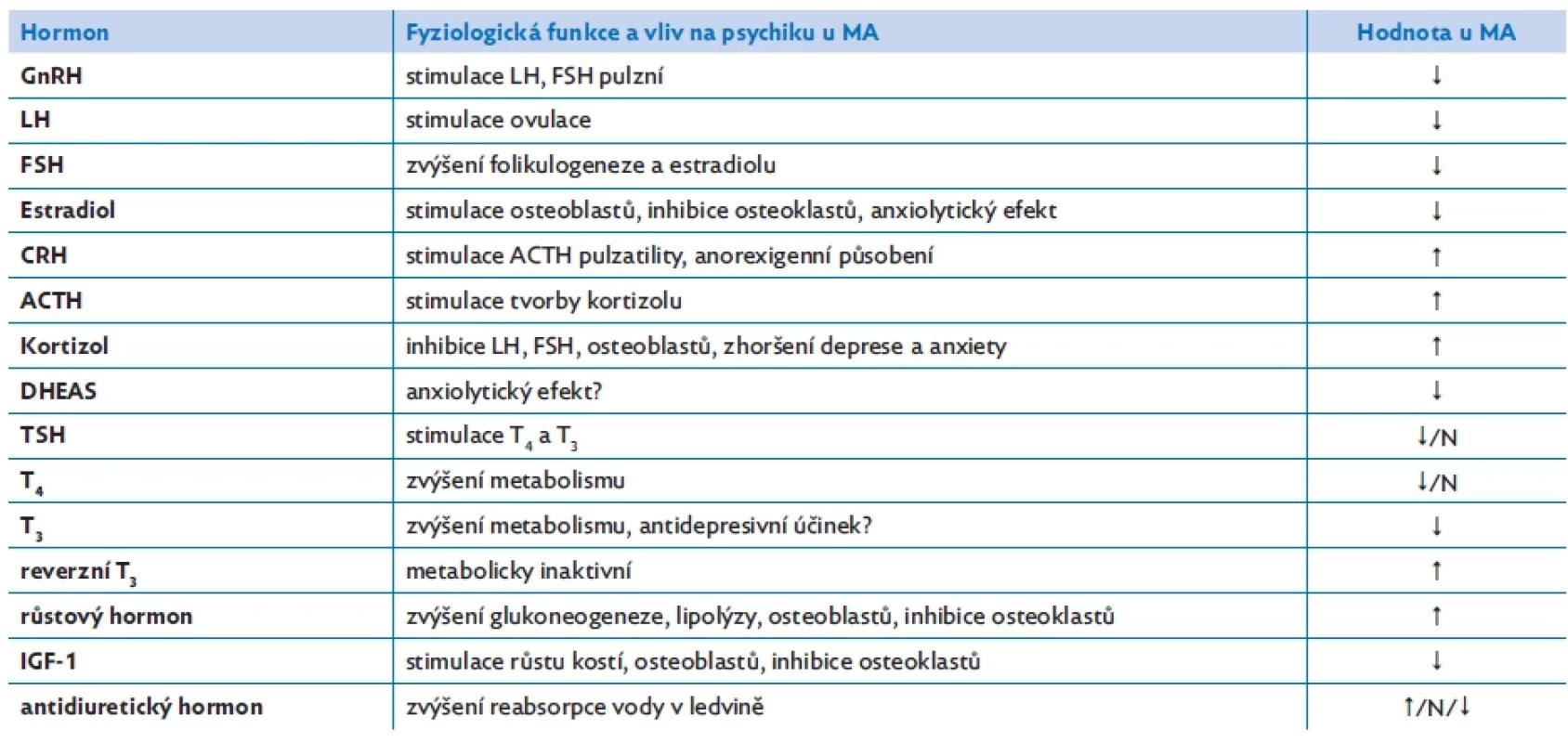
Endokrinní poruchy představují většinou adaptační procesy na hladovění. Většina těchto změn je reverzibilní s nárůstem hmotnosti, ale ne všechny změny se takto upraví. Asi u pětiny pacientek MA dlouhodobě přetrvává jako chronické onemocnění, a proto je důležité mít na mysli také důsledky těchto endokrinních poruch (obr. 2, tab. 2).(6) Při mentální anorexii je narušena většina fyziologických hormonálních regulací. Dochází k poruše hypothalamo-hypofyzární osy s projevy hypogonadotropního hypogonadismu (HH) a hyperkortizolemie, k rezistenci k růstovému hormonu, poruše tyroidální funkce, hyponatremii a hypooxytocinemii. Může být narušena i produkce antidiuretického hormonu. U rozvinuté MA bývá přítomna porucha neurohumorální regulace příjmu potravy. Mentální anorexie představuje také zvýšené riziko poruchy kostního metabolismu, dochází ke zmnožení tukové složky kostní dřeně a poruše integrity kostí.(1) Většina těchto hormonálních změn je reakcí těla na nedostatečný příjem energie, ale HH, nízká hladina oxytocinu, leptinu, fT3 a zvýšená hladina kortizolu a peptidu YY (PYY) přispívají u MA také k neurokognitivním změnám a další psychopatologii – depresi, anxietě.(7)
Osa hypothalamus–hypofýza–gonády
Rozvoj hypogonadotropního hypogonadismu je individuální, nelze asociovat přímo s určitou hodnotou body mass indexu (BMI) či velikostí nebo rychlostí hmotnostního úbytku ani délkou trvání anorexie. 66–84 % žen s MA má amenoreu, 6–11 % oligomenoreu. U 15 % žen, u kterých přetrvává psychopatologie navzdory hmotnostnímu přírůstku, může dokonce amenorea přetrvávat.(6,8,9) Dlouhodobě byla diskutována hmotnost, která by již byla dostatečná k obnovení menstruačního cyklu. Z četných studií na toto téma vyplývá, že pro dospělé ženy je to dosažení BMI 19 kg/m2, pro adolescentky dosažení hmotnosti mezi 15. a 20. percentilem Z skóre BMI.(10) Nízká hladina leptinu, která je projevem úbytku tukové hmoty, signalizuje nedostatečné energetické zásoby a tlumí reprodukční funkce. To vede ke snížení hladiny luteotropního hormonu a porušení jeho pulzatilní sekrece.(11) Je známo, že při kongenitálním deficitu leptinu je součástí klinických projevů centrální hypogonadismus.(12)
Nízká hladina leptinu u MA je příčinou snížené signalizace kisspeptinu, který je důležitým regulátorem hypothalamického gonadotropin-releasing hormonu a tím i reprodukčních funkcí. Zvýšený ghrelin a kortizol také mohou přispívat k funkčnímu HH, jehož důsledkem je nejen pokles estrogenů, ale také hypoandrogenemie (60 % testosteronu u žen je ovariálního původu a 40 % je syntetizováno v kůře nadledvin). Je prokázáno, že hladina androgenů u MA nepřímo koreluje s tíží depresí a anxiety. Dlouhodobý efekt podávání androgenů na zlepšení psychiatrických komorbidit však dosud prokázán nebyl.(4,12) Nejlepší léčbou HH je nárůst hmotnosti minimálně k hodnotě před ztrátou menzes. Přístup gynekologa musí být individuální a po dohodě s psychiatrem, pediatrem, endokrinologem (růst). U adolescentek s perzistující MA a ukončeným růstem, které současně mají historii fraktur nebo Z skóre BMD < −2 SD, nebo v případě, že po 6–12 měsících po úpravě hmotnosti přetrvává amenorea, je indikováno krátkodobé podávání transdermálních estrogenů v nízké dávce (17-β-estradiol 50–100 µg denně) s cyklicky podávaným šetrným gestagenem.(5,6,12) U premenarchálních dívek je volbou miniestrogenizace.(12) Hladiny antimülleriánského hormonu, který je ukazatelem ovariální rezervy, se u MA neliší od zdravé populace.(13)
Osa hypothalamus–hypofýza–nadledviny
Pacienti s MA mívají hyperkortizolemii se zvýšenou hladinou kortikotropin releasing hormonu (CRH) a adrenokortikotropního hormonu (ACTH), která negativně koreluje s BMI a množstvím tuku. Hladiny kortizolu zřídka přesahují dvojnásobek horní hranice normy. Na zvýšení hladiny kortizolu se kromě jeho vyšší produkce podílí i snížená renální clearance.(14) Bývá zvýšena i noční hladina kortizolu v séru, odpověď kortizolu na stimulaci cosyntropinem, je nedostatečná suprese hladiny kortizolu po podání 1 mg dexamethasonu. Nejedná se však o patologii nadledvin, nýbrž o reakci organismu na hladovění a stres. Klinické projevy hyperkortizolismu při současném nedostatečném příjmu energie a živin jsou patrné jen diskrétně. Například při nárůstu hmotnosti v remisi MA bývá výraznější ukládání tuku v abdominální oblasti.(8) Je zvažována také role vysoké hladiny CRH a ACTH v patofyziologii MA, protože vysoká hladina CRH má silně anorexigenní působení.(11) Kortizol je do vyšetřovacího schématu MA zařazen k vyloučení insuficience nadledvin, která se také může projevit nechutenstvím a úbytkem hmotnosti.
Rezistence k růstovému hormonu
Již od roku 1963 je známo, že hladovění stimuluje sekreci růstového hormonu. U MA bývá jeho bazální hladina až 20× vyšší než v běžné populaci. Mohla by se na tom podílet také vyšší hladina ghrelinu (sekretagogum pro růstový hormon). Vysoká hladina růstového hormonu může u MA sloužit zvýšením glukoneogeneze a lipolýzy k udržení normoglykemie.(15) Po podání glukózy nedochází u MA k supresi hladiny růstového hormonu, jak je u zdravých osob obvyklé. Hladina inzulinu podobného růstového faktoru (IGF-1), jehož produkce je stimulována růstovým hormonem, je však překvapivě nízká, v průměru dosahuje asi 50 % populační normy. Jde pravděpodobně o snahu strádajícího organismu snížit energetický výdej pomocí navození rezistence jaterních receptorů k působení růstového hormonu.(16) Podstatou rezistence k růstovému hormonu může být zvýšená hladina fibroblastového růstového faktoru FGF-21, který je tvořen v játrech, adipocytech a myocytech v důsledku nedostatečného příjmu bílkovin. FGF-21 následně zvyšuje příjem bílkovin cestou zpětnovazebného ovlivnění hypothalamických jader. FGF-21 se tedy jako neurotransmiter podílí na regulaci příjmu bílkovin, které jsou nezbytné pro růst, metabolické a imunitní funkce.(17) Současně FGF-21 antagonizuje intracelulární působení růstového hormonu včetně produkce IGF-1. Na rezistenci k růstovému hormonu se u MA také může podílet nízká hladina inzulinu, která v játrech snižuje expresi receptorů pro růstový hormon, nízká hladina leptinu a fT3.(16)
S úpravou hmotnosti se normalizuje i osa růstový hormon IGF-1.(6) U premenarchálních dívek vede MA k významné redukci růstové rychlosti. Rezistence je tak závažná, že ani podávání růstového hormonu v suprafyziologické dávce (5× vyšší, než je substituční dávka u deficitu růstového hormonu) nevede k vzestupu hladiny IGF-1. Léčba růstovým hormonem může vést k redukci tukové masy, což není pro pacientky s MA žádoucí.(9,16)

Tyreoidální osa
Při hladovění dochází ke snížení periferní konverze tyroxinu (T4) na účinný hormon trijodtyronin (T3) a místo T3 vniká neúčinný tzv. reverzní T3, což při nedostatečném příjmu energie vede ke snížení energetického výdeje. U nejtěžších případů MA klesá i hladina TSH a volného tyroxinu (fT4). Nejde vlastně o poruchu funkce štítné žlázy, ale jen o adaptaci organismu na hladovění s obrazem tzv. euthyroid sick syndromu (= reakce štítné žlázy na závažné non-tyroidální onemocnění), u kterého není indikována léčba tyroxinem. S nízkou koncentrací T3 souvisí i závažnost depresí. S restitucí hmotnosti se upravuje hladina TSH a fT4, hladina fT3 bývá nižší dlouhodobě.(6)
Pro ilustraci prezentujeme údaje vlastního souboru 106 adolescentních pacientů a pacientek ve věku 10–17 let hospitalizovaných na Psychiatrické klinice FN Brno v období 1/2019–7/2023 (tab. 1). Jedná se o základní hormonální vyšetření na začátku hospitalizační léčby. Snížená hladina trijodtyroninu byla zachycena u 43 %, z toho u více než poloviny pacientů byla provázena i sníženou hladinou fT4, v 85 % případů bez elevace hladiny TSH. Zvýšená hladina kortizolu byla pozorována u více než třetiny pacientů, hyperprolaktinemie u 42 %. Hladiny hormonů štítnice a kortizolu lze těžko porovnávat mezi jednotlivými soubory, protože vždy jde o individuální stupeň reakce na závažnost MA a stresové situace. Přítomnost zvýšeného kortizolu byla námi zachycena v menší míře, než je udáváno v literatuře (42 % versus 80 %).(18)
Četnost pacientů s nízkou hladinou fT4 byla srovnatelná, ale nízký fT3 jsme prokázaly méně často než Wronská,(19) která současně prokázala nepřímou úměru tíže deprese a hladiny fT3. Naprostá většina pacientek (88 %) v době vyšetření trpěla amenoreou, což je údaj srovnatelný s publikovanými daty.(9)

Zadní lalok hypofýzy
Zadní lalok hypofýzy produkuje antidiuretický hormon (ADH). U 20 % žen s MA bývá přítomna hyponatremie. Částečně je její příčinou zvýšený příjem bezsolutové vody, zvracení, používání laxativ a diuretik, jindy jde o syndrom inadekvátní sekrece antidiuretického hormonu. Jsou však publikovány i studie, kde je hladina ADH snížena s obrazem diabetes insipidus a hypernatremií. V zadním laloku hypofýzy je produkován také hormon oxytocin, který moduluje řadu psychologických procesů včetně sociálního chování, mírní úzkost a depresi, udržuje energetickou rovnováhu a kostní metabolismus. Ženy s MA mají hypooxytocinemii, která může být příčinou zvýšení anxiety a depresí. Nízká hladina oxytocinu také může tlumit pocit hladu.(7,18)
Peptidy regulující příjem stravy
U MA bychom vzhledem k energetickému deficitu očekávali zvýšení orexigenních a snížení anorexigenních působků, ale je to pravda jen částečně. Sice je snížený anorexigenní leptin, ale zvýšený také anorexigenní peptid YY produkovaný L buňkami střeva. U hladovějící MA by fyziologicky PYY měl mít také nízkou hladinu. Jeho zvýšená hladina tedy není adaptací na hladovění, ale spíše lze zvažovat jeho roli v patogenezi MA. Různé studie prokazují rozdílné hladiny tohoto peptidu, ale lze předpokládat, že jeho zvýšená hladina může vyvolávat pocit sytosti po požití minimálního množství stravy. V souladu s předpokladem bývá u MA zvýšená hladina ghrelinu, orexigenního peptidu produkovaného v žaludku, a současně sekretagoga růstového hormonu a ACTH, inhibitoru sekrece gonadotropinů. Hlavním účinkem acylované formy ghrelinu je stimulace orexigenních faktorů agouti-related proteinu a neuropeptidu Y. Hyperinzulinemie však u MA vykazuje na hladinu ghrelinu mnohem větší supresivní účinek. Nabízí se tedy otázka, zda toto nemůže u MA krátce po požití stravy navodit předčasný pocit sytosti.(14) Do budoucna je zvažována také možnost terapie analogy ghrelinu.(9) U MA je zvýšen také anorexigenní peptid obestatin, který vzniká odštěpením z acylované formy ghrelinu a tlumí příjem stravy a motilitu žaludku.(11) Pacientky s MA mívají nízkou hladinu inzulinu, což snižuje glukoneogenezi, lipolýzu a glykogenolýzu. Amylin je peptid produkovaný slinivkou, bývá u MA také snížen a spolu s nízkou hladinou inzulinu udržují euglykemii, ale přispívá také k poklesu minerální denzity kostí (BMD).(9,18)
Kost
Pokles BMD, porucha mikroarchitektury a geometrie kostí jsou závažné komplikace MA, které jsou detekovatelné časně po začátku onemocnění. Maximum postižení je v trabekulární kosti. Alarmující je významný nárůst zlomenin již krátce po diagnóze MA.(19) Pacientky s MA mají výraznější úbytek BMD než dívky s prostým hypothalamickým hypogonadismem, protože k nedostatku estrogenů se u MA přidává ještě nutriční karence a rezistence k růstovému hormonu, zvýšený kortizol, PYY a snížený testosteron, leptin a oxytocin.(11) 40 % dospělých pacientek má pokles BMD pod −2 SD, přičemž průměrný roční úbytek BMD u nich představuje 2,5 %.(14) Adolescence je však fyziologicky obdobím nárůstu BMD a zvýšeného kostního obratu. Proto některé dívky s MA manifestovanou v adolescentním věku nedosáhnou maximální BMD ani po úpravě hmotnosti a gonadální funkce. Rizikovým faktorem pro nízkou BMD je tedy adolescentní věk, delší trvání MA, HH, malá svalová hmota, příjem vápníku pod 600 mg/den, nízká hladina vitaminu D, vysoký kortizol, nízký estradiol a IGF-1. Neexistují guidelines pro screening úbytku BMD, ale dle Endocrine Society Clinical Guidelines pro funkční hypothalamickou amenoreu z roku 2017 je vhodné provést denzitometrii již po 6 měsících amenorey. Je zřejmé, že délka trvání amenorey je přímo úměrná úbytku BMD. Podle FDA není pro adolescentky s MA indikována terapie bisfosfonáty ani orálními kontraceptivy. Orální estrogeny mohou suprimovat hladinu IGF-1 a dále prohloubit ztrátu BMD.(20,21) Jedinou efektivní léčbou je léčba základního onemocnění, normalizace hmotnosti a menstruačního cyklu. Vzhledem k velmi krátké době, kdy je v adolescenci fyziologicky budována maximální kostní denzita, je u pacientek s perzistující MA a ukončeným růstem, které současně mají historii fraktur nebo Z skóre BMD < −2 SD, nebo v případě, že po 6–12 měsících po úpravě hmotnosti přetrvává amenorea, indikováno krátkodobé podávání transdermálních estrogenů v nízké dávce (17-β-estradiol 50–100 µg denně s cyklicky podávaným mikronizovaným progesteronem 100–200 mg denně 12 dní ve zvyšující se dávce).(6,7,16,21–24) U MA dochází také ke zmnožení tukové tkáně v kostní dřeni, jejíž množství negativně koreluje s BMD. Osteoblast a adipocyt pocházejí ze stejné kmenové buňky, proto zmnožení tukové tkáně v kostní dřeni může znamenat poruchu osteoblastogeneze.
Závěr
MA je závažné psychiatrické onemocnění s multisystémovým postižením organismu a globální endokrinní dysregulací. Většina endokrinologických změn je adaptací na nutriční deficit, po úpravě hmotnosti a získání potřebného množství tukové složky dochází k úpravě spontánně. Zcela jistě by měla být vyšší pozornost věnována kostní problematice, zejména u premenarchálních dívek, u kterých je fyziologicky vysoký kostní obrat s převahou osteoprodukce díky MA výrazně zpomalen. Je vhodné zařadit kostní denzitometrii do vyšetřovacích metod u MA. Pokud se onemocnění projeví v době předpokládaného růstového spurtu, vede MA často i ke zhoršení finální výšky. Dosud není vytvořen doporučený postup k řešení kostní problematiky MA, základem je stále psychiatrická, psychologická a nutriční intervence. Samotná substituce vápníku a vitaminu D není prevencí úbytku BMD, protože dívky s MA mají většinou příjem dostatečný. Bisfosfonáty jsou u premenarchálních dívek vzhledem k povaze kostního metabolismu zcela neúčinné, stejně jako perorální hormonální substituce, která může BMD a finální výšku dokonce zhoršovat. V individuálních případech by mohla být benefitem aplikace malých dávek transdermálních estrogenů, ev. dle pubertálního vývoje v kombinaci s malou dávkou progestinu. Optimální léčba a hledání rizikových faktorů a etiologie MA však zůstávají stále ještě otázkou dalšího výzkumu.
Korespondenční adresa:
MUDr. Dana Novotná, Ph.D.
Pediatrická klinika FN Brno a LF MU
Černopolní 9
613 00 Brno
novotna.dana@fnbrno.cz
Sources
1. Navrátilová M, Kalendová M. Poruchy příjmu potravy – mentální anorexie a bulimie, nejzávažnější somatické a metabolické komplikace. Způsoby realimentace. Shrnutí 30leté praxe z metabolického pohledu internisty. Čes-slov Pediat 2019; 74 (5): 290–300.
2. Kohoutek J, Kocourková J. Vliv koronavirové epidemie na vývoj a léčbu poruch příjmu potravy v dětském a adolescentním věku. Psychiatr praxi 2021; 22(2): 116–118.
3. Datta N, Van Wye E, Citron K, et al. The COVID-19 pandemic and youth with anorexia nervosa: A retrospective comparative cohort design. Int J Eat Disord 2023; 56(1): 263–268.
4. Galmiche M, Déchelotte P, Lambert G, Tavolacci MP. Prevalence of eating disorders over the 2000-2018 period: a systematic literature review. Am J Clin Nutr 2019; 109(5): 1402–1413.
5. https://www.lf1.cuni.cz/poruchy-prijmu-potravy-v-cechach
6. Haines MS. Endocrine complication of anorexia nervosa. J Eating Disord 2023. doi: 10.1186/s40337-023-00744-9
7. Lawson EA, Miller KK. Anorexia nervosa: endocrine complications and their management. In: Barbieri RL, Yager J, Martin KA (eds). UptoDate. 2023. Dostupné na: https://www.uptodate.com/contents/anorexia-nervosa-endocrine-complications-and-their-management?csi=cac4ca4f-eb4f-4800-8967-4cc0b69964e6&source=contentShare
8. Miller KK. Endocrine dysregulation in anorexia nervosa update. J Clin Endocrinol Metab 2011; 96(10): 2939–2949.
9. Støving RK. Mechanisms in endocrinology: Anorexia nervosa and endocrinology: a clinical update. Eur J Endocrinol 2019; 180(1): R9–R27.
10. Dempfle A, Herpertz-Dahlmann B, Timmesfeld N, et al. Predictors of resumption menses in adolescent anorexia nervosa. BMC Psychiatry 2013; 13 : 308.
11. Misra M, Klibanski A. Endocrine consequences of anorexia nervosa. Lancet Diabetes Endocrinol 2014; 2 : 581–592.
12. Poncová R, Skřenková J, Fanta M. Poruchy příjmu potravy v ambulanci gynekologa pro děti a dospívající. Ceska Gynekol 2021; 86(1): 46–53.
13. Miller KK, Wexler TL, Zha AM, et al. Androgen deficiency: association with increased anxiety and depression symptom severity in anorexia nervosa. J. Clin Psychiatry 2007; (68): 959–963.
14. Saldanha N, Fisher M. Menstrual disorders in adolescents and young adults with eating disorders. Curr Probl Pediatr Adolesc Health Care 2022; 52 : 101240.
15. Miller KK. Endocrine dysregulation in anorexia nervosa update. J Clin Endocrinol Metab 2011; 96(10): 2939–2949.
16. Miller KK. Endocrine effects of anorexia nervosa. Endocrinol Metab Clin North Am 2013; 42(3): 515–28.
17. Sjögren M. Endocrine disturbances in anorexia nervosa. In: Patel VB, Preedy VR (eds). Eating disorders. 1st ed. London: Springer 2023 : 569–584.
18. Larson KR, Chaffin AT, Goodson ML, et al. Fibroblast growth factor-21 controls dietary protein intake in male mice. Endocrinology 2019; 160(5): 1069–1080.
19. Schorr M, Miller KK. The endocrine manifestations of anorexia nervosa: mechanisms and management. Nat Rev Endocrinol 2017; 13(3): 174–186.
20. Wronski ML, Tam FI, Seidel M, et al. Associations between pituitary-thyroid hormones and depressive symptoms in individuals with anorexia nervosa before and after weight-recovery. Psychoneuroendocrinology 2022; 137 : 105630.
21. Bulik CM, Carroll IM, Mehler P. Reframing anorexia nervosa as a metabo-psychiatric disorder. Trends Endocrinol Metabolism 2021. doi: 10.1016/j.tem.2021.07.010
22. Tichá Ľ, Payer J, Killinger Z, Podracká Ľ. Porucha kostného metabolizmu pri mentálnej anorexii. Čes-slov Pediat 2016; 71(5–6): 287–292.
23. Thavaraputta S, Fazeli PK. Estrogen for the treatment of low bone mineral density in anorexia nervosa. J Psychiatr Brain Sci 2022; 7(3): e220004.
24. Misra M, Katzman D, Miller KK, et al. Physiologic estrogen replacement increases bone density in adolescent girls with anorexia nervosa. J Bone Miner Res 2011; 26(10): 2430–8.
25. Taquet M, Geddes JR, Luciano S, Harrison PJ. Incidence and outcomes of eating disorders during the COVID-19 pandemic. Br J Psychiatry 2021; 220(5): 1–3.
Labels
Neonatology Paediatrics General practitioner for children and adolescentsArticle was published in
Czech-Slovak Pediatrics

2023 Issue S3
- What Effect Can Be Expected from Limosilactobacillus reuteri in Mucositis and Peri-Implantitis?
- The Importance of Limosilactobacillus reuteri in Administration to Diabetics with Gingivitis
-
All articles in this issue
- Alois Wachsman: Žena v křesle
- Editorial
- Current view on the diagnostics of growth hormone deficiency in childhood and adolescence
- Anorexia nervosa from an endocrinologist's point of view
- Multiple endocrine neoplasia in childhood
- Adult height in children born small for gestational age (SGA) with persistent short stature (SGA-SS). Growth hormone treatment outcomes from data of the Czech countrywide REPAR database
- Pubertal growth in children born small for gestational age (SGA) with persistent short stature (SGA-SS). Growth hormone treatment outcomes from data of the Czech countywide REPAR database
- Příběh sv. Starosty: Legenda, historie a endokrinní kontext jednoho zázraku
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Anorexia nervosa from an endocrinologist's point of view
- Multiple endocrine neoplasia in childhood
- Current view on the diagnostics of growth hormone deficiency in childhood and adolescence
- Pubertal growth in children born small for gestational age (SGA) with persistent short stature (SGA-SS). Growth hormone treatment outcomes from data of the Czech countywide REPAR database
