Infekce močových cest po cystektomii s kontinentní ortotopickou derivací – Vesica ileale padovana (V.I.P.)
Urinary tractinfection after cystectomy with continent orthotopic diversion – Vesica ileale padovana (V.I.P.)
Aim:
The verification of microbial findings in the urine of the patients after a cystectomy with urinary tract reconstruction using ileum and determining sensitivity to antimicrobial drugs and ways of the protection. According to results we plan to propose the appropriate prophylaxis. The suitability of subsequent therapy in postoperative period has been consulted with Department of Clinical Microbiology.
Material and method:
The authors evaluated the cohort of 31 patients after cystectomy with continent derivation of urine in modification Vesica Ileale Padovana (V.I.P.), who underwent surgery on Department of Urology in Hradec Kralove. Quantitative bacteriuria, sensitivity to antimicrobial drugs and efficiency of administered antimicrobial therapy were examined in one, three and six month interval.
Results:
Bacteriuria was present in 35.5 % of patients in the postoperative period. Escherichia coli were the most common finding, sensitive to all common antibiotics. The sensitivity of others microbes as Pseudomonas aeruginosa, Enterococcus faecalis and Klebsiella pneumoniae was only to high generation of cephalosporines, aminoglycosides or another more toxic antibiotics. Despite targeted therapy, bacteriuria was repeatedly positive in 77.4 % of patients, but clinically asymptomatic.
Conclusion:
Quinelones, Trimethoprim + Sulfamethoxazolum or Ampicillin with beta-lactamase inhibitors (i.v.) in combination with metronidazolum one hour before and 7–10 days after operation can be used to cover the serious operation. Asymptomatic bacteriuria is not necessary to treat. In the case of infection with clinical sings of sepsis or pyelonephritis, it is necessary to immediately initiate antibiotic therapy according to the sensitivity to antimicrobial agents.
Key words:
ileal neobladder (V.I.P.), bacteriuria, therapy.
Authors:
Petr Morávek jr. 1; Petr Morávek 1; Miroslav Louda 1; Miloš Broďák 1
; Monika Morávková 2
Authors‘ workplace:
Urologická klinika LF UK a FN, Hradec Králové
1; Ústav klinické mikrobiologie LF UK a FN, Hradec Králové
2
Published in:
Ces Urol 2010; 14(3): 173-179
Category:
Original article
Overview
Cíl:
Ověřit mikrobiální nálezy v moči pacientů po cystektomii s rekonstrukcí močových cest s využitím střevního segmentu ilea, se zjištěním citlivosti mikrobů na antibakteriální léky a příčin infekce. Ve spolupráci s Ústavem klinické mikrobiologie vytipovat zajištění operačního výkonu vzhledem k primárnímu osídlení střeva bakteriální flórou a vhodnost následné antibiotické léčby v pooperačním období.
Materiál a metoda:
V souboru 31 nemocných po cystektomii s kontinentní derivací v modifikaci V.I.P. (Vesica ileale padovana) operovaných na Urologické klinice v Hradci Králové v letech 1998–2007 jsme v intervalech po 1, 3 a 6 měsících vyšetřili kvantitativní bakteriurii (KBÚ), citlivost na antibiotika a účinnost podané antimikrobní léčby.
Výsledky:
Bakteriurie se v pooperačním období vyskytla u 35,5 % nemocných. Nejčastěji šlo o Escherichia coli citlivou na běžná antibiotika. Z ostatních uropatogenů byly prokázány zejména Pseudomonas aeruginosa, Enterococcus faecalis a Klebsiella pneumoniae s citlivostí jen na vázaná antibiotika. I přes cílenou léčbu byla bakteriurie opakovaně pozitivní, ale klinicky v 77,4 % asymptomatická.
Závěr:
Dle zkušeností lze k zajištění operace využít chinolony, trimetoprim se sulfamethoxazolem nebo ampicilin s inhibitorem beta-laktamáz v kombinaci s metronidazolem (i.v.) podané jednu hodinu předoperačně a následně po operaci 7–10 dní. Přetrvávající asymptomatickou bakteriurii není třeba v souladu s literárními citacemi léčit, v případě aktivace infekce s klinickými známkami sepse nebo pyelonefritidy je třeba ihned nasadit antibiotika dle citlivosti.
Klíčová slova:
ileální neovesika (V.I.P.), bakteriurie, léčba.
ÚVOD
Přítomnost infekce v močových cestách (IMC) po cystektomii s derivací moče využitím segmentu střeva představuje riziko pro vznik chronické pyelonefritidy s následnou renální insuficiencí. Při vložení segmentu střeva do močového traktu dochází ke spojení sliznice střeva s přirozenou antimikrobiální ochranou, osídlenou bakteriemi, se sliznicí močových cest primárně sterilní. Další rozvoj infekce závisí na řadě faktorů. Především na správné funkci ureterointestinální anastomózy, která má zaručit ochranu před infekcí horních močových cest a vyloučit poruchu odtoku moče z ledvin s následným městnáním, které představuje riziko infekce.
Prioritní je správně zvolená operační technika, může se však uplatnit i výběr interponovaného střevního segmentu. Smíšená bakteriální flóra je častější v ileálním konduitu než kolonickém, kde bývá častěji monokultura Escherichia coli. Obecně platí, že celkové množství bakterií v trávicím traktu se zvyšuje aborálním směrem, zejména se zvyšuje poměr anaerobů k aerobům (1). Důležitý je druh bakteriální flóry, její virulence a sekrece hlenu, který zamezuje průnik bakterií do enterocytů.
Bakteriurie je potencionálně přítomná u všech operovaných, ale je většinou asymtomatická. Stále je otevřená diskuse stran typu ureteroileální anastomózy (refluxní x antirefluxní) a indikace antimikrobní léčby – zajištění operačního výkonu a následné léčby bakteriurie v pooperačním období. V českém písemnictví nebyla dosud tato problematika z uvedeného pohledu publikována.
MATERIÁL A METODA
Do souboru jsme v období 1998–2007 zařadili 31 pacientů (26 mužů a 5 žen), u kterých jsme provedli cystektomii a ortotopickou kontinentní derivaci moče pro karcinom v modifikaci V.I.P. (Vesica ileale padovana) (2). Průměrný věk žen byl 56 let (45/70), průměrný věk mužů 57 let (40/75). Evakuaci moče z neoveziky v pooperačním období zajištuje epicystostomický drén 7–10 dní a měchýřová cévka 18 dní.
U nemocných jsme sledovali předoperační KBÚ ze středního proudu u mužů, cévkované moče u žen, eventuálně z pukčního nefrostomického drénu (byl zaveden pro pokročilé městnání u dvou nemocných) a KBÚ v intervalech l, 3 a 4–6 měsíců po operaci, se stanovením citlivosti na antimikrobní léčbu.
Všem operovaným byl předoperačně a 7–10 dní po operaci, v rámci zajištění operačního výkonu, podán cefoxitin (Mefoxin), od roku 2003 cefotaxim (Claforan) i.v., gentamycin (Gentamicin) i.v. a metronidazol (Metronidazol) i.v. V následném pooperačním období byla podávána antimikrobní léčba při pozitivní bakteriurii.
Sledovali jsme pooperační mikci, reziduum moče s nutností ČIK (čistá intermitentní katetrizace), zavedení permanentní cévky pro závažnou inkontinenci a aktivaci infekce (sepse, akutní pyelonefritis).
VÝSLEDKY
Předoperační vyšetření KBÚ prokázalo pozitivní nález u šesti nemocných. Šlo o běžnou bakteriální floru, která se po manipulaci v močových cestách vyskytuje (tab. 1).
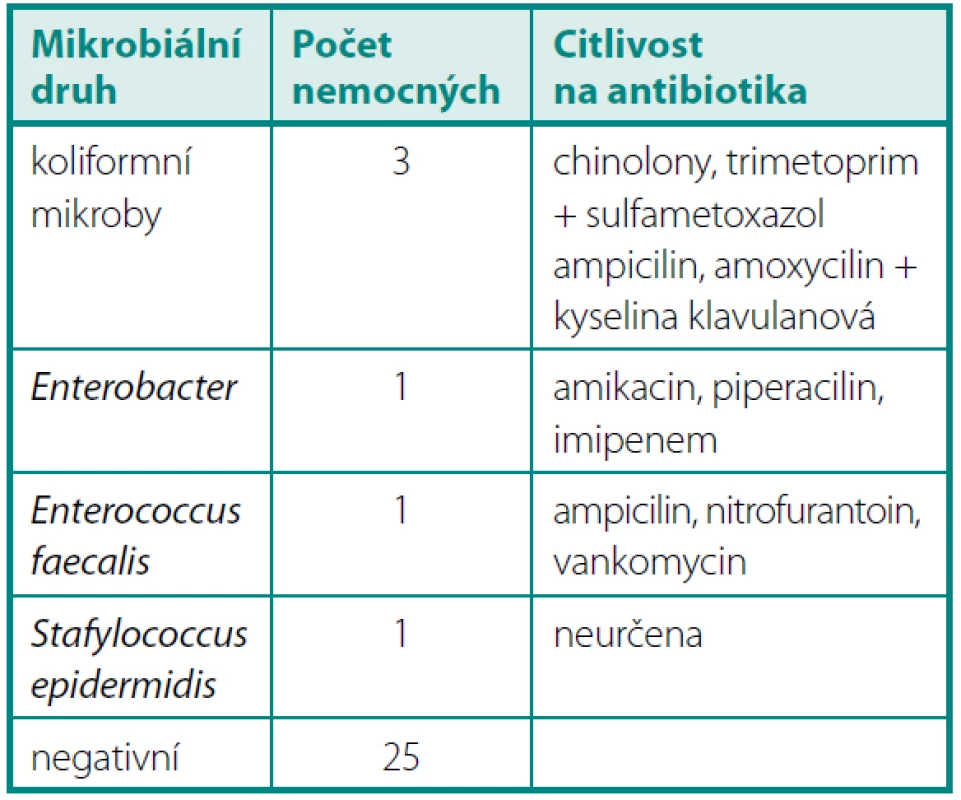
Po jednom měsíci byla pozitivní KBÚ u 11 operovaných. U jednoho nemocného se opakovala infekce Enterococcus faecalis, u jednoho byl opakovaně Stafylococcus epidermidis a u devíti šlo o nový bakteriální nález (tab. 2).
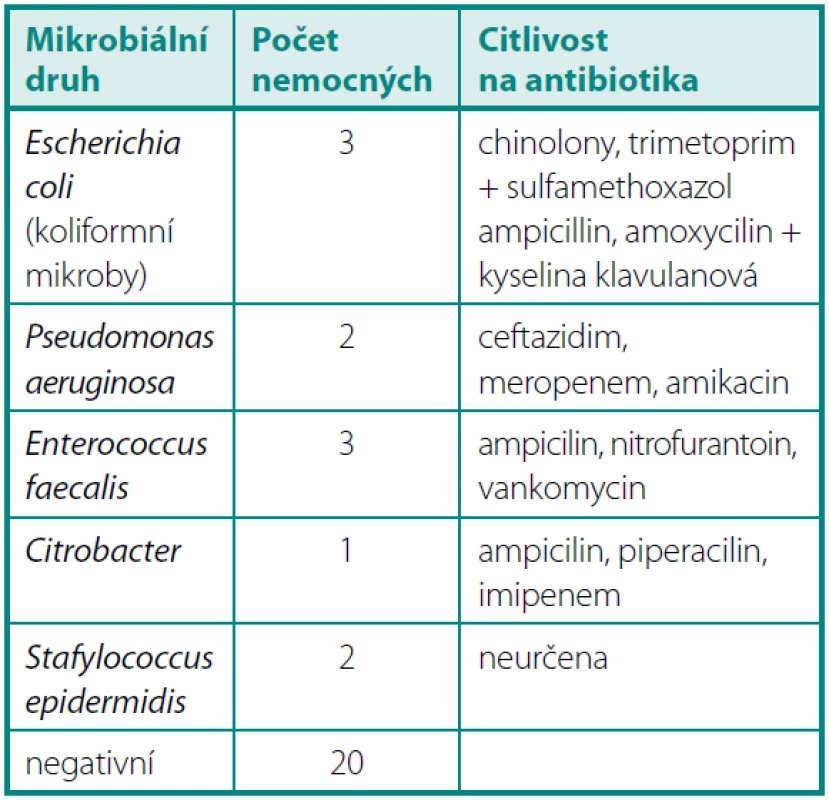
Po 3 měsících byla zjištěna pozitivní KBÚ u šesti operovaných. U pěti přetrvával předchozí mikrobiální nález (Pseudomonas aeruginosa 3×, Enterococcus faecalis 2×) i přes léčbu dle citlivosti. U jednoho nemocného se jednalo o nový nález Klebsiella oxytocica a 4× přetrvával jen nález leukocyturie. Bakteriurie byla u všech nemocných asymptomatická (tab. 3).
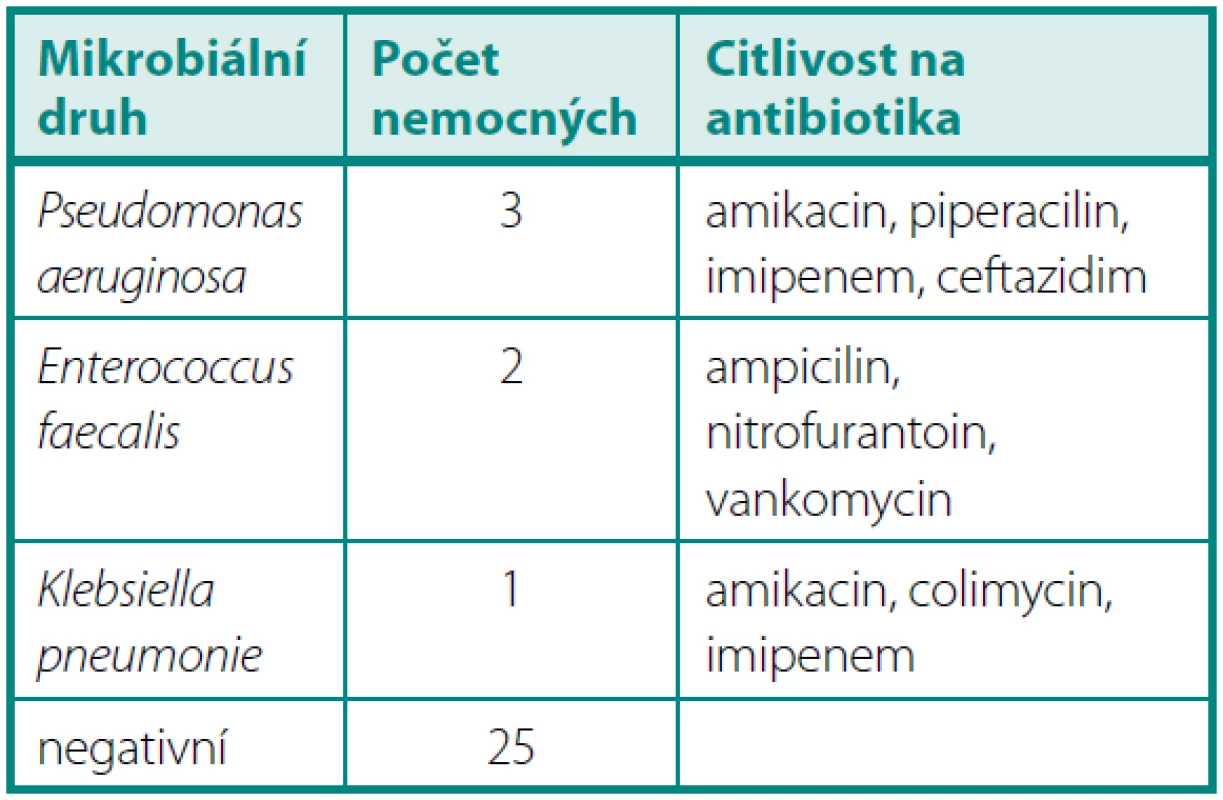
V období od 4 do 6 měsíců byla prokázána pozitivní KBÚ u pěti operovaných. Opakovaně byly vykultivovány Pseudomonas aeruginosa 3× a Enterococcus faecalis 2×. U dalších tří nemocných byla zjištěna významná leukocyturie bez nálezu bakteriurie (tab. 4).
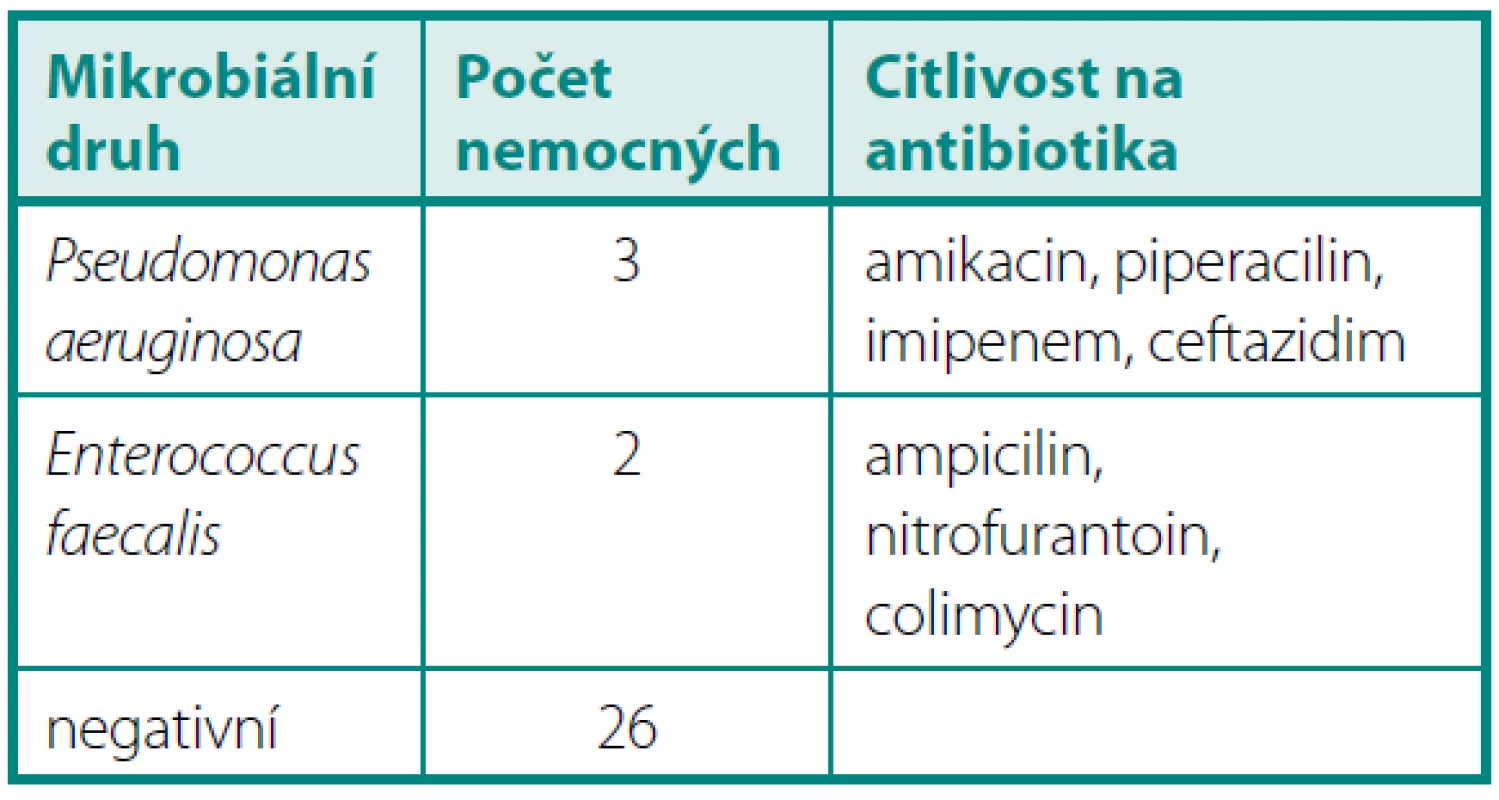
U pěti nemocných byl prokázán nepříznivý vliv ČIK nebo zavedené permanentní cévky pro vysoké reziduum (nad 250 ml) nebo závažnou stresovou inkontinenci. U všech nemocných přetrvávala trvale infekce častěji než u nemocných s úplnou evakuací neoveziky mikcí.. Třikrát se jednalo o Pseudomonas aeruginosa, 2× Escherichia coli a 1× o Enterococcus faecalis.
U žádného nemocného nebyla v pooperačním průběhu zaznamenána sepse ani komplikovaná symptomatická akutní pyelonefritida. U 24 (77,4 %) nemocných došlo k osídlení neoveziky rezistentními bakteriálními kmeny, které nevyvolalo subjektivní ani objektivní klinické symptomy, jednalo se o asymptomatickou bakteriurii. U 7 (22,6 %) byla nekomplikovaná infekce močových cest se vzestupem teploty. Na podanou trojkombinaci antibiotik nebyly uvedené bakterie, jak se ukázalo, citlivé. V pooperačním období byly podávány pro přetrvávající asymptomatickou bakteriurii trimetoprim se sulfamethoxazolem nebo chinolony, které ji neovlivnily ani v případech, kde byly vybrány dle citlivosti.
DISKUSE
Rekonstrukce dolních močových cest po cystektomii přináší pozdní komplikace, které se mohou projevit poruchou renální funkce. Derivace moči je spojena s náhradou chybějící části DMC (dolních močových cest) interpozicí izolované části střeva, nejčastěji ileální kličky nebo části tračníku. Z pozdních komplikací se jedná především o stenózu antirefluxní ureteroileální anastomózy s následným městnáním (2,4 %), která však představuje ochranu HMC (horních močových cest) před refluxem infikované moči (3). Tato anastomóza je prováděna u ortotopických i heterotopických derivací moči při využití preterminální kličky ilea nebo části tračníku k vytvoření nízkotlaké, velkoobjemové neoveziky (pouche). Opakem je refluxní ureterointestinální anastomóza při derivaci moči konduitem (ureteroileostomie dle Brickera nebo v modifikaci dle Wallace) nebo jednoduchá refluxní anastomóza ureterů s neovezikou (dle Hohenfellnera). Při bakteriurii dochází k návratu infikované moči do ledviny, opakované pyelonefritidě a tvorbě renálních jizev.
U velkoobjemové a nízkotlaké ortotopické neoveziky, za předpokladu dobrého vyprazdňování, je reflux prokázán výjimečně a antirefluxní anastomóza není požadována, ale pouze doporučována, protože riziko pyelonefritidy je až u 18 % nemocných. I u kontinentní heterotopické neoveziky může dojít v době mezi naplněním a pravidelným vyprázdňováním pomocí ČIK k intermitentnímu zvýšení intraluminálního tlaku, proto je většinou autorů vhledem k vyšší četnosti akutní pyelonefritidy a urosepse antirefluxní anastomóza rovněž doporučována (4, 5). Sami jsme pro častý výskyt stenózy ureteroileálního spojení, která představuje překážku v odtoku moči s následnými komplikacemi (městnání v horních močových cestách, obstrukční pyelonefritis, sepse), antirefluxní anastomózu opustili a doporučujeme jednoduchou refluxní anastomózu (6, 7). Antirefluxní anastomózu jsme provedli u 20 nemocných a po změně taktiky refluxní anastomózu u 11 nemocných. Nepozorovali jsme častější výskyt pyelonefritidy ani sepse. U ileálního konduitu s refluxní anastomózou je vyšší výskyt chronické pyelonefritidy s tvorbou jizev často spojený s městnáním v horních močových cestách z obstrukce výtoku. Ta může být němá a projeví se až po 10 letech.
V případě rekonstrukce močového traktu interpozicí střeva, jak už bylo řečeno, dochází ke spojení dvou různých kompartmentů. Střevní sliznice s přirozenou i specifickou ochranou pro bakteriální antigeny je spojena se sliznicí močového traktu, která je sterilní. Vhledem k antibakteriální ochraně je bakteriurie většinou asymtomatická, neprojeví se subjektivními ani objektivními klinickými symptomy (4, 8).
Bakteriurie z ileálního konduitu nebo kontinentního rezervoáru s vytvořením abdominálního stomatu se potencionálně vyskytuje u všech operovaných. U ileálního konduitu je přítomná v 84 %, symtomatická je jen ve 14 % (9). Většinou se jedná o gram + koky (rod Streptoccus, rod Stafylococcus), které adherují v epidermálních buňkách stomatu a gram-bakterie (E. coli, Pseudomonas aeruginosa, Proteus species, Enterococcus faecalis), které se kolonizují v neovezice (10, 11). U ortotopické derivace byla bakteriurie v literatuře popsána u 30 až 80 % operovaných, v naší sestavě V.I.P. u 35,5 % nemocných. Jedná se o stejné bakteriální druhy, většinou jde o polybakteriální infekci. Jako monobakteriální infekce se vyskytuje v 59 % E. coli, která je častěji v kolonickém rezervoáru (neovesice) (12).
Cesta infekce je přes abdominální stoma (konduit nebo nefunkční stoma heterotopické kontinentní derivace). Významnou roli hraje ČIK při hyperkontinenci, velkém reziduu (více než 250 ml) nebo PC (permanentní cévka) zavedená pro těžkou stresovou inkontinenci. Bakteriurie byla významně vyšší než u nemocných s dobře funkční neovezikou (13). ČIK a PC byly v našem souboru u šesti nemocných (16,3 %) a ovlivnily trvalé přetrvávání infekce u pěti nemocných, ale i u nich byla bakteriurie asymptomatická.
Ochrana proti ascendentní infekci je ve dvou rovinách – specifické tvorbě protilátek při aktivaci T - a B-lymfocytů a přirozené obraně v místě, kterou představuje dobrý proud moči, úplné vyprázdnění neoveziky a přítomnost funkční sliznice s tvorbou hlenu. Po rekonstrukci je lokální antibakteriální ochrana výrazně oslabena, eventuálně i odstraněna a uplatní se jen přirozené specifické mechanismy. Pokud se bakterie ve sliznici usídlí, dojde k její aktivaci a startuje exkrece cytokinů a interleukinu-6 a -8. Nemocní s asymptomatickou bakteriurií mají hladinu IL-6 velmi nízkou na rozdíl od nemocných s pyelonefritidou (4, 14).
Důležitým faktorem součásti ochrany proti osídlení neoveziky bakteriemi je hlen. Mucin, jeho hlavní součást, produkují pohárkové buňky, jejichž počet se aborálně zvyšuje. Vrstva hlenu představuje částečnou prevenci průniku a vazby bakterií do enterocytů (4). Jsou však práce, které závislost bakteriální kontaminace na produkci hlenu zpochybňují (15).
Dalším faktorem ovlivňujícím rozvoj bakteriurie po rekonstrukci je výběr interponovaného střeva. Smíšená bakteriální flóra je častější v ileálním než kolonickém konduitu a neovezice, monokultura je častější v kolonickém kontinentním rezervoáru. Osídlení střeva bakteriální flórou se aborálně zvyšuje. Kolon je více rezistentní vůči infekci E. coli (14). Nepochybně výběr neoveziky záleží na zkušenostech a zvyklostech pracoviště a operatéra. Technicky správně provedený operační výkon s kompletním vyprazdňováním neoveziky je jistě základním předpokladem dobrého funkčního výsledku, a tedy i prevence následné bakteriurie.
Je třeba ještě zmínit, že ochranu proti ascendentní infekci snižuje odstranění prostaty při cystektomii, jejíž sekret má antibakteriální účinek (4, 16). Z onkologického hlediska je v současnosti indikována radikální cystektomie s prostatektomií.
Vhodnost antibiotické profylaxe a následné léčby prokázané bakteriurie po rekonstrukci močových cest je stále diskutována. U nemocných se subjektivními a objektivními známkami aktivní infekce musí být antibakteriální léčba podána dle výsledku KBÚ a citlivosti.
Léčba asymptomatické bakteriurie je dosud kontroverzní. Asymptomatická bakteriurie u ileálního konduitu a heterotopické kontinentní derivace (neoveziky) je přítomná prakticky u všech nemocných a její eradikace je většinou neúspěšná. U nemocných s vytvořenou ileální neovezikou a ortotopickou derivací moči je názor renomovaných pracovišť různý. Některá centra doporučují profylaxi nízkými dávkami antibiotika. Důvodem je možná aktivace infekce a negativní vliv neoveziky na pacienta. Profylaxe však pouze snižuje bakteriální kolonizaci a zmenšuje pohyb uropatogenů (17, 18). Jiná centra vycházejí ze zjištění, že bakteriurie i v případě dalšího růstu uropatogenů je téměř vždy asymptomatická (4). Asymptomatická bakteriurie u nemocných s intaktním močovým traktem nemá být léčena. Nepřináší benefit, může být naopak spojena se škodlivými výstupy, jako jsou zkrácení doby intervalu reinfekce a zvýšení antimikrobní rezistence antibiotik u symptomatické infekce. Z těchto důvodů se nedoporučuje léčba asymptomatické bakteriurie ani u pacientů po rekonstrukci močových cest střevem.
ZÁVĚR
Bakteriální nálezy zjištěné v našem souboru nemocných s rekonstrukcí dolních močových cest po cystektomii pro malignitu, s využitím ilea v modifikaci V.I.P., odpovídají literárním zkušenostem. Příčinou asymptomatické bakteriurie je spojení sliznice střeva primárně osídlené bakteriální flórou, s přirozenou antibakteriální ochranou se sliznicí sterilního močového traktu. Správně provedená rekonstrukce s dobrým vyprazdňováním kalichů, pánvičky i neoveziky, bez refluxu infikované moče do horních močových cest je ochranou před vznikem pyelonefritidy s tvorbou jizev a následné renální insuficience v delším časovém úseku. Dle našich zkušeností a literárních citací má být léčena pouze bakteriurie kultivačně ověřená před operací a symptomatická bakteriurie se známkami sepse nebo pyelonefritidy v pooperačním průběhu, dle výsledku KBÚ a citlivosti na antibiotika. Pro zajištění operačního výkonu postačí týdenní podání chinolonů, trimetoprimu se sulfamethoxazolem, ampicilinu s inhibitorem beta-laktamáz v kombinaci s metronidazolem, které ovlivní kolonizaci koliformních mikrobů. Následnou asymtomatickou bakteriurii uropatogeny, které osídlí neoveziku, doporučujeme jen ke sledování bez léčby. Její eradikace je většinou neúspěšná.
Došlo: 18. 1. 2010
Přijato: 28. 4. 2010
Kontaktní adresa
MUDr. Petr Morávek
Urologická klinika LF UK a FN
Sokolská 580,
500 05 Hradec Králové
e-mail: moravek.petr@centrum.cz
Sources
1. Zbořil, et al. Mikroflora trávicího traktu. Praha: Grada Publishing 2005.
2. Pagano F, Artibani W. Kontinente Ileumblase: Vesica Ileale Padovana (V.I.P.). Akt Urol 1991; 22: I–VI.
3. Mansson W, Davidson T, Konyves J, Liedberg F, Mansson A, Wullt B. Continent urinary tract reconstruction - the Lund experience. BJU Int 2003; 92(3): 271–276.
4. Wullt B, Agace V, Mansson W. Bladder, bowel and bugs – bacteriuria in patiens with intestina urinary diversion. World J Urol 2004; 22 : 186–195.
5. Bonfig R, Gerharz EW, Riedmiller H. Ileal ureteric replacement in complex reconstruction of the urinary tract. BJU Int 2004; 93(4): 575–580.
6. Kristjánsson A, Bajc M, Wallin L, Willner J, Mansson W. Renal function up to 16 years after conduit (refluxing or anti-refluxing anastomosis) or continent urinary diversion Renal scarring and localisation of bacteriuria. Br J Urol 1995; 76(5): 546–550.
7. Madersbacher S, Schmidt J, Berle JM, Thoeny HC, Burkhard F, Hochreiter W, Studer UE. Long-term outcome of ileal conduit diversion. J Urol 2003; 169(3): 985–990.
8. Suriano F, Galluci M, Flammia GP, Musco S, Alcini A, Imbalzano G, Dicoonzo G. Bacteriuria in patients with an orthotopic ileal neobladder: urinary tract infection or asymptomatic bakteriuria? BJU International 2008; 101(12): 1576–1579.
9. Bruce AW, Reid G, Chan RC, Costerton JW. Bacterial adherence in the human ileal conduit: a morphological and bacteriological study. J Urol 1984; 132(1): 184–188. 10. Bishop RF, Smith ED, Gracey M. Bacterial flora of urine from ileal conduit. J Urol 1971; 105(3): 452–455.
11. Chan RC, Reid G, Bruce AW, Costerton JW. Microbial colonisation of human ileal conduits. Appl Environ Microbial 1984 Dec.
12. Keegan SJ, Graham C, Neal DE, Blum-Oehler G, N´Dow J, Pearson JP, Gally DL. Characterization of E. coli strains causing urinary tract infections in patiens with transported intestine segments. J Urol 2003; 169(6): 2382–2387.
13. Hartmann RE, de Petriconi R, Gottfried HW, Kleinschmidt K, Mattes R, Paiss T. The ileal neobladder : complications and functional results in 363 patients after 11years of follouwup. J Urol 1999; 161(2): 422–427; discussion 427–428.
14. Nakano Y, Miyake H, Inoue T, Takenaka A, Hara I, Fujisawa M. Elevated urinary cytokine levels in patients undergoing ileal neobladder replacement compared wirth sigmoid neobladder replacemnet, International Urol and Nephrol 2006; 39(2): 467–472.
15. Akerlund S, Berglund B, Kock NG, Philipson BM. Voiding pattern, urinary volume, composition and bacterial contamination in patiens with urinary diversion via a continet ileal reservoir. Br J Urol 1989; 63(6): 619–623.
16. Fair WR, Couch J, Werner N. Prostated antibacterial factor. Identity and significance Urology 1976; 7 : 169–177.
17. Nicolle LE. Asymptomatic bacteriuria: when to screen and when to treat. Infect Dis Clin North Am 2003; 17(2): 367–394.
18. Akerlund S, Campanello M, Kaijser B, Jonsson O. Bacteriuria in patiens with a continent ileal reservoir for urinary diversion does not regularly require antibiotik treatment. Brit J Urol 1994; 74(2): 177–181.
Labels
Paediatric urologist Nephrology UrologyArticle was published in
Czech Urology

2010 Issue 3
-
All articles in this issue
- Infekce močových cest po cystektomii s kontinentní ortotopickou derivací – Vesica ileale padovana (V.I.P.)
- Naše zkušenosti s aplikací rázové vlny u pacientů s induratio penis plastica (průměrná doba sledování 13 měsíců)
- Postavení magnetické rezonance a magnetické rezonanční spektroskopie při detekci karcinomu prostaty
- Molekulární vlastnosti klinicky signifikantního karcinomu prostaty
- Genetické riziko karcinomu prostaty
- Mikrochirurgická operace varikokély u dětí a dospívajících – prospektivní srovnání laparoskopické a otevřené subingvinální operace
- Chronická urinární toxicita 3D-CRT a IMRT karcinomu prostaty
- Srovnání akutní toxicity radioterapie technikou IMRT a IMRT + HDR BRT u pacientů s karcinomem prostaty vysokého rizika rekurence
- Czech Urology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Mikrochirurgická operace varikokély u dětí a dospívajících – prospektivní srovnání laparoskopické a otevřené subingvinální operace
- Naše zkušenosti s aplikací rázové vlny u pacientů s induratio penis plastica (průměrná doba sledování 13 měsíců)
- Postavení magnetické rezonance a magnetické rezonanční spektroskopie při detekci karcinomu prostaty
- Molekulární vlastnosti klinicky signifikantního karcinomu prostaty
