Stanovení exprese SHB v tkáni karcinomu prostaty: využití v diagnostice a prognostice
Expression of SHB in prostate cancer tissue: its role in the diagnostics and prognostics
Aim:
Among urological malignancies prostate cancer most frequently leads to death. The etiology of this disease remains unknown. Many analyses identified genes associated with increased susceptibility to prostate cancer, where changes in gene expression were associated with prostate cancer. Adaptor protein SHB is involved in apoptosis, angiogenesis and cell cycle regulation systems. A correlation between the expression of SHB, and reduced proliferation of prostate cancer PC3 cells was detected. The aim of this work was to compare SHB expression in prostate cancer to that in benign prostate hyperplasia and to evaluate its diagnostic and prognostic potential.
Methods:
In 2008–2010, isolation of mRNA from prostate cancer was performed in 53 patients. Twenty four patients with benign prostate hyperplasia were used as a control group. The identical procedure of mRNA isolation using Oligotex Direct mRNA Midi/Maxi was used. RTPCR, expression of specific sample was visualized by electrophoresis. Optical density was measured with densitometry. For relative expression calculation, housekeeping gene GAD (glyceraldehyde-3-phosphate dehydrogenase) was used. Results have been evaluated statistically.
Results:
Statistically significant decrease in relative expression of SHB in prostate cancer tissue was detected (p < 0.001). In a comparison of patients with localized (T2) and locally advanced tumor, we observed a trend of decreased expression in locally advanced disease which had not achieved statistic significance (p < 0.0693). A comparison between groups detected no differences in the Gleason score (GS < 7 and GS ≥ 7).
Conclusion:
SHB is a candidate gene for prostate cancer development. Its expression is decreased in prostate cancer compared to benign prostate hyperplasia. Its levels are decreased in locally advanced stages.
Key words:
gene expression, prostate cancer, radical prostatectomy, SHB.
Authors:
Marek Schmidt 1; Jaroslav Mareš 2; Ladislav Jarolím 1; Michal Černý 3; Štěpán Veselý 1; Marek Babjuk 1
Authors‘ workplace:
Urologická klinika 2. LF UK a FN Motol
Praha
1; Ústav biologie a lékařské genetiky 2. LF UK
a FN Motol, Praha
2; Přírodovědecká fakulta JČU
České Budějovice
3
Published in:
Ces Urol 2012; 16(1): 58-66
Category:
Original article
Overview
Cíl:
Karcinom prostaty je nejčastější urologickou onkologickou příčinou úmrtí. Etiologie onemocnění zůstává neznámá. Byla identifikována řada genů náchylnosti ke karcinomu prostaty, u kterých byla prokázána asociace změny genové exprese s výskytem karcinomu. Adaptorový protein SHB je součástí systému regulace apoptózy, angiogeneze a buněčného cyklu. Při jeho zvýšené expresi byla prokázána snížená proliferace prostatických nádorových buněk PC3. Cílem prezentované práce je stanovení genové exprese SHB v tkáni karcinomu prostaty, její porovnání s expresí v tkáni benigní hyperplazie a vyhodnoceni diagnostického a prognostického potenciálu SHB.
Metody:
V letech 2008–2010 byla provedena izolace mRNA z tkáně karcinomu prostaty u 53 pacientů. Jako kontrolní skupina byla použita tkáň prostaty u 24 pacientů s benigní hyperplazií. Izolace mRNA byla prováděna u všech pacientů identickým způsobem pomocí soupravy Oligotex Direct mRNA Midi/Maxi. Po RT-PCR byla exprese vybraného vzorku vizualizována pomocí elektroforézy. Optická hustota byla měřena denzitometricky. Pro výpočet relativní exprese genu byl zvolen provozní gen GAD kódující glyceraldehyd-3-fosfátdehydrogenázu. Dosažené výsledky byly statisticky vyhodnoceny.
Výsledky:
Získaná data prokázala nižší relativní expresi SHB v tkání karcinomu (p < 0,001). Při rozdělení karcinomu na lokalizované (T2) a lokálně pokročilé (T3–T4) byl pozorován trend k nižší expresi u lokálně pokročilých forem, který ale nedosáhl statistické významnosti (p < 0,0693). Při porovnání skupin dle Gleasonova skóre (GS < 7 a GS ≥ 7) jsme nezaznamenali žádný rozdíl.
Závěr:
SHB je kandidátní gen náchylnosti k vzniku karcinomu prostaty. Jeho exprese je nižší v tkáni karcinomu ve srovnání s tkání benigní hyperplazie a klesá při lokálně pokročilých stadiích.
Klíčová slova:
genová exprese, karcinom prostaty, radikální prostatektomie, SHB.
ÚVOD
Karcinom prostaty (CaP) zůstává druhou nejčastější onkologickou příčinou úmrtí. Asi 10 % všech mužů onemocní karcinomem prostaty a asi 3 % na něj zemřou. V Evropě je každoročně diagnostikováno asi 2,6 milionů nových případů. Tvoří asi 11 % všech nádorových onemocnění u mužů a v Evropské unii činí úmrtí na karcinom 9 % všech úmrtí na nádorová onemocnění. Podle údajů ÚZIS představovala incidence karcinomu prostaty v roce 2008 v České republice 60,3 nových případů na 100 000 obyvatel a mortalita 15,7/100 000 (www.svod.cz) (graf 1). Data z dalších let nejsou k dispozici.

Zda se jedná o karcinom prostaty lokalizovaný, nebo lokálně pokročilý, má pro pacienta z hlediska kurability zásadní význam. Asi 30–45 % pacientů s klinicky lokalizovaným onemocněním má při určování patologického stadia extrakapsulární rozšíření karcinomu. V prognóze dalšího průběhu onemocnění a z ní vyplývajících léčebných postupů má význam pouze patologicko-anatomické stadium, Gleasonovo skóre nádoru a hladina prostatického specifického antigenu (PSA) v séru. PSA je v současné době jediným prakticky používaným markerem v diagnostice, volbě optimální terapie, sledování průběhu onemocnění a efektu léčby. Snaha o získání dalších prognostických faktorů, které by pomohly predikovat další průběh onemocnění, vede k intenzivnímu výzkumu a hledání dalších molekulárně biologických markerů. Z několika komplexních segregačních analýz byly získány důkazy o hlavních genech, vedoucích k náchylnosti ke vzniku a rozvoji karcinomu prostaty. Přitom byla nalezena řada kandidátních genů, jejichž genetické alterace odrážejí predispozice k onemocnění karcinomem prostaty. Příkladem genetických markerů mohou být RNASEL/PC1, ELAC2/HPC2, NKX3.1, PTEN, RB1, CDKN1B, DD3PCA3 nebo PDF. Přestože byla prokázána snížená proteinová exprese, nebo mutace výše uvedených genů, sledované genetické faktory zatím kromě DD3PCA3 nenabyly praktického významu (1). Potenciálním markerem se zdá být human organic cation transporter 3(OCT3/SLC22A3), který zprostředkovává vychytávání důležitých endogenních aminů a základních léků v různých tkáních. Úroveň metylace OCT3 je vyšší u 62 % nádorů prostaty ve srovnání se zdravou tkání a u agresivních tumorů je jeho exprese snížená (2).
Molekulární mechanismy spojené se vznikem karcinomu prostaty nejsou dosud zcela ozřejměny. Proces maligní transformace je zřejmě podmíněn řadou genetických a epigenetických změn, které jsou umožněny chybami v kontrolních mechanismech buněčného cyklu (3). Tyto změny dovolují nádorovým buňkám získat určité specifické schopnosti – např. deregulace kontroly buněčného cyklu, autonomii buňky pro buněčné signály, únik z regulovaného programu apoptózy, nebo neomezený replikační potenciál. Dále dochází ke schopnosti indukovat angioinvazi, infiltrativní růst do okolních tkání a metastazování. Přenos vlastností podporující nádorový zvrat buňky na další generaci je možný dvěma způsoby: geneticky nebo epigeneticky. Genetické změny nastávají mutací genomu buňky určitého orgánu nebo tkáně. Tyto změny bývají dědičné. Příkladem jsou protonkogeny, které jsou součástí buněčných regulačních kaskád a signál k proliferaci dávají pouze za přísné regulace odpovědi na podněty přicházející z okolí buňky. Při jejich mutaci a změně v onkogen mohou generovat neregulovaný signál, vedoucí k nekontrolovatelné proliferaci buňky (4). Dalším příkladem jsou nádorové supresorové geny, které regulují buněčná dělení. Jejich mutace vede k poruše regulace buněčného cyklu a následné živelné proliferaci. Epigenetické změny jsou definovány jako dědičné změny genové exprese při nezměněné sekvenci DNA.
Karcinom prostaty může vznikat na podkladě mutací nebo deregulací genů účastnících se regulace buněčného cyklu (např. RB, TP53, P16), signální transdukce (PTEN), buněčné adheze, exprese androgenových receptorů (AR) a mnoha dalších buněčných procesů (5).
Hlavními příčinami vzniku nádorových onemocnění jsou zřejmě změny v buněčné proliferaci, diferenciaci a apoptóze buněk. Protein Shb, který spolupracuje s tyrosinkinázovými receptory, je součástí systému regulace apoptózy, angiogeneze a buněčného cyklu. Při jeho zvýšené expresi je prokázána snížená proliferace prostatických nádorových buněk PC3 (6).
Protein Shb byl objeven při identifikaci genů indukovaných sérem v inzulinové buněčné linii βTC-1 u myší (7). Název Shb vznikl zkratkou označení proteinu SH2 β-buněk, ale později byla zjištěna exprese Shb v řadě dalších tkání (8). Lokus genu Shb byl identifikován na chromosomu 9p12-p11. Je dlouhý 150 kb a obsahuje 6 exonů (9). Produkt genu Shb hraje roli při přenosu signálu do jádra buňky. Obsahuje silně homologní motiv domén SH2, které se uplatňují v buněčné komunikaci. Typicky se vážou na fosforylované tyrosinové postranní zbytky tyrosinkináz, které slouží jako vazebná místa pro velkou skupinu intracelulárních signálních proteinů. Funkcí proteinů SH2 je jejich interakce s aktivovanými tyrosinkinázovými receptory a jsou označovány jako adaptorové (schéma 1).

Protein Shb patří mezi adaptorové proteiny, které spolupracují s tyrosinkinázovými receptory, jako jsou receptory epidermálního růstového faktoru (EPF), růstového faktoru krevních destiček (PDGF), vaskulárního endoteliálního růstového faktoru (VEGF), nebo fibroblastového růstového faktoru (FGF). Po aktivaci tyrosinkinázového receptoru vytváří proteinové komplexy. Dochází k seskupování signálních komponent vazbou těchto složek na různé domény Shb (10).
Apoptóza je fyziologický, ale na rozdíl od nekrózy, přesně organizovaný a regulovaný děj. Buňka je eliminována takovým způsobem, že nedojde k poškození okolních buněk. Apoptóza je nezbytná pro normální vývoj a funkce mnohobuněčného organismu a projevuje se morfologickými změnami, jako je redukce objemu buňky, kondenzace chromatinu a následně rozpad buňky. Chyby v signalizaci v průběhu apoptózy jsou typické pro tumorigenezi (11). Aktivaci apoptotické reakce může způsobit genotoxický, oxidativní anbo endoplazmatický stress (12). Buněčná nereceptorová tyrosinkináza c-ABL patří mezi proteiny účastnící se odpovědi na stres endoplazmatického retikula. Za normálních podmínek je c-Abl přísně regulována. V případě poškození buňky se kináza c-Abl aktivuje, což může způsobit zastavení buněčného cyklu a apoptózu (13). Složitá struktura proteinu c-Abl obsahuje domény a motivy, které umožňují interakce se signálními a adaptorovými proteiny. Shb reguluje fosforylaci c-ABL, a tak pravděpodobně ovlivňuje její kinázovou aktivitu. Biologický význam interakce c-ABL/SHB byl testován při zvýšené expresi obou proteinů a při knockoutu Shb. Při expozici toxickým sloučeninám spolu SHB a c-ABL interagují, což vede k regulaci kinázové aktivity c-ABL ale i signální dráhy pro buněčnou smrt (14).
Shb tak hraje klíčovou roli v modulaci proapoptotické signalizace mediované pomocí c-ABL. Při zvýšené expresi Shb byla prokázána zvýšená aktivita c-Abl v prostatických nádorových buňkách PC3 a redukce růstu nádoru in vivo (6).
Další funkcí Shb je vliv na proliferaci a diferenciaci endotelových buněk, čímž se podílí na procesu angiogeneze (15). Hlavními regulátory angiogeneze jsou růstové faktory FGF s VEGF, které ovlivňují proliferaci, migraci a diferenciaci endotelových buněk. S jejich receptory interaguje protein Shb. Jednou z metod nádorové terapie může být inhibice nekontrolované angiogeneze v nádoru indukcí apoptózy endotelových buněk. Knockdown Shb zvyšuje citlivost buněk SVR (angiosarkomická buněčná linie) k apoptóze (16).
MATERIÁL A METODY
V letech 2008–2010 byla provedena izolace mRNA z tkáně karcinomu prostaty u 53 pacientů. Průměrný věk skupiny pacientů byl 64,9 let (48–81). Jako kontrolní skupina bylo vyšetřeno 24 pacientů, kteří podstoupili operační zákrok pro benigní hyperplazii a histologické vyšetření prokázalo nepřítomnost tkáně karcinomu. Průměrný věk skupiny byl 64,8 let (45–80). Materiál k izolaci mRNA byl u pacientů s karcinomem získán částečně transrektální biopsií (9 pacientů) a částečně z preparátu po radikální prostatektomii (44 pacientů). Přítomnost karcinomu v tkáni určené k izolaci byla ověřena histologickým vyšetřením okrajů odebraného vzorku. U kontrolní skupiny byl materiál získán z resekátu během transuretrální prostatektomie (16 pacientů) nebo odběrem části tkáně prostaty odstraněné transvezikálně (8 pacientů). Odebrané vzorky byly uchovávány v RNA lateru a následně zpracovány. Patologicko-anatomické vlastnosti karcinomu byly posouzeny standardním vyšetřením preparátu.
Izolace mRNA byla prováděna u všech pacientů identickým způsobem pomocí soupravy Oligotex Direct mRNA Midi/Maxi firmy Qiagen. Hmotnosti zpracovávané tkáně se pohybovaly v rozmezí 50–100 mg. Izolace mRNA z bioptických vzorků probíhala tak, aby se zabránilo případné kontaminaci vzorků. Veškerá izolovaná mRNA byla okamžitě zmrazena na -70° a při této teplotě uchovávána až do analýzy.
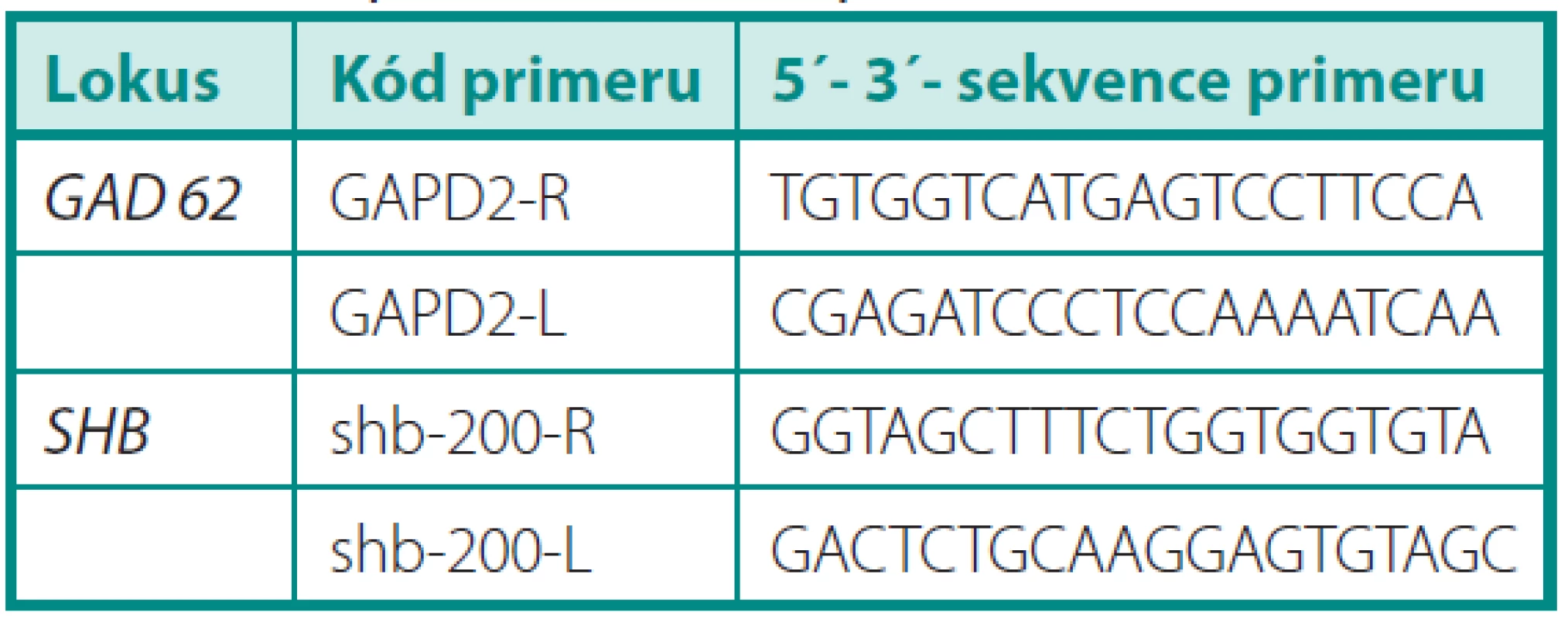
Vzorky mRNA byly analyzovány pomocí soupravy OneStep RT-PCR firmy Qiagen. Dále byly použity specifické primery pro kandidátní gen SHB (obr. 1) a kontrolní gen GAD kódující glyceraldehyd-3-fosfátdehydrogenázu. Annealingová teplota pro každý gen byla určena experimentálně pomocí gradientového programu na cykleru Biometra T-Gradient. Po gradientové RT-PCR byla exprese vzorku při různých teplotách gradientu vizualizována pomocí elektroforézy a dle výsledků byla určena optimální annealingová teplota pro zkoumaný gen. S výjimkou annealingové teploty probíhaly jednotlivé kroky RT-PCR ve všech případech stejně. V průběhu polymerázové reakce proběhlo 35 cyklů. Výsledek RT-PCR byl verifikován gelovou elektroforézou. Výsledky byly vizualizovaný pomocí zobrazovacího přístroje MiniBIS Pro (Bio-Imaging Systems) a optická hustota byla měřena denzitometricky. Pro výpočet relativní exprese genu byl zvolen provozní gen GAD. Relativní exprese genu u konkrétního pacienta byla určena pomocí vztahu: optická hustota proužku exprese příslušného genu: optická hustota proužku exprese genu GAD. Předpokládali jsme, že exprese genu SHB bude u kontrolní skupiny vyšší. Dále jsme v rámci skupiny pacientů s karcinomem porovnávali relativní expresi u skupiny s lokalizovaným nádorem (T2) a skupiny s lokálně pokročilým karcinomem (T3–T4), kde jsme očekávali nižší expresi u lokálně pokročilých forem. Při porovnání skupiny s nepříznivou histologií (Gleasonovo skóre 7–10) a skupiny s příznivou histologií (Gleasonovo skóre 6) jsme předpokládali vyšší expresi u skupiny s příznivou prognózou. Posuzovali jsme také korelaci relativní exprese genu SHB a plazmatické hladiny PSA. Dosažené výsledky byly statisticky vyhodnoceny pomocí StatView soft ware (Abacus Conceprs, Berley, USA). K vyhodnocení statistické významnosti byl použit Mann-Whitney test. Všichni pacienti zařazení do studie podepsali informovaný souhlas.
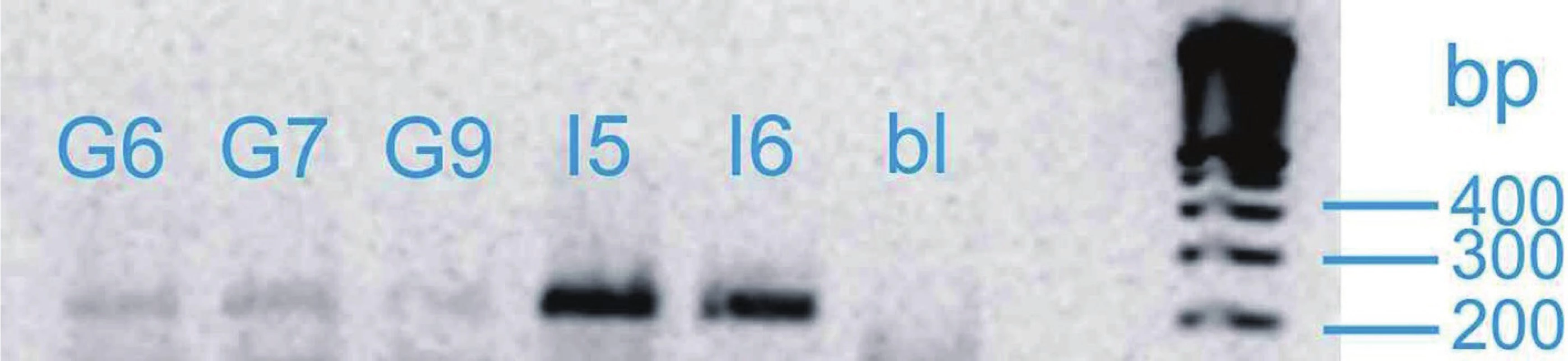
VÝSLEDKY
Ve skupině pacientů s karcinomem se jednalo v 38 případech o karcinom lokalizovaný (T2) a v 15 případech o karcinom lokálně pokročilý (T3–T4). V případě devíti pacientů, u kterých byly vzorky získání transrektální biopsií, se jednalo o lokálně pokročilé onemocnění klasifikované na základě palpačního vyšetření prostaty a transrektální sonografie. U těchto pacientů nebyla indikována radikální prostatektomie, ale hormonální léčba, eventuálně v kombinaci s radioterapií. Ve skupině pacientů s karcinomem prostaty mělo 25 pacientů dobře až středně diferencovaný karcinom prostaty (Gleasonovo skóre do 6) a 28 pacientů bylo nositeli špatně diferencovaného agresivního karcinomu prostaty (Gleasonovo skóre 7–10).
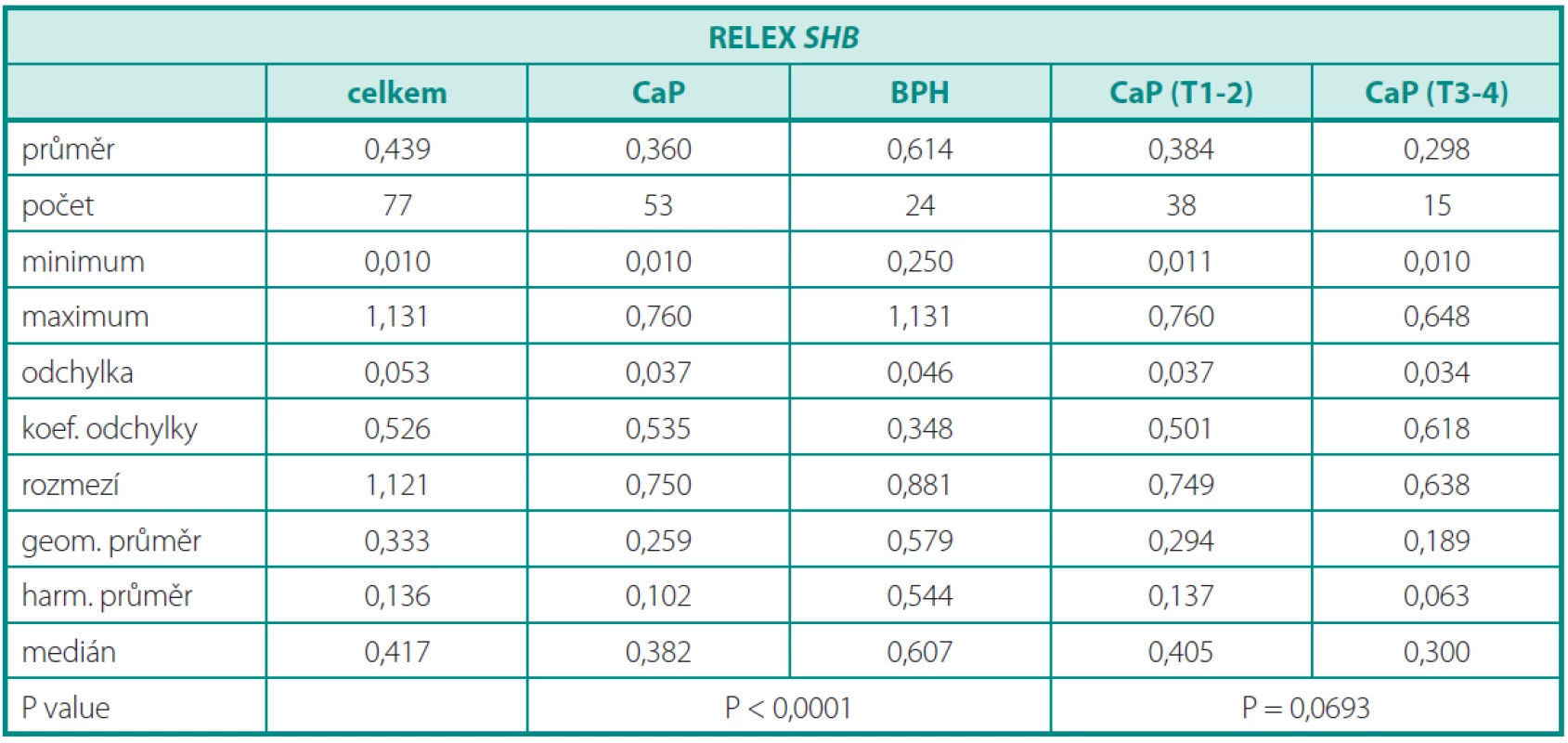
Deskriptivní statistika souboru pacientů s karcinomem a pacientů s BPH je obsahem tabulky 2. Dosažené výsledky (graf 2) prokazují signifikantně nižší relativní expresi SHB v tkání karcinomu (p < 0,001). Minimální a maximální naměřená hodnota relativní exprese SHB u karcinomů byla 0,010, resp. 0,760. Minimální a maximální naměřená hodnota relativní exprese SHB u benigní hyperplazie byla 0,250, resp. 1,131. Při rozdělení karcinomu na lokalizované (T2) a lokálně pokročilé (T3–T4) byl pozorován trend k nižší expresi u lokálně pokročilých forem, který ale nedosáhl statistické významnosti (p < 0,0693) (tab. 2). Přesto se zdá, že lokálně pokročilé karcinomy vykazují nižší expresi SHB, která může být jedním z důvodů neregulovaného invazivního růstu. Očekávaně nebyla prokázána korelace genové exprese a plazmatické hladiny PSA. Při porovnání skupin dle Gleasonova skóre (GS < 7 a GS ≥ 7) jsme nezaznamenali žádný rozdíl. Exprese SHB nekoreluje se stupněm agresivity karcinomů a zřejmě ani s metastatickým potenciálem.V tomto parametru role SHB jako prognostického markeru selhává.

DISKUSE
Karcinom prostaty je onemocnění, u kterého dosud není známá účinná prevence, a nelze tak zabránit jeho vzniku. Včasná diagnostika onemocnění v jeho ranném stadiu má zásadní význam pro další prognózu pacienta. Velká pozornost je věnována možnostem včasného záchytu, a to především pomocí biomarkerů. K jejich hledání napomáhají analýzy exprese genů potenciálně zapojených do vzniku a progrese karcinomu. Zásadní změna v expresi a regulaci genů se zdá být důležitým faktorem nádorového bujení. Exprese genu Shb dosud byla analyzována pouze v buněčných liniích nádorů prostaty a u myší. Po úspěšné izolaci mRNA z vzorků tkáně prostaty u 77 pacientů a optimalizaci všech kroků RT-PCR byla stanovena exprese genu SHB každého ze vzorků, jež byla relativizována na expresi genu GAD.
Protein SHB je pleiotropním adaptorovým proteinem, který reguluje buněčnou migraci, proliferaci, diferenciaci či apoptózu. Jednou z odpovědí na jeho knockout je změna endotelového fenotypu, což je významný děj tumorové angiogeneze (17). V předkládané práci byla relativní exprese SHB u pacientů s karcinomem prostaty signifikantně nižší než u kontrolní skupiny pacientů s BPH. Tento výsledek je v souladu se studií Davoodpourové et al. (6), která při zvýšené expresi genu SHB pozorovala redukci růstu prostatických nádorových buněk PC3. Protein SHB hraje roli v modulaci proapoptotických signálů. V předkládané studii zjištěná nižší relativní exprese v tkáních karcinomů poukazuje na redukovanou míru apoptózy v nádorových buňkách, jejímž výsledkem je nárůst počtu nádorových buněk. Vliv SHB na angiogenezi není možné přesně specifikovat, neboť k inhibici angiogeneze vlivem působení apoptotických činitelů dochází při úplné inaktivaci SHB. Ačkoliv nebyl při porovnání genové exprese v lokalizovaném (T2) a lokálně pokročilém (T3–T4) stadiu karcinomu zaznamenán jednoznačný statisticky signifi kantní rozdíl, byl pozorován trend nižší exprese genu SHB u lokálně pokročilých forem onemocnění. Také ve studii Davoodpourové et al. (6) byla zaznamenána nižší exprese v buněčných liniích pokročilého karcinomu. Ostatní statistické šetření neprokázala korelaci relativní exprese genu SHB s plazmatickou hladinou PSA ani závislost exprese na Gleasonově skóre. Podle dostupných studií porovnávajících hladinu PSA s mnoha patologickými nádorovými daty se zdá, že PSA je spíše markerem BPH (18). Přesto zůstává vynikajícím diagnostickým markerem karcinomu prostaty.
Ve srovnání s jinými zkoumanými geny náchylnosti ke vzniku karcinomu prostaty nemá SHB zatím oporu v obsáhlých multicentrických studiích a možnosti jeho využití – např. k indikaci či kontraindikaci rebiopsie prostaty při benigní histologii a vysoké hodnotě PSA – nejsou vyzkoušeny. Výhodami DD3PCA3 proti SHB jsou orgánová specificita a dostupnost standardní komerční metodiky detekce mRNA DD3PCA3 z prostatických buněk uvolněných do moči (GenProbe) (1).
Díky signifikantně rozdílné expresi v nádorových a kontrolních vzorcích a detekovanému trendu k dalšímu poklesu exprese u lokálně pokročilých forem onemocnění má SHB gen určitý prognostický potenciál. Jeho rozdílné exprese je, vzhledem k absenci podobně uspořádaných analýz, třeba potvrdit dalšími studiemi.
ZÁVĚR
V předkládané studii jsme provedli izolaci mRNA z tkáně karcinomu prostaty 53 pacientů a z tkáně benigní hyperplazie prostaty 24 pacientů jako kontrolní skupiny. Z dosažených výsledků vyplývá signifikantně nižší exprese genu SHB v tkáni karcinomu než u kontrolní skupiny. Při diferenciaci karcinomů do skupiny lokalizovaných (T2) a skupiny lokálně pokročilých (T3–T4) byl pozorován trend k nižší expresi u lokálně pokročilých forem onemocnění. Zjištěný výsledek nebyl statisticky signifikantní ale kontrolní skupina obsahovala nižší počet pacientů. Při porovnání genové exprese a s plazmatickou hladinou PSA a Gleasonovým skóre jsme nedosáhli statisticky signifikantního rozdílu. Konkrétní role proteinu SHB v tumorigenezi není dosud zcela vyjasněna. Byla prokázána asociace řady kandidátních genů s výskytem karcinomu prostaty. Vzhledem k vysokému počtu kandidátních genů a oblastí chromozomů, kde dosud ještě nebyly zjištěny konkrétní geny, budou zapotřebí další studie dokumentující korelaci genetických odchylek s určitými typy karcinomu, popřípadě s konkrétními klinickými průběhy. Dále bude nutné odlišit geny zodpovědné za vznik jednotlivých nádorů a geny způsobující obecnou genetickou nestabilitu. Jejich individuální podíl na vzniku tohoto onemocnění bude pravděpodobně ještě dlouho předmětem výzkumu. Stejně tak není zcela vyjasněna možnost skupinového působení genových produktů a jejich vzájemné působení.
Z dosažených výsledků se SHB jeví jako potenciální prognostický biomarker. Dosažené výsledky bude nutné potvrdit v rozsáhlejších studiích. Bude nezbytné porovnat genovou expresi v benigní tkáni prostaty s přítomným karcinomem, což by umožnilo lepší klinické využití v odlišení karcinomu a benigní hyperplazie při v diagnostice a snad i užitečný parametr v detekci lokálně pokročilých forem karcinomu.
Tato práce byla podpořena grantem GA UK 200 090.
Došlo: 4. 1. 2012.
Přijato: 22. 3. 2012.
Kontaktní adresa
MUDr. Marek Schmidt
Urologická klinika 2. LF UK a FN Motol
V Úvalu 84, Praha 5, 150 06
e-mail: mschmidt@centrum.cz
Sources
1. Klečka J, Hora M, Holubec L, Pešta M, Topolčan O, Eret V, Chottová-Dvořáková M, Babjuk M, Novák K, Stolz J. Exprese DD3PCA3 (Diff erencial Display Code 3) mRNA ve tkáni prostaty u pacientů s karcinomem prostaty a benigní hyperplazií prostaty. Ces Urol 2010; 14(1): 39–47.
2. Chen L, Hong C, Chen EC, Yee SW, Xu L, Almof EU, Wen C, Fuji K, Johns SJ, Stryke D, Ferrin TE, Simko J, chen X, Costello JF, Giacomini KM. Genetic and epigenetic regulation of the organic cation transporter 3, SLC22A3. Pharmacogenomics J 2012 Jan 10. doi: 10.1038/ tpj.2011.60. [Epub ahead of print]
3. Hahn WC, Weinberg RA. Modelling the molecular circuity of cancer. Nat Rev Cancer 2002; 2 : 331–341.
4. Štern P, Vranovský K, Šafarčík K. Karcinom prostaty – molekulární podstata, diagnostika a ekonomika prevence. Klin Biochem Met 2008; 16(37): 19–26.
5. Foley R, Hollywood D, Lawler M. Molecular pathology of prostate cancer: the key to identifying new biomarkers of disease. Endocalc Relat Cancer 2004; 11 : 477–488.
6. Davoodpour P, Landström M, Welsh M. Reduced tumor growth in vivo and increased c-Abl activity in PC3 prostate cancer cells overexpressing the Shb adapter protein. BMC Cancer 2007; 7 : 161.
7. Welsh M, Mares J., Karlsson T, Lavergne C, Breant B, Cleasson-Welsh L. Shb is ubiquitously expressed Src homology 2 protein. Oncogene 1994; 9 : 19–27.
8. Welsh M, Songyang Z, Frantz JD, Trub T, Reedquist KA, Karlsson T, Miyazaki M, Cantley LC, Band H, Shoelson SE. Stimulation through the T cell receptor leads to interaction between SHB and several signalling proteins. Oncogene 1998; 16 : 891–901.
9. Yulug IG, Hillermann R, Fisher EM. Th e Shb adaptor protein maps to human chromosome
9. Genomics 1994; 24 : 615–617.
10. Karlsson T, Songyang Z, Landgren E, Lavergne C, Di Fiore PP, Anafi M, Pawson T, Cantley LC, Cleasson-Welsh M. Molecular interactions of the Src homology 2 domain protein Shb with phosphotyrosine residues, tyrosine kinase receptors and Src homology 3 domain proteins. Oncogene 1995; 10 : 1475–1483.
11. Lowe SW, Cepero E, Evan G. Instrinsic tumour supression. Nature 2004; 432 : 307–315.
12. Igney FH, Kramer PH. Death and anti-death: tumour resistance to apoptosis. Nat Rev Cancer 2002; 2 : 277–288.
13. Kumar S, Mishra N, Raina D, Saxena S, Kufe D. Abrogation of the cell death response to oxidative stress by the c-Abl tyrosine kinase inhibitor STI571. Mol Pharmacol 2003; 63 : 276–282.
14. Hagerkvist R, Mokhtari D, Lindholm C, Farnebo F, Mostoslavsky G, Mulligan RC, Welsh N, Welsh M. Consequences of Shb and c-Abl interactions for cell death in response to various stress stimuli. Exp Cell Res 2007; 313 : 284–291.
15. Lingge L, Holmquist K, Cross M, Welsh M. Role of the Src homology 2 domain-containing protein Shb in murine brain endothelial cell proliferation and diff erentiation. Cell Growth Differ 2002; 13(3): 141–148.
16. Funa NS, Reddy K, Bhandarkar S, Kurenova EV, Yang L, Cance WG, Welsh M, Arbiser JL. Shb gene knockdown increases the susceptibility of SVR endothelial tumor cells to apoptotic stimuli in vitro and in vivo. J Invest Dermatol 2008; 128 : 710–716.
17. Funa NS, Kriz V, Zang G., Calounova G, Akerblom B, Mares J, Larsson E., Sun Y, Betsholtz C, Welch M. Dysfunctional microvasculature as a consequence of Shb gene inactivation causes impaired tumor growth. Cancer Res 2009; 69(5): 2141–2148.
18. Standy TA, Caldwell M, McNeal JE, Nolley R, Hemenex M, Dosna J. Th e prostate specifi c antigen era in the United States is over for prostate cancer: Chat happyend in the last 20 years?
J Urology 2004; 172(4 Pt 1): 1297–1301.
Labels
Paediatric urologist Nephrology UrologyArticle was published in
Czech Urology

2012 Issue 1
-
All articles in this issue
- Využití neuromodulace v léčbě dysfunkcí dolních močových cest
- Do akej miery je aktívne sledovanie malých nádorov obličiek bezpečná stratégia?
- Srovnání výsledků miniinvazivní léčby ženské stresové inkontinence metodou AjustTM a MiniArcTM
- Urologické komplikace po zavedení močového katétru po náhradách velkých kloubů u mužů
- Matematické modelování deformace penisu při induratio penis plastica po terapii rázovými vlnami (SWT)
- Možnosti intervenční radiologie při léčbě nádorů ledvin
- Korelace výsledku pozitronové emisní tomografie a nálezu při resekci reziduálních lézí po chemoterapii neseminomových germinálních nádorů
- Stanovení exprese SHB v tkáni karcinomu prostaty: využití v diagnostice a prognostice
- Oboustranná adrenalektomie – u pacientů s Cushingovým syndromem při ektopické sekreci ACTH
- Czech Urology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Urologické komplikace po zavedení močového katétru po náhradách velkých kloubů u mužů
- Do akej miery je aktívne sledovanie malých nádorov obličiek bezpečná stratégia?
- Využití neuromodulace v léčbě dysfunkcí dolních močových cest
- Oboustranná adrenalektomie – u pacientů s Cushingovým syndromem při ektopické sekreci ACTH
