Tumor z Leydigových buněk
Leydig cell tumor
We report about a case of a Leydig cell tumor, which is one of the most common nongerminal tumors of the testis. Endocrine symptoms, which develop due to the tumors hormonal activity, can be the only sign of the disease. The overproduction of hormones leads to the hypogonadism and can also lead to infertility. Some Leydig cell tumors are malignant with metastatic potential. The treatment is surgical and prognosis depends on early diagnosis.
Key words:
fertility, hypogonadism, Leydig cells, tumor, testis.
:
Katarína Lenková; Jan Vašinka; Martin Labovský
:
Urologické oddělení Nemocnice Znojmo, a. s.
:
Ces Urol 2014; 18(1): 61-64
:
Case report
Prezentujeme kazuistiku pacienta s tumorem z Leydigových buněk, který patří mezi nejčastější negerminální tumory varlete. Projevuje se endokrinní symptomatologií vzhledem k jeho hormonální aktivitě, která může být jediným příznakem tumoru. Nadprodukce hormonů vede k příznakům hypogonadismu a k možnému poškození fertility. Část tumorů je maligních s metastatickým potenciálem. Léčba je chirurgická a prognóza závisí na časné diagnóze tumoru.
Klíčová slova:
fertilita, hypogonadismus, Leydigovy buňky, tumor, varle.
ÚVOD
První případ tumoru z Leydigových buněk byl popsán v roce 1895 Sacchim (1). Tumory z Leydigových buněk jsou vzácné. Tvoří cca 1–3 % všech testikulárních tumorů. Většina je benigní, ale asi 10 % může vykazovat známky malignity. U cca 20–30 % pacientů se tumor projevuje endokrinní symptomatologií. Základní metodou léčby je chirurgické odstranění, tumor je rezistentní vůči většině známých chemoterapeutických režimů a k radioterapii. Prognóza pacientů závisí na časné diagnóze. V práci uvádíme kazuistiku pacienta s tumorem z Leydigových buněk.
KAZUISTIKA
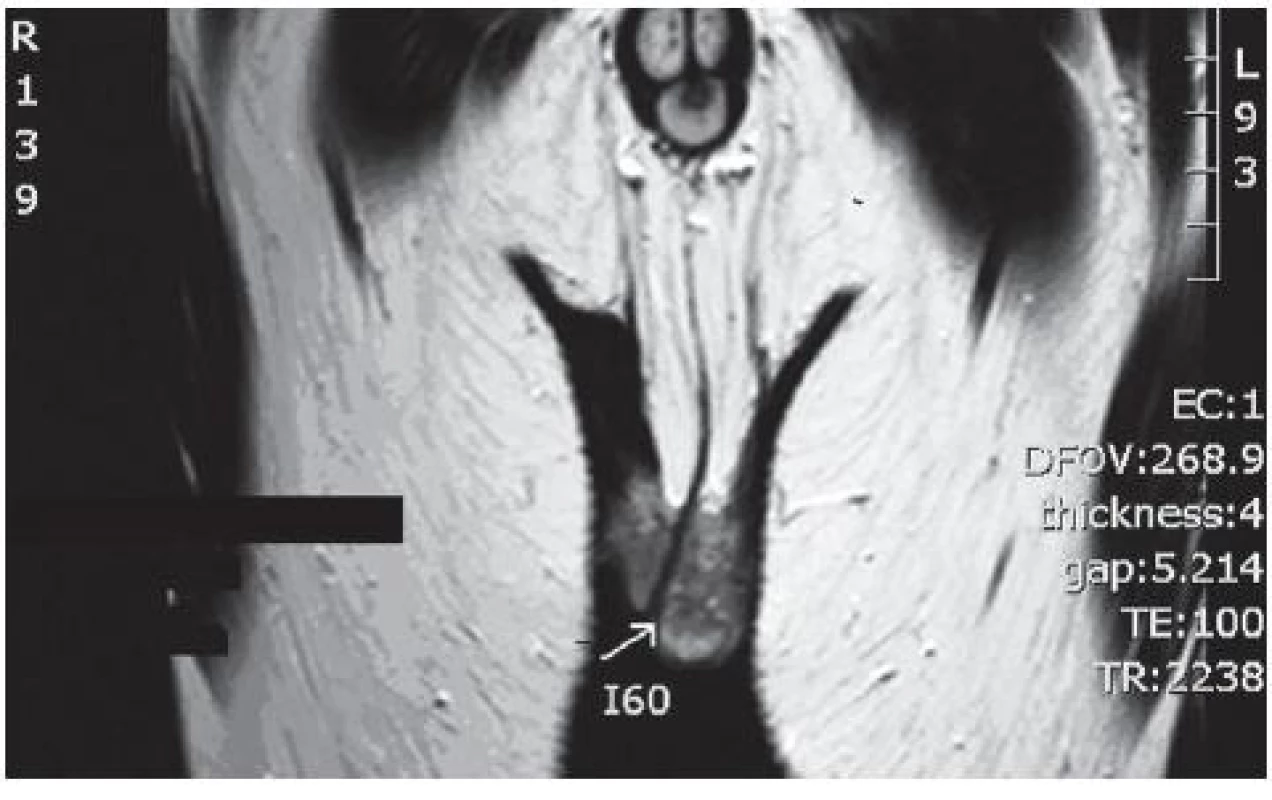
Prezentujeme kazuistiku pacienta s tumorem z Leydigových buněk s endokrinní symptomatologií. Třicetipětiletý pacient byl na našem pracovišti dispenzarizován asi od roku 2006 pro recidivující urolitiázu. Již při primárním vyšetření jsme u pacienta diagnostikovali hypotrofická varlata. Dle anamnestických údajů u pacienta vznikly první známky puberty v cca 12 letech s normálním vývinem sekundárních pohlavních znaků. Pacient neudával při vyšetření poruchu erekce ani snížené libido a neměl zájem o další andrologické došetření. V roce 2009 pacient podstoupil paratyreoidektomii pro primární hyperparatyreózu. Následně se pacient dostal do dispenzarizace endokrinologického pracoviště. Dle hormonálního vyšetření byla zjištěna zvýšená hladina gonadotropinů a estradiolu a nízká hladinu testosteronu. Vzhledem k absenci klinických známek hypogonadismu nebyla indikována substituční léčba. Dále však hypogonadismus došetřen nebyl. V roce 2012 se pacient dostal pro příznaky epididymitidy vlevo na zahraniční urologické pracoviště. Nejdříve byla nasazena antibiotická léčba, ale pro zhoršující se klinický obraz byla provedena skrotální explorace s probatormí excizí z varlete. Dle histologického vyšetření byl diagnostikován tumor z Leydigových buněk. Pacient byl následně na vlastní žádost přeložen na naše pracoviště. V ultrazvukovém nálezu bylo levé varle nehomogenní s hypoechogenním ložiskem. Byla provedena magnetická rezonance s nálezem měkkotkáňových hmot v levém hemiskrotu. Po domluvě s pacientem byla provedena radikální orchiektomie vlevo. Makroskopicky se jednalo o hypotrofické varle s tuhým uzlem špatně diferencovatelným od nadvarlete. Mikroskopicky byl nalezen tumor tvořený polygonálními buňkami se světlou eozinofilní cytoplazmou a objemnými jádry bez patrných mitóz, ale s určitým stupněm anisonukleózy. Nález byl uzavřen jako tumor z Leydigových buněk s nejistou biologickou prognózou vzhledem k anisonukleoze. Při histologickém vyšetření varlete byl semenotvorný epitel zcela atrofický bez známek spermiogeneze. U pacienta nebyly nalezeny známky diseminace onemocnění dle CT vyšetření břicha a CT vyšetření plic. Vzhledem k histologickému výsledku a radiologicky nezvětšeným uzlinám v retroperitoneu jsme neindikovali provedení retroperitoneální lymfadenektomie a bylo rozhodnuto o konzervativním postupu s další observací. Endokrinologicky došlo po operaci k dalšímu poklesu testosteronu s následnou nutností substituční léčby. Pacient je nyní 12 měsíců po stanovení diagnózy bez známek recidivy onemocnění, avšak nedošlo k úpravě hormonálních parametrů.
DISKUSE
Leydigovy buňky jsou uloženy v interstíciu varlete mezi semenotvornými kanálky. Jejich hlavní funkce spočívá v produkci testosteronu pod vlivem luteinizačního hormonu hypofýzy. Testosteron následně ovlivňuje vývoj sekundárních pohlavních znaků a spermatogenezi. Etiologie tumorů z Leydigových buněk není známa. Jedním z předpokládaných mechanismů může být porucha hypotamalamo-hypofýzo-testikulární osy, která vede k excesivní stimulaci Leydigových buněk zvýšenou hladinou luteinizačního hormonu (2). Byly však objeveny i strukturální změny receptorů pro LH nebo poškození G proteinů (3, 4). V literatuře jsou popsány případy tohoto tumoru u pacientů s Klinefelterovým syndromem (5, 6). Tumor se může vyskytnout i extratestikulárně v semenném provazci, v nadledvinách nebo vaječnících.
Incidence dosahuje dvou vrcholů. První se vyskytuje u dětí mezi 5.–10. rokem života a tvoří asi 25 % všech tumorů (7). U dětí je tumor vždy benigní. Druhý vrchol incidence je mezi 20.–60. rokem života. Maligní varianty postihují zejména starší muže. V hormonálním obrazu je typická vysoká hladina estradiolu a nízká hladina testosteronu vedoucí k příznakům feminizace u dospělých mužů (8). Dominují příznaky hypogonadismu jako gynekomastie, erektilní dysfunkce, snížené libido a infertilita s oligospermií až azoospermií. Hladina gonadotropinů bývá snížena, ale byly zaznamenány i případy se zvýšenou hladinou (9). Vysvětlením vysoké hladiny estradiolu je aktivita aromatázy, enzymu, který konvertuje testosteron na estradiol v Leydigových buňkách. U dětí je aktivita aromatázy snížena, eventuálně nulová, proto je typická vysoká hladina testosteronu, která vede k vývoji známek předčasné puberty (růst penisu, pubického ochlupení, akcelerovaný růst kostní a svalové hmoty).
Fyzikálním vyšetřením můžeme zjistit zvětšené varle s hmatnou rezistencí, popsané jsou i případy imitující orchiepididymitidu. Diagnostika spočívá v ultrazvukovém vyšetření varlete, protože tumor může být také nehmatný a projevit se pouze endokrinní symptomatologií. Typický je nález hypoechogenního ložiska s hypervaskularizací. V práci autorů Maizlin et al. bylo ultrazvukově vyšetřeno osm tumorů, ze kterých sedm vykazovalo typický obraz periferní hypervaskularizace s centrální relativní hypovaskularizací (10).
Makroskopicky jsou benigní tumory většinou velikosti 3–5 cm, solidní, ostře ohraničené, hnědé až žluté nebo šedobílé barvy dle obsahu lipidů. Typická zlatohnědá barva tumoru je způsobena ukládáním lipofuscinu v buňkách tumoru. Maligní tumory jsou většinou větší než 5 cm, s okrsky krvácení a nekróz, s prorůstáním přes tunica albuginea a infiltrací okolních struktur. Mikroskopicky je typická přítomnost tzv. Reinkeho krystalů, což jsou podélné nebo hexagonální eozinofilní krystaly uložené intracytoplazmaticky nebo intranukleárně. Buňky tumoru jsou polygonální s eozinofilní cytoplazmou, s pravidelným kulatým nebo oválným jádrem a malým prominujícím nukleolem. Popsané jsou případy se sarkomatoidní variantou (11). Lipofuscin je uložen v zlatožlutých až hnědých intracytoplazmatických granulích viditelných při barvení hematoxylin-eozinem. Mitózy u benigní varianty jsou vzácné a cytologické atypie se nevyskytují. Typickými známkami malignity jsou buněčné a jaderné atypie, nekrózy, lymfovaskulární invaze, zvýšená mitotická aktivita a zvýšená exprese Ki-67/MIB-1 a proteinu p53 (12). Imunohistochemicky je tumor pozitivní pro alfa-inhibin, calretinin a melan-A. Alfa-inhibin je typický marker pro stromální tumory varlete a esenciální k rozlišení germinálních a negerminálních tumorů. Melan-A (Mert-1) je markrem steroidy produkujících tumorů. Tumor může vykazovat i pozitivitu pro vimentin, ale je negativní pro cytokeratiny (13). Imunofenotyp tohoto tumoru je identický s adrenokortikálními tumory.
V rámci diferenciální diagnózy je nutné vyloučit hyperplazii Leydigových buněk, tumor z granulárních buněk, kongenitální adrenální hyperplazii a jiné testikulární tumory. Hyperplazie Leydigových buněk bývá typicky multifokální s ložisky ne většími než půl centimetru, tumor je většinou solitární a větší. Tumor z granulárních buněk odlišíme imunohistochemicky a histologicky absencí přítomnosti Reinkeho krystalů a lipofuscinu v buňkách. U kongenitální adrenální hyperplazie dochází při excesivní sekreci adrenokortikotropního hormonu (ACTH) ke stimulaci ACTH-závislých sítí buněk ve varleti, což vede ke vzniku testikulárních pseudotumorů. Tyto se dají však odlišit histologicky. Nutné je vyloučit i jiné tumory metastazující do varlete.
Léčba je chirurgická a spočívá v provedení radikální orchiektomie. U dětí může být indikován varle-šetřící postup, u dospělých může být proveden varle-šetřící postup v případě solitárního varlete a velmi malých, náhodně zachycených tumorů (14). Nutné je však pečlivé sledování. Nádor má nejisté biologické chování. V literatuře byly popsány i případy metastatické diseminace po primární diagnóze benigního tumoru (15). Nádor metastazuje zejména do retroperitoneálních lymfatických uzlin, jater, plic a kostí. U maligních tumorů je indikována orchiektomie s retroperitoneální lymfadenektomií s diagnostickým a také terapeutickým cílem. Tumor je rezistentní vůči většině známých chemoterapeutických režimů i vůči radioterapii. Parciální odpověď byla popsána po aplikaci mitotanu. Střední doba přežití u pacienta s maligním metastatickým tumorem je asi 2 roky (16). Po orchiektomii se hodnota estradiolu normalizuje za 24–48 hodin, hladina testosteronu do 10 dní, úprava spermatogeneze a hladiny gonadotropinů může trvat několik měsíců (1, 9). Vzhledem k dlouhodobé nadprodukci estradiolu bývá spermatogeneze vážně poškozena u většiny pacientů (17).
ZÁVĚR
Tumory z Leydigových buněk jsou vzácné a často se projevují endokrinní symptomatologií i několik let před klinickou diagnózou tumoru. Nemusí být hmatné, a proto by mělo být u každého pacienta se známkami hypogonadismu nebo infertilitou provedeno ultrazvukové vyšetření varlat. Většina je benigní, ale biologické chování tumoru je nejisté a existuje možnost metastatického postižení i několik let po orchiektomii. Dlouhodobá dispenzarizace a pečlivé sledování je nutné rovněž u pacientů s benigními tumory. U maligních tumorů je nutné spolu s orchiektomií provedení retroperitoneální lymfadenektomie. V případě metastatického postižení je prognóza špatná vzhledem k jeho chemorezistenci a radiorezistenci a medián přežití je průměrně 2 roky.
Došlo: 8. 8. 2013.
Přijato: 29. 11. 2013.
Střet zájmů: žádný.
Kontaktní adresa
MUDr. Katarína Lenková
Urologické oddělení Nemocnice Znojmo
MUDr. J. Jánskeho 11, 669 02 Znojmo
e-mail: slatinova@zoznam.sk
Sources
1. Fadl Tazi M, Mellas S, Jamal El Fassi M. Leydig cell hyperplasia revealed by gynecomastia. Rev Urol 2008; 10(2): 164–167.
2. Holm M, Rajpert-De Meyts E, Andersson A-M, Skakkebk NE. Leydig cell micronodules are a common finding in testicular biopsies from men with impaired spermatogenesis and are associated with decreased testosterone/LH ratio. J Pathol 2003; 199 : 378–386.
3. Liu G, Duranteau L, Carel JC, Monroe J, Doyle DA, Shenker A. Leydig-cell tumors caused by an activating mutation of the gene encoding the luteinizing hormone receptor. N Engl J Med 1999; 341 : 173–176.
4. Fragoso MC, Latronico AC, Carvalho FM. Activating mutation of the stimulatory G protein (gsp) as a putative cause of ovarian and testicular human stromal Leydig cell tumors. J Clin Endocrinol Metab 1998; 83 : 2074–2081.
5. Poster RB, Katz DS. Leydig cell tumor of the testis in Klinefelter syndrome: MR detection. Comput Assist Tomogr 1993; 17 : 480–481.
6. Carroll PR, Morse MJ, Koduru PP, Chaganti RS. Testicular germ cell tumor in patient with Klinefelter syndrome. Urology 1988; 31 : 72–74.
7. Kawaciuk I. Urologie, Praha: Galén 2009.
8. Ponce de Leon Roca J, Algaba Arrea F, Bassas Arnau L, Villavicencio Mavrich H. Leydig cell tumor of the testis. Arch Esp Urol 200; 53 : 453–458.
9. Kalfon A, Abram F, Kirsch-Noir F, et al. Les tumeurs testiculaires à cellules de Leydig. A propos de 10 observations. Prog Urol 1999; 9 : 299–304 (Fre).
10. Zeev V. Maizlin, Belenky A, Kunichezky M, Sandbank J, Strauss S. Leydig Cell Tumors of the Testis Gray Scale and Color Doppler Sonographic Appearance ChBJ Ultrasound Med 2004; 23 : 959–964.
11. Richmond I, Banerjee SS, Eyden BP, et al. Sarcomatoid Leydig cell tumor of the testis. Histopathology 1995; 27 : 578–580.
12. Cheville JC, Sebo TJ, Lager DJ, Bostwick DG, Farrow GM. Leydig cell tumor of the testis: a clinicopathologic, DNA content, and MIB-1 comparison of nonmetastasizing and metastasizing tumors. Am J Surg Pathol 1998; 22 : 1361–1367.
1 3. McCluggage WG, Shanks JH, Whiteside C, Maxwell P, Banerjee SS, Biggart JD. Immunohistochemical study of testicular sex cord-stromal tumors, including staining with anti-inhibin antibody. Am J Surg Pathol 1998; 22 : 615–619.
14. Kratochvíl P. Benigní tumory varlete-záchovné operace, Urolog. pro Praxi 2010; 11(6): 310–312.
15. Hyršl L, Abrahámová J, Zuntová A, Kawaciuk I, Dušek P. Nádory varlete z Leydigových a Sertoliho buněk /Didymal tumours from leydig and sertoli cells. Ces Urol 2005; 9(3): 16–19.
16. Bertram KA, Bratlof B, Hodges GF, Davidson H. Treatment of malignant Leydig cell tumor. Cancer 1991; 68 : 2324–2329.
17. Mineur P, De Cooman S, Hustin J, et al. Feminizing testicular Leydig cell tumor: hormonal profile before and after unilateral orchidectomy. J Clin Endocrinol Metab 1987; 64 : 686–691.
Labels
Paediatric urologist Nephrology UrologyArticle was published in
Czech Urology

2014 Issue 1
-
All articles in this issue
- Amended classification of renal tumours 2013 (International Society of Urological Pathology Vancouver Classification of Renal Neoplasia)
- Benefit of determining [-2]proPSA levels in the differential diagnosis of prostate cancer
- Radical prostatectomy – analysis of 191 cases examined using whole-mount section method
- Monitoring the loss of botulinum toxin during intradetrusor administration – pilot study results
- Benign retroperitoneal schwannoma
- Synchronic triplicity of urological malignancies
- Solitary metastasis of a urothelial carcinoma in the renal parenchyma imitating a primary tumour of the kidney
- Squamous cell carcinoma of the renal pelvis
- Thromboembolism of the renal artery causing renal parenchymal infarction
- Leydig cell tumor
- Leydig cell tumor of the testis
- Czech Urology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Leydig cell tumor
- Benign retroperitoneal schwannoma
- Leydig cell tumor of the testis
- Thromboembolism of the renal artery causing renal parenchymal infarction
