Extrakorporální litotrypse rázovou vlnou v současné urologické praxi
Extracoporeal shock wave lithotripsy in current urological practice
Since the introduction of extracorporeal shock wave lithotripsy (ESWL) in the 1980s, this method has become one of the most widely used therapeutic modalities for patients with urolithiasis. ESWL gained popularity among urologists for its non-invasiveness and also for its high efficiency and good tolerance by patients. Over the years there has been significant progress in new types of lithotripter machines. Nowadays it is difficult to compare the success of individual ESWL machines. Data suggest that the more recently developed lithotripters don’t have a better fragmentation effect or less side effects. At the same time, great progress has been made in interventional endourology, mainly in the use of flexible instruments. Endourology is becoming a viable alternative to shock wave litotripsy for the treatment of nephrolithiasis. Even though, ESWL is a non-invasive therapeutic method which is well tolerated, it does have side effects. Some of them (although rare) can be very serious and it is important to take them into account and deal with them in a timely fashion. ESWL is often indicated by a large number of doctors. It is therefore necessary that these urologists are familiar with the main physical principles of shock waves and the function of lithotripters. This knowledge enables Urologists to refine indications, select proper patients, enhance the therapy process, and limit the occurrence of side effects. This article summarizes the indication and contraindication criteria for ESWL. It also outlines suggestions on how to improve preoperative planning, perform surgery, and provides some recommendations for potential methods to reduce side effects.
Key words:
nefrolithiasis, therapy, shock wave, ESWL, ureterorenoscopy.
:
Leo Pšenčík
:
Urologické oddělení KNTB Zlín a. s.
:
Ces Urol 2014; 18(4): 288-299
:
Review article
Od zavedení extrakorporální litotrypse rázovou vlnou v osmdesátých letech 20. století do medicínské praxe se tato metoda stala jednou z nejužívanějších terapeutických modalit pro urolitiázu. Po rychlém rozšíření získala ESWL obrovskou oblibu lékařů pro svou neinvazivitu i vysokou efektivitu a dobrou snášenlivost. V průběhu let došlo k vývoji nových generací přístrojů pro litotrypsi. V současnosti je ovšem poměrně obtížné srovnání úspěšnosti jednotlivých generací přístrojů. Data nasvědčují tomu, že novější litotryptory nemají lepší fragmentační efekt ani vliv na snížení nežádoucích účinků. V kontrastu s tím dochází k rozvoji endourologických zákroků za použití převážně flexibilních přístrojů a terapie rázovou vlnou dostává alternativu i pro indikaci nefrolitiáz. I když představuje ESWL dobře snášenou neinvazivní metodu léčby, jako každý lékařský zákrok, má své nežádoucí účinky. Některé z nich, ač vzácně, mohou být závažné a je nutné na ně myslet a včas je řešit. Indikační šíře ESWL je velmi široká, výkony provádí velký počet lékařů a je vhodné seznámit urology se základními fyzikálními principy rázové vlny a fungováním přístrojů. To umožní lépe indikovat pacienty, zlepší vedení terapie a může mít vliv na snížení nežádoucích účinků. V článku jsou uvedeny aktualizace indikačních kritérií i kontraindikací. Podáváme návrhy postupů pro zlepšení předoperační rozvahy, vedení zákroku a postupy potenciálně snižující nežádoucí účinky.
Klíčová slova:
nefrolitiáza, terapie, rázová vlna, ESWL, ureterorenoskopie.
ÚVOD
První zmínky o rázových vlnách jako fyzikálním jevu se objevují začátkem 20. století, přelomová byla ale první polovina osmdesátých let, kdy byly do medicínské praxe uvedeny první přístroje užívající tento princip. Uplatnění našly právě v urologii k terapii urolitiázy. Tato událost razantně změnila dosavadní strategii terapie z doposud chirurgické léčby na léčbu neinvazivní, a tedy i pacienty lépe snášenou. Metoda nabídla možnost řešit i drobnější nefrolity, aniž by zásadním způsobem zatěžovala pacienta a vyžadovala celkovou anestezii. Později se uplatnila i jako bezpečná a účinná modalita pro akutní terapii ureterolitiázy v rámci renální koliky. Vzhledem k možné opakovatelnosti a dobré efektivitě, která se udává kolem 75 % do 3 měsíců od léčby (7), došlo mezi urology ve velmi krátké době k obrovské oblibě této metody. Úspěšnost extrakorporální litotrypse se udává pomocí indexu stone-free rate, kdy jako pozitivní označujeme s odstupem 3 měsíců od léčby nález odchodu veškeré drti konkrementu (5). ESWL je efektivní terapeutická modalita pro léčbu uroli-tiázy, v poslední době ji ale značně konkurují endourologické přístupy, které nabízejí alternativní terapeutický plán. I přesto je litotrypse rázovou vlnou dnes velmi běžně indikovanou metodou prováděnou velkým počtem lékařů. Proto je vhodné, aby urologové měly alespoň bazální představu o fyzikálním principu rázové vlny, jejím vlivu na tkáně, a mohly tak lépe zefektivnit léčbu a minimalizovat potencionální nežádoucí účinky. Uvědomění si i možných dlouhodobých nežádoucích účinků, zvláště u pacientů po opakovaných zákrocích, umožní případné zvolení alternativního přístupu u rizikových skupin nebo opatrnější léčebný algoritmus. Znalost pozdních vlivů ESWL na organismus nám umožní dispenzarizovat pacienta nejen na základě rizika novotvorby konkrementů, nýbrž nám i umožní doporučit ostatním specializacím kontroly například krevního tlaku či funkce ledvin.
PRINCIP RÁZOVÉ VLNY
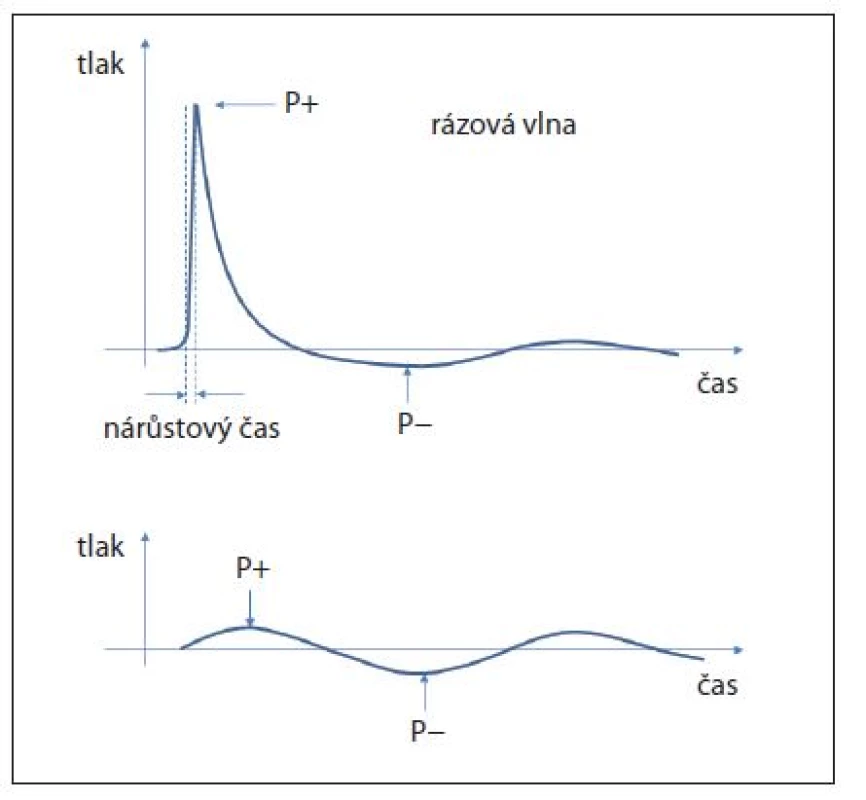
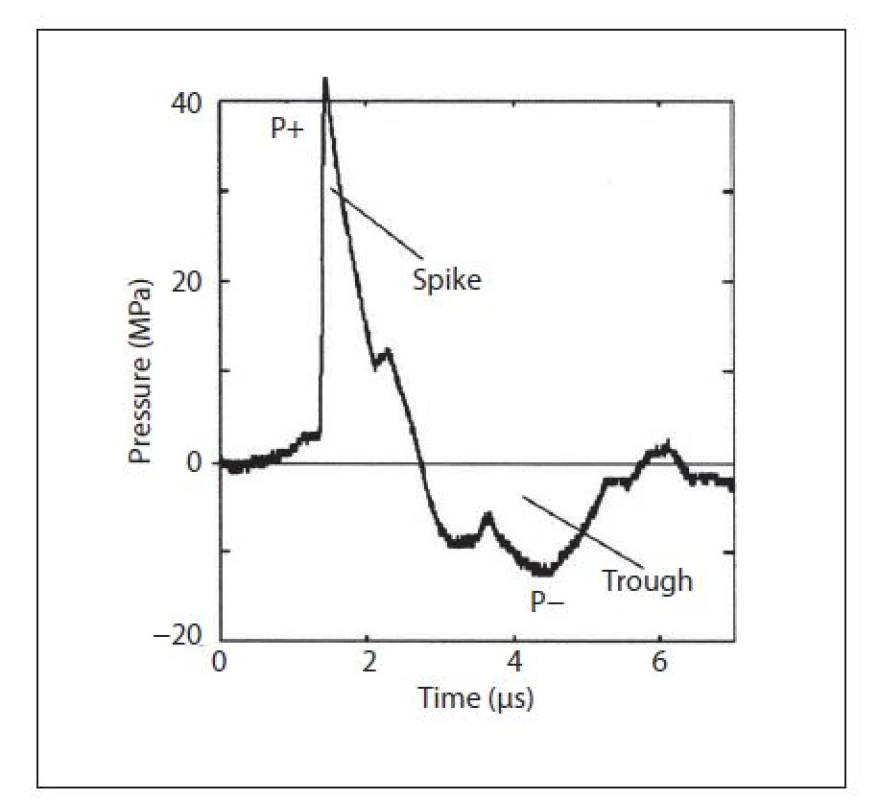
Podkladem vzniku energie, která je schopna fragmentovat konkrement v těle pacienta, je rázová vlna. Principiálně jde o akustickou vlnu, která vzniká při pohybu objektu v hmotném prostředí. Tímto prostředím může být v optimálním případě kapalina, ale i vzduch, tuhé těleso či elektromagnetické pole. Pro šíření akustické vlny je nezbytnou podmínkou právě materiální prostředí. Šířící se akustická vlna je charakterizována střídáním kompresní a podtlakové, tzv. tažné vlny (1). Při pohybu rázové vlny jedním směrem se na přední straně konkrementu tvoří zóna komprese s pozitivní tlakovou charakteristikou a za ním zóna molekulárního zředění s pod tlakem (2). Rozdíl mezi ultrazvukovým vlněním a rázovou vlnou ukazuje obrázek 1. Ultrazvuková akustická vlna má charakter sinusoidy s periodickým střídáním pozitivní a negativní amplitudy o specifikované vlnové délce a tedy frekvenci. Rázová vlna vzniká vysokoenergetickým stimulem a strmým nárůstem tlaku s velkou amplitudou a na rozdíl od ultrazvukové vlny přichází o lineární a harmonickou charakteristiku. Rázová vlna je tedy neharmonická a nelineární. Dělí se na fázi šoku (spike) a na pokles tlaku v negativní fázi (trough) (obr. 2). Ve fázi spike se generuje tlak 40–110 MPa, který při přechodu do negativní komponenty vlny klesá až na –10 MPa (2). U přístrojů vyráběných pro litotrypsi jsou okolní fyzikální podmínky upraveny tak, aby bylo šíření a uplatnění rázové vlny co nejefektivnější. Pro pochopení principu fragmentace litiázy je důležitý pojem akustická impedance. Jedná se o vlastnost látky, která popisuje denzitu a akustickou rychlost. Význam pro litotrypsi má šíření akustické vlny mezi médii s rozdílnou akustickou impedancí. Částečně se vlna odrazí zpět, částečně proniká novým mediem dále (progresivní vlna) a určitá energie působí destrukčně na konkrement. Při přechodu vlny z vodního prostředí do tkání a orgánů je rozdíl impedancí malý, a průchod tedy velmi účinný bez redukce tlakové amplitudy. Pokud vlna naráží z vodního prostředí na konkrement je redukce energie až 25 %, při přestupu z vody na kostní tkáň ztráta energie činní i 60 %. Pro praxi je dobré vědět, že na přechodu vody a vzduchu se pohltí prakticky veškerá energie (1).
MECHANISMUS ÚČINKU
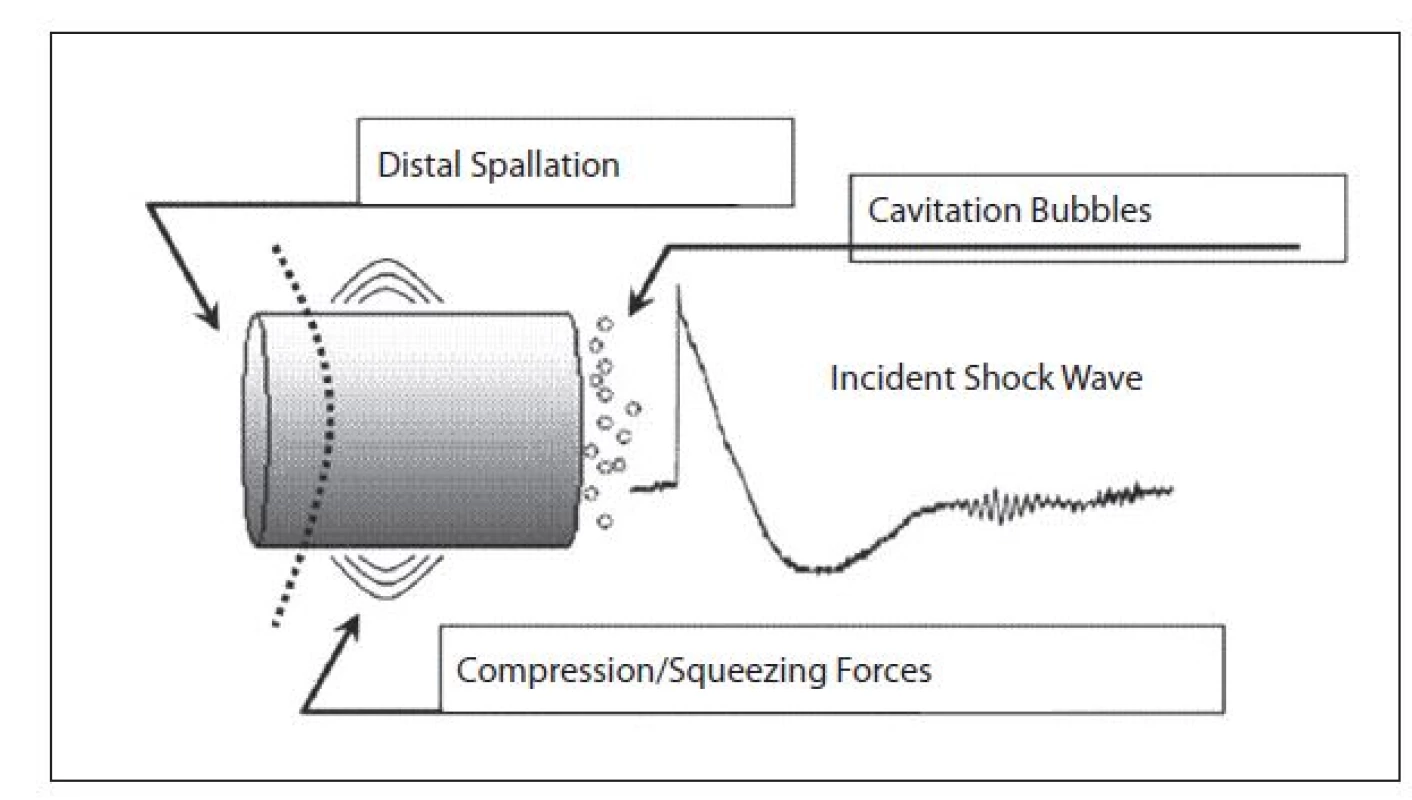
V literatuře se popisuje hned několik fenoménů podílejících se na fragmentaci konkrementů. Komprese s erozí na přední stěně konkrementu, tříštění, stlačení, únava a kavitace (obr. 3, 4). Tříštění (spall, Hopkinsonův efekt) se prosazuje při průchodu vlny konkrementem na rozhraní akustických odporů a uplatňuje se hlavně na distálním povrchu. Původně pozitivní vlna se mění v negativní. Tím dojde k narušení vnitřního napětí v konkrementu a fragmentaci (3, 5). Stlačení (squeezing, Hopkinsonův efekt) je fenomén, působící kolmo na osu šíření rázu. Ten prochází konkrementem s odlišnou rychlostí než tekutinou kolem něj. Rozdíl tlaků mezi tekutým me-diem a tuhým prostředím způsobuje vyboulení a narušení struktury konkrementu. Dynamická únava (fatigue) se uplatňuje při opakovaných rázech, kdy již postupně vzniklé fisury se stávají lomnými liniemi fragmentace jako nejslabší místo litiázy (4). Kavitace je pro litotrypsi důležitý jev a je vektorem jak fragmentace konkrementů, tak nežádoucích účinků ESWL formou traumatizace tkání. Při průchodu rázové vlny dochází ve fázi negativní amplitudy k takovému podtlaku, který překoná kavitační práh a dojde působením tahových sil k porušení soudržnosti kapaliny. Takto vytvořené dutiny, naplněné zprvu vakuem, jsou závislé na trvání i velikosti těchto sil. Vznikají z větší části na proximálním pólu litiázy. Po skončení negativního tlaku se bubliny stávají nestabilními a prudce kolabují, čímž je prolomena stěna kavity a okolní tekutina vytryskne proti její kontralaterální stěně. Kapalina proudí nadzvukovou rychlostí a dochází ke vzniku vysoké teploty, kyslíkových radikálů a sekundárních rázových vln (6). Vzhledem k tomu, že kavitace vzniká ve vodním prostředí, což je i krev, týká se její destrukční působení i orgánů a je podmíněno hlavně vaskulárním poškozením (6). Pro praxi je žádoucí, aby podtlaková fáze rázové vlny, která se podílí na vzniku kavitace v průběhu ESWL, byla co nejmenší. Při dezintegraci rázovými vlnami má totiž větší význam jejich pozitivní komponenta.
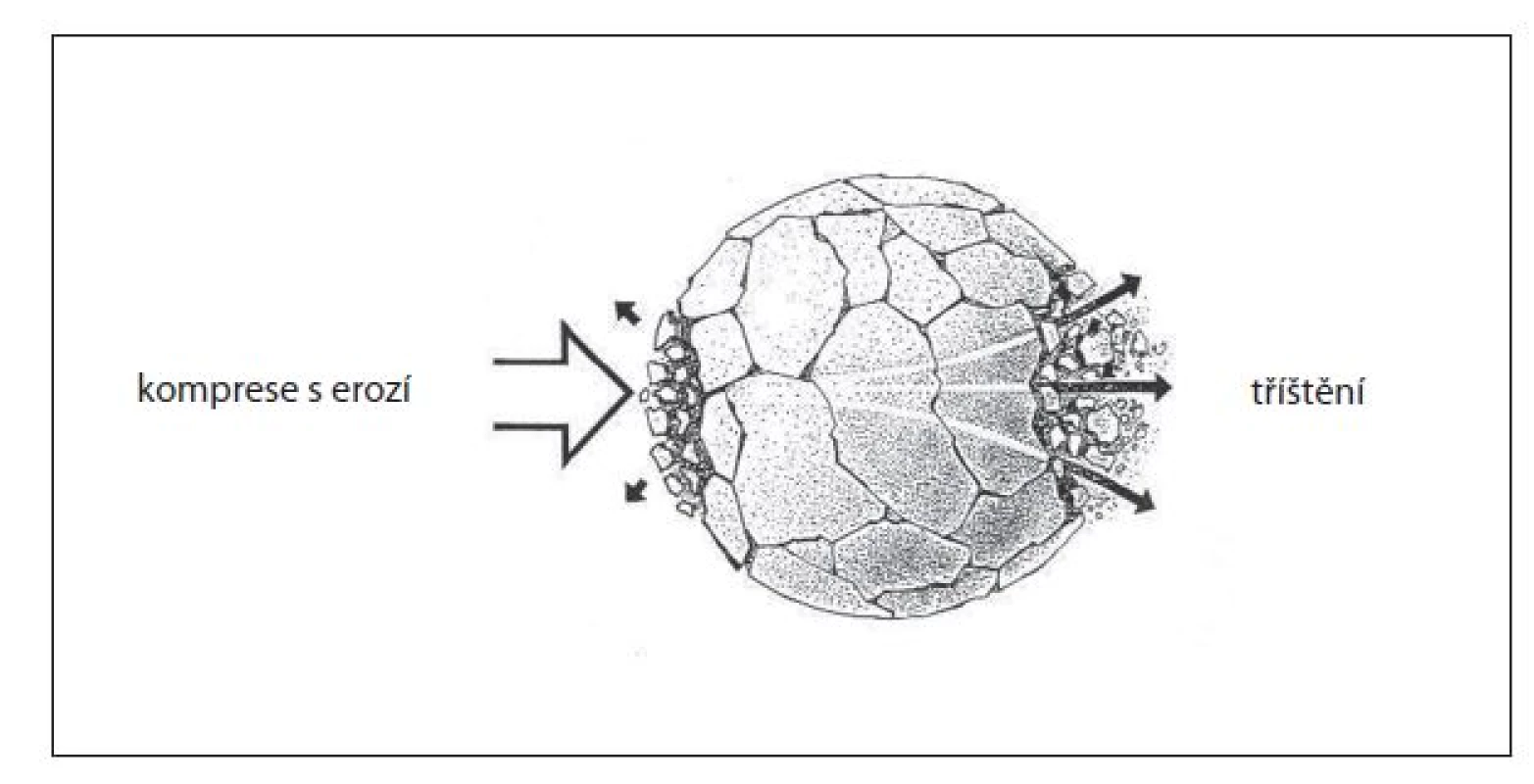
K rozpadu konkrementu dochází v momentě, kdy síly způsobené rázovou vlnou převýší síly komplexní poutající konkrement pohromadě.
TYPY LITOTRYPTORŮ
Výboj pro litotrypsi může z hlediska fyzikálního vznikat několika způsoby. V případě ESWL jako neinvazivní terapeutické modality se generuje výboj mimo tělo pacienta a je zacílen do tzv. ohniska. Chceme-li co nejefektivnější využití rázové vlny, je nutné ji zacílit přesně do ohniska (7). Navedení rázové vlny do tohoto místa se nazývá tzv. fokusace a lze k ní užít parabolických zrcadel, akustických čoček či reflektorů. Prostor okolo ohniska je nazýván fokální zóna (FZ) (7). Fokální zóna je pro každý přístroj jinak veliká a tvarově specifická. Většinou se jedná o elipsoid velikosti v řádu až desítek milimetrů. Všechny přístroje s užší FZ mají vyšší cílové tlaky v ohnisku. Prokázalo se ale, že úspěšnost dezintegrace konkrementu nezávisí ani na výkonu litotryptoru ani na hodnotách tlaků v ohnisku. Malý rozměr FZ je důvodem horší efektivity a vyšších nežádoucích účinků u přístrojů 3. generace (2).
Rázová vlna je přenesena od zdroje výboje přes membránu potřenou indiferentním gelem. Vany s vodní lázní a v ní ležící pacient se týkají přístrojů první generace a jsou již dnes obsolentní. V běžné praxi používáme nejčastěji tři typy generátorů: elektrohydraulický, piezoelektrický a elektromagnetický.
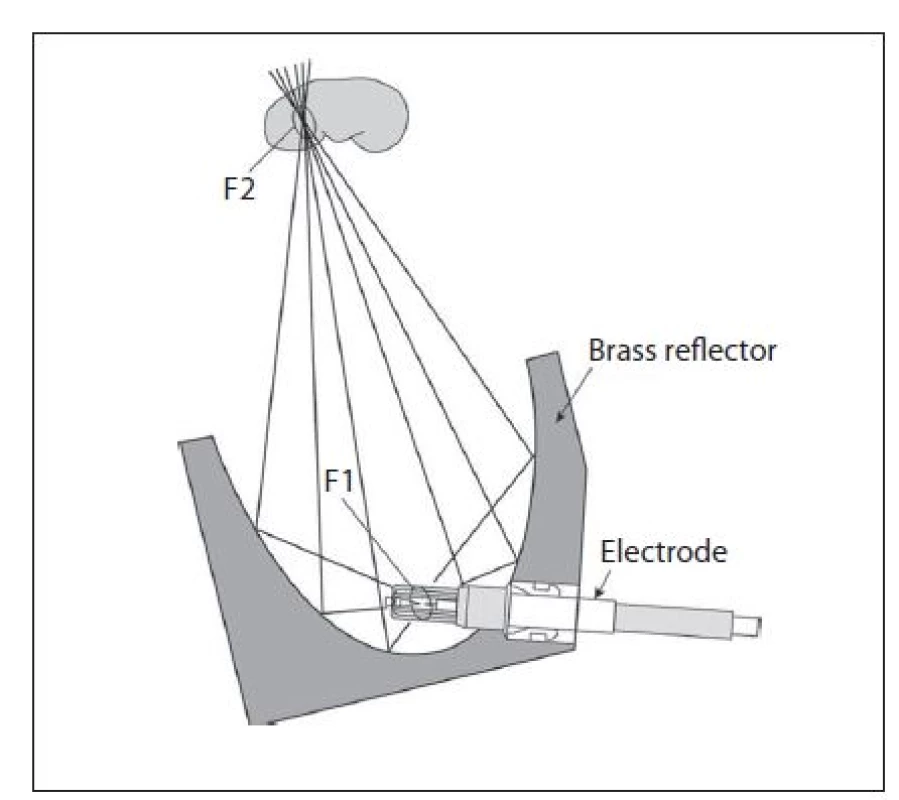
Elektrohydraulický generátor (jiskrový, „spark gap“) pracuje na principu intenzivního výboje mezi hroty elektrod v kapalině. Vzniká vaporizační bublina, která expanduje a záhy kolabuje. Nestlačitelností tekutiny dojde k utvoření tlakové vlny, která se propaguje všemi směry. Specifikum tohoto principu je zasažení ohniska dvěma frakcemi rázové vlny. Jedna se šíří přímo, druhá – o 30 µs opožděná – je vlna odražená od kovového fokusačního elipsoidu, a tím centralizovaná do ohniska (obr. 5). Je nutné hlídat nepřítomnost vzduchových bublin v místě vodného prostředí jiskřiště, které významně snižuje efektivitu rázové vlny a kalibraci hrotů elektrod, jejichž vybočení může zhoršovat fokusaci (6, 8). Tento typ generátoru se v běžné urologické praxi používá nejčastěji a má vysokou účinnost. Nevýhodou může být fluktuace tlaku mezi jednotlivými rázy a nutnost častějších výměn elektrod.
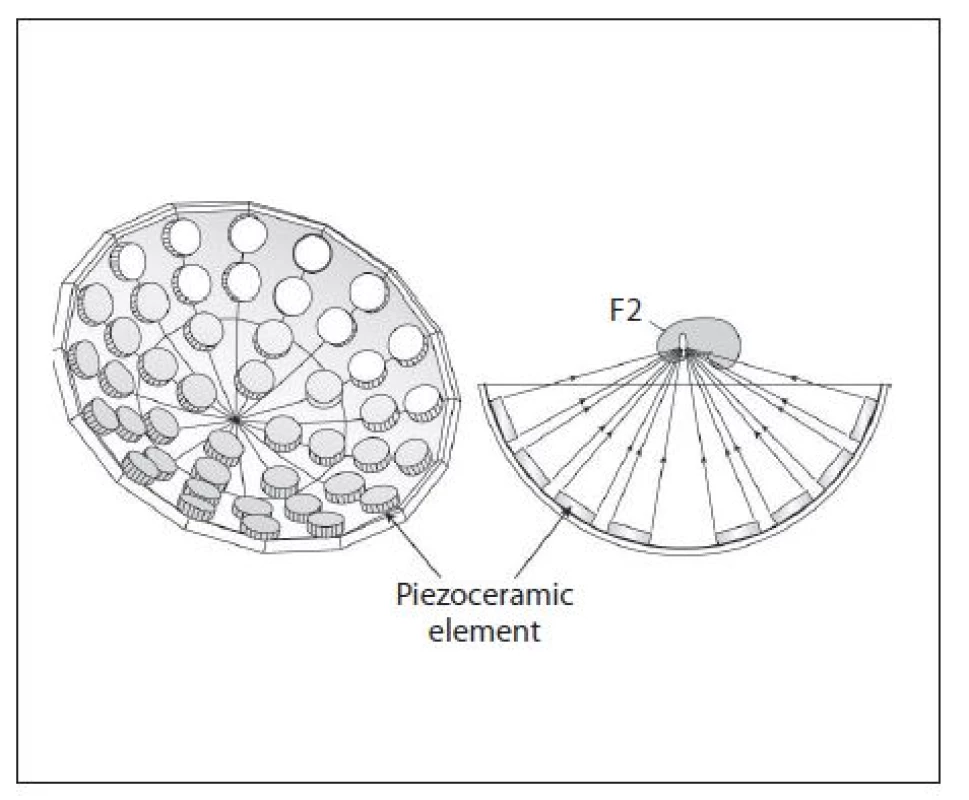
Piezoelektrický generátor vytváří rázovou vlnu deformací piezoelektrického krystalu. Těchto krystalů je umístěno na parabolické polokouli 300–3000 (obr. 6). Toto umístění umožňuje fokusaci a konvergenci. Specifikem pro tento typ generátoru je malý rozměr ohniska a doznívající oscilace po vlastním vzniku akustické vlny. To může mít vliv na kavitaci v ohnisku. Zaměřování konkrementů je pod ultrasonografickou kontrolou. Výhodou je přesná fokusace, dlouhá životnost zdroje a minimální dyskomfort pacienta. Nižší energie ale znamená také nižší účinnost a potenciální častější potřebu opakované léčby (6, 8).
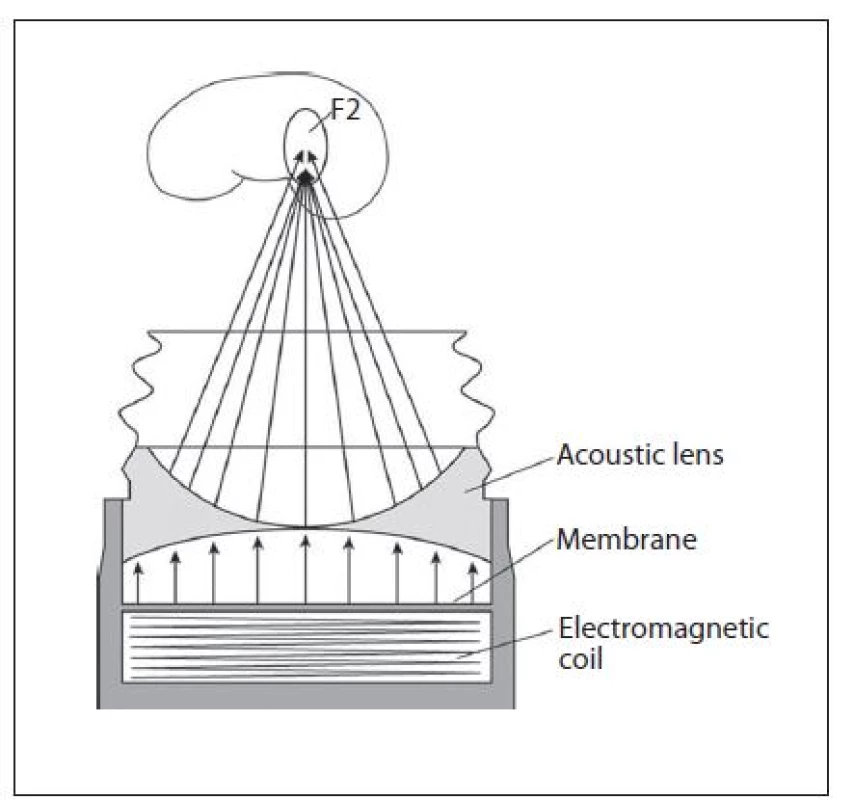
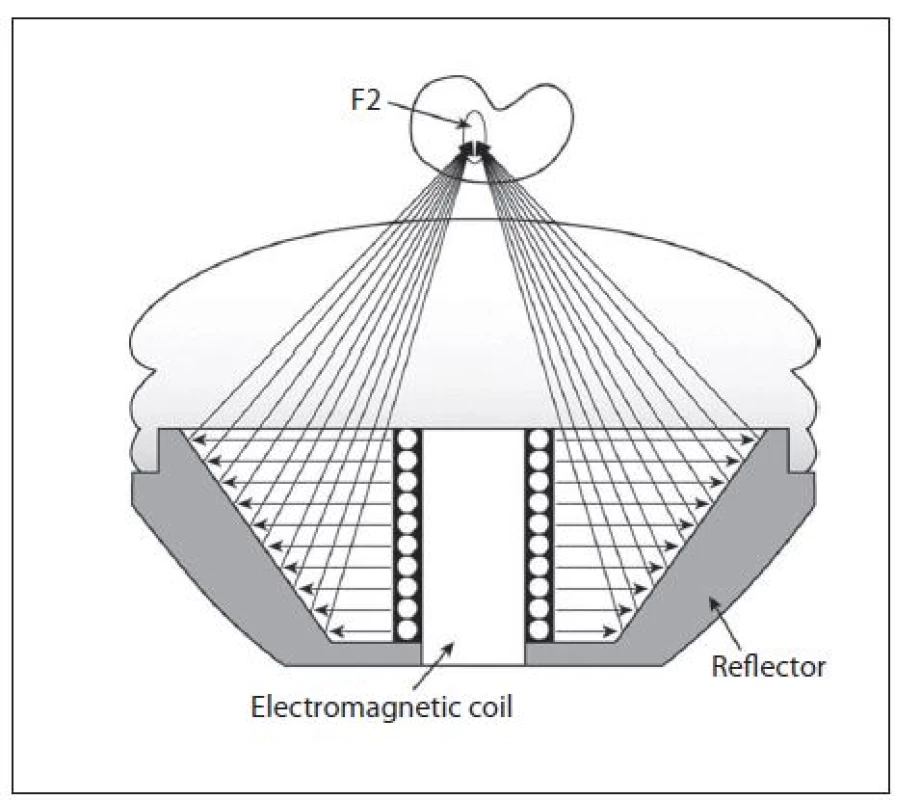
Elektromagnetický generátor požívá jako principu kmit kovové membrány spojené s cívkou proti vodnímu prostředí. Tento kmit vznikne působením magnetického pole za pomoci vysoké energie, která projde cívkou. Rozlišujeme plošnou rázovou vlnu, která je fokusována do ohniska pomocí akustické čočky (obr. 7), nebo cylindrickou rázovou vlnu, která je odrážena parabolickým reflektorem a transformována na sférickou vlnu (obr. 8). Elektromagnetický generátor produkuje slabší rázovou vlnu než elektrohydraulický generátor a vzhledem k rozložení energie na větší plochu je výkon pro pacienty méně bolestivý. Je u něj vyšší riziko vzniku subkapsulárního hematomu (3,1 %) než u elektrohydraulického (0,6 %). Elektromagnetický litotryptor mívá velkou fokální zónu (kolem 80 × 15 mm). Přístroj nemá obtížnou údržbu (6, 8).
Obrázky 5 až 8 převzaty z Wein A, Kavoussi L, et al. Campbell-Walsh Urology, 9th ed. Philadelphia: Saunders 2007.
INDIKACE A PREDIKCE ÚSPĚŠNOSTI ESWL
Indikační kritéria k řešení urolitiázy formou extrakorporální litotrypse se částečně překrývají s endoskopickými a velmi vzácně operativními postupy. Alternativy by neměly být brány jako vyloženě si konkurující metody, ale spíše jako jednotky komplementární. Jedná se především o perkutánní extrakci konkrementu a ureterorenoskopii se stoupajícím významem ve světle stále častěji používaných flexibilních přístrojů. Dnes je stále velká část urolitiáz řešena metodou ESWL (9). Jedná se zejména o nefrolitiázu, ureterolitiáza je preferována k litotrypsi extrakorporální vlnou častěji, nachází-li se proximálně. Rozhodujícím faktorem pro volbu metody léčby je lokalizace a velikost konkrementu. Důležité jsou také anatomické dispozice v okolí a případně očekávané vlastnosti kamene na základě známého mineralogického složení (odolné na ESWL jsou cystin, whewellit a brushit) (10). Nezanedbatelné jsou také zvyklosti, materiální zázemí a zkušenosti daného pracoviště a v neposlední řadě preference pacienta. Dle doporučení nefrolity nad 2 cm a odlitkové konkrementy by měly být odstraněny spíše pomocí perkutánní extrakce konkrementu. U litiázy v proximálním močovodu do velikosti 1 cm se preferuje pokus o ESWL, jakož i u nefrolitiáz pod 2 cm. U ureterolitiáz větších než 1 cm hrozí riziko steinstrasse a preferuje se ureterorenoskopické řešení. Distální ureterolitiázu je možné drtit rázovou vlnou, ale zvláště u kamenů větších než 1 cm se pro větší efektivitu dává přednost ureterorenoskopii (10).
Faktorů určujících úspěšnost ESWL je více. Mimo již výše zmíněný mineralogický typ konkrementu je významným nezávislým prediktivním faktorem rozhodujícím o účinné fragmentaci velikost a umístění konkrementu. S rozměry litiázy nad 1 cm klesá úspěšnost ESWL (13). Pochopitelnou komplikací jak při zaměření, tak při samotném výkonu může představovat netypická anatomie pacienta a hyperstenický habitus. Četnost odstranění nefrolitu, tzv. stone-free rate, u kamene do velikosti 1 cm pomocí ESWL je asi 75 %, u PNL 100 %, u nefrolitů větších než 1 cm je stone-free rate jen 52 % pro ESWL a 90 % metodou PNL (11). Obecně je přijímáno, že terapie extrakorporální rázovou vlnou na nefrolitiázu v dolním kalichu má menší procento úspěšnosti. Nedostatečný efekt je popisován až u 35 % případů (12). Významu tato skutečnost nabývá hlavně proto, že dolní kalich bývá predilekčním místem tvorby konkrementů v ledvině. Podle některých autorů jsou pro úspěšnost terapie konkrementů v dolním kalichu důležité geometricko-anatomické faktory. Hodnotí při tom šířku a délku kalichu jako i infundibulopelvický úhel (12). Denzita konkrementu na CT zobrazení se ukazuje jako velmi přínosná metoda pro odhad odezvy na terapii. Většinou se jako hranice označuje 1000 HU (Hounsfieldových jednotek), kdy pod tuto hranici se fragmentuje s úspěchem až 95 % konkrementů, zatímco nad 1000 HU jen 55 %. Někteří autoři popisují jako hranici dokonce 750 HU, kdy zjistily, že nad touto hranicí je 10krát větší riziko opakované léčby rázovou vlnou ve třech a více sezeních (13, 14). Významná je i korelace mezi BMI a úspěchem terapie. U obézních pacientů se pro množství adipózní tkáně zvětšuje vzdálenost od ohniska, tzv. SSD (skin to stone distance), a zvláště hodnoty přesahující 10 cm výrazně zhoršují úspěšnost. Je prokázáno, že pacienti s BMI nad 30 mají významně nižší šanci úspěšné fragmentace (13).
ESWL nachází uplatnění i v jiných indikacích, než je terapie močových kamenů, ať už v rámci samotné urologie, či v jiných medicínských oborech. Využití je však zatím spíše okrajové.
KONTRAINDIKACE ESWL
Mezi současné absolutní kontraindikace patří nekorigovaná koagulopatie, gravidita, floridní infekce močových cest a obstrukce močových cest distálně od konkrementu (12, 15). Gravidita je jednoznačnou kontraindikací vzhledem k tomu, že zvláště při výkonech v distálních partiích urotraktu hrozí vysoké riziko abortu (16). Moran ve své experimentální studii prokázal teratogenní vliv rázových vln na kuřecí embrya, podle jiných prací prováděných na laboratorních krysách se ale teratogenní efekt nepotvrdil (15). Relativní kontraindikace s nutností individuálního posouzení představují korigovatelná koagulopatie, aneurysma abdominální aorty, morbidní obezitu a těžké skeletální malformace (15). Při kalcifikovaném aneurysmatu aorty je nutné dodržování bezpečného průběhu, jehož podmínky definoval Carey. Kalcifikované aneurysma by nemělo být hemodynamicky významné, nemělo by být větší než 5 cm a od ohniska by mělo být vzdáleno přes 5 cm (18). Kardiální pacemaker dnes není kontraindikací, vhodné je ale konzultovat při plánování arytmologa a předem zajistit odborné přeprogramování přístroje na režim bezpečný pro provedení výkonu. U moderních litotryptorů je tzv. trigger, který zajišťuje při snímání EKG iniciaci vzniku rázové vlny ve fázi plató kardiálního vzruchu lokalizovaného za QRS komplex. V této fázi aktivity kardiomyocyt není příliš vulnerabilní pro vznik dysrytmií. Při absenci tohoto mechanismu by dle předpokladu mohly hrozit komorové extrasystoly (15). I přes tuto teorii se dnešní studie zabývající se problematikou dysrytmií při ESWL kloní k názoru, že i aplikace rázů bez synchronizace je u zdravého pacienta bez poruch kardiálního rytmu bezpečná (24).
PŘEDOPERAČNÍ PŘÍPRAVA A PRŮBĚH VÝKONU
Při plánování extrakorporální litotrypse je vhodné mít představu o anatomických poměrech vývodných cest močových a lokalizaci konkrementu. K tomu slouží nejčastěji ultrazvuk, nativní nefrogram, nativní či kontrastní CT, méně často IVU. Nutné je vyšetřit KO, koagulační parametry, odebrat moč na kultivaci, případně fyzikálně vyšetřit pacienta a posoudit potencionální překážky výkonu. V rámci přípravy na litotrypsi by měl mít pacient provedeno předoperační vyšetření včetně standardního záznamu EKG. Je nutná adekvátní analgetizace pacienta, aby potenciální podvědomý úhyb před rázovou vlnou byl maximálně limitován, a zaměřený konkrement tak zůstal v ohnisku (19). V průběhu výkonu je tuto lokalizaci vhodné opakovaně ověřovat. Dostatečná analgezie také umožňuje u algicky reagujících pacientů aplikovat adekvátní energii potřebnou pro trypsi litiázy. Neexistuje standardizovaný protokol, který by určoval, jaká analgetika podat při ESWL. Nejčastěji se používají spazmolytika, nesteroidní antiflogistika, opiáty (fentanyl, alfentanyl) hypnotika (midazolam) či lokální anestezie (EMLA gel aplikován cca hodinu před výkonem je směsí prilocainu a lidocainu). Někteří autoři popisují i užití inhalační anestezie (19).
Po uložení pacienta na pohyblivé lůžko zaměříme konkrement co nejpřesněji pomocí více rovin RTG zobrazení a případně pod USG kontrolou. Je nutné dbát na adekvátní kontakt pacienta s vakem naplněným vodním médiem, a zajistit tak optimální přenos rázové vlny. Vícečetné studie ukazují benefit z nastavení nižší energie při začátku výkonu s její postupnou eskalací. Dochází nejen k navyknutí pacienta na rázy, a tak omezení jeho dislokace z ohniska, nýbrž i k vazokonstrikci na úrovni ledviny, a tím k její přípravě na rázové vlny s vyšší intenzitou (21). V Lambertově prospektivní studii byli pacienti řazeni do skupiny s postupnou eskalací energie (500 rázů 14 kV, 1000 rázů 16 kV a 1000 rázů 18 kV) a do skupiny s fixní strategií 2500 rázů při 18 kV. Po výkonu se pozoroval stone-free rate a β2-mikroglobulin s mikroalbuminem v moči. Výsledky ukázaly lepší protektivní efekt na ledvinu u ramene s eskalující voltáží, ale také lepší výsledky týkající se fragmentace konkrementů (20). Handa a kol. testoval na modelu prasat tři postupy. Aplikoval 100, resp. 500 úvodních rázů s napětím 12 kV a poté s tříminutovou pauzou 2000 rázů s napětím 24 kV. Třetí skupina obdržela 2000 rázů od úvodu s 24 kV. Po výkonu se měřila clearens inulinu k posouzení glomerulární filtrace a histologické poranění ledviny. Zatím co GFR byla ve všech skupinách podobná, ve skupině s postupnou eskalací s pauzou bylo signifikantně menší rozsah poranění tkáně ledviny. Obdobný pokus s pauzou pouze 10 s mezi eskalací dávky energie v prvních dvou ramenech nezaznamenal dostatečnou ochranu ledvinného parenchymu (34).
Po provedení výkonu je nutné pacienta sledovat, kontrolovat jeho TK a tepovou frekvenci, moč a vyšetřit ultrasonograficky ledviny k vyloučení potenciálního poškození a krvácení.
Dle obecných doporučení by neměla léčba probíhat ve více než 3–5 sezeních, a pokud je opakovaně terapie neúčinná, měla by se zvolit jiná alternativa léčby. Interval mezi jednotlivými výkony není přesně definován, avšak u ureterolitiáz je možné provádět zákrok s odstupem 24–48 hodin (10). Delší interval je vhodné ponechat u elektrohydraulických a elektromagnetických generátorů oproti piezoelektrickým (12).
BIOLOGICKÝ EFEKT RÁZOVÉ VLNY NA TKÁNĚ A KOMPLIKACE ESWL
Bioefekt rázových vln na tkáně s sebou přináší kromě pozitivního vlivu na terapeutické řešení litiázy nesporně i negativní působení na okolní struktury. Tyto negativní vlivy, jak již bylo popsáno, jsou zprostředkovány především jevem kavitace. Ke snižování potenciálních nežádoucích účinků u nových přístrojů je snaha o zkracování negativní vlny, a tím ovlivnění vzniklé tahové síly. Díky tomu se vytvořené bubliny nemají čas rozšířit, než dojde k jejich kolapsu kompresivní vlnou, a je tak částečně potlačen nežádoucí vliv kavitace (22, 23). Rozdělení nežádoucích účinků ESWL lze klasifikovat z více pohledů: akutní a chronické, vliv rázových vln z pohledu jednotlivých orgánů či rozdělení: na poškození reverzibilní a ireverzibilní. Časné negativní vlivy nejčastěji zahrnují potíže s eliminací konkrementů, infekční komplikace, krvácení včetně renálního hematomu, kardiovaskulární patologie, gastrointestinální komplikace a vliv na gonády. Pozdní komplikace zahrnují potenciální snížení renálních funkcí, výskyt hypertenze a vliv na fertilitu. Predisponujícími faktory vzniku komplikací jsou tvrdé, velké a vícečetné kameny, kameny lokalizované ve spodním kalichu, atypická renální anatomie a při samotném výkonu zvýšená frekvence rázů, počet rázů, napětí a přesnost zaměření. V dalším textu budou rozděleny nežádoucí účinky ESWL na vliv na fertilitu a těhotenství, infekční komplikace, potíže spojené s fragmentací a eliminací konkrementu a negativní efekty na jednotlivé tkáně.
VLIV NA FERTILITU A TĚHOTENSTVÍ
Potenciálně teratogenní vliv na plod těhotných matek a na potratovost byl popsán v kapitole o kontraindikacích. Určitý experimentální výzkum byl v minulosti vyvinut v oblasti definování potenciální bezpečnosti terapie ESWL v průběhu gravidity u proximálně lokalizovaných konkrementů (26). Možnosti jiných, v těhotenství bezpečných modalit řešení urolitiázy však podporují obecně uznaný konsenzus – absolutní kontraindikace ESWL v průběhu gravidity. V minulosti v literatuře často uváděné potenciální riziko terapie ESWL distálních urolitiáz na fertilitu u mladších žen se nepotvrdilo. EAU guidelines v současnosti nedávají doporučení neindikovat terapii rázovou vlnou u žen ve fertilním věku (10).
INFEKČNÍ KOMPLIKACE
V průběhu drcení konkrementu dochází k vaskulárnímu poškození a zvyšování tlaku v pánvičce. To umožňuje vniknutí potenciálně přítomných bakterií z dutého systému ledviny či močovodu do krevního oběhu na podkladě pyelovenózního a pyelolymfatického refluxu. Klinický obraz může oscilovat od zcela inaparentního průběhu až po septické projevy. Bakteriurie byla nalezena u 7–23 % pacientů, kteří podstoupili ESWL včetně těch, kteří neměli infekční konkrement. Klinické propuknutí infekce po zákroku je mnohem častější u velkých, infekčních nebo odlitkových kamenů a u pacientů, kteří jsou po urologické instrumentaci (mají zavedený ureterální stent, nefrostomie apod.) (25). Bakteriemie vzniká v průměru u 14 % pacientů po ESWL, propuknutí urosepse se objeví ale jen u méně než 1 % pacientů. Vyšší riziko sepse je u ledviny s obstrukcí (27). Role rutinní antibiotické profylaxe je diskutabilní. Podle současných doporučení je vhodné antibiotickou prevenci podat u terapie infekčních konkrementů, pochopitelně při pozitivní kultivaci moči, u jedinců s recidivujícími uroinfekty v anamnéze a pacientům po urologické instrumentaci se zavedeným stentem, nefrostomií nebo permanentním katetrem (10, 12, 25).
KOMPLIKACE FRAGMENTACE A ELIMINACE KONKREMENTU
Nežádoucí účinky spojené s fragmentací a eliminací konkrementu zahrnují inkompletní fragmentaci, reziduální konkrementy, steinstrasse a obstrukci. Procento těchto komplikací závisí mimo jiné na velikosti drceného kamene a průměrně se pohybuje kolem 15 % (8). Výrazný vliv na fragmentaci mají i habitus pacienta a mineralogické vlastnosti litiázy. Velmi rezistentní na extrakorporální litotrypsi jsou především cystin, brushit a kalcium-oxalát monohydrát. Ač je ESWL účinná i u ureterolitiáz, lepšího efektu dosahuje u proximálních konkrementů v porovnání s distálními, a v této lokalizaci je optimálně indikována při velikostech ureterolitů do 1 cm (29). Frekvence rázových vln v průběhu výkonu může být nepřímo úměrná míře fragmentace (30). Mechanismus účinku je opět v závislosti na jevu kavitace. Při rychlejší frekvenci rázů mají šířící se vlny v cestě vakuum z kavitačních bublin. Kavitační bublina může při časném příchodu dalšího rázu část energie pohltit. Snížení frekvence umožní kolaps nebo rozptýlení bublin v době příchodu dalšího rázu (30). Vlivem nižší frekvence můžeme ale docílit i nižších negativních dopadů na okolní tkáně. Při dostatečném času pro zánik kavitačních bublin není další rázová vlna částečně rozptýlena plynem na okolní tkáň a většina energie míří na konkrement. V současnosti se doporučuje optimální frekvence 60 rázů za 1 minutu (10, 12, 30). V kapitole o předoperační přípravě jsem zmiňoval postupný nástup napětí na začátku drcení jako faktor minimalizace rizika poškození tkání. Tento postup zvyšuje i šanci odchodu konkrementu (20).
Prokázalo se, že při retenci zbytkového fragmentu pod 4 mm po ESWL je více jak 40% pravděpodobnost vzniku potřeby navazující intervence nebo alespoň symptomatické následné epizody v průběhu 2 let (28). Po ESWL může vzniknout renální kolika, způsobená zaklíněním fragmentu v distálních partiích vývodných močových cest. Po výkonu se doporučuje expulzivní terapie dle příslušných doporučení, pokud není efektivní a dochází k obstrukci s bolestivostí či vznikem teplot, je nutný desobstrukční výkon (10).
NEGATIVNÍ DOPAD ESWL NA JEDNOTLIVÉ TKÁNĚ
Účinky rázové vlny na tkáně mohou být strukturální i funkční a můžeme je rozdělit na akutní nebo chronické. Za příčinu poškození je považován kavitační efekt.
Makroskopická hematurie vyskytující se zcela pravidelně po ESWL je způsobena fokálním traumatem ledviny na vaskulární úrovni, nikoliv dříve zvažovaného poškození urotelu (12). Hematurie po výkonu odezní sama většinou v řádu hodin až několika dnů. Závažnější komplikaci, ač relativně vzácnou, představuje intrarenální, subkapsulární nebo perirenální hematom. Objevuje se klinicky v méně než 1 % případů (15). Po zavedení nových generací přístrojů s menším ohniskem a vysokou pozitivní vlnou rázu se míra hematomů zvýšila na 3–12 %. Toto se zdá jako varující trend ve vývoji modernizace extrakorporálních litotryptorů (30). Studie ale prokázaly, že pokud se prováděl monitoring po výkonech pomocí CT nebo NMR, byl výskyt subklinických hematomů až 25 %, a to i u přístrojů první generace (15). Ze strany pacienta je predisponujícím faktorem koagulopatie, trombocytopenie, solitární ledvina a rizikové faktory aterosklerózy – věk, diabetes mellitus, hypertenze, obezita a koronární onemocnění (12). Terapie renálních hematomů je ve velké většině konzervativní bez nutnosti nefrektomie a ke vstřebání dojde během 6 týdnů až půl roku. Velmi vzácně jsou popisovány poranění okolních orgánů včetně poranění jater, skeletální svaloviny, velkých cév, ruptury sleziny, kolon či pankreatu s následnou pankreatitidou (12, 15).
Chronické komplikace představují zvažovaný vliv na recidivitu konkrementu, potenciální snížení renálních funkcí. Spojujícím faktorem těchto komplikací je zřejmě fibrotizace tkáně v oblasti ohniska po akutním renálním poškození důsledkem ESWL (30). Při porovnání s metodou PNL je u pacientů po ESWL také větší míra recidivity litiázy v průběhu 1 roku od léčby a častěji je tvořena mineralogicky kalcium-fosfátem (12). Poškození ledvinného parenchymu lze prokázat ztrátou N-acetyl-β--D-gukosaminidázy do moči, jakožto specifického tubulárního markeru (31).
Možnost, že terapie extrakorporální rázovou vlnou může mít souvislost se vznikem hypertenze, poprvé vyslovil Peterson a Finlayson v roce 1986. Lingeman později vypracoval práci podporující tuto teorii. Přesto v současnosti nemáme jednoznačné validní data dle EBM prokazující souvislost vzniku hypertenze a terapie rázovou vlnou (10).
DOPORUČENÍ PRO ZLEPŠENÍ EFEKTIVITY A SNÍŽENÍ NEŽÁDOUCÍCH ÚČINKŮ
Na základě zjištěných dat ze studií a objasnění fyzikálních principů je potřebné definovat kroky, které by na jedné straně pomohli zefektivnit terapii, a na straně druhé eliminovaly potenciálně nežádoucí účinky. Velmi perspektivní metodou se jeví předoperační posouzení denzity konkrementu a SSD (skin to stone distance) pomocí CT. Tímto způsobem je možné rámcově předpovědět efekt terapie a případně se při rozhodování o způsobu léčby vyhnout zbytečným pokusům o ESWL. Nebo naopak se konkrement může defragmentovat poměrně rychle a pacienta nevystavovat zbytečně vyšší dávce rázové energie, než je nebytné. Rozhodneme-li se o terapii rázovou vlnou, je potřebné pro zajištění optimální efektivity zajistit vhodné prostředí pro transport rázové vlny do ohniska. Nezbytná je kontrola dobrého kontaktu pacienta s vakem a důsledné odstranění bublin jak z vodního vaku, tak z gelu spojujícího vak s pacientem. Pokud se tento postup nedodrží, i velmi drobné bubliny vzduchu jsou schopné významně snížit efektivitu výkonu. K tomuto účelu se doporučuje gel nanášet přímo z nádoby, nikoliv rukou (10). Analgetizace pacienta před výkonem zajistí jeho pohybový klid a minimální nutnost úpravy zaměření v průběhu výkonu. Lokálně na kůži se doporučuje EMLA gel, předoperačně nejlépe krátkodobě působící opiáty případně nesteroidní antiflogistika. Pečlivé zaměření konkrementu je samozřejmostí, velmi vhodné jsou ale průběžné kontroly polohy ohniska s případnou úpravou polohy. Zvláště u mladších pacientů si musíme uvědomovat rentgenovou zátěž, které je pacient vystaven v průběhu zaměřování (nepoužíváme-li pro zaměření ultrazvuk). Vhodné je používání ochranných pomůcek na gonády, užívání clony v C rameni rentgenu pro zmenšení ozařovaného pole a užívat RTG jen po nezbytně nutnou dobu. Chceme-li zlepšit efektivitu výkonu, můžeme pacientům aplikovat dechový pás, který sladí rázové vlny nejen se srdeční aktivitou, ale i s dechovou frekvencí, a omezí tak prošlé rázové vlny mimo ohnisko v důsledku dechových exkurzí. K ochraně ledvinného parenchymu, jak bylo popsáno, přispěje i frekvence rázů kolem 60/min a pozvolný nástup napětí v počátečních výbojích výkonu. Po konci drcení je nutné pacienty sledovat k vyloučení závažných komplikací a provést ultrasonografickou kontrolu ledviny. Pro zlepšení eliminace fragmentů je výhodné podat pacientům expulzivní terapii dle doporučení EAU guidelines s největším významem alfablokátorů. Rutinní stenting není indikován, nezlepšuje stone-free rate a dokonce omezuje peristaltiku močovodu a u urgentní ESWL se nedoporučuje (10). Přesto může předcházet obstrukčním komplikacím a vzniku koliky hlavně u větších konkrementů, kde hrozí steinstrasse. ATB profylaxe byla popsána v kapitole o infekčních komplikacích ESWL.
ZÁVĚR
Terapie litiázy extrakorporální rázovou vlnou byla nesporně zásadním pokrokem směrem k neinvazivní a zároveň účinné léčbě. Míra úspěšnosti je měřena pomocí stone-free rate a průměrně se u ESWL udává kolem 75 %. V současné době dochází paralelně k významnému rozvoji ureterorenoskopie, zvláště pomocí flexibilních přístrojů, což v indikaci terapie ureterolitiázy nabízí plně rovnocennou alternativu k ESWL. Za hlavní příčinu poranění okolních tkání při extrakorporální litotrypsi se označuje jev kavitace. Zcela určitě se ale nejedná o jediný mechanismus, kterým dochází k poškození okolních struktur. Komplikace a nežádoucí účinky jsou v kontextu s velkou indikační šíří této metody a počtem výkonů velmi řídké a lze říci, že ESWL má dobrý bezpečnostní profil. Přesto je možné velký počet faktorů způsobujících komplikace ovlivnit, ať už při samotném výkonu, nebo již v rámci indikace. Je proto nutné, aby velký počet lékařů, který tyto výkony provádí, byl seznámen se základními fyzikálními principy, bioefektem rázových vln na tkáně a s tím spojenými potenciálními riziky. S nežádoucími účinky souvisí i parametry, které neovlivňuje ani operatér ani samotný pacient. Jedná se o typ generátoru přístroje, velikost jeho fokální zóny a další vlastnosti litotryptoru, které definují potenciální rizika. Bohužel v současné době je patrné, že výrobci 3. generace litotryptorů se zřejmě nevydali zcela správným směrem, když se snažili o zvýšení tlaku v kombinaci se zúžením ohniska. To potvrzuje i stále jako zlatý standard uváděný přístroj 1. generace Dornier HM3 (30). Objevující se 4. generace přístrojů by mohla být příslibem ke zvýšení efektivity, nikoli však za cenu vyšších nežádoucích účinků. Ve vývoji jsou i tzv. duální přístroje, které používají dva zdroje rázových vln (33). Užitím duálního pulzu by mohlo docházet nejen ke zlepšení účinku, ale i snížení negativního bioefektu na tkáně. V této oblasti bude ale třeba ještě dalšího výzkumu k potvrzení povzbudivých výsledků.
Došlo: 25. 6. 2014.
Přijato: 13. 11. 2014.
Kontaktní adresa
MUDr. Leo Pšenčík
Urologické oddělení KNTB Zlín a.s.
Havlíčkovo nábřeží 600, 762 75 Zlín
e-mail: leopsencik@seznam.cz
Střet zájmů: žádný.
Sources
1. Cleveland RO, McAteer JA. The physics of Shock Wave Lithotripsy. In Smith AD, Badlani G, Bagley D, Clayman R, others a eds. Smiths Textbook of Endourology. Hamilton-London: BC Decker Inc 2006; 317–332.
2. Fógel K. Fyzikální základy extrakorporální litotrypse. Ces Urol 2010; 14 : 73–80.
3. Xi X, Zhong P. Dynamic photoelastic study of thetransient stress field in solids during shock wave lithotripsy. J Acoust Soc Am 2001; 109 : 1226–1239.
4. Eisenmenger W. The mechanisms of stone fragmentation in ESW: Ultrasound In Medicine And Biology 2001; 27 : 683–693.
5. Sass W, Braunlich M, Dreyer HP, et al. The mechanisms of stone disintegration by shock waves. Ultrasound Med Biol 1991; 17 : 239–243.
6. Štuka Č, Beneš J, Šunka P. Medicína rázových vln. Remedia populi 1998; 3(2): 6–19.
7. International standard. IEC61846 Ed. 1.0 en: Ultrasonics – Pressure pulse lithotriptors – Characteristics of fields, T. Ultrasonics, Editor 1998.
8. Vobořil V. LERV (litotrypse extrakorporální rázovou vlnou). In Dvořáček J. a kol. Urologie ISV. Praha: ISV 1998; 399–408.
9. Tomescu P, Mitroi G, Stoica L, Dena S, et al. Assessment of extracorporeal shock wave lithotripsy (eswl) therapeutic efficiency in Urolithiasis Department of Urology, University of Medicine and Pharmacy, Craiova; County Emergency University Hospital, Craiova. No 1, 2009.
10. Türk C, Knoll T, Petrik A, et al. European Association of Urology: Guidelines 2014 Edition: Guidelines on Urolithiasis.
11. Lingeman JE, Siegel YI, Steele B, et al. Management of lower pole nephrolithiasis: A critical analysis. J Urol 1994; 151 : 663–667.
12. Cambell-Walsh Urology. Philadelphia: Elsevier Souders, Tenth edition 2012; 1356–1408.
13. Pareek G, Armenakas NA, Panagopoulos G, Bruno JJ, Fracchia JA. Extracorporeal shock wave lithotripsy success based on body mass index and Hounsfield units: Urology 2005; 65 : 33–36.
14. Ji Woong Choi, Phil Hyun Song, Hyun Tae. Kim Predictive Factors of the Outcome of Extracorporeal Shockwave Lithotripsy for Ureteral Stones. Korean J Urol 2012; 53(6): 424–430.
15. Poršová M, Kaplan O, Pabišta R, et al. Ruptura sleziny, vzácná komplikace po LERV. Urologie pro praxi 2005; 5 : 213–215.
16. Vienweg J, Weber HM, Miller K, et al. Female fertility following extracorporeal shock wave lithotripsy of distal ureter calculi. J Urol 1992; 148 : 1007.
17. Erturk E, Ptak AM, Monaghan J. Fertility measures in women after extracorporeal shockwave of distal ureteral stones. J Endourol 1997; 11 : 315–317.
18. Carey SW, Streem SB. Extracorporeal shock wave lithotripsy for patiens with calcified ipsilateral renal arterial or abdominal aortic aneurysma. J Urol 1992; 148 : 18–20.
19. Bach C, Zaman F, Kachrilas P, et al. Drugs for pain management in shock wave lithotrypsy. Pain Res Treat 2011; 3, ID: 259426.
20. Lambert EH, Walsh R, Moreno MW, et al. Effect of escalating versus fixed voltage treatment on stone comminution and renal injury during extracorporeal shock wave lithotripsy: a prospective randomized trial. J Urol 2010; 183(2): 580–584.
21. Weizer AZ, Zhong P, Preminger GM. New concepts in shock wave lithotripsy. Urol Clin North Am 2007; 34(3): 375–382.
22. Williams JC, Woodward JF, Stonehill MA, et al. Cell damage by lithotriptor shock waves at high pressure to preclude cavitation. Ultrasound In Medicine and Biology 1999; 25 : 1445–1449.
23. Connors BA, Evan AP, Willis LR, et al. Separation of SWL-induced cavitation and renal injury from impairment of hemodynamics. J Urol 1998; 159: S32.
24. Lingeman JE, Newman DM, Siegel YI, et al. Shock wave lithotripsy with the Dornier MFL 5000 lithotriptor using an external fixed rate signal. J Urol 1995; 154 : 951–954.
25. Moody JA, Evans AP, Lingeman JE. Extracorporeal shockwave lithotripsy. In Weiss RM, George NJR, O’Reilly PH (eds.) Comprehensive Urology. Mosby International Limited 2001; 623–636.
26. Frankenschmidt A, Heisler M. Fetotoxicity and teratogenesis of SWL treatment in the rabbit. J Endourol 1998; 12 : 15–21.
27. Lingeman JE, Coury TA, Newman DM, Kahnoski RJ, Mertz JH, Mosbaugh PG, et al. Comparison of results and morbidity of percutaneous nephrostolithotomy and extracorporeal shock wave lithotripsy. J Urol 1987; 138 : 485–490.
28. Streem SB, Yost A, Mascha E. Clinical implications clinically insignificant store fragments after extracorporeal shock wave lithotripsy. J Urol 1996; 155 : 1186–1190.
29. Anagnostou T, Tolley D. Management of ureteric stones. Eur Urol 2004; 45 : 714–721.
30. Lingeman JE. Současnost extrakorporální lithotrypse. Urologické listy 2004; 2 : 8.
31. Perez-Blanco FJ, Arrabal, Martin M, et al. Urinary glycosaminoglycans after extracorporeal shock wave lithotripsy in patients with kidney lithiasis. Arch Esp Urol 2001; 54 : 875–883.
32. Ligeman JE, Kulb JB. Hypertension following extracoroporeal shock wave lithotrypsi. J Urol 1987; 137 : 142A.
33. Peschel R, Janetschek G, Frauscher F, Hofle G, et al. Does ESWL induce hypertension in the elderly? AUA 92nd Annual Meeting, April 12–17, New Orleans. In J Urol 1997; 157(Suppl): 272.
34. Handa RK, McAteer JA, Connors BA, Liu Z, Lingeman JE, Evan AP. Optimizig an escalating shock wave amplitude treatment stategy to protect the kidney from injury during shock wave lithotripsy. (dostupné z: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3749741/)
Labels
Paediatric urologist Nephrology UrologyArticle was published in
Czech Urology

2014 Issue 4
-
All articles in this issue
- Immunotherapy of prostate cancer
- Autonomic dysreflexia in patient after spinal cord injury
- Extracoporeal shock wave lithotripsy in current urological practice
- Use of multiparametric magnetic resonance imaging and comparison with other modern imaging methods in the preoperative diagnosis of prostate cancer
- Retrospective assessment of indication for surgical treatment of BPH in patients with cystolithiasis
- Assessment of the efficacy of extracorporeal shock wave lithotripsy using a EMSE 140f Dornier Compact Sigma electromagnetic generator, and determination of the effective energy dose
- Evaluation of erectile dysfunction after robotic assisted radical prostatectomy
- Primary amyloidosis of the ureter
- Ten commandments for novice congress speakers
- Czech Urology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Extracoporeal shock wave lithotripsy in current urological practice
- Use of multiparametric magnetic resonance imaging and comparison with other modern imaging methods in the preoperative diagnosis of prostate cancer
- Autonomic dysreflexia in patient after spinal cord injury
- Evaluation of erectile dysfunction after robotic assisted radical prostatectomy
