ONKOLOGICKÁ LÉČBA KARCINOMU PENISU Z POHLEDU RADIAČNÍHO ONKOLOGA
ONCOLOGICAL TREATMENT OF PENILE CANCER FROM THE POINT OF VIEW OF RADIATION ONCOLOGIST
Penile cancer is a rare tumour, however it has serious psychological and social consequences.The incidence of penile cancer increases with reaching with maximum in the sixth decade of life. The aetiological and epidemiological penile cancer risk factors are well recognized. Among them human papilloma virus infection, namely types HPV 16 and 18 is an important. Due to its low incidence about 1/100 000, there is limited experience with penile cancer therapy in most of urology or oncology departments. Randomised prospective studies are not available. Reports about surgical and other oncological therapy describe small studies with patients treated during long period. Early surgical treatment of penile lesions, and if possible of nodal metastases, plays an essential role in curing the disease and its prognosis. The review article highlights the importance of precise diagnosis and staging for the stratification of the patients and selection appropriate therapy according to risk and prognostic factors. The role of contemporary radiotherapy and chemotherapy in multimodal treatment of penile cancer is discussed. Additionally, personal experience with HDR brachytherapy in the treatment of 25 patients is discussed.
KEY WORDS:
Penile cancer, radiotherapy, brachytherapy, chemotherapy.
:
Hana Stankušová
:
Onkologická klinika 2. LF UK a FN Motol, Praha
:
Ces Urol 2015; 19(1): 19-32
:
Review article
Karcinom penisu patří mezi řídce se vyskytující onemocnění, avšak s významnými psychosociálními následky. Postihuje muže převážně vyššího věku s maximem výskytu v šesté dekádě života. Etiologické a epidemiologické faktory jeho vzniku jsou poměrně dobře známy. Významnou roli při vzniku nádoru hraje infekce HPV, zejména typy HPV 16 a 18. Vzhledem k nízké incidenci karcinomu penisu kolem 1/100 000 osob jsou na většině urologických a onkologických pracovišť malé zkušenosti s jeho terapií. Neexistují žádné prospektivní randomizované studie o jeho léčbě. Literární soubory o chirurgické a další onkologické léčbě, jako je radioterapie a chemoterapie, se týkají obvykle jen několika desítek pacientů léčených během dlouhého období. Časná chirurgická léčba lokálního nálezu a případného uzlinového postižení hraje podstatnou roli ve vyléčení a prognóze pacienta. Nechirurgická léčba karcinomu penisu je v českém písemnictví málo publikována. V přehledovém článku je zdůrazněna nutnost přesné diagnózy a stagingu pro stratifikaci pacientů do skupin ke vhodné léčbě podle rizika a prognostických faktorů. Dále je uveden pohled na současné možnosti a roli radioterapie a chemoterapie v léčbě karcinomu penisu. Stručně jsou také uvedeny vlastní zkušenosti s léčbou 25 pacientů ozářených pomocí HDR brachyterapie.
KLÍČOVÁ SLOVA:
Karcinom penisu, radioterapie, brachyterapie, chemoterapie.
ÚVOD
Karcinom penisu v Evropě a v Severní Americe patří mezi řídce se vyskytující nádory s incidencí méně než 1/100 000 osob (1). V některých zemích Afriky, Jižní Ameriky a Asie je jeho incidence až několikanásobně vyšší. V Brazílii je např. uváděna jeho incidence 8,3/100 000 osob. V Ugandě jde dokonce o nejčastěji diagnostikovaný zhoubný nádor u mužů (2). Incidenci a mortalitu karcinomu penisu v České republice v období let 1998–2010 ukazuje graf 1 (údaje ze SVOD). Průměrně je v ČR ročně hlášeno asi 90 nových případů a přibližně jedna třetina jich na tuto diagnózu umírá. Výskyt karcinomu penisu je věkově závislý. Podle údajů SVOD je jeho výskyt ve věku 70 let 5/100 000 osob a ve věku nad 80 let již dokonce 10/100 000 osob.

ETIOLOGICKÉ A EPIDEMIOLOGICKÉ RIZIKOVÉ FAKTORY
Časná diagnóza karcinomu penisu je bohužel často promeškána, protože nádor je vzácný a praktický lékař nebo i urolog se s ním v praxi setká jen zřídkakdy. Příčina pozdní diagnózy často také spočívá v pacientovi, který se ostýchá a k lékaři přichází v průměru s roční prodlevou, i déle. Přitom platí, že čím časnější je diagnóza, tím je léčba účinnější, méně mutilující a je větší šance na uzdravení. Proto je zcela zásadní, aby každá eroze, bolák, vřídek, změna barvy na žaludu penisu, na předkožce či na těle penisu byly řádně vyšetřeny. Je pravděpodobné, že většina takových změn je bakteriální, mykotické nebo alergické etiologie a bude vyléčena odpovídajícími léky. Pokud se afekce nehojí nebo vzniká opakovaně, pak je nutné provedení biopsie k histologickému ověření. Karcinom penisu obvykle vzniká z epitelu vnitřní strany předkožky nebo na žaludu. Nádory na kůži těla penisu jsou velmi zřídkavé. Symptomy, kterými se nádory penisu manifestují, jsou: vznik nádorové většinou ulcerózní léze, bolest, svědění, krvácení, močové obtíže, sekundární infekce s výrazným zápachem, zvětšené tříselné uzliny. Nádor může růst infiltrativně, ulcerózně, plazivě nebo může mít papilárně exofytický růst.
Existuje několik rizikových faktorů podporujících vznik nádoru. Nejčastější příčinou je chronické dráždění v oblasti žaludu a předkožky. Uváděna je zejména fimóza spojená s hromaděním smegmatu, které samo o sobě není kancerogenem, ale při špatné osobní hygieně působí iritaci žaludu a předkožky, a tím vyvolává chronické zánětlivé procesy penisu (3, 4). Karcinom penisu se nevyskytuje u obřezaných mužů, kde obřízka byla provedena v útlém dětském věku. Obřízka provedená v pozdějším věku již nemá protektivní vliv vůči vzniku karcinomu penisu. Dále je mezi příčinami podporujícími vznik karcinomu uváděna léčba psoralenem nebo UV fototerapie při léčbě psoriázy (5), condylomata accuminata v anamnéze, množství sexuálních partnerů a nízký věk při zahájení pohlavního života, kouření (4).
Většina karcinomů penisu patří do skupiny dlaždicových (skvamózních) karcinomů. Invazivním dlaždicovým karcinomům zpravidla předcházejí prekurzory těchto tumorů. Prekancerózy dosud nazývané jako Erythroplasia Queyrat, Morbus Bowen, Pagetova choroba, Giant condylomata (Buschke-Löwenstein) se asi v 1/3 zvrhnou v invazivní spinocelulární karcinom (7). Uvedené pojmy však jednoznačně nedefinují jednotlivé typy preneoplastických změn tak, aby odrážely nové poznatky o etiologickém vztahu k HR–HPV i typické charakteristiky růstu a rizika progrese do invazivního karcinomu. Část dlaždicových karcinomů penisu, podobně jako dalších dlaždicových karcinomů v anogenitální oblasti, je způsobená lidskými vysoce rizikovými (high-risk) papilomaviry (HR-HPV), nejčastěji typem 16 a 18. V řadě studií je uváděna přítomnost lidského papilomaviru (HPV) až v 70–100 % intraepiteliálních lézí a ve 40–50 % případů invazivních karcinomů (8). Podle prof. Michala (9) je velmi pravděpodobné, že budoucí nová klasifikace intraepiteliálních lézí penisu (PeIN) bude postavena na stejném principu jako klasifikace intraepitaliálních lézí vulvy (VIN), vaginy (VaIN) či cervixu (CIN). Návrh prof. Michala publikovaný v České Urologii č. 2 v roce 2014 (9) rozděluje obvyklé typy penilních intraepiteliálních neoplazií (PeIN) na základě paralely s VIN na obvyklé nediferencované PeIN a diferencované (simplexní) PeIN. Pokud bude nová klasifikace PeIN uznána a v praxi prověřena, mohla by mít významný dopad pro stratifikaci rizikových skupin pacientů, jejich léčbu i sledování.
Není zcela jasné, jaký vztah má HPV infekce k prognóze karcinomu penisu. Lont ve své práci (10) uvádí signifikantně lepší pětileté přežití u pacientů s karcinomem penisu souvisejícícím s HPV proti HPV negativním případům (93 % vs. 78 %). Rozdíl mezi oběma skupinami nevidí Bezerra (11), který nenašel mezi oběma skupinami rozdíl ve výskytu uzlinových metastáz a v desetiletém přežití. Souvislost s HPV infekcí se také liší u jednotlivých typů squamózního karcinomu. Rubin (12) našel souvislost s HPV téměř u všech basaloidních karcinomů. Na druhou stranu je přítomnost HPV velmi vzácná u verukózního karcinomu (13).
DIAGNÓZA A STAGING
Základem pro stanovení diagnózy karcinomu penisu je jeho histologické ověření a přesné stanovení typu nádoru. Spinocelulární karcinomy (SCC) představují 95 % všech zhoubných nádorů penisu (14). Jiné nádory, jako melanomy, lymfomy, sarkomy nebo metastázy z jiných orgánů se na penisu vyskytují zcela vzácně. Kromě „obvyklého“ SCC, existují různé jeho podtypy, které mohou mít odlišnou etiologii, chování i prognózu. Proto je přesné určení jednotlivých podtypů SCC a gradingu velmi důležité pro správné určení léčby. Zatímco typy, jako je verukózní karcinom či papilární karcinom, mají velmi dobrou prognózu a jen velmi vzácně metastazují, basaloidní, sarkomatoidní, adenosquamózní a nízce diferencovaný karcinom metastazují časně a mají špatnou prognózu. Střední riziko pak mají typické SCC, smíšené formy a pleomorfní formy bradavičnatého (warty) karcinomu. Kromě přesného určení histologického typu a gradingu je nutné znát velikost léze a hloubku invaze, přítomnost lymfangioinvaze či angioinvaze a perineurálního šíření pro vyhodnocení rizika a zvolení správné strategie léčby.
KLASIFIKACE TNM (11)
T – Primární nádor
TX primární nádor nelze hodnotit
T0 bez známek primárního nádoru
Tis karcinom in situ Ta neinvazivní verukózní karcinom
T1 nádor postihuje subepiteliální pojivovou tkáň
T1a nádor postihuje subepiteliální tkáň bez invaze mízních cév a není nízce diferencovaný
T1b nádor se šíří do subepiteliální pojivové tkáně s invazí mízních cév, nebo je nízce diferencovaný či nediferencovaný
T2 nádor postihuje corpora cavernosa nebo corpus spongiosum
T3 nádor postihuje uretru
T4 nádor postihuje jiné přilehlé struktury
N – Regionální mízní uzliny
NX regionální mízní uzliny nelze hodnotit
N0 hmatem nebo pohledem nejsou zvětšené inguinální místní uzliny
N1 hmatná pohyblivá inguinální mízní uzlina
N2 hmatné pohyblivé vícečetné nebo oboustranné inguinální mízní uzliny
N3 fixovaný paket inguinálních uzlin nebo pánevní lymfadenopatie jednostranně nebo oboustranně
pN kategorie
pN1 jedna pozitivní inguinální uzlina
pN2 pozitivní mnohočetné jednostranné či bilaterální inguinální uzliny
pN3 pozitivní pánevní jednostranné či oboustranné uzliny nebo extranodální šíření
M – Vzdálené metastázy
MX vzdálené metastázy nelze hodnotit
M0 bez vzdálených metastáz
M1 vzdálené metastázy
pTNM – Patologická klasifikace
Kategorie pTa pN odpovídají kategoriím T a N. Kategorie pN je založena na výsledku z biopsie nebo chirurgické excize.
G – Histologický grading
GX stupeň diferenciace nelze hodnotit
G1 dobře diferencovaný
G2 středně diferencovaný
G3 nízce diferencovaný/nediferencovaný
Kategorii T určí vyšetření pohledem, pohmatem a k posouzení hloubky infiltrace lze použít UZ či MRI. Vyšetření magnetickou rezonancí je vhodné provést zejména při pochybnostech o infiltraci corpora cavernosa nebo corpus spongiosum. Pro zpřesnění vyšetření je doporučena intrakavernózní aplikace prostaglandinu E1, která způsobí artificiální erekci a zkvalitní vyšetření (16).
Rozdělení do stádií
Asi u 1/3 pacientů jsou v době diagnózy hmatné zvětšené tříselné uzliny, ale pouze asi polovina z nich je metastaticky postižená. Na druhou stranu, 13–20 % pacientů bez hmatných uzlin má okultní metastázy. K určení uzlinového postižení lze využít UZ, CT/MR. Metastázy v hmatných uzlinách definitivně potvrdí biopsie uzliny pod ultrazvukovou kontrolou, případně aspirační cytologie tenkou jehlou (FNAB – fine-needle aspiration biopsy), rovněž navigovaná ultrazvukem. FNAB nese v sobě riziko falešně negativních výsledků. Pánevní uzliny nejsou nikdy postižené při negativních tříselných uzlinách. Užitečnou metodou pro staging pánevních uzlin a případně odhalení vzdálených metastáz je FDG PET/CT.
TERAPIE
Přehled současných možností léčby časných stadií kategorií penisu byl v českém písemnictví uveden v roce 2014 prof. Horou v České Urologii č 3. (17)
Metody lokální léčby
U neinvazivních forem Tis a u povrchních lézí bývá v první linii léčby často používána lokální chemoterapie s 5-FU nebo a imiquimodum. Kompletní odpověď je udávána v méně než 60 %. Další možnosti léčby u této skupiny nádorů nabízí fotodynamická terapie spočívající v jednorázové aplikaci senzibilizátoru s následnou expozicí červenému světlu. K léčbě se rovněž užívá plynový CO2 laser nebo Nd-YAG laser (18). Nově se zkouší i šetrný Er-YAG, hlavně u plošných lézí Cis a PeIN k termálnímu poškození pouze epidermis v horní vrstvě dermis s následnou rychlou reepitelizací (19). Nevýhodou těchto metod je, že se nezíská tkáň pro histopatologické vyšetření celé léze, zejména chybí informace o dostatečném ošetření spodiny a okrajů. To je zřejmě také příčina častých recidiv (10–48 %) po použití těchto metod (20).
Chirurgické metody
Chirurgická léčba karcinomu penisu, která je hlavní metodou léčby karcinomu penisu, není předmětem tohoto sdělení a na tomto místě je uváděna jen pro doplnění přehledu celé onkologické léčby.
U počátečních T kategorií (PeIN, Cis, Ta, T1a) jde především o excizi a cirkumcizi. Z novějších postupů je také uváděn resurfasing (případně s kožním štěpem). V literatuře je často popisovaná Mohsova operace jako jedna z chirurgických metod maximálně šetřící zdravou tkáň. Ve skutečnosti se běžně neprovádí, hlavně z důvodu značné náročnosti na čas chirurga a patologa při postupně prováděných excizích nádoru a mikroskopickém peroperačním vyšetřování jednotlivých řezů a jejich okrajů.
Detailnější poznání o lokálním šíření nádorů penisu vedlo k vypracování nových operačních technik snažících se co nejvíce šetřit tkáň penisu a jeho funkční integritu, aniž by byla zhoršena onkologická kontrola nádoru. Ve vybraných případech (kategorie tumoru T1aG3, T1b, T2 při postižení pouze na glandu) je možné provést odstranění pouze glandu penisu (tzv. glansektomie) s ponecháním intaktních kavernózních těles a vytvořit neogland pomocí dermoepidermálního štěpu (21).
U pokročilejších forem nádorů T2 s invazí do corpora cavernosa je metodou volby parciální amputace. Totální amputace penisu je obvykle řešením pro nádory kategorie T3, případně s emaskulinizací u nádorů T4.
Pokud karcinom penisu metastazuje, jde o závažné onemocnění ohrožující pacienta na životě. Léčba metastáz v regionálních uzlinách je primárně chirurgická. K přesnějšímu určení metastáz v nehmatných inguinálních uzlinách byla zavedena metoda mapování a biopsie sentinelových uzlin a stanovena pravidla pro provádění lymfadenektomií regionálních uzlin podle zařazení pacienta do rizikové skupiny (22, 23). Zdokonalení chirurgických technik (stejně jako jiných léčebných technik) lze dosáhnout jedině jejich častým prováděním, proto v některých západoevropských zemích (UK, Nizozemí) je chirurgická léčba karcinomu penisu centralizována do několika nadregionálních pracovišť. Například v Anglii NICE (National Institute for Clinical Excellence) doporučuje, aby karcinom penisu byl léčen pouze v nadregionálních centrech, která ročně léčí minimálně 25 nových případů (24).
Radioterapie
Chirurgická léčba je v léčbě invazivního karcinomu penisu efektivní, ale až do nedávné doby radikální léčba znamenala částečnou či totální amputaci a s tím související funkční a psychosexuální morbiditou. Proto, a hlavně z důvodu zachování funkce penisu, byla po mnoho let využívána radioterapie. Konzervativní postup s použitím samostatné radioterapie může být metodou volby u počátečních stadií karcinomu penisu, pokud lokální kontrola a míra komplikací zůstane srovnatelná s chirurgií. Neexistuje však žádná studie, která by obě metody porovnávala. V publikovaných zprávách (29, 33), i podle naší zkušenosti, obvykle nejde o stejnou skupinu pacientů léčených tou kterou metodou. Na radioterapii přicházejí spíš pacienti po opakovaných excizích pro recidivující karcinom, kteří odmítli amputační výkon penisu nebo primárně zásadně odmítají operaci. Na rozdíl od parciální nebo totální penektomie zůstává orgán po ozáření celistvý, ale s rizikem možného vzniku recidivy. Lokální recidivy jsou po radioterapii častější (20–25 %) než po amputačních výkonech na penisu, ale při vzniku recidivy lze až v 85 % dosáhnout nové kontroly nádoru salvage operací (25). Postiradiační komplikace jako teleangiektázie, fibróza, atrofie, stenóza uretry nebo nekróza bývají uváděny urology jako argument proti primární volbě radioterapie. Námitka urologů vychází z toho, že je dnes možné provádět méně mutilující chirurgické výkony s dobrými léčebnými výsledky při zachování funkce penisu. Léčba zářením se může týkat primárního nádoru penisu a/nebo regionálních lymfatických uzlin. Pro ozáření primárního nádoru lze využít ozáření externí – radioterapii (teleterapii) nebo, a to častěji, brachyterapii, kdy je radioaktivní zdroj pomocí aplikátoru zaveden přímo do nádoru (intersticiální brachyterapie), nebo do těsné blízkosti nádoru (povrchová brachyterapie, také nazývaná muláž).
Zevní radioterapie
Při ozáření penisu zevní radioterapií je aplikována homogenní dávka do cílového objemu. K dosažení dostatečné build-up dávky na povrchu penisu je třeba použít vhodný tkáň ekvivalentní bolus a zajistit stabilizovanou a reprodukovatelnou polohu penisu při každé frakci ozařování a zároveň se vyhnout ozáření testes. Podle uložení nádoru na penisu, délky penisu i podle tělesné konstituce pacienta se pak volí ozařovací poloha na zádech s penisem fixovaným vertikálně nebo poloha na břiše s penisem visícím dolů. Při použití bolusu se obvykle volí ozařovací technika dvou protilehlých polí a nižší energie fotonového záření (4 MeV). Aplikovaná dávka záření se pohybuje kolem 65 (70) Gy při frakcionaci 2 Gy/den. Dávky záření pod 60 Gy/6 týdnů jsou pro kontrolu nádoru nedostačující. Stejně tak prodloužení ozařovací doby nad 45 dní vede ke zhoršení výsledků lokální kontroly nádoru. Celková doba ozařování hraje důležitou roli podobně jako u jiných SCC. Zkušenosti s externí radioterapií vyššími dávkami záření na frakci ve zkrácené ozařovací době publikovali kolegové z Manchesteru (25). Dávku záření 50–52,5 Gy v 16 frakcích aplikovali během 22 dní. Dosáhli lokální kontroly nádoru v 62 %. Všechny recidivy byly pak léčeny salvage operací a celkové pětileté přežití činilo 88 %. V osmi procentech se objevil na penisu ulkus a 29 % pacientů vyžadovalo dilataci uretry kvůli stenóze. Popsané schéma zevní radioterapie poukázalo na nevhodnost zvoleného ozařovacího režimu vyššími dávkami na frakci. Léčebné výsledky po zevní radioterapii jsou většinou horší než po brachyterapii, a proto samostatná zevní radioterapie není u T1/T2 tumorů příliš často samostatně používána. Někdy je používána v kombinaci s brachyterapií u větších (T2) nádorů. Častěji se využívá pro adjuvantní ozáření po lymfadenektomiích pro N2 event. N3 (26) nebo z důvodů paliativních u velmi pokročilých neoperabilních tumorů. Elektivní ozařování regionálních uzlin se u karcinomu penisu nepoužívá.
Brachyterapie
Od 80. let minulého století byla publikována celá řada prací o použití brachyterapie v léčbě karcinomu penisu. Většina zpráv se týkala brachyterapie s nízkým dávkovým příkonem (LDR-low-dose rate) metodou manuálního afterloadingu s drátky 192Iridia (Ir-192). Renezanci brachyterapie v té době způsobilo zavedení neaktivního způsobu zavádění aplikátorů (afterloading), používání zdrojů Ir-192 ve formě velmi tenkých drátků o stejné lineární aktivitě a vypracování nových dozimetrických pravidel pro jeho aplikací (Pařížský systém). Nový systém přinesl, kromě zlepšení radiační bezpečnosti personálu i pacientů, zcela nové aplikační techniky, zlepšení výsledků lokální kontroly nádorů a snížení postiradiačních komplikací proti období, kdy se používalo 226radium. Teprve později začala být brachyterapie aplikována pomocí automatického afterloadingu s LDR nebo metodou PDR (pulse dose radiotherapy). Výsledky LDR intersticiální brachyterapie publikované v 90. letech 20. století byly v té době srovnatelné s tehdejší chirurgickou léčbou. Tabulka 1 uvádí literární přehled výsledků léčby pomocí LDR brachyterapie u karcinomu penisu stadií T1–T3. Ošetření uzlin bylo řešeno chirurgicky ± v kombinaci se zevním ozářením.
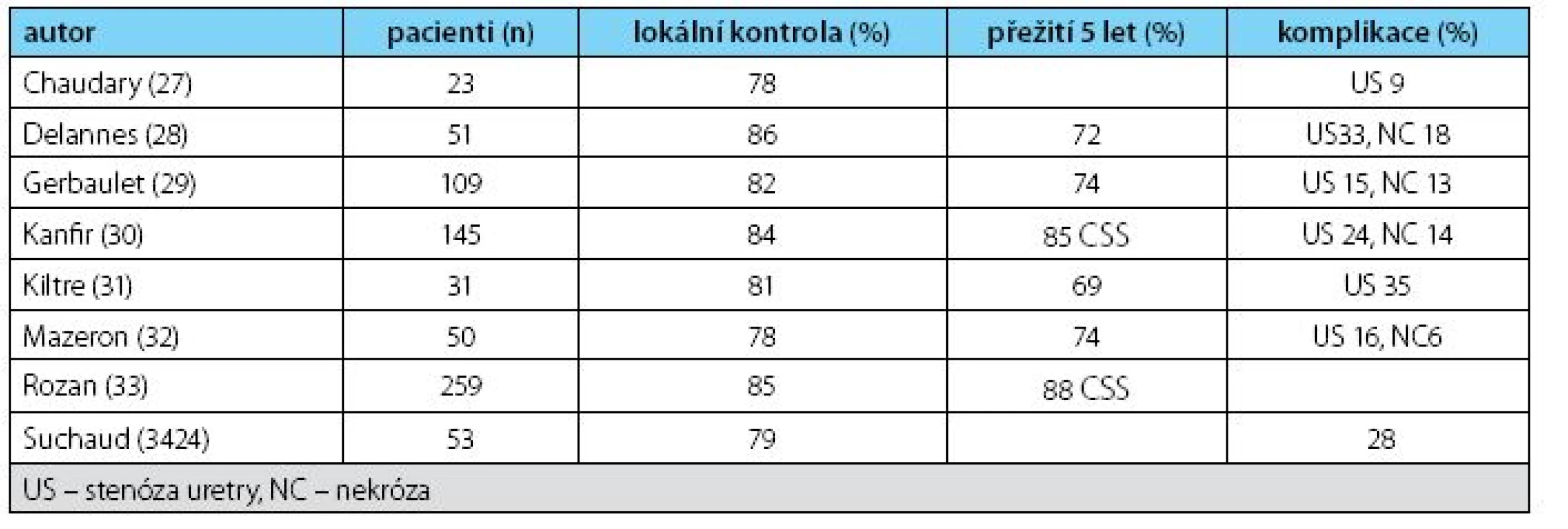
Indikace pro brachyterapii se po zkušenostech z minulosti zpřesnily a dnes se považují za vhodné pro brachyterapii pouze nádory T1 (T2) s rozměrem ≤ 4 cm (35). Cílový objem pro brachyterapii musí zaujmout jednak samotný tumor GTV (gros tumor volume) a lem 0,5–1 cm. Kvůli časté přítomnosti superinfekce, je přesné určení GTV někdy obtížné. Brachyterapii vždy musí předcházet cirkumcize. Při pochybnostech o infiltraci corpora cavernosa nebo corpus spongiosum je vhodné doplnit vyšetření magnetickou rezonancí s intrakavernózní injekcí prostaglandinu E (16).
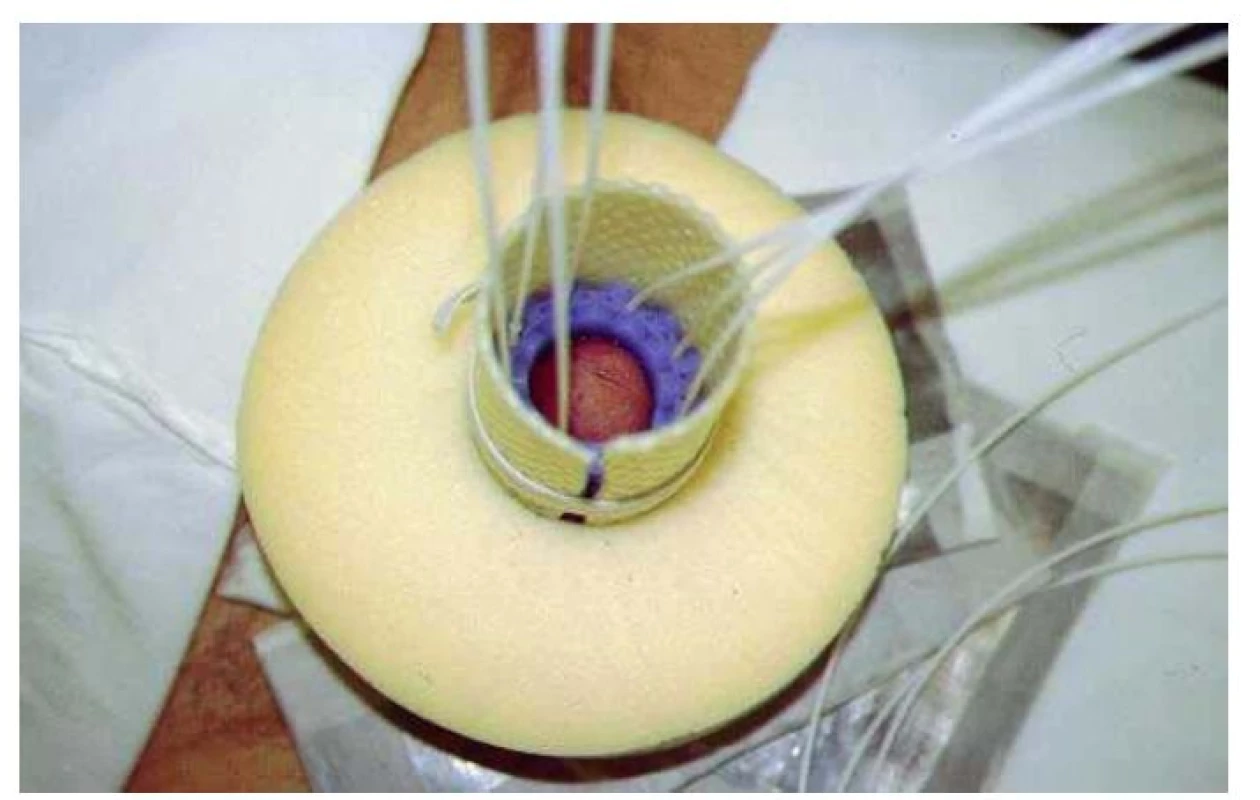
Intersticiální brachyterapie se provádí pomocí tenkých kovových nebo plastikových dutých jehel (obr. 2) v celkové narkóze se zavedeným močovým katétrem, který se ponechává po celou dobu aplikace. Při aplikaci je nutné předvídat (a samozřejmě pak i vypočítat) dávku záření na uretru.

Při LDR brachyterapii byla požadována minimální dávka záření v plánovaném cílovém objemu 65 Gy/6–7 dní. V současné době je LDR brachyterapie, a to jak s automatickým afterloadingem, tak s manuálním afterloadingem většinou nahrazena brachyterapií s vysokým dávkovým příkonem (HDR-high dose rate). Dávkový příkon pro HDR brachyterapii je nad 12 Gy/hod, a proto je nutné ozáření provádět frakcionovaně. Vývoj směrem k HDR brachyterapii přinesl změny v používaných technikách, v organizaci práce, ale také větší pohodlí pro pacienty, zpřesnění plánování léčby s možností optimalizace a podstatné zlepšení kontroly nad celým ozařováním. V literatuře zatím chybí dostatečná data o HDR brachyterapii u karcinomu penisu (36), a proto uvedeme osobní zkušenosti s jejím použitím u karcinomu penisu.
VLASTNÍ ZKUŠENOSTI S HDR BRACHYTERAPIÍU KARCINOMU PENISU
Charakteristika souboru
Na našem pracovišti jsme od roku 1999 do roku 2014 ozařovali 26 pacientů s karcinomem penisu pomocí HDR brachyterapie. Šlo o pacienty ve věku 31–68 let, s průměrným věkem 56,2 roku. Všichni pacienti předtím prošli různými českými urologickými pracovišti, někteří byli léčeni na kožních odděleních. Na různých pracovištích byly opakovaně prováděné excize, někdy s pozitivními okraji, opakovaly se recidivy a při odmítnutí amputačního výkonu byli pacienti odesláni k radioterapii. Třetina pacientů měla v anamnéze fimózu a u více než 40 % pacientů se vyskytovala v anamnéze prekanceróza (M. Bowen, Erythroplasia Queyrat). Většina pacientů udávala dlouhodobou symptomatologii v souvislosti se změnami na penisu, která u šesti pacientů byla delší než 10 let, u dvou dokonce trvala 15 let. V době, kdy přišli na naše oddělení, 20 pacientů mělo nádor kategorie T1, ať už recidivu nebo po excizi recidivy s pozitivními okraji a šest pacientů mělo nádor velikosti T2. U třech pacientů jsme doporučili provedení lymfadenektomie pro N1 na urologickém pracovišti, ze kterého byli odesláni.
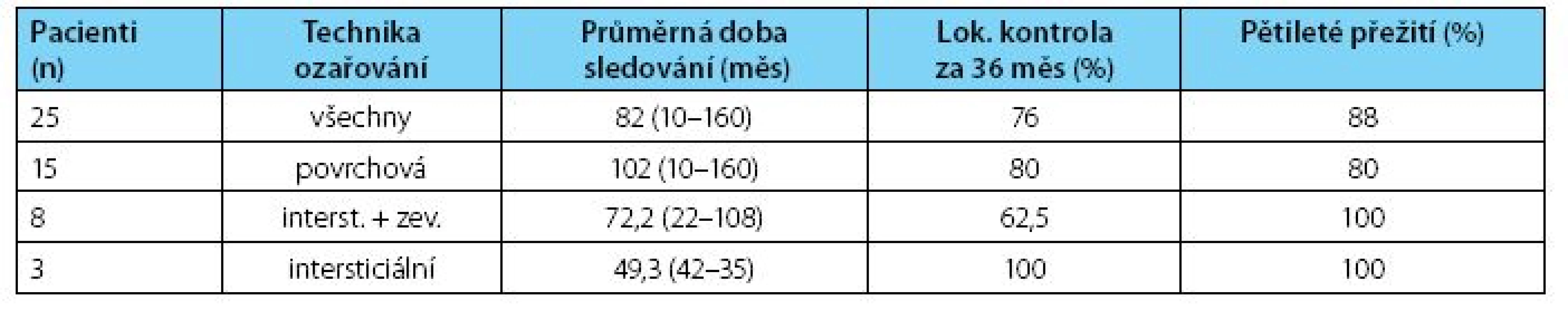
Povrchová brachyterapie
U 15 pacientů byla provedena povrchová HDR brachyterapie. Povrchová brachyterapie byla indikována u povrchních lézí do tloušťky maximálně 0,5 cm. Byla prováděna pomocí individuálních muláží s plastikovými katétry umístěnými podle nádorové topografie na termoplastickém materiálu (orfit) nebo byly použity dva cylindry, kdy vnitřní cylindr byl navlečen na penis, v zevním pak byly umístěny aplikátory pro pohyb radioaktivního zdroje 192Iridia (obr. 1). Ozařování bylo prováděno ambulantně v 10 frakcích/2 týdny při frakcionaci 4,3 Gy na 1 frakci ve 2/-3 mm pod povrchem penisu.
Výsledky
U 6/15 pacientů se v průběhu sledování objevila recidiva a sice za 4, 6, 14, 46, 82 a 90 měsíců po skončení ozáření. U pacientů, kteří měli recidivu ve 4., 6., a 14. měsíci, šlo o nádory velikosti T2 s nepříznivou histologií (angioinvaze, perineurální šíření), u kterých se záhy objevily i uzlinové metastázy. Léčba brachyterapií pomocí muláže zřejmě nebyla optimální volbou léčby. Tito pacienti byli spíš kandidáty pro primární parciální amputaci penisu s lymfadenektomií. U zbývajících tří pacientů s recidivou po 90., 46. a 82. měsících lze uvažovat o tom, zda nešlo o nový nádor. U dvou z nich byla provedena parciální amputace penisu a dále žijí bez recidivy. U pacienta s recidivou po 90 měsících od ozáření byla provedena totální amputace penisu, ale bohužel, pak se objevily metastázy v tříselných a v pánevních uzlinách a přes další chemoterapii a radioterapii pacient zemřel na karcinom penisu po 127 měsících po skončené léčbě brachyterapií.
Časná postiradiační reakce se objevila vždy ve formě erytému G1–2 ve 3. týdnu od zahájení ozáření, tj. již po ukončení léčby U pacientů ozařovaných povrchovou HDR brachyterapií jsme nepozorovali závažnější pozdní komplikace, až na teleangiektázie na kůži těla penisu a postupné zkracování délky penisu.
Intersticiální brachyterapie
HDR intersticiální brachyterapie byla provedena celkem u 11 pacientů, z toho u osmi v kombinaci se zevní radioterapií kvůli velikosti nádoru. Před brachyterapií všichni opakovaně prodělali excize pro recidivující nádor. Jeden z pacientů s T2 měl za sebou 12 excizí v průběhu 13 let. Intersticiální brachyterapii jsme prováděli hyperfrakcionovaně 2 x denně s intervalem šesti hodin mezi oběma frakcemi a dávkou záření 3 Gy na jednotlivou frakci. Ekvivalentní dávka z brachyterapie samotné i u kombinovaného ozáření se zevní radioterapií byla u všech pacientů mezi 63–67 Gy v cílovém objemu.
Výsledky
V průběhu sledování po ozáření vznikla u pěti pacientů recidiva po 26, 26, 42, 45 a 36 měsících od skončení léčby. U dvou pacientů s recidivou šlo původně o T2 nádory, u dalších tří o nádor T1, z nichž jeden byl bifokální. Vzniklé recidivy byly řešeny amputačním výkonem, 2x totální amputací, 3x parciální penektomií. Všech 11 pacientů dále žije bez progrese onemocnění.
Tři pacienti po intersticiální brachyterapii měli stenózu uretry, z toho ve dvou případech byla spojena s recidivou v oblasti zevního ústí uretry. Jeden pacient měl protrahované hojení postiradiační reakce grade 2–3, které však nevyžadovalo chirurgickou intervenci a reakce se spontánně zahojila.
Závěr
Ze získaných zkušeností můžeme potvrdit, že HDR brachyterapie karcinomu penisu je technicky dobře zvládnutelná a pacienty dobře tolerovaná metoda léčby. Jde o jednu z možností léčby karcinomů penisu maximálně do velikosti tumoru 4 cm, nejlépe T1 kategorie. Nejde o rutinní metodu volby léčby karcinomu penisu, preferovaná je chirurgická léčba. Z důvodu prevence vzniku závažných pozdních změn je vhodné používat nižší dávky na frakci a ozařování hyperfrakcionovat. Pozdní recidivy (nebo nově vniklé nádory?) potvrdily nutnost dlouhodobé dispenzarizace ke včasnému podchycení recidiv či uzlinových metastáz. Při zjištění recidivy či uzlinové metastázy musí být chirurgické řešení urgentní a nelze ho odkládat. Vzhledem k pozdním recidivám může být publikování časných výsledků poněkud zavádějící, jak jsme se sami přesvědčili. Více než 50 % recidiv u našich pacientů se objevilo až po třech a více letech.
CHEMOTERAPIE
Z obecné klinické zkušenosti o prospěšnosti chemoterapie u SCC jiných lokalizací (karcinomy v ORL oblasti, ca anu, ca hrdla děložního), zejména v multimodální terapii, byly vkládány naděje do jejího zařazení i u karcinomů penisu. Na rozdíl od výše uvedených lokalizací, místo pro vhodnou chemoterapii u karcinomu penisu se stále ještě hledá. Karcinom penisu, který masivně metastazoval do uzlin nebo systémově, je prakticky nekurabilní. Úspěšné léčby uzlinových metastáz může být dosaženo pouze radikální chirurgickou léčbou doplněnou u některých pacientů chemoterapií/radioterapií. Vzhledem k řídkému výskytu karcinomu penisu je nedostatek klinických dat o chemoterapii v léčbě tohoto onemocnění. Dosud nebyly publikovány žádné randomizované studie o užití chemoterapie v léčbě karcinomu penisu. Randomizovanou studii nelze prakticky ani uskutečnit. V posledních letech byla publikována jediná studie fáze 2 o neodjuvantní chemoterapii karcinomu penisu u pokročilých stadií III/IV (37). Dosavadní zprávy o chemoterapii se zabývaly retrospektivním hodnocením souborů o malých počtech pacientů s pokročilými formami nádoru. Odpověď na monoterapii s cisplatinou (CDDP), bleomycinem (BLM) či metotrexátem (MTX) byla velmi nízká (0–27 %) a toxicita, zejména plicní toxicita po BLM, byla značná (38). Jedinou kompletní remisi po monoterapii vysokodávkovaným metotrexátem publikoval Garnick (39). S cílem zlepšit špatnou odpověď dosahovanou při monoterapii byla zkoušena celá řada dvoj - a trojkombinací cytostatik. Shammas s kolegy (40) použili kombinaci 5-fluorouracilu (5-FU)1 000 mg/m2 s (CDDP) 100 mg/m2 ve třítýdenních intervalech a dosáhli částečnou odpověď u dvou z osmi pacientů. Z hlavních toxických projevů popsali zhoršení renálních funkcí, nauzeu a zvracení. Theodore a spol. (41) dosáhli odpověď v 30,8 % případů při použití EORTC protokolu s dvojkombinací CDDP 80 mg/m2 s irinotecanem 60 mg/m2. Hlavními vedlejšími projevy byly průjmy grade 3 a neutropenická horečka grade 4. O rozpacích při hledání účinnější kombinace chemoterapie svědčí i práce francouzských autorů z Institutu Gustave Roussy (42), kteří publikovali zkušenost s léčbou 14 pokročilých případů karcinomu penisu, z nichž 12 bylo ve stadiu IV. Všichni pacienti dostali CDDP, která byla kombinována buď s 5FU (4 pacienti), s MTX a BLM (4 pacienti), s MTX (3 pacienti), s Adriamycinem (1 pacient), s BLM a vinblastinem (1 pacient) nebo s BLM a epirubicinem (1 pacient). Objektivní odpověď byla prokázána u dvou pacientů (15 %). U jednoho pacienta byla kompletní odpověď, u druhého částečná odpověď. Většina popsaných tradičních režimů chemoterapie z konce 80. let 20. století vykazovala nízkou účinnost a vysokou toxicitu. V devadesátých letech několik skupin lékařů popsalo zkušenosti s trojkombinacemi chemoterapie Vincristin l mg/m2, BLM 15mg/m2 a MTX 30 mg/m2 v týdenním režimu po dobu 12 týdnů. Pizzocaro a Piva (43) popsali částečnou remisi u 3/5 pacientů, ale s těžkou plicní toxicitou, kdy se u dvou pacientů rozvinula plicní fibróza. V roce 1991 Dexeus (44) s kolegy publikovali trojkombinaci chemoterapie, která se na delší dobu stala standardem pro karcinom penisu. Použili CDDP 20 mg/m2 den 2–6, MTX 200 mg/m2 den 1. a 15 a BLM 10 mg/m2 den 2–6 a popsali pozitivní odpověď u 10/14 pacientů. Bohužel, později se nepodařilo dalším autorům potvrdit stejně pozitivní výsledky a naopak pozorovali i závažnější toxicitu včetně úmrtí následkem chemoterapie.
Po pozitivních zkušenostech se zařazením taxanů do léčby SCC jiných lokalizací byl paclitaxel rovněž experimentálně použit v kombinaci s carboplatinou u karcinomu penisu (45, 46). Bermejo (45) použil tuto kombinaci u dvou pacientů v neoadjuvantním podání před disekcí lymfatických uzlin a popsal výraznou regresi a prodloužené přežití ve srovnání proti historickým kontrolám: 82 vs. 50 měsíců. Tolerance uvedené kombinace byla dobrá. Pizzocaro s kolegy (46) kombinovali CDDP (50 mg/m2 den 1 a 2 s 5FU (1 000 mg/m2 den 2–5 a s paclitaxelem 120 mg/m2 den 1). Popsali pozitivní odpověď u 5/6 léčených pacientů a vedlejší účinky nepřekročily grade 2. Slibné výsledky ze studie fáze 2 s neoadjuvantním podáním Paclitaxelu 175 mg/m2 den 1, Ifosfamidu 1 200 mg/m2 den 1 až 3 a CDDP 25 mg/m2 den 1 až 3 publikoval Pagliaro (37). Bylo dosaženo tří kompletních a 12 částečných remisí ze 30 pacientů zahrnutých ve studii. Odpovědi bylo tudíž dosaženo v 50 % případů. Ve 30 % bylo onemocnění stabilizováno a ve 20 % progredovalo. Šlo o pacienty s objemnými uzlinovými metastázami N2, N3. Chirurgické odstranění metastáz po chemoterapii podstoupilo 22 pacientů (73,3 %). Prodloužení doby do progrese i celkové přežití byly statisticky významně vztaženy k odpovědi na chemoterapii. 30 % pacientů bylo bez známek choroby s mediánem sledování 36 měsíců (14–59 měsíců).
Z uvedených údajů je vidět, že i když přibývají publikace o chemoterapii karcinomu penisu, zatím neexistuje jasné doporučení ani pro kombinaci chemoterapie ani pro její jednoznačné zařazení. Z logických důvodů, alespoň částečně podpořených zkušenostmi publikujících autorů, lze doporučit její zařazení do multimodální léčby v neoadjuvantním podání před chirurgickým výkonem u pacientů stadia III a IV. Nejslibnější se jeví kombinace Paclitaxel + Ifosfamid + CDDP, čtyři cykly před operací (37).
Na podkladě zpráv o zlepšení léčebných výsledků po adjuvantním podání chemoterapie u pacientů s kompletním odstraněním lokálního nádoru i metastatických uzlin N2 doporučuje Evropská urologická společnost (22) podávat u této skupiny pacientů adjuvantní chemoterapii. I když její prospěšnost je zřejmá, zatím není jasné, která kombinace je nejlepší.

U pacientů s diseminovaným onemocněním mimo uzliny nebo u neoperabilních uzlinových metastáz jsou výsledky dosavadní chemoterapie velmi špatné a přežití krátké kolem pěti měsíců. Závěrem o chemoterapii karcinomu penisu lze shrnout, že zatím zůstává problematickou kvůli chybění robustnějších dat z klinické praxe a agresivnímu chování pokročilých nádorů. Vzácný výskyt nádoru a jeho léčba rozptýlená na velké množství urologických pracovišť neumožňuje rychlé ověřování nových léků na dostatečném počtu pacientů. Ojedinělé zprávy o použití cílené terapie s anti - EGFR monoklonáními protilátkami panitumumabem a cetuximabem vyžadují další ověření před eventuálním použitím v praxi.
ZÁVĚR
V literatuře lze nalézt množství odkazů týkajících se léčby karcinomu penisu. Kriticky je třeba připustit, že se týkají obvykle malých souborů, často léčených v průběhu mnoha let. Navíc, publikované výsledky nemusí reprezentovat běžnou praxi roztříštěnou na množství malých pracovišť. V posledních 15 letech se rozšířily poznatky o etiologii a biologickém chování nádorů penisu, zároveň se mění názory na dosud používané klasifikace, na potřebu detailnější diagnózy i na dosud užívané metody léčby. To by postupně mělo vést k lepší stratifikaci pacientů pro tu nejvhodnější léčbu. Vzhledem k nízké incidenci je potřebné léčbu karcinomu penisu centralizovat jen do několika center, kde se o léčbě rozhoduje v týmu, kde kromě urologa erudovaného v moderních chirurgických postupech, je také přítomen patolog, radiolog, klinický a radiační onkolog. Pacient by měl být před léčbou velmi podrobně seznámen se všemi možnostmi léčby i s důsledky z ní plynoucími a s možnými komplikacemi. Kvůli možným recidivám je další sledování pacienta nutné. Pokud nádor metastazuje, jde o závažné onemocnění ohrožující pacienta na životě. Časná chirurgická léčba lokálního nálezu a případného uzlinového postižení i nadále hraje podstatnou roli ve vyléčení a prognóze pacienta.
Došlo: 4. 2. 2015
Přijato: 13. 3. 2015
Kontaktní adresa:
MUDr. Hana Stankušová, CSc.
Onkologická klinika 2. LF UK a FN Motol
V Úvalu 84,
150 06 Praha 5
e-mail: hana.stankusova@fnmotol.cz
Střet zájmů: žádný.
Prohlášení o podpoře:
Zpracování tohoto sdělení nebylo podpořeno žádnou společností.
Sources
1. Novák J, Žídek I. Carcinoma of the penis. Praha: Grada Publishing, 1996.
2. Ferlay J, Shin HR, Bray F, et al. Estimates of worldwide burden of cancer in 2008: Globocan 2008, Int J Cancer 2010; 127 : 2893–2917.
3. Dilner J, van Krogh G, Horenblas, et al. Etiology of squamous call carcinoma of the penis. Scand J Urol Nephrol Suppl 2000; (205): 189–193.
4. Maden C, Sherman KJ, Beckmann AM, et al. History of circumcision, medical conditions, and sexual activity and risk of penile cancer. JNatl Cancer Inst 1993 Jan; 85(1): 19–24.
5. Archier E, Devaux S, Castela E, et al. Carcinogenic risk of psoralen UV-A therapy and narrowband UV-B therapy in chronic plaque psoriasis: a systematic literature review. J Eur Acad Dermatol Venerol 2012 May; (26 suppl 3): 22–31.
6. Philippou P, Shabir M, Ralph DJ, et al. Genital lichen sclerosus/balanitis xerotica obliterans/in men with penile carcinoma: a critical analysis. BJU Int 2013 May; 111(6): 970–976.
7. Bleeker MCG, Heideman DAM, Snijders PJF, et al. Penile cancer: Epidemiology, pathogenesis and prevention. World J of Urology 2008; 27(2): 141–150.
8. Backes DM, Kurman RJ, Pimenta JM, et al. Systematic review of human papilomavirus prevalence in invasive penile cancer. Cancer causes Contro1 2009 May; 20(4): 449–457.
9. Michal M, Hes O, Kacerovska D, et al. Klasifikace intraepiteliálních neoplazií předcházejících dlaždicovému karcinomu penisu a jejich analogie s rekancerózami dlaždicových karcinomů vulvy. Ces Urol 2014, 18(2): 94–100.
10. Lont AP, Kroon BK, Horenblas S, et al. Presence of high risk human papilllomavirus DNA in penis carcinoima predicts favorable outcome in surfoval. Int J Cancer 2006 Sep; 119(5): 1078–1081.
11. Bezerra AL, Lopes A, Santiago GH, et al. Human papilomavirus as a prognostic factor in carcinoma of penis: analysis of 82 patients treated with amputation and bilateral lymphadenectomy. Cancer 2001 Jun; 91(12): 5–21.
12. Rubin MA, Kleter B, Zhou M, et al. Detection and typing of human papillomavirus DNA in penile carcinoma: evidence for multiple independent pathways of penile carcinogenesis. Am J Pathol 2001; 159 : 1211–1218.
13. Schneider H, Sokol L, Valanský L, et al. Verukózny karcinom penisu – zriedkavý variant dlaždicobunkového karcinómu. Ces Urol 2000; 4(2): 43–46.
14. Velazquez EF, Barreto JE, Rodriquez I, et al. Limitations in the interpretation of biopsies in patiens with penile squamous cell carcinoma. Int J Surg Pathol 2004 Apr; 12(2): 139–146.
15. TNM klasifikace zhoubných novotvarů. 7. vydání 2009 (česká verze 2011); ÚZIS 93–95.
16. Kayes O, MinhasS, AllenC, et al. The role of magnetic resonance imaging in the local staging of penile cancer. European Urology 2007; Vol 51(5): 1313–1319.
17. Hora M, Trávníček I, Kalusová K, et al. Penis šetřící metody léčby nižších T kategorií karcinomu penisu Ces Urol 2014, 18(3): 199–207.
18. Babjuk M, Novák J, Dvořáček J. Nd: YAG Laser v léčbě povrchových lézí penisu Rozhledy Chir, 1998; 77 : 497–499.
19. Alexiades-Armenakas MR, Dover JS, Arndt KA. Fractional laser skin resurfacing. Journal Journal of drugs in dermatology: JDD 2012; 11(11): 1274–1287.
20. Meijer RP, BoonTA, vanVenrooij GE, et al. Long-term follow up after laser therapy for penile carcinoma.Urology 2007 Apr; 69(4): 759–762.
21. Hora M, Pizinger K, Bursa V, et al. Glansektomie v léčbě karcinomu penisu. Ces Urol 2011; 15(1): 15–23.
22. Hakenberg OW, Compérat E, Minhas S, et al. Guidelines on penile cancer, EAU 2014.
23. Pávek V, Drábek M, Lavička Z. Lymfadenektomie sentinelové uzliny epidermoidního karcinomu prostaty. Ces Urol 2012, 16(2): 125–128.
24. National Institute for Clinical Excellence (2002) Guidance on cancer services. Improving outcomes in urological cancers - the manual. NICE, London: 83–85, také: http://www.nice, org, uk/pdfúUrological_Manual. pdf.
25. Azif M, Logue JP, Swindell R, et al. External – beam radiotherapy in T1–T2 N0 penile carcinoma. Clinical Oncology May 2006; 18(4): 320–325.
26. Franks KN, Kancherla K, Sethugavalar B, et al. Radiotherapy for node positive penile cancer: experience of the Leeds teaching hospitals. J. Urol 2011 Aug; 186(2): 524–529.
27. Chaudhari AJ, Ghosh S, Bhalavat RL, et al. Interstitial brachytherapy in carcinoma of penis. Strahlenth Oncol 1999; 175 : 17–20.
28. Delannes M, Malavaud V, Douchez J, et al. Iridium-192 interstitial radiation therapy for squamous cell carcionoma of the penis. Int J Radiat Oncol Biol Phys 1984; 10 : 1891–1895.
29. Gerbaulet A, Lambin P, Haie-Mader C, et al. Brachytherapy of penile cancer. Ann Urol 1994; 28 : 306–311.
30. Kanfir K, Haie-Mader C, Abano M, et al. Outcome of patiens treated with exclusive brachytherapy for carcinoma of penis: the IGR experience. Clin Oncol 2000; 12 : 25–31
31. Kiltie AE, Elwell C, Close HJ, et al. Iridium-192 implantation for node-negative carcinoma of the penis. Clin Oncol 2000; 12 : 25–31.
32. Mazeron JJ, Langlois D, Lobo PA, et al. Interstitial radiation therapy for carcinoma of the penis using iridium -192 wires. The Henri Mondor experience (1970–1979) Int J Radiat Oncol Biol Phys 1984; 10 : 1891–1895.
33. Rozan R, Albuisson E, Giraud B, et al. Interstitial brachytherapy for penile carcinoma; a multicentric survey (259 patients), Radiother Oncol 1995; 36 : 83–93.
34. Suchaud JP, Kantor G, Richard P, et al. Brachytherapy of the cancer of the penis. Analysis of a series of 53 cases. J Urol 1989; 95 : 27–31.
35. Crook JM, Haie-Meder C, Demanes DJ, et al. American Brachytherapy Society-Groupe Europeén de Curiethérapie - European Society of Therapeutic Radiation Oncology (ABC-GEC-ESTRO) consensus statement for penile brachytherapy. Brachytherapy 2013; 12 : 191–198.
36. Petera J, Odrazka K, Zouhar M, et al. High-dose rate interstitial brachytherapy for the treatment of penile carcinoma. Strahhlenter Oncol 2004; 180 : 123–125.
37. Pagliaro LC, Williams DL, Daliani D, et al. Neoadjuvant paclitaxel, ifosfamid, and cisplatin chemotherapy for metastatic penile cancer: A phase II study. J Clin Oncol, 2010; (28)24 : 3851–3857.
38. Ahmed T, Sklarof R, Yagoda A. An appraisal of the efficacy of bleomycin in epidermoid carcinoma of the penis. Anticancer res 1984; 4 : 289–292.
39. Garnick MB, Skarin AT, Steele GD. Metastatic carcinoma of the penis: complete remission after high dose methotrexate chemotherapy. J Urol 1979; 122 : 265–266.
40. Shammas FV, Ous S, Fossa SD. Cisplatin and 5-fluorouracil in advanced cancer of the penis. J Urol 1992; 147 : 630–632.
41. Theodore C, Skoneczna I, Bodrogi I, et al. A phase II multicentre study of irinotecan in combination with cisplatin in metastatic or locally advanced penile carcinoma (EORTC protocol 30992). Ann Oncol 2008; 19 : 1304–1307.
42. Kattan J, Culine S, Droz JP, et al. Penile cancer chemotherapy: Twelve years experience at Institut Gustave-Roussy. UROLOGY 1993; 42(5): 559–563.
43. Pizzocaro G, Piva L, Bandieramonte G, et al. Up-to-date management of carcinoma of the penis. Eur Urol 1997; 32 : 5–15.
44. Dexeus FH, Logothetis CJ, Sella A, et al. Combination of chemotherapy with methotrexate, bleomycin and cisplatin for advanced squamous cell carcinoma of the male genital tract. J Urol 1991; 146 : 1284–1287.
45. Bermejo C, Busby JE, Spiess PE, et al. Neoadjuvant chemotherapy followed by aggressive surgical consolidation for metastatic penile squamous cell carcinoma. J Urol 2007; 177 : 1335–1338.
46. DiLorenzo G, Federico P, Buonerba C, et al. Paclitaxel in pretreated metastatic penile cancer: final results of a phase 2 study. Eur Urol 2011; 60 : 1280–1284.
47. Pizzocaro G, Nicolai N, Milani A. Taxanes in combination with cisplatin and fluorouracil for advanced penile cancer: preliminary results. Eur Urol 2009; 55 : 546–551
Labels
Paediatric urologist Nephrology UrologyArticle was published in
Czech Urology

2015 Issue 1
-
All articles in this issue
- EFFECTS OF FREE RADICALS ON MALE FERTILITY AND AVAILABLE TREATMENT
- ONCOLOGICAL TREATMENT OF PENILE CANCER FROM THE POINT OF VIEW OF RADIATION ONCOLOGIST
- IMMUNOSTIMULATION WITH POLYBACTERIAL LYSATE (URIVAC®) IN PREVENTING RECURRENT LOWER URINARY TRACT INFECTIONS
- URINE TUMOUR ASSOCIATED TRYPSIN INHIBITOR (TATI) IN DIAGNOSIS AND PROGNOSIS OF TRANSITIONAL CELL CARCINOMA OF THE BLADDER
- COMMUNICATION BETWEEN A UROLOGIST AND A PROSTATE CANCER PATIENT DURING PHYSICIAN CONSULTATION
- THE COMPLICATIONS FOLLOWING RADICAL PROSTATECTOMY VIA OPEN OR LAPAROSCOPIC APPROACH, A COMPARISON OF RESULTS ACCORDING TO THE CLAVIEN SYSTEM SCALE
- COMPLICATIONS FOLLOWING LOCAL APPLICATION OF INORGANIC MATERIAL INTO THE SUBCUTANEOUS TISSUE OF PENIS
- EMPHYSEMATOUS PYELONEPHRITIS – DESCRIPTION OF SIX CASES
- RAPID PROGRESSION OF TRANSITIONAL CELL CARCINOMA OF LEFT KIDNEY WITH THROMBOSIS OF VENA CAVA INFERIOR
- LESS (LAPARO-ENDOSCOPIC SINGLE-SITE SURGERY) NEPHRECTOMY
- Czech Urology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- IMMUNOSTIMULATION WITH POLYBACTERIAL LYSATE (URIVAC®) IN PREVENTING RECURRENT LOWER URINARY TRACT INFECTIONS
- COMPLICATIONS FOLLOWING LOCAL APPLICATION OF INORGANIC MATERIAL INTO THE SUBCUTANEOUS TISSUE OF PENIS
- ONCOLOGICAL TREATMENT OF PENILE CANCER FROM THE POINT OF VIEW OF RADIATION ONCOLOGIST
- EMPHYSEMATOUS PYELONEPHRITIS – DESCRIPTION OF SIX CASES

