VYUŽITÍ PRŮTOKOVÉ CYTOMETRIE PRO STANOVENÍ KVALITY EJAKULÁTU U MUŽŮ S PORUCHOU REPRODUKCE
Flow cytometry analysis of sperm quality in sub‑fertile men
Objective:
Overview of sperm quality data measured by flow cytometry.
Material and method:
800 sub‑fertile men (aged 21–66 years) were treated at GENNET – assisted reproduction centres. 366 patients had normal results and 434 patients had pathological parameters of semen analysis. Flow cytometry analyses of apoptotic sperm were done in all patients. DNA fragmentation rate was measured by TUNEL assay in 65 samples. The acrosome integrity was measured in 213 samples. Two groups of patients were set according to the number of apoptotic sperm in the semen samples – ApoHigh group included samples with > 50 % of apoptotic sperm and ApoLow group included samples with < 50 % of apoptotic sperm.
Results:
16.9 % of normal semen samples were ApoHigh as well as 53.9 % pathological semen. Higher average values of DNA fragmentation were detected in the ApoHigh group than in the ApoLow group both in normal semen (24.0 % vs. 13.5 %) and in pathologic semen too (33.3 % vs. 18.0 %). Higher average values of the acrosome integrity were detected in the ApoHigh group than in the ApoLow group both in normal semen (40.2 % vs. 23.9 %) and in the pathologic samples as well (53.1 % vs. 35.2 %).
Conclusion:
The presence of apoptotic sperm decreases the semen quality. The examination of apoptosis, DNA fragmentation and acrosome integrity together with microscopic semen analyses provide a better diagnostic tool how to identify sub‑fertile men, than simple semen analysis. These tests might be helpful for selection of patients for further uro‑andrological examination and treatment.
Keywords:
Apoptosis, DNA integrity, fertility, men, sperm quality.
:
Zuzana Krátká 1; Štěpánka Luxová 1; Viktor Vik 2
:
Imunologická laboratoř GENNET, s. r. o., Praha
1; Andrologie a urologie GENNET, s. r. o., Praha
2
:
Ces Urol 2017; 21(4): 289-298
:
Original Articles
Hlavní stanovisko:
Vyšetření spermiogramem neposkytuje dostatek informací o kvalitě spermií. Pomocí průtokové cytometrie je možné stanovit zastoupení apoptotických spermií v ejakulátu, fragmentaci jejich DNA a integritu akrozomu. Tyto testy umožňují diagnostikovat pacienty s rizikem nižší fertility, kteří by měli být vyšetřeni andrologem.
Cíl:
Přehled výsledků vyšetření kvality spermií pomocí průtokové cytometrie
Soubor pacientů a metody:
Vyšetření ejakulátu bylo provedeno u 800 mužů (ve věku 21–66 let) léčených v Centrech asistované reprodukce GENNET. Soubor zahrnoval 366 normozoospermiků a 434 pacientů s patologickým spermiogramem. Pomocí průtokové cytometrie byl u všech pacientů stanoven počet živých a apoptotických spermií, u 213 pacientů byl stanoven počet spermií s nízkou integritou akrozomu a u 65 pacientů byl stanoven počet spermií s fragmentací DNA metodou TUNEL. Pacienti byli rozděleni do skupiny ApoHigh s vysokým zastoupením apoptotických spermií (>50 % apoptotických spermií) a ApoLow s nízkým zastoupením apoptotických spermií (<50 % apoptotických spermií).
Výsledky:
U normozoospermiků bylo zjištěno 16,9 % ApoHigh vzorků, u pacientů s patologickým spermiogramem 53,9 % ApoHigh vzorků. Čím více je apoptotických spermií v ejakulátu, tím vyšší je výskyt fragmentace DNA a nízké integrity akrozomu. Průměrná hodnota fragmentace DNA byla vyšší u vzorků ApoHigh než u ApoLow jak u normozoospermiků (24,0 % vs. 13,5 %), tak u pacientů s patologickým spermiogramem (33,3 % vs. 18,0 %). Vyšší průměrný počet spermií s nízkou integritou akrozomu byl zjištěn u ApoHigh vzorků než u Apo ‑ Low jak u normozoospermiků (40,2 % vs. 23,9 %), tak u pacientů s patologickým spermiogramem (53,1 % vs. 35,2 %).
Závěr:
Vyšší zastoupení apoptotických spermií v ejakulátu snižuje jeho kvalitu. Test apoptózy spermií, fragmentace DNA a stanovení integrity akrozomu doplňují informace získané ze spermiogramu a umožňují vytipovat rizikové subfertilní pacienty, pro které je vhodné podrobné andrologické vyšetření.
Klíčová slova:
Apoptóza, integrita DNA, fertilita, muži, kvalita spermií.
ÚVOD
Infertilita postihuje 15 % párů v plodném věku, přibližně 48,5 milionů párů na celém světě (1, 2). U poloviny infertilních párů je příčina infertility zjištěna u mužů (2). Standardním vyšetřením kvality ejakulátu je spermiogram (3). Nicméně prediktivní význam spermiogramu, jako metody potvrzující fertilitu muže, je sporný (4, 5). Spermiogram hodnotí zejména koncentraci, pohyblivost a základní morfologii spermií (3). Ale fertilní spermie musí mít také kvalitní membránu s potřebnými receptory, nepoškozenou DNA, dostatek energie, musí obsahovat potřebné enzymy v akrozomu atd. (5)
Kvalitní DNA je nutná pro úspěšný vývoj embrya vzniklého přirozeným oplozením nebo při oplození pomocí metod asistované reprodukce (5, 6). Stanovení integrity DNA ve spermiích se považuje za velmi nadějný biomarker fertility, ale samo o sobě není dostatečně přesné pro spolehlivou predikci úspěšnosti přirozeného či in vitro provedeného oplození (7). Proto se doporučuje využívat další diagnostické postupy (5, 7). Jaká vyšetření jsou v současnosti dostupná v klinické diagnostice? A mají přínos pro klinickou praxi?
V tomto článku se zaměříme na analýzu kvality ejakulátu pomocí průtokové cytometrie. Základním cytometrickým vyšetřením je stanovení koncentrace spermií a přítomnosti leukocytů v ejakulátu. Pomocí specifického značení spermií je možné zjistit zastoupení živých a apoptotických spermií v ejakulátu, ověřit integritu akrozomu nebo stanovit fragmentaci DNA ve spermiích. Kombinací těchto metod získáme mnoho informací o kvalitě ejakulátu a na základě výsledků můžeme doporučit andrologickou léčbu pacientům s méně kvalitními spermiemi nebo zvolit nejvhodnější metodu in vitro reprodukce (5, 6).
MATERIÁL A METODY
Soubor pacientů
Vyšetřili jsme 800 mužů z párů s poruchou plodnosti ve věku 21–66 let léčených v Centrech asistované reprodukce GENNET, s. r. o. Ejakulát byl v odběrových místnostech odebrán masturbací do označené sterilní nádobky po doporučené tří až pětidenní pohlavní abstinenci. U všech vzorků byl proveden spermiogram v Laboratoři IVF GENNET Archa nebo Laboratoři IVF GENNET Kostelní, poté následovalo vyšetření průtokovou cytometrií v Imunologické laboratoři GENNET.
Metody
Spermiogram
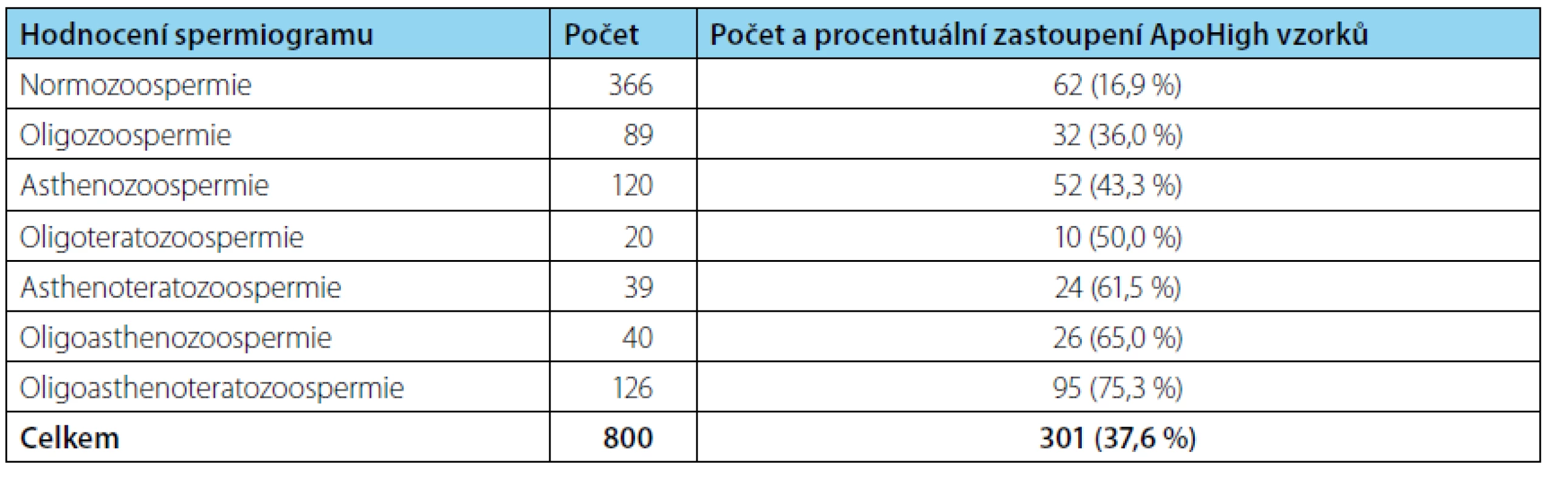
Vyšetření spermiogramu bylo provedeno podle doporučení WHO 2010. Soubor pacientů zahrnoval 366 normozoospermiků a 434 pacientů s patologickým spermiogramem (tabulka 1).
Cytometrické vyšetření
Zpracování ejakulátů bylo zahájeno v Imunologické laboratoři zpravidla do jedné hodiny, maximálně do čtyř hodin od odběru. Ke vzorkům byly přidány specifické fluorescenční reagencie a poté byly vzorky změřeny na průtokovém cytometru Navios Beckman Coulter. Hodnocení naměřených dat bylo provedeno softwarem Kaluza, verze 1.5.
Stanovení počtu živých a apoptotických spermií
Vzorek čerstvého ejakulátu jsme zpracovali podle instrukcí uvedených v soupravě ApoFlowEx®FITC kit (Exbio Praha, a. s.). Ke značení buněk jsme použili Annexin V – FITC (AN), který se váže na fosfatidylserin na povrchu apoptotických buněk, a propidium jodid (PI), který prostupuje do mrtvých buněk.
Na obrázku č. 1 jsou zřejmé tři základní populace buněk: živé spermie (AN - PI-), časně apoptotické spermie (AN+ PI-), mrtvé a pozdně apoptotické spermie (AN - PI+ a AN+ PI+). Uvedený postup značení apoptotických spermií byl použit v různých publikacích (8, 9, 10), ale nebyla v nich navržena fyziologická hranice.
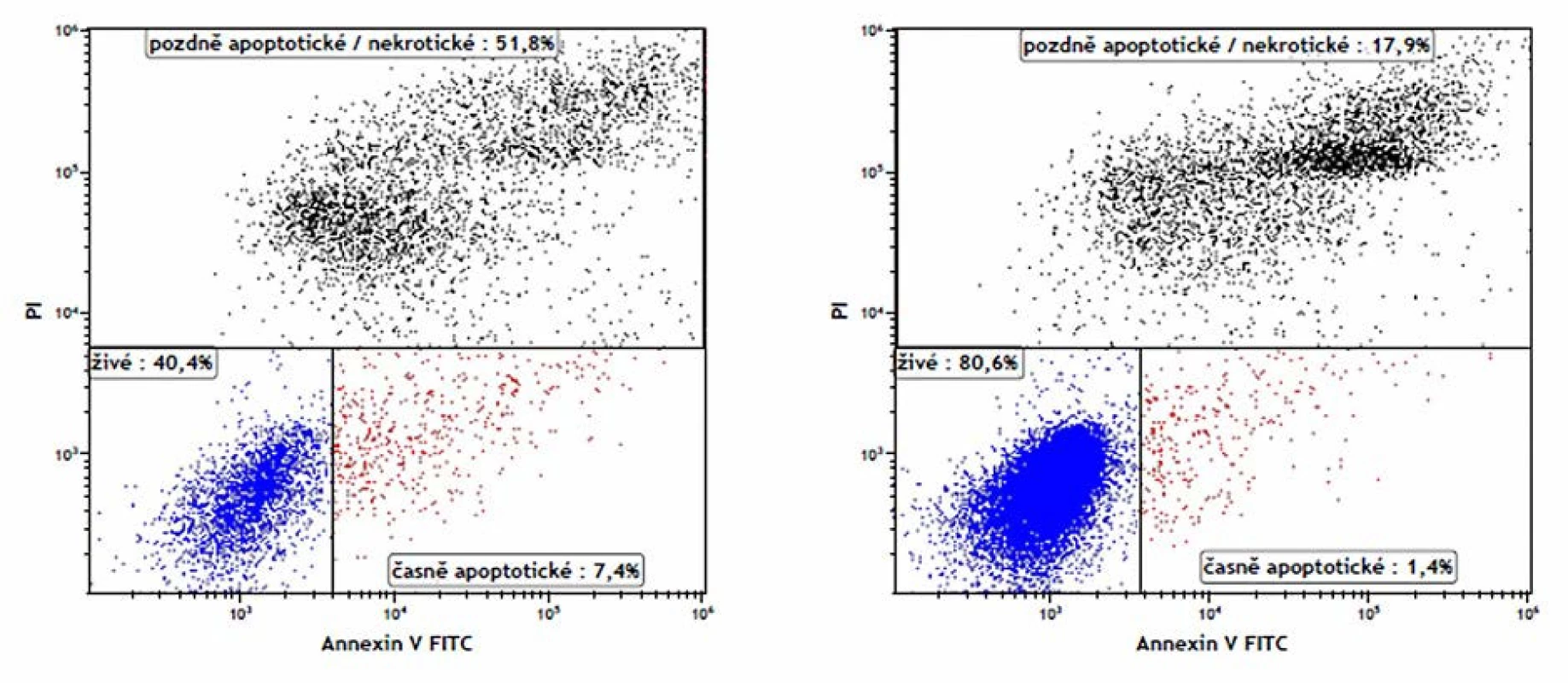
Fyziologická hodnota životnosti (tj. počet PI – buněk) odpovídá normě nastavené např. pro histologické barvení eosinem tj. >58 % (PI–) spermií (3). Při použití dvou reagencií současně (AN a PI) však rozlišujeme dvě populace buněk v rámci PI – spermií. Pro živé a časně apoptotické spermie bylo nutné nastavit hraniční hodnotu. Nejprve jsme spočítali průměrnou hodnotu časně apoptotických spermií u skupiny 20 mužů normozoospermiků (s vitalitou vyšší než 58 %, fragmentací DNA nižší než 20 %, ve věku 26–50 let). Průměrný počet časně apoptotických spermií (AN+ PI–) byl 8 % (rozmezí hodnot 2,5–15,6). Tuto hodnotu jsme odečetli od 58 % (životnost značená pouze PI). Fyziologická hodnota pro živé spermie (AN – PI–) byla nastavena na >50 %.
Stanovení integrity akrozomu
Vzorek ejakulátu jsme zpracovali podle instrukcí uvedených ve SpermFlowEx® kitu (Exbio Praha, a. s.). Principem metody je vazba intraakrozomální protilátky Hs-8-FITC na proteiny přítomné v akrozomu. Vazba protilátky proběhne, pokud je akrozom prostupný (má nízkou integritu membrány). Fyziologická hodnota je <30 % spermií.
Stanovení počtu spermií s fragmentovanou DNA metodou TUNEL (terminal deoxynucleotidyl transferase dUTP nick end labeling)
Ejakulát jsme zpracovali dle postupu uvedeném v soupravě Apo DirectTM (Phoenix Flow Systems). Principem metody je specifická vazba fluorescenčně značeného deoxyuridine trifosfátu (f‑dUTP) na 3’ - OH konce jednovláknové i dvouvláknové DNA (11, 12). Specifickou vazbu f‑dUTP na fragmenty DNA katalyzuje enzym terminální deoxynukleotidyltransferáza. Po změření vzorku v průtokovém cytometru jsme hodnotili zastoupení spermií s navázaným f‑dUTP. Fyziologická norma pro fragmentaci DNA stanovená metodou TUNEL je <20 % spermií (11, 12).
VÝSLEDKY
Stanovení apoptózy spermií
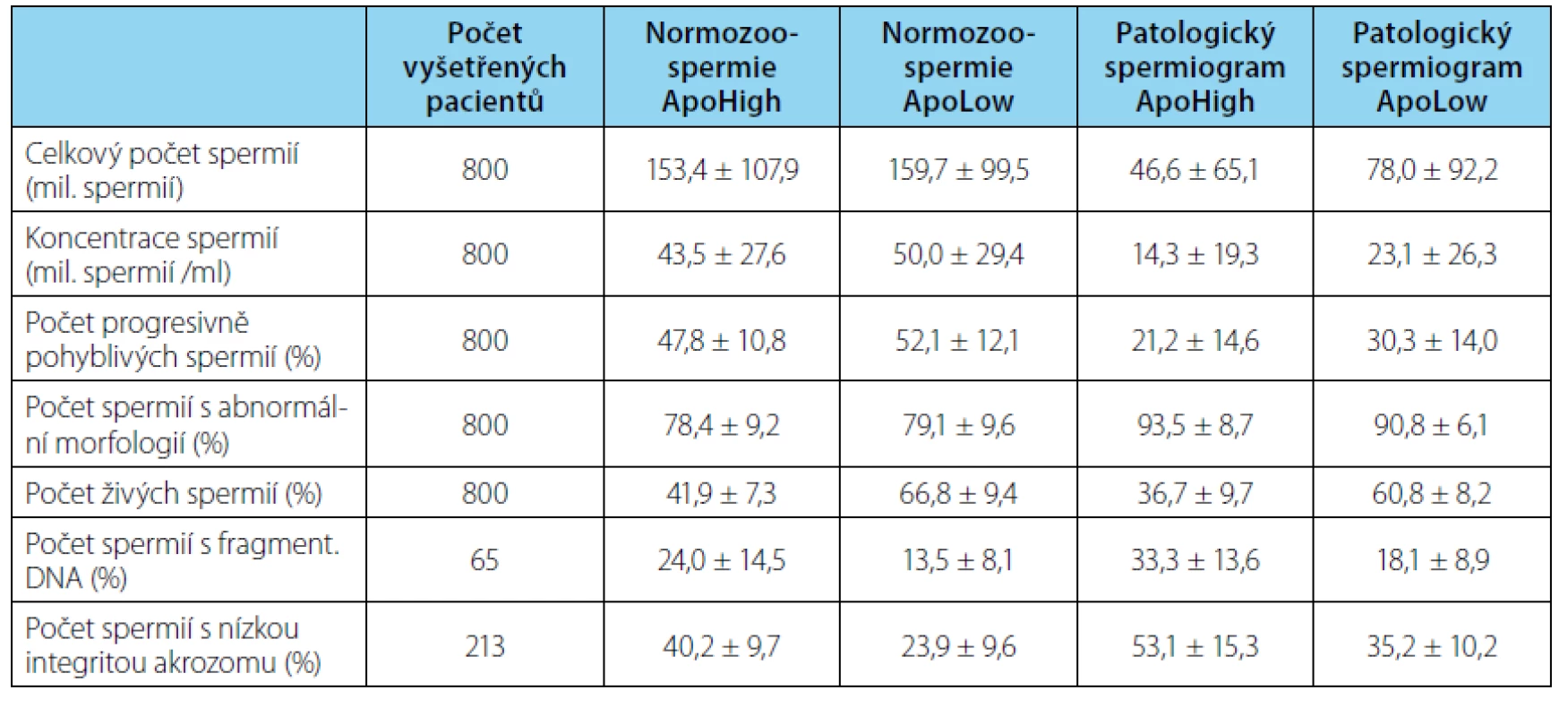
U všech pacientů jsme provedli vyšetření apoptózy spermií. Na základě počtu živých (AN - PI-) spermií jsme rozdělili vzorky na skupinu ApoLow s nízkým zastoupením apoptotických spermií (50 % spermií). 37,1 % vyšetřených vzorků ejakulátu mělo vyšší zastoupení apoptotických spermií (byly označeny jako ApoHigh) (tab. 1). Ve skupině normozoospermiků bylo zjištěno 16,9 % ApoHigh vzorků, ve skupině pacientů s patologickým spermiogramem bylo 53,9 % ApoHigh vzorků. Průměrné hodnoty procenta živých spermií u normozoospermiků a pacientů s patologickým spermiogramem jsou uvedeny v tabulce 2. V ní jsou obě skupiny pacientů rozdělené na ApoHigh a ApoLow podskupiny.
Výsledky spermiogramu u pacientů s vysokým a nízkým počtem apoptotických spermií
Průměrné hodnoty celkového počtu spermií, koncentrace spermií, progresivní pohyblivosti a abnormální morfologie u skupiny normozoospermiků a skupiny pacientů s patologickým spermiogramem jsou uvedeny v tabulce 2. V těchto parametrech jsme nezjistili významné rozdíly mezi ApoHigh a ApoLow podskupinami ani u normozoospermiků, ani u pacientů s patologickým spermiogramem.
Stanovení spermií s DNA fragmentací
Vzhledem k časové a finanční náročnosti je vyšetření fragmentace DNA ve spermiích zavedeno jako doplňkový test kvality spermií. Vyšetřili jsme proto jen 65 pacientů. U 40,0 % pacientů jsme zjistili patologické hodnoty fragmentace DNA. Vzorky z podskupiny ApoHigh měly vyšší průměrnou hodnotu počtu spermií s fragmentací DNA než vzorky ApoLow (tabulka 2) jak u normozoospermiků (24,0 % vs. 13,5 %), tak u pacientů s patologickým spermiogramem (33,4 % vs. 18,1 %). Závislost počtu spermií s fragmentací DNA na počtu apoptotických spermií je uvedena v grafu 1. U pacientů s méně než 30 % apoptotických spermií byla fragmentace DNA v normě.

Stanovení integrity akrozomu
Vyšetření integrity akrozomu jsme provedli u 213 pacientů. U 54,4 % byl vyšší počet spermií s narušenou integritou akrozomu. Významně vyšší průměrné počty spermií s narušenou integritou akrozomu jsme zjistili u podskupin ApoHigh v porovnání s ApoLow (tab. 2) jak u normozoospermiků (40,2 % vs. 23,9 %), tak u pacientů s patologickým spermiogramem (53,1 % vs. 35,3 %). Závislost počtu spermií s nízkou integritou akrozomu na počtu apoptotických spermií v ejakulátu je uvedena v grafu 2. U pacientů s méně než 30 % apoptotických spermií byla kvalita akrozomu v normě s výjimkou jediného pacienta.

DISKUZE
Spermie velmi citlivě reagují na zdravotní stav muže. Jejich kvalita je ovlivněna věkem, probíhajícími infekcemi, hormonální nerovnováhou, varikokélou, nedostatečnou výživou, některými systémovými onemocněními apod. (13, 14). Vyšší apoptóza spermií souvisí s kouřením, obezitou nebo častou expozicí spermií vysokým teplotám např. při saunování. Na spermie negativně působí užívání drog, anabolik a některých léků (15) nebo radiace, přítomnost toxických látek a těžkých kovů v prostředí (16). Apoptóza ovlivňuje produkci zárodečných buněk muže od časného vývoje až po fertilizaci (14). V časném embryonálním vývoji se prostřednictvím apoptózy reguluje ideální poměr spermatogonií a Sertoliho buněk v testes. V dospělosti jsou apoptózou eliminovány poškozené zárodečné buňky, čímž se snižuje riziko vytváření spermií s nekvalitní DNA. Smrt apoptózou je osudem všech spermií, které se po ejakulaci dostaly do pohlavních cest ženy a nebyly natolik úspěšné, aby oplodnily vajíčko. Apoptotické spermie jsou bezpečně odklizeny imunitním systémem bez vyvolání zánětlivé reakce. Z pohledu fertility není problém apoptóza samotná, ale spíše její načasování a poměr živých a apoptotických spermií v ejakulátu.
Jedním z prvních znaků apoptózy je aktivace tvorby ROS (reaktivních forem kyslíku) mitochondriemi spermií, při níž dochází ke změnám v membránovém potenciálu mitochondrií, postupné ztrátě pohyblivosti spermií, aktivaci kaspáz, endonukleáz a změnám ve složení membrány buněk (14, 17). Působením oxidačního stresu dochází ve spermiích k poškození DNA a na povrchu apoptotických spermií se objeví fosfatidylserin, který využíváme při detekci apoptotických spermií. Cytometrické vyšetření apoptotických spermií pomocí AN a PI je velmi rychlé a metodicky jednoduché. Na našem pracovišti bylo vyšetření apoptózy spermií zařazeno společně se spermiogramem do standardního vyšetřovacího schématu mužů z párů se sníženou fertilitou.
Vyšší zastoupení apoptotických spermií (>50 % apoptotických spermií) bylo zjištěno u 37,6 % vzorků získaných od 800 pacientů. Velmi přínosné je toto stanovení u normozoospermiků. Zjistili jsme, že 16,9 % normozoospermiků mělo vysoké zastoupení apoptotických spermií, což u nich zvyšovalo riziko vyšší fragmentace DNA. Tato hodnota odpovídá údajům uvedeným v publikaci Agarwal et al. (2), která uvádí, že 15 % normozoospermiků má sníženou fertilitu, která se projeví nízkou kvalitou embryí. Cytometrické vyšetření apoptózy spermií tak umožňuje včas odhalit a léčit normozoospermiky s rizikem nižší fertility.
K vyšetření fragmentace DNA ve spermiích jsme použili metodu TUNEL (11, 12). Stanovení fragmentace DNA metodou TUNEL patří mezi prognosticky nejpřesnější metodu (7), nicméně je výrazně časově i finančně náročnější v porovnání se stanovením apoptózy spermií. Vyšetřili jsme proto pouze část pacientů – 65 mužů – a u 40 % z nich jsme zjistili vyšší hodnoty fragmentace DNA. Doporučujeme vyšetřovat fragmentaci DNA společně s apoptózou spermií, pokud je dodán čerstvý ejakulát, protože se oba testy vzájemně informačně potvrzují. U pacientů s méně než 30 % apoptotických spermií jsme nezjistili překročení fyziologické hranice fragmentace DNA.
Vztah mezi fragmentací DNA a úspěšností metod asistované reprodukce se sledoval v desítkách klinických studií a v několika metaanalýzách (7, 18). V případě vysoké fragmentace DNA byl zjištěn nižší počet těhotenství, ale publikace se neshodují v tom, zda pouhá znalost fragmentace DNA stačí pro předpověď úspěšnosti metod asistované reprodukce (7, 18). Jednou z příčin rozdílných závěrů metaanalýz je fakt, že existují různé postupy v diagnostice fragmentace DNA. Kromě metody TUNEL se používá i cytometrická metoda SCSA (sperm chromatin structure assay) (4). Existují i mikroskopické metody stanovení fragmentace jako Comet assay nebo Hallo Sperm Assay (19).
Fertilní lidské spermie použitelné pro přirozené oplození vajíčka potřebují mít kvalitní akrozom. K detekci integrity akrozomu jsme použili protilátku proti intraakrozomálnímu proteinu označovanou jako Hs-8 (20). Vyšší průměrný počet spermií s narušenou integritou akrozomu se vyskytoval u ApoHigh podskupin než u ApoLow podskupin jak u normozoospermiků (40,2 % vs. 23,9 %), tak u pacientů s patologickým spermiogramem (53,1 % vs. 35,2 %). Podobně vyšší průměrný počet spermií s nízkou integritou akrozomu stanovený průtokovou cytometrií byl zjištěn u pacientů s asthenozoospermií než u normozoospermiků také v práci Čapková et al. (21).
Nízká integrita akrozomu se může vyskytovat u poškozených spermií, apoptotických spermií nebo u živých spermií, u kterých došlo k předčasné kapacitaci. Kapacitace spermií se standardně odehrává až v reprodukčním traktu ženy a je aktivována vyšší koncentrací ROS (14). Stimulátorem kapacitace mohou být také estrogeny, které aktivují estrogenové receptory na hlavičce spermií (22). Zpravidla jde o endogenní estrogeny produkované v organizmu ženy. Ale spermie mohou být aktivovány také exogenními estrogeny, které jsou přítomné v prostředí, např. v pitné vodě kontaminované hormonální antikoncepcí. Negativní efekt exogenních estrogenů na kapacitaci spermií byl potvrzen na myším modelu. Jejich působením došlo k předčasné aktivaci myších spermií již v nadvarleti a zvířata vystavená exogenním estrogenům byla méně fertilní než kontrolní. Předpokládá se, že exogenní estrogeny mohou ovlivnit také fertilitu spermií mužů.
Jaký je klinický přínos cytometrického vyšetření spermií? Test apoptózy spermií je používán na našem pracovišti jako screeningový test doplňující spermiogram. Při opakovaně patologických výsledcích apoptózy spermií doporučujeme pacientovi andrologické vyšetření. Příčin vysoké koncentrace apoptotických spermií může být několik např. anatomická či funkční abnormalita, infekce, hormonální nerovnováha, genetická abnormalita nebo porucha imunity (6). Cílená specifická léčba, podpůrná léčba antioxidanty a změna životního stylu mohou přispět ke zlepšení kvality spermií, i když jsou současné možnosti léčby omezené. Doporučujeme také sledování dynamiky procesu – opakovaným vyšetřením apoptózy spermií můžeme zachytit pokles počtu apoptotických spermií v případě pozitivního efektu léčby. Naopak při vzestupu počtu apoptotických spermií stoupá např. riziko přítomnosti mikrobiální infekce. Stanovení apoptotických spermií může pomoci i při výběru metody asistované reprodukce. Časně apoptotické spermie jsou špatně mikroskopicky rozeznatelné od živých a mohou být omylem použity na in vitro oplození (5). Kvalitní oocyt umí opravit poškozenou DNA, nicméně tato schopnost klesá u oocytů starších žen (23). Pro potřeby asistované reprodukce jsou vyvíjeny metody umožňující selekci spermií s kvalitní DNA. Jednou z možností je magnetická separace apoptotických spermií (MACS). Kovové kuličky s navázaným annexinem V jsou přidány ke spermiím a naváží se na apoptotické spermie. Pomocí separační kolony umístěné v magnetickém poli se suspenze buněk rozdělí – v koloně se zadrží apoptotické spermie a do zkumavky protečou živé spermie. Ty je možné použít na metody asistované reprodukce (17, 28).
ZÁVĚR
Kvalita spermií výraznou měrou ovlivňuje výsledek oplození oocytu. Vyšší výskyt apoptotických spermií s fragmentovanou DNA v ejakulátu je jednou z příčin nekvalitního vývoje embryí in vitro. Vyšetření spermií pomocí průtokové cytometrie poskytuje informace o zastoupení živých a apoptotických spermií, fragmentaci DNA a integritě akrozomu. U mužů s vyšším zastoupením apoptotických spermií doporučujeme provést andrologické vyšetření. Získané informace o kvalitě spermií mohou přispět také k volbě vhodných postupů zpracování ejakulátu před in vitro oplozením vajíčka. Zvláště u starších párů může být tento přístup přínosný pro zvýšení úspěšnosti cyklů asistované reprodukce.
Střet zájmů: žádný
Prohlášení o podpoře: Autor prohlašuje, že zpracování článku nebylo podpořeno farmaceutickou firmou.
Došlo: 25. 10. 2017
Přijato: 16. 11. 2017
Kontaktní adresa: RNDr. Zuzana Krátká, Ph.D.
Imunologická laboratoř GENNET, s. r. o. Na Poříčí 26, 110 00 Praha 1
e-mail: zuzana.kratka@gennet.cz
Sources
1. Sharlip ID, Jarow JP, Belker AM, et al. Best practice policies for male infertility. Fertil Steril 2002; 77 : 873–882.
2. Agarwal A, Mulgund A, Hamada A, Chyatte MR. A unique view on male infertility around the globe. Reprod Biol Endocrinol 2015; 13 : 37. doi: 10.1186/s12958–015–0032–1
3. WHO World health organization laboratory manual for examination of human semen. 5th ed. Geneve: WHO press 2010.
4. Evenson DP. The sperm chromatin structure assay (SCSA) and other sperm DNA fragmentation tests for evaluation of sperm nuclear DNA integrity as related to fertility. Anim Reprod Sci 2016; 169 : 56–75.
5. Sakkas D, Ramalingam M, Garrido N, Barratt CLR. Sperm selection in natural conception: what can we learn from mother nature to improve assisted reproduction outcomes? Hum Reprod Update 2015; 21(6): 711–726.
6. Aitken RJ, Koppers AJ. Apoptosis and DNA damage in human spermatozoa. Asian J Androl 2011; 13 : 36–42.
7. Cissen M, Wely MV, Scholten I, et al. Measuring Sperm DNA fragmentation and clinical outcomes of medically assisted reproduction: a systematic review and meta‑analyses. PLoS One 2016; 11(11): e0165125.doi: 10.1371/journal.pone.0165125.
8. Oosterhuis GJ, Mulder AB, Kalsbeek‑Batenburg EK, et al. Measuring apoptosis in human spermatozoa: a biological assay for semen quality? Fertil Steril 2000; 74(2): 245–250.
9. Glander HJ, Schaller J. Binding of annexin V to plasma membranes of human spermatozoa: a rapid assay for detection of membrane changes after cryostorage. Mol Hum Reprod 1999; 5(2): 109–115.
10. Vermes I, Haanen C, Steffens‑Nakken H, Reutelingsperger CPM. A novel assay for apoptosis. Flow cytometric detection of phosphatidylserine expression on early apoptotic cells using fluorescein labelled Annexin V. J Immunol Methods 1995; 184 : 39–51.
11. Sergerie M, Laforest G, Bujan L, Bissonnette F, Bleau G. Sperm fragmentation: treashold value in male fertility. Hum Reprod 2005; 20(12): 3446–3451.
12. Sharma RK, Sabanegh E, Mahfouz R, et al. TUNEL as a test for sperm DNA damage in the evaluation of male infertility. Urology 2010; 76(6): 1380–1386.
13. Krátká Z. Kvalita DNA ve spermiích je negativně ovlivněna věkem mužů a je rizikovým faktorem početí. Ces. Gynek. 2017; 82 (6): 490–494.
14. Aitken RJ, Baker MA. Causes and consequences of apoptosis in spermatozoa; contributions to infertility and impacts on development. Int J Dev Biol 2013; 57 : 265–272.
15. Semet M, Paci M, Saïas‑Magnan J, et al. The impact of drugs on male fertility: a review. Andrology 2017; 5(4): 640–663.
16. Vecoli C, Montano L, Andreassi MG. Environmental pollutans: genetic damage and epigenetic changes in male germ cells. Environ Sci Pollut Res 2016; 23 : 23339–23348.
17. Aziz N, Said T, Paasch U, Agarwal A. The relationship between human sperm apoptosis, morphology and the sperm deformity index. Hum Reprod 2007; 22(5): 1413–1419.
18. Simon L, Zini A, Dyachenko A, Ciampi A, Careell DT. A systematic review and meta‑analysis to determine the effect of sperm DNA damage on in vitro fertilization and intracytoplasmic sperm injection outcome. Asian J Androl 2017; 19 : 80–90.
19. Novotná B, Svobodová L, Čechová M, et al. Naše první zkušenosti s využitím kometového testu při hodnocení integrity DNA ve spermiích. Ces Urol 2016; 20(4): 317–325.
20. Peknicova J, Chladek D, Hozak P. Monoclonal antibodies against sperm intra‑acrosomal antigens as markers for male infertility diagnostics and estimation of spermatogenesis. AJRI 2005; 53 : 42–49.
21. Capkova J, Kubatova A, Ded L, Tepla O, Peknicova J. Evaluation of the expression of sperm proteins in normozoospermic and asthenozoospermic men using monoclonal antibodies. Asian J Androl 2016; 18(1): 108–113.
22. Sebkova N, Cerna M, Ded L, Peknicova J, Dvorakova‑Hortova K. The slower the better: how sperm capacitation and acrosome reaction is modified in the presence of estrogens. Reproduction 2012; 143 : 297–307.
23. Meseguer M, Santiso R, Harrero S, Remohi J, Fernandesz JL. Effect of sperm DNA fragmentation on pregnancy outcome depends on oocyte quality. Fertil Steril 2011; 95(1): 124–128.
24. Gil M, Sar‑Shalom V, Sivira YM, Carreras R, Checa MA. Sperm selection using magnetic activated cell sorting (MACS) in assisted reproduction: a systematic review and meta‑analysis. J Assist Reprod Genet 2013; 30 : 479–485.
Labels
Paediatric urologist Nephrology UrologyArticle was published in
Czech Urology

2017 Issue 4
-
All articles in this issue
- Laparoscopic nerve sparing extraperitoneal radical prostatectomy – video
- Home‑based sperm analysis with a smartphone? Welcome to the age of telespermatology
- Flow cytometry analysis of sperm quality in sub‑fertile men
- A solitary skeletal metastasis in the thumb of a silent bilateral clear cell renal cell carcinoma pT1a in a patient with a sporadic uro‑oncological triplicity
- Paratesticular malignant mesothelioma
- Agranulocytosis after analgesic treatment for renal colic
- Untypical secondary cancer after radiotherapy for prostate cancer
- A remarkable anniversary of Assoc. Prof. Radko Petřík, MD, CSc.
- Highlights of the Czech Urological Society Annual Meeting in conjunction with CEM in Pilsen in October 2017
- Results of the 2016 Best Scientific Publication competition of the Czech Urological Society
- Lynch syndrome in the hands of the urologist
- Laudation in honour of an anniversary of Assoc. Prof. Jan Krhut, M.D., Ph.D.
- Assoc. Prof. Miloš Broďák, M.D., Ph.D., celebrates his anniversary
- Czech Urology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Agranulocytosis after analgesic treatment for renal colic
- Home‑based sperm analysis with a smartphone? Welcome to the age of telespermatology
- Assoc. Prof. Miloš Broďák, M.D., Ph.D., celebrates his anniversary
- Flow cytometry analysis of sperm quality in sub‑fertile men
