Akantolytický variant skvamózneho karcinómu prsnej žľazy. Kazuistika a prehľad literatúry
Acatholytic Variant of Squamous Carcinoma of the Breast. A Case Report and Review of Literature
The acantholytic variant of squamous carcinoma (ASC) represents a rare type of metaplastic breast carcinoma with typical occurrence of pseudoglandular and pseudovascular structures, arising as a result of cohesion loss between the neoplastic cells. Up to the present, there have been only 10 cases of mammary ASC described in the English written literature.
The authors present a case of a 57-year-old woman with a large (6 x 7 cm) suspicious lump on ultrasonography in her right breast treated by mastectomy with an ipsilateral axillary lymph node dissection due to histologically verified ASC. Additional postoperative staging computer tomography revealed metastatic foci in the left lungs, thus calling for adjuvant chemotherapy for the patient. Six months after setting the diagnosis, the patient is alive with a partial therapeutic response.
In the differential diagnosis of ASC it is important to exclude angiosarcoma, phyllodes tumor and metastatic sarcomas to the breast. The useful tools for differentiation between the above-mentioned entities are extensive bioptic examination and detailed immunohistochemical staining, enabling the pathologist to exclude the endothelial lineage (using CD31 and CD34) and to verify the epithelial origin through the detection of cytokeratins (spectra of high-molecular weight cytokeratins). Furthermore, the ASC shows positive immunohistochemical staining for markers of the myoepithelial differentiation, e.g. cytokeratin 14, CD10 and p63, suggesting an immature cell population with basaloid features.
In conclusion, as ASC is an aggressive subtype of the breast carcinoma with a poor prognosis, the correct diagnosis set by the pathologist is of great importance on the therapeutic management in affected patients.
Keywords:
carcinoma of the breast – metaplastic carcinoma – squamous carcinoma – acantholytic carcinoma
Authors:
K. Kajo 1,2; K. Macháleková 3; M. Kajo 1; P. Žúbor 4
Authors‘ workplace:
Ústav patologickej anatómie, JLF UK a UN, Martin
1; BB BIOCYT, diagnostické centrum, s. r. o., Banská Bystrica
2; Oddelenie patológie, Onkologický ústav svätej Alžbety, s. r. o., Bratislava
3; Gynekologicko-pôrodnícka klinika, JLF UK a UN, Martin
4
Published in:
Čes.-slov. Patol., 47, 2011, No. 4, p. 184-188
Category:
Original Article
Overview
Akantolytický variant skvamózneho karcinómu (ASC) je zriedkavá forma metaplastického nádoru prsníka, ktorý je charakterizovaný výskytom pseudoglandulárnych a pseudovaskulárnych štruktúr spôsobených stratou kohezivity medzi bunkami. Doteraz bolo opísaných len 10 prípadov mamárneho ASC.
Autori prezentujú prípad 57- ročnej ženy s ASC pravého prsníka, pre ktorý pacientka podstúpila mastektómiu s disekciou axilárnych lymfatických uzlín. Dodatočnými vyšetreniami pomocou počítačovej tomografie sa dokázali metastázy v ľavých pľúcach a pacientka následne podstúpila chemoterapiu. Šesť mesiacov od stanovenia diagnózy je pacientka v remisii s parciálnou liečebnou odpoveďou.
V diferenciálnej diagnostike ASC je nutné odlíšiť angiosarkóm, phyllodes tumor a metastatické sarkómy v prsníku, pričom nástrojmi na oddiferencovanie sú starostlivé a extenzívne bioptické vyšetrenie a cielený imunohistochemický panel na vylúčenie endoteliálnej diferenciácie, napr. CD31 a CD34 a potvrdenie epitelového pôvodu dôkazom široko-spektrálnych a vysoko-molekulových cytokeratínov. ASC sa vyznačuje aj expresiou markerov myoepiteliálnej diferenciácie, napr. cytokeratínu 14, CD10 a p63, čo svedčí pre nezrelú bunkovú populáciu s bazaloidnými črtami.
ASC predstavuje agresívny podtyp karcinómu prsníka so zlou prognózou, a preto jeho poznanie má význam pre následný terapeutický manažment.
Kľúčové slová:
karcinóm prsníka – metaplastický karcinóm – skvamózny karcinóm – akantolytický karcinóm
Akantolytický variant skvamózneho karcinómu (ASC) je zriedkavý histomorfologický podtyp metaplastického karcinómu prsnej žľazy, ktorý sa vyznačuje značnou akantolýzou. Jej výsledkom je tvorba charakteristických pseudoglandulárnych a pseudovaskulárnych formácií imitujúcich žľazový alebo cievny pôvod lézie (1). Najčastejším miestom vzniku ASC je koža (2,3–5), avšak sporadické prípady ASC boli opísané aj na niektorých slizničných membránach a v orgánoch, ako sú ústna dutina, pľúca, cervix, penis a slepé črevo (2,6–11). V prsníku bolo doteraz zaznamenaných len 10 prípadov ASC (1,12–14). Cieľom našej prezentácie je opísať ďalší prípad mamárneho ASC s jeho jedinečnými histomorfologickými a imunohistochemickými charakteristikami.
VLASTNÉ POZOROVANIE
Išlo o 57- ročnú ženu s manicko-depresívnou psychózou a s anamnézou pádu a udretia pravého prsníka pred troma mesiacmi, po čom mala prsník „celý modrý“ a ostala v ňom „hrča“. Pri ultrasonografickom vyšetrení išlo o tumor veľkosti 68 x 52 mm v dolnom laterálnom kvadrante. Nádor nesúvisel s kožným krytom a u pacientky nebol nájdený ďalší nádor na koži. Pacientka podstúpila pravostrannú mastektómiu s disekciou axilárnych lymfatických uzlín.
Makroskopicky išlo o nádor dosahujúci veľkosť 7 cm v najväčšom rozmere s centrálnou dutinou. V histologickom obraze tumor pozostával z rozsiahlych partií tvorených spleťou nepravidelných, vetvených a miestami navzájom komunikujúcich kanálov, ktoré boli lemované značne atypickými bunkami so zreteľnou eozinofilnou cytoplazmou a mitotickou aktivitou približne 20 až 30 mitóz na 10 HPF. Ojedinele sa v lúmene niektorých štrbín nachádzali voľné erytrocyty (obr. 1). Fokálne nádorové štruktúry pripomínali pseudoangiomatóznu stromálnu hyperpláziu (obr. 2) a prítomné boli aj rôzne rozsiahle okrsky s vretenobunkovou diferenciáciou (obr. 3), resp. so zhlukmi skvamoidných buniek. V centrálnej časti sa nachádzala dutina vystlaná neoplasticky transformovaným dlaždicovým epitelom, ktorý v podobe infiltratívnych čapov zabiehal do hlbších partií (obr. 4). Len v mikrookrskoch bola prítomná žľazová diferenciácia v podobe rudimentárnej tvorby nepravidelných glandulárnych štruktúr. Akantolytické zmeny tvorili približne 70 % z rozsahu vyšetreného nádorového tkaniva. Jednoznačná angioinvázia v rozsahu vyšetrených vzoriek nebola nájdená.
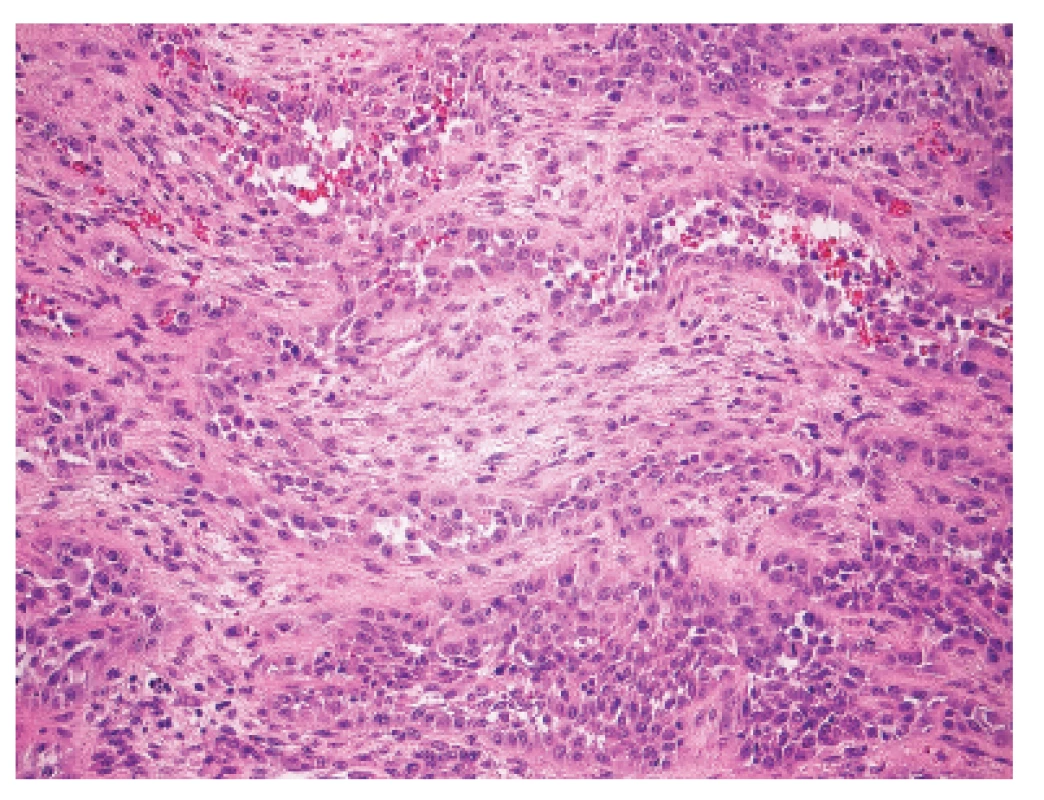
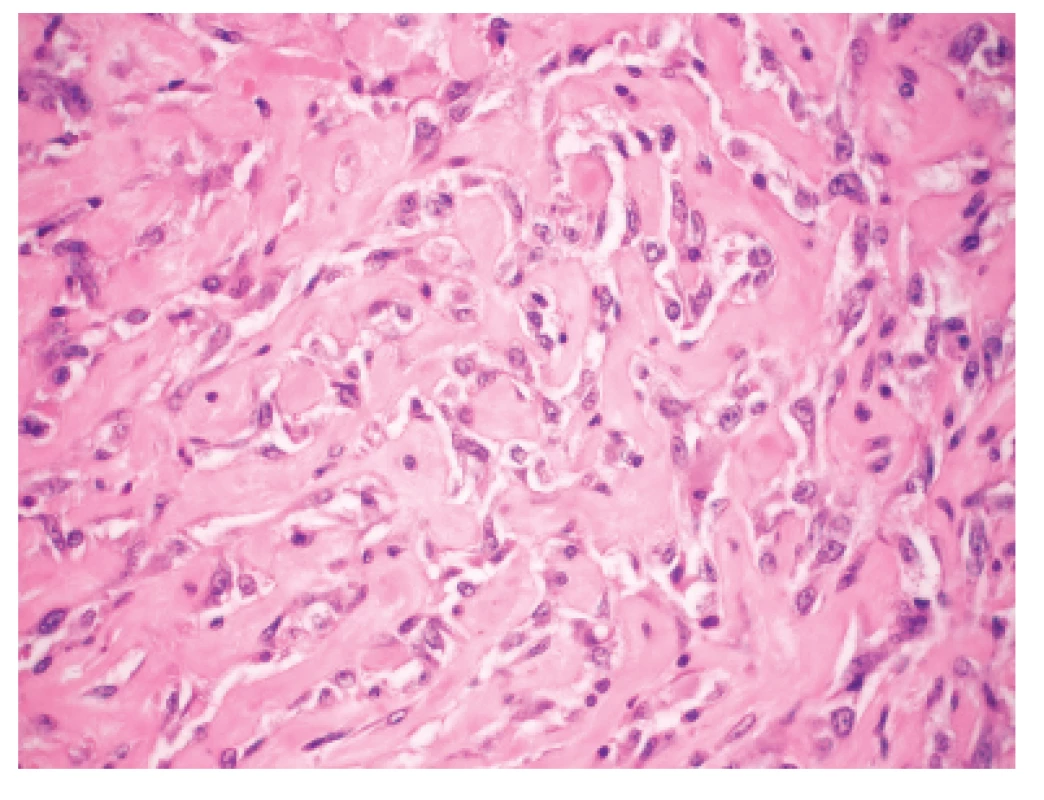
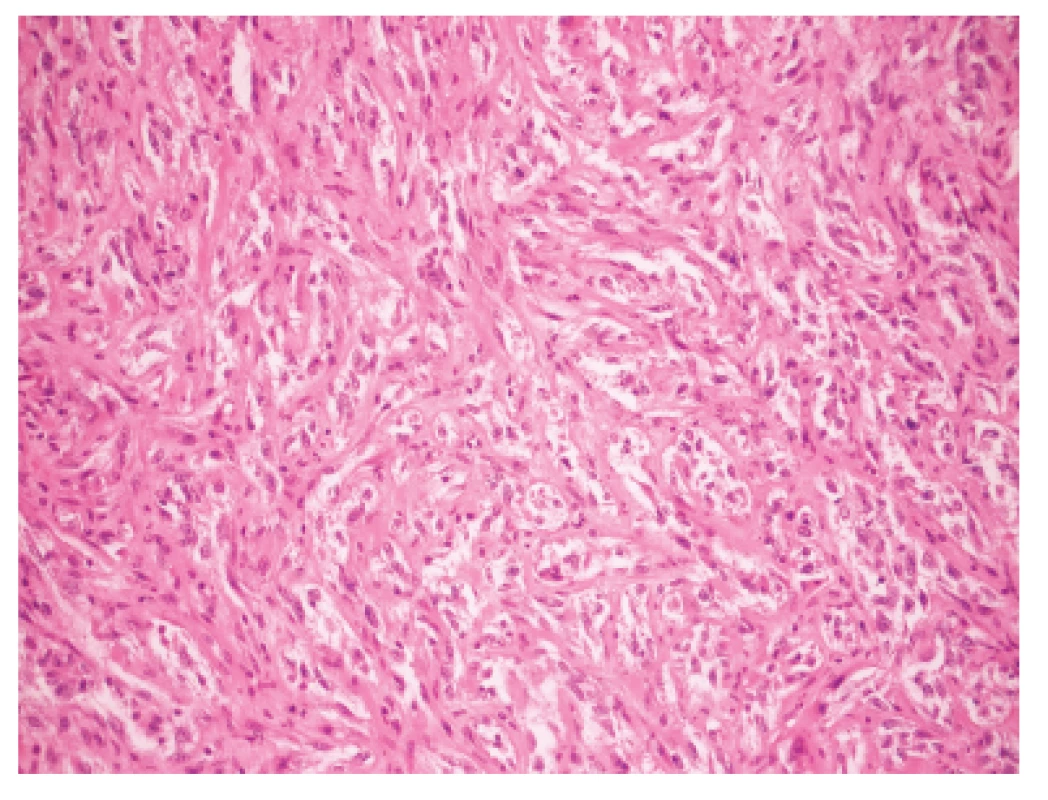
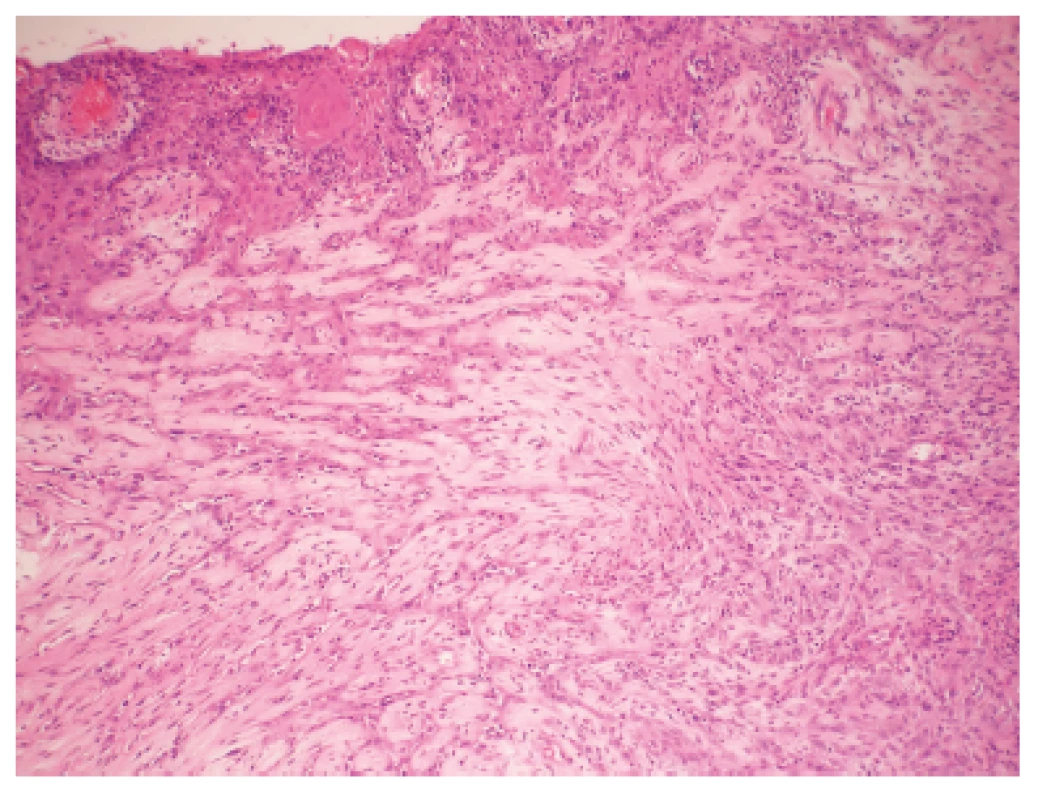
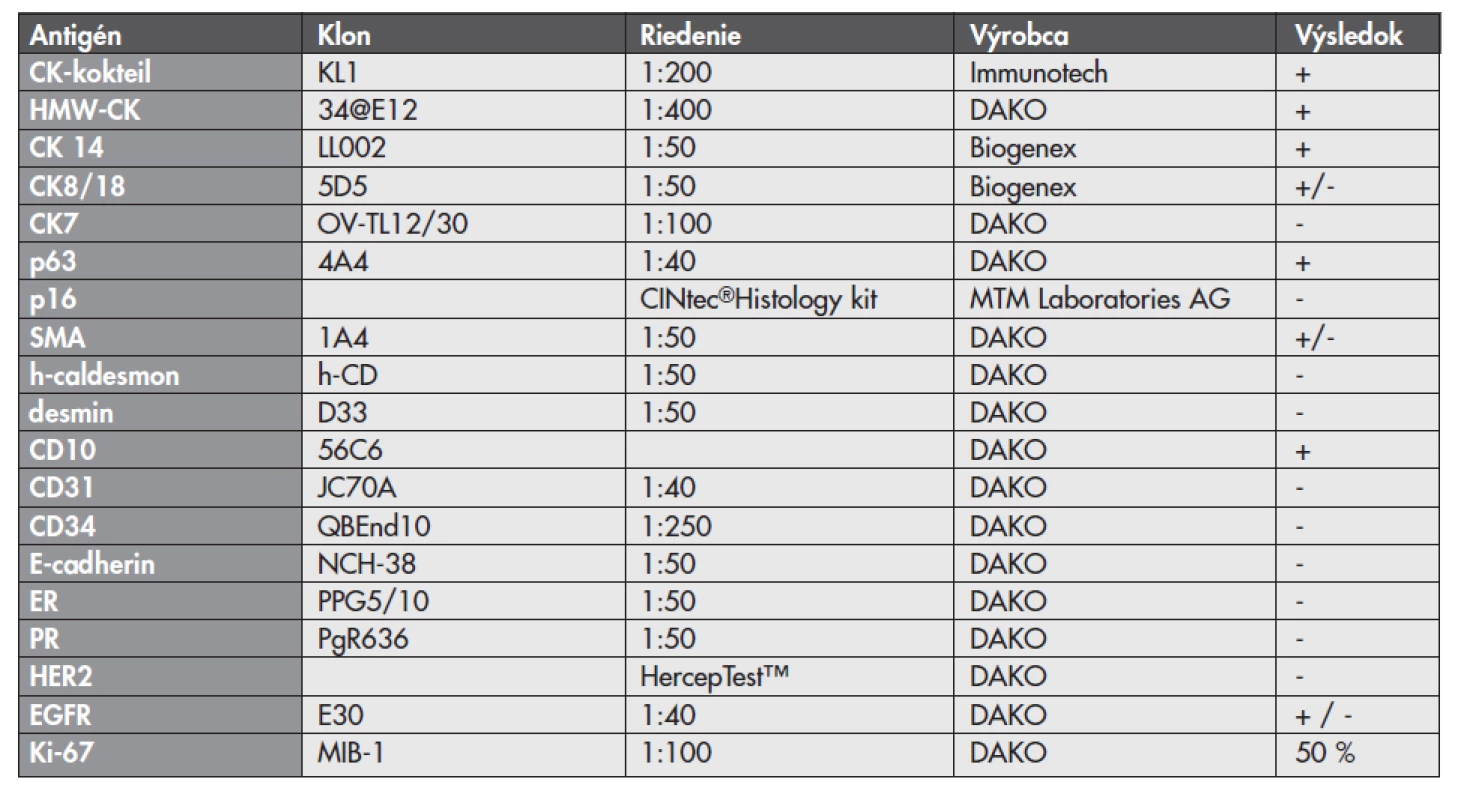
Zoznam použitých protilátok, základné charakteristiky imunohistochemicky sledovaných markerov a výsledok ich expresie sú uvedené v tabuľke 1. Nádorové bunky vykazovali expresiu cytokeratínového kokteilu (KL1) a ďalších markerov myoepiteliálnej diferenciácie, ako sú vysoko-molekulové cytokeratíny (HMW-CK), CK 14, p63 a CD10 (obr. 5). Fokálne bola dokázaná membránová expresia EGFR, pozitivita hladko-svalového aktínu a tiež slabá expresia CK8/18. Dôkaz p16, CK7, dezmínu, h-caldesmonu, estrogénových a progesterónových receptorov a HER2 (HercepTest, DAKO) bol negatívny. Taktiež E-cadherin nebol v miestach vystupňovaných akantolytických zmien prítomný. Nádorové bunky boli negatívne pri dôkaze markerov endoteliálnej diferenciácie, napr. CD31 a CD34 (obr. 6). Proliferačná aktivita bola vysoká a dosahovala pri farbení Ki-67 index 40 %. Vo vyšetrených axilárnych lymfatických uzlinách neboli dokázané metastázy.
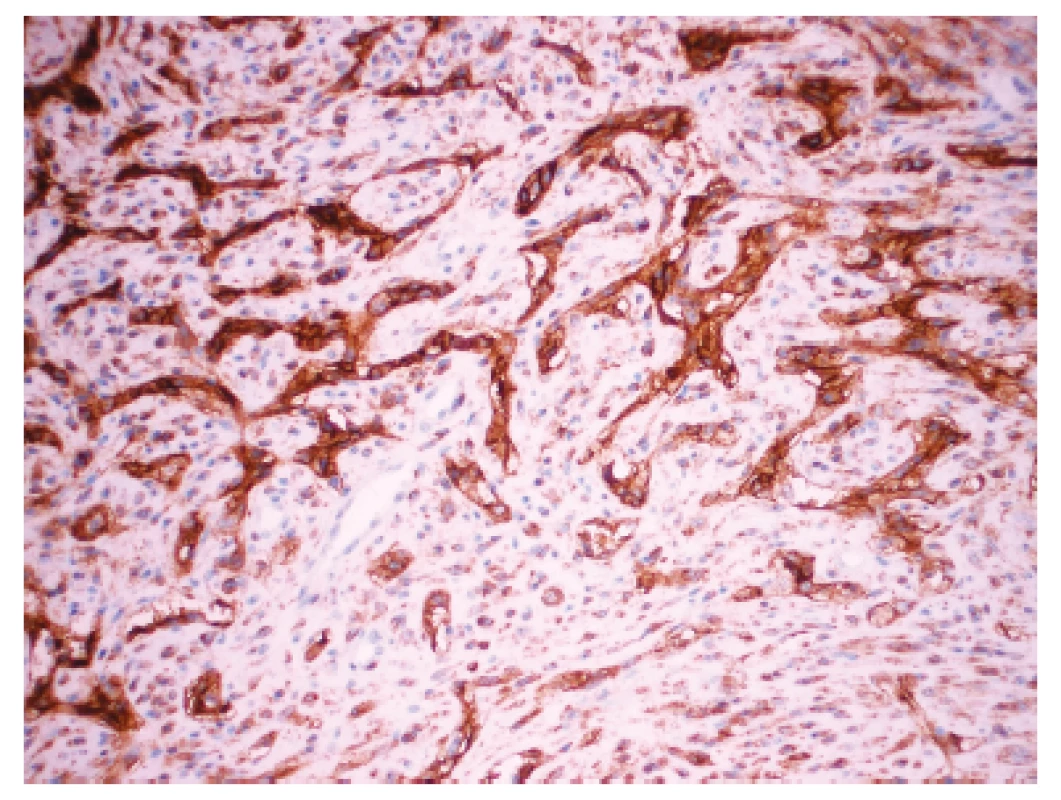
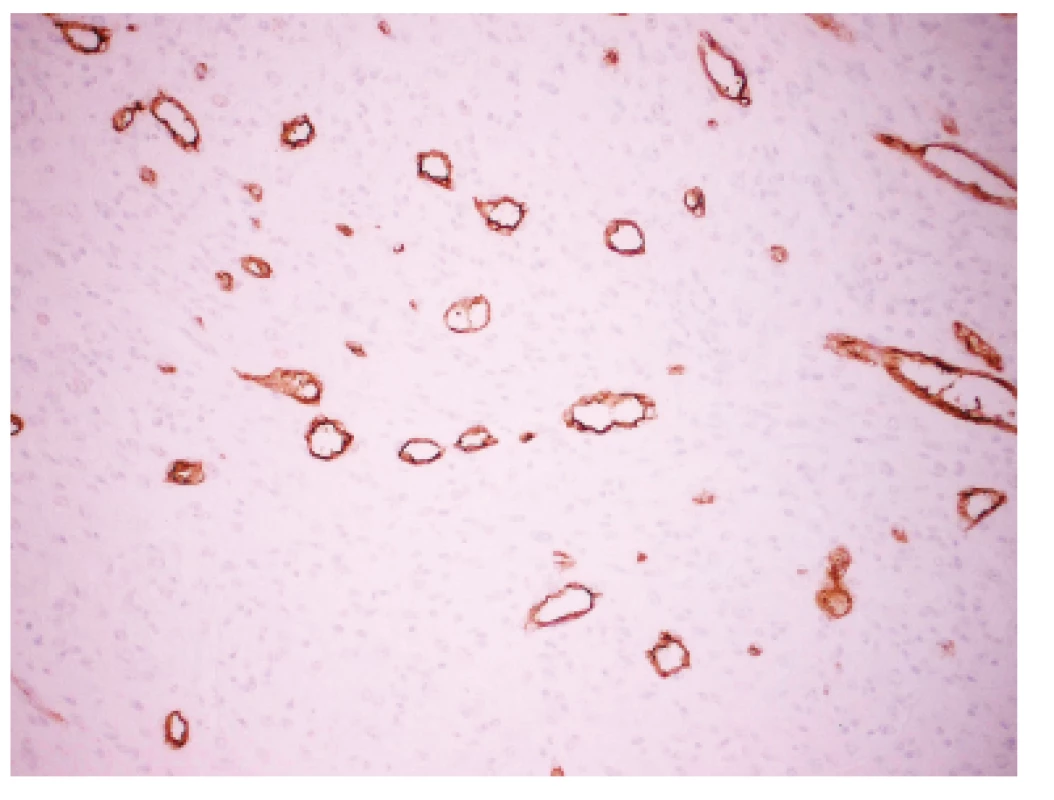
U pacientky boli pomocou počítačovej tomografie po troch mesiacoch od operácie diagnostikované subpleurálne uložené ložiská do veľkosti 5 mm v ľavých pľúcach, ktoré boli rádiodiagnostikom opísané ako metastatické ložiská. Biopsia z týchto ložísk nebola realizovaná. V iných orgánoch neboli dokázané ďalšie metastázy. Hladina sérových onkomarkerov nebola zvýšená (CEA 0,95 ng/ml a CA 15-3 16,0 U/ml).
U pacientky bola následne indikovaná a v dvoch cykloch aplikovaná chemoterapia paklitaxelom s pridaním biologickej liečby bevacizumabom, ktorú tolerovala dobre a došlo k parciálnej odpovedi v pľúcnych metastatických ložiskách. Pre akutné zhoršenie manicko-depresívnej psychózy musela byť chemoterapia prerušená a pacientka nastúpila ústavnú psychiatrickú liečbu.
Po šiestich mesiacoch od operácie je pacientka z onkologického hľadiska v parciálnej remisii bez známok progresie a s pretrvávajúcimi metastázami v pľúcach.
DISKUSIA
Akantolytický variant skvamózneho karcinómu (ASC) prsnej žľazy bol prvýkrát opísaný v roku 1986 (12). Odvtedy pribudlo v literatúre len niekoľko záznamov o tomto podtype karcinómu väčšinou vo forme kazuistík (1,2,13,14) a bol tiež uvedený do WHO klasifikácie nádorov prsníka (15).
Charakteristickou diagnostickou črtou ASC sú nepravidelné kanály vystlané atypickými bunkami, pričom tvorba týchto pseudovaskulárnych štruktúr je spôsobená stratou bunkovej kohezivity. Pre tieto rastové charakteristiky býva niekedy ASC označovaný aj ako pseudoangiosarkomatózny karcinóm (2). Akantolýza vzniká na podklade genetickej inaktivácie CDH1 génu, kódujúceho E-cadherin. Aj v našom prípade sme zaznamenali stratu expresie E-cadherinu podobne ako aj iní autori (1), pričom táto strata expresie je tiež zodpovedná za zvýšenú motilitu nádorových buniek a skoré metastázovanie (16).
ASC sa vyznačuje zvláštnou imunohistochemickou expresiou zmiešaných typov cytokeratínov typických pre skvamózne aj žľazové druhy epitelu, napríklad cytokeratínov typ 5, 13, 8/18 (1), čo potvrdzujú aj výsledky našej imunohistochemickej analýzy. Navyše v našom prípade bola zreteľná aj expresia niektorých markerov myoepiteliálnej diferenciácie, ako sú cytokeratín typ 14, p63, CD10 a fokálne bol pozitívny aj EGFR. Tieto markery sú štatisticky významnejšie exprimované v nádoroch s bazaloidnými črtami a známky takejto fenotypovej plasticity sú charakteristické pre epitelovo-mezenchymálny prechod (17). Dôkaz CD10 býva v literatúre opisovaný najmä v stromálnych bunkách karcinómov, pričom jeho pozitivita koreluje so skráteným prežívaním, negativitou estrogénových receptorov a nízkym stupňom diferenciácie nádoru (18). Pri komparatívnej genomickej hybridizácii ASC vykazovali veľký počet chromozómových alterácií v zmysle straty na 3p11-p25, 5q21-q31, 8p, 9, 13p13-q21, 16q12-q21, a 17p a tiež zmnožení 1q31-qter, 7p, 18q12-qter, 19q, a 20. Podobne ako pri expresii cytokeratínov aj tieto zmeny sa vyskytujú tak v prsníkových adenokarcinómoch, ako aj skvamóznych karcinómoch v iných lokalitách (1). Doteraz opísané prípady ASC predstavovali karcinómy s metaplastickými zmenami v celom rozsahu tumoru, iba v dvoch prípadoch išlo o zle diferencované adenokarcinómy s fokálnou dlaždicovobunkovou diferenciáciou (2).
Vo všeobecnosti metaplastické karcinómy prsníka predstavujú problémové terapeutické ciele, pretože vo väčšine prípadov ich základný profil spadá do skupiny tzv. „triple“ negatívnych karcinómov, t.j. negatívnych pri dôkaze estrogénových a progesterónových receptorov a HER2 (1,19). Keďže vykazujú expresiu EGFR a vysoko-molekulových cytokeratínov predpokladalo sa, že by mohli patriť do kategórie bazaloidných karcinómov v rámci molekulovej klasifikácie (20). Stotožňujeme sa s názormi niektorých autorov, že veľká časť metaplastických karcinómov prsníka sa radí medzi bazaloidné karcinómy, pretože majú imunofenotypové črty tejto molekulovej skupiny (najmä negativita ER, PR a HER2, expresia CK5/6, CK14, CK17 a EGFR). Navyše sa imunofenotypovo prekrývajú s ostatnými známkami myoepitelovej diferenciácie, ako sú expresia hladko-svalového aktínu, p63, maspinu, hladko-svalového myozínu, CD29, 14-3 sigma a pod. (21–25).
Nedávno však bola objavená nová molekulová skupina, tzv. “claudin-low” karcinómov, ktoré sú charakterizované nízkou expresiou “claudin” génov 3, 4 a 7. Tieto gény zohrávajú úlohu pri zabezpečení medzibunkových adhézií a vykazujú molekulové odlišnosti voči bazaloidným karcinómom (26,27). Práve metaplastické karcinómy sa svojou molekulovou výbavou najviac približujú tejto novej skupine. Ide najmä o vysokú expresiu markerov epitelovo- mezenchymálneho prechodu a zvýšený pomer CD44/CD24 a CD29/CD24, ktorý svedčí pre vysoký podiel elementov s charakteristikami kmeňových buniek. Preto sa predpokladá, že „claudin-low“ tumory a metaplastické karcinómy by mohli vznikať z primitívnejších a chemorezistentnejších buniek s kmeňovými charakteristikami v porovnaní s luminálnymi alebo bazaloidnými nádormi (26). Metaplastické karcinómy taktiež vykazujú častejšie mutácie, amplifikáciu a aktiváciu zložiek PI3K/AKT signálnej cesty, čo by sa mohlo využiť ako možný terapeutický cieľ (28).
Metaplastické karcinómy všeobecne predstavujú značne heterogénnu skupinu tak z hľadiska morfológie, imunofenotypickej prezentácie, ako aj biologického správania. Súčasné poznatky o biologickom správaní ASC sú značne limitované počtom zaznamenaných prípadov. Z doteraz opísaných prípadov je však zrejmé, že ASC predstavuje veľmi agresívny typ karcinómu prsníka, aj keď nie je známe, aký podiel akantolytickej komponety ovplyvňuje prognózu, pretože väčšina prác to doteraz neuvádzala (13). Len v dvoch prácach je uvedené majoritné zastúpenie tejto zložky v rozsahu vyšetreného nádorového tkaniva (2,13). Už v pôvodnej práci (12) boli zaznamenané úmrtia po 5, 6 a 16 mesiacoch od jeho zachytenia. Vo všetkých troch prípadoch však išlo o pokročilé štádiá ochorenia. Ostatné štúdie zaznamenali prežívanie do 37 mesiacov (1,2,14) a jedna z posledných prác uvádza „follow-up“ 38 mesiacov s jednou lokálnou rekurenciou po 7 mesiacoch od primárnej diagnostiky ASC (13).
Ako z prehľadu viacerých štúdií vyplýva, metaplastické karcinómy prsníka sú spojené so zlou prognózou, pretože bývajú zachytené ako veľké nádory v pokročilejších štádiách a s častejšími rekurenciami v porovnaní s konvenčnými karcinómami prsníka (19).
Ako už bolo spomenuté, ASC imituje pri bioptickom vyšetrení najmä malígne vaskulárne lézie. Odlíšenie od angiosarkómov je relatívne jednoduché pri využití imunohistochemickej analýzy na dôkaz expresie cytokeratínov a chýbanie markerov endotelovej diferenciácie, napr. CD31, CD34, či faktoru VIII (2,12,14). Z ostatných diferenciálno-diagnostických lézií pripadajú do úvahy phyllodes tumor a metastatické sarkómy (13). Phyllodes tumor je možné vylúčiť starostlivým „samplingom“ za účelom nájdenia patognomickej epitelovej komponenty a metastatické sarkómy sú obvykle negatívne pri dôkaze antigénov epitelovej diferenciácie (cytokeratíny a EMA). Pomocným znakom pri odlíšení môže byť aj prítomnosť intraduktálnej zložky, aj keď táto bola doteraz zaznamenaná len v troch prípadoch ASC prsnej žľazy (1,2,13) a tiež v našom prípade nebola prítomná. Hypotetickou je aj možnosť prípadnej metastázy pľúcneho skvamózneho karcinómu do prsníka, ktorú by nebolo možné oddiferencovať bez klinicko – patologickej korelácie. U našej pacientky boli počítačovou tomografiou nájdené štyri subpleurálne ložiská v ľavých pľúcach, ktoré však boli relatívne malé. Navyše periférne typy skvamóznych pľúcnych nádorov menej často metastázujú v porovnaní s centrálne lokalizovanými karcinómami (29). Vzdialeným metastázam z pľúc obvykle predchádza symptomatológia respiračných obtiaží (30). Tiež charakter lézie v prsníku vykazoval typické črty primárnych metaplastických skvamóznych mamárnych karcinómov s centrálnou dutinou a fokálne bola dokázaná glandulárna diferenciácia. Nezodpovedanou ostáva otázka súvislosti medzi úrazom prsníka a ASC u pacientky. Aj keď mechanická trauma nebola všeobecne dlho považovaná za príčinný faktor pri vzniku karcinómu prsníka, niektoré novšie práce sa pokúšajú oživiť starú hypotézu o vplyve traumy na vznik karcinómu prsníka (31) alebo poukázať na jej možnú účasť pri progresii už pre- existujúceho nádoru. Negatívny efekt poškodenia tkaniva sa pravdepodobne uplatňuje už v zápalovej fáze, ktorá je sprevádzaná infiltráciou T-lymfocytmi a sekréciou cytokínov, čím môže vplyvom mikroprostredia dôjsť k akcelerácii predtým spusteného nádorového rastu (32). Tieto závery potvrdzujú aj práce zaoberajúce sa porovnaním génovej expresie medzi nádorom a susediacim poškodeným nenádorovým tkanivom, ktoré poukázali na podobnosti medzi procesom hojenia a nádorovým rastom (4,33). Oba procesy sú charakterizované bunkovou proliferáciou, zápalovou reakciou a angiogenézou. Aj keď v našom prípade nemožno jednoznačne potvrdiť ani vylúčiť účasť úrazu pri vzniku karcinómu, jeho nezvyčajná histomorfologická prezentácia vo forme ASC núti zvážiť vplyv reparačných pochodov na rastové charakteristiky tohto nádoru.
Záverom je možné konštatovať, že aj keď ASC predstavuje zriedkavý podtyp karcinómu prsnej žľazy, jeho poznanie je veľmi dôležité, pretože terapeutický manažment je odlišný oproti vyššie uvedeným léziám v diferenciálnej diagnostike ako aj konvenčným typom karcinómov v prsníku.
POĎAKOVANIE
Autori týmto ďakujú prim. MUDr. Cibíčkovi z PAO FORLIFE, n.o. Komárno za zaslanie prípadu ku konzultácii a prim. MUDr. Šebovi z Onkologického oddelenia FORLIFE, n.o. Komárno za poskytnutie klinických údajov.
Práca bola podporená projektom ITMS 26220120016 „Centrum excelentnosti pre perinatologický výskum“, ktorý je spolufinancovaný zo zdrojov EÚ a grantom VEGA MŠ 1/0069/09.
Adresa pro korespondenci:
Doc. MUDr. Karol Kajo, Ph.D.
ÚPA JLF UK a UNM
Kollárova 2, 036 59 Martin, Slovenská republika
tel: 00421-43-4203-874
e-mail: kajo@jfmed.uniba.sk
Sources
1. Aulmann S, Schnabel PA, Helmchen B, et al. Immunohistochemical and cytogenetic characterization of acantholytic squamous cell carcinoma of the breast. Virchows Arch 2005; 446(3): 305–309.
2. Banerjee SS, Eyden BP, McWilliam LJ, Harris M. Pseudoangiosarcomatous carcinoma: a clinical study of seven cases. Histopathology 1992; 21(1): 13–23.
3. Lever WF. Adenoacanthoma of sweat glands: carcinoma of sweat glands with glandular and epidermal elements: report of four cases. Arch Dermatol Syphilol 1947; 56(2): 157–171.
4. Schäfer M, Werner S. Cancer as an overhealing wound: an old hypothesis revisited. Nat Rev Mol Cell Biol 2008; 9(8): 628–638.
5. Smoller BR. Squamous cell carcinoma: from precursor lesions to high-risk variants. Mod Pathol 2006; 19 Suppl 2: S88–92.
6. Cunha IW, Guimaraes GC, Soares F, et al. Pseudoglandular (adenoid, acantholytic) penile squamous cell carcinoma: a clinicopathologic and outcome study of 7 patients. Am J Surg Pathol 2009; 33(9): 551–555.
7. Horie Y, Kato M. Pseudovascular squamous cell carcinoma of the uterine cervix: A lesion that may simulate an angiosarcoma. Patol Int 1999; 49(2): 170–174.
8. Jukič Z, Ledinsky I, Ulamec M, Ledinsky M, Krušlin B, Tomas D. Primary acantholytic squamous cell carcinoma of the cecum: a case report. Diagn Pathol 2011; 6(1): 5.
9. Kuraoka K, Takehara K, Oshita S, Saito A, Taniyama K. Acantolythic squamous cell carcinoma of the uterine cervix. Pathol Int 2010; 60(3): 245–246.
10. Papadopoulou E, Tosios KI, Nikitakis N, Papadogeorgakis N, Sklavounou-Andrikopoulou A. Acantholytic squamous cell carcinoma of the gingiva: report of a case and review of the literature. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2010; 109(6): 67–71.
11. Zámečník M, Mukenšnabl P, Chlumská A. Pseudoglandular (adenoid, acantholytic) squamous cell carcinoma of the penis. A case report. Cesk Patol 2011; 47(1): 15–18.
12. Eusebi V, Lamovec J, Cattani MG, Fedeli F, Millis RR. Acantholytic variant of squamous-cell carcinoma of the breast. Am J Surg Pathol 1986; 10(12): 855–861.
13. Lee TH, Kim YB, Lee K, Yim H. Acantholytic variant of squamous cell carcinoma of the breast. Basic Appl Pathol 2010; 3: 34–37.
14. Parramore B, Hanly M, Yeh KA, McNeely T. Acantholytic variant of squamous cell carcinoma of the breast: a case report. Am Surg 1999; 65(5): 467–469.
15. Ellis IO, Sastre-Garau X, Bussolati G, et al. Invasive breast carcinoma. In: Tavassoli FA, Deville P, eds. World Health Organization of Tumours Pathology and Genetics of Tumours of the Breast and Female Genital Organs. Lyon, IARC Press; 2003: 13–59.
16. Handschuh G, Candidus S, Luber B, et al. Tumor-associated E-cadherin mutations alter cellular morphology, decrease cellular adhesion and increase cellular motility. Oncogene 1999; 18(30): 4301–4312.
17. Sarrió D, Rodriguez-Pinilla SM, Hardisson D, et al. Epithelial-mesenchymal transition in breast cancer relates to the basal-like phenotype. Cancer Res 2008; 68(4): 989–997.
18. Makretsov NA, Hayes M, Carter BA, Dabiri S, Gilles CB, Huntsman DG. Stromal CD10 expression in invasive breast carcinoma correlates with poor prognosis, estrogen receptor negativity, and high grade. Mod Pathol 2007; 20(1): 84–89.
19. Lim KH, Oh DY, Chie EK, et al. Metaplastic breast carcinoma: clinicopathologic features and prognostic value of triple negativity. Jpn J Clin Oncol 2010; 40(2): 112–118.
20. Reis-Filho JS, Milanezi F, Steele D, et al. Metaplastic breast carcinomas are basal-like tumours. Histopathology 2006; 49(1): 10–21.
21. Kinkor Z, Boudová L, Ryska A, Kajo K, Svec A. Matrix-producing breast carcinoma with myoepithelial differenntiation – description of 11 cases and review of literature aimed at histogenesis and differential diagnosis. Ceska Gynekol 2004; 69(3): 229–236.
22. Leibl S, Gogg-Kammerer M, Sommersacher A, Denk H, Moinfar F. Metaplastic breast carcinomas: are they of myoepithelial differentiation? Immunohistochemical profile of the sarcomatoid subtype using novel myoepithelial markers. Am J Surg Pathol 2005; 29(3): 347–53.
23. Rakha AE, Putti TC, Abd El-Rehim DM, et al. Morphological and immunophenotypic analysis of breast carcinomas with basal and myoepithelial differential differentiation. J Pathol 2006; 208: 495–506.
24. Gilbert JA, Goetz MP, Reynolds CA, et al. Molecular analysis of metaplastic breast carcinoma. Mol Cancer Ther 2008; 7(4): 944–951.
25. Wang H, Guan B, Shi Q, et al. May metaplastic breast carcinomas be actually basal-like carcinoma? Further evidence study with its ultrastructure and survival analysis. Med Oncol 2011; 28(1): 42–50.
26. Hennessy BT, Smith DL, Ram PT, Lu Y, Mills GB. Exploiting the PI3K/AKT pathway for cancer drug discovery. Nat Rev Drug Discov 2005; 4(12): 988–1004.
27. Perou CM. Molecular stratification of triple-negative breast cancers. The Oncologist 2010; 15(Suppl 5): 39–48.
28. Hennessy BT, Gonzalez-Angulo AM, Stemke-Hale K, et al. Characterization of a naturally occurring breast cancer subset enriched in epithelial-to-mesenchymal transition and stem cell characteristics. Cancer Res 2009; 69(10): 4116–4124.
29. Funai K, Yokose T, Ishii G, et al. Clinicopathologic characteristics of periheral squamous cell carcinoma of the lung. Am J Surg Pathol 2003; 27(9): 978–984.
30. Hsu W, Shen-Chen SM, Wang JL, Huang CC, Ko SF. Squamous cell lung carcinoma metastatic to the breast. Anticancer Res 2008; 28(2B): 1299–1231.
31. Rigby JE, Morris JA, Lavelle J, Stewart, M, Gatrell AC. Can physical trauma cause breast cancer? Eur J Cancer Prev 2002; 11(3): 307–311.
32. Stuelten CH, Barbul A, Busch JI, et al. Acute wounds accelerate tumorigenesis by a T cell- dependent mechanism. Cancer Res 2008; 68(18): 7278–7282.
33. Troester MA, Lee MH, Carter M, et al. Activation of host wound responses in breast cancer microenviroment. Clin Cancer Res 2009; 15(22): 7020–7028.
Labels
Anatomical pathology Forensic medical examiner ToxicologyArticle was published in
Czecho-Slovak Pathology

2011 Issue 4
Most read in this issue
- Carneyho komplex
- Prediktivní diagnostika HER2 v adenokarcinomu žaludku
- „Gigantický“ bazocelulárny karcinóm kože hlavy s intrakraniálnou propagáciou – kazuistika
- Akantolytický variant skvamózneho karcinómu prsnej žľazy. Kazuistika a prehľad literatúry
