Prekancerózy endometria, děložní tuby a ovaria: přehled současné problematiky
Precanceroses of the endometrium, fallopian tube and ovary: a review of current conception
Recently, there has been a significant increase of knowledge regarding the pathogenesis and genetic changes occurring in carcinomas of the female genital tract and also regarding the definition of their precursors. A dualistic model of endometrial carcinogenesis has been accepted for a long period of time. Recently, a similar concept has been proposed for ovarian carcinomas. A correct definition of cancer precursors is important for the understanding of tumor pathogenesis. Moreover, it has an impact on the prevention and therapy of these tumors. In this review we summarize the precancers of the endometrium, fallopian tube and ovary according to the most recent advances in this research.
Keywords:
atypical endometrial hyperplasia – endometrial glandular dysplasia – endometrial intraepithelial carcinoma – p53 signature – tubal intraepithelial carcinoma
Authors:
P. Dundr
Authors‘ workplace:
Ústav patologie 1. LF UK v Praze a VFN
Published in:
Čes.-slov. Patol., 48, 2012, No. 1, p. 30-34
Category:
Reviews Article
Overview
Během posledních let došlo k významnému rozvoji poznatků týkajících se patogeneze a genetických změn vyskytujících se u karcinomů ženského vnitřního genitálu. V souvislosti s tím se také u některých nádorů poměrně výrazně změnil pohled na jejich prekancerózy. Dualistický model tumorigeneze karcinomů endometria je akceptován již delší dobu, obdobný systém se v posledních letech uplatňuje i u karcinomů ovaria. Nalezení a přesné definování prekurzorů maligních nádorů má význam nejen pro pochopení jejich patogeneze, ale i pro prevenci, včasnou diagnostiku a léčbu. V následujícím textu podáváme přehled současné problematiky prekanceróz endometria, děložní tuby a ovaria.
Klíčová slova:
atypická hyperplazie endometria – endometriální glandulární dysplázie – endometriální intraepiteliální karcinom – p53 signatury – tubární intraepiteliální karcinom
Prekanceróza podle konsenzuální konference z roku 2006 musí splňovat následující kritéria: 1) musí být důkazy o tom, že léze označená jako prekanceróza je spojená se zvýšeným rizikem vzniku maligního nádoru; 2) pokud dojde k progresi v maligní nádor, ten musí vznikat z jejích buněk; 3) musí se odlišovat od normální tkáně, ze které vzniká; 4) musí se lišit od maligního nádoru, který z ní vzniká, má s ním však shodné některé (ne všechny) fenotypické a genetické rysy; 5) existuje metoda, kterou může být diagnostikována (1). Rozpoznání a charakterizace prekanceróz jsou důležité nejen s ohledem na pochopení patogeneze maligních nádorů, ale mají význam i pro prevenci, časnou detekci nádorů a jejich léčbu. U karcinomů endometria, děložní tuby a ovaria došlo v posledních letech k významnému rozvoji poznatků týkajících se patogeneze a genetických změn vyskytujících se u některých nádorů a poměrně výrazně se změnil pohled na jejich prekancerózy. I přes značný pokrok v této oblasti však zůstává mnoho nejasností. V následujícím textu je probrána problematika prekanceróz endometria, děložní tuby a ovaria s ohledem na současné poznatky týkající se těchto lézí.
ENDOMETRIUM
Endometriální karcinomy představují skupinu nádorů, které se podle všeobecně akceptovaného dualistického modelu tumorigeneze těchto nádorů dělí na 2 typy s odlišnou patogenezou, prekurzorovými stádii i prognózou. Mezi I. typ patří hormonálně dependentní nádory, které mají vztah k absolutnímu či relativnímu hyperestrinizmu, často exprimují hormonální receptory a mají lepší prognózu. Tyto nádory zahrnují endometroidní a mucinózní adenokarcinom a často vznikají v terénu atypické hyperplazie. II. typ jsou nádory hormonálně non-dependentní, které většinou vznikají v terénu atrofického či inaktivního endometria. Na rozdíl od I. typu nádorů vznikajících v souvislosti s estrogenní stimulací je etiologie nádorů II. typu neznámá. Mezi tyto nádory patří endometriální serózní karcinom (ESC) a světlobuněčný karcinom. Prekurzorem nádorů I. typu je atypická hyperplazie endometria, její diagnóza je však do určité míry subjektivní a intra - i interpersonální reproducibilita je poměrně nízká. Objevují se proto snahy o vytvoření jiného klasifikačního schématu. Nadějnou se zdá být koncepce endometriální intraepiteliální neoplazie (EIN), která se však zatím do běžné diagnostické praxe neprosadila. Jako prekanceróza nádorů II. typu byl v minulosti nahlížen (serózní) endometriální intraepiteliální karcinom (EIC), tato léze má však maligní potenciál a nesplňuje některá kritéria prekancerózy zmíněná v úvodu článku. Podle současné koncepce jsou prvním krokem v karcinogenezi nádorů II. typu tzv. p53 signatury (detekovatelné pouze imunohistochemicky – viz níže). Morfologicky definovaným následným krokem je endometriální glandulární dysplazie (EmGD), která může progredovat do EIC a následně do invazivního ESC (2–4). Tento model karcinogeneze podporuje i fakt, že u části pacientek s ESC byly v přítomných p53 signaturách, EmGD i EIC prokázány shodné mutace p53 (5).
Hyperplazie endometria
Podle WHO klasifikace se hyperplazie endometria klasifikuje podle architektonických znaků jako prostá a komplexní (adenomatózní) a podle cytologických znaků jako atypická a bez atypií (6). Klinický význam rozlišení mezi prostou a komplexní hyperplazií je ovšem sporný a důležitý se zdá být pouze výskyt atypií (obr. 1A). Někteří autoři se proto přiklánějí ke zjednodušené klasifikaci hyperplazií s dělením pouze na atypickou hyperplazii a hyperplazii bez atypií. Atypická hyperplazie je prekancerózou pro karcinomy I. typu, podle různých studií progreduje do karcinomu ve 20–40 % případů, či se vyskytuje současně s karcinomem přítomným v jiné oblasti endometria. Výskyt atypií je v hyperplazii často pouze fokální. Problémem je však již zmíněná poměrně nízká reproducibilita této diagnózy. Obecná kritéria pro diagnózu atypické hyperplazie zahrnují poruchu stratifikace jader a jejich struktury. Jádra mohou být oválná s vezikulárním chromatinem s prominentními jadérky, či jsou naopak hyperchromní s nerovnými jadernými membránami a četnými mitózami. Nejlépe reprodukovatelným z těchto znaků je výskyt prominentních jadérek. Odlišení atypické komplexní hyperplazie a endometroidního adenokarcinomu je na podkladě splývaní žlázek a/nebo výskytu stromální reakce (dezmoplázie).
Endometriální intraepiteliální neoplazie (EIN)
Vzhledem k problémům v diagnostice atypické hyperplazie je snaha o vytvoření snáze reprodukovatelného alternativního klasifikačního schématu těchto změn. Na podkladě klonality lze hyperplazie endometria rozlišit na léze polyklonální a monoklonální. Změny spadající to skupiny monoklonálních proliferací byly analyzovány s ohledem na jejich morfologické aspekty a na podkladě těchto analýz vznikla koncepce EIN (7). Základním diagnostickým postupem při hodnocení EIN je morfometrická analýza se stanovením rozsahu stromální a žlázové složky – jako EIN jsou klasifikovány případy, u kterých je stroma redukováno na < 55 % objemu tkáně ložiska. Dalšími kritérii jsou velikost ložiska (alespoň 1 mm v největším rozměru), přítomnost jaderných rysů odlišných od okolního endometria (nelze aplikovat v případě, že léze tvoří celý objem vyšetřované tkáně), vyloučení benigních změn nespadajících do rámce hyperplazie a také vyloučení endometriálního karcinomu. Pro rutinní diagnostiku je morfometrická analýza nevhodná a často i nedostupná a v běžné praxi je možno provést subjektivní odhad objemu žlázové komponenty a stromatu (8). Výhodou tohoto systému oproti WHO klasifikaci hyperplazií je možnost objektivního hodnocení definovaných znaků. Studie provádějící srovnání těchto dvou klasifikačních schémat prokázaly poměrně vysokou shodu v diagnostice atypické hyperplazie a EIN (78 % resp. 94 % atypických hyperplazií bylo klasifikováno jako EIN). Asi 40 % komplexních hyperplazií bez atypií a v jedné studii i 4 % prostých hyperplazií bez atypií však byly klasifikovány jako EIN a toto schéma má tedy ve vztahu k atypickým hyperplaziím nižší specifitu (7,9). V současné době se všeobecné použití koncepce EIN do rutinní diagnostické praxe neprosadilo a hyperplazie je tedy nadále vhodné hodnotit podle klasifikace WHO.
P53 signatury a endometriální glandulární dysplazie (EmGD)
P53 signatury jsou charakterizovány přítomností úseků p53 pozitivních buněk v epitelu endometria jinak normálního vzhledu a lze je tedy detekovat pouze imunohistochemicky. Na rozdíl od p53 signatur vyskytujících se v děložní tubě (viz níže) není pro tyto změny v endometriu přesně definováno kvantitativní kritérium. Biologický význam p53 signatur je nejasný, část z nich však může progredovat do EmGD. EmGD je první morfologicky detekovatelná změna v endometriu předcházející vzniku EIC a invazivního ESC (3,4). Popsána a zvažována je i jako prekurzor světlobuněčného karcinomu endometria s označením světlobuněčná EmGD, tato jednotka však v současné době není jednoznačně definována (2). Většinou se jedná o multifokální změny postihující žlázky a/nebo povrchový epitel. Charakteristické je zvětšení jader (2–3 x oproti žlázkám okolního endometria), která mohou být hyperchromní či vezikulární. Jadérka jsou patrná, avšak obvykle neprominují. Může být přítomna ztráta polarity jader. Mitózy jsou nečetné, atypické mitózy se nevyskytují. Důležité je odlišení od benigních metaplastických procesů a EIC. Ve sporných případech je možno použít imunohistochemické vyšetření. EmGD je typicky výrazněji p53 a IMP3 pozitivní a má zvýšenou proliferační aktivitu (MIB-1) oproti okolnímu endometriu. Oproti EIC (pokud je přítomen) je však exprese těchto markerů nižší. Kromě toho je obvykle oproti okolnímu endometriu snížená exprese estrogenových a progesteronových receptorů. Ve srovnání s EmGD jsou na morfologické úrovni jádra EIC obvykle 4–5 x větší oproti žlázkám okolního endometria a často jsou přítomny makronukleoly (2,3).
Endometriální intraepiteliální karcinom (EIC)
EIC byl v minulosti nahlížen jako prekurzor invazivního ESC (podle poslední WHO klasifikace nádorů se pro tuto lézi používá označení serózní EIC) (6). U části případů EIC je však přítomno extrauterinní šíření a dříve používaný termín carcinoma in situ je pro tuto lézi s ohledem na její maligní potenciál nevhodný. Maligní potenciál také svědčí proti tomu, že se jedná o prekancerózu. Odlišení EIC a ESC bez invaze do myometria může být na morfologické úrovni obtížné a někteří autoři proto na EIC nahlížejí jako na časný ESC rostoucí v endometriu sice neinvazivním způsobem, nicméně s možnou diseminací. Bez ohledu na označení by měl být terapeutický postup v případě EIC i časného ESC stejný. Morfologicky je EIC charakterizován přítomností výrazných jaderných atypií v povrchovém epitelu a/nebo ve žlázkách (obr. 1B). Často jde o změny pouze fokální v jinak obvykle atrofickém endometriu (atrofie však není podmínkou pro diagnózu).
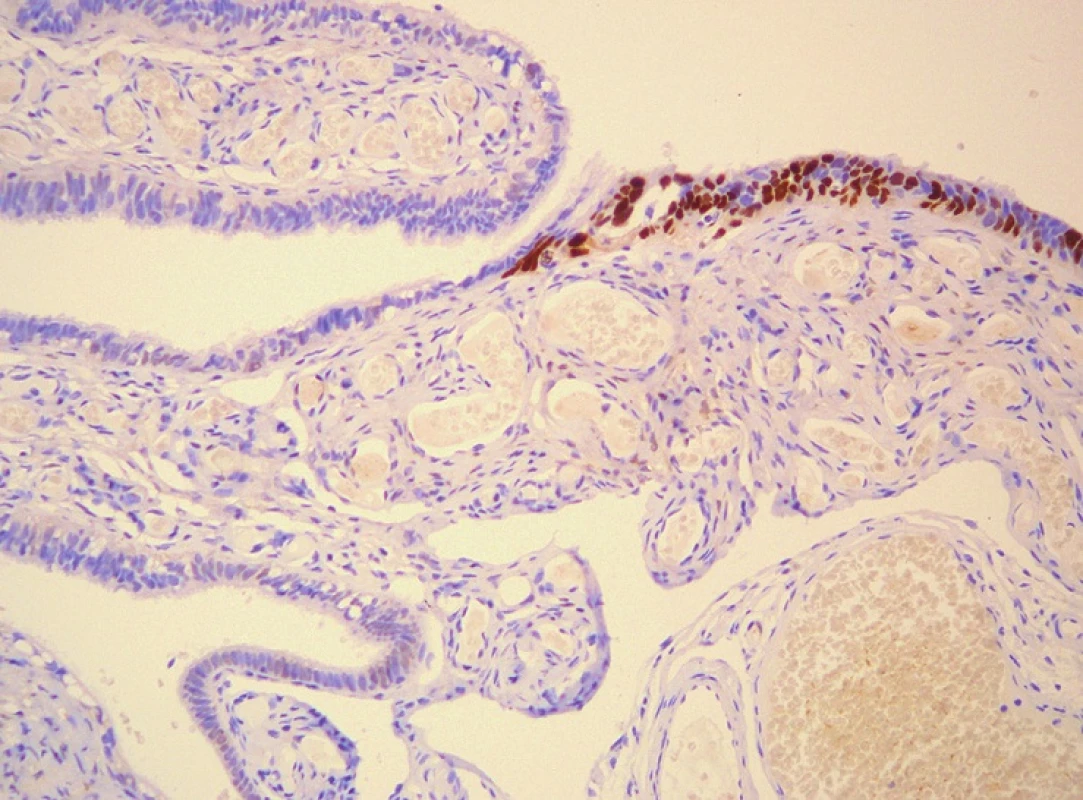
Děložní tuba
Většina primárních karcinomů děložní tuby jsou high grade serózní karcinomy (HGSC). Vzácně se vyskytují i další typy karcinomů, z nichž nejčastější jsou karcinomy endometroidní a nediferencované. Podle v současnosti používaných diagnostických kritérií jde o nádory vzácné, které celkově tvoří asi 0,7–1,5 % všech maligních nádorů ženského genitálu (10). Recentní poznatky však svědčí pro fakt, že skutečná incidence primárních HGSC děložní tuby je vyšší a přinejmenším část nádorů diagnostikovaných jako primárně ovariální či peritoneální jsou ve skutečnosti primárně tubární. Prvním krokem v karcinogenezi HGSC jsou nejspíše tzv. p53 signatury, které mohou v některých případech progredovat do tubárního intraepiteliálního karcinomu (TIC). TIC však představuje lézi s maligním potenciálem a stejně jako EIC nesplňuje kritéria prekancerózy. Další změnou zcela recentně popsanou v souvislosti s p53 signaturami je tzv. přerůst sekrečních buněk („secretory cells outgrowth“ – SCOUT).
Jako významný zdroj informací týkajících se karcinogeneze HGSC se ukázala být analýza děložních tub profylakticky odstraněných u pacientek s BRCA mutací (11). Z praktického hlediska je v této souvislosti vhodné zdůraznit, že naprostá většina změn odpovídajících TIC se vyskytuje v oblasti fimbrií. Procentuální výskyt těchto změn se v různých sestavách liší, ve studiích používajících standardizovaný způsob zpracování tkáně jsou však výsledky srovnatelné. Asi nejvhodnějším postupem při zpracování tkáně je v současné době použití protokolu SEE-FIM (sectioning and extensively examining the fimbria) (11). Podle tohoto protokolu jsou istmus, ampula a část infundibula zpracovány v celém rozsahu v příčných řezech širokých 2–3 mm kolmých k dlouhé ose tuby. Oblast fimbrií a přilehlá část infundibula jsou po oddělení zpracovány v celém rozsahu v longitudinálních řezech, což umožní vyšetření větší oblasti fimbrií než v případě příčných řezů (obr. 2).
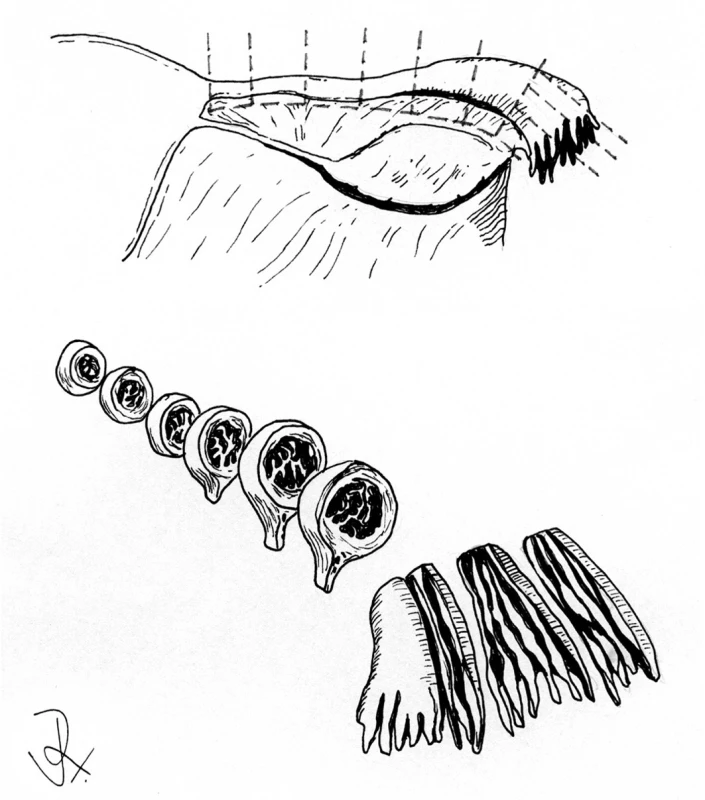
Pravděpodobným prekurzorem endometroidního karcinomu děložní tuby je endometrióza, u ostatních typů nádorů jsou prekurzory neznámé.
P53 signatury
P53 signatury jsou definované jako souvislé úseky alespoň 12-ti p53 pozitivních sekrečních buněk v tubárním epitelu jinak normálního vzhledu (či jde častěji o epitel s redukcí ciliárních buněk) (12). Proliferační aktivita není zvýšena. Sporadický výskyt p53 pozitivních buněk je v tubárním epitelu normální, důležité je tedy kvantitativní kritérium. Tyto změny se vyskytují poměrně často, při extenzivním vyšetření je lze detekovat asi u 20 % žen a to s obdobnou frekvencí u pacientek s BRCA mutací i u normálních kontrol (12,13). Klinický a biologický význam p53 signatur je v současné době nejasný, v některých případech však mohou progredovat do TIC a předpokládá se, že jsou prvním krokem v karcinogenezi HGSC.
Přerůst sekrečních buněk („secretory cells outgrowth“ - SCOUT)
Nově popsanou změnou s úzkou vazbou na p53 signatury je tzv. přerůst sekrečních buněk („secretory cells outgrowth“ – SCOUT) (14). Jedná se o širší kategorii zahrnující i většinu p53 signatur, která je na morfologické úrovni charakterizovaná kontinuálními úseky alespoň 30 sekrečních buněk (bcl2+ a p73-). Většina případů vykazuje ztrátu exprese PAX2, která je prokazatelná i u značné části TIC a HGSC. U minority případů je přítomna mutace p53 (tyto případy tedy odpovídají p53 signaturám). SCOUT se stejně jako p53 signatury vyskytuje s obdobnou frekvencí u pacientek s BRCA mutací i u normálních kontrol. Stejně jako u p53 signatur se v určitých případech předpokládá přechod v TIC a následně HGSC, s možným uplatněním downregulace PAX2 v procesu karcinogeneze (14).
Tubární intraepiteliální karcinom (TIC)
TIC představuje neinvazivní lézi, která však má maligní potenciál, může diseminovat cestou implantačních metastáz a nesplňuje tedy kritéria prekancerózy (10). Dřívější označení carcinoma in situ je nevhodné a nemělo by se používat. Naprostá většina těchto lézí má serózní diferenciaci, jako synonymum je proto obvykle používáno označení serózní tubární intraepiteliální karcinom (STIC). Na morfologické úrovni je TIC charakterizován přítomností sekrečních buněk s výraznými jadernými atypiemi, prominentními jadérky, často četnými mitózami a zvýšeným N/C poměrem (obr. 1C). Tyto buňky tedy připomínají buňky HGSC, není však přítomna invaze. Většina TIC je lokalizována v oblasti fimbrií, pouze vzácně se vyskytují v ampule (15). TIC je daleko častější u žen s BRCA1/2 mutací, vyskytuje se však i sporadicky. Proliferační aktivita je výrazně zvýšená a u většiny případů TIC lze prokázat p53 mutaci (obr. 1D). Obvykle jde o missense mutace vedoucí k akumulaci abnormálního proteinu p53, který pak lze prokázat imunohistochemicky. Negativita p53 však STIC nevylučuje, mohou být přítomny i jiné typy mutací (inzerce, delece, nonsense mutace) vedoucí k zástavě tvorby proteinu a imunohistochemické vyšetření v těchto případech vyzní negativně (13).
Ovarium
U karcinomů ovaria se v současné době obdobně jako u karcinomů endometria prosazuje dualistický model karcinogeneze dělící tyto nádory na dvě skupiny s odlišnou prognózou, cestou tumorigeneze a různými genetickými změnami (16–19). Do I. skupiny nádorů s lepší prognózou patří low grade serózní adenokarcinom, low grade endometroidní adenokarcinom, mucinózní adenokarcinom, maligní Brennerův nádor a zřejmě část světlobuněčných adenokarcinomů. Do II. skupiny nádorů s horší prognózou patří nediferencovaný karcinom, high grade serózní adenokarcinom, high grade endometroidní adenokarcinom, high grade karcinom z přechodních buněk, smíšený maligní mülleriánský nádor a zřejmě část světlobuněčných adenokarcinomů. Současné poznatky svědčí pro primární původ většiny (podle některých názorů prakticky všech) epitelových nádorů neteratogenního původu a tedy i karcinomů mimo vlastní ovariální tkáň: v případě serózních nádorů v oblasti fimbrií děložní tuby nebo tubárního epitelu vytvářejícího v ovariu inkluze; v případě endometroidních a světlobuněčných nádorů na podkladě endometriózy (opět tkáň primárně nenáležící k ovariu); původ mucinózních nádorů a nádorů z přechodního epitelu je nejasný, zvažována je však možnost vzniku z hnízd přechodního epitelu v parovariální oblasti (20).
Prekurzory I. skupiny nádorů
Prekurzory nádorů spadajících do první skupiny podle současných poznatků představují benigní a borderline nádory příslušné diferenciace a u některých typů nádorů i endometrióza. Podrobný popis benigních a borderline nádorů je nad rámec tohoto textu. Endometrióza ovaria se vyskytuje podle literárních údajů až u 30 % karcinomů ovaria diagnostikovaných ve stádiu I. a je brána jako prekurzor endometroidních, světlobuněčných a vzácně i mucinózních adenokarcinomů (21). Jedná se však o onemocnění velmi časté s nízkým rizikem maligního zvratu, které je podle některých literárních údajů < 0,3 %, podle jiných jsou však až 4 % případů ovariální endometriózy asociovány s maligním nádorem (22).
Prekurzory II. skupiny nádorů
Prekurzorové stádium je u těchto nádorů obtížně definovatelné, obvykle se jedná o nádory diagnostikované v pozdních stádiích a oblasti případné prekurzorické léze tedy mohou být překryty invazivním karcinomem. Jako možný zdroj některých z těchto karcinomů byly a nadále některými autory jsou zvažovány tzv. inkluze povrchového epitelu. Původ těchto inkluzí v povrchovém epitelu ovaria je však podle současných poznatků málo pravděpodobný a spíše jde o inkluze epitelu pocházejícího z oblasti fimbrií děložních tub (23). Předpokládaný prekurzor HGSC v podobě dysplastických změn povrchového epitelu ovaria či epitelu inkluzních cyst se přesvědčivě nepodařilo prokázat a po určitou dobu panoval názor, že tyto nádory vznikají de novo bez definovatelné prekurzorické léze. Podle posledních poznatků jsou však při důkladném vyšetření u pacientek s HGSC nejen děložní tuby, ale i ovaria a peritonea nalezeny v epitelu děložní tuby změny odpovídající TIC (15). Tyto nálezy podporují v současné době převládající názor, že většina HGSC (s výjimkou nádorů endometria) vzniká na podkladě těchto změn a jsou tedy primárně tubárního původu se shodnou cestou tumorigeneze (viz oddíl děložní tuba).
Závěr
Současná koncepce prekanceróz endometria, děložní tuby a ovaria zaznamenala oproti minulosti výrazné změny zvláště v souvislosti s rozvojem molekulárně biologických, imunohistochemických, ale i morfologických poznatků týkajících se těchto lézí a z nich vznikajících nádorů. Pochopení procesu karcinogeneze a správná diagnostika prekanceróz mají zásadní význam pro prevenci, časnou detekci nádorů a jejich léčbu. Obzvláště důležitá je v tomto kontextu správná definice prekanceróz a vyčlenění lézí dříve nahlížených jako prekancerózy či in situ karcinomy (EIC a TIC), které však mají maligní potenciál a kritéria pro prekancerózy nesplňují. Naopak biologický a tudíž i klinický význam některých nově popsaných změn jako jsou p53 signatury a SCOUT je nejasný. Závěrem lze konstatovat, že i přes značné pokroky v dané problematice zůstává mnoho nejasností.
Poděkování
MUDr. R. Jakšovi za zhotovení obrázku č. 2.
Adresa pro korespondenci:
Doc. MUDr. Pavel Dundr, Ph.D.
Ústav patologie 1. LF UK v Praze a VFN
Studničkova 2, 128 00 Praha 2
e-mail: pdundr@seznam.cz
tel: 224968624, fax: 224911715
Sources
1. Berman JJ, Albores-Saavedra J, Bostwick D, et al. Precancer: a conceptual working definition – results of a Consensus Conference. Cancer Detect Prev 2006; 30 : 387–394.
2. Fadare O, Zheng W. Endometrial Glandular Dysplasia (EmGD): morphologically and biologically distinctive putative precursor lesions of Type II endometrial cancers. Diagn Pathol 2008; 8 : 6.
3. Fadare O, Zheng W. Insights into Endometrial Serous Carcinogenesis and Progression. Int J Clin Exp Pathol 2009; 2 : 411–432.
4. Zheng W, Xiang L, Fadare O, Kong B. A proposed model for endometrial serous carcinogenesis. Am J Surg Pathol 2011; 35: e1–e14.
5. Jia L, Liu Y, Yi X, Miron A, et al. Endometrial glandular dysplasia with frequent p53 gene mutation: a genetic evidence supporting its precancer nature for endometrial serous carcinoma. Clin Cancer Res 2008; 14 : 2263–2269.
6. Tavassoli FA, Devilee P (Eds.) WHO Classification of tumours. Pathology and genetics tumours of the breast and female genital organs. IARC Press: Lyon 2004.
7. Mutter GL, Baak JPA, Crum CP, et al. Endometrial precancer diagnosis by histopathology, clonal analysis, and computerized morphometry. J Pathol 2000; 190 : 462–469.
8. Hecht JL, Ince TA, Baak JPA, et al. Prediction of endometrial carcinoma by subjective endometrial intraepithelial neoplasia diagnosis. Mod Pathol 2005; 18 : 324–330.
9. Salman MC, Usubutun A, Boynukalin K, Yuce K. Comparison of WHO and endometrial intraepithelial neoplasia classifications in predicting the presence of coexistent malignancy in endometrial hyperplasia. Gynecol Oncol 21; 2010 : 97–101.
10. Vang R, Wheeler JE. Diseases of the fallopian tube and paratubal region. In: Kurman RJ, Ellenson LH, Ronnett BM, eds. Blaustein’s Pathology of the Female Genital Tract (6th ed). New York, NY: Springer; 2011 : 453–527.
11. Crum CP, Lee KR (Eds). Diagnostic Gynecologic and Obstetric Pathology. Elsevier Saunders; 2006.
12. Lee Y, Miron A, Drapkin R, et al. A candidate precursor to serous carcinoma that originates in the distal fallopian tube. J Pathol 2007; 211 : 26–35.
13. Shaw PA, Rouzbahman M, Pizer ES, Pintilie M, Begley H. Candidate serous cancer precursors in fallopian tube epithelium of BRCA1/2 mutation carriers. Mod Pathol 2009; 22 : 1133–1138.
14. Chen EY, Mehra K, Mehrad M, et al. Secretory cell outgrowth, PAX2 and serous carcinogenesis in the Fallopian tube. J Pathol 2010; 222 : 110–116.
15. Przybycin CG, Kurman RJ, Ronnett BM, Shih IeM, Vang R. Are all pelvic (nonuterine) serous carcinomas of tubal origin? Am J Surg Pathol 2010; 34 : 1407–1416.
16. Cho KR. Ovarian cancer update: lessons from morphology, molecules, and mice. Arch Pathol Lab Med 2009; 133 : 1775–1781.
17. Köbel M, Kalloger SE, Santos JL, et al. Tumor type and substage predict survival in stage I and II ovarian carcinoma: insights and implications. Gynecol Oncol 2010; 116 : 50–56.
18. Kurman RJ, Shih IM. The origin and pathogenesis of epithelial ovarian cancer: a proposed unifying theory. Am J Surg Pathol 2010; 34 : 433–443.
19. Shih IM, Kurman RJ. Ovarian tumorigenesis: a proposed model based on morphological and molecular genetic analysis. Am J Pathol 2004; 164 : 1511–1518.
20. Kurman RJ, Shih IM. Molecular pathogenesis and extraovarian origin of epithelial ovarian cancer-Shifting the paradigm. Hum Pathol 2011; 42 : 918–931.
21. Irving JA, Clement PB. Disease of the peritoneum. In: Kurman RJ, Ellenson LH, Ronnett BM, eds. Blaustein’s Pathology of the Female Genital Tract (6th ed). New York, NY: Springer; 2011 : 453–527.
22. Prefumo F, Venturini VL, Fulcheri E. Anylysis of p53 and c-erb-2 expression in ovarian endometrioid carcinomas arising in endometriosis. Int J Gynecol Pathol 2002; 22 : 83–88.
23. Li J, Abushahin N, Pang S, et al. Tubal origin of ‘ovarian’ low-grade serous carcinoma. Mod Pathol. In press 2011.
Labels
Anatomical pathology Forensic medical examiner ToxicologyArticle was published in
Czecho-Slovak Pathology

2012 Issue 1
-
All articles in this issue
- Gynekologické prekancerózy z pohledu klinika dnes a zítra
- Prekancerózní léze vulvy
- Co je nového v cytodiagnostice cervikálních prekanceróz?
- Prekancerózy endometria, děložní tuby a ovaria: přehled současné problematiky
- Primární neuroendokrinní karcinom jater
- Neuroendokrinní adenom středouší s prorůstáním do zevního zvukovodu
- Vaginálny myofibroblastóm so žliazkami exprimujúcimi mamárne a prostatické antigeny
- Recidivujúci multifokálny leiomyosarkóm močového mechúra 22 rokov po liečbe bilaterálneho (hereditárneho) retinoblastómu: popis prípadu a prehľad literatúry
- Czecho-Slovak Pathology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Gynekologické prekancerózy z pohledu klinika dnes a zítra
- Prekancerózní léze vulvy
- Co je nového v cytodiagnostice cervikálních prekanceróz?
- Prekancerózy endometria, děložní tuby a ovaria: přehled současné problematiky



