Fluorescenční in situ hybridizace na histologických řezech
Fluorescence in situ hybridization on histologic sections
I-FISH (fluorescence in situ hybridization on interphasic nuclei) represents a laboratory method linking morphological investigations (histological sections of formaldehyde fixed and paraffin embedded tissues) with molecular techniques (sequence specificity of nucleic acids bases for a certain locus). I-FISH is relatively undemanding for a laboratory workout, but offering a lot of important information about the investigated cells. Within a scope of pathology departments I-FISH is utilized mostly in diagnostics of neoplasms. I-FISH is helpful in detecting gene copy numbers (amplifications or deletions), and, importantly, in establishing copy numbers of individual chromosomes (polysomies or monosomies), chromosomal breaks and translocations. At present, I-FISH is used not only for diagnosis and estimation of prognosis, but also as a method to qualify a patient for a targeted biological therapy. Because demands on investigation of solid tumors keep raising I-FISH becomes a part of routine investigations. The aim of this paper is to summarize principles and the utility of I-FISH and to help the interested readers in finding a basic orientation in this laboratory method.
Keywords:
fluorescence in situ hybridization – histological section – fluorescence microscope – probe – interphasic nuclei – formaldehyde fixation
Authors:
Marcela Mrhalová; Roman Kodet
Authors‘ workplace:
Ústav patologie a molekulární medicíny 2. LF UK a FN v Motole, Praha
Published in:
Čes.-slov. Patol., 49, 2013, No. 4, p. 114-122
Category:
Review articles
Overview
Metoda I-FISH (fluorescenční in situ hybridizace na jádrech v interfázi) propojuje morfologické vyšetření histologických řezů z formolem fixovaných a do parafinu zalitých tkání s molekulárními technikami, které využívají sekvenční specifičnosti bází nukleových kyselin pro určitý lokus (oblast na chromozomu). I-FISH je poměrně nenáročná na laboratorní provedení a přitom poskytuje celou řadu důležitých informací o vyšetřovaných buňkách. V rámci pracovišť patologie je využívána především v diagnostice nádorů. I-FISH umožňuje detekovat počty kopií genů (amplifikace či delece), počty jednotlivých chromozomů (polyzomie či monozomie), chromozomální zlomy a translokace a další změny. V současné době se I-FISH používá nejen pro stanovení diagnózy onemocnění nebo k odhadu prognózy nemocných, ale i k indikaci cílené terapie nádorů. Protože se zvyšují nároky na vyšetřování solidních nádorů, stává se metoda I-FISH prakticky rutinním vyšetřením. Článek shrnuje princip a využití I-FISH a snaží se usnadnit základní orientaci v této problematice.
Klíčová slova:
fluorescenční in situ hybridizace – histologický řez – fluorescenční mikroskop – sonda – interfázická jádra – fixace formaldehydem
V posledních letech se rozvíjí řada molekulárních metod umožňujících vyšetřování patologických procesů na úrovni nukleových kyselin. Jejich aplikace vede k odhalování molekulárních změn, které mohou být charakteristické pro určitá nádorová onemocnění. Tento přístup přispívá nejen k upřesnění diagnostiky, ale molekulární změny v nádorech se dají využít i při odhadu prognózy onemocnění. V neposlední řadě se molekulární vyšetřování stává nezbytnou součástí indikací ke specifické cílené terapii pacientů s nádorovými onemocněními. Přestože morfologické vyšetření je a nadále stále bude trvalým základem diagnostiky patologických procesů, je nezbytné, aby patolog postupně zaváděl nová vyšetření, která mu umožní reagovat na zvýšené nároky současné diagnostické i terapeuticko-indikační onkopatologie.
Metoda fluorescenční in situ hybridizace (FISH) stojí na pomezí morfologického a molekulárního vyšetření. FISH je zkratkou počátečních písmen anglického názvu „fluorescence in situ hybridization“. Umožňuje identifikovat řadu chromozomálních změn, například zjištění počtu kopií genů (amplifikace, delece), zjištění počtu chromozomů (polyzomie, monozomie), stanovení chromozomálních zlomů a translokací a dalších změn na úrovni nukleových kyselin (DNA, méně často RNA) a to přímo in situ ve tkáni.
Na našem pracovišti jsme zavedli metodu FISH na histologických řezech v roce 1998, kdy jsme jako jednu z prvních komerčně vyráběných sond začali používat nepřímo značenou sondu pro zjištění počtu kopií genu ERBB2 u nemocných s karcinomy mléčné žlázy a následně přímo značenou sondu pro zjištění zlomu v oblasti genu ALK u dětských pacientů s velkobuněčným anaplastickým lymfomem ALK protein pozitivním. Od té doby se spektrum komerčně dostupných sond rozrostlo obrovským způsobem.
Princip FISH je založen na sekvenční specifičnosti bází nukleových kyselin pro určitý lokus (oblast) a na schopnosti DNA opakovaně tvořit jedno a dvou řetězcové struktury na základě komplementarity bází nukleových kyselin. Sonda (anglicky „probe“), je úsek nasyntetizované DNA, který sekvencí bází odpovídá vyšetřované oblasti genomické DNA. Sonda najde v buňce komplementární část genomické nukleové kyseliny a za vhodných podmínek k ní přihybridizuje. Vytvoří se hybridní dvouřetězcová DNA molekula, jeden řetězec tvoří genomická DNA a druhý uměle nasyntetizovaná DNA sonda (obr. 1). Aby bylo možné navázanou sondu ve tkáni pozorovat, je značena fluorescenční značkou – tzv. fluorochromem. V mikroskopu pak detekujeme fluorescenční signály, a to buď jejich počet, nebo hodnotíme jejich vzájemné uspořádání. Pro detekci změn v interfázickém jádře bývá pro metodu FISH používána zkratka I-FISH (pod označením FISH se většinou rozumí vyšetření spiralizovaných chromozomů v metafázi).
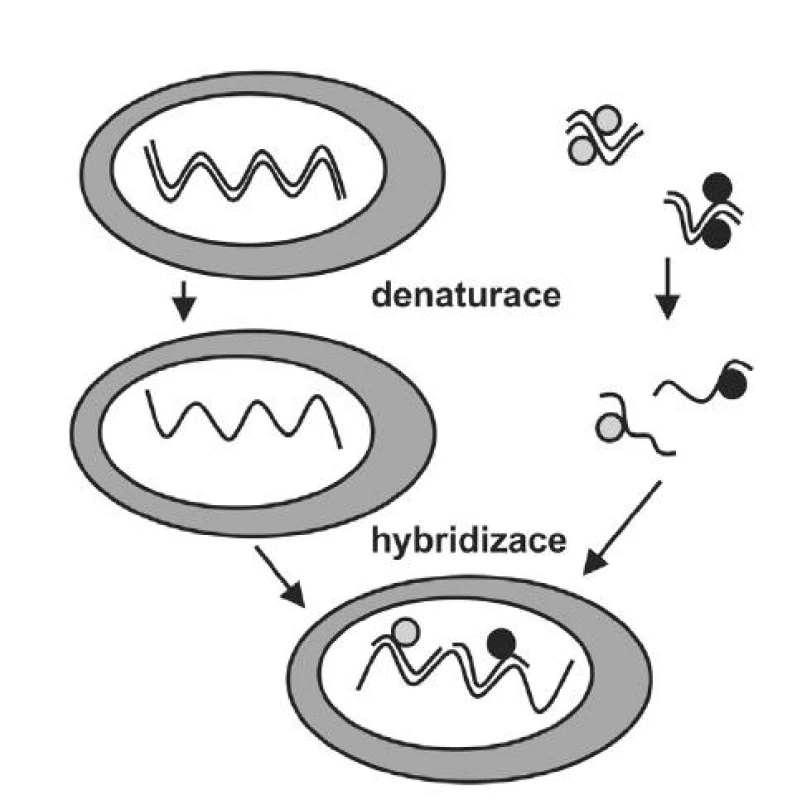
Molekulárním základem hybridizace je opakovaná schopnost dvoušroubovice DNA denaturovat (vzniknou dva jednovláknové řetězce) a následně renaturovat (znovu vytvořit dvoušroubovici). Tato schopnost je dána způsobem propojení jednotlivých bází řetězců DNA vodíkovými můstky, které lze v laboratorních podmínkách tepelně či chemicky rozvolnit. Poprvé popsali tvorbu RNA-DNA hybridů v cytologických preparátech pomocí inkubace s radioaktivně značenou RNA sondou Joseph G. Gall a Mary Lou Pardue v roce 1969 (1). Ve stejném roce tito autoři publikovali také techniku umožňující lokalizaci DNA-DNA hybridů (2). Postupně byly radioaktivně značené sondy nahrazeny sondami značenými fluorescenčně (3). Od té doby se metodika I-FISH rozvíjí rychlým tempem a v současné době je již v některých případech pro patologa rutinním vyšetřením.
STRUČNÉ LABORATORNÍ SEZNÁMENÍ S I-FISH
Metoda I-FISH se dá použít pro vyšetření různorodého biologického materiálu – histologických řezů ze zmrazených tkání, histologických řezů z formolem fixovaných a do parafinu zalitých tkání, cytospinových preparátů, histologických řezů z cytobloků, otiskových preparátů nativních tkání, roztěrových preparátů, izolátů jaderných buněk atd. Při vyšetřování solidních nádorů v histopatologických laboratořích jsou pro I-FISH nejčastěji používaným materiálem histologické řezy z formolem fixovaných a do parafinu zalitých tkání.
Postup I-FISH na histologických řezech z formolem fixovaných a do parafinu zalitých tkání je poměrně jednoduchý. Po deparafinaci a zavodnění histologických řezů je nutné zpřístupnit nukleové kyseliny (odstranit okolní proteiny a jiné makromolekuly stericky bránící sondě v přístupu k DNA) a uvolnit zesíťování tkáně způsobené formaldehydovou fixací. Aby mohla sonda najít sekvenčně specifické oblasti v genomové DNA, je nutné dvouvláknové struktury nukleových kyselin rozvolnit na jednovláknové (denaturovat). Denaturace DNA se provádí nejčastěji za zvýšené teploty v roztoku formamidu, který snižuje teplotu tání DNA-DNA duplexů na úroveň, při které není tepelně poničena morfologie tkáně. Sonda je nanesena na odvodněnou denaturovanou tkáň. Po přikrytí krycím sklem je preparát umístěn ve tmě ve vlhkém prostředí a za potřebné teploty pak probíhá hybridizace, nejčastěji přes noc. Druhý den odmyjeme přebytek sondy, která přihybridizovala pouze k částečně komplementárním sekvencím genomové DNA. Tyto hybridy jsou méně stabilní, než dokonale komplementární hybridy, a proto je lze za vhodných podmínek „odmýt“, a zajistit tak vysokou specifitu reakce. Pro orientaci ve tkáni je nutné „dobarvit“ fluorescenčně také jádra. K tomuto účelu se používají interkalační činidla, která se vkládají mezi báze nukleových kyselin. Protože jsou v jádrech v interfázi chromozomy despiralizovány, je zviditelněno prakticky celé jádro. Následně je preparát zamontován do roztoku, který omezuje blednutí fluorochromů. Výsledek hybridizace se hodnotí ve fluorescenčním mikroskopu.
Samotná metoda I-FISH tedy není náročná na techniku zpracování ani na laboratorní vybavení, postačuje běžně zařízená histologická laboratoř. Pro hodnocení výsledku I-FISH je však nezbytný fluorescenční mikroskop, jehož pořízení je již finančně náročnější.
PRINCIP FLUORESCENCE A FLUORESCENČNÍ MIKROSKOP
Fluorescenci popsal britský vědec Sir George G. Stokes v roce 1852 (4). Pozoroval, že minerál fluorit (fluorspar) po ozáření ultrafialovým zářením vyzařuje světlo a pojmenoval tento jev „fluorescence“. Stokesovo pozorování, že fluoreskující světlo má delší vlnovou délku než excitační světlo, je označováno jako Stokesův posun. Stručně lze princip fluorescence charakterizovat takto: foton ultrafialového záření se srazí s elektronem v atomu, excituje jej a „vyzvedne“ na vyšší energetickou hladinu. Excitovaný elektron následně relaxuje na nižší energetickou hladinu a emituje při tom světlo ve formě fotonu s nižší energií (delší vlnovou délkou) v oblasti viditelného světla (emise trvá nanosekundy). Tento děj se neustále opakuje, dokud je objekt vystaven excitačnímu záření. Většina fluorochromů může opakovat excitační a emisní cyklus v řádu set až tisíců cyklů, než je molekula „vysvícena“. Redukce intenzity emitovaného světla se obecně nazývá „fading“ nebo „photobleaching“, tedy blednutí, a lze ji omezit chemicky.
První komerční fluorescenční mikroskop byl vyvinut mezi roky 1911 a 1913 německými fyziky (Otto Heimstädt, Heinrich Lehmann) pro pozorování autofluorescence baktérií, zvířecích a rostlinných tkání a byl vyráběn společnostmi Reichert a Carl Zeiss. Krátce na to (1914) Stanislav von Prowazek začal studovat vazbu barevných fluorescenčních látek ve fixovaných tkáních a v živých buňkách. Přelom nastal kolem roku 1941, kdy Albert Coons vyvinul techniku pro značení protilátek fluorescenčními barvivy tzv. fluorochromy (4).
Fluorochromy jsou látky schopné fluorescence a jsou charakterizovány excitačními a emisními spektry. Výhodou fluorochromů (příklad chemické struktury viz obr. 2) je většinou jejich malá velikost (stericky nebrání vazbě sondy na DNA) a umožňují tak přímé značení sond. Orientační přehled fluorochromů nejčastěji používaných pro I-FISH sondy uvádíme v tabulce (tab. 1).
![Příklady chemické struktury fluorochromů. FITC [fluorescein 5(6)-isothiokyanát] často používaný fluorochrom pro značení sond (poskytuje zelenou fluorescenci) a DAPI [4´,6-diamidino-2-phenylindol dihydrochlorid hydrát] často používaný fluorochrom pro „dobarvení“ jader – ozřejmí rozvolněnou interfázickou DNA (poskytuje modrou fluorescenci).](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/c9383626159879edce656690142c26b5.jpg)

Základním úkolem fluorescenčního mikroskopu je umožnit excitačnímu záření ozářit tkáň a následně separovat mnohem slabší emitované fluorescenční světlo od jasnějšího excitačního světla tak, aby pouze toto emitované světlo dopadalo přes okuláry do očí nebo do detektoru. Fluoreskující oblasti pak svítí jasně oproti tmavému pozadí s dostatečným kontrastem, který dovoluje detekci fluorescence. Fluorescenční mikroskop umožní pozorovat fluoreskující materiál s vynikající citlivostí. I-FISH má takové rozlišení, že umožňuje lokalizovat geny, které jsou přítomné pouze v jedné kopii.
Původní fluorescenční mikroskopy měly klasické transmisní („prozařovací“) uspořádání tak, jak je známe z běžné světelné mikroskopie. Pozorované objekty však měly nízký kontrast a rozlišení a pozadí bylo zaplaveno rozptýleným excitačním zářením (intenzita excitačního záření je daleko větší než intenzita emitované fluorescence). Fluorescenční mikroskop s dopadajícím („episcopic“) osvětlením, který se používá do současnosti, byl poprvé vyvinut v dvacátých letech dvacátého století pro pozorování fluorescence neprůhledných hutních materiálů. Uvedené uspořádání poskytovalo obraz mnohem jasnější než u transmisního fluorescenčního mikroskopu, a proto postupně převládly epi-fluorescenční mikroskopy i v lékařském využití (5).
V epifluorescenčním uspořádání prochází ultrafialové záření emitované zdrojem UV záření (rtuťovou výbojkou) přes sadu filtrů do objektivu a přes něj dopadá shora na preparát. Pokud je v preparátu přítomen fluorochrom, který je schopen pohltit filtry vymezenou část ultrafialového záření, dojde k fluorescenci a vyzářené světlo prochází zpět přes objektiv a sadu filtrů do okulárů nebo do kamery (obr. 3).
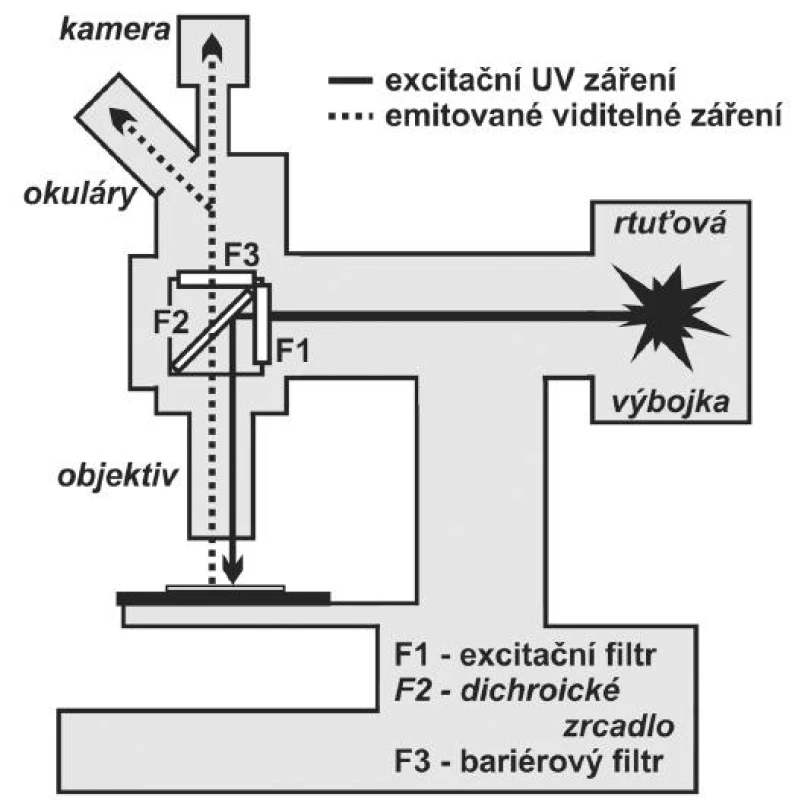
Podrobnější popis zasluhuje sada tří filtrů, která je pro pozorování fluorescence klíčová. První je do cesty UV záření postaven excitační filtr, který propustí právě tu část UV záření, které je potřeba pro excitaci použitého fluorochromu. Následně UV záření narazí na dichroické zrcadlo („dichromatic beamsplitter“ nebo „dichroic mirror“), které UV záření nepropustí, ale odrazí přes objektiv na pozorovaný preparát. Fluorochromem emitované viditelné záření po průchodu objektivem prochází přes dichroické zrcadlo a dále přes bariérový filtr do okulárů mikroskopu. Bariérové filtry zabraňují excitačnímu UV záření, aby prošlo přes okuláry do oka nebo do detektoru kamery a umožní průnik pouze vybraným emisním vlnovým délkám. Jelikož je sestava filtrů specifická vždy pro jeden konkrétní fluorochrom, je většina epi-fluorescenčních mikroskopů vybavena karuselem umožňujícím jednoduše měnit různé sady fluorescenčních filtrů, podle toho, který fluorochrom chceme pozorovat. V dnešní době se běžně používají vícepásmové filtry umožňující pozorování dvou, tří a dokonce i čtyř fluorochoromů současně. Problémem těchto vícepásmových filtrů je celkově nižší intenzita fluorescence jednotlivých fluorochromů a zvýšené blednutí fluorochromů.
SPECIFIKA I-FISH NA JÁDRECH V INTERFÁZI V HISTOLOGICKÉM ŘEZU
Na rozdíl od cytogenetiků, kteří hodnotí chromozomy v metafázi, používá patolog (vyšetřující převážně solidní nádory) FISH nejčastěji na jádra v interfázi (I-FISH). Buňky solidních nádorů jsou totiž poměrně obtížně kultivovatelné, kultivace musí být dlouhodobá a získané chromozomy nebývají příliš kvalitní. Výhodou vyšetřování jader v interfázi je vyšší rozlišení (schopnost odlišit od sebe dva fluoreskující body podél délky chromozomu). U chromozomů v metafázi se rozlišení pohybuje okolo 3 Mb (3x106 bází), u jader v interfázi, kdy je struktura chromozomu rozvolněná, se rozlišení zvyšuje na 100 kb (1x105 bází). Právě pro velmi dobré rozlišení se FISH využívá i pro identifikaci pozice genů při mapování lidských chromozomů.
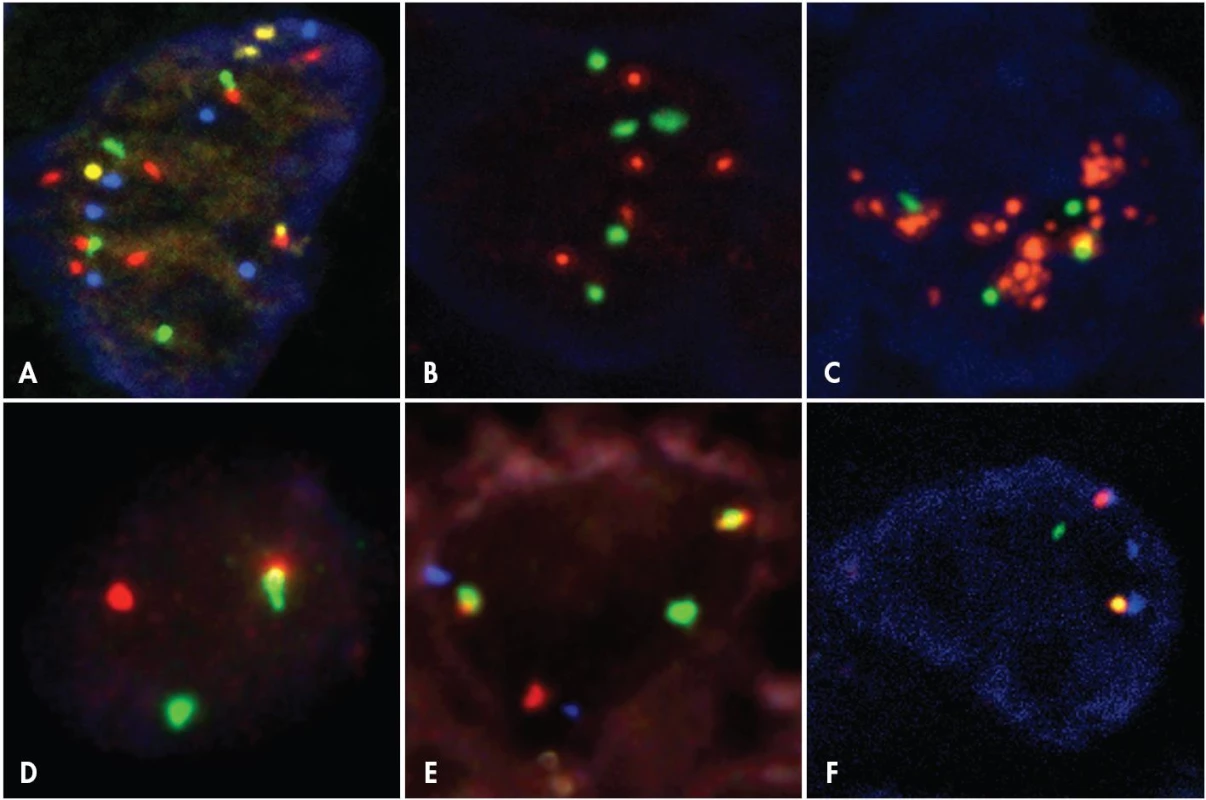
V současné době se pro I-FISH prakticky výlučně používají sondy, které jsou přímo značené fluorochromy. Dříve se používalo značení nepřímé – na sondu byla navázána malá molekula, která nebyla barevná ani nebyla schopná fluorescence. Proti této molekule byla vyrobena protilátka, jejíž vazba na sondu byla následně detekována vazbou další protilátky značené fluorochromem. Použití přímo značených sond má proti nepřímo značeným sondám několik výhod. Celý laboratorní postup je urychlen (odpadá inkubace s protilátkami) a jsou minimalizovány nespecifické vazby protilátek v histologických řezech. U současných přímo fluorescenčně značených sond již není třeba zesilovat intenzitu fluorescence, a proto jsou přímo značené sondy značně rozšířené. Dostupné jsou i systémy využívající chromogenní detekce. Je to vyvoláno zejména snahou rozšířit hybridizační vyšetření i na pracoviště, která nemají k dispozici fluorescenční mikroskop. V případě chromogenní detekce je sonda značena malou molekulou a detekce je prováděna jako v imunohistochemii vazbou protilátek a reakcí enzym – substrát / ko-substrát. Přestože detekce tohoto způsobu značení nevyžaduje fluorescenční mikroskop, má celou řadu nevýhod, pro které je obecně stále preferována metoda hybridizace s fluorescenčně značenými sondami. I-FISH totiž poskytuje proti metodám chromogenním (CISH – chromogenic in situ hybridization; SISH – chromogenic silver in situ hybridization) vysoké rozlišení a kontrast intenzivně fluoreskujících signálů na tmavém pozadí. To je výhodné zvláště při detekci jedné kopie genu. Mnohem lépe lze při I-FISH využít také vícebarevného značení – například kombinaci fluorochromů poskytujících zelenou, červenou, žlutou a modrou fluorescenci (obr. 4A), což je při použití chromogenního značení prakticky nemožné.
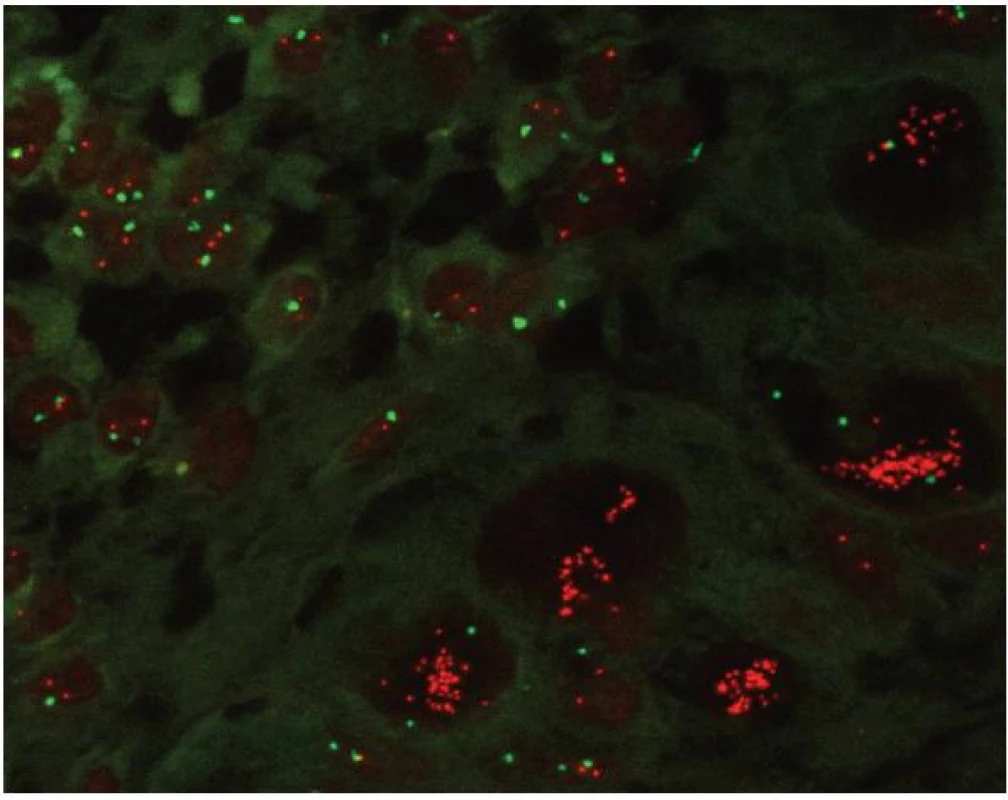
Vyšetřování jader v interfázi přineslo možnost rutinně pro FISH používat histologické řezy z formolem fixovaných a do parafinu zalitých tkání. I-FISH na histologických řezech poskytuje mnoho výhod. Na prvním místě je to možnost vyšetření genové či chromozomální změny v kontextu s morfologií tkáně (obr. 5). Ve fluorescenčním mikroskopu lze většinou snadno odlišit populaci nádorovou od nenádorové nebo in situ lézi od invazivní nádorové populace (6). Lze vyšetřit velké množství nádorové populace, ale I-FISH je vhodná i v případech, kdy je bioptického materiálu nedostatek – například při endoskopických odběrech ze žaludku nebo z plic. V histologickém řezu lze s výhodou porovnat změny na úrovni genové se změnami na úrovni proteinové – tedy provést stanovení exprese určitého proteinu metodami imunohistochemickými a na následném řezu provést stanovení genu, který protein kóduje metodou I-FISH. Výhodou I-FISH na histologických řezech je možnost vyšetření archivního materiálu (pokud nemocný v době relapsu onemocnění již není únosný pro další bioptický odběr nebo pokud je třeba porovnat nález v primárním nádoru s odběrem z metastatického ložiska, nebo z recidivy po předchozí terapii). I-FISH na histologických řezech je také nezastupitelná v případech, u kterých je problematická izolace nukleových kyselin pro PCR metody, způsobená například degradací nukleových kyselin po formaldehydové fixaci. Obecná výhoda I-FISH spočívá také ve skutečnosti, že signály jsou v buňkách přítomny prakticky vždy, pouze se může lišit jejich počet nebo uspořádání. Je tedy vždy přítomna vnitřní kontrola dobře provedeného vyšetření.
Nevýhodou histologických řezů je paradoxně řez samotný – při síle řezu několika mikrometrů je prakticky vždy k dispozici pouze část jádra (část DNA zůstává buď v parafinovém bloku, nebo je součástí předchozího histologického řezu). Zdálo by se tedy, že čím silnější řez použijeme, tím více DNA v jádře budeme moci vyšetřit a je tudíž optimální používat co nejsilnější řezy. Pokud je však síla řezu velká, jádra (nebo jejich části) se překrývají, a nelze rozpoznat, do kterého jádra signál patří. To může být zásadní komplikace při hodnocení například početních změn genů nebo chromozomů. Při použití velmi tenkého řezu se jádra prakticky nepřekrývají, ale pro hodnocení jsou k dispozici pouze malé „plátky“ jader, a proto jsou často přítomná i jádra bez signálů. Při volbě síly histologického řezu musíme tedy volit kompromisní řešení.
TYPY I-FISH SOND POUŽÍVANÝCH V PATOLOGII A JEJICH HODNOCENÍ
Sondy používané pro I-FISH jsou poměrně dlouhé – sta až tisíce kilobází (105 – 106 bází). Umožňují tedy (na rozdíl od metod PCR) mapovat velké úseky nukleových kyselin a zjistit zlomy genů v různých alternativních místech v jednom vyšetření. Tyto „dlouhé“ sondy jsou schopny přihybridizovat, i když jsou přítomny např. bodové mutace, nebo i pokud jsou nukleové kyseliny naštípané formaldehydovou fixací (reakce se provádí in situ v tkáni, naštípané úseky DNA jsou lokalizovány stále na místě, v původní pozici a sonda na ně může přihybridizovat).
Pro vyšetření interfázických chromozomů se nepoužívají tzv. malovací sondy, často využívané u metafázických chromozomů (směs různých sond charakteristická vždy pro jeden chromozom). Jelikož jsou v interfázických jádrech chromozomy despiralizovány, malovací sonda vytváří v jádře difúzní fluoreskující oblasti a nelze odlišit, jaký počet chromozomů je v jádře skutečně přítomen. Pro zjišťování počtu chromozomů na jádrech v interfázi se používají centromerické sondy, které jsou svojí sekvencí nukleotidů specifické pro centromery jednotlivých chromozomů. Sondy centromerické jsou většinou namířené proti vysoce repetitivním sekvencím centromerických oblastí – hybridizační signál bývá silný (sonda hybridizuje k těmto sekvencím mnohonásobně). Druhým, často používaným typem sond, jsou sondy lokus specifické. Svojí sekvencí bází nukleových kyselin jsou specifické pro určitý konkrétní lokus – oblast na chromozomu. Tyto sondy musí být schopné, na rozdíl od sond centromerických, hybridizovat i k jedné kopii genu. Od doby, kdy jsou dostupné dvoupásmové a trojpásmové fluorescenční filtry se velice často používají směsi různě značených sond. Například směs sondy lokus specifické a centromerické se používá u hodnocení amplifikací genů – umožňuje v jedné buňce hodnotit počet kopií genu, a zároveň počet chromozomů, na kterém je vyšetřovaný gen lokalizován (7,8). Umožní tedy odlišení například mírného stupně amplifikace genu od polyzomie chromozomu (obr. 6, obr. 4B – 4C).
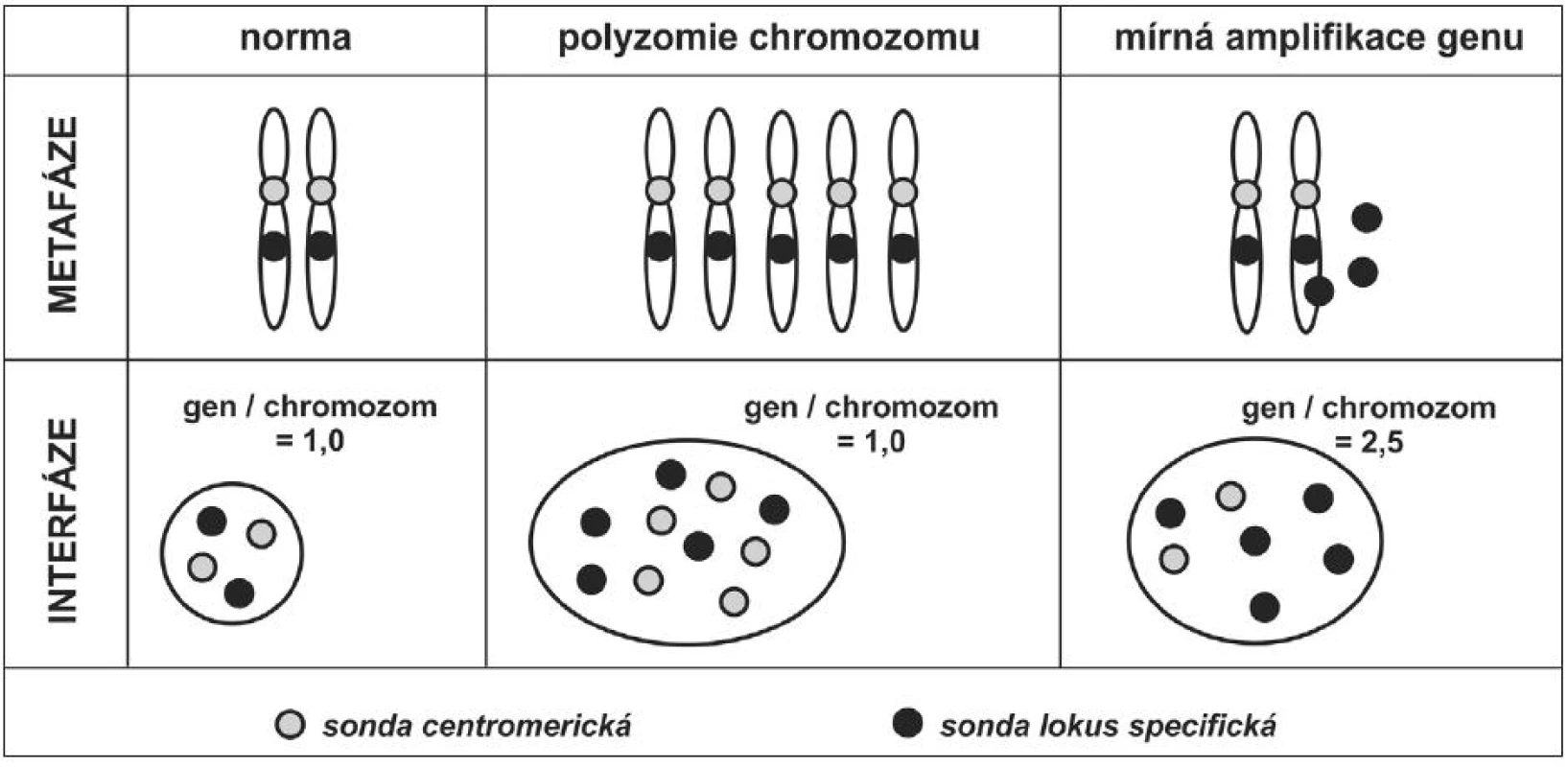
Chromozomální změny mohou být buď numerické (změny v počtu chromozomů) nebo strukturální (změny nastávají v rámci chromozomu, počet chromozomů se nemění). Pomocí sond centromerických můžeme zjistit polyzomie (zvýšení počtu některého chromozomu), monozomie (přítomnost pouze jednoho chromozomu z páru), nebo aneuzomie (abnormální počet některého z chromozomů). Polyploidie (celý set chromozomů je přítomen více než dvakrát) a aneuploidie (označuje fakt, že je přítomen abnormální počet sad chromozomů) jsou lépe detekovatelné jinými molekulárními metodami. Polyzomie jsou časté u nádorových populací a v některých případech jsou i diagnosticky či prognosticky využitelné. Změny v počtu genů se detekují pomocí lokus specifických sond. V normální buňce jsou přítomny dva signály vyšetřované oblasti – po jedné na každém z páru chromozomů.
Velmi často se používají směsi dvou a více sond – hlavně při detekci chromozomálních zlomů a translokací, ale i pro detekci více genů či chromozomů současně. Pro zjištění chromozomálních translokací se využívá několik systémů uspořádání směsi sond (obr. 7). Lze použít takzvaných zlomových sond („dual color break-apart probes“). Na jeden z chromozomů účastnících se translokace jsou použity dvě různě značené sondy. Při přítomnosti zlomu genu dochází k oddálení signálů (obr. 4D). Tento typ sond zjistí zlom vyšetřovaného genu, ale neumožňuje identifikovat partnerský gen translokace. Proto se tyto sondy využívají zvláště v případech, u kterých má vyšetřovaný gen více partnerských genů translokace. Další, takzvaný „dual color single fusion“ systém, je založen na použití dvou lokus specifických sond, každá pro jeden pár partnerských chromozomů translokace. Jedna sonda pokrývá úsek za místem zlomu jednoho genu směrem k centromeře chromozomu a druhá sonda překlenuje oblast od místa zlomu druhého genu směrem k telomeře na druhém partnerském chromozomu translokace. Translokací tedy vznikne jeden fúzní signál. Nevýhodou je, že v interfázickém jádře může docházet k nahodilé kolokalizaci obou značených oblastí. Tuto nahodilost lze snížit použitím systému „dual color single fusion with extra signal“. Uspořádání je stejné jako u předešlého systému, ale jedna sonda překlenuje oblast před i za místem zlomu jednoho z genů, které se translokace účastní. Pokud je translokace přítomna, je výsledkem jeden signál navíc, než v předchozím systému. Z pohledu omezení výskytu falešně pozitivních jader vzniklých nahodilou kolokalizací despiralizovaných chromozomů je však nejvýhodnější aplikovat systém „dual color dual fusion“. Pro oba geny účastnící se translokace jsou použity sondy pokrývající oblasti před i za místem zlomu a pro každý z partnerských genů je použit jiný fluorochrom. Nelze sice určit, který ze dvou vzniklých fúzních signálů přísluší kterému ze dvou derivativních chromozomů, ale přítomnost dvou fúzních signálů v jednom jádře vzniklá nahodilou kolokalizací je prakticky vyloučená. V některých případech se ještě přidává centromerická sonda, značená třetím fluorochromem (obr. 4E).
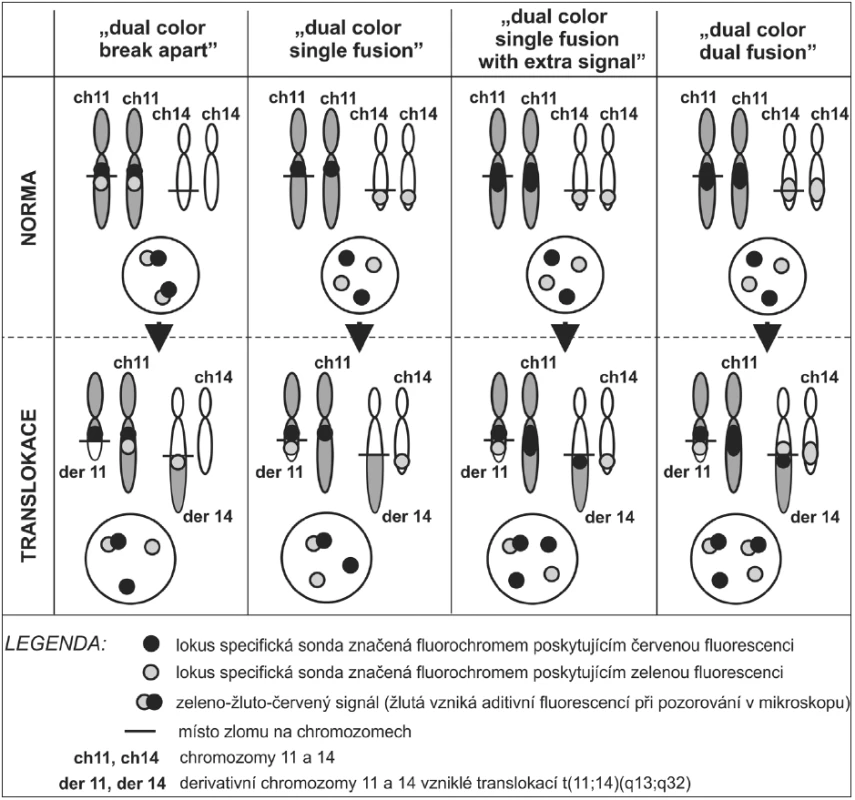
Ne vždy však dochází pouze k jednoduchým recipročním translokacím. V jedné translokaci mohou být zavzaty například tři chromozomy se čtyřmi místy zlomu. Tyto změny pak nazýváme komplexními translokacemi a vedou většinou k velmi komplikovaným přestavbám na chromozomech. Komplexní translokace většinou nelze při použití I-FISH sond na histologickém řezu blíže specifikovat a jejich analýza vyžaduje zapojení dalších molekulárních metod.
PŘÍKLADY VYUŽITÍ I-FISH V PROBLEMATICE SOLIDNÍCH NÁDORŮ
Nejčastěji se metodami I-FISH v histologických řezech u pacientů se solidními nádory vyšetřují chromozomální zlomy, translokace, počty genů a počty chromozomů (viz. tab. 2).
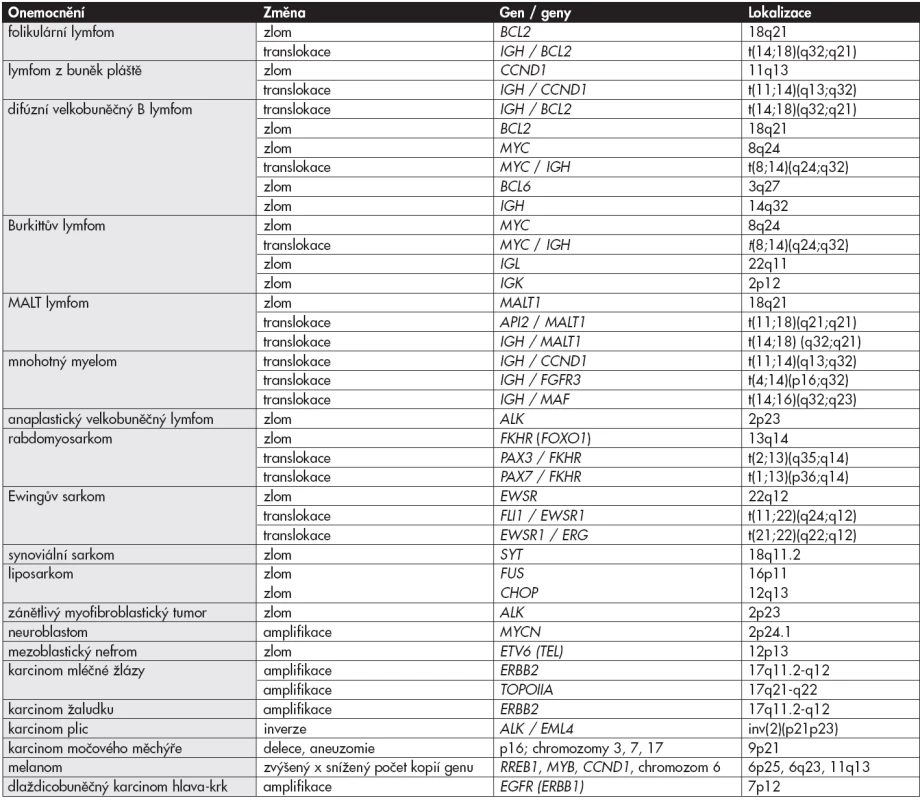
Časté je vyšetřování amplifikace genu ERBB2 u nemocných s karcinomy mléčné žlázy (9-11). Pozor – ERBB2 je oficiální název podle „HUGO Gene Nomenclature Committee“, nesprávně se používá předchozí označení genu „HER2/neu“ nebo „c-erbB-2“. Druhým příkladem je vyšetření amplifikace genu MYCN u nemocných s neuroblastomem (12,13). Tyto geny mohou sloužit pro zpříkladnění dvou různých způsobů amplifikace chromozomálních úseků – „double minutes“ a „homogeneously staining region“.
„Double minutes“ (DM) se objevují jako malá, často párová tělíska. Jsou acentrická a jejich segregace během mitózy je nepravidelná. Proto je počet DM v jádrech buněk jednoho nádoru značně variabilní. Příkladem amplifikace ve formě DM je amplifikace genu MYCNu nemocných s neuroblastomem. Stanovení amplifikace genu MYCN slouží k odhadu prognózy onemocnění. Pacienti s neuroblastomem jejichž nádorové buňky mají gen MYCN amplifikován, mají onemocnění s nepříznivou prognózu ve srovnání s nemocnými, u kterých tento gen amplifikován není.
Druhým způsobem amplifikace jsou homogenně se barvící oblasti („homogeneously staining region“, HSR). Jde o intrachromozomální amplifikaci. HSR mají variabilní velikost, často jsou v chromozomu mnohonásobně multiplikovány. HSR se mohou vkládat také do jiných chromozomů, než do chromozomu, z kterého vznikly. Tento způsob amplifikace bývá pozorován například u genu ERBB2 u nemocných s karcinomy mléčné žlázy. Stanovení amplifikace genu ERBB2 (10) ve spojení se imunohistochemickým zjištěním zvýšené exprese produktu tohoto genu, proteinu ERBB-2 (9), a případně zvýšené exprese ERBB2 mRNA (14), vede onkologa k nasazení biologické léčby protilátkou proti ERBB-2 proteinu. Jedná se tedy o vyšetření důležité pro indikaci ke specifické terapii.
Na rozdíl od epiteliálních nádorů, u kterých bývají často přítomny amplifikace genů, jsou pro lymfomy, a pro některé sarkomy, charakteristické chromozomální translokace. Například u nemocných s lymfomem z buněk pláště („mantle cell lymphoma“, MCL) dochází ke zlomům v oblasti 13 dlouhého raménka chromozomu 11 (oblast genu CCND1) a v oblasti 32 dlouhého raménka chromozomu 14 (oblast genu IGH). Výsledkem je balancovaná translokace t(11;14)(q13;q32), která je pro MCL charakteristická a může být použita k podpoře diagnózy. Translokace t(11;14)(q13;q32) vede k expresi cyklínu D1 i ve tkáních, ve kterých se normálně cyklín D1 na regulaci proliferace buněk nepodílí, tedy v leukocytech (15). Obdobně se sleduje přítomnost t(14;18)(q32;q21) u nemocných s folikulárním lymfomem (16) u nemocných s difúzním velkobuněčným B-lymfomem (DLBCL) (17). Nemocní s DLBCL s komplexními chromozomálními přestavbami [t(14;18)(q32;q21) a zároveň například t(8;14)(q24;q32)] mají průběh onemocnění vysloveně nepříznivý (18). Stanovení translokací tedy v tomto případě slouží k odhadu vývoje onemocnění.
V případech, u kterých má gen více translokačních partnerů [například gen ALK u velkobuněčných anaplastických lymfomů – ALCL (19), gen EWSR u různých solidních nádorů a gen MYC u Burkittových lymfomů (20)] je vhodné požívat sondy zlomové a pokud je zlom prokázán, určit změnu pomocí sond translokačních nebo následně využít metod PCR. Zjištění přítomnosti chromozomálního zlomu je často důležité pro potvrzení diagnózy – např. zlom genu EWSR u Ewingova sarkomu a dalších nádorů, zlom genu SYT u synoviálního sarkomu, zlom genu FKHR u alveolárního rabdomyosarkomu.
Častá je také situace, kdy se zlom jednoho genu může (s různými partnerskými geny translokace) vyskytovat u více různých onemocnění. Například zlom genu ALK má řadu translokačních partnerů a může se vyskytovat u ALCL, DLBCL, zánětlivého myofibroblastického nádoru, adenokarcinomu plic a u dalších onemocnění (19).
V nádorové populaci mohou také vzniknout chromozomální inverze. Při inverzi dochází ke dvěma zlomům na jednom chromozomu, otočení této „vyštěpené“ části a k novému funkčnímu spojení obou zlomů. Pokud části chromozomů, které se inverze zúčastňují, leží na jednom raménku chromozomu, je inverze označována jako paracentrická. Pericentrická inverze nastává, pokud je jeden zlom na krátkém raménku a druhý zlom na dlouhém raménku téhož chromozomu a centromera je tak zavzata do inverze. V současné době je nejčastěji I-FISH metodou vyšetřována inverze krátkého raménka chromozomu 2, tedy paracentrická inverze inv(2)(p21p23) u nemocných s karcinomy plic, vedoucí k vytvoření fúzního transkriptu EML4-ALK (obr. 4F). U nemocných s touto změnou v nádorové populaci je možné nasadit specifickou terapii.
V některých případech se stanovují delece (ztráta segmentu z chromozomu). Například u melanomů bývá přítomna delece v oblasti 6q23 (gen MYB), označovaná del(6)(q23), a metodou I-FISH se vyšetřuje.
Metoda I-FISH může vhodně doplňovat například cytologické vyšetření – u nemocných s karcinomy močového měchýře se používá močový sediment, ve kterém se detekují „abnormální“ buňky nesoucí změny v počtu některých chromozomů. Jedná se tedy o určitý typ neinvazivního skreeningu.
Další, u solidních nádorů relativně častou chromozomální aberací, je přítomnost isochromozomů. Jedná se o ztrátu celého jednoho raménka chromozomu, která je kompenzována duplikací druhého raménka stejného chromozomu. Například i(17q) – duplikace dlouhého raménka a ztráta krátkého raménka chromozomu 17. Tuto změnu nalézáme například u nádorové populace nemocných s karcinomy mléčné žlázy.
Metodou I-FISH je možné zjišťovat také počet pohlavních chromozomů (X a Y), například u případů s komplexními změnami karyotypu (21), nebo u molárního onemocnění či po transplantacích (odlišné pohlaví příjemce a dárce), kdy je možné odlišit, zda potransplantační nádorová proliferace vznikla z buněk příjemce nebo dárce. Stanovení přítomnosti chromozomů X a Y umožňuje také zjistit, zda lymfocyty, napadající například cévy při rejekci jsou od dárce nebo příjemce. Tato vyšetření se však provádějí zatím spíše výjimečně.
KRÁTKÉ SROVNÁNÍ METOD I-FISH A PCR
Sondy používané v I-FISH jsou dlouhé zpravidla stovky kilobází (105 bází), na rozdíl od primerů pro PCR, které vymezují oblasti dlouhé stovky párů bází (102 bází). Takováto délka I-FISH sond umožňuje vyšetřit poměrně dlouhé úseky DNA v jedné hybridizaci a překlenout například i několik variabilních míst zlomu. Tím se zvyšuje šance záchytu chromozomální změny v jednom vyšetření.
Oproti PCR však nemůže I-FISH určit například přesné místo zlomu na chromozomu a tedy zjistit přestavbu specifickou pro konkrétního pacienta, důležitou pro následné sledování minimální reziduální nemoci. Naopak metody PCR jsou pro sledování minimální reziduální nemoci optimální (viz další článek této laboratorní série).
Velkou výhodou I-FISH je možnost vyšetřovat s „morfologickým aspektem“ – lze identifikovat nádorovou populaci a celkem spolehlivě ji odlišit od příměsi buněk stromálních. Naproti tomu metody PCR pracují většinou s homogenáty tkání a stromální příměs může ovlivnit výsledek. I-FISH také umožňuje vyšetřit zvlášť např. invazivní nádorovou populaci a in situ nádorovou populaci. Pokud chceme stejné vyšetření provést pomocí PCR, je nutné do výběru tkáně zařadit laserovou mikrodisekci (viz další článek této laboratorní série).
Jak již bylo zmíněno, I-FISH je použitelná i v případech, kdy jsou nukleové kyseliny pro metody PCR příliš fragmentované formaldehydovou fixací.
Metody I-FISH jsou také nezastupitelné při porovnávání například exprese proteinu s počtem kopií genu na dvou následných řezech.
Jak je tedy z předchozího patrné, oba přístupy (I-FISH a PCR) se vhodně doplňují a je s výhodou je provádět současně.
ZÁVĚR
Metoda I-FISH se během posledního desetiletí stala rutinním vyšetřením v mnoha oblastech histopatologické diagnostiky. Vhodně navazuje na vyšetření morfologické a imunohistochemické. Slouží tedy jako jakýsi most mezi klasickými histologickými a imunohistochemickými technikami a metodami čistě molekulárními typu PCR. S výhodou spojuje aspekt morfologický s aspektem molekulárním. Jak vyplyne z dalších příspěvků této „laboratorní“ série článků, je třeba jednotlivá vyšetření kombinovat.
Velikou výhodou je, pokud jsou všechny metody prováděny přímo na pracovištích patologie. Molekulární biolog ovládající metody molekulární ve spolupráci s patologem ovládajícím morfologickou diagnostiku tvoří dobrý diagnostický tým. Z jejich vzájemné spolupráce pak těží především pacient a jeho ošetřující lékař.
PODĚKOVÁNÍ
Podpořeno projektem (Ministerstva zdravotnictví) koncepčního rozvoje výzkumné organizace 00064203 (FN MOTOL).
Adresa pro korespondenci:
RNDr. Marcela Mrhalová, Ph.D.
Ústav patologie a molekulární medicíny 2. LF UK a FN v Motole, Praha
V Úvalu 84, 150 06 Praha 5 – Motol
e-mail: marcela.mrhalova@lfmotol.cuni.cz
Sources
1. Gall JG, Pardue ML. Formation and detection of RNA-DNA hybrid molecules in cytological preparations. Proc Natl Acad Sci U S A 1969; 63(2): 378-383.
2. Pardue ML, Gall JG. Molecular hybridization of radioactive DNA to the DNA of cytological preparations. Proc Natl Acad Sci U S A 1969; 64(2): 600-604.
3. Rudkin GT, Stollar BD. High resolution detection of DNA-RNA hybrids in situ by indirect immunofluorescence. Nature 1977; 265(5593): 472-473.
4. Rost FWD. Fluorescence microscopy. Press Syndicate of the University of Cambridge, Cambridge University Press: Cambridge, New York, USA; 1996.
5. Olympus. Microscopy resource center, Olympus America Inc. 2012, Available from: http://www. olympusmicro.com/
6. Mrhalová M, Kodet R. Paget’s disease of the nipple: a copy number of the genes ERBB2 and CCND1 versus expression of the proteins ERBB-2 and cyclin D1. Neoplasma 2003; 50(6): 396-402.
7. Mrhalová M, Kodet R, Strnad P. Invazivní duktální karcinomy mléčné žlázy: vyšetření počtu kopií genu CCND1 a počtu chromozómů 11 metodou fluorescenční in situ hybridizace (FISH) v porovnání s expresí proteinu cyklín D1 a receptoru pro estrogen (ER alpha) detegovanou imunohistochemicky (IHC). Cas Lek Cesk 2002; 141(22): 708-714.
8. Mrhalová M, Plzák J, Betka J, Kodet R. Epidermal growth factor receptor - its expression and copy numbers of EGFR gene in patients with head and neck squamous cell carcinomas. Neoplasma 2005; 52(4): 338-343.
9. Mrhalová M, Kodet R, Strnad P. Korelace exprese c-erbB-2 genu (detekce metodou FISH) s membránovou expresí erbB-2 proteinu (detekce metodou IHC) u pacientek s karcinomy mléčné žlázy. Cas Lek Cesk 2001; 140(18): 553-559.
10. Mrhalová M, Kodet R. Indikace k léčbě nemocných s invazivními duktálními karcinomy mléčné žlázy Herceptinem z pohledu laboratorní diagnostiky - vyšetření ERBB-2 proteinu a stanovení počtu kopií ERBB2 genu. Přehled problematiky. Cesk Patol 2002; 38 Suppl 1 : 4-14.
11. Mrhalová M, Kodet R. A modified approach for I-FISH evaluation of ERBB2 (HER-2) gene copy numbers in breast carcinomas: comparison with HER-2/CEP17 ratio system. J Cancer Res Clin Oncol 2007; 133(5): 321-329.
12. Eckschlager T, McClain K. Comparison of fluorescent in situ hybridization (FISH) and the polymerase chain reaction (PCR) for detection of residual neuroblastoma cells. Neoplasma 1996; 43(5): 301-303.
13. Procházka P, Hraběta J, Vícha A, Eckschlager T. Expulsion of amplified MYCN from homogenously staining chromosomal regions in neuroblastoma cell lines after cultivation with cisplatin, doxorubicin, hydroxyurea, and vincristine. Cancer Genet Cytogenet 2010; 196(1): 96-104.
14. Mrhalová M, Kodet R, Kalinová M, Hilská I. Relative quantification of ERBB2 mRNA in invasive duct carcinoma of the breast: correlation with ERBB-2 protein expression and ERBB2 gene copy number. Pathol Res Pract 2003; 199(7): 453-461.
15. Kodet R, Mrhalová M, Krsková L, et al. Mantle cell lymphoma: improved diagnostics using a combined approach of immunohistochemistry and identification of t(11;14)(q13;q32) by polymerase chain reaction and fluorescence in situ hybridization. Virchows Arch 2003; 442(6): 538-547.
16. Mrhalová M, Krsková L, Kalinová M, Soukup J, Kodet R. Folikulární lymfomy: molekulární diagnostika t(14;18)(q32;q21) - fluorescenční in situ hybridizace, kvalitativní a kvantitativní PCR Cesk Patol 2003; 39(3): 130-137.
17. Soukup J, Krsková L, Mrhalová M, et al. Velkobuněčné difúzní B-lymfomy: heterogenní původ a prognóza z hlediska současné diagnostiky. Cas Lek Cesk 2003; 142(7): 417-422.
18. Kobayashi T, Tsutsumi Y, Sakamoto N, et al. Double-hit lymphomas constitute a highly aggressive subgroup in diffuse large B-cell lymphomas in the era of Rituximab. Jpn J Clin Oncol 2012; 42(11): 1035-1042.
19. Kodet R, Mrhalová M, Krsková L, Stejskalová E. Anaplastický velkobuněčný lymfom: přehled problematiky Cesk Patol 2003; 39(3): 102-114.
20. Kodet R, Mrhalová M, Stejskalová E, Kabíčková E. Burkitt lymphoma (BL): reclassification of 39 lymphomas diagnosed as BL or Burkitt-like lymphoma in the past based on immunohistochemistry and fluorescence in situ hybridization. Cesk Patol 2011; 47(3): 106-114.
21. Stejskalová E, Jarošová M, Kabíčková E, et al. Primary mediastinal (thymic) large B-cell lymphoma with a der(14)t(8;14)(q24;q32) and a translocation of MYC to the derivative chromosome 14 with a deleted IgH locus. Cancer Genet Cytogenet 2006; 170(2): 158-162.
Labels
Anatomical pathology Forensic medical examiner ToxicologyArticle was published in
Czecho-Slovak Pathology

2013 Issue 4
-
All articles in this issue
- Fluorescenční in situ hybridizace na histologických řezech
- Laserová mikrodisekce a její praktické aplikace
- Imunofenotypizace průtokovou cytometrií v patologii
- Minimální reziduální nemoc – možnosti detekce u hematologických i nehematologických malignit
- Jak v praxi zlepšit bioptickou diagnostiku benigních lézí jater (adenom versus fokální nodulární hyperplazie)
- Mucinózny adenokarcinóm (neintestinálneho typu) vzniknutý v zrelom cystickom teratóme vaječníka - kazuistika
- Eozinofilná dysplázia krčka maternice asociovaná s infekciou HPV 6 – kazuistika a prehľad literatúry
- Czecho-Slovak Pathology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Jak v praxi zlepšit bioptickou diagnostiku benigních lézí jater (adenom versus fokální nodulární hyperplazie)
- Imunofenotypizace průtokovou cytometrií v patologii
- Minimální reziduální nemoc – možnosti detekce u hematologických i nehematologických malignit
- Fluorescenční in situ hybridizace na histologických řezech
