Laserová mikrodisekce a její praktické aplikace
Laser capture microdissection and its practical applications
Laser capture microdissection is a relatively young method used both in biomedical sciences as in other studies of animal and vegetable tissues and cells. Current human medicine and its methods of investigation are based on both current established processes, and simultaneously there are new experimental approaches from molecular biology tested. In this context it is highly desirable that the studied tissue is homogenous and representative population of cells. For this purposes at the late 80’s the method of laser capture microdissection (LCM) has been developed, the first publication dealing with this method was released even in 1996. In current databases of literature we are able to find hundreds of papers focused on LCM such a method or as a part of methodic approach of experiments whose results led to the improved knowledge of genetic and proteomic nature of various diseases. This knowledge is of great promise for successful targeted therapy in the future.
Keywords:
laser capture microdissection – tissue – molecular biology applications
Authors:
Pavla Lužná; Jiří Ehrmann Jr.
Authors‘ workplace:
Ústav histologie a embryologie, Lékařská fakulta Univerzity Palackého v Olomouci
Published in:
Čes.-slov. Patol., 49, 2013, No. 4, p. 123-125
Category:
Review articles
Overview
Laserová záchytná mikrodisekce je poměrně mladá metoda využívaná jak v biomedicínských vědách, tak při studiu ostatních živočišných a rostlinných tkání a buněk. V kontextu nových experimentálních i diagnostických přístupů z oblasti molekulární biologie je žádoucí, aby studovaná tkáň byla homogenním a reprezentativním souborem buněk. Pro tyto účely byla proto již koncem osmdesátých let vyvíjena metoda laserové záchytné mikrodisekce (LCM), avšak první publikace o této metodě pojednává až roce 1996. V současných literárních databázích nacházíme stovky prací zaměřených na samotnou LCM či jako součást metodiky experimentů, jejichž závěry mají vést k lepšímu poznání genetické a proteomické podstaty nejrůznějších onemocnění. Toto poznání je příslibem úspěšné cílené terapie mnoha chorob v budoucnu.
Klíčová slova:
laserová mikrodisekce – tkáň – molekulárně-biologické aplikace
PRINCIPY LASEROVÉ ZÁCHYTNÉ MIKRODISEKCE (LCM)
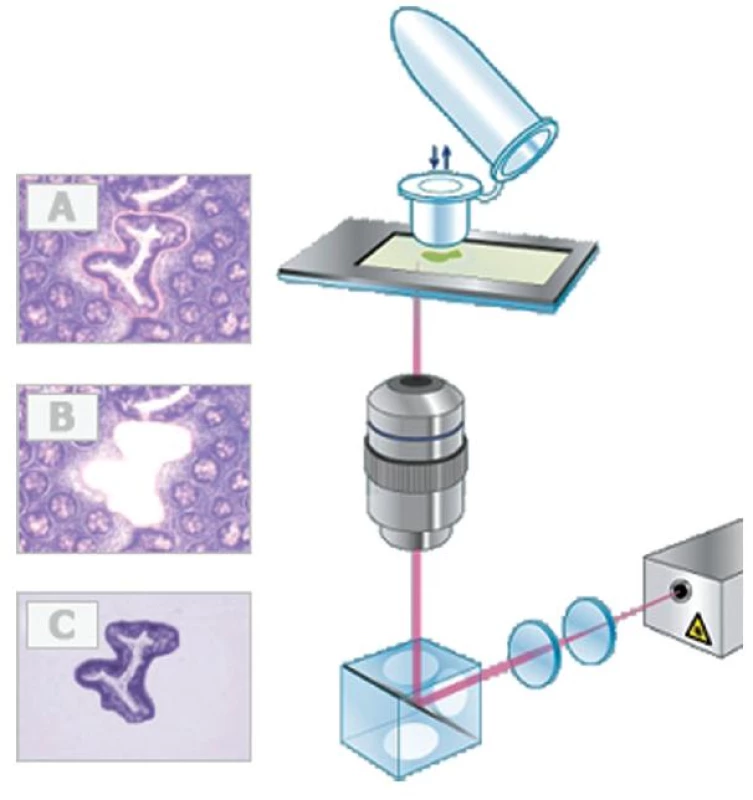
Laserová záchytná mikrodisekce (LCM, obvykle pouze laserová mikrodisekce) je stále využívanějším předstupněm molekulárně biologického studia tkání a buněk (1,2). Principem metody je „oddělení“ konkrétní buněčné populace (nádorové, geneticky transformované, stromální a jiné buňky) z tkáňových řezů, buněčných kultur, stěrů či cytospinů od tkáně nebo buněčné kultury podle přesného mikroskopického výběru. „Oddělení“ buněk probíhá pomocí cíleného laserového paprsku, který však s jejich obsahem nereaguje. Z buněk jsou následně izolovány nukleové kyseliny nebo proteiny, které jsou předmětem dalších analýz. Výběr buněk určených k mikrodisekci probíhá na základě přehledového či imunohistochemického barvení a jejich označením na monitoru počítače, který ukazuje reálný obraz tkáňového řezu nebo buněčné kultury pomocí digitální kamery.
Existují dva obecné způsoby mikrodisekce. Prvním možným způsobem získání žádaných buněk je adheze selektovaných buněk na termoplastickou membránu speciálního víčka (obr. 1) (3). Termoplastická membrána je v místě vybraných buněk aktivována nízkovýkonnostním infračerveným laserovým pulsem, a tím je k cílové buňce navázána. Membrána současně absorbuje téměř všechnu tepelnou energii laseru, proto buňky zůstávají nepoškozeny. Buňky jsou pak z víčka uvolněny do mikrozkumavky pomocí lyzačního pufru. Další způsob funguje na principu „vyřezání“ označených buněk laserovým paprskem a jejich mechanickému přichycení na speciálně upravené víčko mikrozkumavky (obr. 2) nebo zachycení do mikrozkumavky vlivem vlastní gravitace (http://www.leica-microsystems.com). Oba způsoby mikrodisekce jsou zcela bezkontaktní, což eliminuje možnost kontaminace.
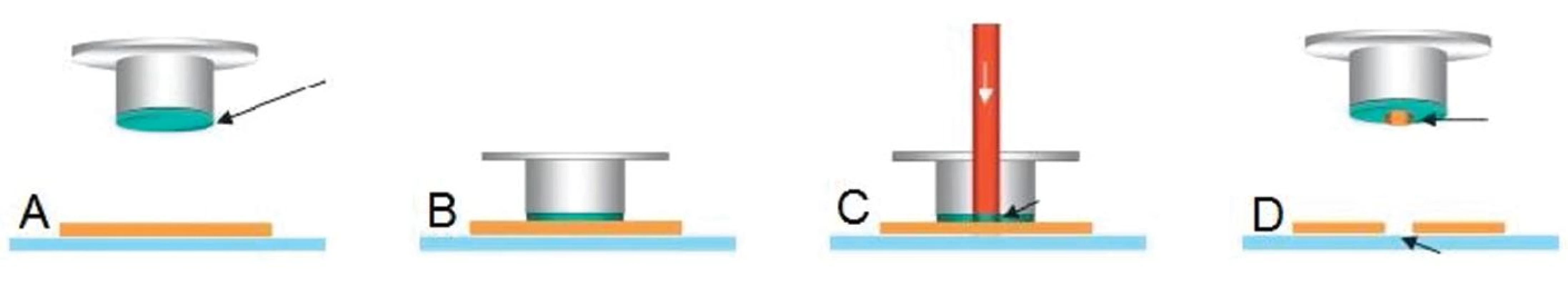
Koupě laserového mikrodisektoru je investičně náročná záležitost. Práce s LCM systémem vyžaduje vysokou přesnost, je nezbytné minimalizovat riziko kontaminace minimální frekvencí pohybu vzduchu i osob; vzorky určené pro LCM musí být zpracovávány s důrazem na další molekulárně-biologické aplikace. Neméně důležitým aspektem je zajištění nákladů na spotřební materiál a součinnost lékaře - obvykle patologa s pracovníkem, který samotnou LCM provádí.
Na LF UP v Olomouci pracujeme s laserovým mikrodisektorem společnosti MMI (typ mmi CellCut), který disponuje optikou Olympus. Tento typ mikrodisektoru je v podstatě invertovaný světelný mikroskop (s možností využití fluorescenčních filtrů) s elektronicky ovládaným polohovacím stolkem. Další součástí přístroje je zdroj vysoce pulzního nízkoenergetického UV laserového záření (lze ovládat rychlost a intenzitu laseru, zaostřit rovinu řezu), počítač s dotykovou obrazovkou ovladatelnou jak polohovacím zařízením, tak speciálním perem a ovládací software. K příslušenství patří speciální hliníkové rámečky (velikosti standardního podložního skla) potažené zcela inertní PET membránou, která nese histologický preparát a mikrozkumavky s adhezním víčkem.
Je na místě zmínit také další LCM přístroje. Jde o mikrodisektor Zeiss pracující na totožném principu jako mmi CellCut, dále přístroj firmy Leica (4), který pracuje obdobně, jen vybraná tkáň po vyřezání padá do rezervoáru (mikrozkumavky) vlivem vlastní gravitace. Další je přístroj Veritas firmy Arcturus, jehož základem je taktéž invertovaný mikroskop, disektor je navíc vybaven infračerveným laserem o nízkém výkonu, který by měl být nejvhodnějším nástrojem k mikrodisekci oblastí s malým počtem žádaných buněk včetně disekce jediné buňky. Vzorek tkáně určený k disekci přístrojem Veritas je nanesen na standardním podložním skle, sběr disekovaných buněk je pak uskutečněn pomocí víčka s termoplastickou membránou. Víčko je umístěno nad dehydratovaný preparát, přičemž zaostřený laserový paprsek aktivuje termoplastickou membránu, která se tím přichytí k označené cílové buňce v mikroskopovaném preparátu.
TKÁNĚ A BUŇKY VHODNÉ PRO LCM
Před vlastním prováděním mikrodisekce je nutné vědět, zda budou použity vzorky fixované ve formalínu a zalité do parafínu nebo čerstvá tkáň a přizpůsobit tomu pracovní podmínky. Čerstvá tkáň je vhodnějším materiálem, avšak ta je po odběru extrémně citlivá na podmínky skladování. Tkáň je nutné ihned po odběru zmrazit v mikrozkumavce nejlépe v tekutém dusíku (případně suchém ledu), nebo uložit na 24 hodin do speciálního roztoku, který stabilizuje nukleové kyseliny (zvláště RNA) a až následně vzorek zmrazit. V případě odběru čerstvé tkáně je důležitá spolupráce s odběrovým sálem, protože od správného zpracování vzorku se odvíjejí všechny další výsledky práce.
Tkáň zalitá do parafínu (FFPE) je vlivem procesů fixace a zalévání do značné míry poškozena, RNA i DNA jsou fragmentovány, proteiny jsou zesíťovány fixativem, což některé experimentální aplikace zcela znemožňuje. Stále ovšem existuje limitované množství molekulárně-biologických analýz, které na FFPE provádět lze. Navíc, FFPE bloky jsou na pracovištích patologie dlouhou dobu archivovány, což dovoluje pracovat s nimi retrospektivně. (Pozn. Laserová mikrodisekce umožňuje pracovat také např. s buňkami tkáňových kultur nebo s jednotlivými chromozomy. Jedná se o techniky vysoce pokročilé, v praxi zatím mnohem méně aplikované.)
POSTUP PŘI LASEROVÉ MIKRODISEKCI
Po navržení experimentálního plánu následuje období optimalizace celého pracovního procesu, což dle vlastních zkušeností trvá týdny až měsíce. Je-li z disekovaných buněk izolována RNA, musí tomu být od začátku přizpůsobeny pracovní podmínky (5). RNA je vysoce citlivá na degradaci, je třeba neustále pracovat v rukavicích, v “RNAse free” podmínkách, včetně všech roztoků a laboratorního skla a plastiku. Plastový spotřební materiál lze již zakoupit jako “RNAse free”, nástroje a sklo je nutno obalit aluminiovou fólií a minimálně na 6 hodin uložit do sušárny na 240°C, samotné autoklávování je naprosto nedostačující.
Prvním krokem vlastní práce je příprava řezů na mikrotomu. Tloušťku řezu je nutno experimentálně optimalizovat neboť laserový paprsek má limitující schopnost průniku vrstvou tkáně. Je vhodné pracovat s řezy silnějšími než 3 μm, poněvadž pokud je vzorek chudý na žádané buňky, výtěžky nukleových kyselin nebo proteinů jsou malé a pro molekulárně-biologické aplikace často nedostačující. Jedinou výhodou slabších řezů jsou lépe rozpoznatelné struktury v mikroskopu a lepší přilnavost k PET membráně hliníkového rámečku nebo k podložnímu sklu. Proto je nutné vybalancovat optimální tloušťku řezu, která poskytne dostatečné množství materiálu, umožní rozpoznat žádané struktury a která půjde vyřezat laserem nebo bude spolehlivě adherovat k termoplastické membráně. Záleží též na druhu použité tkáně, na schopnosti její adheze na PET membránu a odolnosti při procesu barvení a oplachování. V tomto ohledu je značně komplikované pracovat s některými tkáněmi (např. s nervovou nebo kůží), kdy během barvení velice často dochází k jejich odloučení z podložního skla nebo PET membrány. Pro zvýšení adheze vzorku k PET membráně (systém Olympus, Zeiss, Leica) nebo podložnímu sklu (systém Veritas) je proto možné před samotným nanesením tkáně tyto ozářit UV světlem nebo ošetřit poly-L-lysinem.
Po nanesení tkáňového řezu na membránu či sklo (obvykle více řezů podle velikosti) následuje zaschnutí, barvení a vlastní mikrodisekce. Barvení se provádí nejčastěji hematoxylinem (eozin není vhodný – poškozuje nukleové kyseliny), používá se i kresylová violeť, methylzeleň nebo fluorescenční barviva, vzorek se dá též značit imunohistochemicky. V případě tkáně zalité do parafínu je na začátku nutná její deparafinizace xylenem, hydratace sestupnou řadou alkoholů, rychlý oplach vodou, samotné barvení trvající několik vteřin, oplach, dehydratace a projasnění (připomínáme nutnost použití veškerých vodných roztoků s “RNAse free” H2O v případě izolace RNA). Po skončení barvení je preparát vložen do nádoby se silikagelem a dokonale vysušen. Přestože barvení tkáně probíhá několik vteřin, po zaschnutí je vzorek obvykle tmavý (zvláště, pokud je silnější) a mnohé struktury jsou špatně rozpoznatelné. Je proto vhodné připravit paralelní řez tkáně obarvený HE a detailně prostudovat jeho strukturu.
Vlastní proces mikrodisekce trvá různě dlouho, především podle toho, kolik struktur je nutné mikrodisekovat, resp. kolik jich je potřeba pro izolaci dostatečného množství nukleových kyselin nebo proteinů. Obvykle jde řádově o hodiny. Přístroj mmi CellCut, Zeiss i Leica umožňují práci na krátkou dobu přerušit. Po dokončení disekce je však doporučeno ihned buňky dále zpracovat, či alespoň převrstvit lyzačním pufrem a uskladnit v hlubokomrazicím boxu.
Způsob dalšího nakládání se vzorkem určuje výběr následné molekulárně biologické aplikace. K izolaci proteinů a nukleových kyselin je zapotřebí speciálních komerčních kitů, které existují i pro FFPE tkáň. Pokud jsou molekulárně biologické aplikace (nejčastěji PCR) limitovány nízkými výtěžky RNA nebo DNA, lze použít tzv. preamplifikační kity, pomocí kterých se před vlastní detekcí „předmnoží“ produkt PCR reakce, což výrazně zvýší úspěšnost jeho detekce (5,6).
PRAKTICKÉ APLIKACE LCM VE VÝZKUMU A DIAGNOSTICE
Co se týče praktických aplikací laserové mikrodisekce, nejčastěji se z disekovaných buněk izolují nukleové kyseliny a proteiny. Izoláty RNA a DNA jsou následně využity pro detekci genové exprese na úrovni klasické nebo kvantitativní PCR, proteiny pak pro sekvenaci a studium posttranslačních modifikací (7,8). Provádějí se též alelotypizace u onemocnění, kde dochází ke ztrátě heterozygozity (9,10).
Posledních několik let dochází k výraznému zdokonalování techniky izolace RNA z FFPE tkáně. Je to především díky výzkumu v oblasti krátkořetězcových RNA – mikroRNA (miRNA), které díky své velikosti (cca 20 nukleotidů) významně ovlivňují genovou expresi (11,12). I přes poměrně drastické zpracování tkáně do FFPE bloku zůstávají tyto miRNA zachovány a jsou plně detekovatelné i po dlouhodobém skladování bloků (13). Současná molekulární biologie míří k využívání detekce exprese miRNA v mikrodisekovaných vzorcích jako markerů především nádorových onemocnění (14). Naše pracoviště publikovalo práci zabývající se detekcí miRNA u Barrettova jícnu (5), kolegové na Ústavu klinické a molekulární patologie popisovali genovou expresi buněk duktálního karcinomu prsu (15), publikovány byly například práce o karcinomu prostaty nebo genové expresi v testes (16,17). U nativní tkáně se možnost detekce genové exprese rozšiřuje, RNA není ve vzorcích fragmentována a je často předmětem mikročipových analýz (15,18,19).
ZÁVĚR
Laserová mikrodisekce je už poměrně zavedenou, avšak stále se zdokonalující a rozvíjející metodou separace homogenní populace buněk, následovanou popisem jejího genomu či proteomu. Umožňuje analýzu buněk vybraných na podkladě totožné morfologie nebo antigenicity, čímž nedochází ke zkreslení výsledků způsobenému přítomností buněk, které nejsou předmětem zájmu.
Adresa pro korespondenci:
prof. MUDr. Jiří Ehrmann, Jr., Ph.D.
Ústav histologie a embryologie, LF UP v Olomouci,
Hněvotínská 3, 779 00 Olomouc
e-mail: jiri.ehrmann@hotmail.com
Sources
1. Emmert-Buck MR, Bonner RF, Smith PD, et al. Laser capture microdissection. Science 1996; 274(5289): 998-1001.
2. Webb T. Laser capture microdissection comes into mainstream use. J Natl Cancer Inst 2000; 92(21): 1710-1711.
3. Fend F, Raffeld M. Laser capture microdissection in pathology. J Clin Pathol 2000; 53(9): 666-672.
4. Ossi J, Lee A, Zhou J. Leica AS LMD – The Latest Advance in Laser Microdissection. Scientific and Technical Information 2005; CDR 8 : 114–122.
5. Lužná P, Gregar J, Überall I, Radová L, Procházka V, Ehrmann J jr. Changes of microRNAs-192, 196a and 203 correlate with Barrett’s esophagus diagnosis and its progression compared to normal healthy individuals. Diagn Pathol 2011; 6 : 114.
6. Noutsias M, Rohde M, Block A, et al. Preamplification techniques for real-time RT-PCR analyses of endomyocardial biopsies. BMC Mol Biol 2008; 9 : 3.
7. Domazet B, MacLennan GT, Lopez-Beltran A, Montironi R, Cheng L. Laser capture microdissection in the genomic and proteomic era: targeting the genetic basis of cancer. Int J Clin Exp Pathol 2008; 1(6): 475-488.
8. Xu Y, Cao LQ, Jin LY, et al. Quantitative proteomic study of human lung squamous carcinoma and normal bronchial epithelial acquired by laser capture microdissection. J Biomed Biotechnol 2012; 2012 : 510418.
9. Lieberfarb ME, Lin M, Lechpammer M, et al. Genome-wide Loss of Heterozygosity Analysis from Laser Capture Microdissected Prostate Cancer Using Single Nucleotide Polymorphic Allele (SNP) Arrays and a Novel Bioinformatics Platform dChipSNP1,2. Cancer Research 2003; 63 : 4781–4785.
10. Di Cristofano C, Mrad K, Zavaglia K, et al. Papillary lesions of the breast: a molecular progression? Breast Cancer Res Treat 2005; 90(1): 71-76.
11. Nelson P, Kiriakidou M, Sharma A, Maniataki E, Mourelatos Z. The microRNA world: small is mighty. Trends Biochem Sci 2003; 28(10): 534-540.
12. Griffiths-Jones S, Grocock RJ, van Dongen S, Bateman A, Enright AJ. miRBase: microRNA sequences, targets and gene nomenclature. Nucleic Acids Res 2006; 34(Database issue): D140-144.
13. Siebolts U, Varnholt H, Drebber U, et al. Tissues from routine pathology archives are suitable for microRNA analyses by quantitative PCR. J Clin Pathol 2009; 62(1): 84-88.
14. Mirnezami AH, Pickard K, Zhang L, Primrose JN, Packham G. MicroRNAs: key players in carcinogenesis and novel therapeutic targets. Eur J Surg Oncol 2009; 35(4): 339-347.
15. Turashvili G, Bouchal J, Baumforth K, et al. Novel markers for differentiation of lobular and ductal invasive breast carcinomas by laser microdissection and microarray analysis. BMC Cancer 2007; 7 : 55.
16. Nonn L, Vaishnav A, Gallagher L, Gann PH. mRNA and micro-RNA expression analysis in laser-capture microdissected prostate biopsies: valuable tool for risk assessment and prevention trials. Exp Mol Pathol 2010, 88(1): 45-51.
17. Sluka P, O’Donnell L, McLachlan RI, Stanton PG. Application of laser-capture microdissection to analysis of gene expression in the testis. Prog Histochem Cytochem 2008; 42(4): 173-201.
18. Zhu G, Reynolds L, Crnogorac-Jurcevic T et al. Combination of microdissection and microarray analysis to identify gene expression changes between differentially located tumour cells in breast cancer. Oncogene 2003; 22(24): 3742-3748.
19. Noppert SJ, Eder S, Rudnicki M. Laser-capture microdissection of renal tubule cells and linear amplification of RNA for microarray profiling and real-time PCR. Methods Mol Biol 2011; 755 : 257-266.
Labels
Anatomical pathology Forensic medical examiner ToxicologyArticle was published in
Czecho-Slovak Pathology

2013 Issue 4
-
All articles in this issue
- Fluorescenční in situ hybridizace na histologických řezech
- Laserová mikrodisekce a její praktické aplikace
- Imunofenotypizace průtokovou cytometrií v patologii
- Minimální reziduální nemoc – možnosti detekce u hematologických i nehematologických malignit
- Jak v praxi zlepšit bioptickou diagnostiku benigních lézí jater (adenom versus fokální nodulární hyperplazie)
- Mucinózny adenokarcinóm (neintestinálneho typu) vzniknutý v zrelom cystickom teratóme vaječníka - kazuistika
- Eozinofilná dysplázia krčka maternice asociovaná s infekciou HPV 6 – kazuistika a prehľad literatúry
- Czecho-Slovak Pathology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Jak v praxi zlepšit bioptickou diagnostiku benigních lézí jater (adenom versus fokální nodulární hyperplazie)
- Imunofenotypizace průtokovou cytometrií v patologii
- Minimální reziduální nemoc – možnosti detekce u hematologických i nehematologických malignit
- Fluorescenční in situ hybridizace na histologických řezech
