Využití imunohistochemie v patologii prostaty
Immunohistochemistry in prostate pathology
The diagnosis of prostatic adenocarcinoma is based on a combination of histological features, none of which is absolutely sensitive and specific. Immunohistochemical examination is therefore sometimes necessary in difficult cases for confirmation of the diagnosis and distinction of mimickers. The second major indication of immunohistochemical staining in prostatic pathology is metastatic prostatic adenocarcinoma.
Keywords:
immunohistochemistry – prostate – NKX3.1 – PSA – seminal vesicles
Authors:
Kristýna Pivovarčíková; Ondřej Hes
Authors‘ workplace:
Šiklův ústav patologie LF UK a FN Plzeň
Published in:
Čes.-slov. Patol., 56, 2020, No. 3, p. 161-167
Category:
Reviews Article
Overview
Diagnóza prostatického adenokarcinomu se opírá o kombinaci histologických znaků, z nichž žádný není pro prostatický adenokarcinom absolutně sensitivní a specifický. Pomoc imunohistochemických barvení je proto potřeba v některých komplikovaných případech k potvrzení diagnózy prostatického adenokarcinomu a jeho odlišení od lézí jej napodobujících. Druhou hlavní indikací k použití imunohistochemie v rámci prostatické patologie je metastatický proces, tedy dotypování origa metastatického nádoru právě z prostaty.
Klíčová slova:
imunohistochemie – NKX3.1 – prostata – PSA – semenné váčky
V rámci patologie prostaty toho imunohistochemie v posledních letech příliš nového nepřinesla. Není ale na škodu si připomenout již známé a osvěžit si v rutinní diagnostice ne zrovna často používané poznatky. Imunohistochemie je při vyšetřování prostaty využívána v různých indikacích, nejčastěji k potvrzení diagnózy karcinomu prostaty a k odlišení prostatického karcinomu od lézí jej napodobujících. I když imunohistochemie má v této indikaci rozhodně své opodstatnění a místo, při diagnostice by stále měl zůstávat hlavní důraz na morfologii léze, imunohistochemie je pouze pomocný diagnostický nástroj a tak by k ní mělo být i přistupováno. V rámci metastatického onemocnění je pak imunohistochemie neodmyslitelným pomocníkem k dotypovávání origa metastatického procesu právě z prostaty.
IMUNOHISTOCHEMICKÉ MARKERY PROSTATICKÉHO ORIGA
PSA je základní a tradiční imunohistochemický marker prostatické diferenciace, který je sice považován za velmi specifický pro prostatu a její nádory, zároveň je však znám i pro svou sníženou expresi (či i kompletní ztrátu) ve špatně diferencovaném a metastatickém prostatickém adenokarcinomu. Existuje celá řada prací popisujících pozitivitu PSA i v různých jiných nádorech a nenádorových tkáních (1-3). Recentní práce zkoumající expresi monoklonální protilátky PSA na velkém souboru různých nádorových i nenádorových tkání prokázala jeho vysokou specificitu (99,9 %) a sensitivitu (99,7 %) pro prostatický adenokarcinom (4). V praxi však bývají výsledky této protilátky lehce méně optimistické. Navíc, častěji užívaná polyklonální protilátka je známa svou nižší specificitou oproti protilátce monoklonální, za to vyšší sensitivitou (hlavně v rámci high-grade adenokarcinomu prostaty, kde však též nedosahuje potřebných hodnot) (5). V rámci metastáz prostatického adenokarcinomu si PSA sice drží svou excelentní specificitu, jeho sensitiva je však poněkud nižší, udávaná v širokém rozmezí v různých pracích (50-97 % (6-9)). Též známý je fakt, že exprese PSA v nádoru může být u pacientů po hormonální léčbě variabilní (10,11).
Prostein (P501S) je též považován za marker vysoce specifický pro prostatické origo (exprimován nádorovou i nenádorovou tkání (12)), reaguje cytoplazmaticky perinukleárně (tzv. Golgiho typ cytoplazmatického barvení). V rámci užití prosteinu při diagnostice metastáz adenokarcinomu prostaty je udávána sensitivita obdobná, či často dokonce i vyšší než u PSA, ale i v rámci tohoto markeru je v různých publikacích udáváno široké rozmezí sensitivity (59–99 % (8,9)). Stejně jako u PSA i u prosteinu exprese barvení klesá v případech špatně diferencovaného prostatického adenokarcinomu (13). Velmi často se různé práce shodují na výhodách užití obou markerů (PSA i prosteinu) současně (9,13).
Prostatický specifický membránový antigen (PSMA) je, dá se říct, překonaná protilátka prostatického origa. Barvení může být cytoplazmatické, apikální, apikální a cytoplasmatické, či cytoplazmatické s akcentací na membráně buněk (14). Imunoreaktivita PSMA byla zaznamenána v menším procentu primárních adenokarcinomů prostaty než v případě již dříve zmiňovaných markerů (sensitivita se pohybuje většinou okolo 60 % (14,15)). Na rozdíl od PSA a prosteinu je však PSMA s vyšší frekvencí exprimován u karcinomů s vyšším Gleasonovým gradem (15). Proto i PSMA bylo často v různých publikacích zkoušeno jako prediktor rekurence a progrese prostatického karcinomu (16). Kromě nižší sensitivity PSMA byla prokázána i jeho nižší specificita – pozitivita byla zastižena jak v některých benigních lézích napodobujících prostatický adenokarcinom (17) tak i v množství nenádorových tkání a v nádorech jiného původu (14,18,19).
Prostatická kyselá fosfatáza (PAP/PAPH/PSAP/PASP) je další vysoce sensitivní a specifický marker prostatického origa, kde pozitivitu vykazuje nádorová i nenádorová prostatická tkáň (20). Stejně jako u jiných protilátek, specificita PAPH není absolutní a byla popsána pozitivita PAPH i v nádorech a nenádorových tkáních jiných než prostatických (3,20-24). PAPH je též známo inverzní pozitivitou ve vztahu ke zvyšujícímu se Gleasonovu gradu, tedy sníženou expresí u high-grade adenokarcinomu (25,26). V rámci detekce metastáz prostatického origa je tak i sensitivita PAPH horší (okolo 66 % (8)). I tak byl tento marker společně s PSA historicky považován za velmi sensitivní a specifický pro prostatické origo.
Protože cytoplazmatická pozitivita PSA je hůře hodnotitelná než pozitivita jaderná, je v současné době s výhodou využívám nový prostatický imunohistochemický marker s jadernou pozitivitou - NKX3.1. NKX3.1 (homeobox protein NKX3.1) je relativně vysoce specifický prostatický marker, který ale není absolutně specifický jen pro tkáň prostaty. O této problematice pojednával i monitor posledního čísla Československé patologie (2/2020), tedy si jen zkráceně připomeňme, že pozitivita NKX3.1 byla prokázána u invazivního lobulárního karcinomu prsu, sex-cord stromálních nádorů varlete a ovaria (7), NKX3.1 je též pozitivní ve slinných žlázkách a submukózních peribronchiálních žlázkách. Sensitivita barvení při detekci metastatického prostatického karcinomu je však patrně vyšší než u PSA (u NKX3.1 se pohybuje mezi 98,6-100 % (7, 8)) a specificita barvení je též velmi vysoká (99,7 %) (7). Zároveň NKX3.1 ukázalo i velmi dobré výsledky při barvení dekalcifikované tkáně (27). NKX3.1 se tak jeví jako velmi slibný marker prostatického origa.
HOXB13 (homeobox protein Hox-B13) je též novější slibný marker prostatického origa. Barvení vykazuje jadernou pozitivitu jak v benigních prostatických luminálních epiteliích tak v buňkách prostatického karcinomu. HOXB13 je považován za imunohistochemický marker prostatického origa s vysokou specificitou a sensitivitou (specificita 100 %, sensitivita 89 %) (28). V rámci metastatického onemocnění byla prokázána sensitivita 60-93 % (8,29). Hůře si však marker vedl u metastáz prostatického adenokarcinomu do kostí, kde sensitivita byla jen 33 % (29), což si autoři studie vysvětlují proběhlým dekalcifikačním procesem, neboť limitované množství případů metastáz do kostí, které procesem odvápnění neprošly, vykazovalo 100 % sensitivitu tohoto barvení (30).
Hledáme-li tak nejvhodnější marker či jejich kombinaci k dotypování origa metastatického procesu právě v prostatě, lze na základě našich zkušeností a zkušeností jiných autorů doporučit kombinaci PSA a NKX3.1. Kombinace těchto dvou markerů má podle literatury 100 % sensitivitu v detekci metastatického prostatického adenokarcinomu (8,31).
IMUNOHISTOCHEMICKÁ BARVENÍ VYUŽÍVANÁ K DETEKCI/POTVRZENÍ DIAGNÓZY PROSTATICKÉHO ADENOKARCINOMU
V roce 1989 byla publikována práce upozorňující na využití markerů bazálních buněk, jako pomocného nástroje při diagnostice karcinomu prostaty (32), výrazný mezník v moderní diagnostice prostatického karcinomu. Dnes už si jen těžko dokážeme představit prostatickou patologii bez této imunohistochemie. Silně zjednodušeně lze celou situaci shrnout do jedné věty - přítomnost bazálních buněk mluví silně proti diagnóze invazivního prostatického adenokarcinomu, na stranu druhou absence barvení bazálními markery sama o sobě zcela nevylučuje benigní diagnózu (33). Imunohistochemie tak má v diagnostice adenokarcinomu prostaty své opodstatnění. Práce autorů Al Diffalha a kol. prokázala, že užití imunohistochemie (34bE12/K-903, p63, AMACR) vyřešilo diagnostickou nejistotu až v 75 % případů s okrsky s atypických žlázek. Na stranu druhou, časté užití imunohistochemie dle autorů nevedlo k poklesu stanovení diagnózy ASAP (atypical small acinar proliferation). Práce zároveň ukázala, že patologové ve vyšší míře využívající imunohistochemii mají sice ve svých diagnózách vyšší frekvenci prostatického adenokarcinomu, ale současně též právě i vyšší frekvenci diagnózy ASAP (34). I zde tak jasně platí zlaté pravidlo – všeho s mírou. Užití imunohistochemie u případů jasných adenokarcinomů nebo případů s jednoznačně benigní morfologií nemá opodstatnění.
V rámci rutinní diagnostiky adenokarcinomu se tak používají bazální markery, ke kterým patří vysokomolekulární cytokeratiny (nejčastěji 34ßE12/K-903 – cytoplazmatický marker) a p63 (nukleární pozitivita), současně se tyto kombinují s tzv. s prostatickým karcinomem asociovaným markerem, alpha-methylacylcoenzymem A (CoA) racemasou (AMACR, též označováno jako P504S – barvení exprimováno v maligních žlázkách cytoplazmaticky), většinou ve formě koktejlů. V minulosti byly v literatuře popisovány i jiné markery bazálních buněk (např. CK5/6 (35), p40 (36), D2.40(37)). Tato barvení dosahovala sensitivity obdobné jako konvenčně užívané markery (34ßE12/K-903, p63) a nepřinášela oproti nim žádné výraznější výhody, v rutinním užití se tak neujala.
Základním pravidlem při diagnostice adenokarcinomu prostaty a hodnocení imunohistochemie je vždy klást důraz především na vlastní morfologii léze. Celkem logicky, u diagnóz vyznačujících se ztrátou barvení (ztráta exprese myoepiteliálních markerů) by se nikdy nemělo zapomínat na současné hodnocení vnitřní a vnější kontroly (38). Pro správné vyhodnocení případu je též důležité mít základní znalost o specifických situacích. Existuje skupina primárních prostatických adenokarcinomů, které jsou p63 pozitivní – tzv. prostatický adenokarcinom s aberantní expresí p63. Jedná se sice o extrémně raritní typ adenokarcinomu, který typicky exprimuje p63, avšak v „non-bazální“ distribuci (39). Dále, absence bazálních markerů není pro prostatický adenokarcinom absolutně specifická. Negativita barvení bazálních markerů byla popsána u signifikantního množství případů benigních prostatických žlázek (19 % (40)). Ani pozitivita AMACR nemusí nevyhnutelně znamenat přítomnost karcinomu. Beach a kol. prokázali pozitivitu AMACR fokálně až u 21 % benigních prostat, téměř vždy však fokálně, slabě a necirkulárně(41) a existuje i řada jiných prací, které došli k podobným závěrům (33). Stejně tak negativita tohoto barvení přítomnost adenokarcinomu nevylučuje (až 18 % případů prostatického adenokarcinomu je AMACR negativních (41)). Ani klasický „nádorový“ imunoprofil léze (absence bazálních markerů a pozitivita AMACR) není 100 % zárukou, že se patolog dívá na prostatický adenokarcinom (viz níže).
NA CO SI DÁT POZOR
Semenné váčky
Chronicky známý diagnostický pitfall v rámci prostatické patologie jsou semenné váčky (obr. 1). Jejich sekreční (kolumnární) buňky můžou vykazovat výraznou pleomorfii, hyperchromazie, nukleocytoplazmatický posun, pseudoinkluze, vícejadernost – známky budící suspekci z diagnózy karcinomu. Intracytoplazmatický jemný žlutavo-zlatý pigment odpovídající lipofuscinu, nacházející se právě v epitelu semenných váčků a ductus ejaculatorius je jejich hlavním diagnostickým znakem. Pigment však může být též vzácně přítomen v benigních i maligních prostatických žlázkách (42), což situaci lehce ztěžuje. I přes to je při hodnocení hlavním diagnostickým znakem právě morfologie společně se zlatavým pigmentem. Pokud se přeci jen uchýlíme k imunohistochemii, je dobré vědět, že semenné váčky jsou většinou negativní v imunohistochemickém průkazu PSA (při barvení monoklonální protilátkou (5)), při užití 34ßE12/K-903 se v semenných váčkách dočkáme pozitivity bazálních buněk, AMACR je negativní (41). Při hodnocení je však třeba obezřetnost – přítomný pigment může při interpretaci imunohistochemie interferovat s barvením. Nápomocným markerem by tak spíše než markery prostatické mohlo být např. barvení protilátkou PAX8, která je pozitivní v epitelu semenných váčků (43) a naopak negativní v prostatické tkáni (s výjimkou ojedinělých prostatických žlázek centrální zóny (44)). O reaktivitě NKX3.1 v epitelu semenných váčků nemá současná literatura dostatek poznatků.
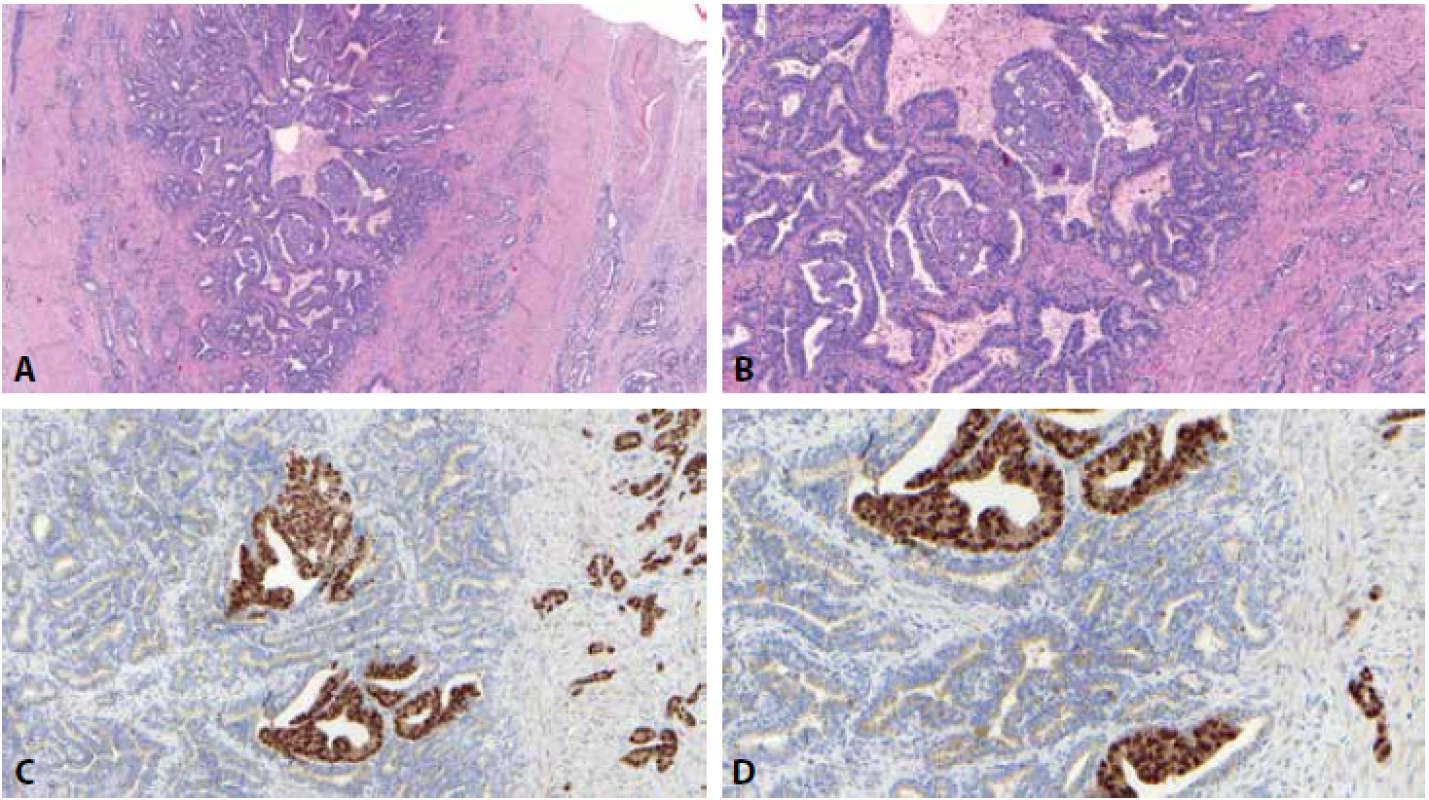
Nefrogenní adenom (NA)
S nefrogenním adenomem se můžeme setkat prakticky v celém vývodném močovém traktu a stejně tak i v prostatě (resp. prostatické části uretry), kde pokud na diagnózu NA není aktivně pomýšleno, právě a zejména při užití imunohistochemie můžeme dojít k zcela nesprávné diagnóze a poškození pacienta (obr. 2).
Jak už bylo dopodrobna popsáno v přehledovém imunohistochemickém článku lézí vývodného močového traktu (45), NA je pozitivní v CK7, AMACR, PAX8, PAX2, CD10, EMA a vimentinu, významná část NA je též GATA3 pozitivní. Naopak p63 je v NA negativní a stejně tak bývá většinou negativní i 34ßE12/K-903 (46). Čtenáři tak jistě neuniklo, že léze morfologicky (mimo jiné) vytvářející tubulární struktury, které jsou difúzně pozitivní v racemáze/AMACR a naopak negativní v p63 a 34ßE12/K-903, které jsou posuzovány v rámci např. transuretrální resekce prostaty, lze relativně snadno zaměnit za prostatický adenokarcinom. Základem pro správnou diagnózu je tak především pomyslet na možnost NA prostatické uretry, k potvrzení diagnózy zcela postačí pozitivní průkaz PAX8. Prostatických markerů je lepší se v těchto případech spíše vyvarovat, neboť popsána byla pozitivita PSA a PAPH v 36 %, respektive 50 % nefrogenních adenomů (a to i při použití monoklonální protilátky proti PSA) (46).
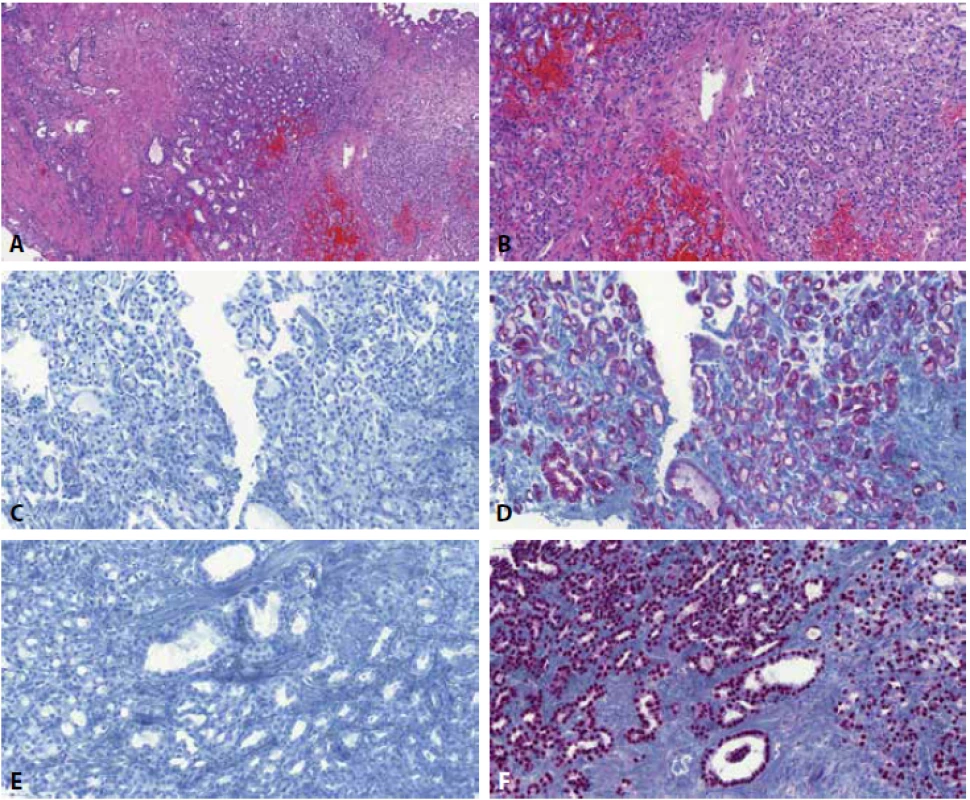
Cowperovy (bulbouretrální) žlázky
Cowperovy žlázky jsou normální anatomickou strukturou urogenitální diafragmy, raritně tak bývají součástí jehlové transrektální biopsie typicky z oblasti apexu prostaty (obr. 3). Histologicky představují těsně nahloučené glandulární struktury, připomínající mucinózní slinné žlázky (buňky s hojnou mucinózní cytoplazmou a jádrem při bazi). Pomocným znakem je současná přítomnost morfologicky odlišných exkrečním duktům podobných struktur a přítomnost příčně pruhované svaloviny v okolí žlázek. V rámci diferenciální diagnózy, Cowperovy žlazky mohou být zaměněny především za prostatický adenokarcinom, tzv. „foamy cell“ variantu. Využití imunohistochemie je otazné, neboť autoři různých prací prokázali zcela protichůdné výsledky barvení Cowperových žlazek prostatickými markery (47-49). Při podobnosti Cowperových žlázek žlázkám slinným asi též nikoho nepřekvapí jejich pozitivita v NKX3.1. Nezbývá tedy opět nic jiného, než klást důraz na morfologii.
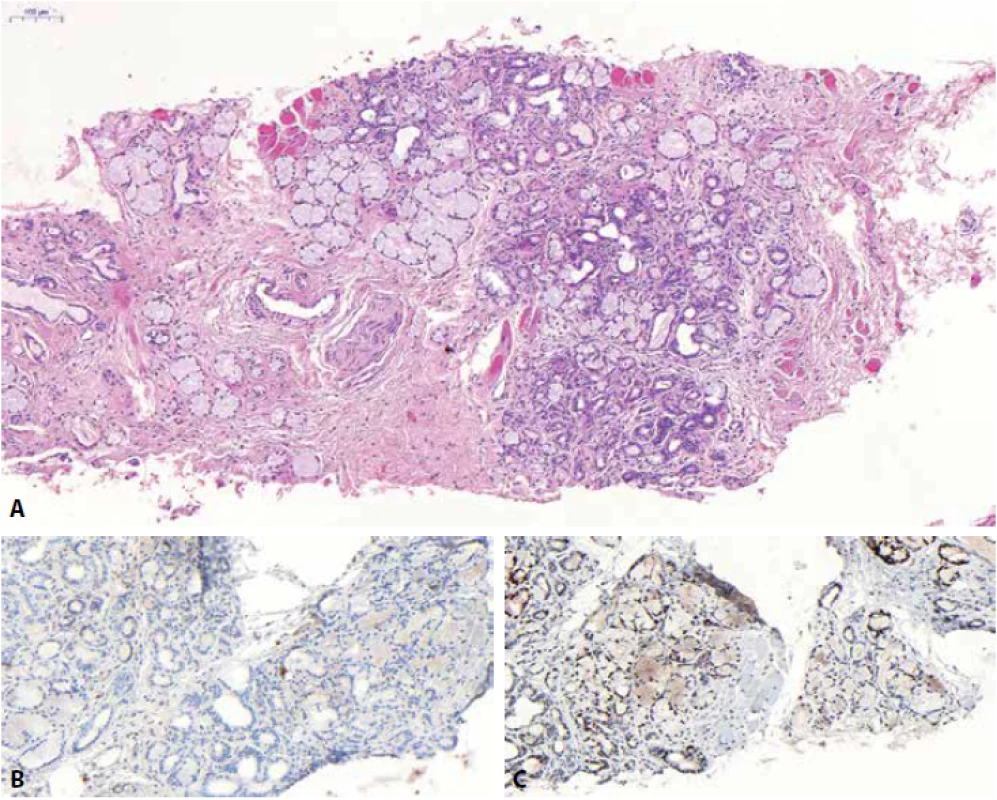
Mezonefrické zbytky
Mezonefrické zbytky jsou tubulární či acinární struktury lemované jednou řadou kubických buněk, vzácně se vyskytující v prostatě. Struktury intraluminálně obsahují charakteristický koloidu podobný PAS pozitivní materiál. Mezonefrické zbytky mohou zmást svojí schopností vyskytovat se perineurálně a extraprostaticky. Imunohistochemicky jsou PSA negativní, 34bE12/K-903 vykazuje většinou pozitivitu (50), PAX8 je pozitivní (51,52). V současné době nejsou dostupné práce popisující imunohistochemickou reaktivitu hyperplázie mezonefrických zbytků v prostatě s markerem dobře známým z mezonefrických zbytků ženského genitálního traktu – GATA3, tento tak k potvrzení diagnózy nelze doporučit.
Atrofie
Prostatická atrofie je relativně častý jev, cytologicky s relativně monomorfním vzhledem (malé buňky s vysokým nukleocytoplazmatickým posunem, bez jaderných iregularit, s tmavým jádrem, bez prominentních jadérek) a architektonickým spektrem (lobulární vzhled, sklerotické malé nepravidelné žlázky, cystický vzhled, či spíše lineární/“streaming“ pattern) (50). Autoři na základě morfologie nejčastěji rozlišují 4 druhy atrofie – prostá, prostá s formací cyst, postatrofická hyperplázie a parciální atrofie. Diferenciálně diagnosticky je důležité odlišit atrofii od prostatického adenokarcinomu (atrofická varianta), u kterého v základním imunohistochemickém panelu na rozdíl od atrofie ideálně prokážeme ztrátu barvení bazálních markerů a většinou současnou pozitivitu nádorových žlázek v racemáze/AMACR. Realita se však od ideálních případů často liší. Je známo, že až 30 % případů atrofických adenokarcinomů je AMACR negativních. Herawi a kol. též prokázali až u 13 % případů benigních atrofických žlázek kompletní absenci bazálních markerů (40). Atrofické žlázky mohou též být v malém procentu AMACR pozitivní (většinou však slabě a necirkulárně (41)), v případech parciální atrofie byla dokonce popsána pozitivita AMACR až u 79 % případů (40).
Atypická adenomatózní hyperplázie
Atypická adenomatózní hyperplázie (též nazývaná adenóza) je proliferace malých na těsno (“back to back”) nahloučených žlázek, většinou vytvářející dobře ohraničený nodulus, buňky léze však většinou postrádají cytologické znaky adenokarcinomu (nenápadná jadérka mohou být přítomna, jsou však menší než u adenokarcinomu (53)). AMACR může být u těchto lézích pozitivní (41,54) a léze většinou exprimuje markery bazálních buněk (p63, 34ßE12/K-903), zároveň však často vykazuje jejich nesouvislou bazální vrstvu (53) a někdy i jejich kompletní absenci.
Uroteliální karcinom versus prostatický adenokarcinom
Problematika překryvné morfologie u high-grade prostatického adenokarcinomu a uroteliálního karcinomu byla též nastíněna již v imunohistochemickém review lézí vývodného močového traktu (45). Ve zkratce – diagnóza prostatického adenokarcinomu by měla být vždy alespoň okrajově zvážena, pokud vyšetřujeme high-grade karcinom z transuretrální resekce močového měchýře (nejčastěji hrdla, není však pravidlem), u kterého je zastižen infiltrující karcinom bez jasně vyjádřených papilárních struktur typických pro uroteliální karcinom, či uroteliální karcinoma in situ. V literatuře však je jasně zaznamenáno, že i high-grade prostatický adenokarcinom dokáže vytvořit papilární/pseudopapilární struktury (55). Proto ve všech ne zcela jednoznačných případech doporučujeme dovyšetření, nejlépe imunohistochemickým panelem - na našem pracovišti nejčastěji využíváme kombinaci CK7, CK20, GATA3 a NKX3.1 (bližší komentář v již dříve zmiňovaném článku).
Malobuněčný neuroendokrinní karcinom prostaty
Malobuněčný neuroendokrinní karcinom prostaty je morfologicky identický nádor jako výrazně častější plicní malobuněčný karcinom, je však o poznání vzácnější. Hlavním diagnostickým problémem většinou není stanovit samotnou diagnózu, ale rozhodnout, zdali se jedná o primární prostatický karcinom, či o per continuitatem šíření z močového měchýře nebo vzdálenou metastázu. Asi nejelegantnější je diagnóza primárního malobuněčného karcinomu prostaty v případech, kdy prokážeme koexistenci s klasickým prostatickým adenokarcinomem (popř. diagnóza malobuněčného neuroendokrinního karcinomu močového měchýře pokud tumor koexistuje uroteliálním karcinomem nebo uroteliálním CIS). Relativně často též malobuněčný karcinom prostaty vzniká dediferenciací z již dříve diagnostikovaného klasického prostatického karcinomu a malobuněčný karcinom pak můžeme najít i v rámci metastického karcinomu prostaty. Markery prostatického origa (PSA, PSMA, prostein, NKX3.1) jsou negativní zhruba u 60 % prostatických malobuněčných karcinomů (56). Exprese GATA3 je u malobuněčných karcinomů prostaty většinou negativní (na stranu druhou, jen u malé části malobuněčných karcinomů močového měchýře byla prokázána GATA3 pozitivita a stejně tak byla prokázána pozitivita i v malém množství plicních malobuněčných karcinomů) (57). TMPRSS2-ERF genová fúze je přítomna 45-67 % prostatických malobuněčných karcinomů (naopak u malobuněčných karcinomů non-prostatického origa, přicházejících v těchto případech nejčastěji v diferenciální diagnóze - tj. malobuněčný karcinom močového měchýře a plic, prokázána nebyla) (56,58-60). Průkaz genové fúze TMPRSS2-ERG (FISH) tak má potenciální využití v diferenciální diagnostice těchto lézí (58) (ačkoliv nepřítomnost této fúze prostatické origo nevylučuje (61)). Imunohistochemický průkaz ERG má menší sensitivitu a specificitu než FISH vyšetření (56).
Je však otázkou, na kolik se přesné dotypování origa malobuněčného karcinomu promítne do specifik vlastní onkologické léčby (61) a tedy zda má smysl za každou cenu geneticky vyšetřovat vzorek místo předání validní informace klinickým kolegům, kteří na podkladě dalších vyšetření origo s největší pravděpodobností stanoví.
ZÁVĚR
I přes velké množství nápomocných imunohistochemických markerů na dnešním trhu, patologie prostaty stále zůstává především morfologickou disciplínou a tím základní klasikou naší každodenní rutinní morfologické praxe. Věříme, že ač tento článek nepřináší nic nového, pomohl připomenout situace, na které je třeba při používání imunohistochemie vždy alespoň okrajově pomýšlet.
PODĚKOVÁNÍ
Podpořeno programem rozvoje vědních oborů Karlovy univerzity (Projekt Q39) a MZ ČR RVO (Fakultní nemocnice Plzeň – FNPl, 00669806).
PROHLÁŠENÍ
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
∗ Adresa pro korespondenci:
MUDr. Kristýna Pivovarčíková, Ph.D.
Šiklův ústav patologie LF UK a FN Plzeň
Alej Svobody 80, 30460 Plzeň
tel.: +420377404633
e-mail: pivovarcikovak@fnplzen.cz
Sources
1. Gatalica Z, Norris BA, Kovatich AJ. Immunohistochemical localization of prostate-specific antigen in ductal epithelium of male breast. Potential diagnostic pitfall in patients with gynecomastia. Appl Immunohistochem Mol Morphol 2000; 8(2): 158-161.
2. van Krieken JH. Prostate marker immunoreactivity in salivary gland neoplasms. A rare pitfall in immunohistochemistry. Am JSurg Pathol 1993; 17(4): 410-414.
3. Varma M, Jasani B. Diagnostic utility of immunohistochemistry in morphologically difficult prostate cancer: review of current literature. Histopathology 2005; 47(1):1-16.
4. Bonk S, Kluth M, Hube-Magg C, et al. Prognostic and diagnostic role of PSA immunohistochemistry: A tissue microarray study on 21,000 normal and cancerous tissues. Oncotarget 2019; 10(52): 5439-5453.
5. Varma M, Morgan M, Jasani B, Tamboli P, Amin MB. Polyclonal anti-PSA is more sensitive but less specific than monoclonal anti-PSA: Implications for diagnostic prostatic pathology. Am J Clin Pathol 2002; 118(2): 202-207.
6. Barresi V, Ieni A, Cardia R, et al. HOXB13 as an immunohistochemical marker of prostatic origin in metastatic tumors. APMIS 2016; 124(3): 188-193.
7. Gurel B, Ali TZ, Montgomery EA, et al. NKX3.1 as a marker of prostatic origin in metastatic tumors. Am J Surg Pathol 2010;34(8): 1097-1105.
8. Kristiansen I, Stephan C, Jung K, et al. Sensitivity of HOXB13 as a Diagnostic Immunohistochemical Marker of Prostatic Origin in Prostate Cancer Metastases: Comparison to PSA, Prostein, Androgen Receptor, ERG, NKX3.1, PSAP, and PSMA. Int J Mol Sci 2017;18(6): 1151.
9. Sheridan T, Herawi M, Epstein JI, Illei PB. The role of P501S and PSA in the diagnosis of metastatic adenocarcinoma of the prostate. Am J Surg Pathol 2007; 31(9):1351-1355.
10. Mai KT, Commons AS, Perkins DG, Yazdi HM, Collins JP. Absence of serum prostate-specific antigen and loss of tissue immunoreactive prostatic markers in advanced prostatic adenocarcinoma after hormonal therapy: a report of two cases. Hum Pathol 1996; 27(12): 1377-1381.
11. Shah RB, Mehra R, Chinnaiyan AM, et al. Androgen-independent prostate cancer is a heterogeneous group of diseases: lessons from a rapid autopsy program. Cancer Res 2004; 64(24): 9209-9216.
12. Xu J, Kalos M, Stolk JA, et al. Identification and characterization of prostein, a novel prostate-specific protein. Cancer Res 2001; 61(4): 1563-1568.
13. Yin M, Dhir R, Parwani AV. Diagnostic utility of p501s (prostein) in comparison to prostate specific antigen (PSA) for the detection of metastatic prostatic adenocarcinoma. Diagn Pathol 2007; 2 : 41.
14. Mhawech-Fauceglia P, Zhang S, Terracciano L, et al. Prostate-specific membrane antigen (PSMA) protein expression in normal and neoplastic tissues and its sensitivity and specificity in prostate adenocarcinoma: an immunohistochemical study using mutiple tumour tissue microarray technique. Histopathology 2007; 50(4): 472-483.
15. Marchal C, Redondo M, Padilla M, et al. Expression of prostate specific membrane antigen (PSMA) in prostatic adenocarcinoma and prostatic intraepithelial neoplasia. Histol Histopathol 2004; 19(3): 715-718.
16. Perner S, Hofer MD, Kim R, et al. Prostate-specific membrane antigen expression as a predictor of prostate cancer progression. Hum Pathol 2007; 38(5): 696-701.
17. Wang W, Tavora F, Sharma R, Eisenberger M, Netto GJ. PSMA expression in Schwannoma: a potential clinical mimicker of metastatic prostate carcinoma. Urol Oncol 2009; 27(5): 525-528.
18. Silver DA, Pellicer I, Fair WR, Heston WD, Cordon-Cardo C. Prostate-specific membrane antigen expression in normal and malignant human tissues. Clin Cancer Res1997; 3(1):81-85.
19. Lane Z, Hansel DE, Epstein JI. Immunohistochemical expression of prostatic antigens in adenocarcinoma and villous adenoma of the urinary bladder. Am J Surg Pathol 2008; 32(9): 1322-6.
20. Jobsis AC, De Vries GP, Meijer AE, Ploem JS. The immunohistochemical detection of prostatic acid phosphatase: its possibilities and limitations in tumour histochemistry. Histochem J 1981; 13(6): 961-973.
21. Haines AM, Larkin SE, Richardson AP, Stirling RW, Heyderman E. A novel hybridoma antibody (PASE/4LJ) to human prostatic acid phosphatase suitable for immunohistochemistry. Br J Cancer 1989; 60(6): 887-892.
22. Kimura N, Sasano N. Prostate-specific acid phosphatase in carcinoid tumors. Virchows Arch A Pathol Anat Histopathol 1986; 410(3): 247-251.
23. Elgamal AA, Ectors NL, Sunardhi-Widyaputra S, Van Poppel HP, Van Damme BJ, Baert LV. Detection of prostate specific antigen in pancreas and salivary glands: a potential impact on prostate cancer overestimation. J Urol 1996; 156(2 Pt 1): 464-468.
24. Graddis TJ, McMahan CJ, Tamman J, Page KJ, Trager JB. Prostatic acid phosphatase expression in human tissues. Int J Clin Exp Pathol 2011; 4(3): 295-306.
25. Goldstein NS. Immunophenotypic characterization of 225 prostate adenocarcinomas with intermediate or high Gleason scores. Am J Clin Pathol 2002; 117(3): 471-477.
26. Varma M, Berney DM, Jasani B, Rhodes A. Technical variations in prostatic immunohistochemistry: need for standardisation and stringent quality assurance in PSA and PSAP immunostaining. J Clin Pathol 2004; 57(7): 687-690.
27. Huang H, Guma SR, Melamed J, Zhou M, Lee P, Deng FM. NKX3.1 and PSMA are sensitive diagnostic markers for prostatic carcinoma in bone metastasis after decalcification of specimens. Am J Clin Exp Urol 2018; 6(5):182-188.
28. Varinot J, Cussenot O, Roupret M, et al. HOXB13 is a sensitive and specific marker of prostate cells, useful in distinguishing between carcinomas of prostatic and urothelial origin. Virchows Arch 2013; 463(6): 803-809.
29. Varinot J, Furudoi A, Drouin S, et al. HOXB13 protein expression in metastatic lesions is a promising marker for prostate origin. Virchows Arch 2016; 468(5): 619-622.
30. Barresi V, Ieni A, Reggiani Bonetti L, Tuccari G. HOXB13 expression in metastatic prostate cancer. Virchows Arch 2016; 469(1): 119-120.
31. Bellizzi AM. An Algorithmic Immunohistochemical Approach to Define Tumor Type and Assign Site of Origin. Adv Anat Pathol 2020; 27(3): 114-163.
32. Hedrick L, Epstein JI. Use of keratin 903 as an adjunct in the diagnosis of prostate carcinoma. Am J Surg Pathol 1989; 13(5): 389-396.
33. Hameed O, Humphrey PA. Immunohistochemistry in diagnostic surgical pathology of the prostate. Semin Diagn Pathol 2005; 22(1): 88-104.
34. Al Diffalha S, Shaar M, Barkan GA, Wojcik EM, Picken MM, Pambuccian SE. Immunohistochemistry in the workup of prostate biopsies: Frequency, variation and appropriateness of use among pathologists practicing at an academic center. Ann Diagn Pathol 2017; 27 : 34-42.
35. Abrahams NA, Ormsby AH, Brainard J. Validation of cytokeratin 5/6 as an effective substitute for keratin 903 in the differentiation of benign from malignant glands in prostate needle biopsies. Histopathology 2002; 41(1): 35-41.
36. Brustmann H. p40 as a Basal Cell Marker in the Diagnosis of Prostate Glandular Proliferations: A Comparative Immunohistochemical Study with 34betaE12. Pathol Res Int 2015; 2015 : 897927.
37. Kuroda N, Katto K, Tamura M, et al. Immunohistochemical application of D2-40 as basal cell marker in evaluating atypical small acinar proliferation of initial routine prostatic needle biopsy materials. Med Mol Morphol 2010; 43(3): 165-169.
38. Paner GP, Luthringer DJ, Amin MB. Best practice in diagnostic immunohistochemistry: prostate carcinoma and its mimics in needle core biopsies. Arch Pathol Lab Med 2008; 132(9): 1388-1396.
39. Tan HL, Haffner MC, Esopi DM, et al. Prostate adenocarcinomas aberrantly expressing p63 are molecularly distinct from usual-type prostatic adenocarcinomas. Mod Pathol 2015; 28(3): 446-456.
40. Herawi M, Parwani AV, Irie J, Epstein JI. Small glandular proliferations on needle biopsies: most common benign mimickers of prostatic adenocarcinoma sent in for expert second opinion. Am J Surg Pathol 2005; 29(7): 874-880.
41. Beach R, Gown AM, De Peralta-Venturina MN, et al. P504S immunohistochemical detection in 405 prostatic specimens including 376 18-gauge needle biopsies. Am J Surg Pathol 2002; 26(12): 1588-1596.
42. Shidham VB, Lindholm PF, Kajdacsy-Balla A, Basir Z, George V, Garcia FU. Prostate-specific antigen expression and lipochrome pigment granules in the differential diagnosis of prostatic adenocarcinoma versus seminal vesicle-ejaculatory duct epithelium. Arch Pathol Lab Med 1999; 123(11): 1093-1097.
43. Ortiz-Rey JA, Juaneda-Benavides L, Peteiro-Cancelo A, de Maria CG, Tejado BS, Tardio-Baiges A. Another application of PAX8: to confirm the presence of seminal vesicle epithelium in prostate needle biopsies. Appl Immunohistochem Mol Morphol 2015; 23(2): 161-162.
44. Tong GX, Memeo L, Colarossi C, et al. PAX8 and PAX2 immunostaining facilitates the diagnosis of primary epithelial neoplasms of the male genital tract. Am J Surg Pathol 2011; 35(10): 1473-1483.
45. Pivovarčíková K, Švajdler M, Hes O. Využití imunohistochemie při diagnostice lézí vývodného močového traktu. Cesk Slov Patol 2020, 140-152.
46. Allan CH, Epstein JI. Nephrogenic adenoma of the prostatic urethra: a mimicker of prostate adenocarcinoma. Am J Surg Pathol 2001; 25(6): 802-808.
47. Elgamal AA, Van de Voorde W, Van Poppel H, Lauweryns J, Baert L. Immunohistochemical localization of prostate-specific markers within the accessory male sex glands of Cowper, Littre, and Morgagni. Urology 1994; 44(1): 84-90.
48. Cina SJ, Silberman MA, Kahane H, Epstein JI. Diagnosis of Cowper’s glands on prostate needle biopsy. Am J Surg Pathol 1997; 21(5): 550-555.
49. Saboorian MH, Huffman H, Ashfaq R, Ayala AG, Ro JY. Distinguishing Cowper’s glands from neoplastic and pseudoneoplastic lesions of prostate: immunohistochemical and ultrastructural studies. Am J Surg Pathol 1997; 21(9): 1069-1074.
50. Srigley JR. Benign mimickers of prostatic adenocarcinoma. Mod Pathol 2004; 17(3): 328-348.
51. Bostwick DG, Qian J, Ma J, Muir TE. Mesonephric remnants of the prostate: incidence and histologic spectrum. Mod Pathol 2003; 16(7): 630-635.
52. Chen YB, Fine SW, Epstein JI. Mesonephric remnant hyperplasia involving prostate and periprostatic tissue: findings at radical prostatectomy. Am J Surg Pathol 2011; 35(7): 1054-1061.
53. Bostwick DG, Srigley J, Grignon D, et al. Atypical adenomatous hyperplasia of the prostate: morphologic criteria for its distinction from well-differentiated carcinoma. Hum Pathol 1993; 24(8): 819-832.
54. Yang XJ, Wu CL, Woda BA, et al. Expression of alpha-Methylacyl-CoA racemase (P504S) in atypical adenomatous hyperplasia of the prostate. Am J Surg Pathol 2002; 26(7): 921-925.
55. Gordetsky J, Epstein JI. Pseudopapillary features in prostatic adenocarcinoma mimicking urothelial carcinoma: a diagnostic pitfall. Am J Surg Pathol 2014; 38(7): 941-945.
56. Schelling LA, Williamson SR, Zhang S, et al. Frequent TMPRSS2-ERG rearrangement in prostatic small cell carcinoma detected by fluorescence in situ hybridization: the superiority of fluorescence in situ hybridization over ERG immunohistochemistry. Hum Pathol 2013; 44(10): 2227-2233.
57. Bezerra SM, Lotan TL, Faraj SF, et al. GATA3 expression in small cell carcinoma of bladder and prostate and its potential role in determining primary tumor origin. Hum Pathol 2014; 45(8): 1682-1687.
58. Guo CC, Dancer JY, Wang Y, Aparicio A, et al. TMPRSS2-ERG gene fusion in small cell carcinoma of the prostate. Hum Pathol 2011; 42(1): 11-17.
59. Lotan TL, Gupta NS, Wang W, et al. ERG gene rearrangements are common in prostatic small cell carcinomas. Mod Pathol 2011; 24(6): 820-828.
60. Williamson SR, Zhang S, Yao JL, et al. ERG-TMPRSS2 rearrangement is shared by concurrent prostatic adenocarcinoma and prostatic small cell carcinoma and absent in small cell carcinoma of the urinary bladder: evidence supporting monoclonal origin. Mod Pathol 2011; 24(8): 1120-1127.
61. Erdem GU, Ozdemir NY, Demirci NS, Sahin S, Bozkaya Y, Zengin N. Small cell carcinoma of the urinary bladder: changing trends in the current literature. Curr Med Research Opin 2016; 32(6): 1013-1021.
Labels
Anatomical pathology Forensic medical examiner ToxicologyArticle was published in
Czecho-Slovak Pathology

2020 Issue 3
-
All articles in this issue
- Využití imunohistochemie při diagnostice renálních neoplázií
- Využití imunohistochemie při diagnostice lézí vývodného močového traktu
- Praktické využití imunohistochemie a genetiky v diagnostice nádorů varlat
- Využití imunohistochemie v patologii prostaty
- Gossypibóm – imitujúci recidívu nádoru mandibuly: kazuistika
- Uzlinová metastáza high-grade adenoidně cystického karcinomu příušní slinné žlázy
- Karcinom z Merkelových buněk se skvamózní diferenciací – kazuistika
- Praktická imunohistochémia v genitourinárnej patológii
- Profesor Ivo Šteiner osmdesátiletý
- Monitor aneb nemělo by vám uniknout, že...
- Monitor aneb nemělo by vám uniknout, že...
- Diagnostic Histopathology of Tumors
- Czecho-Slovak Pathology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Uzlinová metastáza high-grade adenoidně cystického karcinomu příušní slinné žlázy
- Využití imunohistochemie při diagnostice lézí vývodného močového traktu
- Využití imunohistochemie při diagnostice renálních neoplázií
- Využití imunohistochemie v patologii prostaty
