Molekulární testování u karcinomu endometria (společné doporučení ČOS, onkogynekologické sekce ČGPS, SROBF a SČP ČLS JEP)
Molecular testing in endometrial carcinoma (Joint recommendation of Czech Oncological Society, Oncogynecological Section of the Czech Gynecological and Obstetrical Society, Society of Radiation Oncology, Biology and Physics, and the Society of Czech Pathologists)
Molecular classification of endometrial carcinoma is becoming an important part of the diagnostic process with direct therapeutic implications. Recent international guidelines, including the joint ESGO-ESTRO-ESP recommendation, include the molecular classification into standard diagnostic algorithms. Molecular testing of endometrial carcinomas is also recommended in the latest (5th) edition of the WHO classification of Female Genital Tumors. Due to the need to implement these recommendations in practice, representatives of four professional societies of Czech Medical Association of J. E. Purkyně (Czech Oncological Society, Oncogynecological Section of the Czech Gynecological and Obstetrical Society, Society of Radiation Oncology, Biology and Physics, and the Society of Czech Pathologists) organized a meeting focused on this topic. The result of this meeting is a joint recommendation for molecular testing of endometrial carcinoma in routine diagnostic practice in the Czech Republic.
Keywords:
Endometrial carcinoma – molecular testing – FIELD – mismatch repair system –p53
Authors:
Pavel Dundr 1; David Cibula 2; Martin Doležel 3; Pavel Fabian 4; Jindřich Fínek 5; Tomáš Jirásek 6; Radoslav Matěj 1,7,8; Luboš; Petruželka 9; Lukáš Rob 10; Aleš Ryška 11
; Marián Švajdler 12,13; Vít Weinberger 14; Michal Zikán 15
Authors‘ workplace:
Ústav patologie 1. LF UK a VFN v Praze
1; Onkogynekologické centrum, Gynekologicko-porodnická klinika 1. LF UK a VFN v Praze
2; Onkologická Klinika LF Palackého univerzity a Fakultní nemocnice Olomouc
3; Oddělení onkologické patologie, Masarykův onkologický ústav
4; Onkologická a radioterapeutická klinika LF UK v Plzni a Fakultní nemocnice Plzeň
5; Oddělení patologie, centrum PATOS, Krajská nemocnice Liberec
6; Ústav patologie, 3. LF UK a FN Královské Vinohrady
7; Ústav patologie a molekulární medicíny, 3. LF UK a Fakultní Thomayerova nemocnice
8; Onkologická klinika 1. LF UK a VFN v Praze
9; Gynekologicko-porodnická klinika 3. LF UK a FN Královské Vinohrady
10; Fingerlandův ústav patologie, LF UK a FN Hradec Králové
11; Šiklův ústav patologie, LFUK v Plzni a Fakultní nemocnice Plzeň
12; Bioptická laboratoř, s. r. o., Plzeň
13; Gynekologicko-porodnická klinika, LF Masarykovy Univerzity, FN Brno
14; Gynekologicko-porodnická klinika 1. LF UK a FN Bulovka
15
Published in:
Čes.-slov. Patol., 57, 2021, No. 3, p. 181-187
Category:
Overview
Molekulární klasifikace karcinomu endometria se stává důležitou součástí diagnostického procesu s přímými léčebnými dopady. Recentní mezinárodní doporučené postupy včetně společného doporučení ESGO-ESTRO-ESP proto zahrnují molekulární klasifikaci do standardních diagnostických algoritmů, stejně tak je molekulární testování doporučováno i podle nejnovější (5. edice) WHO klasifikace nádorů ženského genitálu z roku 2020. Vzhledem k potřebě implementace těchto doporučení do diagnostické praxe v České republice proběhlo jednání zástupců čtyř odborných společností ČLS JEP (České onkologické společnosti, Onkogynekologické sekce České gynekologické a porodnické společnosti, Společnosti radiační onkologie, biologie a fyziky a Společnosti českých patologů). Výsledkem tohoto jednání je doporučení pro molekulární testování karcinomu endometria v rutinní diagnostické praxi v České republice.
Klíčová slova:
karcinom endometria – molekulární testování – POLE – mismatch repair systém – p53
Klasifikace karcinomů endometria je tradičně založena na hodnocení definovaných morfologických znaků, často v kombinaci s imunohistochemickým profilem, přesto je však diagMolekulární nostická shoda zejména u high grade karcinomů poměrně nízká (1,2). V poslední 5. ediciWHO klasifikace nádorů ženského genitálu je uvedeno 10 histologických typů karcinomu endometria, zahrnujících i nové typy jako je “mesonephric-like” karcinom a mucinózní karcinom gastrického typu (3). Zásadní dopad však v posledních letech přináší zejména molekulární klasifikace karcinomů endometria, která se stává důležitou součástí diagnostického procesu (3,4). To se odrazilo i v tom, že je v nové WHO klasifikaci karcinomů endometria uvedena i molekulární subklasifikace endometroidního karcinomu do čtyř samostatně vyčleněných subtypů (3). Tato molekulární klasifikace je podle WHO možná a doporučovaná nejen u endometroidního karcinomu, ale i u ostatních histologických typů karcinomu endometria. Bližší indikační kritéria pro molekulární testování jsou řešena na úrovni mezinárodních guidelines, recentně jde např. o společné doporučení ESGO - ESTRO-ESP z roku 2020 (4). Podle tohoto doporučení je optimální testování všech karcinomů endometria, nicméně testování karcinomů ze skupiny nízkého (“low”) a středního (“intermediate”) rizika (podle stratifikace do rizikových skupin dle ESGO kritérií)má v současnosti menší význam pro indikaci adjuvantní léčby. Molekulární testování je v obecné úrovni vnímáno jako zásadně důležité a přínosné, nutné je však zohlednit regionální zdroje a jeho dostupnost, v některých oblastech světa tak může být jeho implementace do praxe problematická. Na podkladě recentních doporučení na mezinárodní úrovni a potřeby implementace těchto doporučení do diagnostické praxe v České republice proběhlo jednání zástupců čtyř odborných společností ČLS JEP (České onkologické společnosti, onkogynekologické sekce České gynekologické a porodnické společnosti, Společnosti radiační onkologie, biologie a fyziky a Společnosti českých patologů), jehož výsledkem je toto doporučení pro molekulární testování karcinomu endometria v rutinní diagnostice v České republice.
DOPORUČENÝ POSTUP PRO MOLEKULÁRNÍ TESTOVÁNÍ KARCINOMU ENDOMETRIA V ČR
Kompletním molekulárním testováním či molekulárním testováním se pro účely tohoto doporučení rozumí vyšetření mutačního stavu genu POLE, hodnocení defektů mismatch repair systému a p53. Algoritmus stratifikace do jednotlivých molekulárních subtypů je uveden na obr. 1.
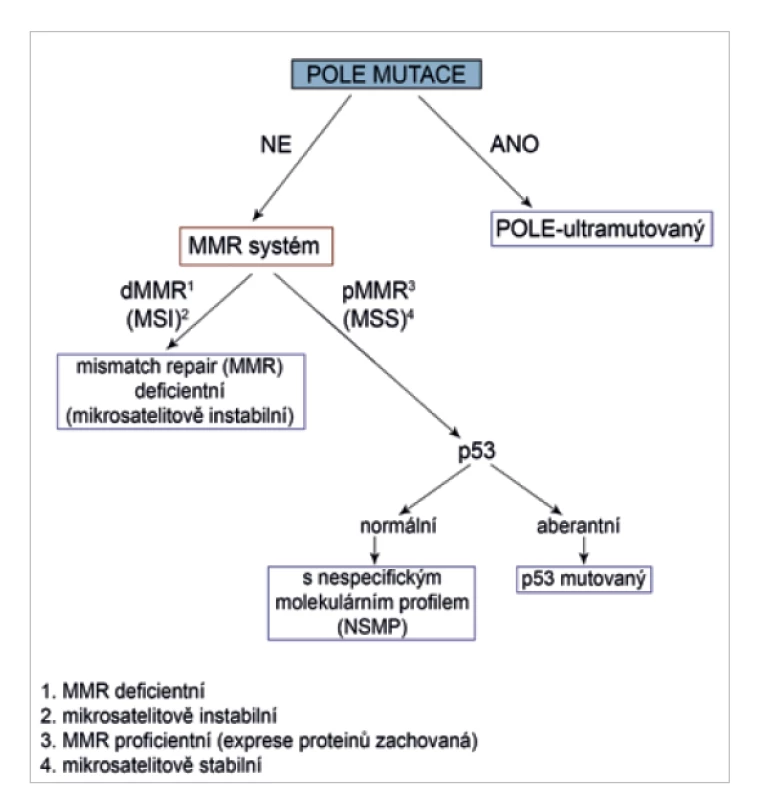
Kdy a koho testovat
Optimální by bylo testování všech karcinomů endometria. V současné době však molekulární testování nemá stejný klinic - ký význam pro všechny rizikové skupiny. Vzhledem k nutnosti zhodnocení všech potřebných klinicko-patologických parametrů důležitých pro indikaci molekulárního testování se doporučuje testování až po vyšetření definitivního resekátu, nikoliv hned v rámci diagnostického bioptického odběru (materiál z diagnostického odběru, který je často lépe fixovaný a objemnější, však může být po zhodnocení indikace v návaznosti na definitivní vyšetření resekátu pro vlastní molekulární testování použit). Každý případ je však posuzován individuálně a v případě klinické relevance je možné příslušná vyšetření provést i z diagnostické biopsie. Vyšetření je prováděno vždy na žádost klinika z Komplexního onkologického centra (KOC) či Onkogynekologického centra.
Klasifikace LVSI (dle ESGO-ESTRO-ESP a WHO doporučení)
Hodnocení LVSI se provádí v okolí nádoru (tedy mimo vlastní karcinom) s dělením do následujících stupňů:
- nepřítomná („absent“) - fokální („focal“): 1-4 cévních prostor
- podstatná („substantial“): ≥ 5 cévních prostor
Rizikové skupiny (dle ESGO kritérií)
1) Skupina nízkého rizika (LR - low risk)
Stádium IA endometroidní karcinom, G1-2, LVSI negativní nebo fokální
2) Skupina středního rizika (IR - intermediate risk)
Stádium IB endometroidní karcinom, G1-2, LVSI negativní nebo fokální
Stádium IA endometroidní karcinom, G3, LVSI negativní nebo fokální Sátdium IA, non-endometroidní karcinom, bez invaze do myometria
3) Skupina vysokého/středního rizika (HIR - high-intermediate risk)
Stádium I endometroidní karcinom bez ohledu na grade a hloubku invaze s podstatnou („substantial“) LVSI
Stádium IB endometroidní karcinom grade 3, bez ohledu na LVSI Stádium II
4) Skupina vysokého rizika (HR - high risk)
Stádium III-IVA bez reziduálního nádoru
Non-endometroidní histologický typ (stádium I-IVA) s invazí do myometria a bez reziduálního nádoru
Současná mezinárodní doporučení vznikala jako konsensuální dokument mnoha odborníků, zastupujících několik odborností. Jednou z nejdiskutovanějších otázek během jejich přípravy byly indikace pro adjuvantní léčbu po operaci. Odrážejí tak poznatky z dostupných prospektivních studií, současně však i rozdílnou klinickou praxi. V doporučení typu adjuvantního zajištění nejsou zcela striktní, ale nechávají volbu na multidisciplinárním týmu (MDT). Význam molekulární testování u jednotlivých rizikových skupin se tak může na pracovištích lišit v závislosti na tom, jaká je jejich klinická praxe. Molekulární testování je obecně kliniky velmi vítané i proto, že přináší další argument pro jejich rozhodnutí.
Níže je uvedena zjednodušená rozvaha o možném významu molekulárního testování dle rizikové skupiny:
1) Nízké riziko (LR)
U této skupiny není doporučeno adjuvantní zajištění. Aberantní typ exprese p53 / mutace TP53 však posouvá pacientky do středního rizika. V případě aberantního typu exprese p53 je však nutné provést kompletní molekulární testování k vyloučení případů, u kterých je aberantní exprese p53 (mutace TP53) sekundárním projevem ultramutovaného stavu při POLE mutaci a jedná se tedy o nádory, jejichž prognóza se odvíjí od POLE mutace, a tedy jde o nádory s výbornou prognózou.
2) Střední riziko (IR)
U této skupiny je ponecháno na volbě MDT, zda zajistit pacientku brachyterapií (BRT) s cílem snížit riziko lokálních recidiv nebo zda ponechat bez zajištění. Při znalosti molekulární profilu nádoru se nádory ze skupiny P53-mutovaných posouvají do vysokého rizika, zatímco POLE-ultramutované do rizika nízkého. Testování stavu p53, které posouvá pacientku do vysokého rizika, by mělo být provedeno u všech případů. V případě aberantního typu exprese p53 je však nutné provést kompletní molekulární testování k vyloučení případů, u kterých je aberantní exprese p53 (mutace TP53) sekundárním projevem ultramutovaného stavu při POLE mutaci či v rámci mikrosatelitové instability a jedná se tedy o nádory, jejichž prognóza se odvíjí od POLE mutace (mikrosatelitové instability).
3) Střední/vysoké riziko (HIR)
Stejně jako v předchozí skupině se při znalosti molekulárního subtypu nádory ze skupiny P53-mutovaných posouvají do vysokého rizika, zatímco POLE-ultramutované do rizika nízkého. Testování stavu p53, které posouvá pacientku do vysokého rizika, by mělo být provedeno u všech případů. V případě aberantního typu exprese p53 je však nutné provést kompletní molekulární testování k vyloučení případů, u kterých je aberantní exprese p53 (mutace TP53) sekundárním projevem ultramutovaného stavu při POLE mutaci či v rámci mikrosatelitové instability a jedná se tedy o nádory, jejichž prognóza se odvíjí od přítomnosti POLE mutace (mikrosatelitové instability).
4) Vysoké riziko (HR)
U této skupiny je adjuvantní radioterapie indikována. Aberantní typ exprese p53 / mutace TP53nemění zařazení do skupiny, na některých pracovištích je však používáno jako argument pro podání sekvenční chemoterapie po ukončení zevní či kombinované radioterapie. Přítomnost POLE mutace je však velmi významná, protože posunuje pacientku do nízkého rizika bez adjuvantního zajištění. U těchto pacientek je tedy molekulární testování doporučeno vždy.
Na základě uvedené rozvahy je možné dojít k doporučení pro molekulární testování, které zohledňuje strategii pracoviště s ohledem na jeho preference v podání či nepodání adjuvantní léčby u jednotlivých rizikových skupin:
a) Testování p53 u všech rizikových skupin. V případě aberantního typu exprese p53 / mutace TP53však musí být provedeno kompletní molekulární testování k vyloučení mutací TP53 sekundárním projevem ultramutovaného stavu při POLE mutaci či v rámci mikrosatelitové instability a jedná se tedy o nádory, jejichž prognóza se odvíjí od POLE mutace (mikrosatelitové instability).
b) Kompletní molekulární testování se stanovením molekulárního subtypu u všech případů ze skupiny vysokého rizika (HR), středního–vyššího rizika (HIR) a středního rizika (IR), u kterých může vést k deeskalaci adjuvantní léčby; u všech případů s abnormálním typem exprese p53 testovaných dle indikace podle bodu a).
V jakých laboratořích testovat
Konsenzuální názor pro jednání s plátci je, že by testování měly mít možnost provádět všechny laboratoře patologie, které jsou součástí instituce se statutem Komplexního onkologického centra (KOC) či Onkogynekologického centra nebo mají na tato centra přímou návaznost (jako je tomu např. u laboratoří zařazených do sítě referenčních laboratoří pro prediktivní diagnostiku) a mají zavedené, validované a akreditované příslušné laboratorní metody umožňující plnou klasifikaci nádorů podle uvedeného algoritmu. Vyšetření pouze části markerů není s ohledem na nastavený algoritmus molekulární klasifikace karcinomů endometria přijatelné.
Testování jednotlivých parametrů
POLE mutace
Vyšetření mutačního stavu POLE může být provedeno jakoukoliv molekulární metodou umožňující stanovení mutací v exonukleázové doméně (exon 9-14). Preferováno je jednoznačně vyšetření metodou NGS, které kromě mutačního stavu POLE umožní i vyšetření dalších genů a stanovení komplexního molekulárního profilu nádoru. V případě využití jiné molekulární metody je nutné vzít v potaz případné limitace dané zejména nízkou senzitivitou Sangerova sekvenování (NGS má ve srovnání se Sangerovým sekvenováním asi o 1/3 vyšší senzitivitu) a při použití komerčních PCR kitů potřebou pokrytí všech relevantních „hot-spotů“ genu POLE v exonu 9-14.
Zdůvodnění
Preference metody NGS vychází ze skutečnosti, že touto metodou lze současně s mutačním stavem POLE vyšetřit i další geny významné s ohledem na molekulární klasifikaci, tedy TP53 a CTNNB1. Imunohistochemické vyšetření exprese p53 lze podle nastavených algoritmů testování použít, má však oproti vyšetření mutačního stavu genu TP53 metodou NGS nižší senzitivitu (část případů s wild-type typemexpresep53 má mutaci genu TP53, která se však neprojeví abnormální expresí proteinu). Vyhodnocení mutačního stav genu CTNNB1 potenciálně umožňuje další stratifikaci nádorů ze skupiny nespecifického molekulárního subtypu (NSMP) do prognosticky příznivé (v případě wild-typeCTNNB1) a intermediální (v případě mutaceCTNNB1a ARID1A) kategorie (5). Aktuálně se však jedná o subklasifikaci s nízkým stupněm evidence, která doposud není všeobecně akceptována. Komplexní molekulární vyšetření nádoru metodou NGS má také diagnostický význam u morfologicky sporných nádorů, z nichž část je možno přesně zařadit právě jen s použitím molekulárního vyšetření. Dále se jedná o vyšetření s potenciálně prediktivním významem u pokročilých nádorů, tedy s možností detekce případných terapeuticky ovlivnitelných molekulárních aberací. V této indikaci je však nutno postupovat podle stávajících algoritmů komplexního molekulárního vyšetření za prediktivním účelem, tak, jak je domluveno na úrovni odborných společností (ČOS a SČP) a plátců.
Vyhodnocení POLE mutace
Jako POLE-ultramutované nádory by měly být hodnoceny pouze nádory, které mají některou z definovaných „hot-spotových“ patogenních mutací (variant) v exonukleázové doméně genu POLE v exonu 9-14 uvedených v tabulce 1 či u nepopsaných variant klasifikovaných jako patogenní podle tzv. POLE-skóre (6). Uvedený seznam těchto variant představuje aktuální situaci a může se s rozvojem vědeckých poznatků dále měnit.
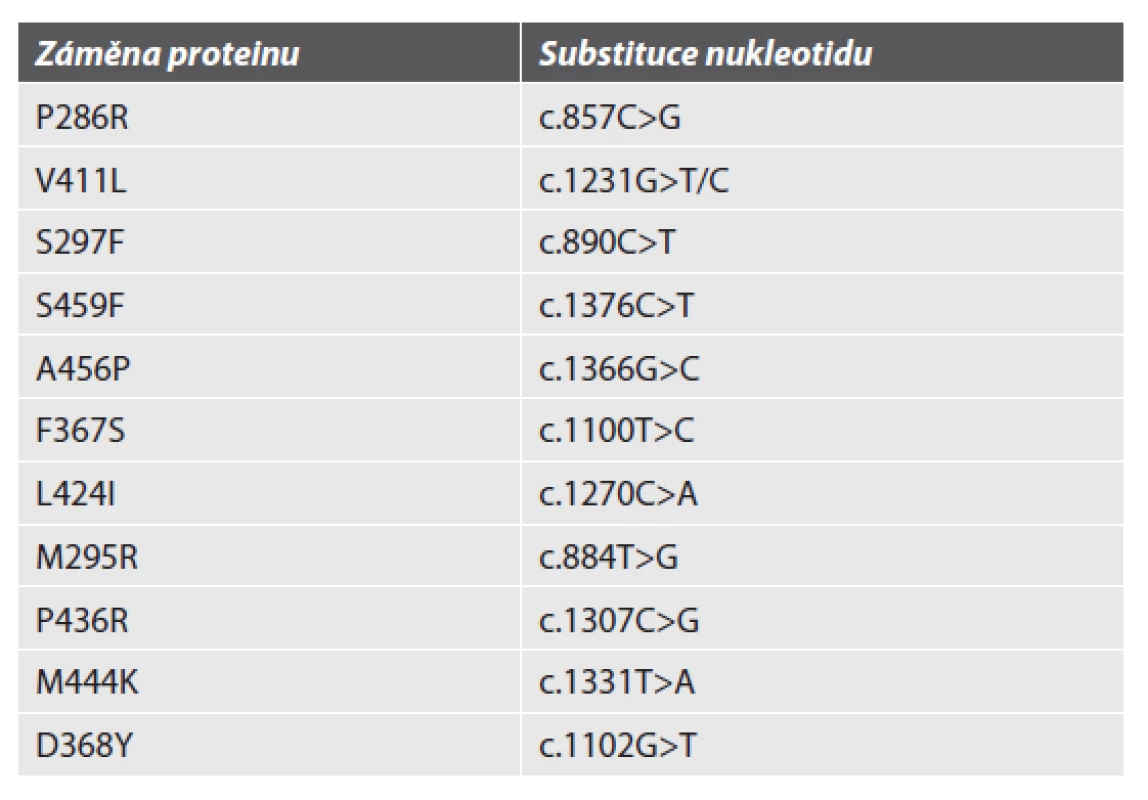
Defekt proteinů tzv. mismatch repair systému (MMR deficience)
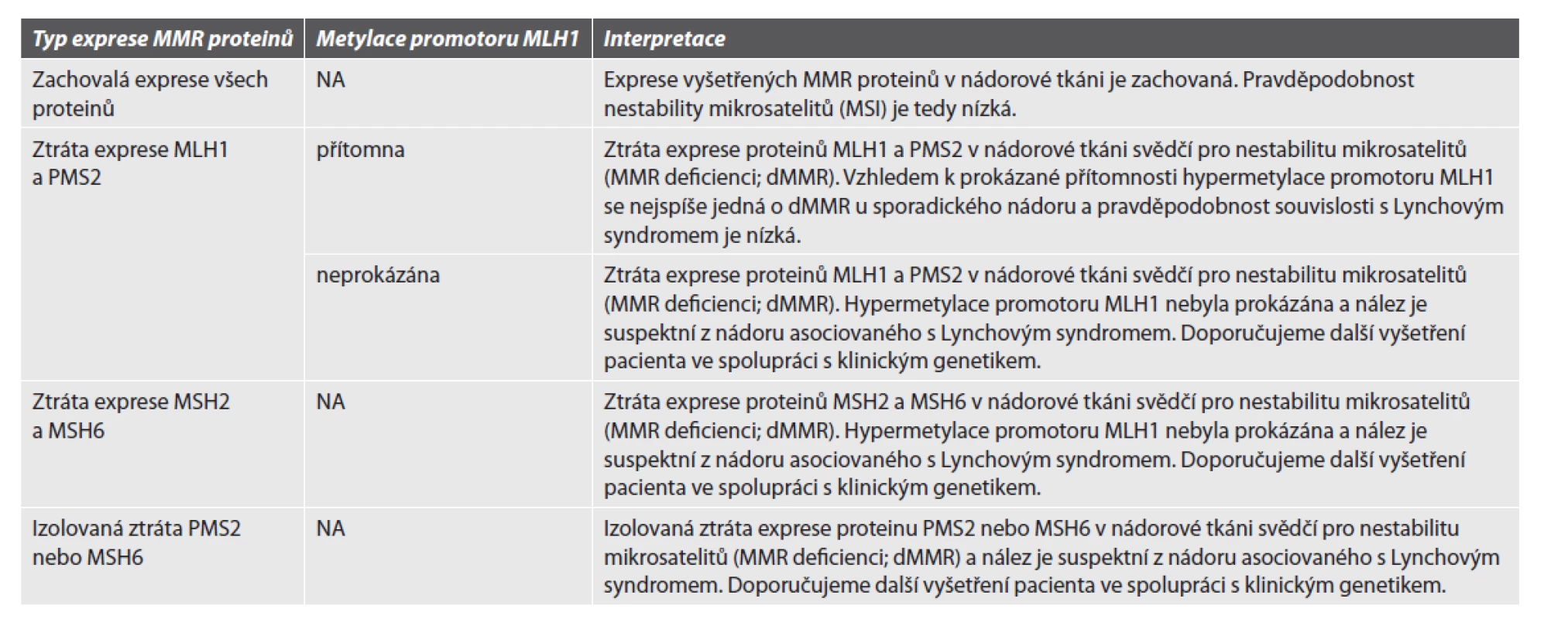
V souladu s ESMO doporučením je preferováno testování pomocí imunohistochemické detekce (IHC) exprese MMR proteinů (7). Optimálně by měla být testována exprese všech 4 proteinů (MLH1, PMS2, MSH2, MSH6), v praxi lze použít i testování pouze 2 tzv. vedlejších proteinů (PMS2 a MSH6) v případě potřeby doplněných o expresi 2 tzv. hlavních proteinů (MLH1 a MSH2). Pro případ nejednoznačné exprese na IHC úrovni musí laboratoř IHC vyšetření doplnit či upřesnit některou molekulární metodou( zejména PCR s fragmentační analýzou nebo metodu NGS s nastavením příslušného algoritmu umožňujícího detekci mikrosatelitové instability).V případě IHC testování exprese MMR proteinů musí mít laboratoř také zavedenou metodu umožňující stanovení metylačního stavu promotoru MLH1 k rozlišení mezi deficiencí MMR (dMMR) vyskytující se u sporadických nádorů a dMMR s možnou souvislostí s Lynchovým syndromem, kdy je nutné vyšetření klinickým genetikem.
Hodnocení stavu MMR
V případě IHC vyšetření se hodnotí jakákoliv jaderná exprese proteinu, která může být vzácně přítomna v < 10 % nádorových buněk (zejména u PMS2 a MSH6) (8). Sporné nebo neprůkazné výsledky je nutné verifikovat jinou metodou. Nutné je vždy vy - hodnocení vnitřní kontroly v nenádorové tkáni (bez této vnitřní kontroly nelze výsledek hodnotit). V případě ztráty exprese některého z MMR proteinů je případ vyhodnocen jak MMR-deficientní (dMMR). V případě zachování exprese všech vyšetřovaných proteinů je případ vyhodnocen jako MMR-proficientní (pMMR). Každé pracoviště musí mít nastavený algoritmus jak postupovat u dMMR případů s ohledem na možnou souvislost s Lynchovým syndromem a formulací doporučení v závěru vyšetření. Doporučení panelu na interpretaci výsledku exprese MMR vycházející ze studií a doporučení zaměřených na problematiku screeningu Lynchova syndromu je uvedeno v tabulce 2 (9, 10).
V případě využití metody PCR s fragmentační analýzou se postupuje podle příslušného algoritmu dle použitého spektra a počtu analyzovaných mikrosatelitů. Jako mikrosatelitově instabilní se hodnotí případy v kategorii MSI-H. Kategorie MSI-L je sporná a v souladu s revidovanými Bethesda kritérii a ESMO guideline jsou tyto případy nahlíženy jako MSS (mikrosatelitově stabilní) (7,11).
Vyšetření P53
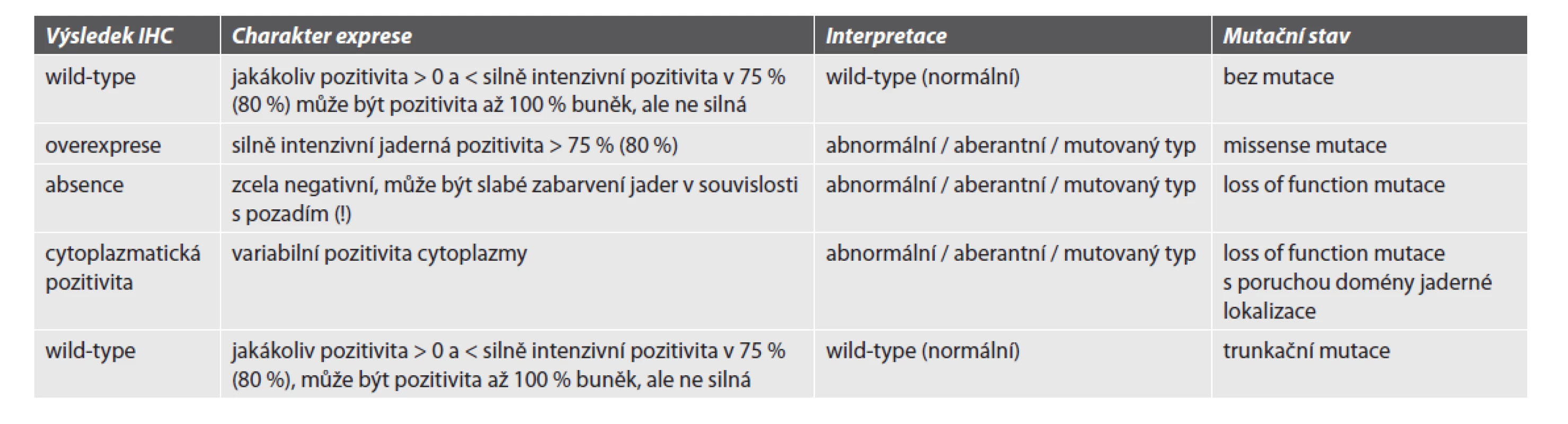
Vyšetření se provádí primárně IHC metodou. Zásadní je správné nastavení protokolu tak, aby splňoval kritéria vysoké senzitivity a specificity. V rámci hodnocení je vždy nutné vyhodnocení interní a externí kontroly. V případě absence interní kontroly nelze vyšetření u případů s úplnou ztrátou exprese proteinu vyhodnotit jako validní. IHC vyšetření je v případě NGS testování doplněno i o stanovení mutačního stavu genu TP53. Výsledky vyšetření se uvádí v kategoriích „wild-type“ / normální typ exprese a abnormální / aberantní / mutovaný typ exprese. Způsob hodnocení s ohledem na kritéria zařazení do jednotlivých kategorií je uveden v tabulce 3.
Klasifikace molekulárních kategorií nádorů
Vzhledem k poněkud odlišné terminologii používané v rámci klasifikace TCGA a skupin nejvíce se věnujících této problematice (PORTEC a ProMisE) (tabulka 4) je doporučeno sjednocené reportování tak, aby pokrývalo všechny alternativy a zachovalo srozumitelnost mezi jednotlivými pracovišti do 4 molekulárních subtypů následovně:
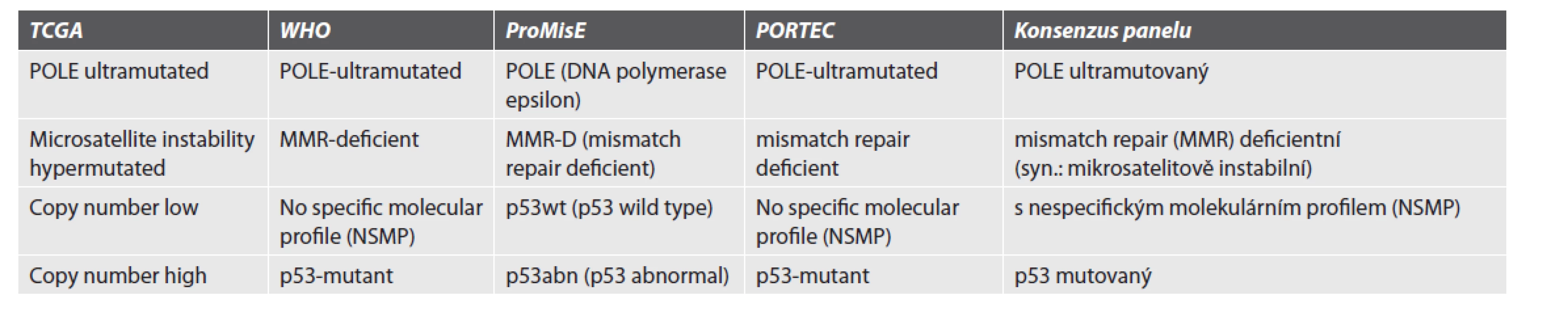
1) POLE-ultramutovaný
2) mismatch repair (MMR) deficientní (mikrosatelitově instabilní)
3) s nespecifickým molekulárním profilem
4) P53 mutovaný
Úhrada testování
Úhrada testování je s výraznými omezeními do určité míry možná i v rámci v současné době nastavených úhradových mechanismů, tyto mechanismy jsou však nevyhovující. Konsenzus panelu je, že bude iniciováno jednání mezi odbornými společnostmi a plátci s cílem nového nastavení úhradových mechanismů a vytvoření specifického kódu či kódů tak, aby umožnilymolekulární testování karcinomu endometria v kontextu stávající diagnostiky a následné léčebné péče.
DISKUZE
Historicky byly definovány 2 základní patogenetické typy karcinomu endometria, zahrnující typ I (low grade estrogen-dependentní nádory, endometrioidní a mucinózní typ, převážně s dobrou prognózou) and typ II (high grade estrogen-independentní nádory, non-endometroidní typy, převážně se špatnou prognózou) (12). Tyto dvě skupiny nádorů však vykazovaly značný překryv na úrovni morfologické, klinické i molekulární a s ohledem na prognostický či další dopad neměly praktický význam. Současné znalosti týkající se molekulární klasifikace karcinomů endometria vychází z výsledků studie “The Cancer Genome Atlas” (TCGA), která definovala 4 molekulární subtypy zahrnující POLE-ultramutovaný (dobrá prognóza), mikrosatelitově instabilní hypermutovaný (intermediální prognóza), “copy-number low” (intermediální prognóza) a “copy-number high” (špatná prognóza) (13). Výsledky této studie prokázaly, že molekulární klasifikace je prognosticky významná a může mít přímé terapeutické dopady.vMetodicky byl však jejich přístup poměrně komplikovaný a pro praktické využití nevhodný. Z tohoto důvodu se do praxe prosadil zjednodušený přístup kombinující využití imunohistochemických analýz a molekulárních metod (14-24).
Molekulární klasifikace karcinomů endometria představuje zásadní posun v diagnostice těchto nádorů s přímými dopady na léčbu pacientek (3,4,25). Nutné je však zdůraznit, že molekulární klasifikace karcinomů endometria je doplněním a nikoliv náhradou stávajících diagnostických postupů a nenahrazuje tedy histopatologické vyšetření, které je nutné pro stanovení stadia onemocnění a vyhodnocení dalších důležitých parametrů, jako je histologický typ nádoru, grading a zhodnocení nádorové angioinvaze (LVSI). Molekulární klasifikace poskytuje nezávislou prognostickou informaci nad rámec stratifikace do prognostických skupin vycházející pouze z hodnocení tradičních klinicko-patologických parametrů, což se odráží i v definici těchto prognostických skupin v recentním doporučení ESGO-ESTRO-ESP (4). Obecně platí, že POLE-ultramutované nádory mají výbornou prognózu (kategorie „favourable“) a p53 mutované nádory mají nejhorší prognózu (kategorie „unfavourable“). Mezi vysoce rizikovými („high risk“) nádory definovanými na podkladě tradičních klinicko-patologických parametrů a molekulárně klasifikovanými nádory p53 mutovaného typu je asi 89 % překryv (16). Molekulární klasifikace je však z kategorie vysoce rizikových nádorů schopna vyčlenit nádory s výbornou prognózou (POLE-ultramutované) a nádory s intermediální prognózou (mismatch repair deficientní). Bez molekulární klasifikace by asi 50 % nádorů z kategorie POLE-ultramutovaných a MMR deficientních bylo klasifikováno v kategorii vysoce rizikových („high risk“).
Molekulární klasifikaci lze použít u všech histologických typů endometriálního karcinomu, včetně karcinosarkomu. U jiných než endometroidních karcinomů má však určitá specifika a nedořešené aspekty, kterých bychom si měli být vědomi. Pro nediferencovaný / dediferencovaný karcinom obecně platí, že i přesto, že asi 50 % případů vykazuje dMMR, se jedná o nádor se špatnou prognózou (26,27). Nicméně minorita těchto nádorů, které vykazují POLE mutace, se zdá mít prognózu podstatně lepší, data jsou však poměrně limitovaná (28). Dalším sporným bodem je molekulární klasifikace světlobuněčného karcinomu endometria (ECCC) zejména s ohledem na fakt, že samotná existence výskytu POLE mutací a dMMR je u těchto nádorů, pokud jsou diagnostikovány dle striktních kritérií, sporná. V největší studii analyzující 37 případů ECCC nebyl nalezen žádný případ s POLE mutací či dMMR (29). Podle literárních údajů se sice dMMR vyskytuje u 0 - 68,8 % případů ECCC, případy vykazující dMMR jsou však nejspíše chybně diagnostikované jiné histologické typy karcinomu endometria (30-32). Naopak abnormality p53 se u ECCC prokazatelně vyskytují (asi u 50-60 % případů) a nejspíše se jedná o prognosticky nepříznivý faktor (33).
Určitou limitací stávající molekulární klasifikace je poměrně široká skupina nádorů v kategorii nespecifického molekulárního profilu, které jsou řazeny do skupiny nádorů s intermediální prognózou. V této oblasti však probíhá intenzivní výzkum zaměřený na možnou stratifikaci těchto nádorů, který má poměrně nadějné výsledky. Jako slibné se v tomto kontextu jeví hodnocení imunohistochemické exprese L1-CAM a mutačního stavu CTNNB1.Nádory kategorie NSMP vykazující L1-CAM expresi a/ nebo mutaci CTNNB1se zdají mít horší prognózu a podle dosavadních výsledků by zůstávaly v kategorii intermediálního rizika, ostatní nádory z kategorie NSMP mají prognózu výbornou a řadily by se do kategorie „favourable“ (19,20,34-39).
S ohledem na molekulární klasifikaci karcinomu endometria je vhodné zdůraznit, že na rozdíl od např. karcinomu ovaria, u kterého je úzká vazba mezi histologickým typem nádoru a molekulárním profilem, u karcinomu endometria histologický typ s molekulárním subtypem významněji nekoreluje (40). Bylo prokázáno, že zejména POLE-ultramutované a MMR deficientní nádory vykazují významnou morfologickou variabilitu a jejich morfologické rysy nejsou specifické pro žádnou molekulární kategorii (41,42). Například POLE-ultramutované nádory jsou často high grade, vykazují významnou LVSI, a i když jsou převážně endometroidního typu, mohou být i smíšené či mají nejednoznačné rysy s překryvnou endometroidní a serózní diferenciací (42). Většina low grade endometroidních karcinomů (G1, G2) spadá do kategorie NSMP, minorita z nich však může patřit do jakékoliv jiné molekulární kategorie, tedy včetně POLE - ultramutované, MMR deficientní a p53mutované. Prognostický význam low grade endometroidních karcinomů spadajících do kategorie p53 mutovaných není v současné době jednoznačný. Podle jedné recentní studie se však mutace TP53 vyskytuje asi u 10 % low grade endometroidních karcinomů a jedná se o nádory s více agresivním potenciálem (43). V této studii však nebyla provedena kompletní molekulární klasifikace nádorů, která je pro správné stanovení molekulárního subtypu nezbytná. Absence znalostí o mutačním stavu genu POLE a stavu exprese MMR proteinů neumožňuje rozlišit mezi „driver“ mutací TP53 a nádory ze skupiny tzv. “double” či “multiple classifiers”, u kterých může být TP53 mutace sekundární při POLE-ultramutačním stavu či MMR deficienci (6,44). Tyto nádory jsou pak klasifikovány jako POLE-ultramutované či MMR deficientní, a nikoliv tedy jako p53 mutované (44). Případy, u kterých je přítomna současně mutace POLE a dMMR jsou klasifikovány jako POLE-ultramutované (6).
Závěrem lze shrnout, že molekulární klasifikace karcinomu endometria představuje zásadní posun v problematice těchto nádorů s přímými terapeutickými dopady. Molekulární testování se stává standardní součástí diagnostiky a v podmínkách České republiky by mělo být aktuálně prováděno podle výše uvedeného algoritmu. Indikační kritéria v aktuální době nastavená na podkladě jednání odborných společností v České republice představují kompromis mezi optimem, kterým by bylo testování všech karcinomů endometria, a reálnými možnostmi se zohledněním ekonomických aspektů a přímého dopadu na volbu léčby. Tato kritéria však mohou být v budoucnu podle potřeby upravena. V brzké budoucnosti lze také očekávat rozšíření diagnostického algoritmu molekulárního testování o další parametry, které by umožnily další stratifikaci nádorů zejména ze skupiny NSMP. S ohledem na testování MMR deficience se panel shodl na potřebě zdůraznění faktu, že dMMR sama o sobě představuje u pokročilých nádorů prediktor terapie checkpoint inhibitory (45). Dále je testování mikrosatelitové instability důležité s ohledem na roli ve screeningu Lynchova syndromu (46-48). Problematika screeningu Lynchova syndromu v České republice však není řešena tímto doporučením.
Adresa pro korespondenci:
Prof. MUDr. Pavel Dundr, Ph.D.
Ústav patologie 1. LF UK a VFN v Praze
Studničkova 2, 128 00 Praha 2
e-mail: pavel.dundr@vfn.cz
Sources
1. Thomas S et al., Interobserver Variability in the Diagnosis of Uterine High-Grade Endometrioid Carcinoma. Arch Pathol Lab Med 2016 140(8): 836-843.
2. Gilks CB, Oliva E, Soslow RA. Poor interobserver reproducibility in the diagnosis of high - grade endometrial carcinoma. Am J Surg Pathol 2013; 37(6): 874-881.
3. Female Genital Tumours. 5 ed. WHO Classification of Tumours. 2020, Lyon: IARC Press. 631.
4. Concin N et al. ESGO/ESTRO/ESP guidelines for the management of patients with endometrial carcinoma. Int J Gynecol Cancer 2021; 31(1): 12-39.
5. De Leo A, et al. ARID1A and CTNNB1/beta - Catenin Molecular Status Affects the Clinicopathologic Features and Prognosis of Endometrial Carcinoma: Implications for an Improved Surrogate Molecular Classification. Cancers (Basel), 2021; 13(5): 950.
6. Leon-Castillo A, et al. Interpretation of somatic POLE mutations in endometrial carcinoma. J Pathol 2020; 250(3): 323-335.
7. Luchini C, et al. ESMO recommendations on microsatellite instability testing for immunotherapy in cancer, and its relationship with PD-1/PD-L1 expression and tumour mutational burden: a systematic review-based approach. Ann Oncol 2019; 30(8): 1232-1243.
8. Doghri R et al. Mismatch Repair Deficiency in Endometrial Cancer: Immunohistochemistry Staining and Clinical Implications. Appl Immunohistochem Mol Morphol 2019; 27(9): 678-682.
9. Chen W, Frankel W. A practical guide to biomarkers for the evaluation of colorectal cancer. Mod Pathol 2019; 32(Suppl 1): 1-15.
10. Stelloo E et al. Practical guidance for mismatch repair-deficiency testing in endometrial cancer. Ann Oncol 2017; 28(1): 96-102.
11. Umar A et al. Revised Bethesda Guidelines for hereditary nonpolyposis colorectal cancer (Lynch syndrome) and microsatellite instability. J Natl Cancer Inst 2004; 96(4): 261-268.
12. Bokhman JV. Two pathogenetic types of endometrial carcinoma. Gynecol Oncol 1983; 15(1): 10-17.
13. Cancer Genome Atlas Research et al. Integrated genomic characterization of endometrial carcinoma. Nature 2013; 497(7447): 67-73.
14. Talhouk A et al. A clinically applicable molecular - based classification for endometrial cancers. Br J Cancer 2015; 113(2): 299-310.
15. Talhouk A et al. Molecular classification of endometrial carcinoma on diagnostic specimens is highly concordant with final hysterectomy: Earlier prognostic information to guide treatment. Gynecol Oncol 2016; 143(1): 46-53.
16. Talhouk A et al. Confirmation of ProMisE: A simple genomics-based clinical classifier for endometrial cancer. Cancer 2017; 123(5): 802 - 813.
17. Wortman BG et al. Molecular-integrated risk profile to determine adjuvant radiotherapy in endometrial cancer: Evaluation of the pilot phase of the PORTEC-4a trial. Gynecol Oncol 2018; 151(1): 69-75.
18. Wortman BG et al. Ten-year results of the PORTEC-2 trial for high-intermediate risk endometrial carcinoma: improving patient selection for adjuvant therapy. Br J Cancer 2018; 119(9): 1067-1074.
19. Stelloo E et al. Improved Risk Assessment by Integrating Molecular and Clinicopathological Factors in Early-stage Endometrial Cancer-Combined Analysis of the PORTEC Cohorts. Clin Cancer Res 2016; 22(16): 4215 - 24.
20. Stelloo E et al. Refining prognosis and identifying targetable pathways for high-risk endometrial cancer; a TransPORTEC initiative. Mod Pathol 2015; 28(6): 836-44.
21. Plotkin A et al. Interlaboratory Concordance of ProMisE Molecular Classification of Endometrial Carcinoma Based on Endometrial Biopsy Specimens. Int J Gynecol Pathol 2019; 39(6): 537-545.
22. Parra-Herran C et al. Molecular-based classification algorithm for endometrial carcinoma categorizes ovarian endometrioid carcinoma into prognostically significant groups. Mod Pathol 2017; 30(12): 1748-1759.
23. Kommoss S et al. Final validation of the ProMisE molecular classifier for endometrial carcinoma in a large population-based case series. Ann Oncol 2018; 29(5): 1180-1188.
24. Bosse T et al. Molecular Classification of Grade 3 Endometrioid Endometrial Cancers Identifies Distinct Prognostic Subgroups. Am J Surg Pathol 2018; 42(5): 561-568.
25 Soslow RA et al. Endometrial Carcinoma Diagnosis: Use of FIGO Grading and Genomic Subcategories in Clinical Practice: Recommendations of the International Society of Gynecological Pathologists. Int J Gynecol Pathol 2019; 38 Suppl 1: S64-S74.
26. Altrabulsi B et al. Undifferentiated carcinoma of the endometrium. Am J Surg Pathol 2005; 29(10): 1316-1321.
27. Silva EG, Deavers MT, Malpica A. Undifferentiated carcinoma of the endometrium: a review. Pathology 2007; 39(1): 134-138.
28. Espdinosa I et al. Undifferentiated and dedifferentiated endometrial carcinomas with POLE exonuclease domain mutations have a favorable prognosis. Am J Surg Pathol 2017; 41(8): 1121-1128.
29. Baniak N et al. Targeted Molecular and Immunohistochemical Analyses of Endometrial Clear Cell Carcinoma Show that POLE Mutations and DNA Mismatch Repair Protein Deficiencies Are Uncommon. Am J Surg Pathol 2019; 43(4): 531-537.
30. An HJ et al. Molecular characterization of uterine clear cell carcinoma. Mod Pathol 2004; 17(5): 530-537.
31. DeLair DF et al. The genetic landscape of endometrial clear cell carcinomas. J Pathol 2017; 243(2): 230-241.
32. Bae HS et al. Should endometrial clear cell carcinoma be classified as Type II endometrial carcinoma? Int J Gynecol Pathol 2015; 34(1): 74-84.
33. Fadare O et al. The clinicopathologic significance of p53 and BAF-250a (ARID1A) expression in clear cell carcinoma of the endometrium. Mod Pathol 2013; 26(8): 1101-1110.
34. Kommoss FK et al. L1CAM further stratifies endometrial carcinoma patients with no specific molecular risk profile. Br J Cancer 2018; 119(4): 480-486.
35. Kommoss F et al. L1CAM: amending the “low-risk” category in endometrial carcinoma. J Cancer Res Clin Oncol 2017; 143(2): 255-262.
36. Bosse T et al. L1 cell adhesion molecule is a strong predictor for distant recurrence and overall survival in early stage endometrial cancer: pooled PORTEC trial results. Eur J Cancer 2014; 50(15): 2602-2610.
37. Kim G et al. Nuclear β-catenin localization and mutation of the CTNNB1 gene: a context - dependent association. Mod Pathol 2018; 31(10): 1553-1559.
38. Klat J et al. L1CAM as a Negative Prognostic Factor in Endometrioid Endometrial Adenocarcinoma FIGO Stage IA-IB. Anticancer Res 2019; 39(1): 421-424.
39. Smogeli E et al. L1CAM as a prognostic marker in stage I endometrial cancer: a validation study. BMC Cancer 2016; 16 : 596.
40. Hoang LN et al. Interobserver Agreement in Endometrial Carcinoma Histotype Diagnosis Varies Depending on The Cancer Genome Atlas (TCGA)-based Molecular Subgroup. Am J Surg Pathol 2017; 41(2): 245-252.
41. Bakhsh S et al. Histopathological features of endometrial carcinomas associated with POLE mutations: implications for decisions about adjuvant therapy. Histopathology 2016; 68(6): 916-924.
42. Hussein YR et al. Clinicopathological analysis of endometrial carcinomas harboring somatic POLE exonuclease domain mutations. Mod Pathol 2015; 28(4): 505-514.
43. Yano M et al. Impact of TP53 immunohistochemistry on the histological grading system for endometrial endometrioid carcinoma. Mod Pathol 2019; 32(7): 1023-1031.
44. Leon-Castillo A et al. Clinicopathological and molecular characterisation of ‘multiple - -classifier’ endometrial carcinomas. J Pathol 2020; 250(3): 312-322.
45. Petrelli F et al. Outcomes Following Immune Checkpoint Inhibitor Treatment of Patients With Microsatellite Instability-High Cancers: A Systematic Review and Meta-analysis. JAMA Oncol 2020; 6(7): 1068-1071.
46. Snowsill TM et al. Cost-effectiveness analysis of reflex testing for Lynch syndrome in women with endometrial cancer in the UK setting. PLoS One 2019; 14(8): e0221419.
47. Ryan N et al. Lynch syndrome screening in gynaecological cancers: results of an international survey with recommendations for uniform reporting terminology for mismatch repair immunohistochemistry results. Histopathology 2019; 75(6): 813-824.
48. Zeimet AG et al. AGO Austria recommendation on screening and diagnosis of Lynch syndrome (LS). Arch Gynecol Obstet 2017; 296(1): 123-127.
Labels
Anatomical pathology Forensic medical examiner ToxicologyArticle was published in
Czecho-Slovak Pathology

2021 Issue 3
-
All articles in this issue
- Next-Generation Pathology
- Cesta k cíli vede přes spolupráci
- 'PATOLOGIE MĚKKÝCH TKÁNÍ
- 'PATOLOGIE ORL OBLASTI
- 'UROPATOLOGIE
- 'GYNEKOPATOLOGIE
- 'NEFROPATOLOGIE
- 'HEPATOPATOLOGIE
- 'KARDIOPATOLOGIE
- 'HEMATOPATOLOGIE
- 'PATOLOGIE MĚKKÝCH TKÁNÍ
- 'PATOLOGIE GIT
- 'CYTODIAGNOSTIKA
- 'LABORATORNÍ METODY
- Next generation sequencing – a science tool or routine pathology?
- 'PULMOPATOLOGIE
- Next generation sequencing and the molecular tumor board from the point of view of oncologists
- The possibilities of molecular testing of somatic aberrations in tumor tissue using NGS in routine practice - current situation in the Czech Republic
- Next generation sequencing and its application in the diagnostics of neuromuscular diseases
- Methylation pattern in the diagnosis and prognosis of brain cancer
- Review of tumor infiltrating lymphocytes assessment in breast cancer in routine diagnostic practice
- Undiagnosed cryptococcal meningoencephalitis with extensive hypoxic-ischemic brain injury mimicking grade 3 diffuse axonal injury
- Doporučení pro testování PD-L1: metodika testování a reportování výsledků Verze_1 (17. 5. 2021)
- Molecular testing in endometrial carcinoma (Joint recommendation of Czech Oncological Society, Oncogynecological Section of the Czech Gynecological and Obstetrical Society, Society of Radiation Oncology, Biology and Physics, and the Society of Czech Pathologists)
- Giant cell myocarditis in young woman diagnosed at the autopsy: a case report
- Czecho-Slovak Pathology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Doporučení pro testování PD-L1: metodika testování a reportování výsledků Verze_1 (17. 5. 2021)
- Next generation sequencing – a science tool or routine pathology?
- Molecular testing in endometrial carcinoma (Joint recommendation of Czech Oncological Society, Oncogynecological Section of the Czech Gynecological and Obstetrical Society, Society of Radiation Oncology, Biology and Physics, and the Society of Czech Pathologists)
- Methylation pattern in the diagnosis and prognosis of brain cancer
