Morfologie zánětlivých střevních onemocnění (IBD)
Morphology of inflammatory bowel diseases (IBD)
Inflammatory bowel diseases (IBD) represent a group of chronic systemic inflammatory conditions with predilection to gastrointestinal tract and include Crohn’s disease and ulcerative colitis. If the IBD cannot be further specified, a term unclassified IBD is used. Histopathological diagnosis of IBD relies on identifying a chronic inflammatory pattern in proper topographic distribution, showing structural abnormalities of the intestinal mucosa and characteristic cellular composition of the inflammatory infiltrate. The intestinal involvement in Crohn’s disease is typically segmental, with predilection for terminal ileum and presence of epithelioid granulomas in histology. Ulcerative colitis shows a diffuse pattern of the inflammation and usually affects a rectum, with variable extension towards a terminal ileum. However, there is an expanding knowledge about etiopathogenesis, morphology and clinical presentation of IBD, which led to detailed phenotypic subclassification and defined many atypical variants. As a result, diagnosis of IBD became complex multidisciplinary process. The aim of this work is to present an overview of IBD morphology and to provide a base for histopathological diagnosis of IBD on both bioptic samples and surgical resections.
Keywords:
inflammatory bowel disease – Biopsy – Ulcerative colitis – Crohn’s disease – morphology
Authors:
Ondřej Fabián 1,2; Kateřina Kamaradová 3,4
Authors‘ workplace:
Pracoviště klinické a transplantační patologie, Institut klinické a experimentální medicíny, Praha
1; Ústav patologie a molekulární medicíny 3. LF UK a FTN, Fakultní Thomayerova nemocnice, Praha
2; AeskuLab Patologie k. s., Praha
3; Fingerlandův ústav patologie, Fakultní nemocnice Hradec Králové
4
Published in:
Čes.-slov. Patol., 58, 2022, No. 1, p. 27-37
Category:
Reviews Article
Overview
Zánětlivá střevní onemocnění (IBD) jsou skupinou chronických systémových zánětlivých chorob postihujících především trávicí trakt a patří mezi ně Crohnova choroba a ulcerózní kolitida. V případě, kdy není možné IBD blíže diagnosticky zařadit, používá se výraz neklasifikovaná IBD. Histopatologická diagnostika IBD stojí na rozpoznání chronického zánětlivého vzorce s odpovídajícím topografickým rozložením zánětu, strukturálními abnormalitami sliznice a charakteristickým složením zánětlivé celulizace. Crohnova choroba se vyznačuje kolísavým charakterem zánětu se skip lézemi, predilekčním postižením terminálního ilea a záchytem epiteloidních granulomů v biopsii. Ulcerózní kolitida vykazuje kontinuální charakter zánětu, obvykle postihuje rektum a variabilně stoupá proximálním směrem. Nicméně, stále se rozšiřující množství znalostí o etiopatogenezi, morfologii a klinické prezentaci IBD vedlo ke jejich složité fenotypické subklasifikaci a vyselektování množství atypických podtypů. Diagnostika IBD se tak stala složitým multidisciplinárním procesem. Cílem tohoto doškolovacího textu je podat ucelený přehled morfologie IBD a poskytnout tak podklad pro histopatologickou diagnostiku IBD z endoskopických biopsií i materiálu z chirurgických resekcí.
Klíčová slova:
Biopsie – ulcerózní kolitida – Zánětlivé střevní onemocnění – Crohnova choroba – morfologie
Zánětlivá střevní onemocnění (IBD) představují skupinu chronických systémových chorob s predilekcí k trávicímu traktu, mezi které řadíme Crohnovu chorobu (CD) a ulcerózní kolitidu (UC). V případě, kdy není možné IBD blíže zařadit, používá se výraz neklasifikovaná IBD (IBDU). Onemocnění se mohou manifestovat ve kterémkoli období života, nejčastěji postiženou skupinou jsou však mladí dospělí. Incidence i prevalence onemocnění celosvětově stoupá a narůstá i procento dětských pacientů. V České republice incidence dospělých IBD dosahuje 12-15/100 000 obyvatel za rok, u dětí pak necelých 10/100 000 (1,2). Narůstající množství znalostí o etiopatogenezi, morfologii a klinické prezentaci IBD vedlo ke jejich složité fenotypické subklasifikaci a vyselektování množství atypických podtypů. Diagnostika IBD se tak stala složitým multidisciplinárním procesem, postaveným především na klinické bázi a vydatně podporovaným laboratorními, radiologickými, endoskopickými a histopatologickými daty (3,4). Mikroskopie však v diagnostice IBD stále hraje významnou roli a je zásadní i pro následný terapeutický management.
Cílem tohoto doškolovacího textu je podat ucelený přehled morfologie IBD a poskytnout tak podklad pro histopatologickou diagnostiku IBD z endoskopických biopsií i materiálu z chirurgických resekcí. Pojednáno zde bude výhradně o IBD, širší histopatologická diferenciální diagnóza střevních zánětů je předmětem druhého sdělení v tomto čísle časopisu pod názvem „Fabián O, Kamarádová K. Histopatologická diagnostika kolitid: diferenciálně - diagnostický přístup a interpretace.“
ODBĚR A ZPRACOVÁNÍ BIOPTICKÉHO MATERIÁLU
Jak již bylo zmíněno v úvodu, diagnostika IBD je multidisciplinární záležitostí a finální diagnóza je klinická. Histopatologie představuje jen jednu z řady diagnostických modalit a validní histopatologický závěr se neobejde bez pečlivé klinicko-patologické korelace s anamnézou pacienta, jeho endoskopickým nálezem, výsledky mikrobiologického vyšetření, laboratorním nálezem, nálezem na zobrazovacích vyšetřeních a někdy i genetickým vyšetřením. Důležité je znát i klinicky zvažovanou diagnózu nebo přinejmenším diferenciálně-diagnostickou rozvahu. Endoskopický odběr biopsií by měl zahrnovat přinejmenším dva vzorky z minimálně šesti etáží střeva, mezi které by měl vždy patřit odběr z terminálního ilea a rekta. Odběr by měl cílit na postižená místa i okrsky endoskopicky normální sliznice. V případě slizničních defektů by měl být odběr proveden z okraje defektu se zastiženým přechodem do neporušené sliznice, nikoliv z jeho centra (výjimku tvoří odběr na průkaz cytomegaloviru). U pacientů s akutní závažnou kolitidou (viz dále) by měl být v rámci rektosigmoideoskopie odebrán alespoň jeden vzorek k posouzení mikroskopické intenzity zánětu a případnému vyloučení konkomitantní cytomegalovirové infekce. Pro potřeby diagnostiky IBD je dostačující základní histologické barvení hematoxylinem a eosinem s důkladným prokrájením vzorku, doporučováno je zhotovení pěti a více řezů ve 2-3 úrovních (5-8). Jakékoliv specializovanější histologické techniky (například imunohistochemie) nejsou doposud součástí rutinní bioptické praxe.
Bioptický závěr by měl zahrnovat diagnostickou rozvahu, informaci o aktuální intenzitě a známkách aktivity zánětu (přítomnosti neutrofilů a slizničních defektů) a posouzení případných dysplastických změn. Materiál z chirurgických resekcí (např. ileocékálních resekátů) by měl být pečlivě makroskopicky posouzen a popsán. Optimální počet vzorků odebraných k mikroskopickému vyšetření dosud nebyl stanoven, odběr by měl každopádně cílit na jakékoliv makroskopicky viditelné léze i úseky normálně vyhlížející sliznice. Vyšetřeno by mělo být vždy tenké i tlusté střevo, apendix a lymfatické uzliny (6). Nezbytnou součástí je i vyšetření proximálního a distálního resekčního okraje s popisem tíže zánětlivého postižení a případně i dalších histopatologických změn, jejichž přítomnost v resekčních okrajích má prediktivní význam stran rozvoje případných komplikací (např. myenterická plexitida) (9).
MAKROSKOPICKÝ OBRAZ IBD
Crohnova choroba
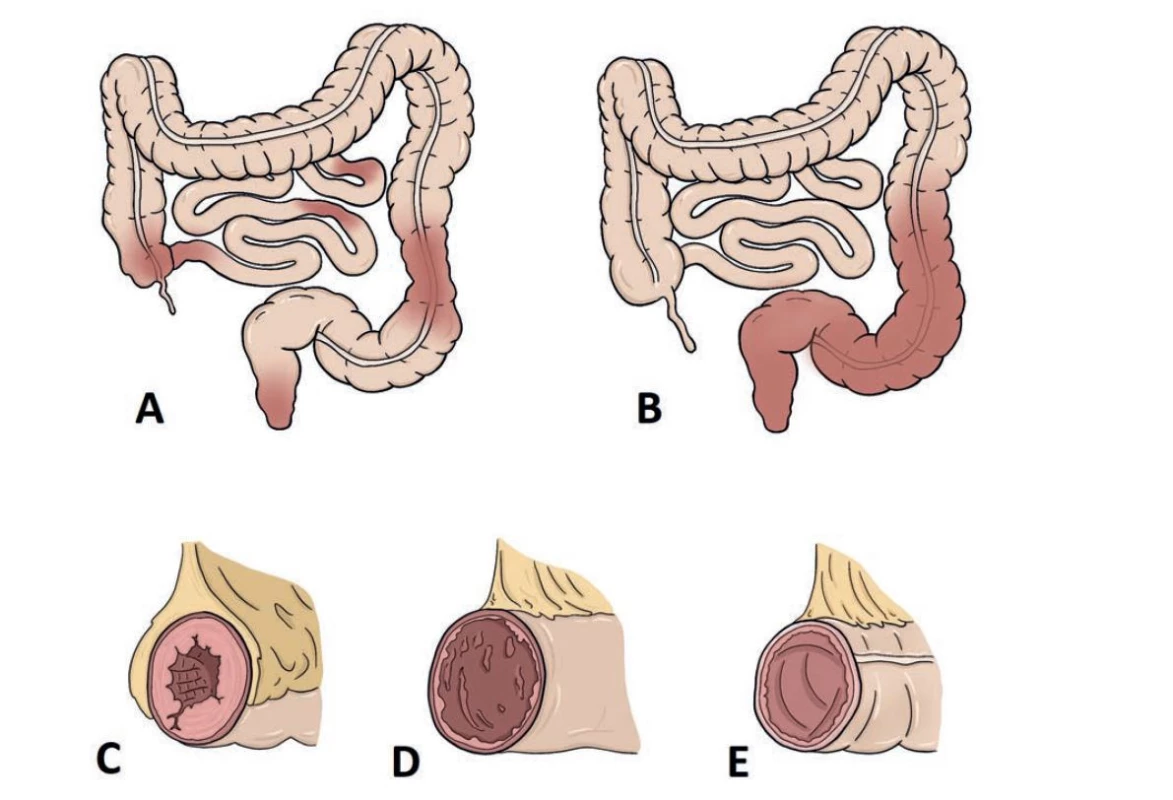
Základní makroskopické rozdíly mezi CD a UC shrnuje tab. 1 a obr. 1-3. Pro CD je charakteristický kolísavý charakter zánětu. V endoskopickém obrazu jsou přítomny skip léze neboli okrsky zánětlivě změněné sliznice oddělené úseky sliznice normálního vzhledu. Predilekční lokalizací CD je terminální ileum a proximální tlusté střevo, následované perianální lokalizací. Postižený však může být jakýkoliv úsek sliznice trávicího traktu včetně dutiny ústní. Až ve 20 % případů bývá tlusté střevo postiženo izolovaně (6). Slizniční defekty se objevují nejprve jako tzv. aftózní léze, což jsou drobné okrouhlé slizniční defekty, často lokalizované nad lymfatickým folikulem, obvykle v průběhu úponu mezenteria (10). Léze postupně splývají a vytvářejí větší ulcerace, které v případě CD bývají hluboké a plazivé. Často jsou ve stejnou dobu přítomny slizniční defekty různých tvarů i velikosti a povrch sliznice tak mívá heterogenní charakter (11). Kombinace podélných a příčných plazivých ulcerací v kombinaci s vícečetnými zánětlivými polypy vytváří obraz tzv. dlažebních kostek neboli kočičích hlav, který nacházíme zejména v terminálním ileu. Polypy jsou většinou drobné, mohou se však vyskytnout i obří formy (tzv. obří zánětlivá polypóza), které jsou pro CD poměrně charakteristické. Oproti tomu, tenké prstovité (filiformní) polypy nacházíme častěji u UC (11). Dalším charakteristickým nálezem jsou hluboké fisury, které mohou zasahovat až do mezenteria a někdy mohou i perforovat a vést k rozvoji peritonitidy, mezikličkových abscesů či vytvářet píštěle do jiných částí střeva nebo do urogenitálního traktu. Zánět má transmurální charakter, což spolu s fibroprodukcí v okolí píštělí vede k tvorbě jizevnatých striktur (6,11). Dalším častým nálezem je perianální postižení v podobě recidivujících perianálních abscesů, chronických análních fisur či objemných a zánětlivě změněných perianálních fibroepiteliálních výrůstků (skin tags) (12). V resekčním bioptickém materiálu nebo v průběhu chirurgických výkonů lze u pacientů s CD pozorovat i další známky trasmurality zánětu jako je fibrinózní peritonitida, která se postupem času může organizovat ve vazivové adheze (6). Někdy vidíme přerůstání serózního povrchu střeva tukovou tkání (tzv. fat wrapping neboli creeping fat), který se taktéž objevuje nejčastěji v oblasti terminálního ilea. Z definice musí tuk přerůstat alespoň 50 % obvodu střevní kličky (6). Fat wrapping je velmi užitečným diagnostickým znakem CD. Přichází i u některých jiných onemocnění jako např. segmentální kolitida asociovaná s divertikulózou, ale prakticky nikdy jej nevídáme u UC (13,14). V době ileocékální resekce bývá přítomný až u 75 % pacientů (11).
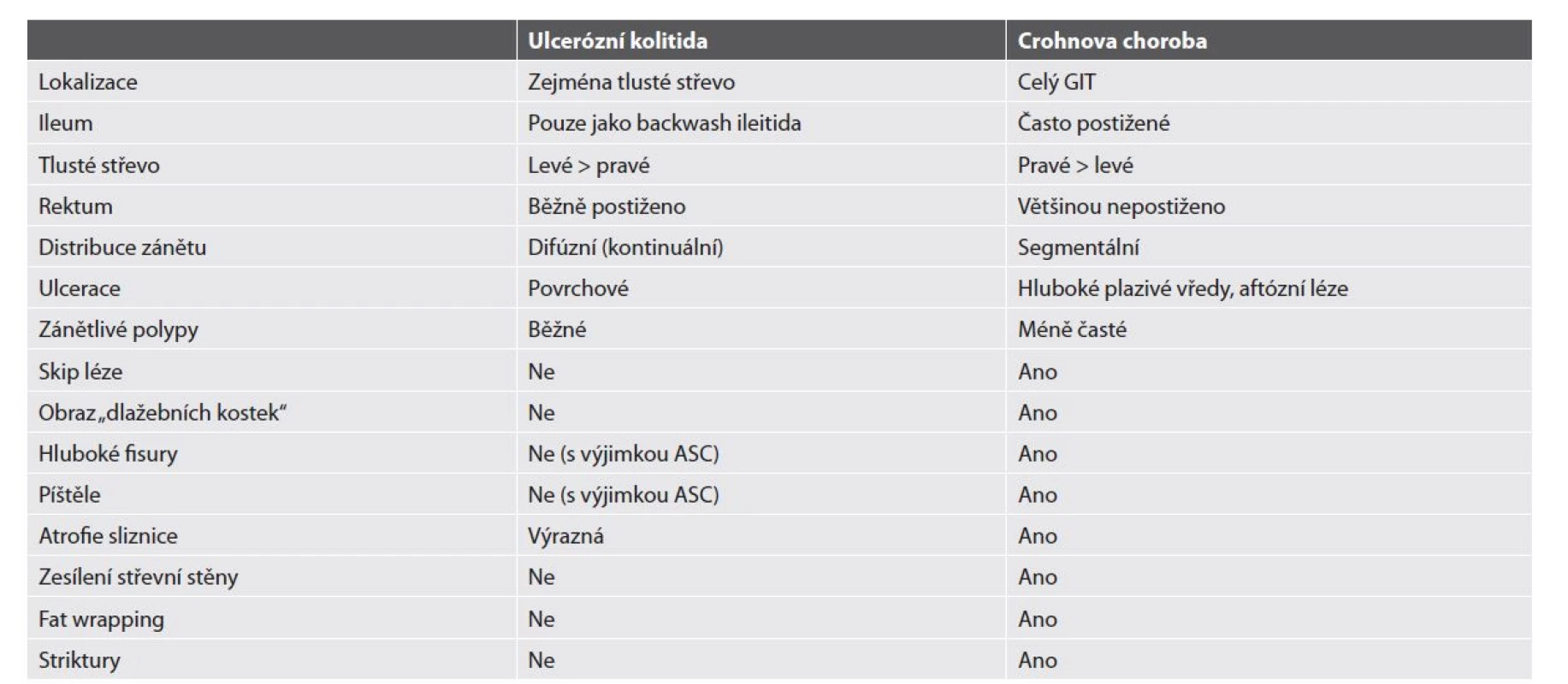
A: Crohnova choroba je segmentální onemocnění postihující kteroukoliv část trávicí trubice a jevící predilekci k terminálnímu ileu.
B: Ulcerózní kolitida je onemocnění obvykle postihující rektum a kontinuálně stoupající proximálním směrem.
C: Postižení střeva u Crohnovy choroby mívá transmurální charakter s tendencí ke tvorbě jizevnatých striktur a hlubokých fisur.
D: Ulcerózní kolitida zůstává obvykle omezená pouze na sliznici a při vyšší aktivitě zánětu tvoří plošné ulcerace někdy až geografického
charakteru. V pozdních stádiích dochází k fibrotizaci sliznice a vymizení haustrace, striktury však nejsou pro ulcerózní
kolitidu typické.
E: Normální tlusté střevo.
Ulcerózní kolitida
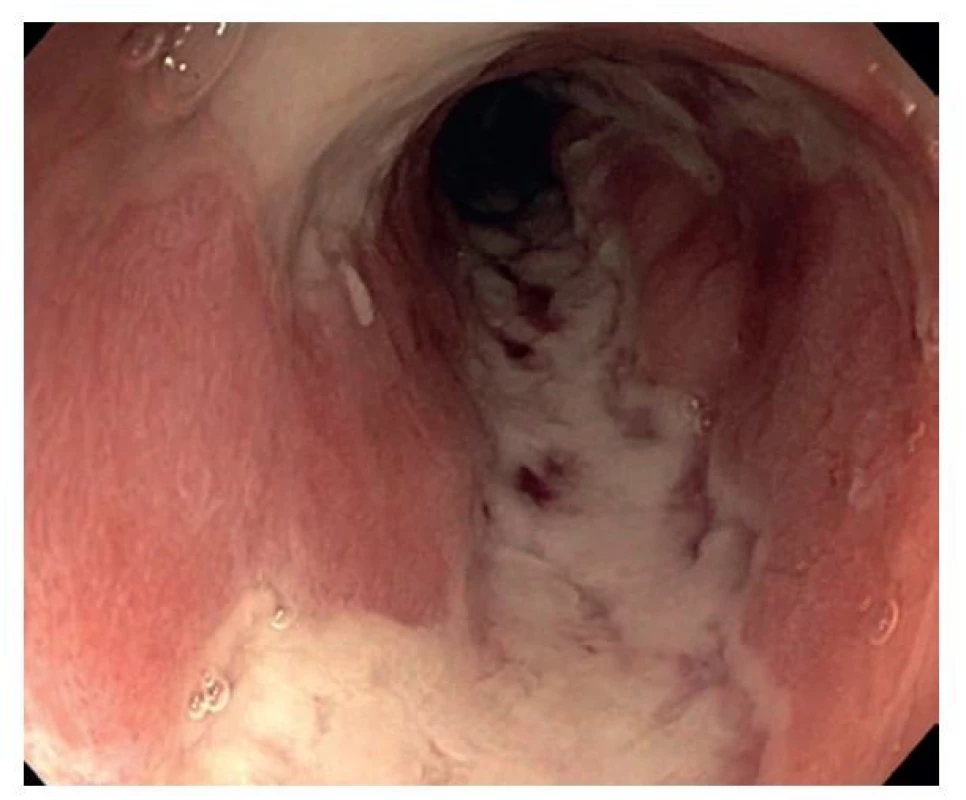
Zánět u neléčené UC má kontinuální charakter začínající od análního okraje a stoupající variabilně proximálním směrem, přičemž intenzita zánětlivých změn postupně klesá. Přechod mezi postiženou a nepostiženou sliznicí zdaleka ne vždy bývá ostrý, mnohdy je spíš postupný. Zánětlivě změněná sliznice bývá překrvená, kyprá, fragilní, granulární a často pokrytá fibrinem a hnisem. Pokud jsou přítomny ulcerace, bývají mělké, plošné, často splývající až geografické, někdy podminovávající přilehlou vitální sliznici. V případně intenzivní kolitidy bývá častá přítomnost zánětlivých polypů (6). Obvykle jsou menší a mnohočetné, někdy mohou být i větší a mít filiformní charakter. Jak již bylo zmíněno výše, filiformní polypóza je na rozdíl od obří zánětlivé polypózy typičtější pro UC. Polypy bývají lokalizovány především v sigmoideu a colon descendens, v rektu jsou vzácné. Seróza může být překrvená. Ve fázi remise se sliznice postupně normalizuje. Hojení často bývá nerovnoměrně rozloženo a může tak imitovat kolísavý charakter postižení u CD. V závažnějších případech u pacientů s dlouhotrvající intenzivní kolitidou se sliznice hojí difúzní fibrotizací a celé střevo je pak zkrácené, zúžené a s vymizelou haustrací (6,11). Striktury nebývají pro UC typické, jejich přítomnost u pacientů s UC by tak měla vždy vést k podezření na karcinom (15). Asi u 20 % pacientů zánět přesahuje i do terminálního ilea jako tzv. backwash ileitida (BI). Koncept BI nicméně v průběhu let prošel řadou změn. V současné době totiž nejenom CD, ale i UC chápeme jako systémové zánětlivé onemocnění, které může postihnout kteroukoliv část trávicí trubice. BI tak podle některých prací (16) nemusí nutně představovat jen jakýsi přesah zánětu z céka do přilehlého terminálního ilea, ale může se jednat o primární manifestaci UC v této lokalitě. Autoři tak namísto BI navrhují výraz UC-asociovaná terminální ileitida. Tato změna pohledu na etiopatogenezu BI má i určité praktické dopady. Pokud by se skutečně jednalo o pouhý přesah zánětu z céka, měl by na BI navazovat v céku zánět přinejmenším stejné, ne-li vyšší intenzity. Jelikož se však UC může manifestovat v terminálním ileu i primárně, není tato kontinuita již natolik zásadní a odlišení BI od terminální ileitidy při CD se řídí jinými, spolehlivějšími znaky jako jsou striktury, fisury, obraz kočičích hlav, transmurální charakter zánětu či nález epiteloidních granulomů v histologii. V některých případech může UC vykazovat i skip léze, a to v podobě rektum šetřící UC, tzv. cecal patch a UC apendicitidy. V případě rektum šetřící UC zůstává sliznice konečníku endoskopicky nepostižena nebo jsou patrny jen velmi mírné zánětlivé změny. Tento typ je typický spíše pro děti, kdy jej nacházíme až u 30 % dětí s neléčenou UC (17,18). U dospělých pacientů se s ním setkáváme obvykle jen při léčbě, často topickými steroidy (19). Cecal patch je okrsek zánětlivě změněné sliznice v okolí ústí apendixu u pacientů s levostrannou kolitidou, který někdy bývá mylně zaměněn za skip lézi u CD (20). UC apendicitidu pak nacházíme u více než poloviny pacientů s UC (8).
MIKROSKOPICKÝ OBRAZ IBD
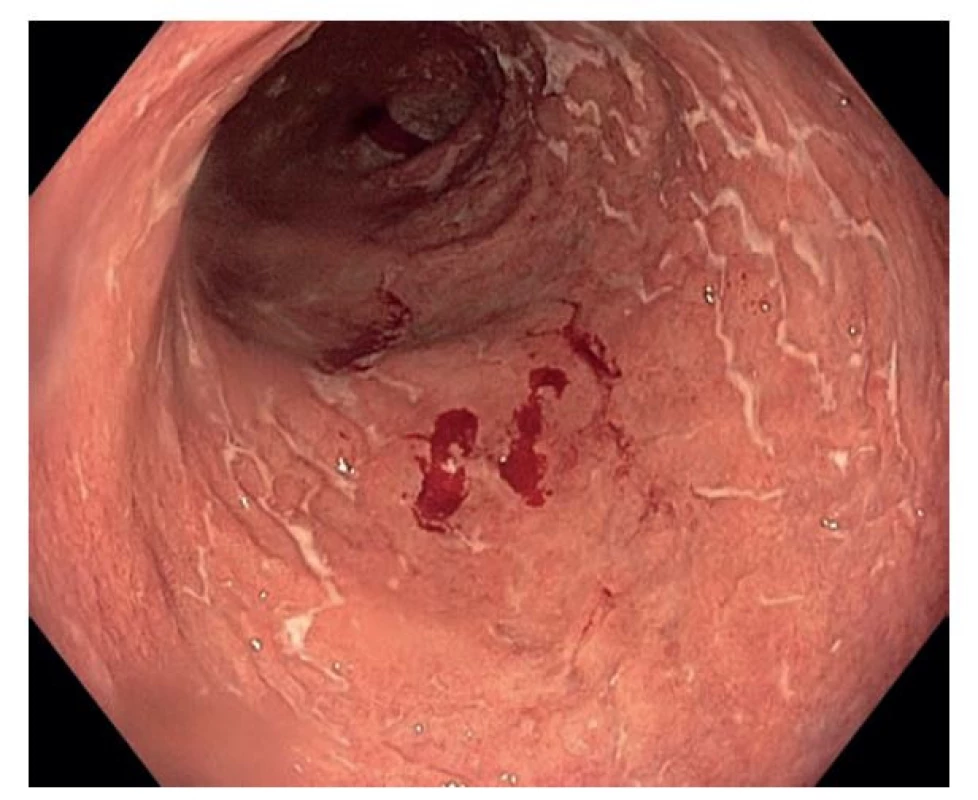
Histopatologická diferenciální diagnostika IBD je široká a je o ní pojednáno v doškolovacím článku „Fabián O, Kamarádová K. Histopatologická diagnostika kolitid: diferenciálně-diagnostický přístup a interpretace.“ V této práci se zaměříme výhradně na mikroskopický obraz IBD. Histopatologický obraz IBD v akutní fázi má nepříznačnou morfologii a nelze ho spolehlivě odlišit od infekční příčiny. I z toho důvodu až 30 % pacientů s obrazem akutní self-limited kolitidy postupem času rozvine IBD (21). V chronické fázi pak histopatologický obraz IBD odpovídá morfologickému vzorci chronické aktivní či neaktivní kolitidy s převážně lymfoplazmocytární zánětlivou celulizací v lamina propria, často i s příměsí početných eosinofilů. V případě aktivity zánětu jsou v menší míře zastoupeny i neutrofily. Ty se zprvu objevují v lamina propria a s narůstající aktivitou onemocnění začínají prostupovat nejprve do povrchového epitelu sliznice, později do výstelky Lieberkühnových krypt v obrazu kryptitidy a nakonec dojde k destrukci kryptové výstelky a exsudaci neutrofilů do jejího lumen s tvorbou tzv. kryptových pseudoabscesů. Přítomnost kryptitidy a kryptových pseudoabscesů tak odráží spíše míru aktivity zánětu a není pro IBD nijak diagnostická. Epitel obvykle vykazuje regresivní změny, jejichž tíže se odvíjí od míry aktivity zánětu. Epitel ztrácí hlenotvorbu, což lze pozorovat jako úbytek počtu pohárkových buněk nebo snížení množství hlenu v nich. Epitelie se postupně oplošťují, začínají se odlučovat od bazální membrány, a nakonec dochází k tvorbě slizničních defektů. Často jsou přítomny i metaplastické změny, většinou v podobě metaplázie Panethových buněk, která představuje zcela obecný znak chronicity a na rozdíl od metaplázie pylorické (viz níže) není nikterak nápomocná v rozlišení CD a UC (6).
Pozorovat lze i další známky chronicity v podobě fibrotizace, novotvorby lymfatických agregátů, a především pak poruchy architektoniky sliznice. Tou rozumíme jakékoliv narušení původního pravidelného uspořádání slizničních krypt. Krypty mohou být větvené, nepravidelně probíhající, dilatované či atrofické. Větvení krypt je známkou jejich regenerace a za patologické je považováno větvení více než 10 % krypt nebo přítomnost více než dvou větvených krypt ve vzorku, který je adekvátně orientovaný a je v něm zastiženo alespoň 2 mm muscularis mucosae (22). Atrofie krypt pak znamená jejich zkrácení a rozšíření prostoru mezi jejich bázemi a hranicí muscularis mucosae (22). Nepravidelným průběhem krypt se pak rozumí stav, kdy krypty nejsou uspořádány paralelně a vzdálenost mezi nimi není konstantní (6). Porucha architektoniky, ač není přímo 100% patognomická, je pro IBD velmi typická a u jiných onemocnění (zejména chronických infekcí) ji pozorujeme méně často (7).
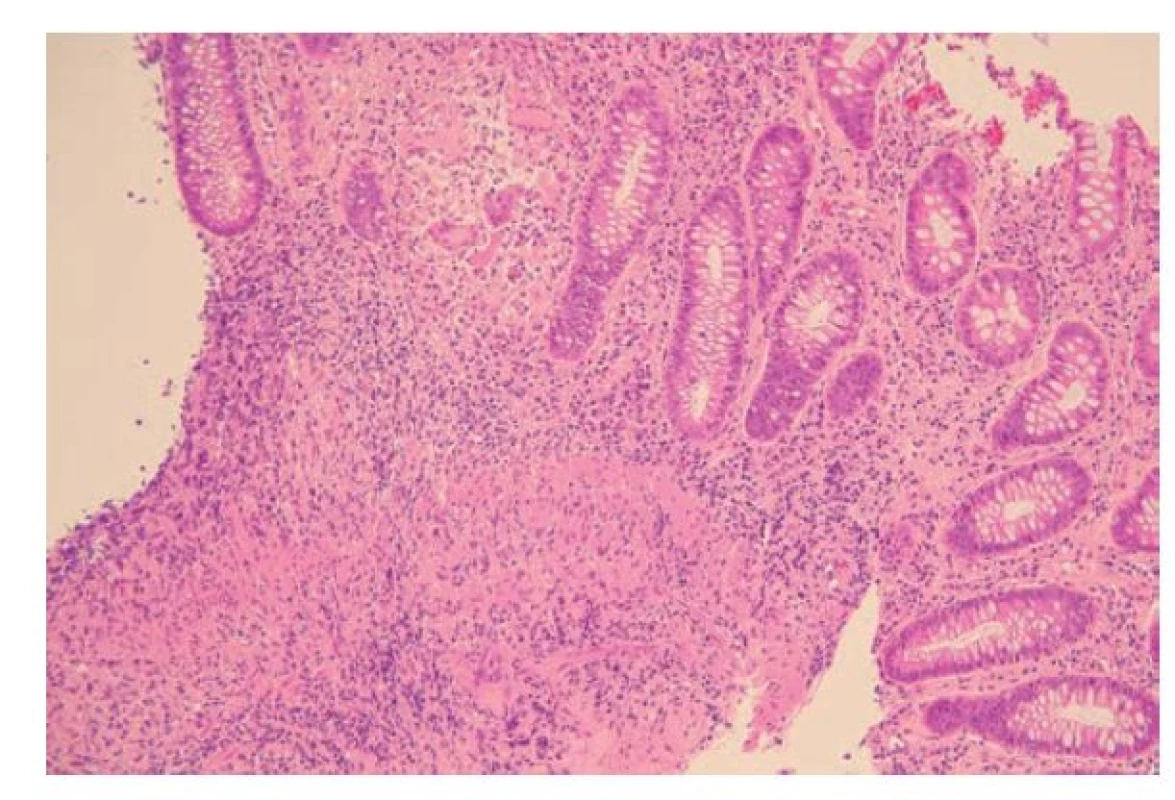
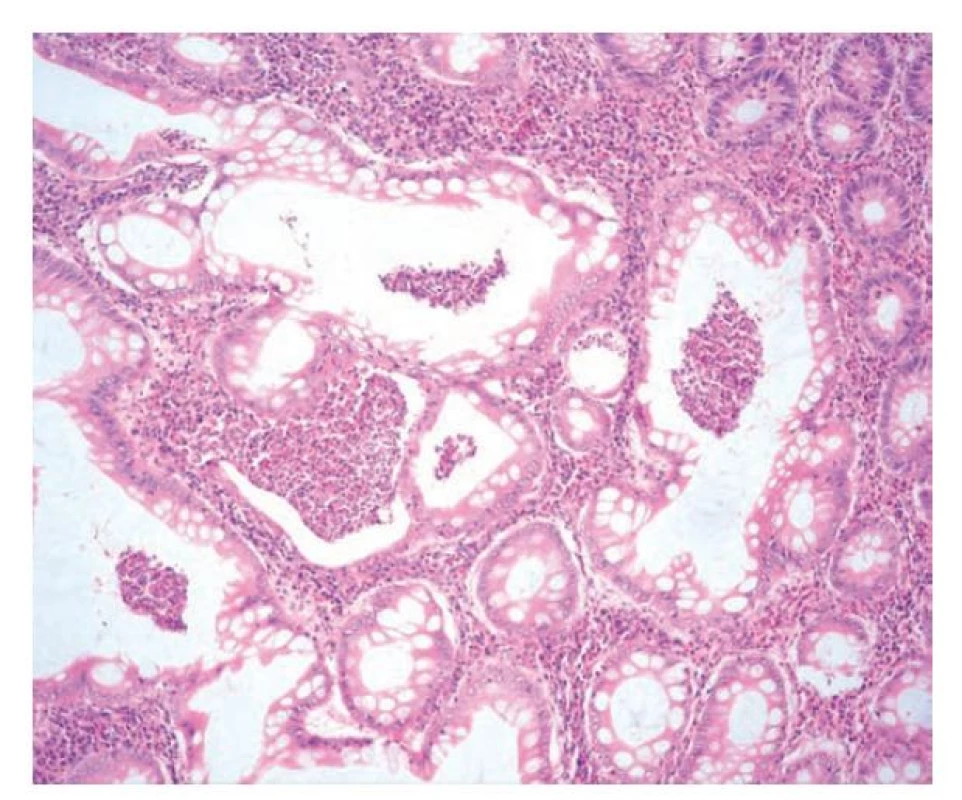
Dalším charakteristickým znakem IBD je bazální plazmocytóza (obr. 4). Za fyziologického stavu a u jiných střevních zánětlivých onemocnění se plazmatické buňky drží v povrchových vrstvách lamina propria a směrem k bázi sliznice jejich počet klesá. Pakliže je tento gradient narušen a nacházíme početnější plazmatické buňky i těsně nad lamina muscularis mucosae, mluvíme o bazální plazmocytóze. Ta představuje znak velmi typický pro IBD a zároveň jde nejspíš o nejčasnější projev chronicity, který se může objevit již 14 dní po vypuknutí choroby (7, 23,24). Bazální plazmocytózu lze podle některých prací detekovat až u 50 % pacientů dva týdny po vypuknutí symptomů a až u 80 % pacientů měsíc po primomanifestaci (11). Nejprve se objevuje fokálně, s postupem času se její přítomnost stává difúzní. Záchyt bazální plazmocytózy u pacientů v endoskopické remisi je nezávislým prediktorem rekurence onemocnění (25).
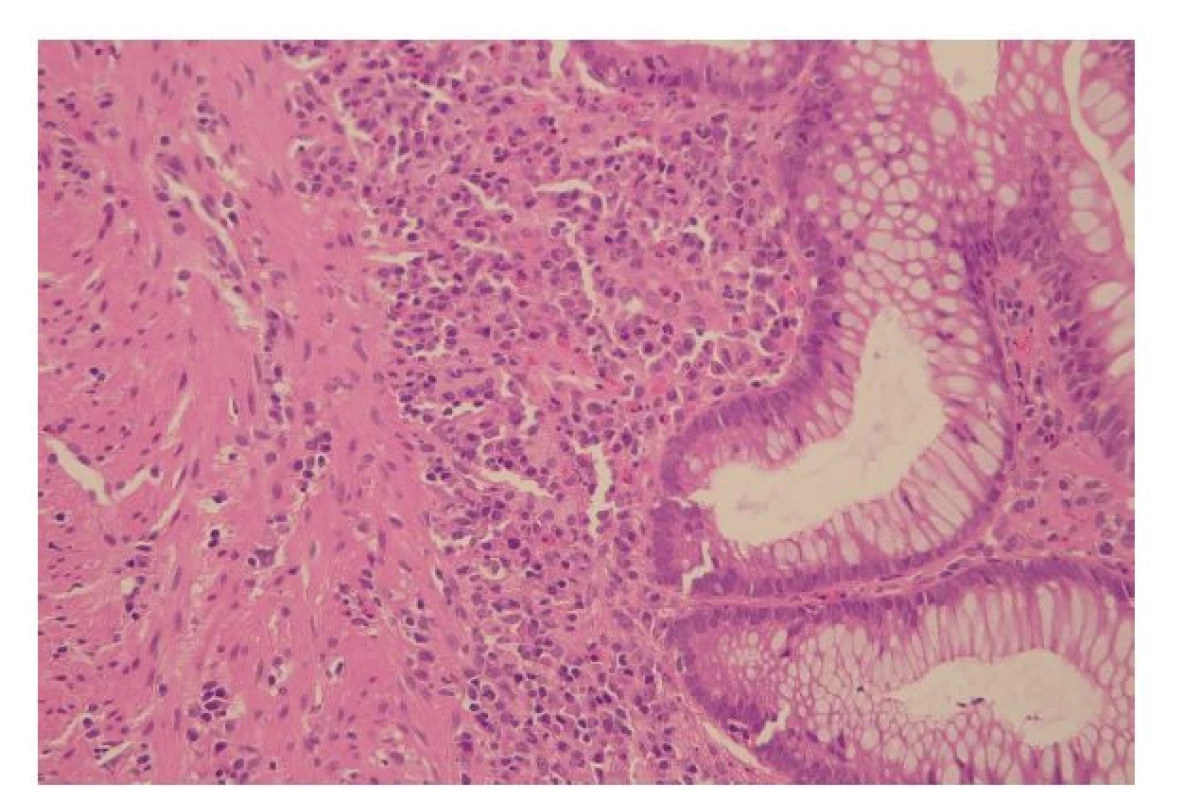
Crohnova choroba
Diferenciální diagnóza CD a UC se opírá o záchyt charakteristických CD znaků (tab. 2, obr. 5-8). UC je tak negativní diagnózou, založenou na absenci znaků typických pro CD a vyloučení jiných příčin onemocnění. Pro CD je typický diskontinuální charakter zánětu, který kolísá nejenom na endoskopické, ale i mikroskopické úrovni (6). Zánět může být zcela ložiskový, v podobě ohraničených chronických zánětlivých infiltrátů na jinak nezánětlivém pozadí (v angličtině označovaný výrazem „focal“), nebo mít difúzní charakter, ale s kolísající intenzitou a aktivitou (v angličtině označovaný jako „patchy“). Za ložiskový zánět by neměly být považovány lymfatické agregáty, které jsou ve sliznici běžným nálezem (6). V případě aktivity zánětu i ta vykazuje ložiskový charakter, s fokálním výskytem kryptitidy a kryptových pseudoabscesů, které se střídají s okrsky chronického zánětu bez aktivity (26). Ložisková bývá i deplece hlenotvorby a především pak porucha architektoniky sliznice, která se zdá být silnějším indikátorem CD než kolísání zánětlivé celulizace, protože svědčí pro dlouhotrvající segmentální charakter onemocnění (6,26).
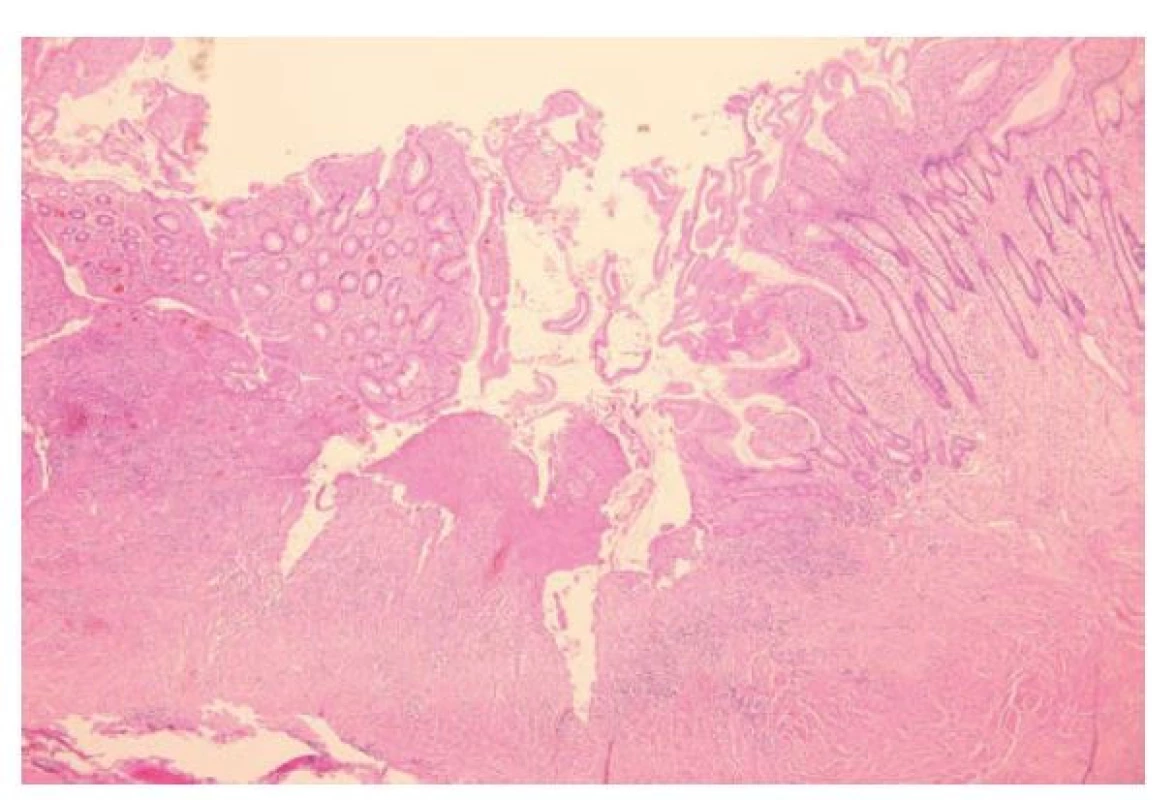
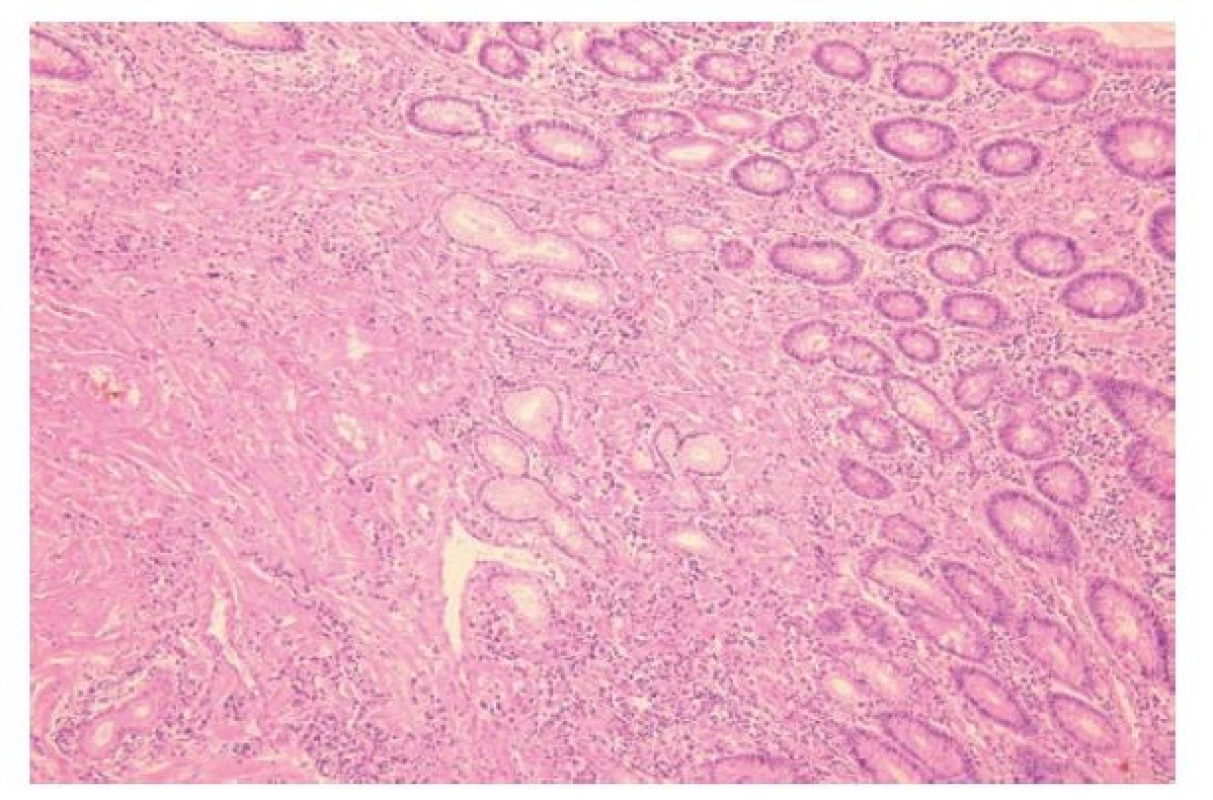
Slizniční defekty bývají v případě CD rozmanité a byly popsány ve stati pojednávající o makroskopii CD. Jedná se zejména o aftózní léze, plazivé ulcerace a fisury. Někdy lze zastihnout i časnější defekty, které jde posoudit spíše na mikroskopické úrovni. Patří mezi ně slizniční mikroulcerace, definované jako mělké defekty se ztrátou 1-6 povrchových epitelií, nebo drobné defekty na dně slizničních krypt s neutrofily tryskajícími do jejich lumen (tzv. mountain peak ulcers) (11,27). Nicméně, žádný z těchto časných defektů nemá zásadní diagnostický přínos, spolehlivějšími CD znaky jsou až aftózní léze a pokročilejší defekty jako plazivé ulcerace a fisury (11).
Zcela charakteristickým znakem CD jsou pak epiteloidní granulomy bez nekróz. Ačkoliv je diferenciální diagnóza granulomatózních zánětů trávicího traktu velmi široká a zdaleka se neomezuje jen na CD, nález epiteloidních granulomů bez nekróz u pacientů s IBD vylučuje diagnózu UC. Epiteloidní granulom je definován jako kolekce alespoň pěti epiteloidních makrofágů (22). V případě CD bývají variabilní velikosti, dobře i vágně formované, často s přítomností mnohojaderných buněk. Nekrózy v případě CD nejsou typické. Odlišit je nutné granulomy z cizích těles v reakci na rupturu krypty nebo sterkorální materiál na spodině slizničních defektů (tzv. kryptolytické a koprofagické granulomy), které nejsou pro CD specifické (28). Incidence epiteloidních granulomů je u CD variabilní a podle různých prací kolísá mezi 15-85 % případů (11). Nejčastěji se vyskytují v submukóze, ale postihnout mohou kteroukoliv vrstvu střevní stěny i spádové lymfatické uzliny. Vzácně se epiteloidní granulomy mohou vyskytovat i v extraintestinálních lokalizacích (11). Jsou asociovány s častějším výskytem ileokolických forem CD nebo forem s postižením horního trávicího traktu (29) a jsou nezávislým indikátorem agresivnějšího klinického průběhu s vyšším rizikem chirurgického zákroku (30,31). Od granulomů je vhodné odlišit mikrogranulomy, které jsou celkově menší a tvořené makrofágy, které nemají epiteloidní morfologii. Celkový počet makrofágů v mikrogranulomu je nižší (v průměru 7-18 buněk proti 25-90 buňkám v klasickém epiteloidním granulomu), zatímco počet okolních lymfocytů je srovnatelný. Většinou jsou lokalizovány v superficiální lamina propria. Nacházíme je asi u 12-24 % pacientů s CD, častěji v případech neaktivního onemocnění a jejich klinický význam je nejasný (11,32).
Zánět se v případě CD šíří i do hlubších vrstev střevní stěny. Prostup do submukózy by neměl být přeceňován, běžně jej vídáme i u floridní UC s vyšší aktivitou zánětu. V případě CD má však zánět tendenci k transmurálnímu prostupu, často až na serózní povrch. V resekčním materiálu tak lze pozorovat i změny na hlubších strukturách jako je autonomní nervový systém nebo větší cévy, transmurální fibrózu či známky serozitidy. Změny na enterálním nervovém systému jsou rozmanité a postihují nervová vlákna i gangliové buňky. Častá bývá neuronální hyperplázie a hypertrofie, kterou lze pozorovat především v submukóze. Ve sliznici je hyperplázie nervových vláken přítomná taky, málokdy však bývá viditelná v přehledném barvení hematoxlinem a eosinem. V myenterickém plexu často bývá zánět (myenterická plexitida) a někdy i epiteloidní granulomy (33). Cévní léze jsou představovány fibrointimální hyperplázií a hypertrofií tunica media. Někdy může být přítomna i granulomatózní vaskulitida. Změny na lymfatických cévách jsou obvykle představovány lymfangiektáziemi v submukóze, vzácně se může vyskytnout i granulomatózní lymfangiitida (34,35). Chronický transmurální zánět je následovaný jizvením, které vede k tvorbě jizevnatých striktur. Ty jsou obvykle doprovázeny i hypertrofií muscularis mucosae a propriae. V submukóze se mohou nacházet novotvořené ostrůvky hladkosvalových buněk a myofibroblastů, které někdy mohou vytvářet i můstky mezi dvěma vrstvami svaloviny (36,37).
Dalším nápomocným znakem je pylorická metaplázie. Ta se objevuje obvykle v terminálním ileu představuje reakci na dlouhotrvající závažnější poškození sliznice. Není tak nápomocná v odlišení CD od jiných onemocnění, které se také mohou prezentovat intenzivní terminální ileitidou (např. yersinióza nebo intestinální tuberkulóza), ale bývá velmi vzácná u pacientů s UC. V bioptických vzorcích ji u pacientů s UC nenacházíme téměř nikdy, v případě CD bývá popisována ve 2-27 %. V resekčním materiálu ileocékálních resekátů je pak velmi častá, v resekátech pankolektomií u pacientů s UC ji vídáme vzácně a jen v případech těžké floridní pankolitidy s ulceracemi (38-40). Diagnózu CD podporuje i transmurální výskyt lymfatických folikulů. Pokud jsou transmurální folikuly zastiženy v návaznosti na ulceraci, je jejich diskriminační přínos slabý, ale v případě jejich nálezu mimo defekty jsou velmi silným indikátorem CD (41).
Histopatologická diagnóza CD by neměla být stanovena na základě nálezu pouze jednoho CD znaku. Za dostačující pro diagnózu CD je obvykle považován nález epiteloidního granulomu a jednoho dalšího typického znaku (obvykle poruchy architektoniky sliznice) (42). V případě absence epiteloidního granulomů se za dostačující považuje 3 a více pozitivních znaků při současném vyloučení specifických infekcí (7,11).
Superficiální (UC-like) Crohnova choroba
Superficiální Crohnova choroba je atypickou variantou CD, u které je zánět omezen na sliznici a submukózu, ale jinak vykazuje typické rysy CD jako segmentální charakter, perianální postižení nebo epiteloidní granulomy. Z logiky věci tak vyplývá, že diagnóza by měla být stanovena pouze z resekčního materiálu, u kterého lze zhodnotit celou tloušťku střevní stěny, a měla by být rezervována jen pro pacienty s jinak přesvědčivou diagnózou CD. Z klinického pohledu jde o mladší pacienty s vyšší prevalencí levostranné kolitidy v porovnání s „konvenční“ CD (43).
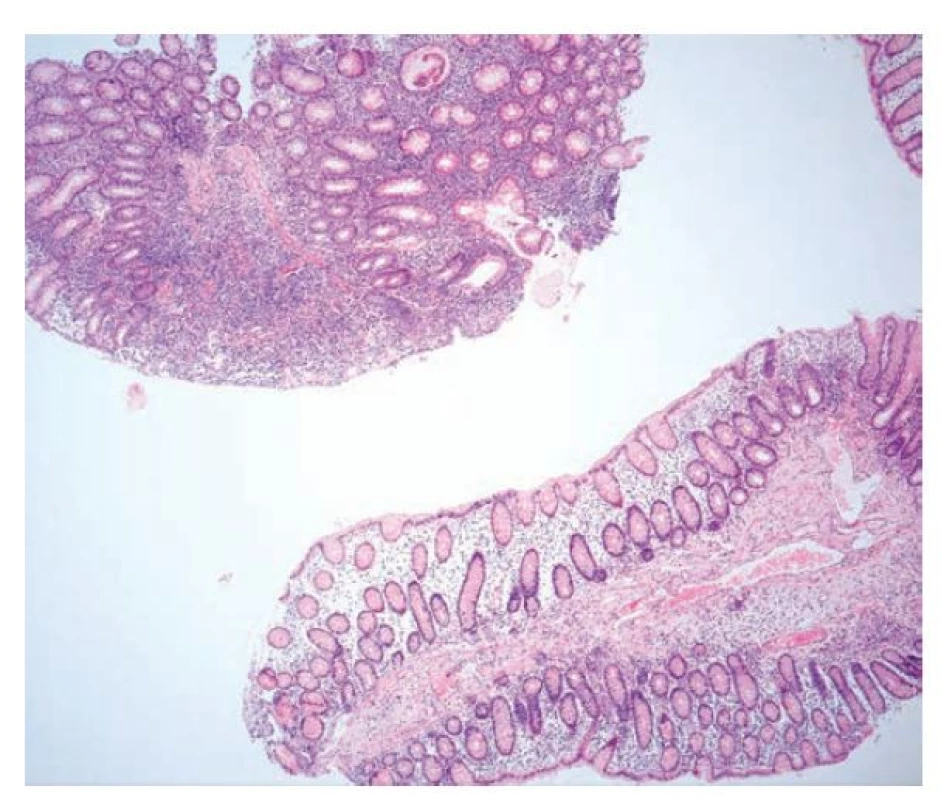
Ulcerózní kolitida
Jak již bylo zmíněno výše, UC je diagnóza z vyloučení, postavená na typickém morfologickém obrazu IBD a nepřítomnosti CD znaků. Charakterizuje ji, obdobně jako v endoskopii, kontinuální a rovnoměrně rozložený zánět, který obvykle zůstává omezený pouze na sliznici. V případě intenzivního zánětu s přítomností slizničních defektů může pronikat i do submukózy, transmuralita zánětu však pro UC není typická. Kryptové pseudoabscesy pro UC sice nejsou diagnostické, bývají zde však častější než u pacientů s CD (cca 40 % pacientů oproti 19 %) (22) (obr. 9,10). Nápomocný může být i charakter poruchy slizniční architektoniky. Ta se, kromě standardního obrazu defigurace krypt s jejich atypickým průběhem, větvením a atrofií, může prezentovat i viliformním reliéfem sliznice s tvorbou slizničních záhybů a nízkých klků a připomínat tak sliznici tenkého střeva. Nález bývá připodobňován obrazu duodenální sliznice u pacientů s céliakií grade 3b dle Marshe-Oberhubera. Viliformní architektonika sliznice je pro UC poměrně typická a vídáme ji častěji než u CD (17-30 % případů oproti 12 %) (6).
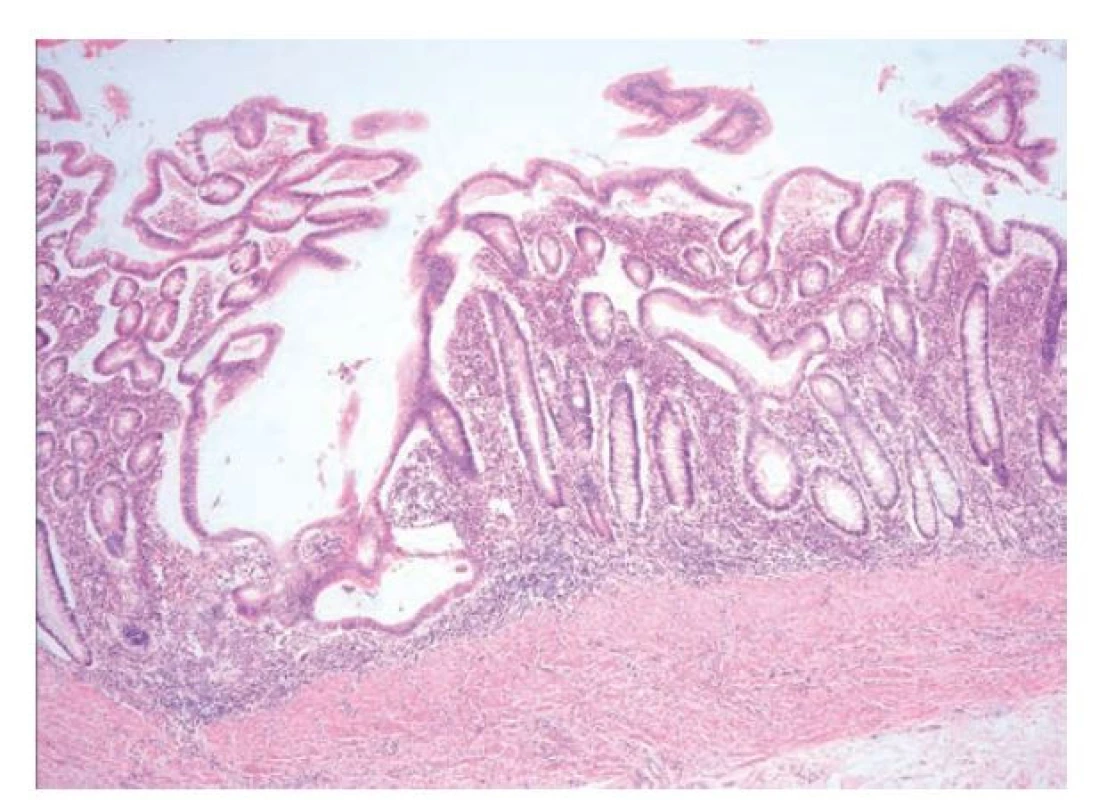
Důležité je mít na paměti, že dlouhodobá terapie mikroskopický obraz IBD výrazně modifikuje a často v bývají v bioptickém obrazu přítomny jen reziduální chronické zánětlivé změny. Označit takovýto nález za nepříznačný nebo za „mírnou chronickou necharakteristickou kolitidu“ by pro klinického lékaře bylo zavádějící, protože by mohlo znít jako zpochybnění původní diagnózy, která je v tomto případě pouze modifikována terapií. V případě UC pak terapie může vyvolat změny, které mohou připomínat CD a neměly by svádět k překlasifikování choroby. Charakter zánětu u léčené UC bývá kolísavý a diskontinuální a až u 1/3 pacientů dochází k vymizení zánětu v oblasti rekta (19,44,45). Klinický údaj o předchozí terapii je tak pro patologa naprosto zásadní.
POUCHITIDA
Pouchitida je zánět ileálního pouche u pacientů s UC po proktokolektomii s následnou ileopouch-anální anastomózou. Je považována za primární idiopatický zánět neorektální ileální sliznice, nikoli o rekurenci základního onemocnění (46). Objevuje se u cca 20 % pacientů s pouchem a její průběh může být akutní i chronický (47). Z histopatologického pohledu je pouchitida definována aktivním zánětem neorektální sliznice. Chronické zánětlivé změny variabilní intenzity bez známek aktivity jsou totiž v oblasti pouche běžným nálezem. Obvykle bývají doprovázeny změnami architektoniky ileální sliznice s atrofií klků a defigurací krypt. Postupem času dochází až k úplnému vyhlazení klků a sliznice tak může být mikroskopicky neodlišitelná od tlustého střeva (tzv. „kolická metaplázie“). V případě pouchitidy se ve sliznici objevují neutrofily, nejprve v lamina propria, s narůstající aktivitou zánětu pak i v epitelu v podobě kryptitidy, kryptových pseudoabscesů a někdy i slizničních defektů. S přechodem do chronicity pak pouchitida často vykazuje CD-like znaky v podobě transmurálního zánětu, fisur, pylorické metaplázie, transmurálního výskytu lymfoidních agregátů a někdy i epiteloidních granulomů (6). Čistě na základě mikroskopie tak CD a UC v oblasti pouche není možné rozlišit. Případná změna původní diagnózy by se měla opírat o zpětnou revizi resekčního materiálu z kolektomie, případně bioptický odběr jiných částí trávicí trubice. Zvýšená opatrnost by v tomto měla platit u dětí s ohledem na vyšší prevalenci postižení horního trávicího traktu u pediatrické UC (48).
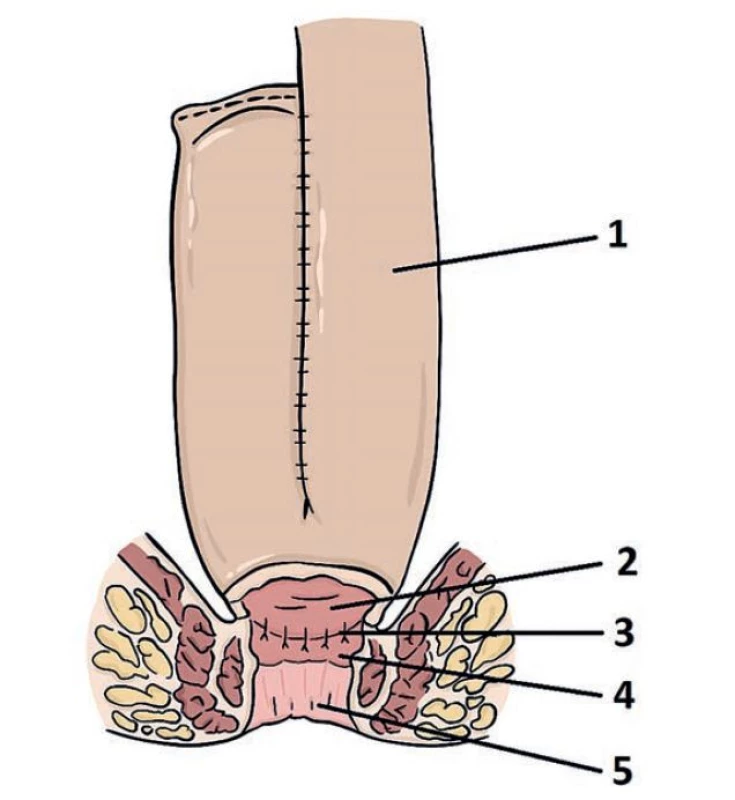
V některých případech pacienti rozvinou zánětlivé změny ve sliznici tenkého střeva proximálně od pouche, případně v krátkém úseku kolické sliznice mezi pouchem a anální přechodní zónou (který nazýváme zánětem rektální manžety neboli „cuffitidou“). Zánět v těchto místech už může být projevem základní choroby a platí pro něj standardní histopatologická kritéria pro diagnózu CD a UC (49). Je tedy zřejmé, že validní diagnostický závěr u těchto pacientů není možný bez klinického údaje o přesné lokalitě odběru (obr. 11).
1) aferentní klička tenkého střeva; 2) apex ileálního pouche; 3) ileo-rektální
anatomóza; 4) Rektální manžeta (zbytek původního rekta); 5) anus.
IBDU A INDETERMINOVANÁ KOLITIDA
V případě, kdy IBD nelze blíže zařadit, ať již z důvodu překryvné morfologie nebo z důvodu chybějících klinických, endoskopických či histopatologických dat, používáme pojem IBDU (50). IBDU je tak klinickou diagnózou, kterou stanovuje klinický lékař až po kompletaci výsledků všech diagnostických modalit. Tím se svojí definicí liší od indeterminované kolitidy. Prevalence IBDU v době diagnózy podle recentní metaanalýzy (51) představuje 13 % pediatrické a 6 % dospělé IBD. Pacienti mohou v dalším průběhu onemocnění rozvinout CD znaky a být reklasifikováni na CD. Změnu diagnózy z IBDU na UC však aktuální diagnostická kritéria neumožňují (6,52). Indeterminovaná kolitida má pak definici odlišnou. Tento výraz použil v 70. letech minulého století Kent TH a spol. (53) na soubor kolektomií s překryvnou morfologií CD a UC. Značná část pacientů se nacházela ve fázi fulminantní kolitidy. Termín se pak postupem času stále vágněji používal i pro nálezy z endoskopických biopsií nebo pro kolitidy zcela nejasné etiologie (54). Současná definice se přiklání k původnímu znění a indeterminovaná kolitida by tak měla být vyhrazena pro případy IBD, u kterých je k dispozici histopatologický nález z kolektomie (6).
MONITORING LÉČENÝCH PACIENTŮ A HISTOPATOLOGICKÉ SKÓROVACÍ SYSTÉMY AKTIVITY ONEMOCNĚNÍ
Kontrolní endoskopické biopsie u léčených pacientů sice mohou v některých případech zpřesnit nebo i změnit původní diagnózu, dlouhodobá terapie však histopatologický nález značně modifikuje a zpětné stanovení konkrétní diagnózy bývá velmi obtížné. Ve většině případů je proto cílem kontrolních biopsií vyloučit dysplázii epitelu, detekovat virovou (hlavně cytomegalovirovou) superinfekci, a především pak posoudit aktuální tíži zánětlivého postižení. K tomuto účelu slouží histopatologické skórovací systémy, jejichž cílem je objektivizovat mikroskopickou intenzitu a aktivitu zánětu a případně i predikovat další klinický průběh onemocnění. Podrobný popis jednotlivých skórovacích systémů však není náplní tohoto článku a autoři si proto dovolují případné zájemce odkázat na recentní přehledový článek „Fabián O, Hradský O, Bronský J, Zámečník J. Histopatologické hodnocení intenzity a aktivity zánětu u zánětlivých střevních onemocnění: Důležitý doplněk endoskopie nebo marná snaha?“, který byl publikován v časopisu ČS patologie ve třetím kvartálu roku 2019 (55).
IBD DĚTSKÉHO VĚKU
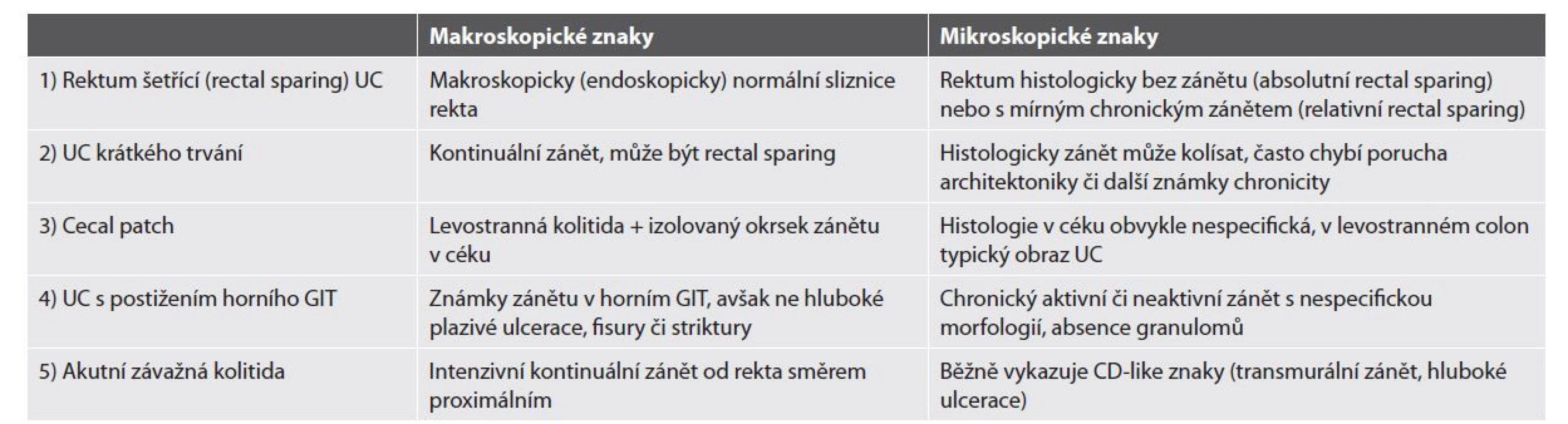
Přibližně 10-15 % IBD je diagnostikováno před 18. rokem věku (56). Pediatrická IBD vykazují určitá specifika, a to jak na klinické, tak i histopatologické úrovni. UC se v době diagnózy manifestuje extenzivnějším endoskopickým postižením, často i v podobě pankolitidy. Mikroskopická intenzita zánětu však bývá v porovnání s dospělou UC slabší, s méně častým výskytem slizničních defektů a menší mírnou poruchy architektoniky (17,18,57). Častější je i výskyt atypických fenotypů jako např. rektum šetřící UC nebo UC s kolísavým charakterem zánětu. Aktuálně platná doporučení pro diagnostiku dětských IBD (revidovaná Portská kritéria z roku 2014) definují pět atypických podtypů pediatrické UC, které jsou shrnuty v tab. 3 (52). CD pak má v době diagnózy vyšší podíl případů s extenzivní kolitidou nebo se prezentují jako izolovaná kolitida bez postižení terminálního ilea. Diferenciální diagnóza mezi dětskou CD a UC je tak mnohdy obtížná (58). V porovnání s dospělými pacienty je častěji postižený i horní trávicí trakt v podobě IBD-asociované ezofagitidy, gastritidy a duodenitidy, a to nejenom u pacientů s CD, ale často i s UC (59,60). Záchyt epiteloidních granulomů je oproti dospělé CD asi dvojnásobně častější (61). Samostatnou kapitolu pak tvoří VEO-IBD, které často mívají odlišný endoskopický nález, mikroskopii i klinickou prezentaci a mnohdy „konvenční“ obraz IBD ani vzdáleně nepřipomínají (52).
IBD A POSTIŽENÍ HORNÍHO TRÁVICÍHO TRAKTU
CD i UC jsou dnes chápány jako systémová zánětlivá onemocnění se schopností postihnout kteroukoliv část trávicí trubice. Stále však platí, že postižení horního trávicího traktu je více typické pro CD, v dospělé populaci se dle různých studií jedná o 8-40 % pacientů. Postižení horního trávicího traktu je častější i v případě pediatrické IBD (11,48,62). V rámci diferenciální diagnózy je v první řadě nezbytné vyloučit běžnější příčiny onemocnění, které mohou s IBD v některých případech i koexistovat. Je to zejména chronická gastritida při infekci Helicobacter pylori, která byla dle studie od Parente F a spol. (63) přítomná až u 33 % pacientů s CD a 47 % pacientů s UC. Jako nespolehlivé se ukazuje i lpění na zažitých morfologických vzorcích jako například fokálně aktivní gastritidě, která byla dříve považována za charakteristickou pro CD. Tento obraz se běžně objevuje i u pacientů s UC, i když méně často v porovnání s CD (63). Chronická duodenitida bývá častější u CD, diagnózu UC však také zdaleka nevylučuje (64). Jícen bývá z horního trávicího traktu postižen nejméně často a ve většině případů jde o pacienty s CD. Histopatologický obraz bývá variabilní, v časné fázi mohou být přítomny pouze mikroskopické změny nebo drobné aftózní léze, které by neměly být zaměněny za herpetickou ezofagitidu. V závažnějších případech se mohou objevit ulcerace a striktury. V diferenciální diagnóze v těchto případech stojí zejména refluxní ezofagitida. Tvorba fisur nebo píštělí je v jícnu vzácná (11,65).
FULMINANTNÍ KOLITIDA
Fulminantní kolitida (FK) je závažnou akutní komplikací, která postihuje nejčastěji pacienty s UC, méně často pak s CD nebo IBDU. V případě UC je klinickým korelátem FK tzv. akutní závažná kolitida, jejíž diagnóza vychází z kritérií klinické aktivity zánětu (66,67). Z morfologického hlediska FK odpovídá těžké, výrazně aktivní pankolitidě s rozsáhlými ulceracemi, která někdy může vést až k paralýze a dilataci tlustého střeva (toxickému megacolon) a často vyžaduje chirurgický zákrok v podobě pankolektomie (68). S ohledem na histopatologickou diagnostiku je důležité zmínit, že ve stádiu FK intenzivní aktivní zánět překrývá znaky chronicity či jiné charakteristické mikroskopické nálezy, které by mohly patologa nasměrovat ke konkrétní diagnóze. Rozlišení CD a UC a často i samotná diagnóza IBD tak je v tomto stádiu velmi obtížná. UC ve fázi FK navíc běžně vykazuje CD-like znaky v podobě transmurálního zánětu, fisur nebo šetření rekta. Pro diagnózu CD ve fázi FK se tak jako nejspolehlivější diagnostické znaky jeví transmurální výskyt lymfatických agregátů, případně nález epiteloidních granulomů (které je však nutné pečlivě odlišit od granulomů z cizích těles v blízkosti ulcerací a fisur) (68-70).
IBD ASOCIOVANÁ S PRIMÁNÍ SKLEROZUJÍCÍ CHOLANGOITIDOU (PSC)
Až 80 % pacientů s PSC v průběhu času rozvine IBD. V některých případech může IBD manifestaci PSC i předcházet. Ve většině případů se jedná o UC, méně často o CD nebo IBDU. PSC - -UC pak vykazuje určitá specifika. Pacienti se obvykle prezentují mírnějším klinickým průběhem, který nekoresponduje s často extenzivním mikroskopickým postižením s vyšším stupněm aktivity a mnohdy i obrazem pankolitidy. Zcela charakteristický je pak reverzní gradient zánětu s maximem v proximálním tlustém střevě a postupným poklesem intenzity zánětu aborálním směrem, často doprovázený BI a šetřením rekta. Tento obrácený charakter zánětu někdy může svádět k mylné diagnóze IBDU nebo i CD (71-73).
ZÁVĚR
Rozpoznání chronického střevního onemocnění jako IBD a následné správné zařazení jako CD nebo UC je pro správný terapeutický postup zásadní. Množství fenotypických variant a atypických podtypů učinil z diagnostiky IBD složitý multidisciplinární proces. Adekvátní patologický závěr by tak vždy měl vycházet z pečlivé korelace s endoskopickým nálezem a klinickými a laboratorními daty.
PODĚKOVÁNÍ
Autoři práce by rádi poděkovali MUDr. Andree Felšöové za zhotovení detailních nákresů.
PROHLÁŠENÍ
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
Adresa pro korespondenci:
MUDr. Ondřej Fabián, Ph.D.
Pracoviště klinické a transplantační patologie Institut Klinické a Experimentální Medicíny
Vídeňská 1958/9
140 21, Praha 4
e-mail: ondrej.fabian@ikem.cz
Sources
1. Schwarz J, Sýkora J. Incidence idiopatických střevních zánětů u dětí a dospívajících v Plzeňském kraji v letech 2001–2011. Prospektivní studie. Ces-slov Pediatr 2013; 68(3): 149-156.
2. Jarkovský J, Benešová K, Hejduk K, Dušek L, Lukáš M. Epidemiology, hospitalisation and migration of patients with IBD under specialized care in the Czech Republic. Gastroent Hepatol 2017; 71(6): 501-509.
3. Magro F, Gionchetti P, Eliakim R, et al. Third European evidence-based consensus on diagnosis and management of ulcerative colitis. Part 1: definitions, diagnosis, extra-intestinal manifestations, pregnancy, cancer surveillance, surgery, and ileo-anal pouch disorders. J Crohns Colitis 2017; 11(6): 649–670.
4. Gomollon F, Dignass A, Annese V, et al. 3rd European evidence-based consensus on the diagnosis and management of Crohn’s disease 2016: part 1: diagnosis and medical management. J Crohns Colitis 2017; 11(1): 3–25.
5. Seldenrijk CA, Morson BC, Meuwissen SG, Schipper NW, Lindeman J, Meijer CJ. Histopathological evaluation of colonic mucosal biopsy specimens in chronic inflammatory bowel disease: diagnostic implications. Gut 1991; 32(12): 1514-1520.
6. Langner C, Magro F, Driessen A, et al. The histopathological approach to inflammatory bowel disease: a practice guide. Virchows Arch 2014; 464(5): 511-527.
7. Magro F, Langner C, Driessen A, et al. European consensus on the histopathology of inflammatory bowel disease. J Crohns Colitis 2013; 7(10): 827-851.
8. Annese V, Daperno M, Rutter MD et al. European evidence based consensus for endoscopy in inflammatory bowel disease. J Crohns Colitis 2013; 7(12): 982-1018.
9. Ferrante M, de Hertogh G, Hlavaty T, et al. The value of myenteric plexitis to predict early postoperative Crohn’s disease recurrence. Gastroenterology 2006; 130(6): 1595 - 1606.
10. Anthony A, Dhillon AP, Pounder RE, Wakefield AJ. Ulceration of the ileum in Crohn’s disease: correlation with vascular anatomy. J Clin Pathol 1997; 50(12): 1013-1017.
11. Geboes K. Histopathology of Crohn’s disease and ulcerative colitis. In: Satsangi J, Sutherland LR, Colombel JF, Fiocchi C, Lofberg R, eds. Inflammatory Bowel Disease (4th edn). London: Churchill Livingstone Elsevier; 2003.
12. Warren BF. Classic pathology of ulcerative and Crohn’s colitis. J Clin Gastroenterol 2004; 38(5 Suppl 1): S33–S35.
13. Sheehan AL, Warren BF, Gear MW, Shepherd NA. Fat-wrapping in Crohn’s disease: pathological basis and relevance to surgical practice. Br J Surg 1992; 79(9): 955-958.
14. Gledhill A, Dixon MF. Crohn’s-like reaction in diverticular disease. Gut 1998; 42(3): 392-395.
15. Yamagata M, Mikami T, Tsuruta T, et al. Submucosal fibrosis and basic-fibroblast growth factor-positive neutrophils correlate with colonic stenosis in cases of ulcerative colitis. Digestion 2011; 84(1): 12-21.
16. Patil DT, Odze RD. Backwash Is Hogwash: The Clinical Significance of Ileitis in Ulcerative Colitis. Am J Gastroenterol 2017; 112(8): 1211-1214.
17. Washington K, Greenson JK, Montgomery E, et al. Am J Surg Pathol 2002; 26(11): 1441 - 1449.
18. Glickman JN, Bousvaros A, Farraye FA, et al. Pediatric patients with untreated ulcerative colitis may present initially with unusual morphologic findings. Am J Surg Pathol 2004; 28(2): 190-197.
19. Kim B, Barnett JL, Kleer CG, Appelman HD. Endoscopic and histological patchiness in treated ulcerative colitis. Am J Gastroenterol 1999; 94(11): 3258-3262.
20. Yang SK, Jung HY, Kang GH, et al. Appendiceal orifice inflammation as a skip lesion in ulcerative colitis: an analysis in relation to medical therapy and disease extent. Gastrointest Endosc 1999; 49(6): 743-747.
21. Therkildsen MH, Jensen BN, Teglbjaerg PS, Rasmussen SN. The final outcome of patients presenting with their first episode of acute diarrhoea and an inflamed rectal mucosa with preserved crypt architecture. A clinicopathologic study. Scand J Gastroenterol 1989; 24(2): 158-164.
22. Jenkins D, Balsitis M, Gallivan S, et al. Guidelines for the initial biopsy diagnosis of suspected chronic idiopathic inflammatory bowel disease. The British Society of Gastroenterology Initiative. J Clin Pathol 1997; 50(2): 93–105.
23. Villanacci V, Antonelli E, Reboldi G, Salemme M, Casella G, Bassotti G. Endoscopic biopsy samples of naïve “colitides” patients: role of basal plasmacytosis. J Crohns Colitis 2014; 8(11): 1438–1443.
24. Schumacher G, Kollberg B, Sandstedt B. A prospective study of first attacks of inflammatory bowel disease and infectious colitis. Histologic course during the 1st year after presentation. Scand J Gastroenterol 1994; 29(4): 318-332.
25. Nostrant TT, Kumar NB, Appelman HD. Histopathology differentiates acute self-limited colitis from ulcerative colitis. Gastroenterology 1987; 92(2): 318–328.
26. Feakins RM. Ulcerative colitis or Crohn’s disease? Pitfalls and problems. Histopathology 2014; 64(3): 317-313.
27. Sankey EA, Dhillon AP, Anthony A, et al. Early mucosal changes in Crohn’s disease. Gut 1993; 34(3): 375–381.
28. Mahadeva U, Martin JP, Patel NK, Price AB. Granulomatous ulcerative colitis: a re-appraisal of the mucosal granuloma in the distinction of Crohn’s disease from ulcerative colitis. Histopathology 2002; 41(1): 50-55.
29. Freeman HJ. Granuloma-positive Crohn’s disease. Can J Gastroenterol 2007; 21(9): 583–587.
30. Heserbach D, Alexandre JL, Branger B, et al. Frequency and significance of granulomas in a cohort of incident cases of Crohn’s disease. Gut 2005; 54(2): 215-222.
31. Johnson CM, Hartman DJ, Ramos-Rivers C, et al. Epithelioid Granulomas Associate With Increased Severity and Progression of Crohn’s Disease, Based on 6-Year Follow-Up. Clin Gastroenterol Hepatol 2018; 16(6): 900 - 907.
32. Rotterdam H, Korelitz B I, Sommers SC. Microgranulomas in grossly normal rectal mucosa in Crohn’s disease. Am J Clin Pathol 1977; 67(6): 550–554.
33. Geboes K, Collins S. Structural abnormalities of the nervous system in Crohn’s disease and ulcerative colitis. Neurogastroenterol Mot 1998; 10(3): 189–202.
34. Wakefield AJ, Sankey EA, Dhillon AP, et al. Granulomatous vasculitis in Crohn’s disease. Gastroenterology 1991; 100(5 Pt 1): 1279–1287.
35. Mottet NK. Intestinal histopathology of regional enteritis: histopathologic spectrum of regional enteritis and ulcerative colitis (1st edn). Philadelphia: WB Saunders; 1971.
36. Graham MF, Diegelmann RF, Elson CO, et al. Collagen content and types in the intestinal strictures of Crohn’s disease. Gastroenterology 1988; 94(2): 257–265.
37. Gelbmann CM, Mestermann S, Gross V, Köllinger M, Schölmerich J, Falk W. Strictures in Crohn’s disease are characterized by an accumulation of mast cells colocalised with laminin but not with fibronectin or vitronectin. Gut 1999; 45(2): 210–217.
38. Haskell H, Andrews Jr CW, Reddy SI, et al. Pathologic features and clinical significance of “backwash” ileitis in ulcerative colitis. Am J Surg Pathol 2005; 29(11): 1472-1481.
39. Koukoulis GK, Ke Y, Henley JD, Cummings OW. Detection of pyloric metaplasia may improve the biopsy diagnosis of Crohn’s ileitis. J Clin Gastroenterol 2002; 34(2): 141-143.
40. Yokoyama I, Kozuka S, Ito K, Kubota K, Yokoyama Y. Gastric gland metaplasia in the small and large intestine. Gut 1977; 18(3): 214–218.
41. Guindi M, Riddell RH. Indeterminate colitis. J Clin Pathol 2004; 57(12): 1233-1244.
42. Lennard-Jones JE. Crohn’s disease: Definition, pathogenesis and aetiology. In: Wright R, ed. Recent advances in gastrointestinal pathology (1st edn). London: WB Saunders; 1980.
43. Soucy G, Wang HH, Farraye FA, et al. Clinical and pathological analysis of colonic Crohn’s disease, including a subgroup with ulcerative colitis-like features. Mod Pathol 2012; 25(2): 295-307.
44. Kleer CG, Appelman HD. Ulcerative colitis: patterns of involvement in colorectal biopsies and changes with time. Am J Surg Pathol 1998; 22(8): 983-989.
45. Moum B, Ekbom A, Vatn MH, Elgjo K. Change in the extent of colonoscopic and histological involvement in ulcerative colitis over time. Am J Gastroenterol 1999; 94(6): 1564-1569.
46. Gionchetti P, Amadini C, Rizzello F, Venturi A, Poggioli G, Campieri M. Diagnosis and treatment of pouchitis. Best Pract Res Clin Gastroenterol 2003; 17(1): 75-87.
47. Ferrante M, Declerck S, de Hertogh G, et al. Outcome after proctocolectomy with ileal pouch-anal anastomosis for ulcerative colitis. Inflamm Bowel Dis 2008; 14(1): 20-28.
48. Bousvaros A, Antonioli DA, Colletti RB, et al. Differentiating ulcerative colitis from Crohn disease in children and young adults: report of a working group of the North American Society for Pediatric Gastroenterology, Hepatology, and Nutrition and the Crohn’s and Colitis Foundation of America. J Pediatr Gastroenterol Nutr 2007; 44(5): 653-674.
49. Shen B. Diagnosis and management of postoperative ileal pouch disorders. Clin Colon Rectal Surg 2010; 23(4): 259-268.
50. Odze R. Diagnostic problems and advances in inflammatory bowel disease. Mod Pathol 2003; 16(4): 347-358.
51. Prenzel F. Uhlig HH. Frequency of indeterminate colitis in children and adults with IBD—a metaanalysis. J Crohns Colitis 2009; 3(4): 277–281.
52. Levine A, Koletzko S, Turner D, et al. ESPGHAN revised porto criteria for the diagnosis of inflammatory bowel disease in children and adolescents. J Pediatr Gastroenterol Nutr 2014; 58(6): 795-806.
53. Kent TH, Ammon RK, DenBesten L. Differentiation of ulcerative colitis and regional enteritis of colon. Arch Pathol 1970; 89(1): 20-29.
54. Geboes K, Colombel JF, Greenstein A, et al. Indeterminate colitis: a review of the concept — what’s in a name? Inflamm Bowel Dis 2008; 14(6): 850-857.
55. Fabián O, Hradský O, Bronský J, Zámečník J. Histopatologické hodnocení intenzity a aktivity zánětu u zánětlivých střevních onemocnění: Důležitý doplněk endoskopie nebo marná snaha? Cesk Patol 2019; 55(3): 158-164.
56. Kugathasan S, Judd RH, Hoffmann RG, et al. Epidemiologic and clinical characteristics of children with newly diagnosed inflammatory bowel disease in Wisconsin: a statewide population - based study. J Pediatr 2003; 143(4): 525 - 531.
57. Robert ME, Skacel M, Ullman T, Bernstein CN, Easley K, Goldblum JR. Patterns of colonic involvement at initial presentation in ulcerative colitis: a retrospective study of 46 newly diagnosed cases. Am J Clin Pathol 2004; 122(1): 94-99.
58. Levine A. Pediatric inflammatory bowel disease: is it different? Dig Dis 2009; 27(3): 212-214.
59. Turner D, Griffiths AM. Esophageal, gastric, and duodenal manifestations of IBD and the role of upper endoscopy in IBD diagnosis. Curr Gastroenterol Rep 2009; 11(3): 234-237.
60. McHugh JB, Gopal P, Greenson JK. The clinical significance of focally enhanced gastritis in children. Am J Surg Pathol 2013; 37(2): 295-299.
61. Rubio CA, Orrego A, Nesi G, Finkel Y. Frequency of epithelioid granulomas in colonoscopic biopsy specimens from paediatric and adult patients with Crohn’s colitis. J Clin Pathol 2007; 60(11): 1268–1272.
62. Lin J, McKenna BJ, Appelman HD. Morphologic findings in upper gastrointestinal biopsies of patients with ulcerative colitis: a controlled study. Am J Surg Pathol 2010; 34(11): 1672-1677.
63. Parente F, Cucino C, Bollani S, et al. Focal gastric inflammatory infiltrates in inflammatory bowel diseases: prevalence, immunohistochemical characteristics, and diagnostic role. Am J Gastroenterol 2000; 95(3): 705-711.
64. Valdez R, Appelman HD, Bronner MP, Greenson JK. Diffuse duodenitis associated with ulcerative colitis. Am J Surg Pathol 2000; 24(10): 1407-1413.
65. Tobin JM, Sinha B, Ramani P, Saleh AR, Murphy MS. Upper gastrointestinal mucosal disease in pediatric Crohn disease and ulcerative colitis: a blinded, controlled study. J Pediatr Gastroenterol Nutr 2001; 32(4): 443-448.
66. Truelove SC, Witts LJ. Cortisone in ulcerative colitis; preliminary report on a therapeutic trial. Br Med J 1954; 2(4884): 375–378.
67. D’Haens G, Sandborn WJ, Feagan BG, et al. A review of activity indices and efficacy end points for clinical trials of medical therapy in adults with ulcerative colitis. Gastroenterology 2007; 132(2): 763–786.
68. Odze RD. Pathology of indeterminate colitis. J Clin Gastroenterol 2004; 38(5 Suppl 1): S36-40.
69. Price AB. Overlap in the spectrum of non-specific inflammatory bowel disease—’colitis indeterminate’. J Clin Pathol 1978; 31(6): 567-577.
70. Swan NC, Geoghegan JG, O’Donoghue DP, Hyland JM, Sheahan K. Fulminant colitis in inflammatory bowel disease: detailed pathologic and clinical analysis. Dis Colon Rectum 1998; 41(12): 1511-1515.
71. Silverberg MS, Satsangi J, Ahmad T, et al. Toward an integrated clinical, molecular and serological classification of inflammatory bowel disease: report of a Working Party of the 2005 Montreal World Congress of Gastroenterology. Can J Gastroenterol 2005; 19(Suppl A): 5A-36A.
72. Joo M, Abreu-e-Lima P, Farraye F, et al. Pathologic features of ulcerative colitis in patients with primary sclerosing cholangitis: a case-control study. Am J Surg Pathol 2009; 33(6): 854-862.
73. Loftus EV Jr, Harewood GC, Loftus CG, et al. PSC-IBD: a unique form of inflammatory bowel disease associated with primary sclerosing cholangitis. Gut 2005; 54(1): 91-6.
Labels
Anatomical pathology Forensic medical examiner ToxicologyArticle was published in
Czecho-Slovak Pathology

2022 Issue 1
-
All articles in this issue
- Histopatologická diagnostika nenádorových onemocnění trávicího traktu
- Při volbě patologie nebylo třeba dlouhého váhaní
- 'PATOLOGIE GIT
- 'HEMATOPATOLOGIE
- 'NEUROPATOLOGIE
- 'GYNEKOPATOLOGIE
- 'NEFROPATOLOGIE
- 'KARDIOPATOLOGIE
- 'HEPATOPATOLOGIE
- 'PATOLOGIE ORL OBLASTI
- 'PULMOPATOLOGIE
- 'UROPATOLOGIE
- 'HISTORIE PATOLOGIE
- Histopathological diagnosis of colitis: differential diagnosis and interpretation
- Morphology of inflammatory bowel diseases (IBD)
- Zemřel MUDr. Jiří Kudrmann (24. 10. 1928 – 21. 1. 2022)
- Non-conventional types of dysplastic changes in gastrointestinal tract mucosa – review of morphological features of individual subtypes
- Penile paraffinoma: a case report
- Uterus transplantation in the treatment of female infertility: the pathologist’s perspective
- Prof. MUDr. Boris Habanec, DrSc., 90letý.
- Životné jubileum prof. MUDr. Lukáša Planka, CSc.
- DOPIS REDAKCI
- Czecho-Slovak Pathology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Morphology of inflammatory bowel diseases (IBD)
- Histopathological diagnosis of colitis: differential diagnosis and interpretation
- Non-conventional types of dysplastic changes in gastrointestinal tract mucosa – review of morphological features of individual subtypes
- Penile paraffinoma: a case report
