Mikroneutralizace v diagnostice chřipkové infekce
Microneutralization Assay in the Diagnosis of Influenza Infection
Serology plays an important role in the diagnosis of influenza, particularly in the detection of post-vaccination and post-infection antibodies. When considering the range of diagnostic options, the serological method should be selected depending on the circumstances – whether single or paired serum samples are tested, whether adequate patient medical history data are available, whether epidemiological links are suspected, and, in particular, to what purpose the result will be used (differential diagnosis, post-infection follow-up, post-vaccination monitoring, etc.). The virus neutralization assay is one of the most sensitive and most objective serological tests, but it is highly dependent on the reaction balance and quality of the virus used. Determining the protective titer is crucial for the routine practice. Based on our experiments, we concluded that the virus neutralizing antibody titers are up to eight times as high in comparison with the hemaglutination inhibition test (HIT) or complement fixation reaction (CFR), but the correlation varies and is significantly influenced by interindividual variation in anti-neuraminidase antibodies and those against some internal proteins of influenza virus. We assume that the protective titer in the virus neutralization assay will be not less than 1 : 80. The predictive value of the titers below 1 : 40 is questionable.
Key words:
serology – virus neutralization – influenza virus – protective titers.
Authors:
Havlíčková Martina 1; Jiřincová Helena 1; Marešová Vilma 2; Džupová Olga 3; Limberková Radomíra 1
Authors‘ workplace:
Státní zdravotní ústav, Centrum epidemiologie a mikrobiologie, Praha
1; Univerzita Karlova v Praze, 2. lékařská fakulta, Praha
2; Nemocnice Na Bulovce, Praha
3
Published in:
Epidemiol. Mikrobiol. Imunol. 61, 2012, č. 1-2, s. 9-14
Overview
Sérologické vyšetření hraje v diagnostice chřipky důležitou roli, především v určení postvakcinačních a postinfekčních protilátek. Vzhledem k různým diagnostickým možnostem je nutné metodiku sérologického vyšetření volit podle konkrétních okolností – zda se jedná o párové sérum či jednovzorek, zda je k dispozici adekvátní anamnéza pacienta a případné epidemiologické souvislosti a především – jakému účelu bude výsledek sloužit (diferenciálnědiagnostická rozvaha, postinfekční sledování, postvakcinační zhodnocení). Virusneutralizace představuje jeden z nejcitlivějších a nejobjektivnějších sérologických testů, je však velmi závislá na přesném vyvážení reakce a kvalitě viru, který je do reakce použit. Stanovení protektivního titru je pro rutinní praxi nezbytné. V našem testovaní jsme došli k závěru, že virusneutralizační titry jsou v porovnání s HIT či KFR až osminásobně vyšší, korelace však není nikterak pevná a je významně ovlivněná individuální výší protilátek proti neuraminidáze a některým vnitřním proteinům. Autoři předběžně uzavírají, že výše protektivního titru ve virusneutralizačním testu bude nejméně 1 : 80. Informativní význam titrů nižších než 1 : 40 je sporný.
Klíčová slova:
sérologie – virusneutralizace – virus chřipky – ochranné titry.
ÚVOD
Rozšíření nového subtypu A/H1N1pdm (pdm = pandemická varianta) v dubnu 2009, který předznamenal první chřipkovou pandemii 21. století a zcela vytěsnil původní variantu H1, s sebou přineslo i značné nároky na rychlou a přesnou diagnostiku onemocnění. Vyšetřování specifických cirkulujících protilátek v séru, které jsou směrované proti antigenům různých patogenů, patří v infektologii stále k základním diagnostickým postupům, což „pandemické“ zkušenosti opět potvrdily.
Chřipka jako taková představuje geneticky značně nestabilní agens a tedy trvalou hrozbu pro veřejné zdraví. Je rovněž jednou z nejčastějších infekcí, kterým lze předcházet preventivním očkováním. Klinická manifestace chřipky závisí jak na charakteristice a vlastnostech vyvolávajícího viru, tak na věku pacienta, rizikových faktorech a případných komorbiditách. Závažnost klinických projevů osciluje od téměř asymptomatických průběhů až po akutní, život ohrožující stavy (fulminantní intersticiální pneumonie, oběhové selhání způsobené myokarditidou, encefalitida, myozitida s následnou rabdomyolýzou provázenou myoglobinurií). Především tyto akutní stavy, často nerespiračního charakteru, představují situace diagnosticky velmi náročné, kde je obvykle nutné kombinovat průkaz virového antigenu či ribonukleové kyseliny (RNA) v biologickém materiálu s vyšetřením sérologickým. Vyšetření specifických protilátek u pacientů s podezřením na chřipkovou infekci má v laboratorní diagnostice chřipky stále své pevné místo, přestože v akutní fázi infekce je jeho vypovídací hodnota omezena obvykle nízkým titrem protilátek. V neposlední řadě slouží citlivý a zároveň specifický průkaz protilátek účelům epidemiologické surveillance, mimo jiné i v pandemické připravenosti při sledování výskytu aviárních chřipkových kmenů jako původců lidských infekcí.
Virusneutralizace (VNT) představuje jeden z nejstarších testů, který byl pro hodnocení protilátkové reakce použit, ať již cestou klasické neutralizace protilátek ve vyšetřovaném séru či dnes již velmi zřídka používanou metodou inhibice hemadsorpce. Význam virusneutralizace v sérologickém vyšetřování chřipky byl částečně omezen klasickým testem inhibice hemaglutinace (HIT), který se postupně stal zlatým standardem hodnocení postinfekční a postvakcinační sérologické odpovědi a který jako jediný test v chřipkové sérologii má v metodice Světové zdravotnické organizace (WHO) jasně stanovenou hladinu protilátek představujících tzv. protektivní titr. Navíc pomocí HIT lze určit nejen typy, ale i subtypy a v rámci subtypů driftové varianty. Provedení HIT je však plně závislé na viru s dostatečně vysokým hemaglutinačním titrem (minimálně 1 : 32), což se v současné době stává určitým problémem, neboť řada kmenů – především subtypu H3N2 – se jak v kuřecích embryích, tak v tkáňových kulturách replikuje s čím dále menší efektivitou a také se snižuje afinita virů k některým druhům červených krvinek. HIT navíc detekuje pouze protilátky proti hemaglutininu, jiné protilátky se v této reakci neuplatní. Oproti tomu virusneutralizační test zachycuje celé spektrum neutralizačních protilátek, a to nejen proti hemaglutininu, ale i proti neuraminidáze a částečně i proti vnitřním proteinům. Detekuje tedy jak protilátky blokující vstup viru do buňky, tak obecněji i další protilátky, které brání replikaci virové částice. Jeho citlivost je již z tohoto hlediska významně vyšší a hovoří o celkové schopnosti vyšetřovaného séra neutralizovat konkrétní virový kmen. Význam VNT velmi vzrostl i v rámci diagnostické připravenosti na nový pandemický virus a při sledování možných kontaktů s aviárními viry. Nejsou však jednoznačně stanovena kritéria, která by hodnotila určitý minimální titr, který by, stejně jako HIT, vyjadřoval takovou hladinu protilátek, které v 50 % případů zabrání rozvoji onemocnění. Největší problém pak představuje interpretace nízkých titrů.
MATERIÁL A METODY
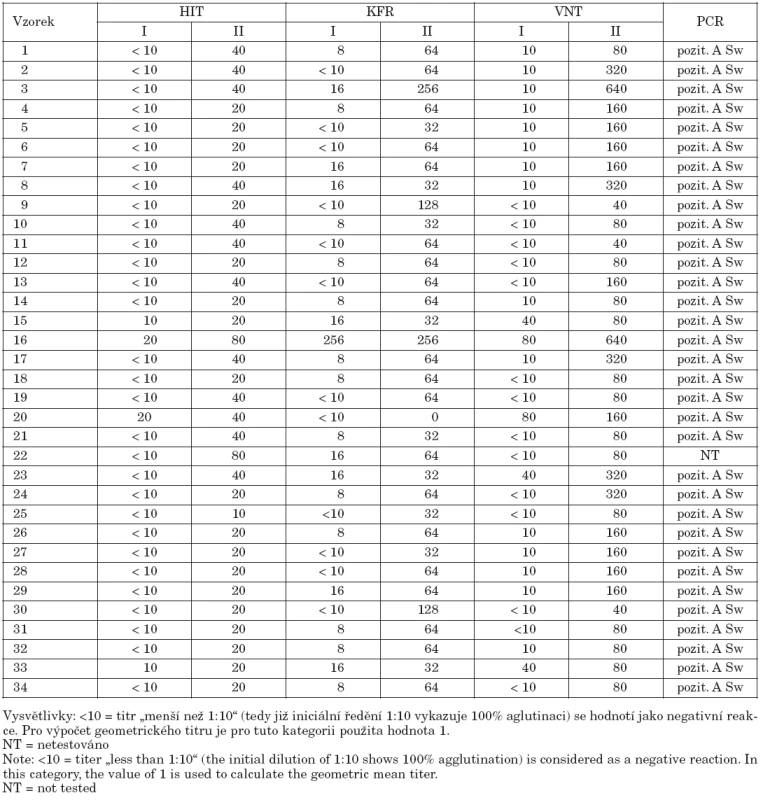
V období první i druhé pandemické vlny (od 26. do 53. týdne 2009) byli v NRL pro chřipku vyšetřeni pacienti přijatí na infekční kliniky FN Na Bulovce s podezřením na chřipkovou infekci. Pro průkaz etiologie chřipky byly použity následující metody:
- Párová séra: Pacientům přijatým k hospitalizaci s podezřením na chřipkovou infekci byl odebírán nazofaryngeální výtěr a rovněž srážlivá krev (5 ml). První (akutní) vzorek krve byl odebrán vždy zároveň s krčním výtěrem a druhý (rekonvalescentní) vzorek pak v odstupu 10–14 dní. Séra byla až do vyšetření virusneutralizací (VNT), testem inhibice hemaglutinace (HIT) i komplementfixační reakcí (KFR) uchovávána při teplotě -20 °C.
- Real time PCR (polymerase chain reaction) pro průkaz virové RNA ve výtěru byl proveden podle metodiky CDC (Center for Disease Control) a doporučené WHO [1].
- Test inhibice hemaglutinace a komplementfixační reakce byly prováděny podle standardní metodiky [2, 3].
- Referenční pandemický virus A/California 7/2009 a referenční sérum proti viru A/California 7/2009 s deklarovaným HIT i VNT titrem byly laskavě poskytnuty z WHO spolupracujícího centra Mill Hill v Londýně, Velká Británie.
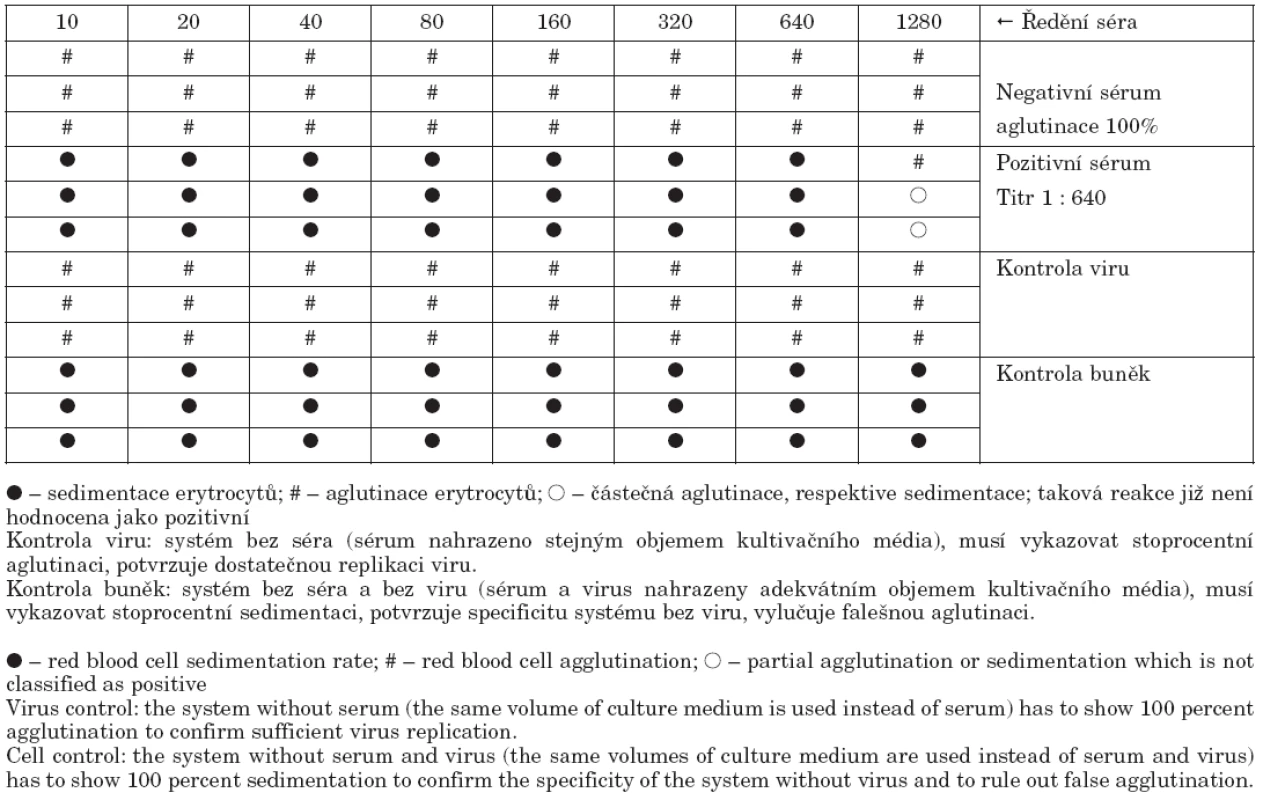
- Virusneutralizační test byl proveden jako mikroneutralizace a modifikován podle metodiky Roweho et al. [4]. Séra byla nejprve inaktivována při teplotě 56 °C po dobu 30 minut. Následně byla v kultivačních mikrodestičkách „P“ typu a v tkáňovém kultivačním médiu dvojkovým ředěním vytitrována od iniciálního ředění 1 : 10 do titru 1 : 1280. Poté byl přidán virus A/California 7/2009 v koncentraci 2krát 103 TCID50/ml. Směs byla inkubována 2 hodiny při 37 °C v atmosféře 5% CO2. Jako poslední krok byla přidána suspenze buněk MDCK v hustotě 350 000/ml a destičky byly inkubovány 48 hodin při teplotě 35 °C a v atmosféře 5% CO2. Po uplynutí inkubační doby byla reakce hodnocena pomocí hemaglutinačního testu tak, že z každé testovací jamky bylo odebráno 50 μl tkáňové tekutiny a smícháno se stejným objeme 0,5% suspenze morčecích krvinek. Sedimentace krvinek znamenala přítomnost specifických protilátek, které zabránily pomnožení viru, aglutinace naopak signalizovala množení viru a tedy nepřítomnost specifických protilátek (tab. 1). Správné nastavení reakce bylo verifikováno testováním mezinárodní standardy, která měla deklarovaný titr 1 : 519. V našem systému jsme dosáhli titru 1 : 450.
VÝSLEDKY
Virusneutralizační test byl proveden se 34 párovými séry od pacientů s jednoznačně prokázanou infekcí virem A/H1N1pdm. Etiologie onemocnění byla zjištěna buď pomocí PCR v reálném čase, nebo sérologicky (HIT, KFR). Virusneutralizační titry byly porovnávány s výsledky HIT i KFR, výsledky shrnuje tabulka 2. V HIT byla ve většině případů (30/34) reakce v prvním (akutním) séru podle očekávání zcela negativní, pouze ve čtyřech případech byl prokázán nízký titr séra, do 1 : 20. U jednoho z těchto čtyř pacientů (pacient č. 16) byl interval mezi začátkem onemocnění a prvním odběrem více jak 7 dní, u dalších dvou (pacienti č. 15 a č. 20) byl proveden během prvních 3 dní od udaného začátku onemocnění, tedy v akutní fázi. U pacienta č. 33 nebyl počátek onemocnění znám. Hemaglutinačně inhibičním testem byl ve druhém (rekonvalescentním) vzorku séra nejčastěji zjištěn titr 1 : 20, vzhledem k první „nulové“ hodnotě se jednalo o signifikantní vzestup. Ve dvanácti případech bylo ve druhém vzorku séra dosaženo titru 1 : 40 a vzestup protilátek byl tedy osminásobný, ve dvou případech až šestnáctinásobný (postinfekční – rekonvalescentní titr 1 : 80). Komplementfixační reakce celkově ukazovala výraznější rozdíly mezi prvním a druhým sérem. Pouze v jednom případě byla reakce zcela negativní, pro což nemáme uspokojivé vysvětlení. Virusneutralizační test ukazoval v prvním vzorku séra zcela negativní reakci pouze ve 14 případech ze 34 testovaných. Ve všech těchto případech byl HIT negativní a KFR vykazovala titry od negativity do hodnoty 1 : 8, pouze u jednoho pacienta 1 : 16. V 15 případech byl v akutním séru zjištěn titr virusneutralizačních protilátek 1 : 10, v HIT byla reakce opět negativní, v KFR se však s vyšší četností vyskytoval titr 1 : 16 (4 případy). V pěti případech byl již v prvním séru zjištěn virusneutralizační titr 1 : 40 až 1 : 80, u dvou z těchto pacientů (pacienti č. 23 a č. 16) byl způsoben pozdním odběrem prvního séra. VNT titry dosažené ve druhém – rekonvalescentním vzorku byly 2–16krát vyšší nežli titry hemaglutinačně inhibiční. Pouze v jednom případě – pacient č. 22 – byly titry shodné v HIT i VNT. Titry dosažené ve VNT přibližně dvakrát převyšovaly titry v KFR reakci, jenom u jednoho pacienta (pacient č. 30) byl v KFR vyšší titr nežli ve VNT. Geometrické průměry titrů akutních i rekonvalescentních sér znázorňuje graf 1.

DISKUSE
Vyšetření specifických protilátek proti virům chřipky patří mezi standardní a značně frekventovaná vyšetření. Nejčastějším testem v rutinní praxi je komplement-fixační reakce a různé modifikace enzymových imunoesejí. Obě tyto metody jsou schopny určit protilátky pouze typově specificky. Ačkoliv pro běžnou praxi je toto zařazení dostačující, u postvakcinačních hodnocení, dále pro účely virologické surveillance a v neposlední řadě u pacientů s těžkým či atypickým průběhem chřipky je nezbytné určit u typu A subtypy a případně i driftové varianty, u typu B obě cirkulující linie viru, které jsou antigenně výrazně odlišné (B/Yamagata a B/Victoria). Pro určení sérologické odpovědi u chřipky typu B je VNT vždy výhodnější [5], neboť klasický HIT je pro B chřipku velmi málo citlivý, pokud není jako antigen použit inaktivovaný virus rozštěpený Tween/etherem [6]. Určení subtypů a variant u typu A umožňuje jak test inhibice hemaglutinace, tak virusneutralizace. Modifikace VNT, kde je místo viru chřipky použit modifikovaný retrovirus s hemaglutininem exprimovaným na svém povrchu, je velice citlivou alternativou HIT, ale neobsáhne neutralizační protilátky proti jiným antigenům [8]. Zatímco u HIT je stanoven protektivní titr a tento test již dlouhodobě slouží jako „zlatý standard“, virusneutralizace tento práh pozitivity určen nemá a její využití v praxi je tímto do určité míry limitováno. Námi prezentované výsledky potvrzují, že korelace mezi titry HIT a VNT není pevná. Vzhledem k faktu, že ve VNT vstupuje do reakce celé spektrum protilátek včetně protilátek proti neuraminidáze, jsou titry VNT vždy vyšší než titry HIT, nicméně bez jakéhokoliv pevného pravidla. Interpretaci samozřejmě velmi ovlivňuje nastavení a především vizualizace přítomnosti nebo nepřítomnosti viru, respektive virového antigenu. Hodnocení pomocí znázornění hemaglutinační aktivity je v praxi velmi výhodné. Je snadné na provedení, ale tento způsob ukončení celé reakce vyžaduje obvykle delší inkubaci celého tkáňového systému (48–72 hodin), byť to nemusí být vždy pravidlem (záleží na infekčním titru použitého viru). Kolorimetrická esej [7] anebo ELISA in situ [5], kdy jsou barevnou reakcí odlišeny infikované a neinfikované buňky, mohou (ale nemusí) být na inkubaci méně náročné. Provedení je však pracnější a test jako takový je nákladnější. Je-li test dobře vyvážen a je-li použit dobře se replikující virus s vysokým infekčním titrem, není délka inkubace a metoda znázornění neutralizační aktivity rozhodující (nepublikované výsledky). Interpretačně jsou u VNT nejobtížnější nízké titry do hodnoty 1 : 40. I při přesném vyvážení testu není zcela jasné, zda se jedná o specifickou reakci a především jaký klinický význam má vzhledem k pacientovi. Při testování zcela nového subtypu viru chřipky, jak tomu bylo při šíření subtypu A(H1N1)pdm, byla v námi testované skupině v testu HIT reakce negativní v 88,2 %, u VNT však pouze v 58,8 %. Tento výsledek pravděpodobně neznamená předchozí styk s novým virem, ale průkaz nízkých hladin jiných protilátek než proti hemaglutininu (především protilátek proti neuraminidáze a nukleoproteinu). Ve vysokých koncentracích séra není možné zcela vyloučit ani částečně nespecifickou neutralizaci jinými sérovými proteiny.
Snahou mikrobiologických vyšetření obecně je dosažení maximální citlivosti při stejně vysoké specificitě. Nicméně důležitou otázkou však zůstává, jak s daným výsledkem můžeme naložit a co nám ve skutečnosti řekne. Při přetrvávání nízkých titrů protilátek po styku s různými chřipkovými viry je téměř jisté, že u pacientů mimo nejnižší věkové skupiny vždy určité protilátky nalezneme. Stanovení hranic pozitivity, respektive protekce, je tedy velice důležité pro interpretaci výsledků. Na podkladě námi získaných výsledků usuzujeme, že virusneutralizační titry do výše 1 : 20 nelze považovat za průkaz infekce (na rozdíl od HIT, kde již tento výsledek s novým virem byl jasným dokladem). Hodnota titru 1 : 40 ve VNT reprezentuje již suspektně pozitivní titr, není však jasná míra jeho protektivity. Teprve virusneutralizační titry 1 : 80 a vyšší budou pravděpodobně představovat ochrannou hladinu protilátek porovnatelnou s HIT.
Podpořeno grantem IGA NT 12493-3/2011.
Do redakce došlo dne 1. 12. 2011.
Kontaktní adresa:
MUDr. Martina Havlíčková, CSc.
Centrum epidemiologie a mikrobiologie
Státní zdravotní ústav
Šrobárova 48
100 42 Praha 10
e-mail: nflucprg@szu.cz
Sources
1. http://www.who.int/csr/resources/publications/swineflu/ realtimeptpcr/en/index.html.
2. World Health Organization: Manual for the Laboratory diagnosis and virological surveillance of influenza. 2011, ISBN: 9789241548090. Dostupné na www: www.who.int/ csr/disease/influenza/manual_diagnosis_surveillance_influenza/en/.
3. Lennette, E. H., Schmidt, N. J. Diagnostic procedures for viral, rickettsial, and chlamydial infections. Marcel Dekker, Inc: New York, 1992.
4. Rowe, T., Abernathy, R. A., Hu-Primmer, J., Thompson, W. W., Lu, X., Lim, W., Fukuda, K., Cox, N. J., Katz, J. M. Detection of antibody to avian influenza A (H5N1) virus in human serum by using a combination of serologic assays. J. Clin. Microbiol., 1999, 37, p. 937–943.
5. Harmon, M., Rota, P. A., Walls, W., Kendal, A. P. Antibody response in humans to influenza virus type B host--cell-derived variants after vaccination with standard (egg--derived) vaccine or natural infection. J. Clin. Microbiol., 1988, 26, p. 333–337.
6. Monto, A. S., Maasab, H. F. Ether treatment of type B influenza virus antigen for the hemagglutination inhibition test. J. Clin. Microbiol., 1981, 13, p. 54–57.
7. Lehtoranta, L., Villberg, A., Santanen, R., Ziegler, T. A novel, colorimetric neutralization assay for measuring antibodies to influenza viruses. J. Virol. Methods., 2009, p. 271–276.
8. Wang, W., Butler, E. N., Veguilla, V., Vassell, R., Thomas, J. T., Moos, M. Jr., Ze, Z., Hancock, K., Weiss, C. D. Establishment of retroviral pseudotypes with influenza hemagglutinins from H1, H3 and H5 antibodies subtypes for sensitive and specific detection of neutralizing antibodies. J. Virol. Methods, 2008, p. 111–119.
Labels
Hygiene and epidemiology Medical virology Clinical microbiologyArticle was published in
Epidemiology, Microbiology, Immunology

2012 Issue 1-2
-
All articles in this issue
- Epidemie virové hepatitidy E v České republice?
- Porovnání produkce vybraných faktorů virulence Pseudomonas aeruginosa izolovaných z katétrů
-
30 let od popsání prvních případů AIDS – historie a současnost
Část I. - Mikroneutralizace v diagnostice chřipkové infekce
- Lymská borelióza – epidemiologická analýza výskytu v severnom regióne Slovenska
- Epidemiology, Microbiology, Immunology
- Journal archive
- Current issue
- About the journal
Most read in this issue
-
30 let od popsání prvních případů AIDS – historie a současnost
Část I. - Epidemie virové hepatitidy E v České republice?
- Porovnání produkce vybraných faktorů virulence Pseudomonas aeruginosa izolovaných z katétrů
- Lymská borelióza – epidemiologická analýza výskytu v severnom regióne Slovenska
