Intravenózní a subkutánní imunoglobulinová terapie
Intravenous and Subcutaneous Immunoglobulin Therapy
Patients with agammaglobulinaemia and hypogammaglobulinaemia require immunoglobulin G (IgG) replacement therapy to prevent serious infections. Since the 1950s, therapy with human immune globulin products has been the standard of treatment. Currently, the most common routes of administration of IgG replacement therapy are intravenous (IVIG) or subcutaneous (SCIG). The home therapy may improve the quality of life in patients who require lifelong IgG replacement. The anti-IgA antibody test identifies the patients with the risk of anaphylactoid reactions in IVIG replacement. The SCIG delivery may be used in patients with anti-IgA antibodies and previous systemic reactions to IVIG.
Keywords:
IVIG – SCIG – immunodeficiency – immunoglobulin – anti-IgA antibodies
:
Thon Vojtěch
:
Ústav klinické imunologie a alergologie, Lékařská fakulta Masarykovy univerzity a FN u sv. Anny v Brně
:
Epidemiol. Mikrobiol. Imunol. 62, 2013, č. 2, s. 64-73
Pacienti s agamaglobulinémií a s hypogamaglobulinémií musí být léčeni lidskými imunoglobuliny z důvodu zamezení rozvoje závažných infekcí. Od padesátých let minulého století se stala léčba sérovými imunoglobuliny IgG standardní terapií. Dnes se aplikuje běžně formou intravenózních (IVIG) nebo subkutánních (SCIG) infuzí. Domácí léčba může zvýšit kvalitu života pacientů závislých na celoživotní imunoglobulinové substituční terapii. Vyšetření anti-IgA protilátek u pacientů s neměřitelnými hodnotami sérového IgA snižuje riziko anafylaktoidních reakcí při podání IVIG. Léčba SCIG může být použita i u pacientů s anti-IgA protilátkami a s předchozími systémovými reakcemi při aplikaci IVIG.
Klíčová slova:
IVIG – SCIG – imunodeficience – imunoglobulin – anti-IgA protilátky
Úvod
Vrozené (primární) imunodeficience tvoří rozsáhlou heterogenní skupinou onemocnění. Poruchu tvorby protilátek nalezneme nejen u protilátkových imunodeficiencí, jež výskytem převládají, nýbrž i u deficiencí kombinovaných (buněčných a humorálních) [2]. Před dostupností substituční imunoglobulinové a antibiotické léčby pacienti s protilátkovými imunodeficiencemi umírali v dětství na bakteriální infekce, zejména pneumonie. V současné době se s léčbou, která je celoživotní, dožívají dospělého věku. Jak prokázala rozsáhlá evropská studie u pacientů s běžnou variabilní imunodeficiencí (CVID), se zdokonalením imunoglobulinové léčby se pacientům délka života znásobila a zvýšila se jeho kvalita, i když i při ní zůstává křivka úmrtnosti strmější, než je u běžné populace [17]. Substituční léčbu je nutné zahájit včas, aby se v maximální míře předešlo rozvoji orgánových změn [14, 19, 22].
V odborné literatuře nalezneme poprvé kazuistiku osmiletého chlapce s agamaglobulinémií, sinopulmonární infekcí a pneumonií v roce 1952. Ogden C. Bruton u dítěte s opakovanými pneumokokovými sepsemi, projevujícími se od čtyř a půl let věku, v časopise Pediatrics publikoval a laboratorně doložil, že pacient, který při vyšetření v séru neměl přítomnu gamaglobulinovou frakci, zásadním způsobem profitoval ze subkutánní substituce lidských imunoglobulinů. Došlo u něj k prokázanému vzestupu sérového gamaglobulinu a klinicky k dlouhodobé prevenci septických stavů [6]. Substituční léčba se přitom stala reálnou po druhé světové válce díky Edwinu J. Cohnovi, který provedl chladovou alkoholovou frakcionaci plasmatických proteinů. Původním aktuálním záměrem bylo využít především albuminové frakce jakožto náhražky krevní plasmy u raněných vojáků ve válce [9], avšak z hlediska izolace lidských protilátek a jejich náhrady se stala následně významnou Cohnova frakce II, která protilátky obsahuje (tab. 1).
VÝVOJ SUBSTITUČNÍ IMUNOGLOBULINOVÉ TERAPIE A JEJÍ POUŽITÍ
Intramuskulární aplikace imunoglobulinů (IMIG)
V polovině padesátých let 20. století začali Robert Good, Charles Janeway a Fred Rosen ve Spojených státech terapeuticky intramuskulárně aplikovat produkty Cohnovy frakce II pacientům s vrozenými imunodeficiencemi. S cílem zabránit infekcím a také orgánovým postižením, zejména pulmonálním komplikacím [3, 13, 24].
Intramuskulární aplikace koncentrovaného imunoglobulinu (16% roztok) vyžadovala časté podávání v týdenních intervalech. Přesto se jen v některých případech podařilo u pacientů dosáhnout fyziologických hladin sérového IgG, i když koncentrované IMIG preparáty obsahují deseti - až dvacetinásobné množství protilátek, než je přítomné v séru zdravého dárce. Bolestivost a četnost podání IMIG znamenala zejména pro dětské pacienty značnou zátěž. V případě, že se při aplikaci nedopatřením intramuskulární imunoglobulinový preparát dostal do krve, docházelo k rozvoji silné anafylaktoidní reakce, způsobené aktivací komplementového systému agregáty imunoglobulinů. Z těchto důvodů se již tehdy někteří lékaři v praxi pokoušeli substituovat imunodeficientní pacienty intravenózní infuzí plné plasmy od zdravého dárce [24]. Dnes je intramuskulární aplikace využívána u profylaktického a terapeutického podání hyperimunních sér. Pro dlouhodobou substituční imunoglobulinovou léčbu se použije i. v. nebo s. c. cesta aplikace.
Intravenózní aplikace imunoglobulinů (IVIG)
Šedesátá léta minulého století přinesla značnou snahu připravit použitelný intravenózní preparát pro imunoglobulinovou substituci. Trvalo však dvě desetiletí systematického výzkumu, než se v roce 1981 dostávají do klinického použití intravenózní imunoglobulinové preparáty (IVIG), u nichž byla přidáním cukerných stabilizátorů a následně aminokyselin a též z důvodu lyofilizace albuminu zajištěna prevence agregace IgG [3, 25]
IVIG obsahuje široké spektrum protilátek. Je extrahován z plasmy řádově od desetitisíců dárců. Biologický poločas intaktního IgG po intravenózním podání se pohybuje mezi 15 až 22 dny, u některých imunodeficientních pacientů může být případně delší (až 40 dní) [10]. Podstatné pro substituční léčbu je zachování integrity molekul IgG protilátek. K účinku protilátek nestačí pouze specifický neutralizační efekt F(ab´)2 části molekuly protilátky. Také Fc část imunoglobulinové molekuly je nezbytná pro zajištění biologických funkcí. Jedná se nejen o zachování biologického poločasu, o fyziologickou aktivaci komplementu po vytvoření imunokomplexu antigen-protilátka, či o přestup IgG placentou, nýbrž též o Fc částí imunoglobulinové molekuly zprostředkovanou fagocytózu, tvorbu reaktivních kyslíkových radikálů a v konečném důsledku intracelulární usmrcení mikroorganismů. Fc gama receptory se vyskytují i na cytotoxických T-lymfocytech a NK buňkách a funkčně se podílejí na protilátkách závislé cytotoxicitě (ADCC). Z důvodů biologické aktivity je proto potřebné při přípravě imunoglobulinových preparátů zachovat a při substituční i při imunomodulační imunoglobulinové léčbě používat intaktní IgG molekuly (7S IgG).
U imunoglobulinových preparátů s enzymaticky odštěpenou Fc částí imunoglobulinové molekuly (5S IgG, štěpení pepsinem) klesá biologický poločas pod 24 hodin. Nejsou zachovány nespecifické funkce zprostředkované Fc částí molekuly. Tyto preparáty se proto v léčbě pacientů v současné době nepoužívají [10, 25].
Subkutánní aplikace imunoglobulinů (SCIG)
Až z roku 1980 je první následná moderní práce o subkutánním použití imunoglobulinů k léčbě, navazující na Brutonovu kazuistiku [4]. Jednalo se o 3 dospělé pacienty, u nichž byl v pomalé subkutánní infuzi několikrát týdně (1–2 ml/hod. v dávce 5–15 ml) aplikován intramuskulární imunoglobulinový preparát. Došlo k zásadnímu zlepšení klinického stavu pacientů, u nichž se při této formě substituce udržovaly sérové hladiny IgG na úrovni 5 g/l a vyšší. Limitací však byl stále dlouhý čas nutný pro aplikaci pomalých subkutánních infuzí.
Ve stejné době se stává reálné použití IVIG (nástup v roce 1981, viz výše). Vedlejší nežádoucí účinky při zavádění IVIG terapie (bolesti hlavy, teplota, mrazení, myalgie, únava, nauzea) u podskupiny pacientů v 80. letech minulého století a také přenos infekcí IVIG (hepatitida C, viz níže) a ekonomická náročnost vedou ve Švédsku počátkem 90. let 20. století k vypracování protokolu rychlého podávání levnějšího 16% imunoglobulinu v subkutánní aplikaci, původně určeného pro IMIG [11]. Ann Gardulf et al. dosahují infuzní rychlosti 17–20 ml/hod. s. c., přičemž řada těchto rychlých infuzí byla podávána při domácí léčbě; pacienty byly tolerovány i dvojnásobně vyšší expresní rychlosti podání [15]. V Evropě začal být pro subkutánní aplikaci používán koncentrovaný imunoglobulin (16% a vyšší) bez rtuti, jež byla jako konzervační činidlo součástí IMIG preparátů. SCIG léčba se ukázala bezpečnou i pro děti [1, 27].
Moderní SCIG terapie se stává rovnocennou alternativou IVIG, což je důležité také pro pacienty s obtížným žilním přístupem nebo s vysokými titry anti-IgA protilátek i předchozími nežádoucími reakcemi po IVIG. Oba způsoby léčby (IVIG a SCIG) mohou být zastupitelné.
MECHANISMY ÚČINKU
Při neutralizaci infekčních agens (včetně jejich produktů, např. bakteriemi produkovaných toxinů) se fyziologicky uplatňuje specifická protilátková imunita. Specificita reakce je dána vazbou antigenu na vazebné místo protilátky, jež se topicky nachází v oblasti Fab části protilátkové molekuly. Neutralizace antigenu s protilátkou je zesílena dalšími reakcemi zprostředkovanými Fc částí molekuly imunoglobulinu, které nejsou antigenně specifické. K nim náleží interakce imunokomplexu s Fc receptory na povrchu buněk nebo aktivace komplementového systému. Uvedené mechanismy vedou k opsonizaci a u bakteriální infekce ke komplementové lýze bakterií (viz též výše).
V případě virových infekcí mohou neutralizační protilátky zabraňovat přilnutí, průniku nebo intracelulární replikaci virů. Protilátky jsou schopny také viriony agregovat. U virem infikovaných buněk mohou být spouštěčem na protilátkách závislé cytotoxické reakce (ADCC). Obdobně jako při eliminaci bakteriálních infekcí mohou také opsonizovat a indukovat fagocytózu. Po vytvoření komplexu protilátek s virovými antigeny může též dojít k aktivaci klasické dráhy komplementu, která je prozánětlivá [10].
ZAJIŠTĚNÍ BEZPEČNOSTI IMUNOGLOBULINOVÝCH PREPARÁTŮ
Imunoglobuliny používané k léčbě jsou biologické preparáty získávané z lidské krevní plasmy od desetitisíců dárců, kteří jsou vyšetřováni na přenosné infekce HIV, hepatitidu B i na hepatitidu C. Pozornost je nutno věnovat také prionovým onemocněním.
V minulosti byla přenesena hepatitida C řadou IVIG preparátů. Infikováno bylo více než 200 pacientů [8, 18]. Nebyl však zaznamenán přenos HCV infekce intaramuskulárními preparáty ani v případech, když byly podány ve vysokých subkutánních dávkách. Aktuálně jsou imunoglobulinové preparáty testovány na HCV metodou PCR.
Veškeré z desítek registrovaných moderních imunoglobulinových preparátů při přípravě procházejí kombinací některých viry inaktivujících nebo štěpících technologických kroků. K nim náleží chladová etanolová precipitace (inaktivace a zničení HIV), nízké pH, použití pepsinu, ošetření solventy – detergenty (inaktivace HCV a dalších opouzdřených virů), pasterizace nebo nanofiltrace. Na základě dodržování těchto technologických bezpečnostních opatření nebyl od roku 1994 zaznamenán další přenos HCV infekce intravenózním imunoglobulinovým preparátem.
V rámci neinfekčních komplikací bylo vypozorováno, že cukerné stabilizátory, které zabraňují agregaci imunoglobulinů u IVIG preparátů, vedly u některých predisponovaných pacientů k vedlejším účinkům asociovaným s poruchou renálních funkcí, osmotickou nefrózou a smrtí. Nejvíce těchto závažných vedlejších nežádoucích účinků nastalo u pacientů, kteří obdrželi IVIG stabilizovaný sacharózou. CDC v Atlantě v roce 1999 vyhodnocuje 88 pacientů s renálním selháním po IVIG se zjištěním, že 90 % z nich obdrželo preparát stabilizovaný sacharózou. 13 pacientů (15 %) zemřelo (CDC, 1999). Ukazuje se, že u všech IVIG preparátů (nejen stabilizovaných sacharózou) je nutná při jejich podávání zvýšená opatrnost u predisponovaných pacientů s renální insuficiencí, diabetes mellitus, dehydratací, sepsí, paraproteinémií, věkem nad 65 let a při použití nefrotoxických léků.
Z cukerných stabilizátorů vykazuje nejnižší riziko pro akutní renální selhání sorbitol. Aminokyseliny osmotickou nefrózu nezpůsobují. Jako stabilizátory nemají za následek akutní renální selhání. Sekundárně velmi vzácně může nastat selhání ledvin nezávisle na stabilizátoru v případě, že by došlo po podání IVIG k hemolýze závislé na protilátkách (Coombsův test pozitivní) a k hemoglobinurii [31].
Obsah IgA v jednotlivých IVIG preparátech kolísá. Žádný z dostupných imunoglobulinových preparátů neobsahuje pouze IgG, nýbrž také určité větší či menší množství IgA. U IgA deficitních pacientů, kteří mohou rozeznat IgA molekulu jako cizí a reagovat na ni, může proto i z těchto důvodů dojít k rozvoji anafylaktoidní reakce. V případě komplikací po IVIG nebo při prokázání vysokých hladin anti-IgA protilátek u pacienta (podrobně viz níže) může být pro jeho substituční léčbu vhodná bezpečná alternativa podání imunoglobulinů subkutánně (SCIG) [16, 28].
INDIKACE IMUNOGLOBULINOVÉ LÉČBY U IMUNODEFICIENCÍ
Substituční imunoglobulinová léčba (IVIG nebo SCIG) je indikována u prokázaných protilátkových deficiencí, které přehledně shrnuje tabulka 2. Řadí se k nim X-vázaná agamaglobulinémie (XLA), veškeré typy běžné variabilní imunodeficience (CVID), včetně již definovaných genových poruch u CVID jako je ICOS deficience, porucha BAFF receptoru, CD19, CD81, CD20 i TACI polymorfismů asociovaných s projevy CVID, poruchy izotypového přesmyku (hyper-IgM syndromy) a další definované syndromy (viz tab. 2). U kombinovaných imunodeficiencí je indikace imunoglobulinové substituční terapie před transplantací a bezprostředně po transplantaci kostní dřeně nebo zárodečnými buňkami (CD34+) a dále po transplantaci kostní dřeně v závislosti na schopnosti B-lymfocytů tvořit protilátky [3, 26].
Substituční imunoglobulinová terapie je indikována také u pacientů se sekundárními hypogamaglobulinémiemi, jako je CLL a myelom, stav po chemoterapii, apod.
Pacienti s deficitem IgG podtříd, přechodnou hypogamaglobulinémií v dětství a pacienti se selektivním IgA deficitem by neměli být léčeni imunoglobulinovou substituční terapií, pokud není prokázána porucha tvorby specifických protilátek po očkování. Nejprve by měla být u nich v případě potřeby vyzkoušena pravidelná profylaktická antibiotická terapie.
U dětí nad 6 let věku a u dospělých je indikace zahájení substituční imunoglobulinové léčby při hodnotách sérového IgG pod 2,5 g/l u všech pacientů, v případě IgG 2,5–5 g/l u pacientů s deficitem tvorby specifických protilátek a opakovanými bakteriálními infekcemi, u hladin sérového IgG nad 5 g/l u pacientů s deficitem tvorby specifických protilátek a těžkými bakteriálními infekcemi. U dětí mladších než 6 let závisí indikace substituční imunoglobulinové léčby na klinické symptomatologii a příčině B-lymfocytární poruchy, s cílem zabránit rozvoji orgánového postižení. Například v případě diagnózy X-vázané agamaglobulinémie (XLA) je okamžitě nasazena substituční terapie [4, 10, 14, 20].
Nově vypracovaný funkční test stanovení plasmablastů, rutinně vyhodnotitelných průtokovým cytometrem po diagnostické vakcinaci, umožňuje i v případě zavedení substituční imunoglobulinové léčby v praxi vyšetřit, nakolik je u pacientů s hypogamaglobulinémií zachována schopnost odpovědi na antigenní stimulaci [29].
DÁVKOVÁNÍ SUBSTITUČNÍ IVIG A RYCHLÉ SCIG LÉČBY
Cílem substituční imunoglobulinové léčby je udržovat sérové koncentrace IgG pacienta na dostatečné hladině tak, aby nedocházelo ke zvýšené frekvenci infekcí. Optimálně se jedná o zajištění předinfuzních hladin v rozmezí normálních mezí, nebo minimálně o 4 g/l více, než byly sérové hladiny IgG u pacienta před léčbou. Orientační hodnotou může být předinfuzní koncentrace sérového IgG 5 g/l a více.
Dávkování IVIG
Při zahájení léčby IVIG je u prvních infuzí pacientů potřebná zvýšená opatrnost z důvodu tvorby imunokomplexů s antigenem. Dochází k postupnému nastavení hladin IgG v organismu, přičemž zásadní je saturace tkání. Sérové hladiny IgG, které se vyšetřují před podáním infuze, jsou využity k monitorování. Terapii je vhodné zahájit pomalými infuzemi, pokud možno v dobrém klinickém stavu pacienta.
U pacientů s agamaglobulinémií nebo výraznou hypogamaglobulinémií jsou na počátku substituční léčby IVIG vhodné pomalé infuze a rozdělení postupně zvyšované dávky na více dní. Zvýšené riziko anafylaktoidních reakcí je u pacientů s akutní bakteriální infekcí. Přeléčení pacienta antibiotiky týden před zahájením IVIG může riziko jeho reaktivity z důvodu infekcí snížit.
Počáteční celkovou dávku 400 mg/kg/měsíc lze při zahájení saturace organismu rozdělit do kratších intervalů, než jsou následné třítýdenní až měsíční intervaly při udržovacích dávkách, s postupným zvyšováním dávek jednotlivých infuzí. Při zahájení léčby tímto postupem, který saturaci urychlí, by v první infuzi neměly být obsaženy více než 2/3 z vypočítané udržovací měsíční dávky v gramech. V praxi je substituční léčba IVIG propočítána a následně udržována měsíční dávkou 400 mg/kg hmotnosti, která může být v případě potřeby zvýšena, aby byla kontrolována manifestace onemocnění. Přibližně po třech měsících od zahájení léčby je dosaženo stabilních předinfuzních hladin sérového IgG.
Ve většině případů je substituční dávka 400 mg na kg tělesné hmotnosti každé 3–4 týdny dostatečná. Pokud je však např. u imunodeficientního pacienta diagnostikována chronická obstrukční plicní nemoc, může případně při dávkách 500 až 700 mg na kg hmotnosti každé 2–4 týdny dojít ke zlepšení plicních funkcí [26]. Pacienti s hypogamaglobulinémií, kteří mají alespoň částečně zachovánu vlastní tvorbu protilátek ve třídě IgA, mohou být z hlediska ochrany sliznic v menším riziku rozvoje orgánového poškození než pacienti s IgA deficitem, neboť IgG protilátky doplňované substitucí zcela funkci IgA protilátek na sliznici nenahradí.
Vedlejší reakce IVIG jsou asociovány ve větší míře s rychlými infuzemi, zejména pak u pacientů s akutní infekcí, u nichž by v té době neměla být IVIG léčba aplikována, nebo u pacientů, kteří zahajují léčbu. U nich je nutná zvýšená opatrnost. V riziku jsou též pacienti IgA deficitní, u nichž je indikováno vyšetření anti-IgA protilátek z důvodu prevence anafylaktoidní reakce. Klinickou snášenlivost shrnuje tabulka 3 [12, 20].

Vedlejší reakce nastávají také častěji při změně preparátu, včetně anafylaktoidních reakcí. Imunoglobulinové preparáty by proto neměly být u pacientů, kteří jsou na zavedené léčbě bez potíží, měněny pouze z důvodu nižší ceny jiného preparátu. IVIG preparáty nejsou bez rizika zaměnitelné.
Pokud je terapie zavedena a pacientem je preparát tolerován, je mu podávána dostatečná substituční dávka a jsou dodržovány intervaly podání IVIG do jednoho měsíce, jsou vedlejší reakce limitovány. Kratší intervaly při podávání IVIG (např. každé 2 týdny) snižují výskyt vedlejších reakcí.
Výskyt mírných vedlejších reakcí při infuzi může být limitován snížením rychlosti infuze. V jejich případě se jedná zejména o reakce spojené s tvorbou imunokomplexů. Vhodná může být premedikace pacienta paracetamolem nebo antihistaminikem. Pokud by byl předpoklad rozvoje těžké reakce, k paracetamolu a antihistaminiku se před infuzí přidá hydrokortison (i. v. 6 mg/kg, maximum 100 mg). Podání lze opakovat za 3 hodiny, pokud by infuze ještě probíhala. V případě reakcí pacienta na jeden preparát IVIG může někdy pomoci jeho záměna za jiný. Alternativou je léčba SCIG.
Zejména u malých dětí může být před infuzí v místě venepunkce aplikován krém nebo sprej s lokálním anestetikem. Pravidelné infuze tak děti lépe snášejí.
Dávkování SCIG
Pro SCIG je vhodný 16% IgG preparát bez rtuti používané jako konzervačního činidla. Sérové hladiny imunoglobulinů se změří před zahájením SCIG infuzí (výchozí hodnoty). Další hladinu sérového IgG stačí stanovit před pátou SCIG infuzí.
U pacienta bez předchozí imunoglobulinové léčby lze saturaci bezpečně zahájit dávkou 200 mg/kg a rychlostí 10 ml za 60 minut, případně lze tuto zkrátit až na 45 minut. U dospělých při použití 16% SCIG preparátu tomu odpovídá praktický protokol: postupně podat vždy 2krát týdně nejprve dávku 30 ml (tzn. v průběhu prvního týdne s odstupem několika dní rozděleně aplikovat 2krát 30 ml), pak dávku zvýšit na 40 ml (tj. druhý týden podat rozděleně 2krát 40 ml) a následující týden navýšit dávku na 50 ml (tzn. v průběhu třetího týdne podat 2krát 50 ml) rychlostí 10 ml za 45 minut (osobní zkušenost, Karolinska Institute, Stockholm, Švédsko). Pokud by se saturace neprovedla, došlo by z důvodu farmakokinetiky SCIG při použití udržovacích dávek k dosažení dostatečných terapeutických hladin až za 6 měsíců.
Rychlé saturace lze dosáhnout také denním podáváním dávky 100 mg/kg/den SCIG po dobu 5 až 10 dní [21].
Při vpichu aplikovat jehlu hluboko s. c. (viz obr. 3–5). Sníží se reaktivita dendritických buněk kůže v rámci lokálních vedlejších účinků. Nejčastěji se SCIG aplikuje do oblasti čtyř abdominálních kvadrantů (místa se systematicky střídají), alternativně do oblasti laterální strany dolních končetin. Nejvhodnější je jehla s křidélky ("butterfly") o průměru velikosti 23–25 G, zejména u dětí. Jehlu ohnout o 90° (viz obr. 3), vpich provést kolmo s. c. (viz obr. 4, 5) a jehlu fixovat náplastí. Nikdy nezapomenout před aplikací SCIG aspirovat (naučit pacienty – rodiče při edukaci pro domácí léčbu!). Nesmí dojít k i. v. podání.

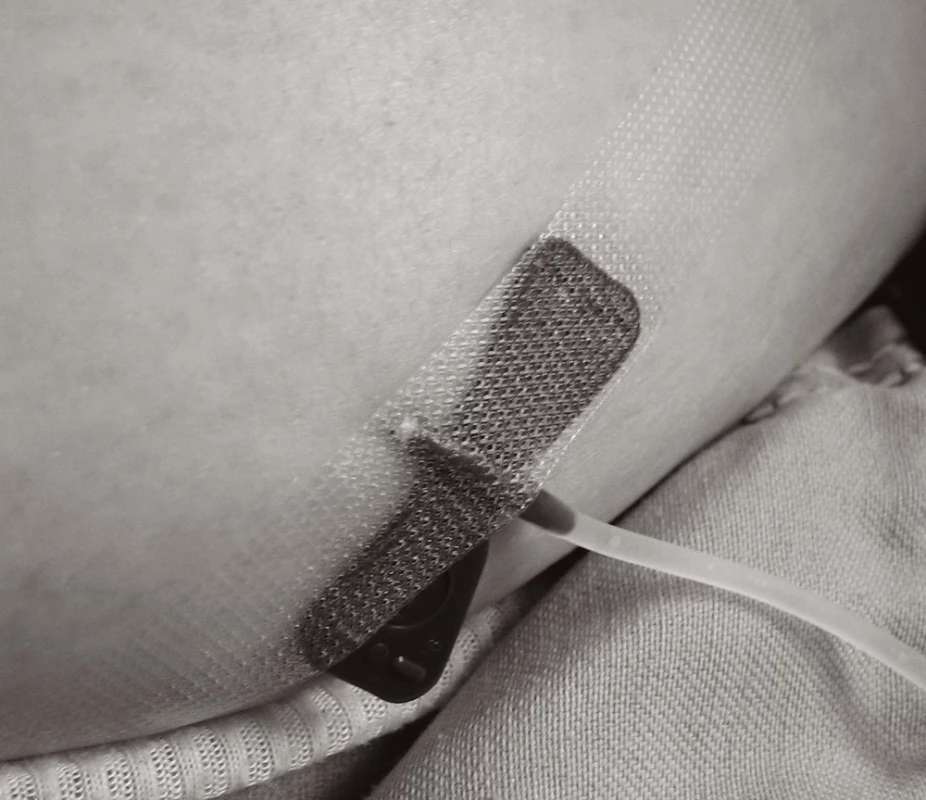
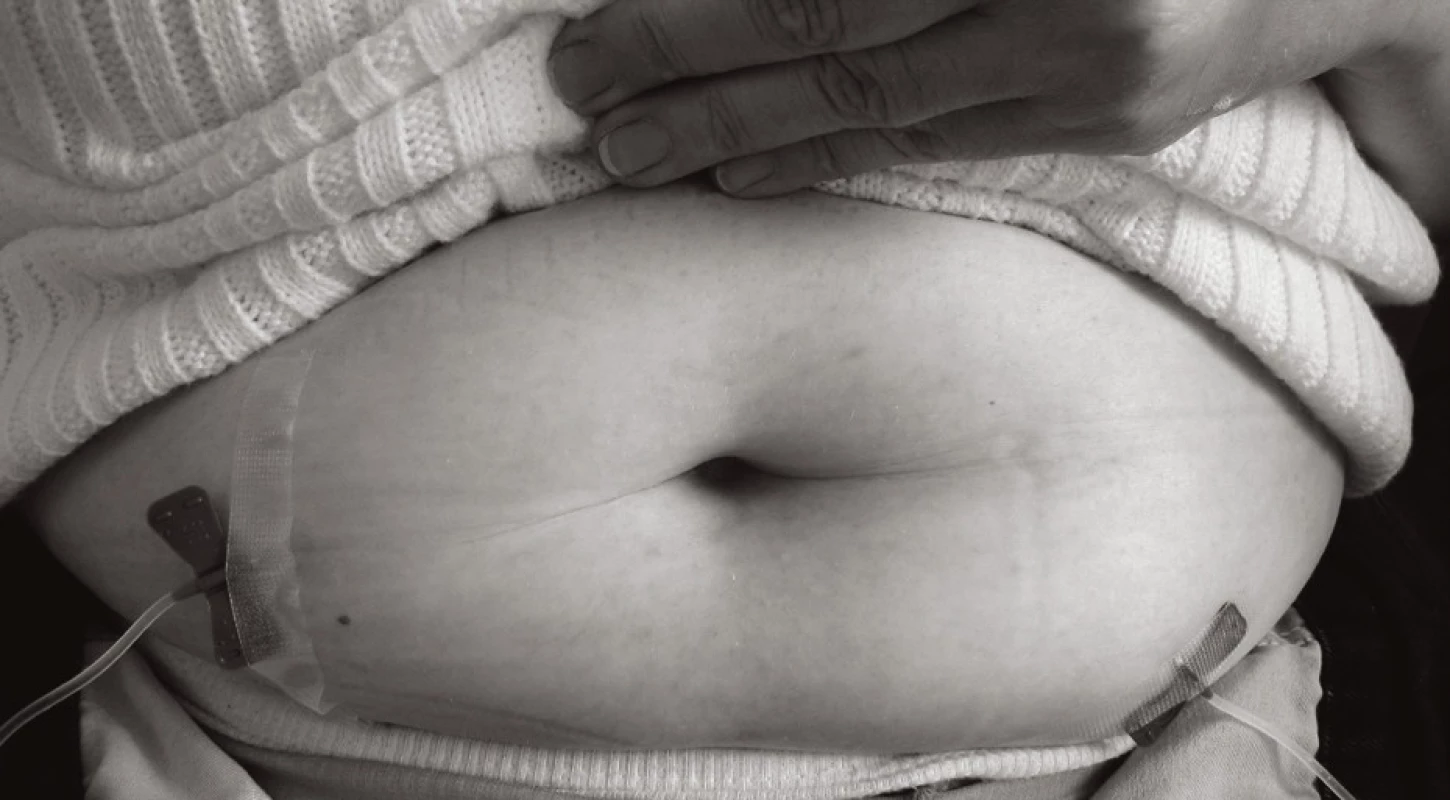
Množství SCIG do jednoho místa vpichu se vyhodnotí podle poměrů subkutánní tkáně: u dětí se jedná o 5–10 ml. U dospělých maximálně 20 ml do jednoho místa, pokud není použita hyaluronidáza.
Po dosažení dostatečných hladin IgG se přechází na udržovací dávky, tj. s. c. infuze 1krát za týden v dávce 100 mg/kg/týden (tzn. 0,6 ml/kg/týden u 16% SCIG preparátu). Rychlost podání se podle snášenlivosti postupně zvyšuje na konečných 10 ml za 30 minut (rychlá SCIG) podle schématu:
- 10 ml/ 45 min.,
- 10 ml/ 40 min.,
- 10 ml/ 35 min.,
- 10 ml/ 30 min.
Při zvyšování rychlosti lze též prakticky postupovat a dojít k výsledné rychlosti 10 ml za 30 minut podle protokolu (16 % SCIG preparát) s dávkováním 100 mg/kg/týden:
- První infuze rychlostí 10 ml/hod.
- Zvyšování o 1–2 ml hod./týden
- Osmá infuze 20 ml/hod.
V prvních 8 týdnech aplikace se mohou běžně vyskytnout lokální reakce (zarudnutí v místě aplikace), které však postupně ustupují. V této době také probíhá edukace pacienta (rodičů), aby byla bezpečně zajištěna správná domácí léčba a aplikace udržovacích dávek.
Pro aplikaci SCIG se používá přenosná infuzní pumpa. V našich podmínkách je vhodná taková, která umožňuje použití univerzální injekční stříkačky, neboť tyto se stávají pro pacienta spotřebním materiálem (viz obr. 2). U infuzních pump se specializovanými stříkačkami je nutno vzít v úvahu, že provozní náklady s každou speciální stříkačkou narůstají. Substituční léčba je celoživotní.
Ani při domácí léčbě SCIG není potřeba pacienta vybavovat autoinjektorem s adrenalinem. Při dodržení postupů bezpečného podání SCIG k anafylaktoidní ani k anafylaktické reakci nedochází.
Pacienti, kteří přecházejí z IVIG léčby na SCIG, by měli obdržet první dávku SCIG během jednoho týdne po IVIG infuzi, aby byly zachovány terapeutické hladiny IgG v organismu [26].
Krém s lokálním anestetikem může být použit v místě vpichu, zejména u dětí.
U malých dětí může být také podána subkutánní infuze 2–3 ml do jednoho místa vpichu přímo injekční stříkačkou v průběhu 2–5 minut (osobní zkušenost, Seattle Children’s Hospital, Seattle, WA, USA) [30]. V závislosti na hmotnosti dítěte mohou být jedna až dvě injekce SCIG týdně dostatečné. U dospělých lze takto přímo (s pumpou nebo bez pumpy) podávat injekce SCIG denně. U 70kg pacienta a 16% SCIG preparátu se jedná přibližně o objem 6 ml denně, neboli 2krát 3 ml do místa vpichu. Při každodenním podání (nebo případně podání ob den ve dvojnásobné dávce, respektive prakticky 3krát týdně, vždy při zachování sumární týdenní dávky) je zajištěna také vynikají ustálená hladina IgG. V anglické nomenklatuře je aplikace SCIG injekční stříkačkou bez infuzní pumpy označována termínem „rapid push“.
Situace je do jisté míry podobná substituční strategii při moderní inzulinové terapii u pacientů s diabetes mellitus s přiblížením se fyziologickému stavu.
Tolerovány jsou i vyšší rychlosti (tzv. expresní SCIG), jakož i vyšší koncentrace nově připravovaných SCIG preparátů (20%). Také je studována možnost zvýšení objemu do jednoho místa vpichu s. c. s aplikací rekombinantní lidské hyaluronidázy. Podobná strategie je po desetiletí využívána u s. c. infuzí lokálních anestetik [21].
SCIG je bezpečnou alternativou léčby také u pacientů s anti-IgA protilátkami, u nichž proběhly těžké anafylaktoidní reakce nebo kteří jsou v riziku, jak jsme prokázali v zaslepené studii u německé populace CVID pacientů [16, 28].
DOMÁCÍ LÉČBA
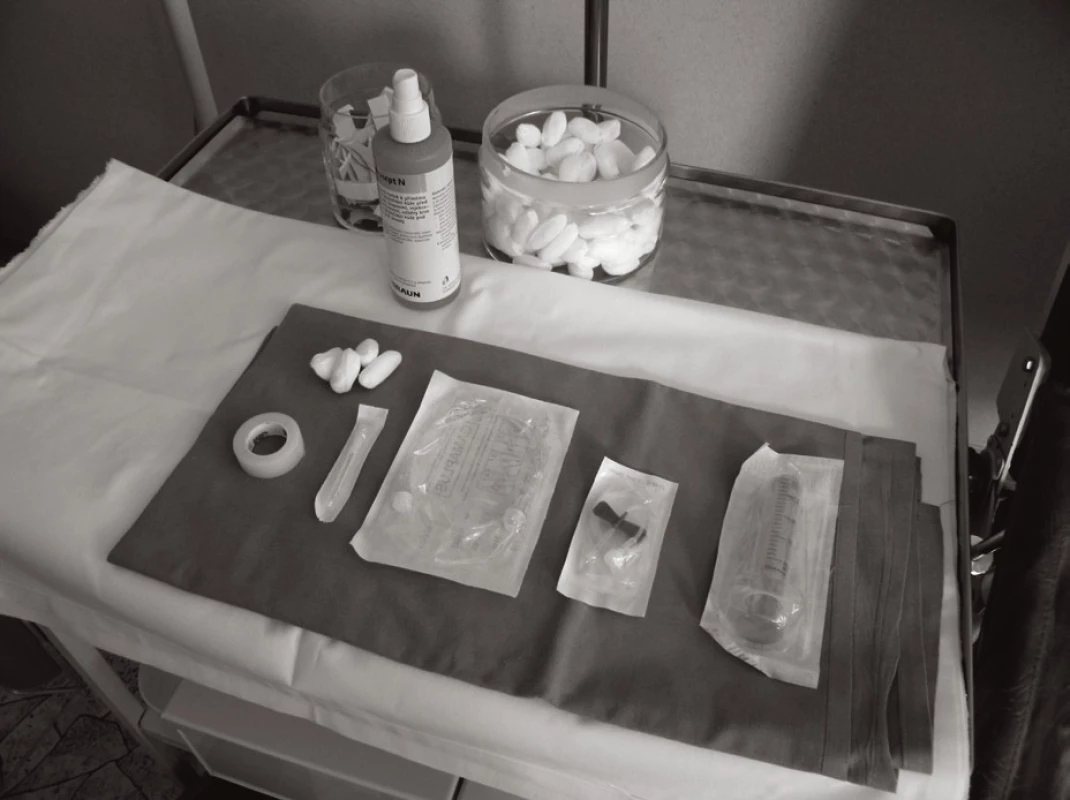
Jednoduché instrumentárium (obr. 1, 2) a způsob aplikace (obr. 3, 4, 5 a 6) umožňuje po patřičném zaškolení pacienta a dobrém rodinném (sociálním) zázemí zejména u SCIG terapie bezpečnou domácí léčbu. Může zvýšit kvalitu života nemocného. Při domácí léčbě pacient nesmí být nikdy sám, aby byla garantována dostupná účinná pomoc v případě výskytu jakýchkoli komplikací.


NEŽÁDOUCÍ VEDLEJŠÍ ÚČINKY
Mírné vedlejší systémové reakce se u aplikace IVIG vyskytují mezi 2–6 % [22]. V řadě případů mohou být způsobeny tvorbou imunokomplexů. Snížení rychlosti podávané infuze může přispět k jejich zvládnutí. Jedná se o bolest hlavy, mrazení, bolest v zádech, myalgie a artralgie, únavu, malátnost, zvýšenou teplotu, třesavku, zčervenání, kopřivku, pruritus, křeče v břiše, nauzeu, zvracení. Může však dojít také k tachykardii, bolesti na hrudi, k bronchospasmu, ke kolapsu, zástavě dýchání, hypotenzi nebo naopak k hypertenzi. Závažnými komplikacemi mohou být systémové anafylaktoidní reakce (včetně reakcí způsobených anti-IgA protilátkami), aseptická meningitida, renální selhání u nedostatečně hydratovaných pacientů nebo v závislosti na stabilizátoru (viz též výše Zajištění bezpečnosti imunoglobulinových preparátů).
Z důvodů viskozity séra při vysokých dávkách IVIG může dojít také k rozvoji trombembolických komplikací, které mohou vést i k infarktu myokardu, mozkové příhodě, pulmonální embolizaci [3, 26].
U SCIG jsou nežádoucí účinky méně časté, subkutánní infuze jsou velmi dobře tolerovány. Většinou mírné lokální vedlejší reakce zahrnují zduření, zarudnutí, svědění. Při zahájení léčby jsou mírné lokální reakce přítomny u většiny pacientů, s postupem opakovaných aplikací ustupují.
SCIG terapie je bezpečná také pro pacienty s přítomnými anti-IgA protilátkami a byla dobře tolerována i u těch, kteří prodělali závažné reakce při použití IVIG [16].
TESTOVÁNÍ ANTI-IGA PROTILÁTEK
Ve středoevropské populaci nalézáme anti-IgA protilátky přibližně u 10 % pacientů s nedetekovatelnými hladinami sérového IgA [28]. Při rutinním stanovení hladin sérových imunoglobulinů nefelometrem se v praxi jedná o měřené hodnoty sérového IgA nižší než 0,05 g/l. U těchto pacientů s neměřitelnými hladinami sérového IgA je indikováno vyšetření anti-IgA protilátek, které se vyskytují ve třídě IgG a mohou způsobit anafylaktoidní reakci aktivací komplementu. Dřívější studie, které převážně uváděly IgE isotyp anti-IgA protilátek, se zatím nepotvrdily. Pro stanovení anti-IgA protilátek je k dispozici standardizovaná kvantitativní ELISA souprava vypracovaná s blokačním krokem, jež vylučuje falešnou pozitivitu stanovení anti-IgA protilátek (Anti-IgA isotype IgG Human ELISA, BioVendor, Brno, Česká republika). V případě nálezu pozitivity anti-IgA protilátek, zejména ve vyšších hodnotách (vysoký titr protilátek anti-IgA protilátek), může být pro zachycené pacienty bezpečné podání SCIG místo IVIG s výhodou. Tuková tkáň, která je depotním prostorem při SCIG aplikaci, indukuje toleranci.
Kombinace kvantitativního stanovení anti-IgA protilátek a měření sérových hladin IgA u pacientů je efektivní a bezpečnou strategií pro diagnostiku a pro prevenci anti-IgA protilátkami zprostředkované anafylaktoidní reakce [16, 23, 28].
ZÁVĚR
Lidský sérový IgG, získaný od zdravých dárců, lze aplikovat intramuskulárně (IMIG), subkutánně (SCIG) a intravenózně (IVIG). Od zavedení IVIG v 80. letech minulého století se přestala používat substituční intramuskulární aplikace (IMIG), která byla suboptimální.
U některých pacientů se při IVIG léčbě mohou rozvinout systémové nežádoucí reakce, u jiných může vzniknout problém se zajištěním venózního přístupu. Je proto výhodné, že byla paralelně s IVIG vypracována subkutánní aplikace lidského IgG, která nevyžaduje žilní přístup (SCIG). IVIG a SCIG jsou zastupitelné a jsou v terapeutickém účinku ekvivalentní.
SCIG může být použita i u pacientů s anti-IgA protilátkami a s předchozími systémovými reakcemi při aplikaci IVIG, včetně dětí a těhotných žen. Vyšetření anti-IgA protilátek u pacientů s neměřitelnými hodnotami sérového IgA snižuje riziko anafylaktoidních reakcí u IVIG. SCIG je bezpečnou alternativou IVIG a může být podána i u pacientů, kteří prodělali závažnou systémovou reakci při IVIG.
Domácí terapie, zejména v případě SCIG aplikace, může zvýšit kvalitu života pacientů závislých na celoživotní imunoglobulinové substituční léčbě. Při patřičném výběru pacienta pro domácí léčbu a zaškolení není nutné vybavovat nemocného autoinjektorem s adrenalinem.
Do redakce došlo dne 2. 4. 2013.
Adresa pro korespondenci:
Doc. MUDr. Vojtěch Thon, Ph.D.
Ústav klinické imunologie a alergologie LF MU
FN u sv. Anny
Pekařská 53
656 91 Brno
e-mail: vojtech.thon@fnusa.cz
Sources
1. Abrahamsen, T. G., Sandersen, H., Bustnes, A. Home therapy with subcutaneous immunoglobulin infusions in children with congenital immunodeficiencies. Pediatrics, 1996, 98, p. 1127–1131.
2. Al-Herz, W., Bousfiha, A., Casanova, J. L., Chapel, H., Conley, M. E., Cunningham-Rundles, C., Etzioni, A., Fischer, A., . L., Geha, R. S., Hammarström, L., Nonoyama, S., Notarangelo, L. D., Ochs, H. D., Puck, J. M., Roifman, C. M., Seger, R., Tang, M. L. Primary immunodeficiency diseases: an update on the classification from the international union of immunological societies expert committee for primary immunodeficiency. Front Immunol., 2011, 2, p. 1–26.
3. Ballow, M. Immunoglobulin therapy: replacement and immunomodulation. In Clinical Immunology, Principles and Practice. Elsevier, 2008, Chapter 85, p. 1265–1280.
4. Berger, M. Principles of and advances in immunoglobulin replacement therapy for primary immunodeficiency. Immunol. Allergy Clin. North Am., 2008, 28, p. 413–437.
5. Berger, M., Cupps, T. R., Fauci, A. S. Immunoglobulin replacement therapy by slow subcutaneous infusion. Ann. Intern. Med., 1980, 93, p. 55–56.
6. Bruton, O. C. Agammaglobulinemia. Pediatrics, 1952, 9, p. 722–728.
7. CENTERS FOR DISEASE CONTROL (CDC) Renal insuficiency and failure associated with immune globulin intravenous therapy – United States 1985–1998. MMWR Morb Mortal Wkly Rep., 1999, 48, p. 518–521.
8. CENTERS FOR DISEASE CONTROL (CDC) Outbreak of hepatitis C associated with intravenous immunoglobulin administration: United States Oct 1993–June 1994. MMWR Morb Mortal Wkly Rep., 1994, 43, p. 505–509.
9. Cohn, E. J. The history of plasma fractionation. In Merler, E. Advances inmilitary medicine, vol. 1. Boston: Little, Brown and Company, 1948. p. 364–443.
10. Eibl, M. M., Wolf, H. M. Immunglobulintherapie. In Pädiatrische Allergologie und Immunologie, Urban und Fischer, 1999, Kap. 38, p. 401–409.
11. Gardulf, A., Hammarström, L., Smith, C. I. Home treatment of hypogammaglobulinaemia with subcutaneous gammaglobulin by rapid infusion. Lancet, 1991, 338, p. 162–166.
12. Gelfand, E. W. Differences between IGIV products: impact on clinical outcome. Int. Immunopharmacol., 2006, 6, p. 592–599.
13. Good, R. A., Varco, R. L. A clinical and experimental study of agammaglobulinemia. Lancet, 1955, 75, p. 245–271.
14. Hoernes, M., Seger, R., Reichenbach, J. Modern management of primary B-cell immunodeficiencies. Pediatr Allergy Immunol., 2011, 22, p. 758–769.
15. Hansen, S., Gustafson, R., Smith, C. I., Gardulf, A. Express subcutaneous IgG infusions: decreased time of delivery with maintained safety. Clin. Immunol., 2002, 104, p. 237–241.
16. Horn, J., Thon, V., Bartonkova, D., Salzer, U., Warnatz, K., Schlesier, M., Peter, H. H., Grimbacher, B. Anti-IgA antibodies in common variable immunodeficiency (CVID): diagnostic workup and therapeutic strategy. Clin. Immunol., 2007, 122, p. 156–162.
17. Chapel, H., Lucas, M., Lee, M., Bjorkander, J., Webster, D., Grimbacher, B., Fieschi, C., Thon, V., Abedi, M. R., Hammarstrom, L. Common variable immunodeficiency disorders: division into distinct clinical phenotypes. Blood, 2008, 112, p. 277–286.
18. Christie, J. M., Healey, C. J., Watson, J., Wong, V. S., Duddridge, M., Snowden, N., Rosenberg, W. M., Fleming, K. A., Chapel, H., Chapman, R. W. Clinical outcome of hypogammaglobulinaemic patients following outbreak of acute hepatitis C: 2-year follow-up. Clin. Exp. Immunol., 1997, 110, p. 4–8.
19. Litzman, J., Stikarovska, D., Pikulova, Z., Pavlik, T., Pesak, S., Thon, V., Kuklinek, P., Lokaj, J. Change in referral diagnoses and diagnostic delay in hypogammaglobulinaemic patients during 28 years in a single referral centre. Int. Arch. Allergy Immunol., 2010, 153, p. 95–101.
20. Maarschalk-Ellerbroek, L. J., Hoepelman, I. M., Ellerbroek, P. M. Immunoglobulin treatment in primary antibody deficiency. Int. J. Antimicrob. Agents, 2011, 37, p. 396–404.
21. Misbah, S., Sturzenegger, M. H., Borte, M., Shapiro, R. S., Wasserman, R. L., Berger, M., Ochs, H. D. Subcutaneous immunoglobulin: opportunities and outlook. Clin. Exp. Immunol., 2009, 158, p. 51–59.
22. Orange, J. S., Hossny, E. M., Weiler, C. R., Ballow, M., Berger, M., Bonilla, F. A., Buckley, R., Chinen, J., El-Gamal, Y., Mazer, B. D., Nelson, R. P., Jr., Patel, D. D., Secord, E., Sorensen, R. U., Wasserman, R. L., Cunningham-Rundles,C.; Primary Immunodeficiency Committee Of The American Academy Of Allergy, Asthma And Immunology Use of intravenous immunoglobulin in human disease: a review of evidence by members of the Primary Immunodeficiency Committee of the American Academy of Allergy, Asthma and Immunology. J. Allergy Clin. Immunol., 2006, 117, p. S525–553.
23. Rachid, R., Castells, M., Cunningham-Rundles, C., Bonilla, F. A. Association of anti-IgA antibodies with adverse reactions to γ-globulin infusion. J. Allergy Clin. Immunol., 2011, 128, p. 228–230.
24. Skoda-Smith, S., Torgerson, T. R., Ochs, H. D. Subcutaneous immunoglobulin replacement therapy in the treatment of patients with primary immunodeficiency disease. Ther. Clin. Risk Manag., 2010, 6, p. 1–10.
25. Skvaril, F., Gardi, A. Differences among available immunoglobulin preparations for intravenous use. Pediatr. Infect. Dis. J., 1988, 7, p. S43–48.
26. Stiehm, R. E., Chapel, H. Conventional Therapy of Primary Immunodeficiency Diseases. In Primary Immunodeficiency Diseases: A Molecular and Genetic Approach. Oxford University Press, 2007, Chapter 46, p. 655–668.
27. Thomas, M. J., Brennan, V. M., Chapel, H. H. Rapid subcutaneous immunoglobulin infusions in children. Lancet, 1993, 342, p. 1432–1433.
28. Thon, V. Importance of screening IgG anti-IgA antibodies in hypogammaglobulinemic subjects to prevent anaphylactoid reactions. Klinická imunológia a alergológia, 2010, 20, p. 26–27.
29. Thon, V., Vlkova, M., Chovancova, Z., Litzman, J., Lokaj, J. Flow Based Enumeration of Plasmablasts in Peripheral Blood After Vaccination as a Novel Diagnostic Marker for Assessing Antibody Responses in Patients with Hypogammaglobulinaemia. In Clinical Flow Cytometry – Emerging Applications, Ingrid Schmid (Ed.), InTech, 2012, Chapter 7, p. 125–142. ISBN: 978-953-51-0575-6. Dostupné na www: http://www.intechopen.com/books/clinical-flow-cytometry-emerging-applications/
30. Torgerson, T. R. Overview of routes of IgG administration. J. Clin. Immunol., 2013, 33, Suppl 2, p. S87–89.
31. Welles, C. C., Tambra, S., Lafayette. R. A. Hemoglobinuria and acute kidney injury requiring hemodialysis following intravenous immunoglobulin infusion. Am. J. Kidney Dis., 2010, 55, p. 148–151.
Labels
Hygiene and epidemiology Medical virology Clinical microbiologyArticle was published in
Epidemiology, Microbiology, Immunology

2013 Issue 2
-
All articles in this issue
- Antibiotická rezistence u netyfových sérovarů Salmonella spp. v České republice
- A Novel Typing Method and Scheme for Streptococcus pneumoniae
- Salmonellosis Outbreaks in the Czech Republic in 2012
- Intravenous and Subcutaneous Immunoglobulin Therapy
- Prevalence Estimates of Problem Drug Users in the Czech Republic in 2006 and 2007 using the Capture-Recapture Method
- Epidemiology, Microbiology, Immunology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Intravenous and Subcutaneous Immunoglobulin Therapy
- Antibiotická rezistence u netyfových sérovarů Salmonella spp. v České republice
- A Novel Typing Method and Scheme for Streptococcus pneumoniae
- Prevalence Estimates of Problem Drug Users in the Czech Republic in 2006 and 2007 using the Capture-Recapture Method
