Nová metoda a schéma typizace Streptococcus pneumoniae
A Novel Typing Method and Scheme for Streptococcus pneumoniae
Study aim:
To introduce a novel molecular PCR method for the typing of Streptococcus pneumonia in the National Reference Laboratory (NRL) for Streptococcal Infections.
Material and Methods:
Strains of Streptococcus pneumoniae are referred to the NRL from different regions of the Czech Republic. Generally, the identification and typing are based on strain morphology, optochin susceptibility, bile solubility, latex agglutination, and the Quellung reaction. Since 2012, a novel multiplex polymerase chain reaction (mPCR) assay has been introduced. The novel assay was tested on 210 S. pneumoniae isolates and 8 isolates of the related species S. pseudopneumoniae, S. sanguinis, and S. oralis.
Results:
The NRL for Streptococcal Infections has included a novel mPCR assay in the algorithm of S. pneumoniae identification and typing. The mPCR assay was able to identify and type any pneumococcal strain from the study collection, with the isolates of the related species remaining negative. The mPCR assay showed 100% sensitivity and specificity in this study. The pCR appeared to be an excellent tool for S. pneumoniae typing.
Conclusion:
Until recently, S. pneumoniae serotypes and serogroups were differentiated using a serological approach (Quellung reaction), but the NRL for Streptococcal Infections has switched to a novel mPCR assay. This molecular tool improves S. pneumoniae typing, making it more accurate.
Keywords:
PCR typing of Streptococcus pneumoniae – Quellung reaction – Streptococcus pneumoniae
:
Vacková Zuzana; Klímová Martina; Kozáková Jana
:
Epidemiol. Mikrobiol. Imunol. 62, 2013, č. 2, s. 50-58
Cíl práce:
Zavedení nové molekulární PCR metodiky pro účely typování kmenů Streptococcus pneumoniae v NRL pro streptokokové nákazy.
Materiál a metodika:
Kmeny Streptococcus pneumoniae jsou zasílány do NRL z různých regionů České republiky. Běžně je identifikace a typizace založena na morfologii kmene, citlivosti k optochinu, rozpustnosti ve žluči, latexaglutinaci a Quellung reakci. Od roku 2012 byla použita nová multiplexová polymerázová řetězová reakce (mPCR). Proběhlo testování nové metody na 210 izolátech S. pneumoniae a na 8 izolátech příbuzných druhů S. pseudopneumoniae, S. sanguinis a S. oralis.
Výsledky:
Nová mPCR metoda byla v NRL pro streptokokové nákazy aplikována do algoritmu identifikace a především typizace S. pneumoniae. Technika mPCR umožnila správně identifikovat a otypovat všechny kmeny pneumokoků zkoumaného souboru, naopak izoláty příbuzných druhů vykazovaly správnou negativní reakci. Metoda mPCR měla ve zkoumaném souboru 100% senzitivitu i specificitu. Ukázalo se, že PCR reakce je pro typování S. pneumoniae výborně použitelná metoda.
Závěr:
Sérotypy a séroskupiny S. pneumoniae byly doposud rozlišovány pouze pomocí sérologické Quellung reakce, nyní došlo ke změně a novému zavedení mPCR reakce. Jedná se o molekulární metodu zlepšující a zpřesňující typizaci S. pneumoniae.
Klíčová slova:
PCR typování Streptococcus pneumoniae – Quellung reakce – Streptococcus pneumoniae
ÚVOD
Streptococcus pneumoniae patří celosvětově k nejvýznamnějším patogenům. Způsobuje pestrou škálu různých onemocnění, od nejzávažnějších invazivních onemocnění (IPO), jakými jsou meningitidy, bakterémie, sepse či pneumonie, až po život zpravidla neohrožující akutní otitidy či sinusitidy. Nejvyšší nemocnost IPO je pozorována u nejmenších dětí (do jednoho roku věku), u seniorů (nad 65 let věku), ale také vysoce rizikovou skupinu představují imunokompromitovaní pacienti a pacienti s chronickými kardiopulmonárními nemocemi [1].
Pneumokoky se řadí mezi grampozitivní bakterie, typicky se vyskytující ve formě diplokoků. Jejich hlavním faktorem virulence je pouzdro. Jedná se o pouzdro polysacharidové povahy, tvořené typově specifickými antigeny. Podle strukturální variability typově specifického polysacharidového pouzderného antigenu, se pneumokoky klasifikují do více než 90 sérotypů a 46 séroskupin [2]. Sérotypy můžeme podle složení pnemokokových vakcín označit na dvě skupiny, vakcinační a nevakcinační. Distribuce jednotlivých sérotypů je ovlivněna geografickou polohou, socioekonomickými podmínkami, věkem pacienta, klinickou formou onemocnění, ale i vakcinační strategií [3, 4, 5]. Při dlouhodobém používání konjugovaných vakcín se nesmí zapomínat i na problém fenoménu replacementu, kompetitivní náhrady sérotypů krytých vakcínou jinými, tzv. nevakcinačními pneumokokovými sérotypy.
Z mnoha důvodů je proto velice žádoucí neustále monitorovat a analyzovat zastoupení sérotypů u kmenů pneumokoků izolovaných z klinických materiálů pacientů. A právě i této problematice se NRL pro streptokokové nákazy (NRL/STR) již celou řadu let věnuje a snaží se novelizovat používané metodiky dle současně známých informací.
V tomto sdělení prezentujeme novou molekulární metodu PCR používanou v procesu identifikace, ale především typizace S. pneumoniae v NRL/STR. Tato metoda byla v průběhu roku 2012 NRL/STR testována a od roku 2013 zařazena do rutinního provozu laboratoře.
MATERIÁL A METODIKY
Kmeny
V období testování nové PCR metody byly použity kmeny S. pneumoniae napříč sérotypy (210 izolátů) z databáze IPO NRL/STR, S. pseudopneumoniae (2 izoláty), S. sanguinis (4 izoláty) a S. oralis (2 izoláty) ze sbírky NRL/STR. Celkem bylo tedy otestováno 218 izolátů. Jednalo se o kmeny získané z různých biologických vzorků – hemokultura (110 izolátů), likvor (24 izolátů), stěr z epidurálního prostoru (1 izolát), sputum (14 izolátů), bronchoalveolární laváž (10 izolátů), nazofaryngeální výtěr (31 izolátů), stěr ze středouší (9 izolátů), stěr z oka (2 izoláty), punktát (8 izolátů), aspirát (4 izoláty), absces (4 izoláty), stěr z rány (1 izolát).
Identifikace Streptococcus pneumoniae
Pro identifikaci species se používá několik testů. Po získání čisté kultury bakteriálního kmene na krevním agaru Columbia (COA) s optochinovým diskem je hodnocena morfologie kolonií. Pneumokoky jsou citlivé k optochinu v koncentraci, jenž neovlivní ostatní viridující streptokoky. Následuje Test rozpustnosti ve žluči, pneumokoky jsou lyzovány v 10% roztoku deoxycholátu sodného. Kombinací těchto metod zjistíme, zda se jedná o S. pneumoniae. V případě problémů či nejasností lze využít ještě další identifikační metody, jakými jsou např. latexaglutinace, reakce s pneumokokovým OMNI sérem, biochemická identifikace, mikroskopie, katalázový test, či molekulární metody (PCR, MLST).
Typizace Streptococcus pneumoniae
1. Sérotypizace
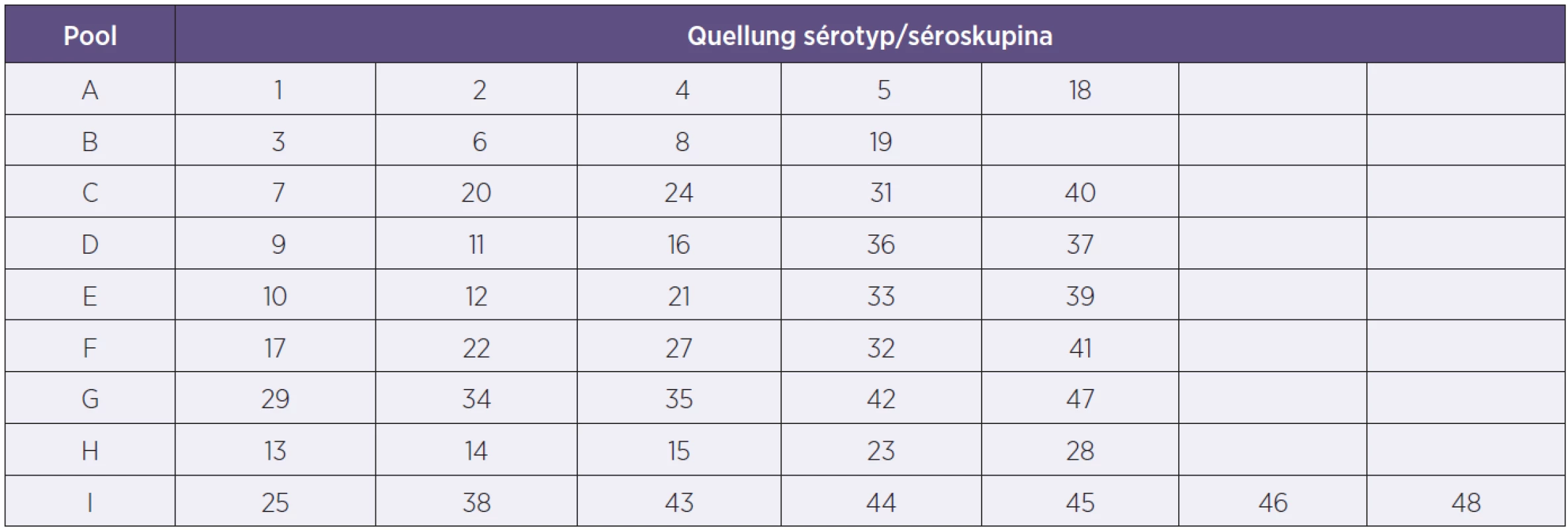
Quellung (Neufeldova) reakce je používána již od roku 1902 a doposud představuje zlatý standard [6]. Jedná se o sérologickou reakci mezi typovým pouzderným polysacharidovým antigenem pneumokoka a typově specifickou protilátkou v hyperimunním králičím komerčním antiséru. Existují poolová antiséra A–I (tab. 1) a pro případné finální dourčení faktorová antiséra (SSI Dánsko). Pozitivní reakce se projeví zvýrazněním pouzderného materiálu – „bobtnání pouzdra“, které se pozoruje v nativním preparátu pod mikroskopem s fázovým kontrastem.
2. Genotypizace
Genotypizace představuje modernizaci metodiky typizace S. pneumoniae za použití polymerázové řetězové reakce, neboli PCR. NRL/STR vycházela při navrhování nové metodiky z principu metody PCR používané v THL, National Institute for Health and Welfare, Helsinky [7]. Následně došlo k modifikaci metody. Jedná se o molekulární metodu uspořádanou do schématu multiplexové reakce PCR (mPCR) s vyhodnocením na agarózové elektroforéze. Účelem této metody je detekce pneumokokových genů, v genomu bakterie, které jsou typické pro určitou kapsulu séroskupiny či sérotypu S. pneumoniae. PCR využívá specifických primerů pro dané geny podle CDC, The Centers for Disease Control and Prevention, Atlanta, USA [9]. Používané geny jsou kapsulární determinanty (geny: cpsA, wzy, cpsH, cpsI, capB, wciY, cpsK, cpsG, galU, wciP, cpsO, wci, Nbeta, wcwL, werG, wzx, wciL). Do multiplex PCR reakcí bylo dále ještě zařazeno testování cpsA genu pro molekulární identifikaci S. pneumoniae bez ohledu na séroskupinu či sérotyp.
Algoritmus používání mPCR reakce typující S. pneumoniae
V literatuře je popsán následující mechanismus typování S. pneumoniae [8]: Sestavení šesti mPCR reakcí podle prevalencí výskytu jednotlivých sérotypů. Každá mPCR obsahuje primery na šest sérotypů či séroskupin a vždy primery pro cpsA gen S. pneumoniae. S vlastním DNA vzorku se vždy začíná s testováním mPCR1 a pokračuje se postupně s dalšími mPCR reakcemi až do doby pozitivního nálezu, což může být i mPCR6. Po mPCR reakcích se podle potřeby provádí dourčení Quellung reakcí s faktorovými antiséry.
Tento mechanismus byl v NRL/STR otestován s výbornými výsledky. Nicméně se neukázal pro místní použití dostatečně efektivní, a proto došlo k následujícím úpravám: Bylo sestaveno devět různých mPCR reakcí podle složení poolových antisér pro Quellung reakci (tab. 2). Podle nich se také jednotlivé mPCR reakce nazvaly A–I. Jednotlivé mPCR se liší počtem primerů pro sérotypy či séroskupiny, od dvou do sedmi a taktéž vždy obsahují primery pro detekci cpsA genu. S vlastní DNA vzorku se použije mPCR označená písmenem podle poolového antiséra, se kterým kmen dává pozitivní Quellung reakci. Jedná se tedy pouze o předurčenou jednu mPCR reakci pro daný vzorek. V případě potřeby následuje dourčení Quellung reakcí s faktorovými antiséry.
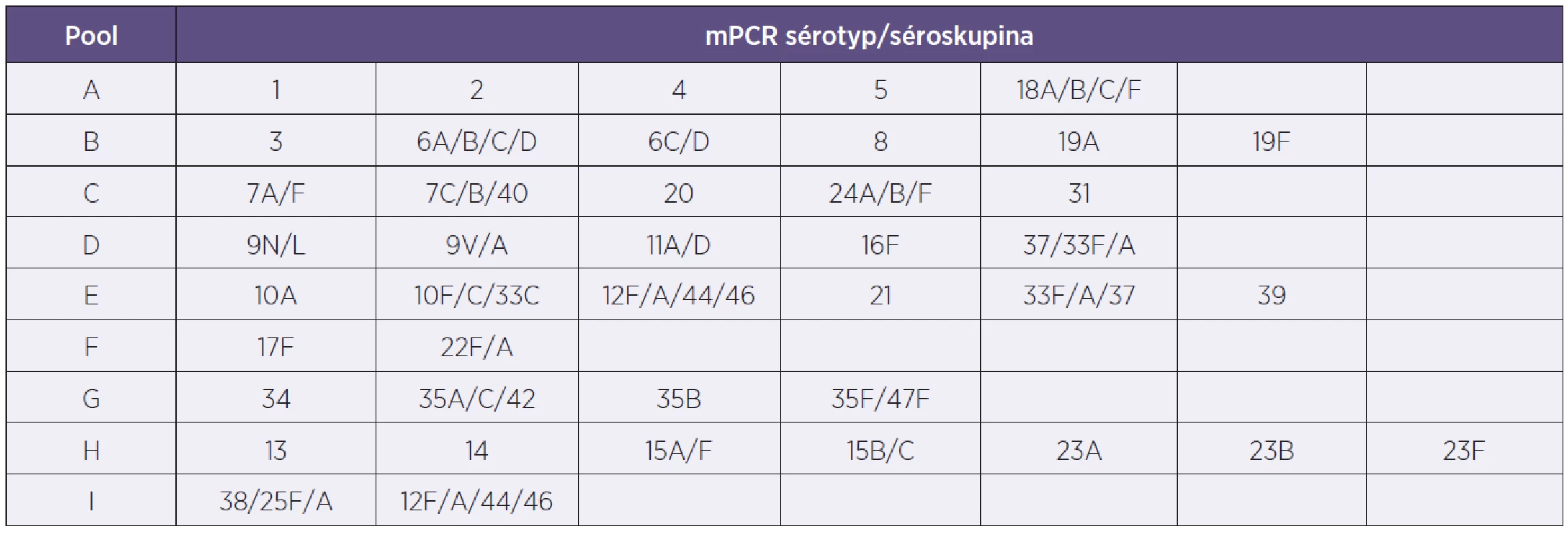
Provedení mPCR rekce typující S. pneumoniae
Izolace DNA z bakteriálních kmenů S. pneumoniae se provádí pomocí Amp QIAGEN mini kit podle manuálu [10].
Obecné složení multiplexPCR reakcí (specifické složení jednotlivých typů A–I se liší):
2,5 µl (1x) 10x reakčního pufru k iTaq DNA polymeráze
2 µl MgCl2
0,5 µl (0,2 mM) dNTP 10 mM
podle typu (10 µM) specifického primeru – forward
podle typu (10 µM) specifického primeru – reverse
0,4 µl iTaq DNA polymeráza
ad 25 µl PCR vody
K 2,5 µl izolované templátové DNA z vyšetřovaných vzorků se přidá po 22,5 µl master mixu do 0,2 ml PCR zkumavek.
Amplifikace DNA:
Cykly: 94 °C – 4 min
94 °C – 45 sec
54 °C – 45 sec
65 °C – 2 : 30 min
65 °C – 10 min
4 °C
Elektroforéza produktu:
Používá se 2% agaróza připravená v 1krát koncentrovaném TBE pufru a obarvení je provedeno ethidium bromidem. Elektroforéza probíhá 120 min při 80 V. Následná vizualizace pomocí UV (330nm).
Hodnocení:
Jedná se o metodu s kvalitativním vyhodnocováním, které se provádí na základě znalosti a porovnávání velikostí amplifikovaných produktů vzorků, pozitivní kontroly (referenční kmeny zpracované stejně jako vzorek) a negativní kontroly (voda) s 50bp DNA Ladderem a jednotlivými pozitivními kontrolami v porovnání s uváděnými výsledky CDC, Atlanta,USA [8].
Nově navržený algoritmus identifikace a typování kmenů S. pneumoniae v NRL/STR
- kultivace + optochinový test
- test rozpustnosti ve žluči
- Quellung reakce s poolovými antiséry A–I
- izolace DNA
- mPCR A – I + elektroforetické vyhodnocení
- případné dourčení Quellung reakcí s faktorovými antiséry
VÝSLEDKY A DISKUSE
Za použití výše popsaného nového algoritmu bylo testováno 210 kmenů S. pneumoniae všech dostupných sérotypů zaslaných do NRL/STR. Jednalo se o 66 sérotypů: 1, 3, 4, 5, 6A, 6B, 6C, 7A, 7B, 7C, 7F, 8, 9A, 9N, 9L, 9V, 10A, 10C, 10F, 11A, 11D, 12A, 12F, 13, 14, 15A, 15B, 15C, 15F, 16F, 17F, 18A, 18B, 18C, 18F, 19A, 19F, 20, 21, 22A, 22F, 23A, 23B, 23F, 24A, 24B, 24F, 25A, 25F, 31, 33A, 33C, 33F, 34, 35A, 35B, 35C, 35F, 37, 38, 39, 40, 42, 44, 46, 47F. Dále bylo testováno 8 izolátů příbuzných streptokoků S. pseudopneumoniae, S. sanguinis a S. oralis.
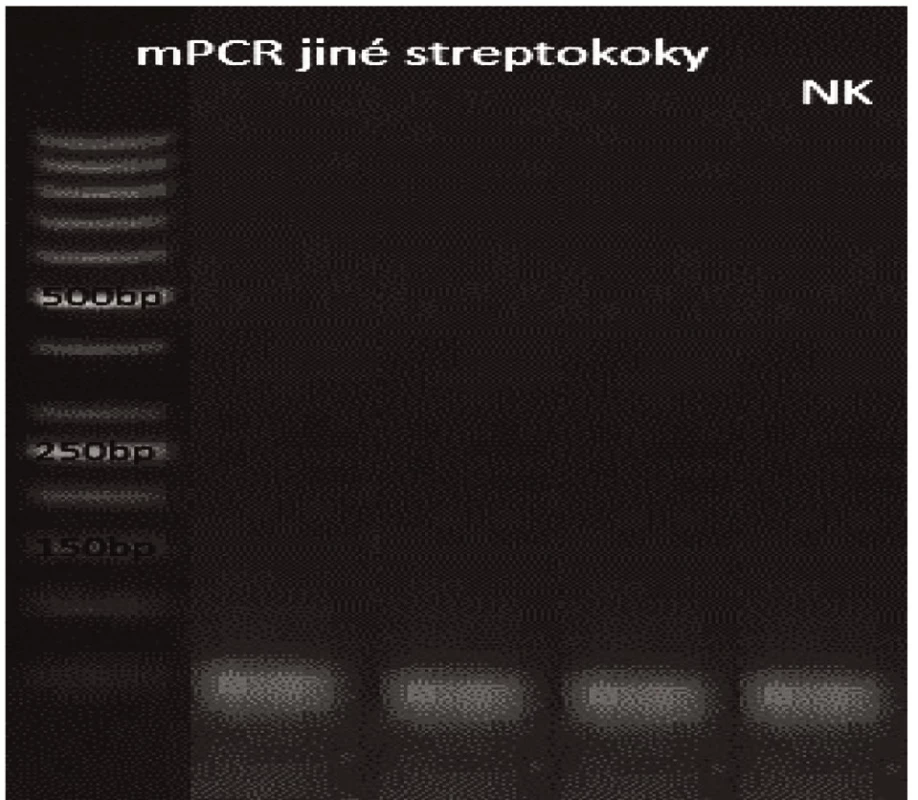
Novým výše popsaným mechanismem se podařilo správně identifikovat a typovat všechny kmeny S. pneumonie ve zkoumaném souboru (210 izolátů) při použití doposud známých primerů až po sérotyp (obr. 1–9: Elektroforetické hodnocení jednotlivých mPCR reakcí). Jediné dva sérotypy, na které jsou známé primery a nebyly otestovány, jsou sérotyp 2 a 6D, neboť NRL/STR nemá ve sbírce dostupné kmeny. Výsledky mPCR byly verifikovány Quellung reakcí. Kromě S. pneumoniae byly testovány i kmeny příbuzných streptokoků S. pseudopneumoniae (2 izoláty), S. sanguinis (4 izoláty) a S. oralis (2 izoláty), které naopak v mPCR metodě vykazovaly negativní výsledky (obr. 10), nebyl zde tedy problém s falešnou pozitivitou.
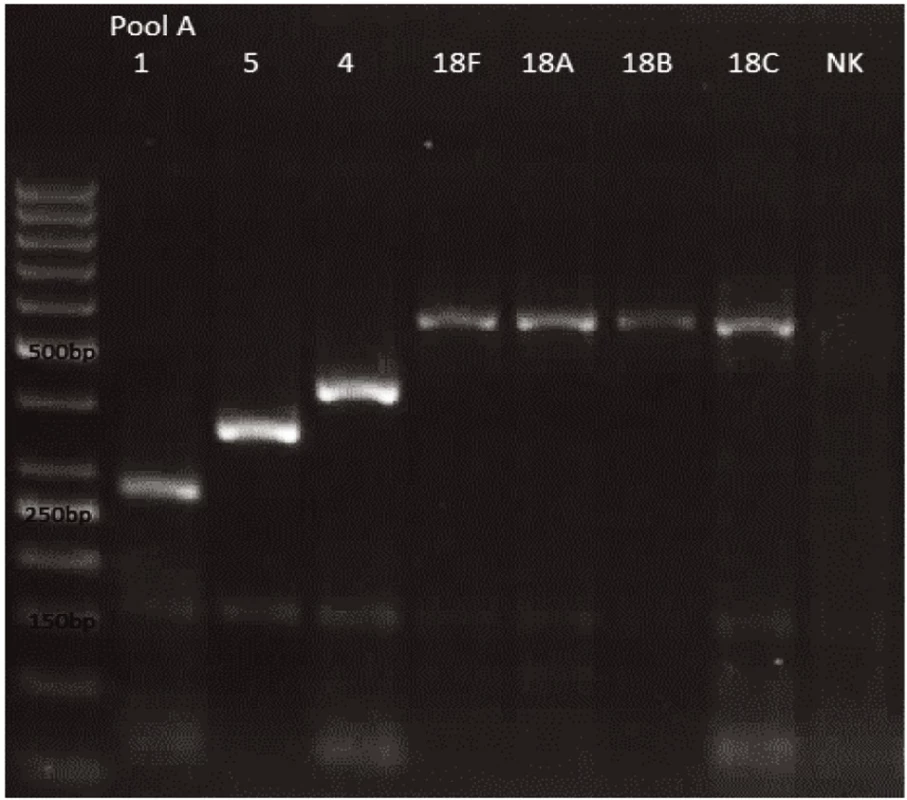
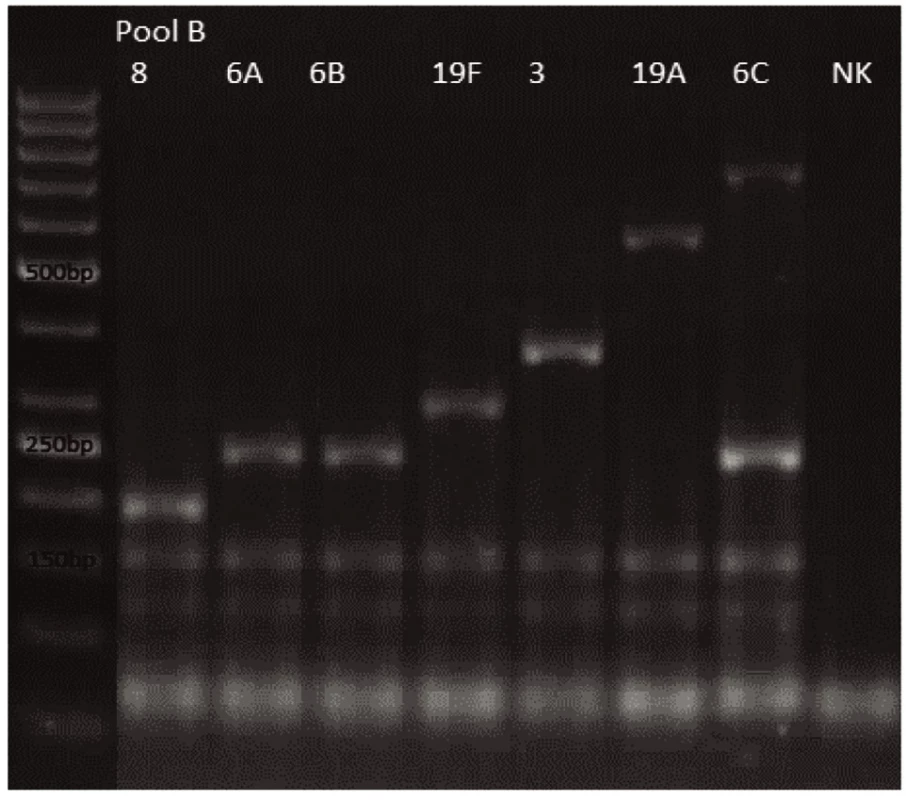
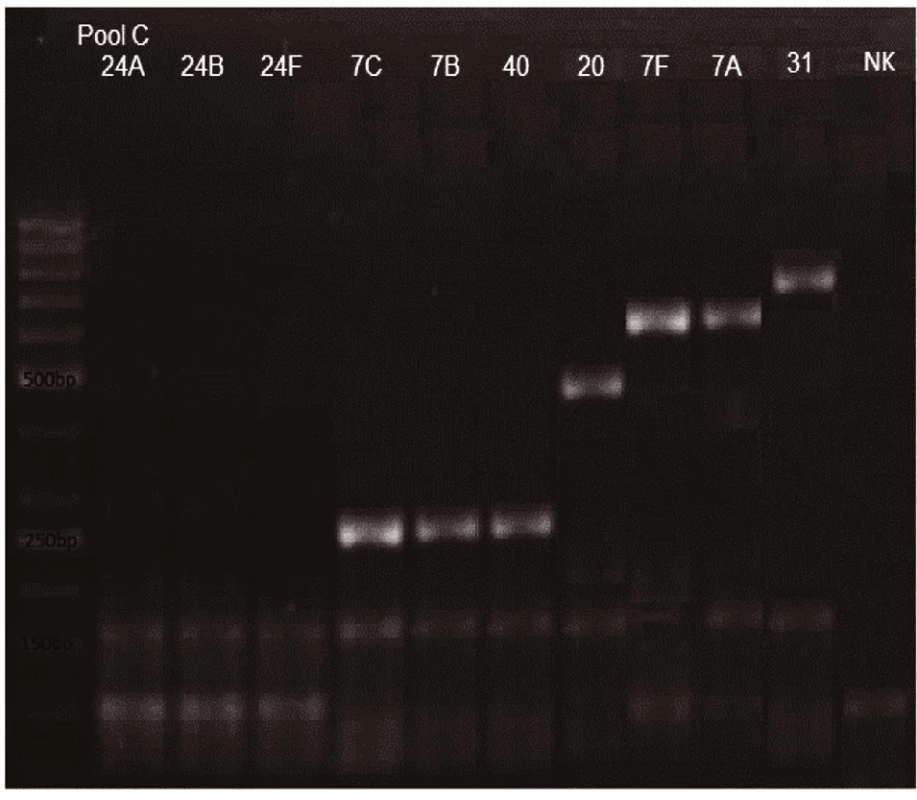
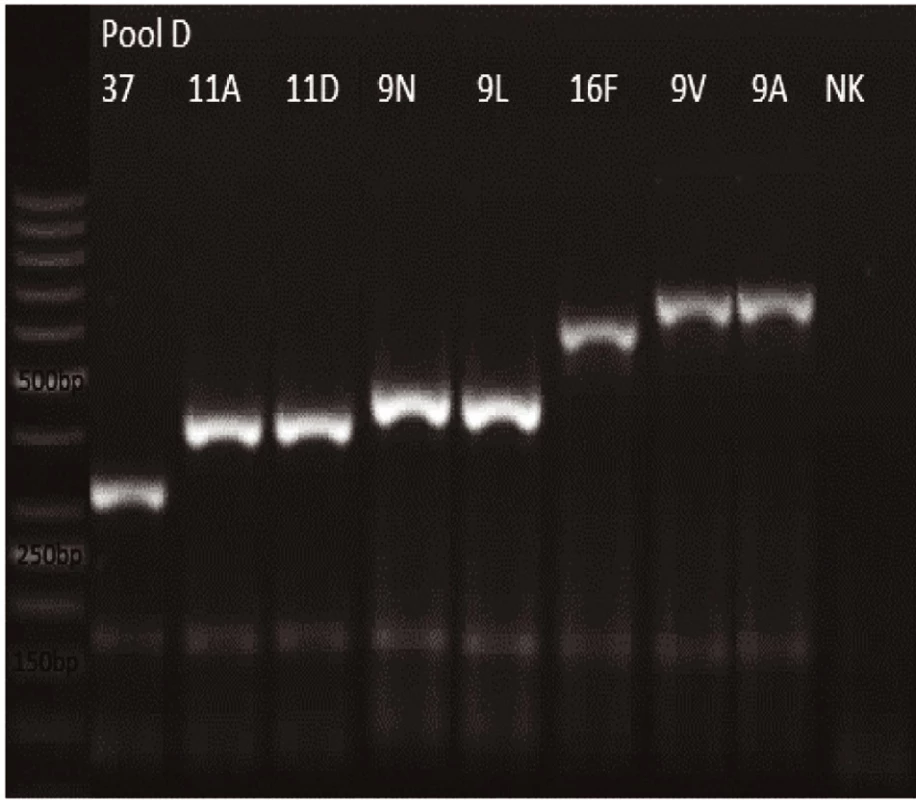
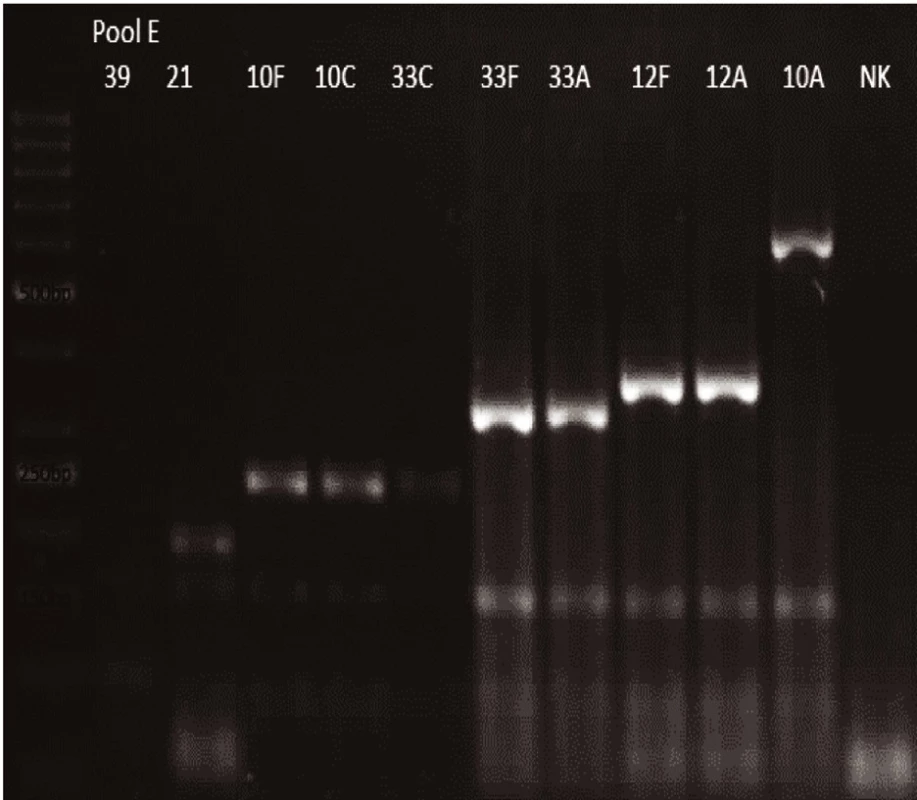
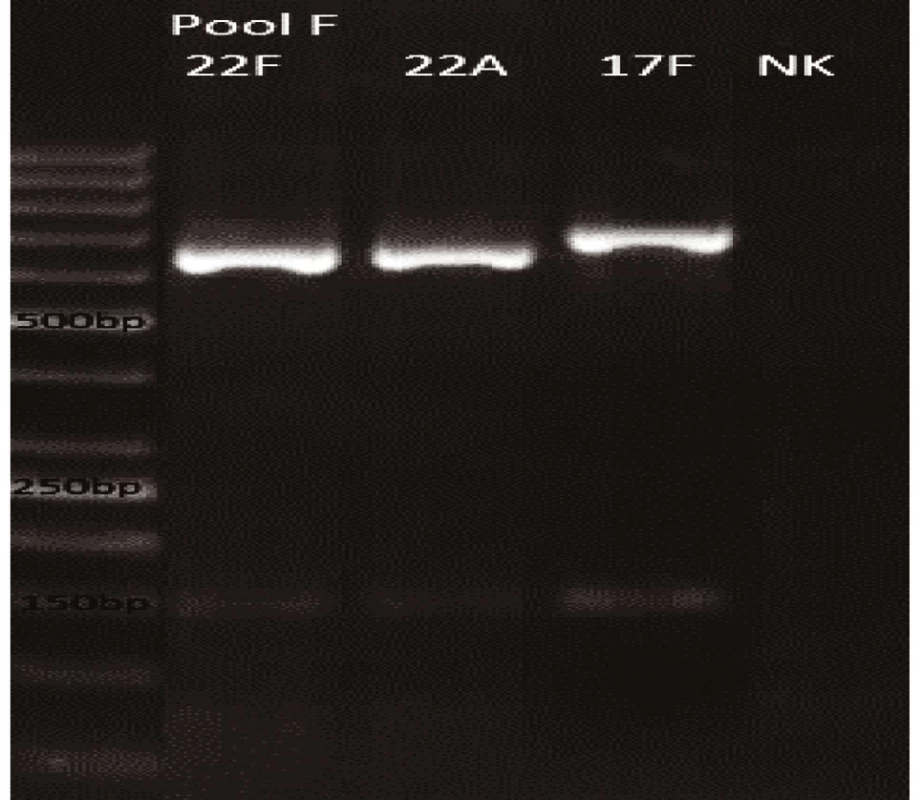
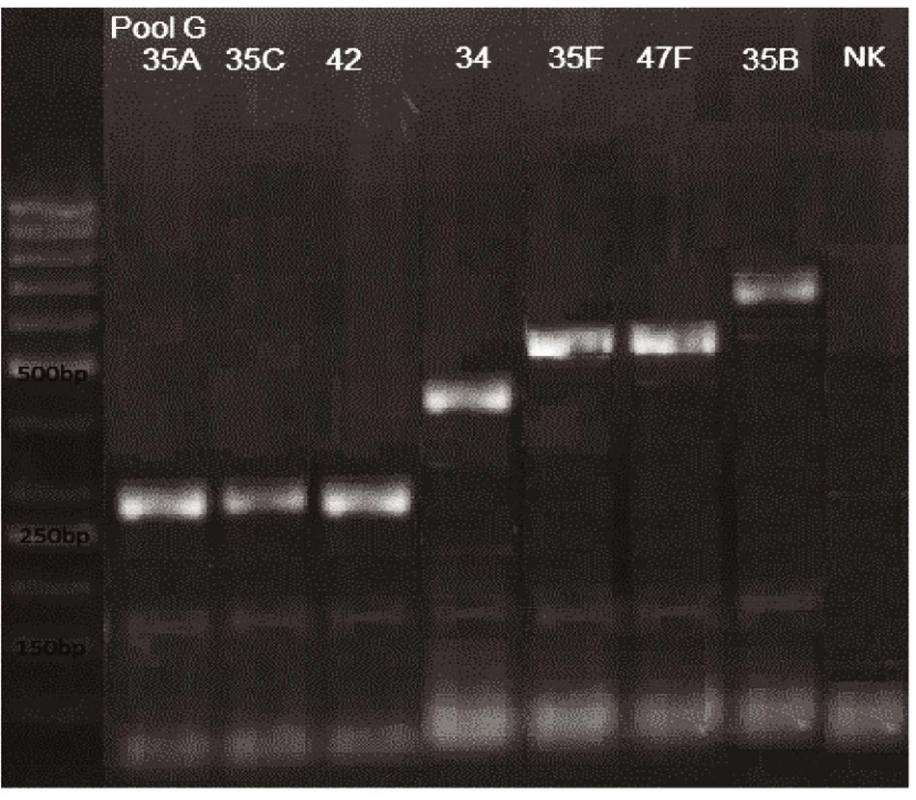
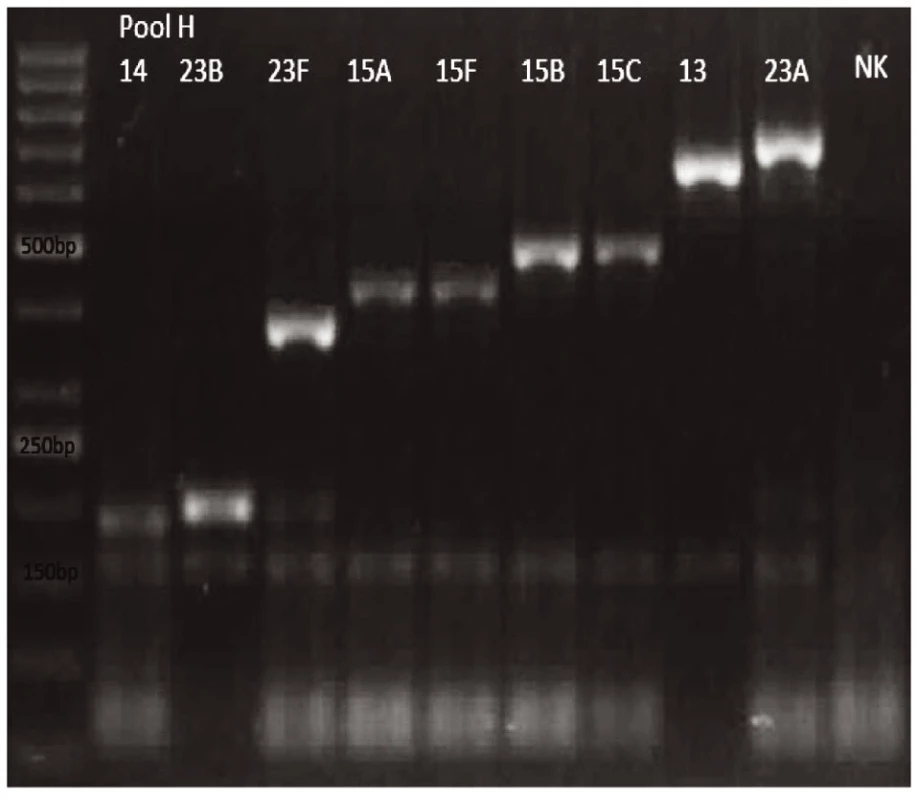
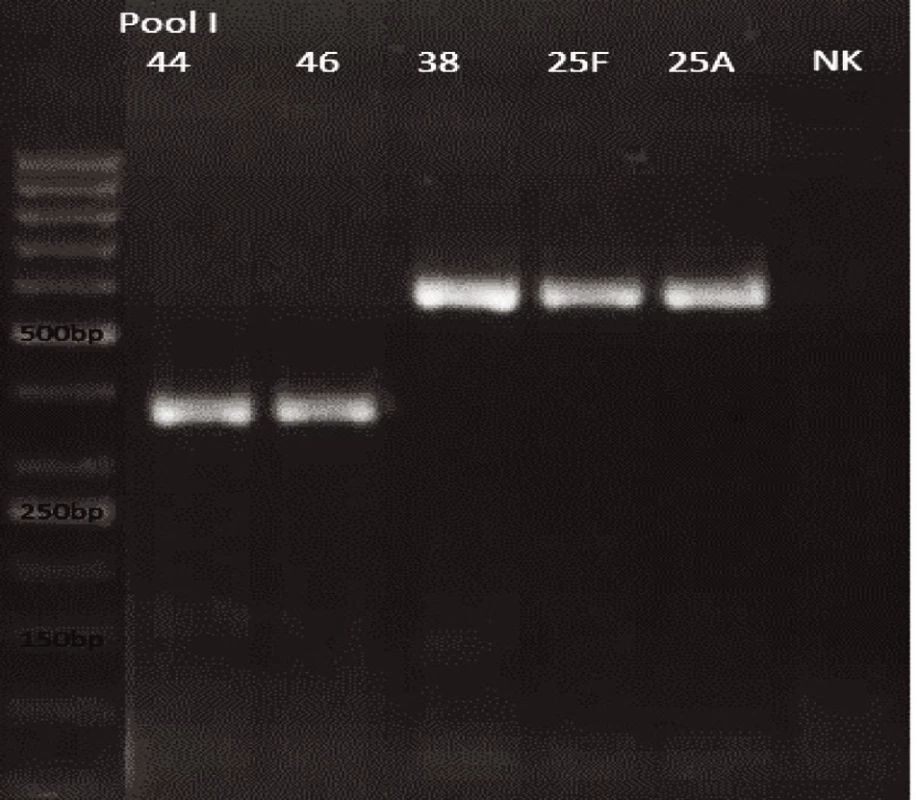
Pro PCR i Quellung metodu byly vypočteny hodnotící parametry podle následujících vzorců: senzitivita = a/(a + c), specificita = d/(b + d), pozitivní předpovědní hodnota = a/(a + b), negativní předpovědní hodnota = d/(c + d). Ve zkoumaném souboru 218 izolátů byly zjištěny následující parametry.
Pro multiplex PCR:
- a) správná pozitivita 210 vzorků
- b) falešná pozitivita 0 vzorků
- c) falešná negativita 0 vzorků
- d) správná negativita 8 vzorků
senzitivita = 1,000
specificita = 1,000
pozitivní předpovědní hodnota = 1,000
negativní předpovědní hodnota = 1,000
Pro Quellung reakci:
- a) správná pozitivita 209 vzorků
- b) falešná pozitivita 0 vzorků
- c) falešná negativita 1 vzorek
- d) správná negativita 8 vzorků
senzitivita = 0,995
specificita = 1,000
pozitivní předpovědní hodnota = 1,000
negativní předpovědní hodnota = 0,888
Doposud se při využívání sérologických typizačních metod uvádělo, že většina (98 %) kmenů S. pneumoniae je typovatelných a malé procento (2 %) kmenů je netypovatelných (NT), tzv. bezpouzderné varianty. Při testování popsaného souboru byl nalezen jeden izolát S. pneumoniae z hemokultury, jenž byl pomocí sérologické Quellung metody netypovatelný, ale pomocí PCR metody typovatelný. Výsledek PCR reakce byl pozitivní při použití primeru jak pro gen cpsA identifikující S. pneumoniae, tak pro gen identifikující séroskupiny 33F/33A/37. V tomto případě nebylo možné přesnější určení faktorovými séry, jelikož se jedná opět o sérologickou Quellung metodu. Mohlo se tedy jednat o příklad kmene, který disponuje genem pro kapsulární antigen, ovšem má problém s expresí antigenu anebo jeho strukturou. Díky tomu není možnost využít sérologických metod založených na principu reakce antigenu s protilátkou. Molekulární metody založené na detekci genu je ovšem pro typizaci neopouzdřených kmenů možné použít. Lze tedy očekávat snížení počtu doposud netypovatelných kmenů S. pneumoniae při používání molekulárních metod, jako je PCR.
A s tím nepřímo souvisí také identifikace nových sérotypů S. pneumoniae těmito novými molekulárními metodikami, např. sérotyp 6D, který není identifikovatelný klasickou sérologickou metodou [11, 12].
Nevýhodou PCR metody je, že v současné době nejsou známé primery pro typizaci všech popsaných sérotypů S. pneumoniae. Dochází však v tomto směru k vývoji a aktualizaci seznamu popsaných primerů.
ZÁVĚR
Zavedení multiplex PCR reakce do systému identifikace a především typizace S. pneumoniae se ukázalo jako velice přínosné. Doposud jedinou používanou metodou pro typizaci byla jen sérologická Quellung reakce. Je to sice zlatý standard, ale jedná se o metodu velice pracovně, časově a finančně nákladnou. Metoda mPCR umožňuje typování všech vakcinačních a i většiny nevakcinačních sérotypů S. pneumoniae. Jedná se o novou a moderní metodu s mnoha výhodami. Její velkou předností je časová nenáročnost a menší finanční nákladnost, především díky obrovské redukci potřeby antisér. V daném souboru izolátů předvedla nová mPCR 100% senzitivitu i specificitu.
V NRL/STR se výborně osvědčil modifikovaný algoritmus typování, kdy se po provedení Quellung reakce s poolovými antiséry A–I vybere pouze příslušná mPCR A–I reakce. Výsledný sérotyp se odečte buď přímo, nebo pokud mPCR reakce určí séroskupinu, dourčí se sérotyp Quellung reakcí s faktorovými antiséry.
Kromě S. pneumoniae byly testovány i kmeny příbuzných streptokoků S. pseudopneumoniae, S. sanguinis a S. oralis, které naopak v mPCR metodě vykazovaly správně negativní výsledky a nebyl zjištěn problém s falešnou pozitivitou.
Autoři děkují všem kolegům z laboratoří v ČR, kteří posílají kmeny do NRL pro streptokokové nákazy.
Do redakce došlo dne 2. 4. 2013.
Adresa pro korespondenci:
Mgr. Zuzana Vacková
SZÚ Praha
Šrobárova 48
100 42 Praha 10
e-mail: zuzana.vackova@szu.cz
Sources
1. Motlová, J., Beneš, Č., Kozáková, J., Křížová, P. Invazivní pneumokoková onemocnění v České republice v roce 2011. Zprávy CEM, 2012, 21, p. 51–58.
2. Bratcher, P. E., Park, I. H., Hollingshead, S. K. & Nahm, M. H. Production of a unique pneumococcal capsule serotype belonging to serogroup 6. Microbiology, 2009, 155, p. 576–583.
3. Zemlickova, H., Jakubu, V., Urbaskova, P., Motlova, J., Musilek, M., Adamkova, V. Serotype-specific invasive disease potential of Streptococcus pneumoniae in Czech children. J. Med. Microbiol., 2010, 59, p. 1079–1083.
4. Motlova, J., Benes, C., Kriz, P. Incidence of invasive pneumococcal disease in the Czech Republic and serotype coverage by vaccines, 1997–2006. Epidemiol. Infect., 2009, 137, p. 562–569.
5. Prymula, R., Motlova, J., Kriz, P. Comparison of Streptococcus pneumoniae serotypes causing acute otitis media & invasive disease in young children in the Czech Republic. Indian. J. Med. Res., 2004, 119, p. 168–170.
6. Merrill, C. W, Gwaltney, J. M. Jr., Hendley, J. W., Sande, M. A. Rapid identification of pneumococci. Gram stain vs. the quellung reaction. N. Engl. J. Med., 1973, 288, p. 510–512.
Dostupné na www:
http://www.ssi.dk/English/SSI%20Diagnostica/Products%20from%20SSI%20Diagnostica/Antisera_antibodies/Pneumococcus%20antisera/Neufeld.aspx.
7. Siira, L., Kaijalainen, T., Lambertsen, L., Nahm, M. H., Toropainen, M., Virolainen, A. From Quellung to Multiplex PCR, and back when needed, in pneumococcal serotyping. J. Clin. Microbiol., 2012, 50, p. 2727–2431.
8. The Centers for Disease Control and Prevention Specifické primery dle CDC, Atlanta, USA. Dostupné na www: http://www.cdc.gov/ncidod/biotech/strep/pcr.htm.
9. Manuál QIAamp DNA Mini Kit. Dostupné na www:
http://www.qiagen.com/Products/Catalog/Sample-Technologies/DNA-Sample-Technologies/Genomic-DNA/QIAamp-DNA-Mini-Kit#technicalspecification.
10. Bratcher, P. E., Kim, K. H., Kang, J. H., Hong, J. Y., Nahm, M. H. Identification of natural pneumococcal isolates expressing serotype 6D by genetic, biochemical and serological characterization. Microbiology, 2010, 156, p. 555–560.
11. Oftadeh, S., Satzke, C., Gilbert, G. L. Identification of newly described Streptococcus pneumoniae serotype 6D by use of the Quellung reaction and PCR. J. Clin. Microbiol., 2010, 48, p. 3378–3379.
Labels
Hygiene and epidemiology Medical virology Clinical microbiologyArticle was published in
Epidemiology, Microbiology, Immunology

2013 Issue 2
-
All articles in this issue
- Antibiotická rezistence u netyfových sérovarů Salmonella spp. v České republice
- A Novel Typing Method and Scheme for Streptococcus pneumoniae
- Salmonellosis Outbreaks in the Czech Republic in 2012
- Intravenous and Subcutaneous Immunoglobulin Therapy
- Prevalence Estimates of Problem Drug Users in the Czech Republic in 2006 and 2007 using the Capture-Recapture Method
- Epidemiology, Microbiology, Immunology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Intravenous and Subcutaneous Immunoglobulin Therapy
- Antibiotická rezistence u netyfových sérovarů Salmonella spp. v České republice
- A Novel Typing Method and Scheme for Streptococcus pneumoniae
- Prevalence Estimates of Problem Drug Users in the Czech Republic in 2006 and 2007 using the Capture-Recapture Method
