Výskyt a vlastnosti baktérií Staphylococcus aureus ve vepřovém mase
Occurrence and characteristic of Staphylococcus aureus in pork meat
This study was conducted to evaluate the contamination of raw pork meat with Staphylococcus aureus in retail market and their ability to participate in the creation of foodborne intoxication. Strains were characterized by genotypic traits. Of the 197 samples examined 43 (21.8%) were found to be positive for the presence of S. aureus. Toxigennic properties were found in 21 (48.8%) isolates, the major enterotoxigennic gene found was seh (81%). All the S. aureus isolates were screened for resistance to antimicrobial agents by disk diffusion method and for mecA gene encoding resistance to meticillin. Two of the strains isolated in this study harboured the mecA gene (MRSA). The determination of sequence type 398 (ST398) has been confirmed in both MRSA isolates.
Keywords:
MRSA – detail – enterotoxins – resistance
Authors:
I. Koláčková; K. Koukalová; R. Karpíšková
Authors‘ workplace:
Výzkumný ústav veterinárního lékařství, v. v. i.
Published in:
Epidemiol. Mikrobiol. Imunol. 63, 2014, č. 3, s. 191-194
Category:
Review articles, original papers, case report
Overview
Tato studie byla zaměřena na sledování kontaminace syrového vepřového masa bakteriemi Staphylococcus aureus v tržní síti a jejich schopnosti podílet se na vzniku alimentárních intoxikací. Kmeny byly charakterizovány genotypovými metodami. Ze 197 vyšetřených vzorků byly ve 43 (21,8 %) detekovány bakterie S. aureus. Schopnost produkovat enterotoxiny byla potvrzena u 21 (48,8 %) izolátů, gen zodpovědný za tvorbu enterotoxinu H byl potvrzen nejčastěji (81 %). U všech izolátů byla sledována rezistence k antimikrobiálním látkám diskovou difuzní metodou a přítomnost genu mecA zodpovědného za rezistenci k meticilinu (MRSA). Dva kmeny izolované v této studii nesly gen mecA (MRSA). U obou izolátů byla potvrzena příslušnost k sekvenačnímu typu 398 (ST398).
Klíčová slova:
MRSA – tržní síť – enterotoxiny – rezistence
ÚVOD
Staphylococcus aureus (S. aureus) je bakterií, která se významnou měrou podílí na vzniku alimentárních intoxikací bakteriálního původu [12]. Výskyt tohoto etiologického agens je popisován u lidí i zvířat. U lidí se vyskytuje zejména na sliznicích a kůži, přibližně 20 % dospělých osob je dlouhodobě osídleno baktériemi S. aureus a přibližně 60 % osob je kolonizováno v průběhu svého života intermitentně [21]. Infikována či kolonizována mohou být i potravinová zvířata a při následném jatečném opracování se mohou bakterie S. aureus přenést i na jatečně opracovaná těla [8]. Zdrojem kontaminace suroviny může ale být i prostředí a personál jatečných a maso zpracujících provozů nebo pracovní pomůcky a pracovní plochy v obsluhovaných úsecích prodeje masa v tržní síti.
Z pohledu bezpečnosti potravin je výskyt bakterií S. aureus v porcovaném mase distribuovaném v tržní síti významný, zejména kvůli své schopnosti produkovat termostabilní stafylokokové enterotoxiny, které u spotřebitelů mohou vyvolat stafylokokovou enterotoxikózu. V současné době je popsáno 21 stafylokokových enterotoxinů, ale v souvislosti se vznikem enterotoxikózy jsou popisovány pouze enterotoxiny A, B, C, D, E a H. [18].
Rezistence bakterií k antimikrobiálním látkám je v posledním desetiletí závažným problémem jak v humánní, tak i veterinární medicíně. Bakterie S. aureus a meticilin-rezistentní S. aureus (MRSA) se vyskytují kromě humánní populace i u zvířat včetně potravinových. Tyto bakterie se rozšířily zejména v chovech prasat, jedná se o klonální komplex MRSA označovaný jako CC 398 [6]. Výskyt MRSA tohoto klonálního komplexu byl v chovech prasat poprvé popsán ve Francii [2]. Později se tento klonální komplex rezistentních stafylokoků rozšířil i v Nizozemí [23] a dalších evropských zemích, USA, Kanadě a Asii [19]. Tyto bakterie se mohou šířit nejen na farmách, ale také na jatkách, kde může docházet ke kontaminaci jatečně upravených těl a následně i vybouraného masa. Výskyt tohoto klonálního komplexu je již zaznamenáván také v populaci lidí [6]. Při šíření tohoto typu MRSA se diskutuje také o otázce možné kolonizace spotřebitelů při manipulaci s masem v domácnostech.
MATERIÁL A METODY
Odběr a charakteristika vzorků
Celkem bylo v roce 2012 a 2013 odebráno 197 vzorků chlazeného vepřového masa. Vzorky byly nakoupeny v tržní síti v 16 obchodech a obchodních řetězcích České republiky. Vzorky masa byly buď balené přímo výrobcem (90) nebo porcované v obsluhovaných úsecích s prodejem masa (107). Maso pocházelo ze tří zemí, 158 (80,2 %) vzorků z České republiky a 39 (19,8 %) bylo importováno, 31 vzorků z Polska a 8 z Rakouska.
Při odběru byly všechny vzorky individuálně zabaleny do mikrotenových sáčků, aby se zabránilo vzájemné kontaminaci vzorků a v chlazeném stavu byly transportovány do laboratoře, kde byly neprodleně vyšetřeny.
Izolace bakterií S. aureus
V laboratoři byly odebrány stěry z povrchu masa pomocí sterilních houbiček (3MTM Sponge-stick, USA), které byly umístěny do sáčků s 30 ml pufrované peptonové vody (PPV, Oxoid, Velká Británie) a zhomogenizovány na zařízení typu Stomacher. Bakterie S. aureus byly ve vzorcích detekovány paralelně dvěma způsoby – izolací na médium Baird-Parker (Oxoid, Velká Británie) z pufrované peptonové vody inkubované při 37 °C po dobu 18–24 hodin a dále použitím metodiky s dvoustupňovým pomnožením. Po homogenizaci vzorku bylo 5 ml PPV přeneseno do média Mueller-Hinton (Oxoid, Velká Británie) s 6,5 % přídavkem NaCl a po inkubaci, která probíhala ve všech krocích při 37 °C 18–24 hodin, byl 1 ml inokulován do trypton-sojového bujonu s cefoxitinem (5 µg/ml) a aztreonamem (7,5 µg/ml) (Labmediaservis, CZ). Další den pak byla suspenze vyočkována na Baird-Parker agar a BrillianceTM MRSA 2 agar (Oxoid, Velká Británie).
Typické kolonie ze selektivních agarů byly vyočkovány na půdu s přídavkem 5 % ovčí krve (Labmediaservis, CZ) a uchovány pro následnou charakteristiku.
Identifikace suspektních bakterií S. aureus
Suspektní kolonie byly konfirmovány metodou PCR, byl detekován fragment specifický pro bakterie S. aureus o velikosti 108 bp [10].
Detekce genů zodpovědných za produkci stafylokokových enterotoxinů
U každého kmene S. aureus bylo metodou PCR provedeno stanovení přítomnosti genů sea, seb, sec, sed, see, seg, seh, sei podle protokolu popsaném autory Monday a Bohach [11] a Løvseth et al. [9].
Stanovení rezistence k antimikrobiálním látkám
U kmenů S. aureus bylo provedeno stanovení rezistence k panelu 12 antimikrobiálních látek za použití diskové difuzní metody s antibiotickými disky firmy Oxoid (UK) na médiu Mueller-Hinton (Biokar, FR). Byla sledována rezistence k následujícím látkám: OXA, oxacilin (1 µg); TET, tetracyklin (30 µg); ERY, erytromycin (15 µg); SXT, sulfometoxazol s trimetoprimem (25 µg); CN, gentamicin (10 µg); DA, klindamycin (2 µg); C, chloramfenikol (30 µg); CTX, cefotaxim (30 µg); CIP, ciprofloxacin (5 µg); FOX, cefoxitin (30 µg); RD, rifampicin (5 µg); TEC, teikoplanin (30 µg). Jako kontrola byl použit kmen S. aureus ATCC 25923, výsledky byly interpretovány podle standardů CLSI [5].
Detekce genu mecA a sekvenačního typu 398 metodou PCR
Všechny izolované kmeny byly testovány na přítomnost genu mecA, kódujícího rezistenci k meticilinu [4] a dále bylo provedeno potvrzení příslušnosti ke sekvenačnímu typu 398 podle autorů [22].
Statistická analýza
Statistická analýza výsledků byla provedena programem STAT PLUS (VÚVeL, CZ).
VÝSLEDKY A DISKUSE
Prevalence S. aureus ve vzorcích masa
Ze 197 odebraných vzorků chlazeného masa byla přítomnost bakterií S. aureus potvrzena u 43 vzorků (21,8 %). Jednalo se o 31 vzorků masa baleného výrobcem a 12 vzorků masa z volného prodeje baleného v tržní síti. Rozdíly ve výskytu bakterií S. aureus ve vzorcích podle typu balení byly statisticky významné (p < 0,01), překvapivě však byla zjištěna vyšší incidence stafylokoků ve vzorcích masa baleného přímo výrobcem. Tento fakt může být způsoben vyšší vodní aktivitou na povrchu masa balených vzorků a tím i lepšími podmínkami pro přežívání stafylokoků.
Prevalence bakterií S. aureus ve vepřovém mase se liší podle výsledků zveřejněných různými autory. Zatímco autoři Pesavento et al. [14] uvádí 15,5 % pozitivních vzorků (10/66), autoři O’Brien et al. [13] uvádí 67 % pozitivních vzorků masa (201/300).
Prevalence genů zodpovědných za produkci stafylokokových enterotoxinů
U 15 kmenů byla zjištěna přítomnost genů zodpovědných za tvorbu enterotoxinů. Nejčastěji byl zjišťován gen seh (12), který kóduje produkci nově popsaného enterotoxinu H, jehož přítomnost se v potravinách (mase) nedá prokázat metodami běžně používanými pro průkaz klasických enterotoxinů. Přehled genů detekovaných u izolátů získaných v této studii je uveden v tabulce 1. Izoláty pocházely ze vzorků masa baleného i nebaleného a byly nakoupeny v různých obchodech a lokalitách. (Tab. 1)
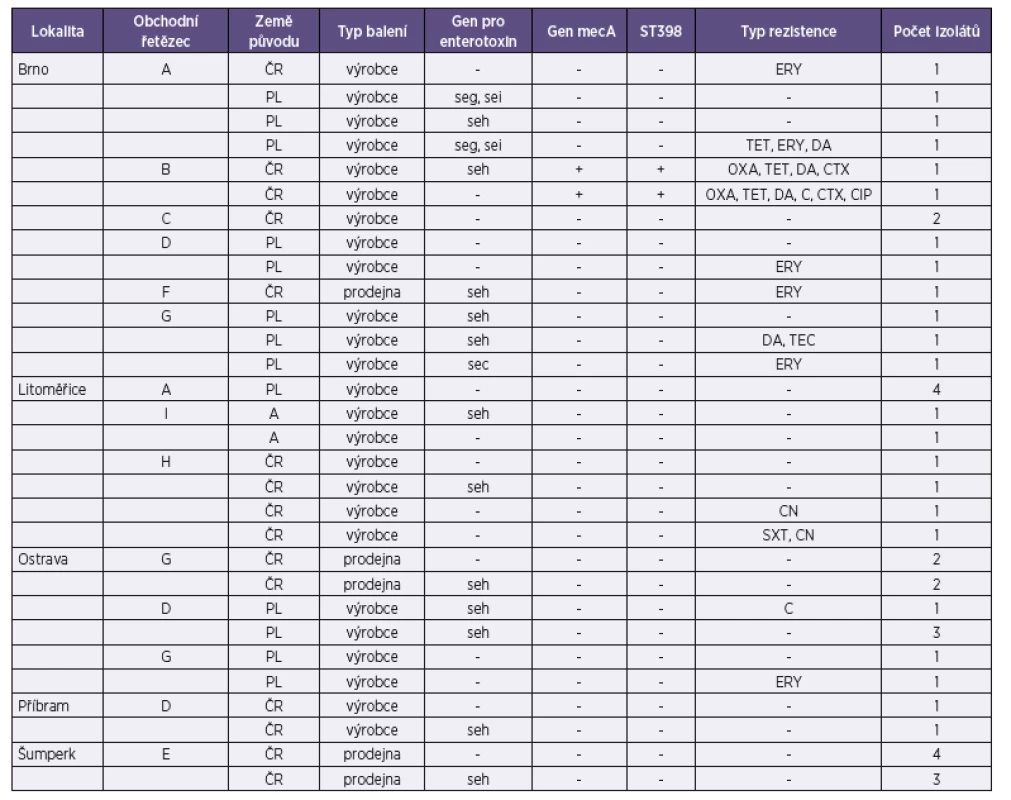
Stafylokokový enterotoxin H byl charakterizován autory Ren et al. [16]. Jedná se o termostabilní protein, jehož schopnosti vyvolat enterotoxikózu byly již potvrzeny různými studiemi [15]. Tento enterotoxin není zařazen mezi klasické enterotoxiny, a proto se podle platné legislativy v potravinách ani neprokazuje. Běžně používané metody ke stanovení enterotoxinu v potravinách jako jsou ELISA a ELFA (Enzyme Linked Fluorescent Assay, VIDAS) budou v přítomnosti enterotoxinu H vykazovat negativní výsledky. Také v České republice již byl výskyt genu seh u potravinových izolátů S. aureus opakovaně prokázán. Autoři Šťástková et al. [20] uvádí 5% prevalenci u izolátů ze syrového kravského mléka a 21% zastoupení genu seh v potravinách uvádí i autoři Růžičková et al. [17]. Také Kim et al. [7] uvádí výskyt genu seh u izolátů S. aureus získaných z potravin určených k přímé spotřebě z tržní sítě v Koreji za častý.
Stanovení rezistence k antimikrobiálním látkám
Rezistence izolátů S. aureus alespoň k jedné z testovaných antimikrobiálních látek byla zjištěna v 27,9 % případů (12/43). Z celkem 12 rezistentních kmenů jich 6 bylo izolováno z importovaných vzorků (50 %). Nejčastěji byla zjištěna rezistence k erytromycinu 14 % (6/43), následovaná rezistencí ke klindamycinu 9,3 % (4/43), tetracyklinu 7 % (3/43), gentamicinu a chloramfenikolu 4,7 % (2/43). Dva izoláty z vepřového masa vykázaly rezistenci k oxacilinu, cefotaximu, klindamycinu a tetracyklinu. Metodou PCR u nich byla potvrzena přítomnost genu mecA a byly proto označeny jako meticilin rezistentní S. aureus (MRSA). Jeden z těchto izolátů byl rezistentní i ke chloramfenikolu a ciprofloxacinu. U obou kmenů byla dále zjištěna přítomnost úseku DNA specifického pro kmeny náležící k sekvenačnímu typu 398. Aktuální situace výskytu MRSA ve vepřovém mase v tržní síti v České republice není známa, tato studie uvádí první nálezy MRSA ve vepřovém mase u nás Autoři Agersø et al. [1] uvádí nálezy MRSA ve sledované komoditě následovně – 19 % v Nizozemí (3/16), 4,6 % v Dánsku (7/153) a 2,1 % v Německu (3/142). V této studii byl potvrzen výskyt 1 % (2/197). V roce 2008 byl v České republice sledován výskyt MRSA v prostředí chovů prasat, byla potvrzena prevalence 1, 8 % (5/283) [3].
ZÁVĚR
Prevalence výskytu baktérií S. aureus ve vepřovém mase není vysoká (21,8 %), závažným ale může být výskyt kmenů nesoucích geny pro tvorbu stafylokokových enterotoxinů a kmenů s vícečetnou rezistencí k antimikrobiálním látkám.
V této studii bylo prokázáno, že ve vepřovém mase je dominantní výskyt kmenů S. aureus schopných produkovat enterotoxin H. Vzhledem k termostabilitě stafylokokových enterotoxinů může být pokrm (potravina) obsahující kontaminované vepřové maso vehikulem intoxikace. Laboratorní vyšetření na přítomnost enterotoxinů v potravině však může vykazovat falešně negativní výsledky, protože běžně používané metody tento typ enterotoxinu nedetekují. Vepřové maso může být kontaminováno i multirezistentními kmeny S. aureus včetně MRSA. První výskyt těchto kmenů ve vepřovém mase v tržní síti v České republice popisuje tato studie.
Tato studie vznikla za finanční podpory Ministerstva zemědělství ČR, projektu NAZV KUS QJI210284 a projektu MŠMT AdmireVet CZ 1.05/2.1.00/01.006ED.
Do redakce došlo dne 12. 2. 2014.
Adresa pro korespondenci:
MVDr. Ivana Koláčková, Ph.D.
Výzkumný ústav veterinárního lékařství, v.v.i.
Hudcova 296/70
621 00 Brno
e-mail: kolackova@vri.cz
Sources
1. Agersø Y, Hasman H, Cavaco LM, Pedersen K, Aarestrup FM. Study of methicillin resistant Staphylococcus aureus (MRSA) in Danish pigs at slaughter and in imported retail meat reveal a novel MRSA type in slaughter pigs. Veterinary Microbiology, 2012;157 : 246–250.
2. Armand-Lefevre L, Ruimy R, Andremont A. Clonal comparison of Staphylococcus aureus isolates from healthy pig farmers, human controls, and pigs. Emerging Infection Diseases, 2005;11 : 711–714.
3. Bardoň J, Kolář M, Karpíšková R, Žemličková H, Fridrichová M, et al. Occurrence and characteristic of methicillin-resistant Staphylococcus aureus in pig farms in the Czech Republic. Acta Veterinaria, 2012;81:p. doi:10.2754/avb201281030000.
4. Boşgelmez-Tmaz G, Ulusoy S, Aridoğan B, Coşkun-Ari F. Evalution of different methods to detect oxacillin resistance in Staphylococcus aureus and their clinical laboratory utility. European Journal of Clinical Microbiology & Infectious Diseases, 2006;25(6):410–412.
5. Clinical and Laboratory Standards Institute (CLSI) Performance standards for antimicrobial susceptibility teststing. CLSI Document M100-S22. Clinical and Laboratory Standards Institute, USA, Pa, 2012.
6. Huijsdens XW, van Dijke BJ, Spalburg E, van Santen-Verheuvel, MG, Heck ME, et al. Community-acquired MRSA and pig-farming. Annals of Clinical Microbiology and Antimicrobials, 2006;5 : 26. DOI:10.1186/1476-0711-5-26.
7. Kim NH, Yun AR, Rhee1 MS. Prevalence and classification of toxigenic Staphylococcus aureus isolated from refrigerated ready-to-eat foods (sushi, kimbab and California rolls) in Korea. Journal of Applied Microbiology, 2011;111 : 1456–1464.
8. Lee JH. Methicillin (oxacillin)-resistant Staphylococcus aureus strains isolated from major food animals and their potential transmission to humans. Applied and Enviromental Microbiology, 2003;6489–6494.
9. Løvseth A, Loncarevic S, Berdal KG. Modified multiplex PCR method for detection of pyrogenic exotoxin genes in staphylococcal isolates. Journal of Clinical Microbiology, 2004;42 : 3969–3872.
10. Martineau F, Picard JF, Roy HP, Ouellette M, Bergeron MG. Species-specific and ubiquitous-DNA-based assays for rapid identification of Staphylococcus aureus. Journal of Clinical Microbiology, 1998;36 : 618–623.
11. Monday SR, Bohach GA. Use of multiplex PCR to detect classical and newly described pyrogenic toxin genes in staphylococcal isolates. Journal of Clinical Microbiology, 1999;37 : 3411–3414.
12. Normanno G, Corrente M, La Salandra G, Dambrosio A, Quaglia NC, et al. Methicilin-resistant Staphylococcus aureus (MRSA) in foods of animal origin product in Italy. International Journal of Food Microbiology, 2007;117 : 219–222.
13. O´Brien AM, Hanson BM, Farina SA, Wu JY, Simmering JE, Wardyn SE, Forshey BM, Kulick ME, Wallinga DB, Smith TC. MRSA in conventional and alternative retail pork products. PLoS ONE, 2012;7(1):e30092.doi:10.1371/journal.pone0030092.
14. Pesavento G, Ducci B, Comodo N, Lo Nostro A. Antimicrobial resistance profile of Staphylococcus aureus isolated from raw meat: A research for methicillin resistant Staphylococcus aureus (MRSA). Food Control, 2007;18 : 196–200.
15. Pospíšilová M., Karpíšková R. Případ stafylokokové enterotoxikózy vyvolané netradičním toxinem SEH. Zprávy CEM (SZÚ Praha), 2005;14 : 84–85.
16. Ren K, Bannan JD, Pancholi V, Cheung AL, Robbins JC, et al. Characterization and biological properties of a new staphylococcal exotoxin. Journal of Experimental Medicine, 1994;180 : 1675–1683.
17. Růžičková V, Karpíšková R, Pantůček R, Pospíšilová M, Černíková P, Doškař J. Genotype analysis of enterotoxin H-positive Staphylococcus aureus strains isolated from food samples in the Czech Republic. International Journal of Food Microbiology, 2008;121 : 60–65.
18. Schelin J, Wallin-Carlquist N, Cohn MT, Lindqvist R, Barker GC, Radström P. The formation of Staphylococcus aureus enterotoxin in food environments and advances in risk assessment. Virulence, 2011;2 : 580–592.
19. Smith TC, Pearson N. The emergency of Staphylococcus aureus ST398. Vector Borne Zoonotic Diseases, 2011;11 : 327–339.
20. Šťástková Z, Karpíšková R, Gelbíčová T, Vaňáč V, Tůma, et al. Detection of enterotoxigenic genes in Staphylococcus aureus isolated from bulk tank cow´s milk samples in the Czech Republic. Acta Alimentaria, 2012;41 : 327 – 333.
21. van Belkum A, Melles DC, Nouwen J, van Leeuwen WB, van Wamel W, et al. Co-evolutionary aspects of human colonisation and infection by Staphylococcus aureus. Infection, Genetics and Evolution, 2009;9 : 32–47.
22. van Wamel WJB, Hansenová Maňásková S, Verbrugh H, van Belkum A. Short term micro-evolution and PCR-detection of methicillin-resistant and susceptible Staphylococcus aureus sequence type 398. Eur. J. Clin. Microbiol Infect Dis, 2010;29 : 119–122.
23. Voss A, Loeffen F, Bakker J, Klaasen C, Wulf M. Methicillin-resistant Staphylococcus aureus in pig farming. Emerging Infection Diseases, 2005;11 : 1965–1966.
Labels
Hygiene and epidemiology Medical virology Clinical microbiologyArticle was published in
Epidemiology, Microbiology, Immunology

2014 Issue 3
-
All articles in this issue
- Infekce vyvoláné lidskými alfa herpetickými viry
- Protikladný vývoj trendů incidence kapavky a syfilis ve východočeském regionu – 30 let surveillance
- Současný pohled na diagnostiku a léčbu amébózy ve světle vlastní kazuistické zkušenosti
- Výskyt a charakteristika termotolerantních kampylobakterů v potravinovém řetězci člověka
- Význam očkování proti chřipce u osob s kardiovaskulárním onemocněním
- Zhodnocení významu ready-made spaceru s gentamicinem ve vztahu k bakteriologickým nálezům u pacientů s infekcí kloubní náhrady
- Q-horečka jako profesionální onemocnění vedoucí k invaliditě – kazuistika
- Návrat spalniček do Ústeckého kraje
- Klinická a mikrobiologická charakteristika závažných infekcií spôsobených streptokokmi skupiny A
- Vplyv prípravkov určených na dezinfekciu kože, slizníc a rán na životaschopnosť biofilmovej formy rastu mikroorganizmov izolovaných od pacientov s katétrovými infekciami
- Enterohemoragické Escherichia coli jako původci průjmu v České republice (1965–2013)
- Rezistence k erytromycinu, ciprofloxacinu a k tetracyklinu u humánních izolátů Campylobacter spp. v České republice, vyšetřená standardní metodou EUCAST
- Výskyt a vlastnosti baktérií Staphylococcus aureus ve vepřovém mase
- Identifikace izolátů Mycobacterium spp. pomocí MALDI-TOF hmotnostní spektrometrie
- Profesionálna TBC na Slovensku a v Českej republike
- Avidita antifosfolipidových protilátek – naše současné znalosti
- Real time RT-PCR panel pro identifikaci dvanácti virů hemoragických horeček
- Epidemiology, Microbiology, Immunology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Současný pohled na diagnostiku a léčbu amébózy ve světle vlastní kazuistické zkušenosti
- Infekce vyvoláné lidskými alfa herpetickými viry
- Enterohemoragické Escherichia coli jako původci průjmu v České republice (1965–2013)
- Real time RT-PCR panel pro identifikaci dvanácti virů hemoragických horeček
