Rezistence původce syfilis, Treponema pallidum subsp. pallidum, k makrolidovým antibiotikům v České republice a ve světě
Macrolide resistance in Treponema pallidum subsp. pallidum in the Czech Republic and in other countries
Treponema pallidum subsp. pallidum (TPA) is the causative agent of the sexually transmitted disease syphilis. In the Czech Republic, several hundred cases of syphilis are reported annually; e.g. in 2012, 696 syphilis cases were documented. In the last decades, an increasing prevalence of macrolide resistant TPA strains harboring A2058G or A2059G mutations in the 23S rRNA gene has been reported. Macrolides were used (and rarely are still being used) in the Czech Republic for the treatment of syphilis in patients allergic to penicillin. While 37% of TPA strains were resistant to macrolides between 2004 and 2010, this rate increased to 67% between 2011–2013. High prevalence of A2058G or A2059G mutations and increasing rates of macrolide resistant TPA strains have also been documented in other developed countries. Therefore, macrolides should not be used in the treatment of syphilis.
Key words:
syphilis – Treponema pallidum – resistence – macrolides
:
L. Grillová 1; L. Mikalová 1; H. Zákoucká 2
; J. Židlická 3; D. Šmajs 1*
:
Biologický ústav, Lékařská fakulta, Masarykova univerzita, Brno
1; Národní referenční laboratoř pro diagnostiku syfilis, Státní zdravotní ústav, Praha
2; Státní ústav pro kontrolu léčiv, Praha
3
:
Epidemiol. Mikrobiol. Imunol. 64, 2015, č. 1, s. 4-10
:
Review articles, original papers, case report
Treponema pallidum subsp. pallidum (TPA) způsobuje venerické onemocnění syfilis. V České republice je ročně zaznamenáno několik set případů syfilis, např. v roce 2012 to bylo 696 případů. V posledních desetiletích se u kmenů TPA rozšířila rezistence k makrolidovým antibiotikům podmíněná mutacemi A2058G nebo A2059G v genu pro 23S rRNA. Makrolidová antibiotika byla v minulosti (a výjimečně stále jsou) v ČR využívána k léčbě syfilis u pacientů alergických na penicilin. Zatímco v letech 2004–2010 bylo 37 % kmenů TPA rezistentních k makrolidům, v letech 2011–2013 dosáhl podíl TPA kmenů rezistentních k makrolidovým antibiotikům 67 %. Vysoká prevalence mutací A2058G nebo A2059G a vzrůstající trend makrolidové rezistence jsou pozorovány nejen v ČR, ale i v dalších rozvinutých zemích světa. Makrolidová antibiotika tedy nejsou vhodným antibiotikem v léčbě syfilis.
Klíčová slova:
syfilis – Treponema pallidum – rezistence – makrolidová antibiotika
ÚVOD
Tento souborný referát se zabývá rezistencí Treponema pallidum subsp. pallidum na makrolidová antibiotika. Cílem je seznámit čtenáře s podstatou rezistence původce syfilis, zmapovat prevalenci rezistentních kmenů v České republice a ve světě a formulovat doporučení při léčbě syfilis.
HISTORIE LÉČBY SYFILIS V ČR A VYUŽÍVÁNÍ MAKROLIDOVÝCH ANTIBIOTIK
Léčba syfilis v České republice spoléhala od vzniku Československa do roku 1949 na terapii arsenobenzenovými, bizmutovými a jodovými preparáty [1]. Po roce 1949 byla nahrazena podle doporučení Světové zdravotnické organizace (WHO) parenterální aplikací penicilinu. Penicilinové přípravky (základní i depotní) byly také použity k rozsáhlé preventivně-léčebné akci „PN“ probíhající v letech 1951 a 1952 [2]. Při této akci organizované dermatovenerology a hygienickou službou byla vyšetřována populace od 15 do 45 let, celkem cca 4,5 miliónu lidí. Zachycení a konfirmovaní pacienti se syfilis (0,4 %, cca 18.000 případů) byli léčeni intramuskulárně aplikovaným penicilinem a kombinovanou kúrou arsenobenzenů a bizmutu. V dalších letech se již používala pouze antibiotika. V 60. letech minulého století byly do spektra validovaných účinných léků zařazeny tetracykliny, erytromycin, chloramfenikol a aureomykoin (chlortetracyklin). Využití těchto přípravků bylo rezervováno pro pacienty s alergií na penicilin v anamnéze a zůstalo proto minoritní. V letech 2003–2012 bylo k léčbě syfilis v 61 případech z celkového počtu 9 151 případů (0,7 %) použito makrolidových antibiotik [3]. Makrolidová antibiotika se v ČR využívají pro léčbu syfilis zejména u gravidních, kde jsou tetracyklinová antibiotika kontraindikována. Desenzibilizace při alergii na penicilin (podle doporučení Centra pro kontrolu nemocí v Atlantě, USA) není v ČR prováděna.
POUŽITÍ MAKROLIDOVÝCH ANTIBIOTIK V ČR V JINÝCH INDIKACÍCH
První makrolidové antibiotikum, erytromycin, bylo izolováno v roce 1952 z metabolického produktu kultury Streptomyces erytheus a v ČR je využíván od 50. let minulého století [4]. V současné době jsou v ČR používány hlavně makrolidy se 14členným laktonovým kruhem (erytromycin, klaritromycin a roxitromycin), 16členným kruhem (spiramycin) a azalidy, jako je azitromycin [5]. Podle údajů Státního ústavu pro kontrolu léčiv je použití většiny makrolidových antibiotik v ČR v letech 2007–2013 nízké a v posledních letech se dále snižuje. Naopak využití azitromycinu vykazuje vzrůstající tendenci (obr. 1); azitromycin se používá zejména k léčbě infekcí dolních cest dýchacích, faryngitid, akutní otitis media, infekcí kůže a měkkých tkání a infekcí močové trubice. Mimo používání antibiotik v indikovaných případech je u pacientů s atypickými a neobvyklými příznaky často třeba empiricky použít několik typů antibiotik [6].
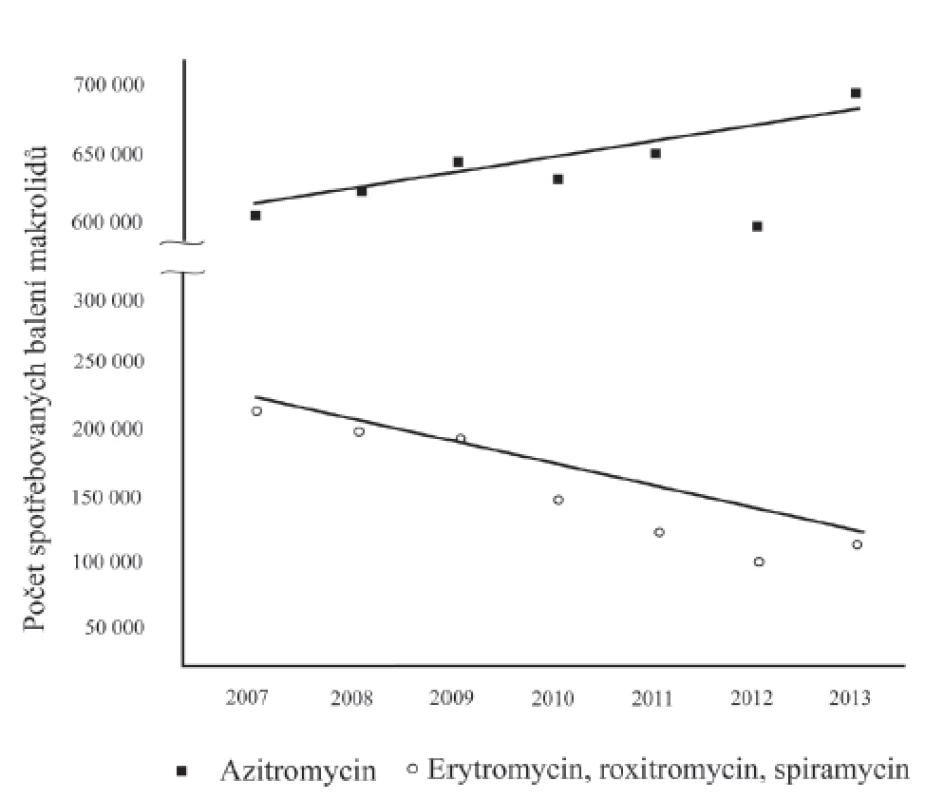
VZNIK REZISTENCE K MAKROLIDŮM
Makrolidy se váží na velkou podjednotku (50S) bakte-riálního ribozomu a vedou k blokádě translace. Selhání makrolidové léčby u syfilitických infekcí bylo popsáno v mnoha případech a navíc byly také zaznamenány případy selhání léčby při použití streptograminu B a linkosamidů, které rozeznávají podobné cílové místo jako makrolidová antibiotika [7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17].
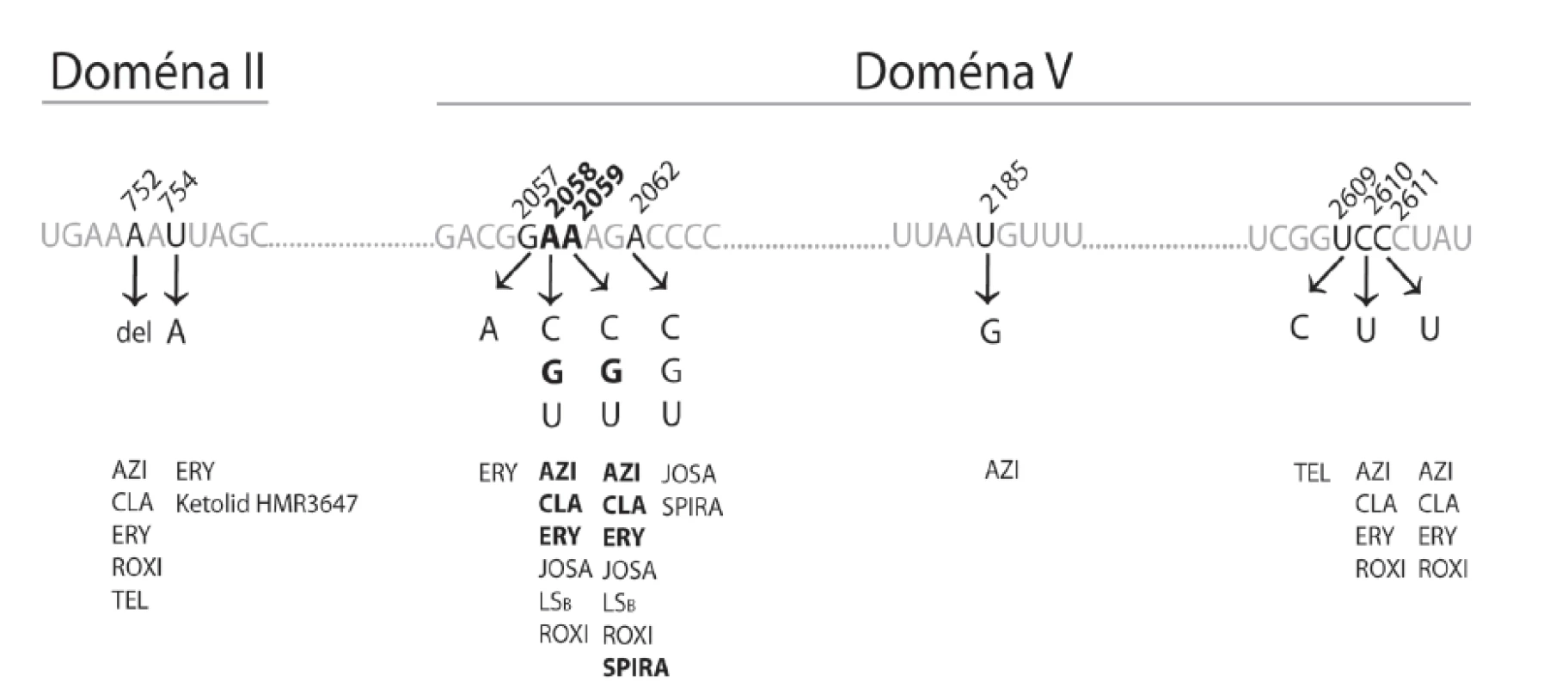
Rezistence k makrolidovým antibiotikům může být obecně způsobena různými mechanismy: jejich inaktivací, zvýšeným exportem z bakteriálních buněk anebo změnami v cílovém místě působení. U Treponema pallidum subsp. pallidum (TPA) byl zatím popsán vznik rezistence k makrolidům podmíněný změnou nukleotidové sekvence 23S rRNA, která je součástí velké ribozomální podjednotky [18]. Mutace v molekule 23S rRNA vede k modifikaci vazebného místa pro makrolidy a tudíž ke snížené účinnosti nebo k neúčinnosti makrolidového antibiotika. Různá makrolidová antibiotika přitom reagují s různými nukleotidy vlásenky 35 domény II a centrální smyčky domény V (definované jako část molekuly 23S rRNA mezi nukleotidy 737-760 a 2000-2624) [19, 20], nejčastěji jde o pozice 2058 a 2059 [21] (číslování je vztaženo na 23S rRNA u druhu Escherichia coli) – obrázek 2. Bodové mutace (A→G) v těchto pozicích 23S rRNA (2058 a 2059) vedou ke vzniku rezistence k makrolidům u mnoha patogenních bakterií zahrnujících kmeny rodu Brachyspira, Campylobacter, Escherichia, Helicobacter, Chlamydia, Lactobacillus, Mycobacterium, Mycoplasma, Neisseria, Propionibacterium, Pseudomonas, Staphylococcus, Streptococcus, Streptomyces a Turicella [18, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34]. Mimo mutací A2058G a A2059G byla u různých bakterií na těchto pozicích popsána řada dalších mutací vedoucích k rezistenci na makrolidy (tab. 1). U kmenů TPA byly zatím popsány pouze dvě mutace vedoucí k rezistenci na makrolidová antibiotika, a to A2058G a A2059G [15, 42]. Mutace A2058G způsobuje rezistenci k azitromycinu, erytromycinu, klaritromycinu a roxitromycinu, nikoliv však ke spiramycinu [9, 16, 43]. Oproti tomu mutace A2059G je asociovaná s rezistencí ke všem běžně využívaným makrolidovým antibiotikům [15].
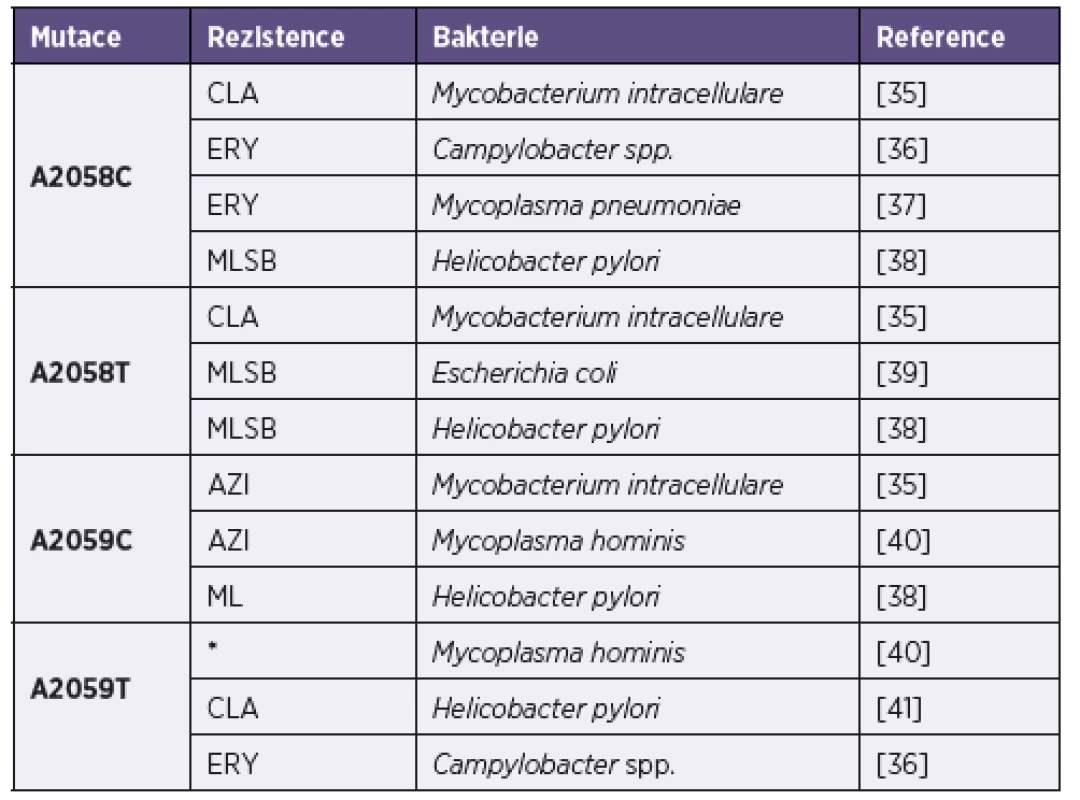
1Mutations at A2058G and A2059G are not indicated.
*Retrospective study, resistance was not associated with treatment failure.
AZI – azithromycin; CLA – clarithromycin; ERY – erythromycin; ML – macrolides, lincosamides; MLSB – macrolides-lincosamides-streptogramin B
DETEKCE MUTACÍ V GENU PRO 23S rRNA ZPŮSOBUJÍCÍCH MAKROLIDOVOU REZISTENCI
Detekce těchto mutací spočívá v amplifikaci obou kopií genu pro 23S rRNA pomocí dvoukrokové (nested) PCR s následnou analýzou délky restrikčních fragmentů (RFLP) vzniklých amplikonů pomocí restrikční endonukleázy MboII, rozpoznávající DNA s mutací A2058G [13], a endonukleázy BsaI, rozpoznávající DNA s mutací A2059G [15]. Další možností je Sangerova sekvenace amplifikovaných 23S rRNA genů a následná sekvenční analýza nukleotidů v pozici odpovídající pozicím 2058 a 2059 u druhu E. coli. Pandori et al. (2007) publikoval detekci mutace A2058G pomocí PCR amplifikace v reálném čase (real-time PCR) a následné analýzy křivky tání produktu PCR [44]. Dále je možné použít triplex PCR amplifikaci využívající fluorescenčních prób pro detekci obou mutací (A2058G i A2059G) v jedné reakci [45].
PREVALENCE SYFILITICKÝCH KMENŮ REZISTENTNÍCH NA MAKROLIDOVÁ ANTIBIOTIKA V ČR
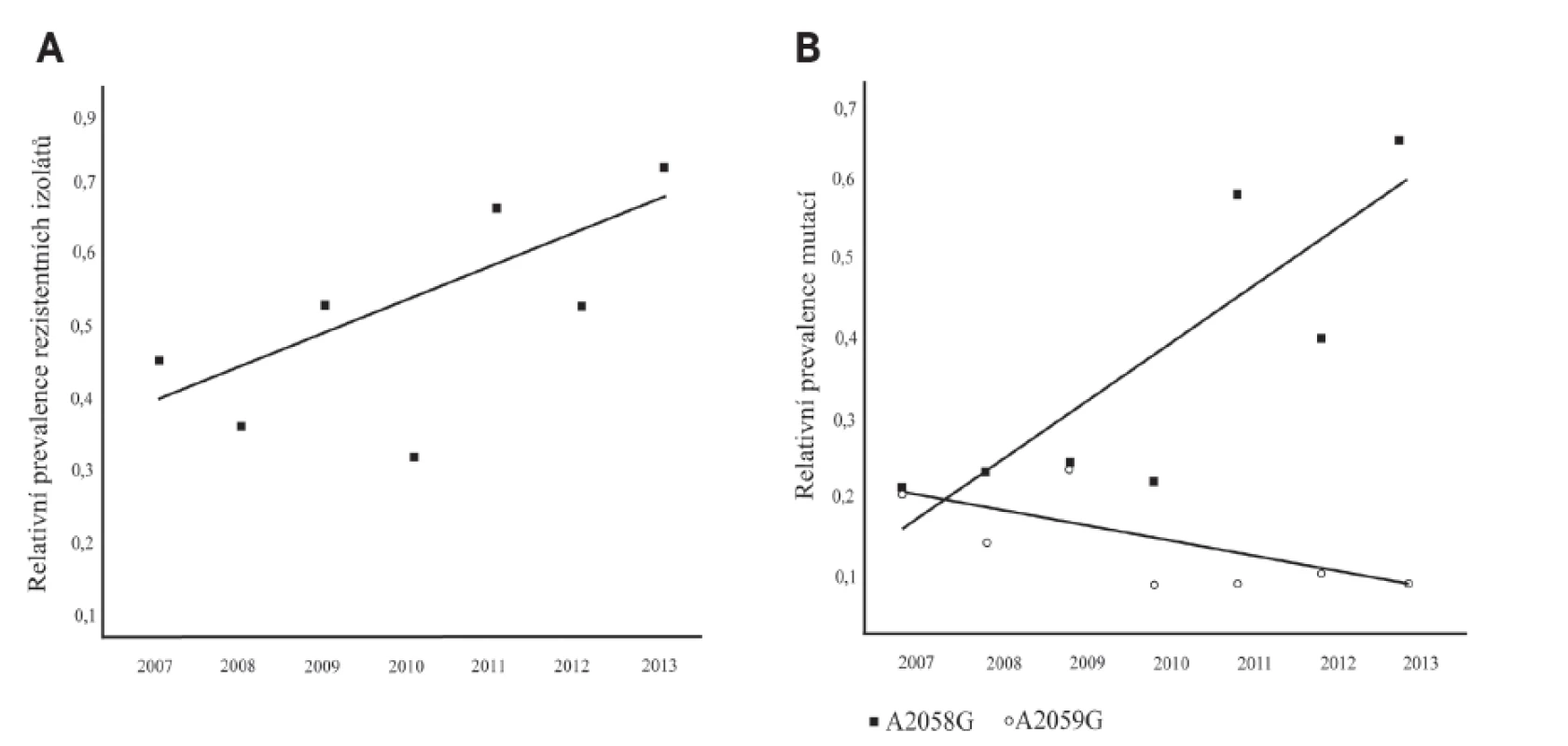
Mapování syfilitických kmenů nesoucích bodové mutace asociované se vznikem rezistence k makrolidovým antibiotikům probíhá v ČR od roku 2004 [46]. V roce 2006 byl detekován první izolát nesoucí mutaci A2058G a o rok později izolát nesoucí mutaci A2059G. Počet těchto kmenů v průběhu času stoupal a v roce 2013 dosáhl 73 % (p = 0,0319) [47, 48] – obrázek 3A. Nalezené mutace se vždy nacházely v obou kopiích genu pro 23S rRNA.
Důvodem pro nárůst rezistentních kmenů TPA je pravděpodobně vznik mutací jako odpověď na selekční tlak makrolidových antibiotik využívaných jak pro léčbu syfilis, tak i v jiných indikacích. Touto hypotézou se jako první zabývali Marra et al. v roce 2006 [49]. Zjistili, že prevalence mutací v sekvenci 23S rDNA syfilitických kmenů je více než dvakrát vyšší u pacientů, kteří byli v předešlém roce léčeni makrolidy. Tuto hypotézu v následujících letech potvrdily i další studie [50, 51]. V ČR sice neznáme údaje o preskripci makrolidových antibiotik před léčbou nebo během léčby pacientů se syfilis, ale data, která byla poskytnuta Státním ústavem pro kontrolu léčiv ČR, ukazují na vzrůstající trend předepisování novějšího derivátu erytromycinu – azitromycinu, který jde ruku v ruce se zvyšující se prevalencí mutací způsobujících rezistenci k makrolidům (viz obr. 1, obr. 3A).
Zatímco prevalence mutace A2058G je u izolátů TPA vysoká a stále roste, prevalence mutace A2059G se zdá být relativně nízká a vykazuje snižující se trend (viz obr. 3, obr. 3B). Rozdílná frekvence výskytu obou mutací by mohla souviset s rozdílnou fyziologickou zátěží, kterou tyto mutace pro kmeny TPA představují. Reverze mutací, které jsou asociované se vznikem rezistence k makrolidovým antibiotikům byly popsány v několika studiích u bakteriálních druhů Campylobacter jejuni, Campylobacter coli, Helicobacter pylori a Streptococcus pneumoniae [22, 52, 53, 54] a rozdílná zátěž způsobená oběma mutacemi (A2058G a A2059G) byla popsána u Chlamydia caviae [55] a také u Mycoplasma genitalium [40].
![Distribuce prevalence rezistentních kmenů TPA ve světě
Vysoká prevalence rezistentních kmenů byla popsána v Austrálii, Číně, Irsku, USA a Velké Británii. Nižší prevalence byla zaznamenána v Kanadě, Jižní Africe a na Tchaj-wanu a nulová prevalence těchto kmenů byla zaznamenána na Madagaskaru. Byla použita data pouze z recentních publikačních zdrojů (2010–2014) [48, 56, 57, 58, 59, 60, 61, 62, 63, 64].<br>
Fig. 4. World distribution of the prevalence of resistant TPA strains. High prevalence countries: Australia, China, Irland, USA, and UK. Lower prevalence countries: Canada, South Africa, and Taiwan. Zero prevalence country: Madagaskar. All data were taken from recent sources (2010–2014) [48, 56, 57, 58, 59, 60, 61, 62, 63, 64].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/ee4e35e39adc7f8db4645015bbcc7a36.png)
PREVALENCE SYFILITICKÝCH KMENŮ REZISTENTNÍCH K MAKROLIDOVÝM ANTIBIOTIKŮM VE SVĚTĚ A HISTORIE ANTIBIOTICKÉ LÉČBY SYFILIS VE SVĚTĚ
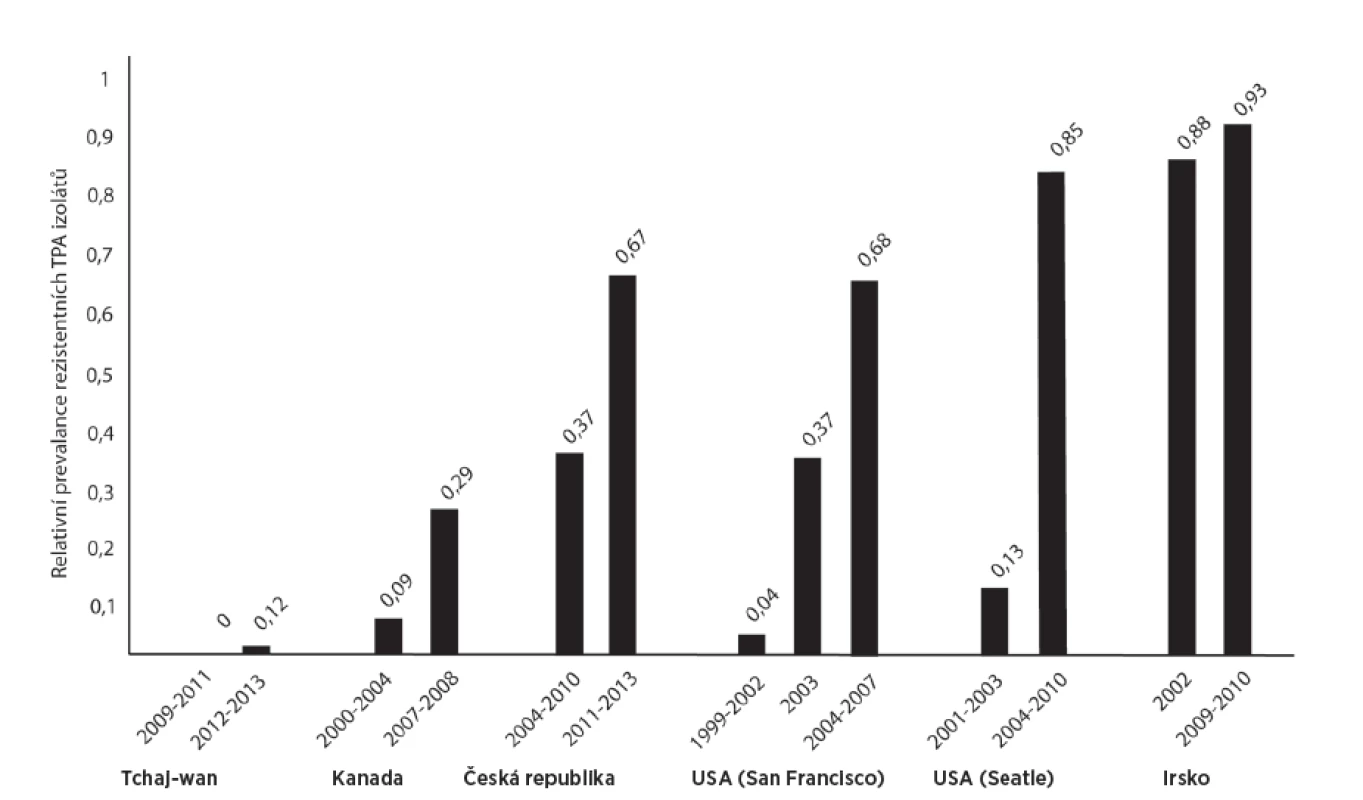
Detekce mutací asociovaných s rezistencí syfilitických kmenů k makrolidovým antibiotikům byla v předešlých letech provedena i v zahraničních studiích. Vysoká prevalence rezistentních kmenů byla popsána v Austrálii, Číně, Irsku, USA a ve Velké Británii. Nižší prevalence byla zaznamenána v Kanadě, Jižní Africe a na Tchaj-wanu a nulová prevalence těchto kmenů byla zaznamenána na Madagaskaru [56, 57, 58, 59, 60, 61, 62, 63, 64] – obrázek 4. Z ostatních oblastí světa nejsou data k dispozici. Vzrůstající trend výskytu makrolidové rezistence u klinických izolátů TPA byl kromě ČR zaznamenán také v Irsku, Kanadě, na Tchaj-wanu a v USA (San Francisco, Seattle) [13, 47, 48, 50, 59, 63, 65, 66, 67, 68] – obrázek 5.
Od roku 1982 publikuje Centrum pro kontrolu a prevenci nemocí v USA (CDC – Center for Disease Control and Prevention) každé 4 roky léčebné postupy doporučené při infekci syfilis. V roce 1982 byl erytromycin doporučován v případech alergie na penicilin pro léčbu primární, sekundární i latentní syfilis. V těhotenství pak nebyl kontraindikován. Po roce 1988, kdy Stamm et al. [9] detekovali in vitro rezistenci klinického izolátu TPA na erytromycin, CDC doporučovalo erytromycin pouze jako alternativní léčbu při primární a sekundární syfilis (500 mg 4krát denně perorálně po dobu 14 dní). V těhotenství začal být erytromycin kontraindikován. V roce 2002 přestal být erytromycin doporučovaný úplně a nahradil jej jeho derivát, azitromycin (2 g perorálně v jedné dávce) při léčbě primárního a sekundárního stadia s kontraindikací u HIV pozitivních pacientů. Od roku 2006, kdy již byly známy případy selhání léčby tímto terapeutikem [13, 14], je azitromycin doporučován jen v krajních případech, kdy není možné pacientům alergickým na penicilin podávat doxycyklin, tetracyklin nebo ceftriaxon. V roce 2010 byl azitromycin kontraindikován při léčbě MSM pacientů (Men who have sex with men), kteří tvoří vysoce rizikovou skupinu při přenosu tohoto onemocnění [69, 70, 71, 72, 73, 74, 75].
ZÁVĚR
Vzhledem ke vzrůstajícímu výskytu makrolidové rezistence u TPA izolátů od pacientů v ČR nelze makrolidová antibiotika používat k léčbě syfilis. Lékem volby při syfilitické infekci je parenterálně podávaný penicilin G, který je také jediný účinný lék na syfilis v průběhu těhotenství (tetracyklinová antibiotika jsou zde kontraindikována). U pacientů s alergií na penicilin je třeba provést desenzibilizaci [75], popřípadě použít tetracyklinová antibiotika, na která jsou TPA kmeny plně citlivé [76].
Poděkování
Tato práce byla podporována Grantovou agenturou České republiky GAČR (P302/12/0574) a Interní grantovou agenturou Ministerstva zdravotnictví IGA MZ (NT-11159-5/10).
Do redakce došlo dne 8. 9. 2014.
Adresa pro korespondenci:
Prof. MUDr. David Šmajs, Ph.D.
Biologický ústav LF MU
Kamenice 5, budova A6
625 00 Brno
e-mail: dsmajs@med.muni.cz
Sources
1. Procházka K. Venerologie. Lékařské knihkupectví a nakladatelstvíMladé generace lékařů v Praze, 1948.
2. Hübschmann K. Venerologie. Státní zdravotnické nakladatelství Praha, 1959.
3. Pohlavní nemoci [online]. Ústav zdravotnických informací a statistiky ČR. 2003-2012. 1x ročně. Dostupný z http://www.uzis.cz/category/tematicke-rady/zdravotnicka-statistika/pohlavni-nemoci. SSN:1210-8634.
4. Urbášková P, Marešová V, Jindrák V et al. Konsenses používání antibiotik II. Makrolidová antibiotika. Dostupné z http://www.szu.cz/konsensy-pouzivani-antibiotik.
5. Adriaenssens N, Coenen S, Versporten A et al. European Surveillance of Antimicrobial Consumption (ESAC): Outpatient macrolide, lincosamide and streptogramin (MLS) use in Europe (1997-2009). J Antimicrob Chemother, 2011;66(6):37–45.
6. Vanicek J, Stastnik M, Kianicka B et al. Rare neurological presentation of human granulocytic anaplasmosis. Eur J Neurol, 2013;20(5):70–72.
7. Hashisaki P, Wertzberger GG, Conrad GL. Erythromycin failure in the treatment of syphilis in a pregnant woman. Sex Transm Dis, 1983;10(1):36–38.
8. Stapleton JT, Stamm LV, Bassford PJ. Potential for development of antibiotic resistance in pathogenic treponemes. Rev Infect Dis, 1985;7(2):314–317.
9. Stamm LV, Stapleton JT, Bassford PJ. In vitro assay to demonstrate high-level erythromycin resistance of a clinical isolate of Treponema pallidum. Antimicrob Agents Chemother, 1988;32(2):164–169.
10. Duncan WC. Failure of erythromycin to cure secondary syphilis in a patient infected with the human immunodeficiency virus. Arch Dermatol, 1989;125(1):82–84.
11. Sands M, Markus A. Lues maligna, or ulceronodular syphilis, in a man infected with human immunodeficiency virus: Case report and review. Clin Infect Dis, 1995;20(2):387–390.
12. Klausner JD, Kohn RP, Kent CK. Azithromycin versus penicillin for early syphilis. N Engl J Med, 2006;354(2):203–205.
13. Lukehart SA, Godornes C, Molini BJ et al. Macrolide resistance in Treponema pallidum in the United States and Ireland. N Engl J Med, 2004;351(2):154–158.
14. Mitchell SJ, Engelman J, Kent CK et al. Azithromycin-resistant syphilis infection: San Francisco, California, 2000-2004. Clin Infect Dis, 2006;42(3):337–345.
15. Matějková P, Flasarová M, Zákoucká H et al. Macrolide treatment failure in a case of secondary syphilis: A novel A2059G mutation in the 23S rRNA gene of Treponema pallidum subsp. pallidum. J Med Microbiol, 2009;58(6):832–836.
16. Woznicová V, Matějková P, Flasarová M et al. Clarithromycin treatment failure due to macrolide resistance in Treponema pallidum in a patient with primary syphilis. Acta Derm Venereol, 2010;90(2):206–207.
17. Zhou P, Li K, Lu H et al. Azithromycin treatment failure among primary and secondary syphilis patients in Shanghai. Sex Transm Dis, 2010;37(11):726–729.
18. Vester B, Douthwaite S. Macrolide resistance conferred by base substitutions in 23S rRNA. Antimicrob Agents Chemother, 2001;45(1):1–12.
19. Vester B, Douthwaite S. Domain V of 23S rRNA contains all the structural elements necessary for recognition by the ErmE methyltransferase. J Bacteriol, 1994;176(22):6999–7004.
20. Xiong L, Shah S, Mauvais P et al. A ketolide resistance mutation in domain II of 23S rRNA reveals the proximity of hairpin 35 to the peptidyl transferase centre. Mol Microbiol, 1999;31(2):633–639.
21. Pfister P, Jenni S, Poehlsgaard J et al. The structural basis of macrolide-ribosome binding assessed using mutagenesis of 23S rRNA positions 2058 and 2059. J Mol Biol, 2004;342(5):1569–1581.
22. Gibreel A, Kos VN, Keelan M et al. Macrolide resistance in Campylobacter jejuni and Campylobacter coli: Molecular mechanism and stability of the resistance phenotype. Antimicrob Agents Chemother, 2005;49(7):2753–2759.
23. Versalovic J, Shortridge D, Kibler K et al. Mutations in 23S rRNA are associated with clarithromycin resistance in Helicobacter pylori. Antimicrob Agents Chemother, 1996;40(2):477–480.
24. Misyurina OY, Chipitsyna EV, Finashutina YP et al. Mutations in a 23S rRNA gene of Chlamydia trachomatis associated with resistance to macrolides. Antimicrob Agents Chemother, 2004;48(4):1347–1349.
25. Zhu H, Wang HP, Jiang Y et al. Mutations in 23S rRNA and ribosomal protein L4 account for resistance in Chlamydia trachomatis strains selected in vitro by macrolide passage. Andrologia, 2010;42(4):274–280.
26. Begovic J, Huys G, Mayo B et al. Human vaginal Lactobacillus rhamnosus harbor mutation in 23S rRNA associated with erythromycin resistance. Res Microbiol, 2009;160(6):421–426.
27. Wallace RJ, Meier A, Brown BA et al. Genetic basis for clarithromycin resistance among isolates of Mycobacterium chelonae and Mycobacterium abscessus. Antimicrob Agents Chemother, 1996;40(7):1676–1681.
28. Hantz S, Garnier F, Peuchant O et al. Multilocus variable-number tandem-repeat analysis-confirmed emergence of a macrolide resistance-associated mutation in Mycoplasma pneumoniae during macrolide therapy for interstitial pneumonia in an immunocompromised child. J Clin Microbiol, 2012;50 : 3402–3405.
29. Lucier TS, Heitzman K, Liu SK, Hu PC. Transition mutations in the 23S rRNA of erythromycin-resistant isolates of Mycoplasma pneumoniae. Antimicrob Agents Chemother, 1995;39(12):2770–2773.
30. Chisholm SA, Dave J, Ison CA. High-level azithromycin resistance occurs in Neisseria gonorrhoeae as a result of a single point mutation in the 23S rRNA genes. Antimicrob Agents Chemother, 2010;54(9):3812–3816.
31. Ross JI, Eady EA, Cove JH et al. Clinical resistance to erythromycin and clindamycin in cutaneous propionibacteria isolated from acne patients is associated with mutations in 23S rRNA. Antimicrob Agents Chemother, 1997;41(5):1162–1165.
32. Marvig RL, Sondergaard MSR, Damkiær S et al. Mutations in 23S rRNA confer resistance against azithromycin in Pseudomonas aeruginosa. Antimicrob Agents Chemother, 2012;56(8):4519–4521.
33. Prunier AL, Malbruny B, Tandé D. Clinical isolates of Staphylococcus aureus with ribosomal mutations conferring resistance to macrolides. Antimicrob Agents Chemother, 2002;46(9):3054–3056.
34. Boumghar-Bourtchai L, Chardon H, Malbruny B et al. Resistance to macrolides by ribosomal mutation in clinical isolates of Turicella otitidis. Int J Antimicrob Agents, 2009;34(3):274–277.
35. Meier A, Kirschner P, Springer B et al. Identification of mutations in 23S rRNA gene of clarithromycin-resistant Mycobacterium intracellulare. Antimicrob Agents Chemother, 1994;38(2):381–384.
36. Vacher S, Menard A, Bernard E et al. Detection of mutations associated with macrolide resistance in thermophilic Campylobacter spp. by real-time PCR. Microb Drug Resist, 2005;11(1):40–47.
37. Matsuoka M, Narita M, Okazaki N et al. Characterization and molecular analysis of macrolide-resistant Mycoplasma pneumoniae clinical isolates obtained in Japan. Antimicrob Agents Chemother, 2004;48(12):4624–4630.
38. Wang G, Taylor DE. Site-specific mutations in the 23S rRNA gene of Helicobacter pylori confer two types of resistance to macrolide-lincosamide-streptogramin B antibiotics. Antimicrob Agents Chemother, 1998;42(8):1952–1958.
39. Sigmund CD, Ettayebi M, Morgan EA. Antibiotic resistance mutations in 16S and 23S ribosomal RNA genes of Escherichia coli. Nucleic Acids Res, 1984;12(11):4653–4663.
40. Chrisment D, Charron A, Cazanave C et al. Detection of macrolide resistance in Mycoplasma genitalium in France. J Antimicrob Chemother, 2012;67(11):2598–2601.
41. Zhen-Hua Z, De-Qiang H, Yong X et al. Characterization of 23S rRNA gene mutation in primary and secondary clarithromycin-resistant Helicobacter pylori strains from East China. Turk J Gastroenterol, 2013;24(1):5–9.
42. Stamm LV, Bergen HL. A point mutation associated with bacterial macrolide resistance is present in both 23S rRNA genes of an erythromycin-resistant Treponema pallidum clinical isolate. Antimicrob Agents Chemother, 2000;44(3):806–807.
43. Stamm LV, Parrish EA. In vitro activity of azithromycin and CP-63,956 against Treponema pallidum. J Antimicrob Chemother, 1990;25(A)11–14.
44. Pandori MW, Gordones C, Castro L et al. Detection of azithromycin resistance in Treponema pallidum by real-time PCR. Antimicrob Agents Chemother, 2007;51(9):3425–3430.
45. Chen CY, Chi KH, Pillay A et al. Detection of the A2058G and A2059G 23S rRNA gene point mutations associated with azithromycin resistance in Treponema pallidum by use of a TaqMan real-time multiplex PCR assay. J Clin Microbiol, 2013;51(3):908–913.
46. Flasarová M, Šmajs D, Matějková P et al. Molecular detection and subtyping of Treponema pallidum subsp. pallidum in clinical specimens. Epidemiol Mikrobiol Imunol, 2006;55(3):105–111.
47. Flasarová M, Pospíšilová P, Mikalová L et al. Sequencing-based molecular typing of Treponema pallidum strains in the Czech Republic: All identified genotypes are related to the sequence of the SS14 strain. Acta Derm Venereol, 2012;92(6):669–674.
48. Grillová L, Pětrošová H, Mikalová L et al. Molecular Typing of Treponema pallidum in the Czech Republic during 2011-2013: Increased Prevalence of Identified Genotypes and of Isolates Encoding Macrolide Resistance. J Clin Microbiol, 2014;52(10):3693–3700.
49. Marra CM, Colina AP, Godornes C et al. Antibiotic selection may contribute to increases in macrolide-resistant Treponema pallidum. J Infect Dis, 2006;194(12):1771–1773.
50. Grimes M, Sahi SK, Godornes BC et al. Two mutations associated with macrolide resistance in Treponema pallidum: Increasing prevalence and correlation with molecular strain type in Seattle, Washington. Sex Transm Dis, 2012;39(12):954–958.
51. Chen XS, Yin YP, Wei WH et al. High prevalence of azithromycin resistance to Treponema pallidum in geographically different areas in China. Clin Microbiol Infect, 2013;19(10):975–979.
52. Xia HX, Buckley M, Keane CT et al. Clarithromycin resistance in Helicobacter pylori: prevalence in untreated dyspeptic patients and stability in vitro. J Antimicrob Chemother, 1996;37(2):473–481.
53. Alarcón T, Domingo D, Prieto N et al. Clarithromycin resistance stability in Helicobacter pylori: Influence of the MIC and type of mutation in the 23S rRNA. J Antimicrob Chemother, 2000;46(4):613–616.
54. Wolter N, Smith AM, Farrell DJ et al. Heterogeneous macrolide resistance and gene conversion in the pneumococcus. Antimicrob Agents Chemother, 2006;50(1):359–361.
55. Binet R, Bowlin AK, Maurelli AT et al. Impact of azithromycin resistance mutations on the virulence and fitness of Chlamydia caviae in guinea pigs. Antimicrob Agents Chemother, 2010;54(3):1094–1101.
56. Read P, Jeoffreys N, Tagg K et al. Azithromycin resistant syphilis-causing strains in Sydney: Prevalence and risk factors. J Clin Microbiol, 2014;52(8):2776–2781.
57. Li Z, Hou J, Zheng R et al. Two mutations associated with macrolide resistance in Treponema pallidum in Shandong, China. J Clin Microbiol, 2013;51(12):4270–4271.
58. Su JR, Pillay A, Hook EW et al. Prevalence of the 23S rRNA A2058G point mutation and molecular subtypes in Treponema pallidum in the United States, 2007 to 2009. Sex Transm Dis, 2012;39(10):794–798.
59. Muldoon EG, Walsh A, Crowley B et al. Treponema pallidum azithromycin resistance in Dublin, Ireland. Sex Transm Dis, 2012;39(10):784–786.
60. Tipple C, McClure MO, Taylor GP. High prevalence of macrolide resistant Treponema pallidum strains in a London centre. Sex Transm Infect, 2011;87(6):486–488.
61. Martin IE, Tsang RSW, Sutherland K et al. Molecular typing of Treponema pallidum strains in western Canada: Predominance of 14d subtypes. Sex Transm Dis, 2010;37(9):544–548.
62. Müller EE, Paz-Bailey G, Lewis DA. Macrolide resistance testing and molecular subtyping of Treponema pallidum strains from southern Africa. Sex Transm Infect, 2012;88(6):470–474.
63. Wu BR, Yang CJ, Tsai MS et al. Multicentre surveillance of prevalence of the 23S rRNA A2058G and A2059G point mutations and molecular subtypes of Treponema pallidum in Taiwan, 2009–2013. Clin Microbiol Infect, 2014;20(8):802–807.
64. Van Damme K, Behets F, Ravelomanana N et al. Evaluation of azithromycin resistance in Treponema pallidum specimens from Madagascar. Sex Transm Dis, 2009;36(12):775–776.
65. Morshed MG, Jones HD. Treponema pallidum macrolide resistance in BC. CMAJ, 2004; 174(3):349.
66. Martin IE, Gu W, Yang Y et al. Macrolide resistance and molecular types of Treponema pallidum causing primary syphilis in Shanghai, China. Clin Infect Dis, 2009;49(4):515–521.
67. Wu H, Chang SY, Lee NY et al. Evaluation of macrolide resistance and enhanced molecular typing of Treponema pallidum in patients with syphilis in Taiwan: A prospective multicenter study. J Clin Microbiol, 2012;50(7):2299–2304.
68. Katz KA, Pillay A, Ahrens K et al. Molecular epidemiology of syphilis, San Francisco, 2004-2007. Sex Transm Dis, 2010;37(10):660–663.
69. Centers for Disease Control and Prevention. Sexually transmitted diseases treatment guidelines. MMWR, 1982;31(2):33–60.
70. Centers for Disease Control and Prevention. Sexually Transmitted Diseases Treatment Guidelines. MMWR, 1989;38(8):1–43.
71. Centers for Disease Control and Prevention. Sexually transmitted diseases treatment guidelines. MMWR, 1993;42(14):1–102.
72. Centers for Disease Control and Prevention. Guidelines for treatment of sexually transmitted diseases. MMWR, 1998;47(1):1–111.
73. Centers for Disease Control and Prevention. Sexually transmitted diseases treatment guidelines. MMWR, 2002;51(6):1–78.
74. Centers for disease control and Prevention. Sexually transmitted diseases treatment guidelines. MMWR, 2006;55(11):1–94.
75. Workowski KA, Berman S. Sexually transmitted diseases treatment guidelines. MMWR, 2010;59(12):1–110.
76. Wu BR, Liu WC, Wu PY et al. Surveillance study of Treponema pallidum harbouring tetracycline resistance mutations in patients with syphilis. Int J Antimicrob Agents, 2014;44(4):370–372.
Labels
Hygiene and epidemiology Medical virology Clinical microbiologyArticle was published in
Epidemiology, Microbiology, Immunology

2015 Issue 1
-
All articles in this issue
- Macrolide resistance in Treponema pallidum subsp. pallidum in the Czech Republic and in other countries
- Contribution of the detection of IgA antibodies to the laboratory diagnosis of mumps in the population with a high vaccination coverage
- A case of tuberculous meningitis associated with persistently reduced CD4+ T lymphocyte counts
- Impact of climate changes on the incidence of tick-borne encephalitis in the Czech Republic in 1982–2011
- A multifactor epidemiological analysis of risk factors for pancreatic cancer in women
- The population’s attitudes to colorectal cancer screening in the Czech Republic
- Prevalence of selected congenital anomalies in the Czech Republic: congenital anomalies of the central nervous system and gastrointestinal tract
- Editorial
- Minimum inhibitory concentrations of erythromycin and other antibiotics for Czech strains of Bordetella pertussis
- Epidemiology, Microbiology, Immunology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Macrolide resistance in Treponema pallidum subsp. pallidum in the Czech Republic and in other countries
- Contribution of the detection of IgA antibodies to the laboratory diagnosis of mumps in the population with a high vaccination coverage
- Minimum inhibitory concentrations of erythromycin and other antibiotics for Czech strains of Bordetella pertussis
- A case of tuberculous meningitis associated with persistently reduced CD4+ T lymphocyte counts
