In-vivo mezidruhový přenos KPC karbapenemázy u dlouhodobě léčené pacientky
In-vivo interspecies transmission of carbapenemase KPC in a long-term treated female patient
The increasing incidence of multiresistant bacterial strains is currently a serious health concern. These pathogens are often the cause of nosocomial infections with limited treatment options and high fatality rates. A case report is presented of an uncommon detection of four different species (Citrobacter freundii, Klebsiella pneumoniae, Escherichia coli, and Morganella morganii) producing the same type of carbapenemase, KPC-2, in a female patient during her complicated long-term hospital stay. Resistance was probably spread to other species by horizontal transmission of plasmids carrying the blaKPC-2 genes. The implementation of strict anti-epidemic measures prevented further spread of these carbapenem-resistant bacteria.
Keywords:
multiresistance – carbapenemase – KPC-2 – interspecies transmission – anti-epidemic measures
Authors:
P. Polcarová 1; L. Hobzová 2; R. Kukla 3
; P. Skořepa 4; J. Smetana 1
; R. Šošovičková 1; R. Chlíbek 1
Authors‘ workplace:
Katedra epidemiologie, Fakulta vojenského zdravotnictví Univerzity obrany, Hradec Králové
1; Oddělení nemocniční hygieny, Fakultní nemocnice Hradec Králové
2; Ústav klinické mikrobiologie, Fakultní nemocnice Hradec Králové
3; III. interní gerontometabolická klinika, Fakultní nemocnice Hradec Králové
4
Published in:
Epidemiol. Mikrobiol. Imunol. 68, 2019, č. 2, s. 99-102
Category:
Short Communication
Overview
Nárůst výskytu multirezistentních bakteriálních kmenů představuje jeden ze závažných problémů současného zdravotnictví. Tyto patogeny jsou častou příčinou nozokomiálních nákaz, které jsou spojené s omezenými terapeutickými možnostmi a vyšší mortalitou. Prezentován je neobvyklý případ záchytu čtyř různých druhů producentů (Citrobacter freundii, Klebsiella pneumoniae, Escherichia coli, Morganella morganii) shodné karbapenemázy typu KPC-2 u jediné pacientky v průběhu dlouhodobé komplikované hospitalizace. K šíření rezistence na ostatní druhy pravděpodobně došlo horizontálním přenosem plazmidů obsahujících geny blaKPC-2. Implementace přísných protiepidemických opatření zabránila dalšímu šíření těchto karbapenem-rezistentních bakterií.
Klíčová slova:
multirezistence – karbapenemáza – KPC-2 – mezidruhový přenos – protiepidemická opatření
ÚVOD
V současnosti dochází k nezanedbatelnému nárůstu výskytu multirezistentních gramnegativních bakterií, které se úspěšně šíří v mnoha zemích světa. Jedná se především o nefermentující gramnegativní tyčinky z rodu Pseudomonas a Acinetobacter a také o bakterie z řádu Enterobacterales, jako například Escherichia coli a Klebsiella pneumoniae [1]. Druhy z uvedené čeledi se řadí k běžným původcům jak nozokomiálních, tak i komunitních nákaz. Způsobují více či méně závažná onemocnění urogenitálního, gastrointestinálního a respiračního traktu, ale také komplikovanější infekce typu peritonitidy, meningitidy či fatální sepse. Z klinického i epidemiologického hlediska je velmi závažný nárůst výskytu rezistence ke karbapenemům podmíněné produkcí karbapenemáz a to zejména u enterobakterií (CPE – Carbapenemase Producing Enterobacteriaceae, karbapenemázy produkující enterobakterie). Naprostá většina karbapenemáz je kódována geny na mobilních genetických elementech, které se mohou u enterobakterií mezidruhově velmi rychle šířit [2]. Karbapenemy jsou vzhledem ke svému širokospektrému účinku považovány za antibiotika poslední volby pro terapii závažných infekcí. Působí baktericidně na klinicky významné druhy z čeledi Enterobacteriaceae včetně těch, které produkují širokospektré beta-laktamázy (ESBL), beta-laktamázy typu AmpC a na citlivé pseudomonády a acinetobaktery [3]. Bakterie produkující karbapenemázy mohou v závislosti na typu enzymu (KPC, IMP, VIM, NDM nebo OXA-48) a úrovni jeho exprese vykazovat v různé míře rezistenci k beta-laktamovým antibiotikům včetně karbapenemů. Uvedené kmeny bývají často rezistentní i k dalším skupinám antibiotik, například k aminoglykosidům a fluorochinolonům [1, 4]. Citlivost CPE pak zůstává zpravidla zachována ke kolistinu, fosfomycinu či tigecyklinu, avšak in vivo účinek těchto antibiotik je špatně předvídatelný [5, 6].
Karbapenemázy jsou klasifikovány do několika skupin, z nichž ve světě nejvíce rozšířené jsou karbapenemázy typu KPC (Klebsiella pneumoniae carbapenemase) [7]. V současné době je známo devatenáct variant KPC, z nichž nejčastější jsou KPC-2 a KPC-3 [8]. Geny pro KPC jsou typicky lokalizovány na mobilních genetických elementech (např. plazmidech), což usnadňuje jejich horizontální přenos mezi druhy z čeledi Enterobacteriaceae. Tento mechanismus přenosu současně umožňuje jejich snadné šíření v populaci bakterií [1, 9].
CPE jsou častými původci nozokomiálních nákaz. Invazivní infekce způsobené kmeny produkujícími karbapenemázy postihují převážně osoby po transplantaci orgánů nebo kmenových buněk a také dlouhodobě léčené nebo ventilované pacienty, kterým jsou podávána širokospektrá antibiotika. Léčba infekcí způsobených CPE je komplikovaná a značně omezená. Je spojená nejen s rostoucími náklady na zdravotní péči, ale i zvýšeným rizikem úmrtí infikovaných pacientů [10, 11, 12].
KAZUISTIKA
Pacientka (45 roků) byla na počátku srpna 2015 přijata do spádové nemocnice pro jeden den trvající bolesti břicha s opakovaným zvracením. Na základě klinického nálezu a výsledků komplementárních vyšetření byla stanovena diagnóza akutní pankreatitidy toxonutritivní etiologie. Stav nemocné se od počátku progresivně zhoršoval a 4. den hospitalizace došlo k rozvoji multiorgánového selhání s rozvojem syndromu akutní dechové tísně s nutností umělé plicní ventilace. Pacientka byla přeložena na interní jednotku intenzivní péče Fakultní nemocnice Hradec Králové. Pro nekrózu pankreatu a rozvoj peripankreatických infiltrátů doprovázených septickým šokem byla provedena chirurgická revize s drenáží, která vyústila v laparostoma. Pooperačně došlo ke zlepšení a stabilizaci stavu. Stav pacienty však následně zkomplikoval vznik mnohočetných střevních píštělí. V průběhu pokračující dlouhodobé mnohaměsíční hospitalizace následovala celá řada dalších komplikací jako recidivující pneumonie, recidivující urosepse, kolitida, recidivující cholangoitidy, krvácení z erodované lienální tepny, flegmóny kůže v okolí rány. Finálně vše vyústilo v absenci možnosti terapeutického ovlivnění celkového stavu a pacientka umírá po 18měsíční hospitalizaci na septický šok.
Mikrobiologie
Vzhledem k opakujícím se infekčním komplikacím a septickým stavům způsobeným zpravidla multirezistentními kmeny Pseudomonas aeruginosa a enterobakteriemi produkujícími ESBL byla od počátku pacientka léčena kombinacemi antibiotik – piperacilin-tazobaktam, meropenem, metronidazol, kolistin a tigecyklin.
Po třech měsících hospitalizace (listopad 2015) byl ve výtěru z rekta pacientky v rámci screeningu designovaného pro multirezistentní kmeny vykultivován kmen Citrobacter freundii rezistentní ke všem testovaným beta-laktamům včetně karbapenemů (tab. 1). Během následujících čtrnácti měsíců byl tento kmen u pacientky opakovaně zachycen zejména v tekutině z břišních drénů, ve výtěrech rekta a také z močového katetru. V srpnu 2016, tedy rok od počátku hospitalizace, byla z močového katétru dále vykultivována karbapenem-rezistentní K. pneumoniae. V listopadu 2016 byla z močového katétru vykultivována E. coli rezistentní ke karbapenemům a v prosinci 2016 i karbapenem-rezistentní Morganella morganii. Tabulka 1 uvádí hodnoty minimální inhibiční koncentrace (MIC) těchto čtyř karbapenem-rezistentních bakteriálních kmenů k vybraným antibiotikům při jejich prvním záchytu. MIC byla zjištěna mikrodiluční metodou (Erba-Lachema, CZ) nebo E-testem (Etest®, BioMerieux, Francie).
Table 1. MICs of selected antibiotics at the time of the first detection of KPC-2-producing enterobacteria
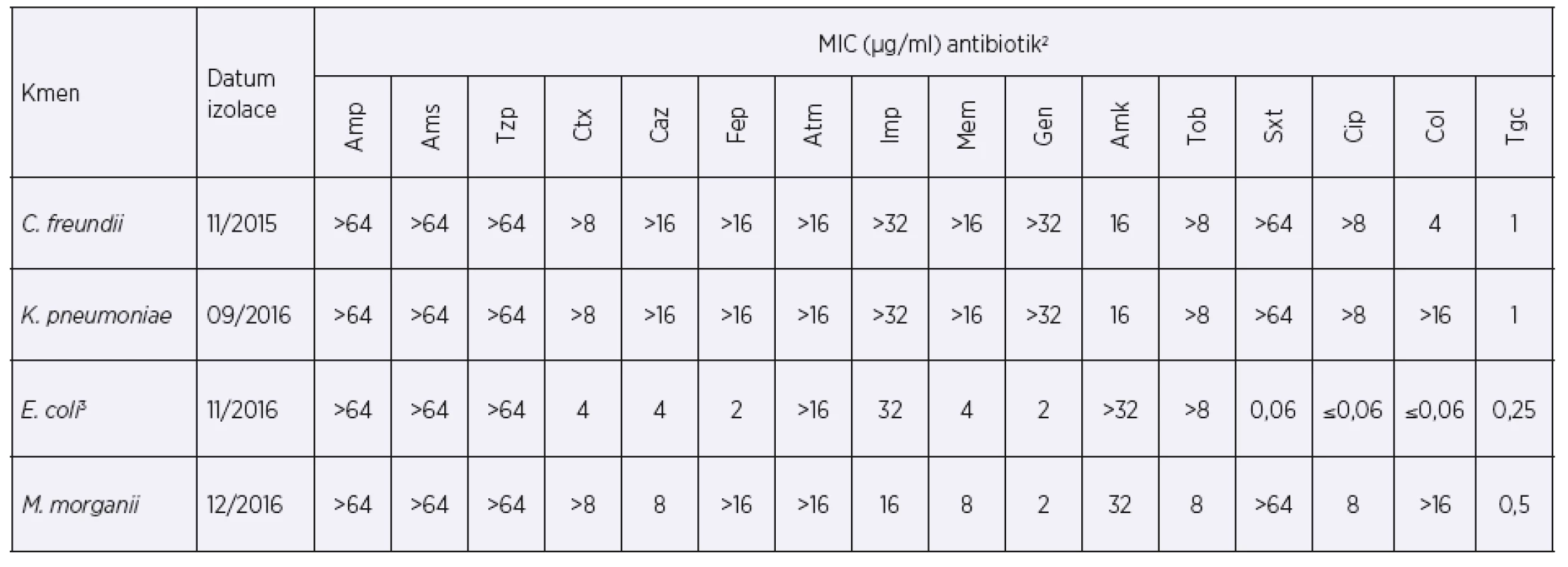
1 Kmeny s hodnotami MIC meropenemu a imipenemu > 8 μg/ml jsou k těmto antibiotikům rezistentní. Některé izoláty produkující karbapenemázu mohou být podle aktuálních
breakpointů hodnoceny jako citlivé, jelikož nižší úroveň exprese (nebo typ) karbapenemázy nemusí ovlivnit výslednou citlivost. Pro screening karbapenemáz se proto využívá
hraniční hodnota meropenemu o koncentraci > 0,125 μg/ml [21].
2 Amp – ampicilin, Ams – ampicilin-sulbaktam, Tzp – piperacilin-tazobaktam, Ctx – cefotaxim, Caz – ceftazidim, Fep – cefepim, Atm – aztreonam, Imp – imipenem, Mem – meropenem,
Gen – gentamicin, Amk – amikacin, Tob – tobramycin, Sxt – trimetoprim-sulfametoxazol, Cip – ciprofloxacin, Col – kolistin, Tgc – tigecyklin
3 V tabulce jsou uvedeny MIC prvního záchytu KPC u enterobakterií. U dalších izolátů E. coli v čase se hodnoty MIC u Caz, Ctx, Fep a Mem zvýšily.
Antibiotic susceptibility of strains was evaluated in accordance with the EUCAST criteria1.
1 Strains with meropenem and imipenem MICs of > 8 μg/ml are considered resistant to these antibiotics. Some carbapenemase-producing isolates can be classified as susceptible
according to the current breakpoints as a lower carbapenemase expression level (or type) may not affect the resultant susceptibility. Therefore, for carbapenemase screening, a
cut-off meropenem value at a concentration of > 0.125 μg/ml is used [21].
2 Amp – ampicillin, Ams – ampicillin-sulbactam, Tzp – piperacillin-tazobactam, Ctx – cefotaxime, Caz – ceftazidime, Fep – cefepime, Atm – aztreonam, Imp – imipenem, Mem – meropenem,
Gen – gentamicin, Amk – amicacin, Tob – tobramycin, Sxt – trimethoprim-sulfametoxazole, Cip – ciprofloxacin, Col – collistin, Tgc – tigecycline
3 The table presents the MICs at the time of the first detection of KPC in enterobacteria. In other E. coli isolates, the Caz, Ctx, Fep, and Mem MICs increased over time.
Produkce karbapenemázy u izolovaného C. freundii byla ověřena fenotypově diagnostickou soupravou ROSCO diagnostika. Byla zjištěna synergie kombinace meropenemu s kyselinou fenylboritou a kmen byl suspektně považován za producenta karbapenemázy KPC. Genotypová konfirmace KPC karbapenemázy byla provedena detekcí genu blaKPC in-house metodou real-time PCR s pozitivním výsledkem. Sekvence primerů a sond byly převzaty z publikace Monteiro et al. 2012 [13]. Kmeny byly rovněž odeslány ke konfirmaci do Státního zdravotního ústavu (Národní referenční laboratoř pro antibiotika), kde byla produkce karbapenemázy potvrzena detekcí hydrolýzy meropenemu na MALDI-TOF MS a průkazem genu blaKPC. Stejným způsobem byly vyšetřeny i následně izolované karbapenem-rezistentní kmeny, u kterých byla potvrzena produkce shodné karbapenemázy. Na přítomnost karbapenemázy byla vyšetřena také multirezistentní P. aeruginosa, u které byla pomocí výše uvedených fenotypových i genotypových metod prokázána metalo-β-laktamáza typu IMP [13].
DISKUSE
Kazuistika popisuje výskyt čtyř různých druhů enterobakterií produkujících karbapenemázu typu KPC u jediné pacientky. Záchyt více druhů CPE produkující stejný typ karbapenemázy u jednoho pacienta je nezvyklý. V Evropě byl první případ přenosu KPC karbapenemázy z K. pneumoniae na E. coli popsán v roce 2011 [14]. V prezentovaném případě je zajímavé, že po záchytu C. freundii produkujícího KPC-2 u pacientky, byl další KPC-2 produkující druh (K. pneumoniae) izolován o deset měsíců později, přičemž další následující KPC-2 produkující bakterie (E. coli a M. morganii) byly zachyceny již v poměrně rychlém sledu jednoho až dvou měsíců. Před hospitalizací prezentované pacientky se na uvedeném oddělení jednotky intenzivní péče kmen C. freundii s genem blaKPC-2 vyskytl u 4 pacientů (u 1 ženy a 3 mužů). První případ byl zachycen v roce 2013, druhý v roce 2014 a další dva případy roce 2015. Mimo uvedené oddělení se KPC-2 pozitivní C. freundii ještě vyskytl u pacienta urologické kliniky v roce 2015. U všech ostatních pacientů se jednalo o infekci močových cest, kdy byl původce zachycen z permanentního katétru. Epidemiologie těchto kmenů je však nejasná.
U prezentovaného případu se předpokládá, že v průběhu hospitalizace pacientky, kdy byla dlouhodobě podávána kombinace širokospektrých antibiotik, došlo k přenosu plazmidů obsahujících gen blaKPC-2 z C. freundii na ostatní enterobakterie (K. pneumoniae, E. coli a M. morganii). Uvedenou hypotézu podporuje publikovaná studie, kde byla zjištěna přítomnost stejného plazmidu nesoucího gen blaKPC-2 u dvou ze čtyř diskutovaných kmenů. U zbylých dvou izolátů byly identifikovány dva různé typy plazmidů nesoucích gen blaKPC-2, což naznačuje schopnost enterobakteriálních plazmidů se vyvíjet [15]. Skutečnost, že může docházet k horizontálnímu přenosu genů KPC rezistence mezi různými druhy enterobakterií dosvědčuje i řada dalších studií a podobné klinické případy [12, 16, 17, 18].
Česká republika je i přes nárůst výskytu karbapenemáza produkujících bakterií v posledních letech stále řazena mezi státy s velmi nízkým výskytem CPE [19]. Přesto je však důležité situaci nepodceňovat, i vzhledem k případu, který je zde prezentován. Česká republika je zapojena do několika mezinárodních projektů zabývajících se problematikou produkce karbapenemáz u enterobakterií a pseudomonád, a to prostřednictvím Národní referenční laboratoře pro antibiotika Státního zdravotního ústavu a Ústavu mikrobiologie Lékařské fakulty Univerzity Karlovy v Plzni. Při výskytu bakterií produkujících karbapenemázu je třeba dodržovat Metodický pokyn vydaný Ministerstvem zdravotnictví [20]. V něm se odrážejí i zkušenosti z Izraele a Polska, kde se podařilo šíření CPE omezit.
Na úrovni Fakultní nemocnice Hradec Králové se kontrolou výskytu rezistentních bakteriálních kmenů intenzivně zabývá tým pro kontrolu infekcí, který sleduje aktuální rizika a stanovuje konkrétní cíle a intervence. Cílem intervencí, které vycházejí z podkladů lokální surveillance, je kontrola výskytu rezistentních bakteriálních kmenů a zamezení jejich nekontrolovanému šíření. Od nálezu prvního producenta karbapenemázy typu KPC-2 u prezentované pacientky byla zavedena nejpřísnější protiepidemická opatření, která se aplikují vždy v případě hospitalizace pacienta s nálezem kmene produkujícího karbapenemázu. Tato opatření vycházejí z Metodického pokynu Ministerstva zdravotnictví a spočívají v přísné izolaci pacienta, bariérové péči s vyčleněným ošetřujícím personálem, speciálním režimu při léčebných výkonech, pravidelném screeningu (1krát týdně výtěr z rekta a chronických ran), který pokračuje ještě cca 1 měsíc po propuštění nebo překladu pacienta s nálezem CPE apod. [20]. V případě překladu pacienta do jiného zdravotnického zařízení nebo zařízení následné péče či při propouštění do domácí péče je přijímající zařízení nebo rodina předem informována o jeho epidemiologickém stavu. Údaj o pozitivitě je též předáván orgánu ochrany veřejného zdraví, který v případě potřeby nastavuje a kontroluje protiepidemická opatření. Pacient s pozitivním nálezem bakteriálního kmene produkujícího karbapenemázu má v nemocničním systému zaveden tzv. epidemiologický příznak, který upozorňuje při každém otevření elektronické zdravotnické dokumentace všechny zdravotníky pečující o pacienta o této skutečnosti, a umožňuje tak zavést a dodržovat výše uvedená protiepidemická opatření. Uplatňování přísných protiepidemických opatření a efektivní antibiotická politika ve Fakultní nemocnici v Hradci Králové udržují relativně nízký výskyt karbapenem-rezistentních kmenů včetně producentů karbapenemáz. Díky zavedení a dodržování těchto opatření v rámci prezentované kazuistiky nedošlo k epidemickému šíření původců produkujících KPC-2 karbapenemázu na další pacienty inkriminovaného oddělení ani na jiné kliniky v nemocnici.
ZÁVĚR
Celosvětové šíření CPE a dalších multirezistentních bakterií představuje v současnosti jednu z nejvýznamnějších hrozeb v oblasti zdravotnictví. Terapeutické možnosti infekcí způsobených těmito patogeny jsou velmi omezené, což následně souvisí s vysokou mortalitou postižených pacientů. Zásadní podíl na tomto fenoménu má zcela jistě značné užívání širokospektrých antibiotik, které umožňuje jednak vznik rezistence, ale také in vivo horizontální přenos genů rezistence mezi jednotlivými druhy. U kmenů enterobakterií se sníženou citlivostí ke karbapenemům je nutné vyloučit nebo potvrdit suspektního producenta karbapenemázy s použitím dnes již mnoha komerčně dostupných screeningových rychlých testů. Při výskytu bakterií produkujících karbapenemázy je nezbytné dodržování přísných protiepidemických opatření, aby se zabránilo jejich šíření ve zdravotnickém zařízení.
Tato práce vznikla za finanční podpory Ministerstva obrany České republiky – dlouhodobého záměru rozvoje organizace Zdravotnická problematika zbraní hromadného ničení Fakulty vojenského zdravotnictví Univerzity obrany.
Do redakce došlo dne 3. 9. 2018.
Adresa pro korespondenci:
npor. MUDr. Petra Polcarová
Katedra epidemiologie
Fakulta vojenského zdravotnictví
Univerzita obrany
Třebešská 1575
500 01 Hradec Králové
e-mail: petra.polcarova@unob.cz
Sources
1. Hrabák J, Žemličková H. Výskyt multirezistentních gramnegativních bakterií v českých nemocnicích – upozornění na problém šíření bakterií produkujících transferabilní karbapenemázy. Dostupné na www: <https://www.sneh.cz/_soubory/_clanky/12.pdf >.
2. Nordmann P, Naas T, Poirel L. Global spread of carbapenemase – producing Enterobacteriaceae. Emerg Infect Dis, 2011;17(10):1791–1798.
3. Hrabák J, Jakubů V, Španělová P, et al. Výskyt Enterobacteriaceae produkující karbapenemázy (CPE) v České republice v období červen 2012 – duben 2014. Zprávy CEM (SZÚ, Praha), 2014;23(4):137–140.
4. Giske ChG, Martinez-Martinez L, Canton R, et al. Návody EUCAST pro detekci mechanismů rezistence a specifické rezistence s klinickým a/nebo epidemiologickým významem. Verze 2.0., 2017. Dostupné na www: http://www.szu.cz/uploads/documents/CeM/NRLs/atb/EUCAST/EUCAST_mechanizmy_rezistence_v2_2017.pdf.
5. Morrill HJ, Pogue JM, Kaye KS, et al. Treatment options for carbapenem – resistant Enterobacteriaceae infections. Open Forum Infect Dis, 2015;2(2):ofv050.
6. Doi Y, Paterson DL. Carbapenemase – producing Enterobacteriaceae. Semin Respir Crit Care Med, 2015;36(1):74–84.
7. van Duin D, Doi Y. The global epidemiology of carbapenemase-producing Enterobacteriaceae. Virulence, 2017;8(4):460–469.
8. Porreca AM, Sullivan KV, Gallagher JC. The epidemiology, evolu-
tion, and treatment of KPC-producing organisms. Curr Infect Dis Rep, 2018;20 : 13.
9. Andrade LN, Curiao T, Ferreira JC, et al. Dissemination of blaKPC-2 by the spread of Klebsiella pneumoniae clonal complex 258 clones (ST258, ST11, ST437) and plasmids (IncFII, IncN, IncL/M) among Enterobacteriaceae species in Brazil. Antimicrob Agents and Chemother, 2011;55(7):3579–3583.
10. Schwaber MJ, Klarfeld-Lidji S, Navon-Venezia S, et al. Predictors of carbapenem-resistant Klebsiella pneumoniae acquisition among hospitalized adults and effect of acquisition on mortality. Antimicrob agents and chemoter, 2008;52(3):1028–1033.
11. van Loon K, Voor AF, Vos MC. A systematic review and meta-analyses of the clinical epidemiology of carbapenem-resistant Enterobacteriaceae. Antimicrob Agents Chemother, 2018;62(1):e01730–17.
12. Jiao Y, Qin Y, Liu J, et al. Risk factors for carbapenem-resistant Klebsiella pneumoniae infection/colonization and predictors of mortality: a retrospective study. Pathog Glob Health, 2015;109(2):68–74.
13. Monteiro J, Widen RH, Pignatari ACC, et al. Rapid detection of carbapenemase genes by multiplex real-time PCR. J Antimicrob Chemother, 2012;67(4):906–909.
14. Richter SN, Frasson I, Bergo C, et al. Transfer of KPC-2 carbapenemase from Klebsiella pneumoniae to Escherichia coli in a patient: first case in Europe. J Clin Microbiol, 2011;49(5):2040–2042.
15. Kukla R, Chudějová K, Papagiannitsis CC, et al. Characterization of KPC-encoding plasmids from Enterobacteriaceae isolated in a Czech hospital. Antimicrob Agents Chemother, 2018;62(3):e02152–17.
16. Martins ER, Estofolete CF, Zequini AB, et al. Transfer of KPC-2 carbapenemase from Klebsiella pneumoniae to Enterobacter cloacae in a patient receiving meropenem therapy. Diagn Microbiol Infect Dis, 2017;88(3):287–289.
17. Ding B, Shen Z, Hu F, et al. In vivo acquisition of carbapenemase gene blaKPC-2 in multiple species of Enterobacteriaceae through horizontal transfer of insertion sequence or plasmid. Front Microbiol, 2016;7 : 1651.
18. Sidjabat HE, Silveira FP, Potoski BA, et al. Interspecies spread of Klebsiella pneumoniae carbapenemase gene in a single patient. Clin Infect Dis, 2009;49 : 1736–1738.
19. Žemličková H, Skálová A, Jakubů V, et al. Výskyt Enterobacteriaceae produkujících karbapenemázy (CPE, Carbapenemase Producing Enterobacteriaceae) v České republice v letech 2014–2015. Zprávy CEM (SZÚ, Praha), 2016;25(6-7):235–238.
20. Ministerstvo zdravotnictví. Metodický pokyn ke kontrole výskytu importovaných případů kolonizace a/nebo infekce enterobakteriemi produkujícími karbapenemázu. Věstník Ministerstva zdravotnictví ČR, 2012;8 : 10–19.
21. The European Committee on Antimicrobial Susceptibility Testing. Breakpoint tables for interpretation of MICs and zone diameters. Version 6.0, 2016. Dostupné na www: http://www.eucast.org.
Labels
Hygiene and epidemiology Medical virology Clinical microbiologyArticle was published in
Epidemiology, Microbiology, Immunology

2019 Issue 2
-
All articles in this issue
- Stanovení antimikrobiálních účinků slizu plže Achatina reticulata
- Surveillance antibiotické rezistence u Streptococcus pneumoniae v České republice, výsledky respirační studie za roky 2010–2017
- Tularémie – zoonóza s rizikem bioterorismu
- Aktinomykóza – zastřešující přehled a 3 případy těžké pánevní aktinomykózy léčené konzervativně
- In-vivo mezidruhový přenos KPC karbapenemázy u dlouhodobě léčené pacientky
- Diagnostika a léčba bartonelových endokarditid
- Infekce a kolonizace Clostridium difficile u dětí do 3 let věku: prospektivní srovnávací studie
- Snížení dávkování thymoglobulinu ze 7,5 mg/kg na 6 mg/kg v rámci přípravného transplantačního režimu prodloužilo dobu do první detekce lidského cytomegaloviru u pacientů po alogenní transplantaci krvetvorných buněk
- Epidemiology, Microbiology, Immunology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Aktinomykóza – zastřešující přehled a 3 případy těžké pánevní aktinomykózy léčené konzervativně
- In-vivo mezidruhový přenos KPC karbapenemázy u dlouhodobě léčené pacientky
- Tularémie – zoonóza s rizikem bioterorismu
- Infekce a kolonizace Clostridium difficile u dětí do 3 let věku: prospektivní srovnávací studie
