Tularémie – zoonóza s rizikem bioterorismu
Tularemia – zoonosis carrying a potential risk of bioterrorism
Tularemia, otherwise known as “rabbit fever”, is a zoonotic disease caused by a gram-negative intracellular bacterium – Francisella tularensis. The species is considered as a potential bioterrorism agent due to its high infectivity, the fact of being relatively easy to culture, the absence of human vaccine, and the potential for spreading through aerosol. In the Czech Republic, infection is usually caused by a tick bite, less frequently by a mosquito bite, direct contact with infected animals, or ingestion of contaminated water. The aim of this review is to provide a comprehensive view of tularemia, its diagnosis, clinical symptoms and treatment, along with the military perspective on a potential risk of F. tularensis to be misused as a biological weapon.
Keywords:
tularemia – bioterrorism
Authors:
M. Prokšová 1; J. Bavlovič 1; J. Klimentová 1; J. Pejchal 2; J. Stulík 1
Authors‘ workplace:
Katedra molekulární patologie a biologie, Fakulta vojenského zdravotnictví, Univerzita obrany, Hradec Králové
1; Katedra toxikologie a vojenské farmacie, Fakulta vojenského zdravotnictví, Univerzita obrany, Hradec Králové
2
Published in:
Epidemiol. Mikrobiol. Imunol. 68, 2019, č. 2, s. 82-89
Category:
Review Article
Overview
Tularémie, neboli zaječí nemoc, je zoonotické onemocnění vyvolané gramnegativní intracelulární bakterií Francisella tularensis. Vzhledem ke své infekčnosti, poměrně jednoduché kultivaci, absenci humánní vakcíny či možnosti šíření prostřednictvím aerosolu je považována za potenciální biologickou hrozbu. K nakažení jedince však v České republice obvykle dochází bodnutím infikovaného klíštěte, méně často komára anebo přímým kontaktem s kontaminovanou zvěří, popř. konzumací kontaminované vody. Cílem tohoto sdělení je komplexní pohled na tularémii počínaje diagnostikou, klinickými projevy a léčbou, obohacenou o vojenskou perspektivu v otázce zneužití Francisella tularensis jako biologické zbraně.
Klíčová slova:
tularémie – bioterorismus
ÚVOD
Tularémie, označovaná též jako zaječí nemoc, je zoonotické onemocnění vyvolané gramnegativní intracelulární bakterií Francisella tularensis (F. tularensis). Nebezpečí této bakterie spočívá ve snadném přenosu mezi infikovaným zvířetem a člověkem a v její vysoké virulenci. Inhalace pouhých 10 bakterií té nejvirulentnější formy vede k život ohrožujícímu stavu – tularemické pneumonii [1, 2].
Vzhledem k vysokému infekčnímu potenciálu získala tato bakterie pozornost i vojenského biologického výzkumu jakožto potenciální biologická zbraň. Jako první testovali F. tularensis za tímto účelem Japonci již ve třicátých letech 20. století [3, 4]. Pozadu nezůstal ani Sovětský svaz, který vyvinul vakcínu a kmeny Francisella rezistentní na antibiotika. K výzkumu biologických agens se záhy přidaly i USA. V roce 1942 souhlasily s používáním biologických zbraní pouze v rámci odvetných opatření, ačkoliv dále pokračovaly na jejich usilovném vývoji s vysokým ofenzivním potenciálem. V roce 1955 byla v USA produkována vylepšená verze biologické zbraně s F. tularensis. Její zdokonalení spočívalo v technologické úpravě dané použitím vysušené suspenzní formy. Díky tomu se podařilo prodloužit dobu použitelnosti zbraně, zvýšit stabilitu a zjednodušit rozptyl bakterie [5]. V následujících dekádách došlo k relativnímu útlumu ofenzivního vojenského výzkumu. Po teroristických útocích 11. září 2001 a rozesílání tzv. antraxových dopisů se však nebezpečí ohledně zneužití biologických zbraní stalo znovu aktuálním. F. tularensis vzhledem ke své infekčnosti, poměrně jednoduché kultivaci, absenci humánní vakcíny či možnosti šíření prostřednictvím aerosolu je jedním z nejnebezpečnějších patogenů pro člověka [2, 6]. Z těchto důvodů Centrum pro prevenci a kontrolu nemocí (CDC) v Americe zařadilo F. tularensis mezi potenciální biologické hrozby v rámci nejrizikovější kategorie A, kde se spolu s ní nachází původce moru, antraxu nebo eboly. Do kategorie A obecně spadají ta nejnebezpečnější biologická agens s nejvyšším rizikem zneužití:
- a) která se jednoduše šíří a přenáší z člověka na člověka,
- b) jejichž důsledkem je vysoká mortalita s významným vlivem na zdraví populace,
- c) která mohou zapříčinit šíření paniky u civilního obyvatelstva a narušit sociální život společnosti nebo
- d) která vyžadují speciální opatření na ochranu zdraví společnosti.
Rovněž Světová zdravotnická organizace (WHO) a Evropské centrum pro prevenci a kontrolu nemocí (ECDC) ve Stockholmu označily F. tularensis za patogena s nejvyšší prioritou stran potenciálního zneužití. Zpráva WHO ze 70. let 20. století obsahovala například informaci, že pokud by aerosol této bakterie byl rozprášen nad městem čítajícím kolem pěti milionů lidí, následný efekt by způsobil 250 tisíc vážně nemocných a okolo 20 tisíc mrtvých [7, 8]. Novější studie vykalkulovaly i ekonomické dopady takovéhoto útoku [9]. Jednalo se o studii zahrnující více než 80 tisíc hypotetických subjektů a nejvirulentnější poddruh bakterie F. tularensis. Výsledek naznačil úmrtnost 7,5 % z celkového počtu obyvatel a cenu následné lékařské péče společně se ztrátou produktivity obyvatelstva v hodnotě 4–6 miliard dolarů.
BIOLOGICKÁ KLASIFIKACE
V rámci rodu Francisella rozlišujeme tři druhy – F. tularensis, F. philomiragia a F. hispaniensis [10]. Druh F. tularensis se dále dělí do pěti poddruhů. Pro člověka i zvířata je vysoce virulentní F. tularensis poddruh tularensis, označovaný jako typ A, který se vyskytuje zejména na území Severní Ameriky a k propuknutí onemocnění stačí vdechnutí 10 bakterií. Potenciálně nebezpečná je pro člověka i F. tularensis poddruh holarctica, neboli typ B. Ta je primárním původcem tularémie v Evropě, Asii a Severní Americe. Mezi méně infekční patří F. tularensis poddruh novicida, která představuje riziko jen pro oslabené jedince, což potvrzuje i množství bakterií potřebné k propuknutí onemocnění (tab. 1). F. tularensis poddruh mediasiatica se vyskytuje především v Kazachstánu, Turkmenistánu a v některých částech bývalého Sovětského svazu, avšak nakažení člověka touto bakterií není doposud uváděno. Posledním zástupcem patřícím do tohoto druhu je obdoba F. holarctica vyskytující se v Japonsku [10–13].
Table 1. Comparison of infectivity between clinically significant
subspecies of F. tularensis
![Porovnání infekčnosti klinicky významných poddruhů
F. tularensis [17]<br>
Table 1. Comparison of infectivity between clinically significant
subspecies of F. tularensis](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image_pdf/2f6dbb210814d96df6cc10e3a73fa8b0.png)
LD50 – the dose of bacteria that causes 50% of infected individuals to die
EPIDEMIOLOGIE
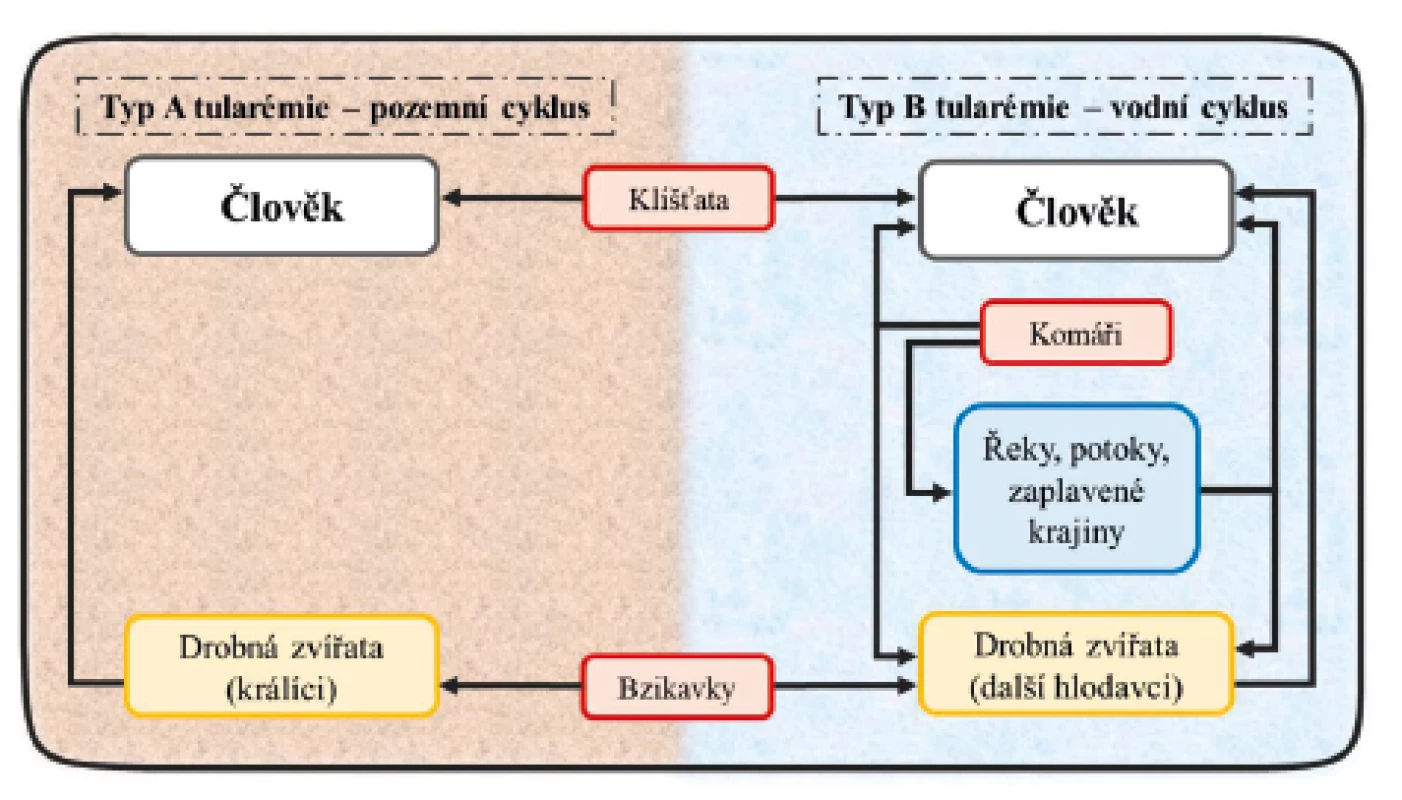
F. tularensis není v přírodě ojedinělou bakterií. Byla identifikována u téměř 250 volně žijících živočichů [14]. K nakažení jedince může dojít několika způsoby, a to prostřednictvím vektorů (členovci), vzduchem, potravou či vodou a také kontaktem s infikovaným zvířetem [15]. V rámci svého pozemního cyklu se hostitelem – amplifikátorem F. tularensis – stává zajíc, v němž se bakterie množí a odkud se prostřednictvím vektoru (klíště, blecha) anebo přímou cestou infikuje člověk. U vodního cyklu je samotným rezervoárem bakterie voda nebo hlodavci a vektory přenosu jsou pak zejména komáři a bzikavky (obr. 1.) [14, 16–18]. Cesta přenosu nákazy a typ infekce tedy často koreluje s geografickou polohou. V severských zemích a USA je většina případů způsobena kousnutím infikovaným komárem [19]. Incidence je proto nejvyšší v letních měsících. V Evropě a USA jsou pro oba klinicky významné poddruhy (poddruh tularensis i holarctica) přenašečem rovněž klíště obecné a piják lužní. Alimentární infekce jsou způsobené zejména poddruhem holarctica. Jejím rezervoárem je v těchto případech voda, ve které dokáže bakterie přežít i 3 měsíce při teplotě 7 °C. Při této teplotě dokáže také přežít ve slepičím trusu, a to až 6 měsíců [15]. Kontaminované zmražené maso pak zůstává infekční i déle než 3 roky [20]. Je proto možné se nakazit konzumací nedostatečně tepelně upraveného masa. Jedinec se infekcí typu A nebo B může nakazit i inhalací infekčního aerosolu. Tímto způsobem jsou ohroženi hlavně lovci a myslivci, kteří zpracovávají ulovenou zvěř [21], ale i odborný laboratorní personál pracující s touto bakterií [13, 19, 22, 23]. V minulosti byly hlášeny i případy onemocnění, kde byli aerosolu bakterií vystavěni pracovníci v kožešnictví nebo cukrovarech [24, 25]. Doposud však nebyl popsán případ přenosu z člověka na člověka [26].
Převzato a upraveno podle: Hong K-J, Park P-G, Seo S-H, Rhie G
a Hwang K-J. Current status of vaccine development for tularemia
preparedness. Clinical and Experimental Vaccine Research.
2013;2(1):34–39.
Figure 1. Transmission of F. tularensis to humans and its water
and terrestrial cycle in nature
Taken and modified from: Hong K-J, Park P-G, Seo S-H, Rhie G
a Hwang K-J. Current status of vaccine development for tularemia
preparedness. Clinical and Experimental Vaccine Research.
2013;2(1):34–39.
Onemocnění způsobená bakterií F. tularensis vykazuje na území České republiky stabilní incidenci. Ročně bývá evidováno okolo 50 případů, s výjimkou roku 2008, kdy počet nakažených narostl na 113. Za poslední 4 roky (2015–2018) se podle statistik Státního zdravotního ústavu (SZÚ) nakazilo tularémií 201 lidí (graf 1) [27]. Největší prevalence tohoto onemocnění byla zaznamenána v kraji Jihočeském (počet případů 44), Plzeňském (27 případů) a Středočeském (25 případů). Jednalo se hlavně o muže (131) starší 18 let. Objevily se i případy (17), kdy tularémie byla diagnostikována u pediatrické populace. Nejmladším pacientem byl tříletý chlapec. Nejméně onemocnění bylo nahlášeno ze Zlínského (4) a Moravskoslezského kraje (2) [28].
*Data jsou platná k 10. 12. 2018. Zdroj: SZÚ – systémy Epidat
a ISIN
Graph 1. Sex-specific incidence of tularemia in the Czech
Republic between 2015 and 2018
*Data valid to 10 December 2018. Source: NIPH – systems Epidat
and ISIN

Na území České republiky monitoruje výskyt tularémie i Státní veterinární správa (SVS), a to zejména u zajíců. Děje se tak na základě pasivního monitorování, v jehož rámci jsou vyšetřováni uhynulí a ulovení zajíci, u nichž bylo podezření na tuto nákazu a také pomocí plošného aktivního monitorování, při kterém jsou vyšetřováni 3 ulovení zajíci na 100 km2 v rámci území celé ČR. V roce 2015 bylo zjištěno 54 případů tularémie u zajíců, v roce 2016 to bylo 51 případů a za rok 2017 jen 31. Data za rok 2018 doposud nejsou k dispozici. Pokud bychom hodnotili místo výskytu, nejčastěji se zoonóza vyskytuje v Jihomoravském kraji a na Vysočině [29]. Zajíci podezřelí z nákazy infekční tularémií jsou charakterizováni některým z následujících znaků – ztráta plachosti, malátnost, zhoršená koordinace pohybů a v terminálních stadiích zježená srst. U ostatních zvířat jsou příznaky spíše atypické. V případě podezření na infekci jsou odchycená zvířata odeslána do laboratoří spádové pobočky Státního veterinárního ústavu a vyšetřena pitvou a kultivací. Nákaza u zajíců je sledována sérologicky, popřípadě i histologicky [18, 20].
PATOGENEZE
Jedinečnost virulence F. tularensis spočívá v jejím vstupu a následné proliferaci v hostitelských buňkách. Tento nitrobuněčný patogen infikuje především fagocytující buňky hostitele, tzn. makrofágy, neutrofily nebo dendritické buňky, ale také hepatocyty a epiteliální buňky [30]. Známé jsou receptory podílející se na procesu fagocytózy. V případě komplementem opsonizovaných bakterií se jedná o manózový receptor, při opsonizaci sérem je naopak rozpoznávání bakterie zprostředkováno CR3 receptorem. Fcγ receptor pak umožňuje vstup bakterií opsonizovaných protilátkami [2]. Po pohlcení mikroba F. tularensis se vytváří fagozom, který postupně vyzrává, což lze monitorovat detekcí povrchových znaků pro časný (EEA1), respektive pozdní (LAMP1, LAMP2) endozom. Konečné fázi vedoucí k fúzi pozdního endozomu s lysozomem však dokáže F. tularensis zabránit. V časovém rozmezí od 1 do 4 hodin po infekci dochází totiž k porušení fagozomální membrány a úniku bakterie do cytosolu [31]. Nitrobuněčná proliferace, únik z fagozomu a virulence F. tularensis je závislá na proteinech lokalizovaných v tzv. Francisella pathogenicity island (FPI). Tento úsek DNA je tvořen souborem 16–17 genů v závislosti na daném kmenu, přičemž u vysoce virulentních kmenů se nachází ve dvou kopiích [32, 33]. Předpokládá se, že některé z těchto genů kódují složky sekreční systém typu VI (T6SS), pomocí kterého jsou do hostitelské buňky transportovány bakteriální efektorové proteiny. Tímto způsobem dochází k ovlivnění celé řady buněčných obranných mechanismů a s předstihem se vytváří prostředí příznivé pro nitrobuněčné přežívání a následnou replikaci bakterií [2].
KLINICKÁ MANIFESTACE
Klinické příznaky onemocnění tularémie se odvíjí od místa vstupu infekce. Podle jednotlivých bran vstupu do organismu rozlišujeme:
- a) ulceroglandulární,
- b) okuloglandulární,
- c) plicní,
- d) gastrointestinální infekci [34, 35].
Po vstupu do organismu se bakterie replikují v lymfatických tkáních, přičemž inkubační doba bývá zpravidla 2–5 dní, maximálně však 2 týdny. Klinická závažnost vzniklého onemocnění je závislá na virulenci daného poddruhu, u typu B je průběh méně závažný s velmi nízkou úmrtností [36, 37]. Naopak mortalita u neléčené nemoci vyvolané typem A dosahuje až 60 % [2, 38, 39]. Po nakažení se tularémie zpravidla manifestuje nespecifickými chřipkovými symptomy, jako jsou vysoké horečky doprovázené slabostí, nevolností a ztrátou chuti k jídlu vedoucím k úbytku hmotnosti. Tyto příznaky jsou charakteristické pro oba typy tularémie A i B a jsou snadno zaměnitelné s jiným infekčním onemocněním. Tato nemoc je proto ve svém počátečním stadiu snadno přehlédnutá. Další průběh je již určen bránou vstupu.
Nejčastější bránou vstupu je kůže vedoucí k ulceroglandulární formě tularémie. Ta se manifestuje vznikem vředu/pustuly, lymfadenopatií a dalšími nespecifickými, chřipce podobnými symptomy v časovém rozhraní 3–21 dní. Při přímém kontaktu s infikovaným zvířetem nebo kontaktem s infikovanými tkáněmi či tekutinami postiženého zvířete přechází infekční činitel do hostitele zpravidla skrz drobné ranky. Zvláště u této formy infekce je snadná a častá záměna za jiné onemocnění. K popisované situaci došlo například u pacienta, u kterého se kožní forma tularémie projevila začervenáním, otokem a bolestivostí pravé dolní končetiny poté, co byl infikován klíštětem. Diagnostikována byla akutní kožní infekce s infekcí měkkých tkání a pacient byl léčen penicilinem. Navzdory terapii se ale u pacienta rozvinula inguinální lymfadenopatie. Histopatologické vyšetření inguinálních lymfatických uzlin prokázalo nekrotizující a granulomatózní zánět. Po konzultaci s infektologem a následnými vyšetřeními byla u pacienta potvrzená infekce F. tularensis poddruh holarctica. Pacient se plně zotavil po 14denní léčbě perorálně podávaným ciprofloxacinem [40].
Okuloglandulární forma infekce je obvykle charakterizována unilaterálním vředem spojivky, konjunktivitidou, otokem očních víček, nadměrným slzením, světloplachostí a zvětšenými cervikálními a supraaurikulárními lymfatickými uzlinami. Tato forma byla, podle literatury, první popsanou formou tularemické infekce, a to 24. listopadu 1913. Pacientem byl zaměstnanec restaurace, jehož prací bylo krájení masa. Infekce se mu zpočátku projevovala zánětem levého oka. Následně došlo ke zvětšení lymfatických žláz v přední části krku, zvýšení teploty, objevilo se nechutenství a ztráta hmotnosti. Zánět se rozšířil do levého slzného vaku a došlo k vytvoření abscesu. Provedená mikroskopická a kultivační vyšetření neodhalila bakteriální příčinu. Následovala aplikace infekčního materiálu pokusnému zvířeti, které po 6 dnech zemřelo. U kadaveru byla zjištěna akutní pneumonie, zvětšení jater a sleziny. Stále se ale nedařilo zjistit prostřednictvím barvících metod původce infekce. Pacient byl nakonec propuštěn z nemocnice. Přestože trpěl příznaky onemocnění, další vzorky pro potvrzení agens se od něj již nepodařilo získat [41].
Plicní infekce je nejzávažnější formou nemoci, při které se k chřipkovým příznakům přidává suchý kašel, bolest hrdla a v hrudní oblasti a dušnost. Tyto příznaky se zpravidla objevují po 3–5denní latenci u poddruhu holarctica anebo již během 24 hodin u infekce poddruhem tularensis. Ve velmi závažných případech může plicní forma tularémie vést k rabdomyolýze a septickému šoku [42]. Nejrozsáhlejší případ infekce plicní formou tularémie v novodobé historii byl zaznamenán v americkém státu Massachusetts v roce 2000. Nakaženo bylo 11 jedinců, přičemž v jednom případě byla tato infekce smrtelná. Postižení do kontaktu s bakterií přišli při sekání trávy a zahradních úpravách. U pacienta, který nemoci podlehl, se tularémie projevovala bolestmi na hrudníku, produktivním kašlem (uvolňujícím hnědé sputum), přidala se dechová nedostatečnost a bolest zad. Lékařská péče byla vyhledána až po 7 dnech od objevení prvních příznaků. Léčba byla zahájená ceftriaxonem pro podezření na infekci bakterií rodu Haemophilus. Až nařízená pitva potvrdila infekční agens F. tularensis poddruh tularensis [43, 44]. Smrtelný případ byl hlášen i z Arizony v roce 2016, kdy 73letá žena podlehla plicní formě tularémie. Stalo se tak pár dní po tom, co její pes přišel do kontaktu s uhynulým infekčním králíkem [45].
Pokud je bránou vstupu F. tularensis gastrointestinální trakt, pak hovoříme o orofaryngeální nebo gastrointestinální infekci. Mezi její další příznaky patří bolest hrdla, drobná ložiska infekce v ústní dutině, silné abdominální bolesti, mezenteriální lymfadenopatie, zvracení a průjem. Případy orofaryngeální infekce jsou nejčastěji hlášeny z Turecka, kde zdrojem nákazy bývá kontaminovaná voda [19, 46]. Právě způsobem přenosu a vyšším počtem nakažených žen než mužů se Turecko liší od ostatních zemí [18, 46–48]. U pacientů se projevila infekce nejčastěji teplotou, bolestí hrdla, celkovou únavou a lymfadenopatií, která se objevila navzdory antibiotické terapii. Pacienti byli primárně léčeni na tonzilofaryngitidu, až později byla jako příčina onemocnění diagnostikována F. tularensis. V monoterapii nebo v kombinaci byl následně podáván streptomycin, doxycyklin nebo ciprofloxacin až do úplné remise onemocnění [46].
V České republice se za období mezi lety 2015–2018 převážně vyskytovala ulceroglandulární (97 případů) a glandulární (57 případů) forma infekce. U 30 pacientů bola diagnostikovaná i plicní tularémie, ani jeden případ však neskončil smrtí pacienta. Incidence orofaryngeální infekce je nízká, 12 případů. Okuloglandulární forma je poměrně vzácná, protože byla diagnostikována jen u 1 pacienta.
TERAPIE
Léčba v závažných případech vyžaduje hospitalizaci pacienta, na kterou navazuje nákladná a dlouhodobá rekonvalescence. Lékem první volby u závažných infekcí je aminoglykosidové antibiotikum gentamicin. Podává se v dávce 5 mg/kg rozdělené do dvou denních dávek. Minimální inhibiční koncentrace gentamicinu (MIC90 – koncentrace, při které dojde k inhibici růstu 90 % bakterií) je 0,125 mg/l [50]. Po dobu léčby je nutné monitorovat sérové koncentrace antibiotika. Do stejné skupiny antibiotik patří i streptomycin. Ten je v případě tularémie podáván intramuskulárně v dávce 2 g denně. Léčba obvykle trvá déle než 10 dní. Vážnou překážkou při podávání výše zmíněných aminoglykosidů je jejich vysoká toxicita (ototoxicita, nefrotoxicita).
K léčbě méně závažných forem infekce je určeno intravenózní nebo perorální podání fluorochinolonů (ciprofloxacinu, levofloxacinu) nebo tetracyklinových antibiotik (doxycyklinu) [50–52]. In vitro studie u F. tularensis poddruh holarctica prokázaly, že MIC90 pro ciprofloxacin je 0,03 mg/l [50]. Pacientům je ciprofloxacin podáván v dávce 800–1000 mg/den. Ciprofloxacin se zároveň jeví jako nejefektivnější a nejvhodnější lék k terapii tularémie u dětí a těhotných žen [39, 53]. MIC90 pro doxycyklin je 0,25 mg/l. Dávkovací schéma pro podání doxycyklinu pacientům je 100 mg dvakrát denně po dobu minimálně 15 dní [52]. F. tularensis je zcela rezistentní na antibiotika ze skupiny cefalosporinů a betalaktamů [50, 54, 55]. Neúspěšnost léčby a relaps onemocnění je pozorován u 5–30 % pacientů. Nejčastějším důvodem selhání terapie jsou situace, kdy se jednalo o imunokompromitovaného jedince, anebo došlo k pozdnímu podání vhodných antibiotik (pozdní nebo chybná diagnostika) [53, 56].
Důležitost načasování dobře dokumentuje dnes již eticky sporná studie Sawyera et al. z roku 1966 [57]. Tato studie byla provedena na lidských dobrovolnících infikovaných bakterií typu A. Její výsledky ukázaly, že při včasném zahájení léčby (do 24 h) dochází k úplné eradikaci onemocnění. Na druhou stranu předčasné ukončení terapie vedlo k opětovnému rozvinutí nemoci, a to až do stavu akutní plicní formy. V úspěšnosti léčby nejzávažnější formy tularémie proto hraje významnou roli i délka terapie. Antibiotikem volby v této studii byl tetracyklin. Jeho podávání bylo zahájeno 24 h po expozici. Aplikován byl dále v různých intervalech. Jako nejefektivnější se jevilo dávkovací schéma 1 g jedenkrát denně po dobu 28 dní nebo 1 g dvakrát denně po dobu 14 dní. Pacienti, které i na úkor úspěšné léčby postihl relaps onemocnění, byli úspěšně zaléčeni streptomycinem [57].
DIAGNOSTIKA
Pro úspěšnou léčbu jedince a účinnou ochranu obyvatelstva v případě biologické hrozby je nutné včasné a přesné rozpoznání infekčního agens. To však může mít svá úskalí. Symptomy na začátku onemocnění mohou být stejné jako u jiných infekčních chorob. Při diagnostice je proto potřeba komplexní zhodnocení anamnézy pacienta a klinické vyšetření spolu s posouzením laboratorních, hematologických a biochemických výsledků. S každým nezapočatým dnem terapie se zvyšuje riziko komplikací a mortality [58]. Pro laboratorní vyšetření je nezbytný odběr vhodného vzorku od infikovaného pacienta. Zpravidla se jedná o sérum, které je nejvíce preferováno, dále pak plná krev, plazma, biopsie a jiné. Vzorek by měl být odebrán co nejdříve během infekce s následným kontrolním odběrem po 3–4 týdnech od objevení příznaků [59]. Pro identifikaci F. tularensis neexistuje univerzální metoda, která by umožnila detekci bakterie již v minimálním množství v jakékoli biologické matrici. Za účelem zajištění co největší míry spolehlivosti samotné identifikace se proto používají kombinace různých metod, jako jsou kultivace, metody molekulárně biologické a sérologická vyšetření [47].
Kultivace F. tularensis za laboratorních podmínek vyžaduje striktně aerobní podmínky. Jednotlivé poddruhy se od sebe liší rychlostí, jakou se bakterie množí. Například F. tularensis poddruh holarctica roste značně pomaleji než podtyp novicida. Ke kultivaci se mohou použít jak tuhé půdy, tak tekutá média. Mezi pevnými půdami se nejčastěji používá srdeční agar doplněný o 1% hemoglobin a obohacený o cystein, jehož přítomnost je pro většinu poddruhů esenciální [60]. Dále se používá Mueller-Hinton agar s aditivy (2% Isovitalex a 0,025% síran železnatý) [61], McLeod agar a čokoládový agar [62, 63]. Z tekutých médií bývá zpravidla používán Brain Heart Infusion nebo chemicky definované Chamberlainovo médium. Optimální teplotou pro kultivaci je 37 °C. U tekutých médií je navíc doporučován rotační inkubátor s 200 rpm [61–64]. Nevýhodou této metody detekce je jednak velká časová prodleva pro získání výsledků (zpravidla v rozmezí několika desítek hodin), ale také vysoké riziko nákazy zdravotnického personálu [64]. Aby se zaručila ochrana pracovníků a okolí, pracuje se při podezření na infekci
F. tularensis v laboratořích splňujících podmínky biologické ochrany stupně 2 nebo 3 (BSL2, BSL3).
Z metod molekulárně biologických je možné použít v klinické praxi u lidských pacientů i u infikované zvěře polymerázovou řetězovou reakci (PCR) nebo její vysoce citlivou variantu real-time PCR. Vzorky vhodné k PCR představují např. vředové exsudáty, aspiráty lymfatických uzlin, tkáňové biopsie, stěry z ran [65–68].
Při sérologickém vyšetření se používá zejména ELISA a aglutinační test, které jsou založeny na stanovení titru specifických protilátek proti F. tularensis [69]. Aglutinační test se provádí v akutní fázi onemocnění a pak za 2–4 týdny od prvního odběru. Sleduje se dynamika tvorby protilátek proti F. tularensis. Pokud dojde k signifikantnímu zvýšení titru protilátek, pravděpodobně se jednalo o akutně probíhající infekci. Test je považován za pozitivní, když je titr protilátek čtyř - a vícenásobně zvýšený (1 : 160). Pomocí metody ELISA se stanovují protilátky typu IgM a IgG, které se objevují v séru již na začátku infekce. Jejich hladiny však mohou zůstat zvýšené i několik let po infekci [70, 71]. Jediná nevýhoda imunologických metod je, že nedokážou identifikovat konkrétní poddruh bakterie, který nemoc vyvolal. Toto vyšetření je nejčastějším diagnostickým vyšetřením v České republice.
Další možností specifické a poměrně rychlé detekce F. tularensis v klinické mikrobiologii je použití hmotnostní spektrometrie s laserovou desorpcí a ionizací za účasti matrice – MALDI-TOF (Matrix-Assisted Laser Desorption/Ionization Time of Flight). Nevýhodou tohoto přístupu jsou ale vysoké náklady na přístrojové vybavení [72, 73].
Za zmínku rovněž stojí systém s názvem Biological Aerosol Warning System (BAWS). BAWS používají jednotky NATO a slouží k detekci biologických agens v případě hrozby jejich zneužití. Tento systém se skládá z řady senzorů vybavených síťovým propojením a schopností sběru vzorku vzduchu pro následnou identifikaci a potvrzení agens prostřednictvím emitované fluorescence. Snímače objemové hmotnosti vzduchu určují rychlost a směr větru a tedy biologický spad. Přístroj nakonec vyhodnotí veškeré údaje z detektorů a porovná je mezi sebou. Teprve podobné hodnoty u více senzorů můžou spustit poplach, nestačí tedy záznam u jediného z nich. Toto zařízení je navíc mobilní a tudíž použitelné v polních podmínkách pro varování jak vojenského personálu, tak i civilního obyvatelstva. Jeho hlavní nevýhodou je potřeba většího množství kontaminovaného prachu ve vzdušném aerosolu, aby bylo možno provést detekci infekčních agens u kriminálních a izolovaných teroristických útoků [64]. BAWS se vyrábí v USA (Lockheed Martin, Suffolk, VA, USA) a jeho alternativou je kanadský Fluorescence Aerodynamic Particle Sizer (FLAPS). FLAPS pracuje na podobném principu, kdy současně měří pro každou vzdušnou částici intenzitu rozptýleného světla a fluorescenční emise ve dvou odlišných pásmech vlnových délek pomocí dvou vysoce citlivých fotonásobičových trubic [74].
PREVENCE
Nejúčinnější prevencí proti život ohrožujícím infekcím je očkování. Navzdory velké snaze vědců, kteří na zvířecích modelech zkouší homologní vakcíny odvozené od mutantů poddruhu holarctica nebo heterologní vakcíny založené na imunoprotektivních antigenech, neexistuje v současné době žádná očkovací látka schválená k použití [75–77]. Empiricky oslabený, živý vakcinační kmen (Live Vaccine Strain-LVS), odvozený od F. tularensis poddruh holarctica byl sice vyvinut před více než 50 lety v Sovětském svazu, nicméně přesný mechanismus jeho oslabení nebyl doposud dobře definován [78]. Rovněž není znám přesný mechanismus navození imunitní odpovědi a také nebyla potvrzena bezpečnost této vakcíny u imunokompromitovaných pacientů. V porovnání s klinickými izoláty byly u kmene LVS odhaleny genetické defekty v podobě bodových mutací nebo velkých delecí. V neposlední řadě vakcinační kmen LVS nechrání pacienty před vysoce virulentním typem A [79].
Prevence proti F. tularensis poddruh tularensis je obtížná, jelikož se šíří i ve formě aerosolu. Opatření proti onemocnění vyvolanému poddruhem holarctica jsou zejména veterinární a hygienická. Veterinární opatření vstupují v platnost při nálezu podezřelého/infekčního zvířete a spočívají ve vymezení pásma, odkud je zakázáno nakaženou zvěř dále distribuovat do tržní sítě. Pokud po období dvou let není nalezen žádný další případ infekce, je toto území považováno za prosté nákazy [20]. Obecná hygienická opatření se charakterizují následovně – vyhnout se manipulaci se zvířaty (zejména s divokými), která nejsou přirozeně plachá. Při práci se senem a stelivem používat ochranné pomůcky. S divokou zvěří manipulovat v rukavicích a zároveň se vyhnout konzumaci jídla, pití a kouření. Po ukončení práce provést dezinfekci rukou a všech předmětů, které přišly do kontaktu s potenciálně rizikovou zvěří. Syrové maso vždy dostatečně tepelně upravit. Při pobytu v přírodě by se neměla konzumovat voda z neověřených vodních zdrojů [20].
ZÁVĚR
F. tularensis nepatří v našich podmínkách k nejčastějším původcům epidemií, nicméně vzhledem ke své vysoké virulenci, závažnosti onemocnění a v neposlední řadě také k možnosti zneužití v bioterorismu je hodná zvýšené pozornosti. Pro člověka je nejnebezpečnější typ A F. tularensis poddruh tularensis, který je vysoce infekční, šíří se vzduchem a může vyvolat plicní formu infekce. Na rozdíl od USA, v České republice nebyl doposud zaznamenán žádný takový případ. V mnohých případech však bývá problematické samotné stanovení diagnózy infekce touto bakterií, protože symptomy onemocnění mohou být poměrně nespecifické. Pokud je však diagnóza stanovena správně a včas, je úspěšnost antibiotické léčby vysoká. V oblasti prevence je stále nedořešena otázka účinné a bezpečné vakcíny. Konstrukce této vakcíny vyžaduje podrobnou znalost molekulárních mechanismů patogeneze tularemického onemocnění. Současný rozvoj nového vědeckého oboru tzv. systémové biologie, který zkoumá biologické soustavy v celé jejich komplexnosti, je příslibem pro dohledné vyřešení tohoto zásadního problému.
Do redakce došlo dne 13. 7. 2018.
Adresa pro korespondenci:
por. PharmDr. Jan Bavlovič
Katedra molekulární patologie a biologie
Fakulta vojenského zdravotnictví
Univerzita obrany
Třebešská 1575
500 01 Hradec Králové
e-mail: jan.bavlovic@unob.cz
Sources
1. Sjöstedt A. Intracellular survival mechanisms of Francisella tularensis, a stealth pathogen. Microbes and Infection, 2006;8(2):561–567.
2. Steiner DJ, Furuya Y, Metzger DW. Host–pathogen interactions and immune evasion strategies in Francisella tularensis pathogenicity. Infection and Drug Resistance, 2014;7 : 239–251.
3. Harris S. Japanese Biological Warfare Research on Humans: A Case Study of Microbiology and Ethics. Annals of the New York Academy of Sciences. Nedatováno;666(1):21–52.
4. Welcome to CDC stacks. Tularemia as a biological weapon : medical and public health management – 7168. Guidelines and Recommendations. Dostupné na www: https://stacks.cdc.gov/view/cdc/7168.
5. Kingry LC, Petersen JM. Francisella tularensis. In: Manual of Security Sensitive Microbes and Toxins. B.m.: CRC Press, 2014 : 359–363.
Dostupné na www: https://books.google.cz/books?id=J37NBQAAQBAJ&pg=PA359&lpg=PA359&dq=francisella+tularensis+misusing&source=bl&ots=
OVNbj89a4Y&sig=64LO57lqfjm6fkn3DusyXEETRVQ&hl=cs&sa=
X&ved=0ahUKEwiF3t7xrZHZAhXDWSwKHZl1AxsQ6AEIbDAJ#v=onepage&q=francisella%20tularensis%20misusing&f=false.
6. Cowley SC, Elkins KL. Immunity to Francisella. Frontiers in Microbiology, 2011;2.
7. WHO. Health aspects of chemical and biological weapons, 1st edition, 1970. WHO. Dostupné na www: http://www.who.int/csr/delibepidemics/biochem1stenglish/en/.
8. McLendon MK, Apicella MA, Allen L.-AH. Francisella tularensis: Taxonomy, Genetics, and Immunopathogenesis of a Potential Agent of Biowarfare. Annual review of microbiology. 2006;60 : 167–185.
9. Kaufmann AF, Meltzer MI, Schmid GP. The economic impact of a bioterrorist attack: are prevention and postattack intervention programs justifiable? Emerging Infectious Diseases, 1997;3(2):83–94.
10. Sunagar R, Kumar S, Franz BJ, Gosselin EJ. Tularemia vaccine development: paralysis or progress? Vaccine : development and therapy, 2016;6 : 9–23.
11. Griffin KF, Oyston PCF, Titball RW. Francisella tularensis vaccines. Pathogens and Disease, 2007;49(3):315–323.
12. Sjöstedt A. Tularemia: history, epidemiology, pathogen physiology, and clinical manifestations. Annals of the New York Academy of Sciences. 2007;1105 : 1–29.
13. Kingry LC, Petersen JM. Comparative review of Francisella tularensis and Francisella novicida. Frontiers in Cellular and Infection Microbiology. 2014;4 : 35.
14. Dinc G, Demiraslan H, Doganay M. Unexpected Risks for Campers and Hikers: Tick-Borne Infections. International Journal of Travel Medicine and Global Health, 2017;5(1):5–13.
15. Feldman KA. Tularemia. Journal of the American Veterinary Medical Association. 2003;222(6):725–730.
16. A General Overview of Francisella tularensis and the Epidemiology of Tularemia in Turkey. Dostupné na www: http://www.floradergisi.org/getFileContent.aspx?op=html&ref_id=153&file_name=2010-15-2-037-058.htm&_pk=f8d7f335-fc34-4850-9c6d-d48341f36eef.
17. Hong K-J, Park P-G, Seo S-H, Rhie G, Hwang K-J. Current status of vaccine development for tularemia preparedness. Clinical and Experimental Vaccine Research, 2013;2(1):34–39.
18. Maurin M, Gyuranecz M. Tularaemia: clinical aspects in Europe. The Lancet Infectious Diseases, 2016;16(1):113–124.
19. Gurcan S. Epidemiology of Tularemia. Balkan Medical Journal, 2014;33(1):3–10.
20. MUDr. Fabiánová Kateřina, MUDr. Jitka Částková, CSc. Opatření při výskytu tularémie v ČR. 2011. Dostupné na www: http://www.szu.cz/tema/prevence/opatreni-pri-vyskytu-tularemie-v-cr-1?highlightWords=francisella.
21. Jenzora A, Jansen A, Ranisch H, Lierz M, Wichmann O, Grunow R. Seroprevalence study of Francisella tularensis among hunters in Germany. FEMS immunology and medical mikrobiology, 2008;53(2):183–189.
22. Sewell DL. Laboratory-associated infections and biosafety. Clinical Microbiology Reviews, 1995;8(3):389–405.
23. Pike RM. Laboratory-associated infections: incidence, fatalities, causes, and prevention. Annual Review of Microbiology, 1979;33 : 41–66.
24. Hightower J, Kracalik IT, Vydayko N, Goodin D, Glass G, Blackburn JK. Historical distribution and host-vector diversity of Francisella tularensis, the causative agent of tularemia, in Ukraine. Parasites & Vectors. 2014;7.
25. Hauri AM, Hofstetter I, Seibold E, Kaysser P, Eckert J, Neubauer H, Splettstoesser WD. Investigating an Airborne Tularemia Outbreak, Germany. Emerging Infectious Diseases. 2010;16(2):238–243.
26. Dennis DT, Inglesby TV, Henderson DA, Bartlett JG, Ascher MS, Eitzen E, Fine AD, Friedlander AM, Hauer J, Layton M, Lillibridge SR, McDade JE, Osterholm MT, O’Toole T, Parker G, Perl TM, Russell PK, Tonat K, Working Group on Civilian Biodefense. Tularemia as a biological weapon: medical and public health management. JAMA, 2001;285(21):2763–2773.
27. Vybrané infekční nemoci v ČR v letech 2008–2017 – absolutně, SZÚ. Dostupné na www: http://www.szu.cz/publikace/data/vybrane-infekcni-nemoci-v-cr-v-letech-2008-2017-absolutne.
28. Zdroj epidemiologických dat: systémy Epidat (celostátní program hlášení, evidence a analýzy dat o přenosných chorobách v ČR) a ISIN (Informační systém infekčních nemocí) Státního zdravotního ústavu ČR. Dostupné na www: http://szu.cz/.
29. Zprávy o činnosti. Státní veterinární správa. Dostupné na www: https://www.svscr.cz/zdravi-zvirat/zpravy-o-cinnosti/.
30. Celli J, Zahrt TC. Mechanisms of Francisella tularensis intracellular pathogenesis. Cold Spring Harbor Perspectives in Medicine, 2013;3(4):a010314.
31. Jones BD, Faron M, Rasmussen JA, Fletcher JR. Uncovering the components of the Francisella tularensis virulence stealth strategy. Frontiers in Cellular and Infection Microbiology, 2014;4.
32. Barker JR, Chong A, Wehrly TD, Yu J-J, Rodriguez SA, Liu J, Celli J, Arulanandam BP, Klose KE. The Francisella tularensis pathogenicity island encodes a secretion system that is required for phagosome escape and virulence. Molecular Microbiology, 2009;74(6):1459–1470.
33. Nano FE, Zhang N, Cowley SC, Klose KE, Cheung KKM, Roberts MJ, Ludu JS, Letendre GW, Meierovics AI, Stephens G, Elkins KL. A Francisella tularensis pathogenicity island required for intramacrophage growth. Journal of Bacteriology, 2004;186(19):6430–6436.
34. Ellis J, Oyston PCF, Green M, Titball RW. Tularemia. Clinical Microbiology Reviews. 2002;15(4):631–646.
35. Hansen B-A, Tilseth R, Finjord T, Bruserud Ø. Francisella tularensis bacteraemia causing multi-organ failure. Oxford Medical Case Reports, 2018;2018(9).
36. Rothfeldt LKL, Jacobs RF, Wheeler JG, Weinstein S, Haselow DT. Variation in Tularemia Clinical Manifestations – Arkansas, 2009–2013. Open Forum Infectious Diseases, 2017;4(1).
37. Foley JE, Nieto NC. Tularemia. Veterinary Microbiology. 2010;140(3):Zoonoses: Advances and Perspectives:332–338.
38. Thomas LD, Schaffner W. Tularemia Pneumonia. The Atypical Pneumonias. Infectious Disease Clinics of North America, 2010;24(1):43–55.
39. Carvalho CL, Lopes de Carvalho I, Zé-Zé L, Núncio MS, Duarte EL. Tularaemia: A challenging zoonosis. Comparative Immunology, Microbiology and Infectious Diseases. 2014;37(2):85–96.
40. Borde JP, Zange S, Antwerpen MH, Georgi E, von Buttlar H, Kern WV, Rieg S. Five cases of vector-borne Francisella tularensis holarctica infections in south-western Germany and genetic diversity. Ticks and Tick-Borne Diseases, 2017;8(5):808–812.
41. Wherry WB, Lamb BH. Infection of Man with Bacterium Tularense. Journal of Infectious Diseases, 1914;15(2):331–340.
42. Kaiser AB, Rieves D, Price AH, Gelfand MR, Parrish RE, Decker MD, Evans ME. Tularemia and Rhabdomyolysis. JAMA, 1985;253(2):241–243.
43. Feldman KA, Enscore RE, Lathrop SL, Matyas BT, McGuill M, Schriefer ME, Stiles-Enos D, Dennis DT, Petersen LR, Hayes EB. An outbreak of primary pneumonic tularemia on Martha’s Vineyard. The New England Journal of Medicine, 2001;345(22):1601–1606.
44. Shapiro DS, Schwartz DR. Exposure of Laboratory Workers to Francisella tularensis despite a Bioterrorism Procedure. Journal of Clinical Microbiology, 2002;40(6):2278–2281.
45. Yaglom H. Notes from the Field: Fatal Pneumonic Tularemia Associated with Dog Exposure – Arizona, June 2016. MMWR. Morbidity and Mortality Weekly Report. 2017;66.
46. Karakas A, Coskun O, Artuk C, Savasci U, Gul HC, Mert G, Avci IY, Besirbellioglu BA a Eyigun CP. Oropharyngeal tularemia cases admit-
ted to a military hospital in Ankara, Turkey. Journal of Infection in Developing Countries, 2014;8(8):994–999.
47. Al AD, et. Epidemiology and Ecology of Tularemia in Sweden, 1984–2012 - Volume 21, Number 1 – January 2015 – Emerging Infectious Disease journal – CDC. nedatováno.
48. Statistics. Tularemia. CDC. 11. leden 2018. Dostupné na www:
https://www.cdc.gov/tularemia/statistics/index.html.
49. Tularaemia – Annual Epidemiological Report 2016 [2014 data]. European Centre for Disease Prevention and Control. 31. srpen 2016. Dostupné na www: http://ecdc.europa.eu/en/publications-data/tularaemia-annual-epidemiological-report-2016-2014-data.
50. Caspar Y, Hennebique A, Maurin M. Antibiotic susceptibility of Francisella tularensis subsp. holarctica strains isolated from tularaemia patients in France between 2006 and 2016. The Journal of Antimicrobial Chemotherapy. 2017.
51. Enderlin G, Morales L, Jacobs RF, Cross JT. Streptomycin and alternative agents for the treatment of tularemia: review of the literature. Clinical Infectious Diseases: An Official Publication of the Infectious Diseases Society of America, 1994;19(1):42–47.
52. Tärnvik A, Weltgesundheitsorganisation, ed. WHO guidelines on tularaemia: epidemic and pandemic alert and response. Geneva: World Health Organization, 2007.
53. Johansson A, Berglund L, Sjöstedt A, Tärnvik A. Ciprofloxacin for Treatment of Tularemia. Clinical Infectious Diseases, 2001;33(2):267–268.
54. Tomaso H, Hotzel H, Otto P, Myrtennäs K, Forsman M. Antibiotic susceptibility in vitro of Francisella tularensis subsp. holarctica isolates from Germany. The Journal of Antimicrobial Chemotherapy, 2017;72(9):2539–2543.
55. Maurin M, Mersali NF, Raoult D. Bactericidal Activities of Antibiotics against Intracellular Francisella tularensis. Antimicrobial Agents and Chemotherapy, 2000;44(12):3428–3431.
56. Sutera V, Hoarau G, Renesto P, Caspar Y, Maurin M. In vitro and in vivo evaluation of fluoroquinolone resistance associated with DNA gyrase mutations in Francisella tularensis, including in tularaemia patients with treatment failure. International Journal of Antimicrobial Agents, 2017;50(3):377–383.
57. Sawyer WD, Dangerfield HG, Hogge AL, Crozier D. Antibiotic prophylaxis and therapy of airborne tularemia. Bacteriological Reviews, 1966;30(3):542–550.
58. Limaye AP, Hooper CJ. Treatment of tularemia with fluoroquinolones: two cases and review. Clinical Infectious Diseases: An Official Publication of the Infectious Diseases Society of America, 1999;29(4):922–924.
59. Johansson A, Petersen JM, Sjöstedt A. Laboratory diagnostics and discrimination of subspecies and strains. In: WHO Guidelines on Tularaemia. France: WHO, 2007, s. 27–33. Dostupné na www: http://www.who.int/csr/resources/publications/WHO_CDS_EPR_2007_7.pdf?ua=1.
60. Payne MP, Morton RJ. Effect of culture media and incubation temperature on growth of selected strains of Francisella tularensis. Journal of Veterinary Diagnostic Investigation: Official Publication of the American Association of Veterinary Laboratory Diagnosticians, Inc. 1992;4(3):264–269.
61. Baker CN, Hollis DG, Thornsberry C. Antimicrobial susceptibility testing of Francisella tularensis with a modified Mueller-Hinton broth. Journal of Clinical Microbiology, 1985;22(2):212–215.
62. Bernard K, Tessier S, Winstanley J, Chang D, Borczyk A. Early recognition of atypical Francisella tularensis strains lacking a cysteine requirement. Journal of Clinical Microbiology, 1994;32(2):551–553.
63. Provenza JM, Klotz SA, Penn RL. Isolation of Francisella tularensis from blood. Journal of Clinical Microbiology, 1986;24(3):453–455.
64. Pohanka M. Biologické zbraně. Hradec Králové: Univerzita obrany, 2010.
65. Johansson A, Forsman M, Sjöstedt A. The development of tools for diagnosis of tularemia and typing of Francisella tularensis. APMIS: acta pathologica, microbiologica, et immunologica Scandinavica, 2004;112(11–12):898–907.
66. Sjöstedt A, Eriksson U, Berglund L, Tärnvik A. Detection of Francisella tularensis in ulcers of patients with tularemia by PCR. Journal of Clinical Microbiology, 1997;35(5):1045–1048.
67. Versage JL, Severin DDM, Chu MC, Petersen JM. Development of a Multitarget Real-Time TaqMan PCR Assay for Enhanced Detection of Francisella tularensis in Complex Specimens. Journal of Clinical Microbiology, 2003;41(12):5492–5499.
68. Molins CR, Carlson JK, Coombs J, Petersen JM. Identification of Francisella tularensis subsp. tularensis A1 and A2 infections by real-time polymerase chain reaction. Diagnostic Microbiology and Infectious Disease, 2009;64(1):6–12.
69. Koskela P, Salminen A. Humoral immunity against Francisella tularensis after natural infection. Journal of Clinical Microbiology, 1985;22(6):973–979.
70. Tarnvik A, Chu MC. New Approaches to Diagnosis and Therapy of Tularemia. Annals of the New York Academy of Sciences, 2007;1105(1):378–404.
71. Nakajima R, Escudero R, Molina DM, Rodríguez-Vargas M, Randall A, Jasinskas A, Pablo J, Felgner PL, AuCoin DP, Anda P, Davies DH. Towards Development of Improved Serodiagnostics for Tularemia by Use of Francisella tularensis Proteome Microarrays. Journal of Clinical Microbiology, 2016;54(7):1755–1765.
72. Cunningham SA, Patel R. Importance of Using Bruker’s Security-Relevant Library for Biotyper Identification of Burkholderia pseudomallei, Brucella Species, and Francisella tularensis. Journal of Clinical Microbiology, 2013;51(5):1639–1640.
73. Seibold E, Maier T, Kostrzewa M, Zeman E, Splettstoesser W. Identification of Francisella tularensis by whole-cell matrix-assisted laser desorption ionization-time of flight mass spectrometry: fast, reliable, robust, and cost-effective differentiation on species and subspecies levels. Journal of Clinical Microbiology, 2010;48(4):1061–1069.
74. Švabenska E. Systems for Detection and Identification of Biological Aerosols (Review Paper). Defence Science Journal, 2012;62(6):404–411.
75. O’Malley KJ, Bowling JL, Stinson E, Cole KS, Mann BJ, Namjoshi P, Hazlett KRO, Barry EM, Reed DS. Aerosol prime-boost vaccination provides strong protection in outbred rabbits against virulent type A Francisella tularensis. PLOS ONE, 2018;13(10):e0205928.
76. Whelan AO, Flick-Smith HC, Homan J, Shen ZT, Carpenter Z, Khoshkenar P, Abraham A, Walker NJ, Levitz SM, Ostroff GR, Oyston PCF. Protection induced by a Francisella tularensis subunit vaccine delivered by glucan particles. PLOS ONE, 2018;13(10):e0200213.
77. Jia Q, Horwitz MA. Live Attenuated Tularemia Vaccines for Protection Against Respiratory Challenge With Virulent F. tularensis subsp. tularensis. Frontiers in Cellular and Infection Microbiology, 2018;8.
78. Place DE, Williamson DR, Yuzefpolskiy Y, Katkere B, Sarkar S, Kalia V, Kirimanjeswara GS. Development of a novel Francisella tularensis Live Vaccine Strain expressing ovalbumin provides insight into antigen-specific CD8+ T cell responses. PLOS ONE, 2017;12(12):e0190384.
79. Wayne Conlan J a Oyston PCF. Vaccines against Francisella tularensis. Annals of the New York Academy of Sciences. 2007;1105 : 325–350.
Práce byla podpořena projektem bezpečnostního výzkumu Ministerstva vnitra ČR – VI20172020095.
Labels
Hygiene and epidemiology Medical virology Clinical microbiologyArticle was published in
Epidemiology, Microbiology, Immunology

2019 Issue 2
-
All articles in this issue
- Stanovení antimikrobiálních účinků slizu plže Achatina reticulata
- Surveillance antibiotické rezistence u Streptococcus pneumoniae v České republice, výsledky respirační studie za roky 2010–2017
- Tularémie – zoonóza s rizikem bioterorismu
- Aktinomykóza – zastřešující přehled a 3 případy těžké pánevní aktinomykózy léčené konzervativně
- In-vivo mezidruhový přenos KPC karbapenemázy u dlouhodobě léčené pacientky
- Diagnostika a léčba bartonelových endokarditid
- Infekce a kolonizace Clostridium difficile u dětí do 3 let věku: prospektivní srovnávací studie
- Snížení dávkování thymoglobulinu ze 7,5 mg/kg na 6 mg/kg v rámci přípravného transplantačního režimu prodloužilo dobu do první detekce lidského cytomegaloviru u pacientů po alogenní transplantaci krvetvorných buněk
- Epidemiology, Microbiology, Immunology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Aktinomykóza – zastřešující přehled a 3 případy těžké pánevní aktinomykózy léčené konzervativně
- In-vivo mezidruhový přenos KPC karbapenemázy u dlouhodobě léčené pacientky
- Tularémie – zoonóza s rizikem bioterorismu
- Infekce a kolonizace Clostridium difficile u dětí do 3 let věku: prospektivní srovnávací studie
