Aktuálne indikačné obmedzenia pre gliptíny, agonisty GLP1-receptorov a bazálne analógy inzulínu
Current indicating limitations in gliptines, GLP1-receptor agonists and basal insulin analogues
Type 2 diabetes mellitus is a very heterogeneous disorder whose pathogenic mechanisms progresses also after diagnosis of the disease. Prognosis of this disease in terms of metabolic control depends primarily on its quality during the first 10-15 years of treatment. Treatment requires individualized approach with the use of the widest possible range of pharmaceuticals already in the early stages. In terms of clinical practice, it is therefore necessary that these pharmaceutical agents are available also in terms of covering by insurance companies and indicating limitations. Recently, our range of availability of innovative pharmaceuticals significantly improved especially in gliptines, basal insulin analogues and GLP1-receptor agonists.
Key words:
basal insulin analogues – gliptines – indicating restrictions
Authors:
Emil Martinka
Authors‘ workplace:
MMM Consulting, Bratislava
; Národný endokrinologický a diabetologický ústav, diabetologické oddelenie, primár doc. MUDr. Emil Martinka, PhD., Ľubochňa
Published in:
Forum Diab 2013; 2(2): 130-139
Category:
Overview
Diabetes mellitus 2. typu je veľmi heterogénne ochorenie, ktorého patogénne mechanizmy progredujú aj po diagnóze ochorenia a ktorého prognóza z hľadiska metabolickej kontroly závisí predovšetkým od jej kvality počas prvých 10-15 rokov liečby. Jedná sa o ochorenie, ktoré vyžaduje individualizovaný prístup s možnosťou použitia čo najširšieho spektra farmák už v úvodných štádiách. Z hľadiska klinickej praxe je preto potrebné, aby tieto farmaká boli dostupné aj v zmysle doplatkov a indikačných obmedzení. V poslednej dobe sa spektrum dostupnosti inovatívnych farmák významne zlepšilo, a to najmä pri gliptínoch, bazálnych analógoch inzulínu a agonistoch GLP1-receptoru.
Kľúčové slová:
bazálne analógy inzulínu – gliptíny – indikačné obmedzenia
Evidence based medicine v koncepcii modernej slovenskej diabetológie
Diabetes mellitus je heterogénne ochorenie a dnes už poznáme viac ako 150 rôznych príčin (defektov) vedúcich v konečnom dôsledku k vzostupu hladiny glukózy v krvi (hyperglykémii), schéma 1. Navyše, tieto defekty sa môžu navzájom kombinovať, čím sa heterogenita ešte zvýrazňuje. To znamená (a prax to potvrdzuje), že rovnako liečba môže vyžadovať terapeutické ovplyvnenie ochorenia na rôznych úrovniach a obvykle je potrebná aj kombinácia viacerých mechanizmov účinkov (viacerých farmák). Súčasne ide o ochorenie, u ktorého patogénne mechanizmy progredujú (prehlbujú sa) aj v dobe po diagnóze ochorenia, čo zas vyžaduje stupňovitú liečbu (schéma 2) s postupnou akceleráciou a titráciou [16].


Ochorenie je závažné predovšetkým dôsledkami komplikácií, ku ktorým vedie, v dôsledku čoho zvyšuje morbiditu a mortalitu a zhoršuje tiež kvalitu života pacientov. K dispozícii máme niekoľko štúdií zásadného významu, ktoré ukázali, že intenzívna glykemická kontrola spomaľuje a odďaľuje rozvoj komplikácií, a tiež že pre prognózu pacienta je rozhodujúca kvalita liečby počas prvých 10–15 rokov po zistení ochorenia, a to tak v prípade diabetu 1. typu [1], ako aj diabetu 2. typu [14]. Naopak, ak sa v dôsledku nedostatočnej metabolickej kontroly v priebehu prvých rokov trvania ochorenia už komplikácie rozvinuli, resp. vytvoril sa solídny základ pre ich rozvoj, nepriaznivú situáciu už nedokáže zvrátiť ani neskoršia optimálna metabolická kontrola [38,39].
Hoci najznámejším prejavom diabetu (a súčasne diagnostickým kritériom) je zvýšená hladina glukózy v krvi, nie je celkom jasné, či sa súčasne jedná aj o najvýznamnejší prejav ochorenia. Obzvlášť diabetes mellitus 2. typu (DM2T) sa združuje s množstvom ďalších defektov na úrovni porúch metabolizmu tukov, krvného tlaku, ale tiež dysfunkcie endotelu, prejavov chronického subklinického zápalu, oxidačným stresom a mnohými inými mechanizmami. A opäť, mnohé štúdie naznačili, že práve ovplyvnenie týchto extraglykemických pleiotropných parametrov môže zohrávať zásadnú úlohu napríklad pri ovplyvnení reziduálneho kardiovaskulárneho rizika a že rovnako v prevencii mikrovaskulárnych komplikácií okrem ovplyvnenia samotnej glykémie zohrávajú úlohu aj viaceré extraglykemické faktory [19,21,22,25,28,31,36,44].
Liečba diabetu, okrem dosiahnutia požadovanej metabolickej kontroly, musí byť predovšetkým bezpečná. Inými slovami, nesmie viesť k zvýšeniu morbiditno-mortalitného rizika. V poslednej dobe je zvláštna pozornosť venovaná práve kardiovaskulárnej (KVO) a onkologickej bezpečnosti a regulačné orgány vyžadujú jej dokladovanie od každého nového prípravku. FDA (Ústav pre kontrolu potravín a liekov USA) preto požaduje, aby novšie lieky boli ešte pred uvedením testované na riziko KVO a nesmú toto riziko zvyšovať.
Ďalšou kľúčovou otázkou sú nežiaduce účinky liečby, medzi ktoré v prípade antidiabetických farmák rátame najmä riziko hypoglykémie a prírastok na hmotnosti. Aj tu máme k dispozícii viacero štúdií, ktoré ukázali, že aj prírastku na hmotnosti je omnoho dôležitejšie predchádzať než ho liečiť. Redukcia hmotnosti totiž síce vedie k zlepšeniu parametrov rizikových faktorov, neovplyvňuje však morbiditno-mortalitné parametre (samozrejme s výnimkou extrémnej obezity liečenej bariatrickou chirurgiou) [23]. A napokon hypoglykémia. Je nielen rizikovým faktorom náhlej smrti, ale tiež faktorom limitujúcim dosiahnutie adekvátnej glykemickej kontroly. Organizmus s tendenciou hypoglykemických reakcií je obvykle ľahšie zraniteľný a práve hypoglykémia a variabilita glykémií sa v „záťažových“ situáciách, ako je napríklad infarkt myokardu, prejavuje už v najvčasnejších štádiách, resp. ich ovplyvnenie v týchto štádiách má pre pacienta (možno paradoxne) najväčší benefit [40]. Ako veľmi dôležitý sa ukazuje aj pleiotropný extraglykemický účinok a možnosť vzájomnej, čo najširšej kombinácie jednotlivých farmák v celej časovej osi ochorenia.
Čo z týchto vyššie uvedených faktov vyplýva pre našu každodennú prax? Predovšetkým potreba včasnej diagnózy ochorenia a včasnej adekvátnej liečby. Teda aby bol pacient od začiatku vedený odborníkom diabetológom. Ďalšou potrebou je, aby diabetológ mal k dispozícii farmaká pôsobiace na rôznych úrovniach a mal možnosť ich reálne použiť (teda musia to umožňovať aj znenia indikačných obmedzení) už vo včasných štádiách liečby, kedy môžu poskytnúť najväčší cost/benefit efektívny prínos. Tieto a mnohé ďalšie fakty zdôrazňuje aj Slovenská diabetologická spoločnosť vo svojich vyjadreniach ku kategorizácii a tvorbe indikačných obmedzení.
Hlavné argumenty SDS používané pri návrhoch znení indikačných obmedzení sú:
- O prognóze pacienta rozhoduje kvalita liečby počas prvých 10–15 rokov.
- Komplikáciám je možné predísť (oddialiť), nie však ich zvrátiť, pokiaľ sa už rozvinuli. A keďže včasná intenzívna liečba je cost/benefit efektívna, indikačné obmedzenia pre inovatívne lieky by nemali byť podmieňované zlým stavom pacienta.
- Diabetes mellitus je veľmi heterogénne ochorenie. Je preto potrebné mať k dispozícii široký výber prípravkov účinkujúcich na rôznych úrovniach.
- Diabetes mellitus je ochorenie s progredujúcim vývojom patogénnych mechanizmov aj po diagnóze. Je preto potrebné mať k dispozícii možnosť využívať jednotlivé farmaká v optimálnej nadväznej kombinácii od samého začiatku po diagnóze ochorenia.
- Medzinárodne akceptované štandardy liečby (ADA/EASD) odporúčajú pristupovať k zmenám liečby (jej akcentácii) v 3-mesačných intervaloch, v prípade že dovtedajšia liečba nebola dostatočne účinná. Pre akcentáciu liečby je odporúčanou hodnotou HbA1c > 7%. Intervaly indikačných obmedzení a hodnoty HbA1c by sa preto od týchto parametrov nemali odlišovať nakoľko by mohli pacienta poškodzovať.
- Prírastok na hmotnosti je nežiaduci efekt pri liečbe rôznymi farmakami. Následný pokles telesnej hmotnosti sa dosahuje ťažšie a aj v prípade, že sa dosiahne, sa síce zlepšia hodnoty jednotlivých rizikových faktorov, nevedie však k zlepšeniu morbiditno-mortalitných ukazovateľov. Prírastku na hmotnosti je preto potrebné predchádzať a teda indikačné obmedzenia by nemali byť podmieňované prítomnosťou obezity.
- Hypoglykémia je nežiaduci efekt pri liečbe rôznymi farmakami. Jej negatívny efekt (zvýšené morbiditno-mortalitné riziko a limitácia adekvátnej titrácie liečby) sa uplatňuje už v najvčasnejších štádiách ochorenia. Hypoglykémiám je preto potrebné predchádzať už na začiatku liečby a teda indikačné obmedzenia nepodmieňovať prítomnosťou hypoglykémií.
- Pri dlhšom trvaní diabetu (> 20–25 rokov), vyššom veku, rozvinutých komplikáciách a pridruženej polymorbidite sa nároky na liečbu (intenzitu glykemickej kontroly) znižujú, nakoľko príliš „tesná kompenzácia“ môže pre pacienta predstavovať skôr zvýšené riziko!
- Zvláštnu pozornosť vyžadujú deti, tehotné ženy, ženy v predkoncepčnej príprave a tzv. zraniteľné (sociálne slabšie) skupiny osôb. Indikačné obmedzenia a doplatky by mali zohľadňovať individualitu týchto skupín.
- Možnosti hradenia liečby sú závislé od ekonomických možností. Pri návrhoch indikačných obmedzení je tento faktor (ekonomickú náročnosť a jej limity) potrebné vždy dôsledne zohľadniť.
- Ani najmodernejšie postupy a ich široká dostupnosť nezabezpečia adekvátne výsledky bez osobnej zaangažovanosti a zodpovednosti každého pacienta.
- Pleiotropné extraglykemické účinky.
Evidence based medicine v liečbe diabetes mellitus 2. typu
Za základnú a najvýznamnejšiu podmienku správnej liečby DM2T od samého začiatku ochorenia sa trvale považuje racionalizácia životného štýlu, čo zahŕňa najmä racionálnu výživu s výberom zdravých zdrojov živín, primeranú fyzickú aktivitu a prevenciu/redukciu telesnej hmotnosti (pokiaľ je zvýšená). Dosahuje sa predovšetkým edukáciou pacienta a potenciál takejto liečby je porovnateľný s výsledkami farmakologickej liečby. Cieľom liečby v tomto období je podľa možností normalizácia glykémií. Ak samotná racionalizácia nepostačuje, je nutné začať s farmakoterapiou. V súčasnej dobe sa za zlatý štandard iniciácie farmakologickej liečby DM2T považuje liečba metformínom [16]. Výhody lieku spočívajú nielen v signifikantnom účinku na glykémiu, ale aj v širokom spektre extraglykemických účinkov. Hlavným dôvodom, pre ktorý je metformín dlhodobo považovaný za zlatý štandard liečby, je okrem efektívnej kontroly glykémie najmä nízke riziko hypoglykémie, hmotnostná neutralita a potenciálny kardiovaskulárny benefit [14,16]. Pomerne veľký podiel pacientov však tento liek netoleruje, v dôsledku gastrointestinálnych nežiaducich účinkov (nauzea, hnačka) alebo je kontraindikovaný (pacienti so zlyhávaním srdca, renálnou či hepatálnou insuficienciou, respiračnou insuficienciou či akútnou alebo chronickou acidózou). Podľa viacerých údajov sa podiel takýchto pacientov pohybuje v rozsahu 15–20 % [4]. Alternatívou liečby bola donedávna obvykle sulfonylurea alebo glitazóny. V súčasnej dobe sa však tieto prípravky postupne stávajú obsolentnými, resp. menej využívanými pre neistotu ich bezpečnosti. V prípade sulfonylurey je hlavnou limitáciou zvýšené riziko hypoglykémie a prírastok na hmotnosti. Tieto limitácie sú najevidentnejšie práve u pacientov vo včasných štádiách, t. j. u pacientov s „len“ mierne vyšším HbA1c v rozsahu 7–8 %, u ktorých je žiaduca normalizácia glykemickej kontroly, a u starších pacientov, ktorí sú v riziku častejších a ťažších hypoglykémií s potenciálne závažnejšími dôsledkami [4]. Okrem toho, prípravkom sulfonylurey (azda s výnimkou gliklazidu) sa pripisuje aj zvýšená kardiovaskulárna morbidita a mortalita [18] a v dôsledku nefyziologickej stimulácie sekrécie inzulínu aj rýchlejšie rozvinutie sa dysfunkcie sekrécie inzulínu. V prípade glitazónov (v súčasnej dobe zostal na trhu už iba pioglitazón) je limitácia ešte výraznejšia v dôsledku neistoty o bezpečnosti aj tohto farmaka z hľadiska rizika retencie tekutín, srdcového zlyhávania, fraktúr či rakoviny močového mechúra [4,16]. Ako výhodná alternatíva metformínu v monoterapii sa ukazuje a čoraz viac presadzuje liečba pomocou inhibítorov dipeptidylpeptidázy-4, čiže gliptínmi [4,16].
Veľmi podobné úvahy týkajúce sa efektivity, bezpečnosti, rizika hypoglykémie a prírastku na hmotnosti sa vynárajú aj pri intenzifikácii liečby v prípade, že samotná monoterapia metformínom postupom času stratila schopnosť udržať adekvátnu úroveň glykemickej kontroly. Aj tu sa ako výhodná alternatíva čoraz viac presadzuje liečba akcentáciou inkretínového účinku prostredníctvom gliptínov, ako sú linagliptín, saxagliptin, sitagliptín, vildagliptín alebo agonistov GLP1-receptorov. O gliptínoch bolo v našej literatúre popísané už mnoho článkov. V skratke, jedná sa o skupinu farmák, ktoré nielenže významne rozširujú doterajšie možnosti liečby, tým že dopĺňajú účinok na viaceré „terapeutické terče“, ktoré donedávna neboli pokryté účinkom žiadnych iných farmák, ale prinášajú aj úplne nové perspektívy. Liečba pomocou gliptínov je založená na fyziologických mechanizmoch a ich hlavná pridaná hodnota spočíva v efektívnej glykemickej kontrole, ktorá je dlhodobá. Tá sa môže uplatniť tak v iniciálnej liečbe alebo aditívnym efektom pri rôznych terapeutických kombináciách (dvojkombinácia, trojkombinácia perorálnymi antidiabetikami), vrátane kombinácie s inzulínom. Aj keď sa v absolútnych hodnotách môže zdať pokles HbA1c pri liečbe gliptínmi nižší (0,6–1,1 %) než pri iných prípravkoch, tento pokles sa uplatňuje vo všetkých stupňoch liečby a kombináciách s inými prípravkami. Navyše, efekt sa uplatňuje iba v prípade vzostupu glykémie (glukózodependentný účinok) čo znamená, že riziko hypoglykémie je pri liečbe gliptínmi minimálne. Inhibítory DPP4 účinkujú mechanizmom vzostupu hladín prirodzených inkretínov GLP1 (glucagon like peptide 1) a GIP (gastric inhibitory polypeptide) tým, že zabraňujú ich štiepeniu dipeptidylpeptidázou 4 (DPP4). Oba tieto hormóny stimulujú sekréciu inzulínu. GLP1 okrem toho suprimuje sekréciu glukagónu, čo je hlavný hormón glukoneogenézy (účinok na pokles glykémie je teda duálny). GIP však v prípade nižších hladín glykémie glukagón stimuluje, čím bráni nadmernému poklesu glykémie [4]. Medzi extraglykemické účinky patrí priaznivý efekt na krvné tuky, krvný tlak, telesnú hmotnosť, spomalenie vyprázdňovania žalúdka s dlhším pocitom nasýtenia, priaznivý efekt na chronický subklinický vaskulárny a adipogénny zápal a ďalšie [6,21,25]. V posledných rokoch sa tieto pleiotropné účinky veľmi intenzívne skúmajú s pozoruhodnými pozorovaniami, ktoré môžu mať kardioprotektívny účinok najmä v prípade akútnych kardiovaskulárnych komplikácií. Výsledky niekoľkých štúdií dokumentovali, že podanie natívnej molekuly GLP1 alebo agonistov GLP1-receptorov v akútnej fáze infarktu myokardu zlepšuje metabolizmus ischemických buniek, bráni reperfúznemu poškodeniu, prispieva k zmenšeniu rozsahu ložiska infarktu, má antiarytmický účinok a zlepšuje funkciu ľavej komory [21,22,28]. Viaceré z týchto účinkov boli opísané aj pri gliptínoch či už v experimente na zvierati [19,36,43] alebo u človeka [6,19,31]. Gliptíny okrem GLP1 a GIP ovplyvňujú aj ďalšie substráty, spomedzi ktorých v problematike kardiovaskulárneho benefitu kľúčovú úlohu zohráva tzv. SDF1a (stromal derived factor 1α), ktorý do miesta ischémie priťahuje multipotentné, endotelové progenitorové bunky, čím podporuje postischemickú angiogenézu. V experimentálne navodenom infarkte myokardu u myší viedlo súčasné podávanie DPP4 a GCSF (stimuluje mobilizáciu kmeňových buniek) k nasmerovaniu cirkulujúcich CXCR4+ kmeňových buniek do myokardu, redukcii remodelácie myokardu a zlepšeniu výkonu myokardu a jeho prežívania [36,44]. Gliptíny okrem benefitu pri akútnych kardiovaskulárnych príhodách však prejavujú aj neutrálny až potenciálny dlhodobý morbiditno-mortalitný kardiovaskulárny benefit, na čo poukázali viaceré registrové štúdie a metaanalýzy štúdií s gliptínmi [7,17,19,34]. Tieto pozorovania sú aj dôvodom prebiehajúcich megaštúdií s gliptínmi, ako sú napríklad TECOS či CAROLINA.
Nové možnosti využitia účinku liečby pomocou inhibítorov dipeptidylpeptidázy 4 (gliptínov)
Nové znenie indikačných obmedzení
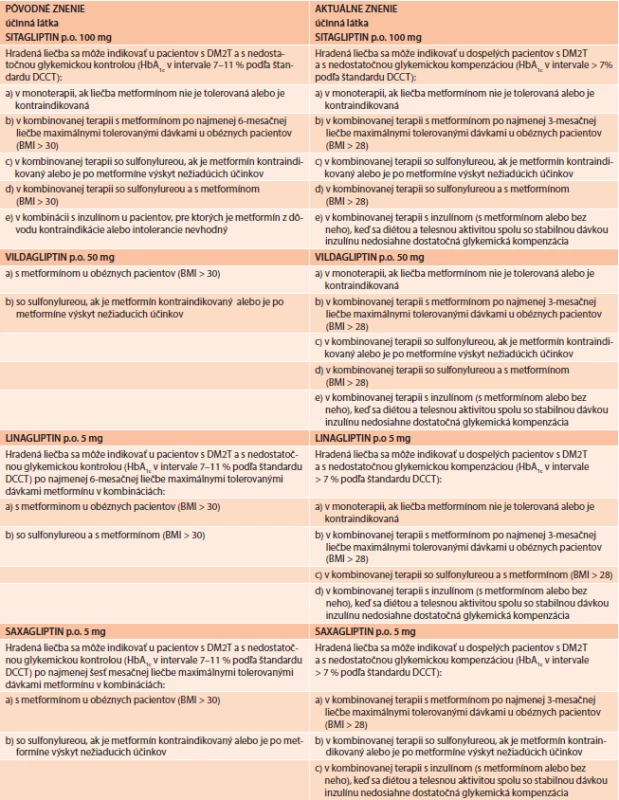
Od 1. 7. 2013 na Slovensku platia nové indikačné obmedzenia pre liečbu pomocou gliptínov (tab. 1). Nové znenie vzišlo s konsenzu rokovania odbornej pracovnej skupiny pre antidiabetiká, ministerstva zdravotníctva a zdravotných poisťovní na podnet, ktorý iniciovala Slovenská diabetologická spoločnosť na základe poznatkov medicíny založené na dôkazoch a aktualizácie SPC jednotlivých gliptínov. Prečo a v čom bolo potrebné dosiahnuť zmeny indikačných obmedzení? V prípade vildagliptínu, linagliptínu a saxagliptínu sa primárne jednalo o rozšírenie jestvujúcich indikácií a kombinácií v zmysle aktuálnych SPC týchto molekúl zhruba na úroveň sitagliptínu (tab. 1). Okrem rozšírenia indikačných možností však konsenzus dosiahol aj štyroch ďalších dôležitých bodov. Skrátila sa požiadavka na dĺžku trvania neuspokojivej monoterapie metformínom (ako podmienka pridania gliptínu) zo 6 na 3 mesiace. Upravila sa podmienka minimálnej hladiny HbA1c na 7 %. Znížila sa podmienka hodnoty BMI z 30 na 28 kg.m-2 . Rozšírilo sa znenie indikácie pre kombináciu gliptínov s inzulínom aj pri súčasnej liečbe metformínom (teda nielen v prípade intolerancie alebo kontraindikácie metformínu pri liečbe inzulínom). Medzi pacientmi s BMI < 30 kg.m-2 sú obvykle lepšie spolupracujúci pacienti (v zmysle dodržiavania režimu a diétnych opatrení). Ako nedávno ukázala štúdia Look AHEAD [23] nárastu hmotnosti je nutné predchádzať a teda prednostne voliť farmaká, ktoré nevedú k prírastku na hmotnosti. Takými farmakami sú práve gliptíny. Neskoršia redukcia hmotnosti (pokiaľ sa dosiahne) síce vedie k vylepšeniu rizikových faktorov (tlak, lipidy, glykémia), neprináša však zníženie kardiovaskulárneho rizika, ktoré je hlavnou príčinou morbidity a mortality pacientov s DM2T. Podmienkovanie indikácie vysokým BMI teda nielenže nemalo medicínske zdôvodnenie, ale práve naopak, bolo v rozpore so súčasnými poznatkami. Redukcia podmienkovej hodnoty BMI priniesla nielen medicínsky benefit pre pacienta, ale aj reálny predpoklad redukcie nákladov v dôsledku prevencie dôsledkov obezity. Rovnako posunutie podmienky indikácie gliptínov pre trvanie neuspokojivej monoterapie metformínom z hranice 6 mesiacov na 3 mesiace prináša benefit pre pacienta. Vyčkávanie na akcentáciu liečby pri nedostatočnej glykemickej kontrole sa totiž považuje za chybu postupu. Napokon, liečba metformínom prináša celý rad priaznivých účinkov a obvykle vedie aj k redukcii potreby dávok inzulínu až o 10–30 %, resp. cca 19 U/deň, čo znamená úsporu liečby inzulínom. Keďže metformín predstavuje základnú súčasť liečby pacienta s DM2T, mala by byť táto ponechaná trvalo (vrátane pri liečbe inzulínom) a nemala by byť prekážkou pre pridanie gliptínu. Aktuálne indikačné obmedzenia sú uvedené v tab. 1 a možno konštatovať, že v súčasnosti máme pre túto skupinu farmák možnosť postupovať v súlade so štandardizovaným odporúčaním ADA/EASD pre liečbu DM2T [16].
Gliptíny v monoterapii
Podľa SPC aj IO je možné všetky kategorizované gliptíny s výnimkou saxagliptínu použiť v monoterapii za podmienky, že liečba metformínom je kontraindikovaná alebo intolerovaná u pacientov s nedostatočnou kompenzáciou samotnou diétou alebo telesnou aktivitou. K dispozícii máme niekoľko prác, ktoré demonštrovali non-inferioritu, alebo ak aj noninferioritu nepotvrdili, preukazovali len mierne nižší efekt v porovnaní s metformínom, avšak s nižším výskytom nežiadúcich gastrointestinálnych účinkov pri porovnateľnom riziku hypoglykémie a prírastku na hmotnosti [2,4,5,12,30,33,34]. Pokles HbA1c sa pri monoterapii gliptínmi obvykle pohybuje v rozsahu 0,5–0,8 %.
Gliptíny v dvojkombinácii s inými perorálnymi antidiabetikami
Najčastejšiu indikáciu gliptínov v súčasnej dobe predstavuje pridanie gliptínu do kombinácie s metformínom (ktorá podľa indikačného obmedzenia platného v SR znie „v kombinovanej terapii s metformínom po najmenej 3-mesačnej liečbe maximálnymi tolerovanými dávkami metformínu s BMI > 28 kg/m2 “). Aditívny pokles HbA1c sa pri tejto kombinácii pohybuje v rozmedzí 0,6–1,1 % a je porovnateľný s kombináciou metformínu so sulfonylureou. V porovnaní s kombináciou metformínu so sulfonylureou však kombinácia metformínu s gliptínom prináša predovšetkým výhodu násobne nižšieho rizika hypoglykémie a pokles alebo neutralitu telesnej hmotnosti. V dvojkombinácii s metformínom je možné použiť všetky registrované gliptíny, čo podporuje celý rad klinických štúdií [3,8,10,15,27,32,37].
V kombinovanej terapii gliptínu so sulfonylureou („ak je metformín kontraindikovaný alebo je po metformíne výskyt nežiaducich účinkov“) prináša liečba gliptínmi aditívny pokles HbA1c v rozsahu 0,5–0,7 % pri hmotnostnej neutralite a nízkom avšak ľahko zvýšenom riziku hypoglykémie. V kombinácii so sulfonylureou je možné použiť iba sitagliptín, saxagliptín a vildagliptín [11,13].
Gliptíny v trojkombinácii s inými orálnymi antidiabetikami
Gliptíny je možné pridať aj do trojkombinácie s metformínom a sulfonylureou, keď sa diétou a telesnou aktivitou spolu s duálnou liečbou týmito liekmi nedosiahne dostatočná glykemická kompenzácia. Pridanie gliptínu vedie k aditívnemu poklesu HbA1c o 0,6–0,8 %. Pridanie gliptínu do liečby bolo v štúdiách dobre tolerované, bez prírastku na hmotnosti a s nízkym rizikom výskytu hypoglykémií. V trojkombinácii s metformínom a sulfnylureou je možné použiť iba linagliptín, sitagliptín a vildagliptín [13,24,29].
Gliptíny v kombinácii s inzulínom
Gliptíny je možné použiť aj v kombinácii s inzulínom (s metformínom alebo bez neho), keď sa diétou a telesnou aktivitou spolu so stabilnou dávkou inzulínu nedosiahne dostatočná glykemická kontrola. Aj v tejto kombinácii prináša pridanie gliptínu aditívny pokles HbA1c o 0,6–0,8 %. Ani v tomto prípade nedochádza k zvýšeniu rizika hypoglykémie či prírastku na hmotnosti. Liečba je dobre tolerovaná a dávka inzulínu zostáva nezmenená alebo klesá [20,42,43]. V kombinácii s inzulínom je možné použiť všetky kategorizované gliptíny.
Nové možnosti využitia účinku liečby pomocou bazálnych analogov inzulínu u pacientov s DM2T
Nové znenie indikačných obmedzení
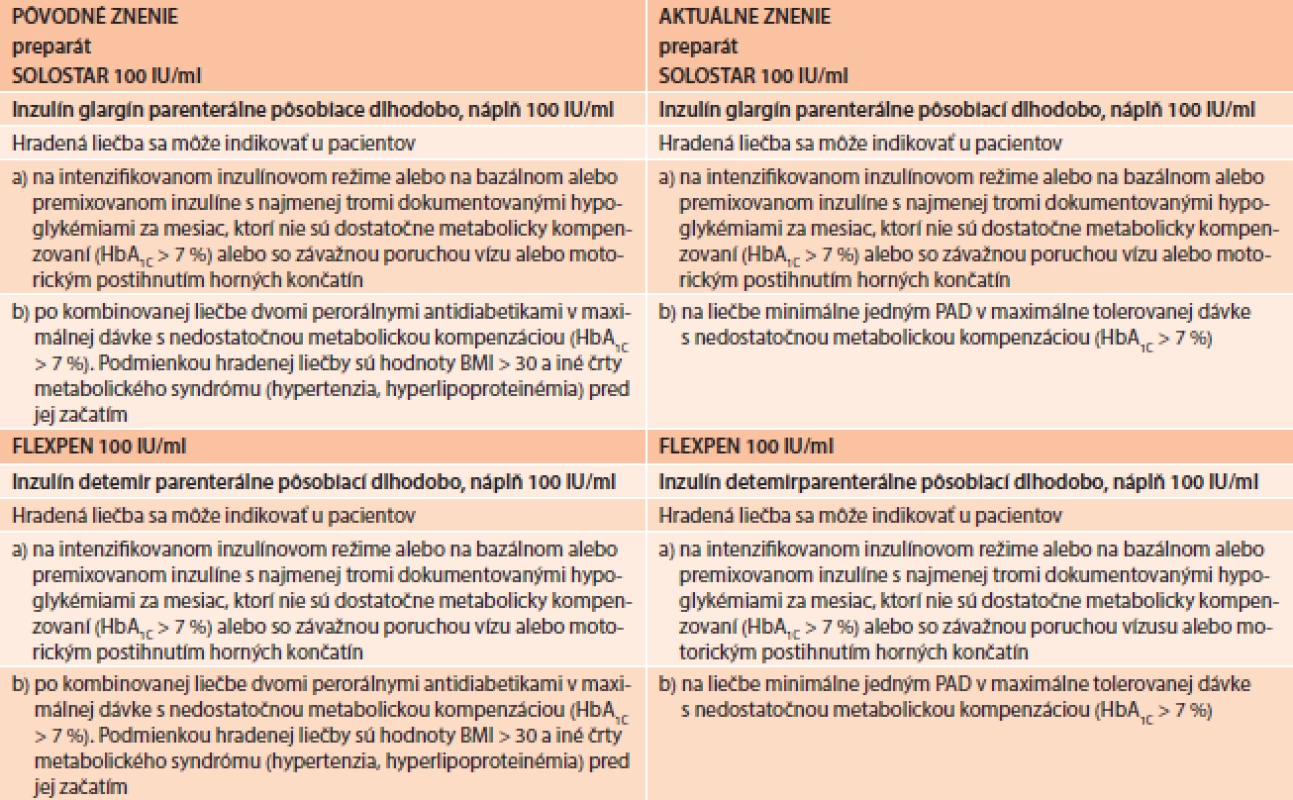
Od 1. 7. 2013 na Slovensku platia nové indikačné obmedzenia pre liečbu pomocou bazálnych analogov inzulínu (tab. 2). Aj toto nové znenie vzišlo s konsenzu rokovania odbornej pracovnej skupiny pre antidiabetiká, ministerstva zdravotníctva a zdravotných poisťovní na podnet, ktorý iniciovala Slovenská diabetologická spoločnosť na základe poznatkov medicíny založené na dôkazoch. Naša argumentácia bola založená na skutočnosti, že DM2T je veľmi heterogénne ochorenie, čo zdôrazňuje aj referenčný algoritmus ADA a EASD, keď odporúča širokú možnosť kombinácie farmák v kombinácii s metformínom pri nedostatočnom účinku metformínu samotného. Miesto na tejto pozícii majú nielen prípravky sulfonylurey, glitazóny, inhibítory DPP4, agonisty GLP1-receptora ale logicky aj inzulín. Pridanie bazálneho analógu k metformínu, ako prvý krok intenzifikácie, sa využíva pre niekoľko špecifických predností, medzi ktoré patrí najmä najsilnejší efekt na zníženie glykémie a HbA1c a najdlhšie pretrvávanie takéhoto efektu spomedzi všetkých antidiabetických farmák, overená bezpečnosť a spomalenie progresie vývoja diabetes mellitus, čo je dôležité z hľadiska prevencie chronických komplikácií [41]. Keďže pre prognózu pacienta je rozhodujúca intenzívna glykemická kontrola počas prvých 10–15 rokov od diagnózy ochorenia, je dôležité, aby pridanie bazálneho analógu bolo možné už od najvčasnejších štádií. V súčasnej dobe sa za takého považuje možnosť pridania k liečbe po zlyhaní monoterapie metformínom, resp. iným OAD pri intolerancii metformínu. Podľa doterajších indikačných obmedzení pre bazálne analógy inzulínu takýto postup nebol možný. Podmienkou bola predošlá minimálne dvojkombinácia perorálnych antidiabetík a navyše prítomnosť obezity a iných čŕt metabolického syndrómu, čo znemožňovalo ich využitie práve u pacientov, u ktorých bolo medicínsky aj ekonomicky najefektívnejšie a najracionálnejšie. Pôvodné podmienky IO teda nielenže postrádali medicínske zdôvodnenie, ale boli aj priamo v rozpore s najnovšími poznatkami.
doc. MUDr. Emil Martinka, PhD.
martinka@nedu.sk
Národný endokrinologický a diabetologický ústav v Ľubochni
www.nedu.sk
Doručené do redakcie 11. mája 2013
Sources
1. Albers JW, Herman WH, Pop-Bussui H et al. Effect of Prior Intensive Insulin Treatment During the Diabetes Control and Complications Trial (DCCT) on Peripheral Neuropathy in Type 1 Diabetes During the Epidemiology of Diabetes Interventions and Complications (EDIC) Study. Diabetes Care 2010; 33(5): 1090–1096.
2. Aschner P, Kipnes MS, Lunceford JK et al. Eff ect of the Dipeptidyl Peptidase-4 Inhibitor Sitagliptin as Monotherapy on Glycemic Control in Patients With Type 2 Diabetes. Diabetes Care. 2006; 29(12): 2632–2637.
3. Bosi E, Camisasca RP, Collober C et al. Eff ects of vildagliptin on glukose control over 24 weeks in patients with type 2 diabetes inadequately controlled with metformin. Diabetes Care 2007; 30(4): 890–895.
4. Dejager S, Schweizer A, Foley J. Evidence to support the use of vildagliptín monotherapy in the treatment of type 2 diabetes mellitus. Vasc Health Risk Manag 2012; 8 : 339–348.
5. Del Prato S, Barnett AH, Huisman H et al. Eff ect of linagliptin monotherapy on glycaemic control and markers of β-cell function in patients with inadequately controlled type 2 diabetes: a randomized controlled trial. Diabetes Obes Metab 2011; 13(3): 258–267.
6. Fadini GP, Boscaro E et al. The oral dipeptidyl peptidase-4 inhibitor sitagliptin increases circulating endothelial progenitor cells in patiens with type 2 diabetes mellitus. Diabetes Care 2010; 33(7): 1607–1609.
7. Frederich R, Alexander JH, Fiedorek FT et al. A systematic assessment of cardiovascular outcomes in the saxagliptin drug development program for type 2 diabetes.Postgrad Med 2010; 122(3): 16–27.
8. Ferrannini E, Fonseca V, Zinman et al. Fifty-two-week effi cacy and safety of vildagliptin vs. glimepiride in patients with type 2 diabetes mellitus inadequately controlled on metformin monotherapy. Diabetes Obes Metab 2009; 11(2): 157–166.
9. Gallwitz B, Uhlig-Laske B, Bhattacharaya S et al. Linagliptin has similar efficacy to glimepiride but improved cardiovascular safety over 2 years in patients with type 2 diabetes inadequately controlled on metformin. 71th Scientific Sessions of the ADA, San Diego, California 2011: Late Breaker 39.
10. Gallwitz B, Rosenstock J, Rauch T et al. 2-year effi cacy and safety of linagliptin compared with glimepiride in patients with type 2 diabetes inadequately controlled on metformin: a randomized, double-blind, non-inferiority trial. Lancet 2012; 380(9840): 475–483.
11. Garber AJ, Foley JE, Banerji MA et al. Eff ects of vildagliptin on glucose control in patients with type 2 diabetes inadequately controlled with a sulphonylurea.Diabetes Obes Metab 2008; 10(11):1047–1056.
12. Göke B, Hershon K, Kerr D et al. Effi cacy and Safety of Vildagliptin monotherapy during 2 year treatment of drug naive patients with type 2 diabetes: Comparison with metformin. Horm Metab Res 2008; 40(12): 892–895.
13. Hermansen K, Kipnes M, Luo E et al. Efficacy and safety of the dipeptidyl peptidase-4 inhibitor, sitagliptin, in patients with type 2 diabetes mellitus inadequately controlled on glimepiride alone or on glimepiride and metformin. Diabetes Obes Metab 2007; 9(5): 733–745.
14. Holman R et al. 10-year follow-up of intensive glucose control in type 2 diabetes. N Engl J Med 2008; 359(15): 1577–1589.
15. Charbonnel B, Karasik A, Liu J et al. Efficacy and safety of the dipeptidyl peptidase-4 inhibitor sitagliptin added to ongoing metformin therapy in patients with type 2 diabetes inadequately controlled on metformin alone. Diabetes Care 2006; 29(12): 2638–2643.
16. Inzucchi SE, Bergenstal RM, Buse JB et al. Management of Hyperglycemia in Type 2 Diabetes: A Patient-Centered Approach. Position Statement of the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care 2012; 35(6): 1364–1379.
17. Johansen OE, Neubacher D, Eynatten M et al. Cardiovascular safety with linagliptin in patients with type 2 diabetes mellitus: a pre-specified, prospective, and adjudicated meta-analysis of a phase 3 programme. Cardiovasc Diabetol 2012; 11.3. Dostupné z DOI: <http://doi: 10.1186/1475–2840–11–3>.
18. JA Johnson, SR Majumdar, SH Simpson. Decreased mortality associated with the use of metformin compared with sulfonylurea monotherapy in type 2 diabetes. Diabetes Care 2002; 25(12): 2244–2248.
19. Jose E, Inzucchi E. Cardiovascular eff ects of the DPP-4 inhibitors. Diab Vasc Dis Res 2012; 9(2):109–16. Dostupné z DOI: <http://doi: 10.1177/1479164111436236>.
20. Kothny W, Foley J, Kozlovski P et al. Improved glycaemic control with vildgliptin added to insulin, with or without metformin in patients with type 2 diabetes mellitus. Diabetes Obes Metab 2013; 15(3): 252–257. Dostupné z DOI: <http://doi: 10.1111/dom.12020>.
21. Laviola L, Leonardini A, Melchiorre M et al. Glucagon-Like Peptide-1 Counteracts Oxidative Stress-Dependent Apoptosis of Human Cardiac Progenitor Cells by Inhibiting the Activation of the c-Jun N-terminal Protein Kinase Signaling Pathway. Endocrinology. 2012; 153(12): 5770–5781. Dostupné z DOI: <http://doi: 10.1210/en.2012–1461>.
22. Lønborg J, Vejlstrup N, Kelbæk H et al. Exenatide reduces reperfusion Indry in patients with ST-elevation myocardial infarction. Eur Heart J 2012; 33(12):1491–1499.
23. Wing RR (ed) et al. Look AHEAD Research Group. Long-term eff ects of a lifestyle intervention on weight and cardiovascular risk factors in individuals with type 2 diabetes mellitus: four-year results of the Look AHEAD trial. Arch Intern Med 2010; 170(17): 1566–1575.
24. Lukashevich V, Wang M, DelPrato S et al. Vildagliptin efficacy and safety in patients with type 2 diabetes inadfequately controlled on dual metformin plus sulfonylurea therapy. Poster 856. Presented at the 48th EASD 2012, 1–5th Oct, Berlin, Germany.
25. Makdissi A, Ghanim H Vora M et al. Sitagliptin exerts an antinfl ammatory action. J Clin Endocrinol Metab 2012; 97(9): 3333–3341. Dostupné z DOI: <http://doi:10.1210/jc.2012–1544>.
26. Nathan DM, Cleary PA, Backlund JY et al. Diabetes Control and Complications Trial/Epidemiology of Diabetes Interventions and Complications (DCCT/EDIC) Study Research Group. Intensive diabetes treatment and cardiovascular disease in patients with type 1 diabetes. N Engl J Med 2005; 353(25): 2643–2653.
27. Nauck MA, Meininger G, Sheng D (eds) et al. Sitagliptin Study 024 Group (2007). Efficacy and safety of the dipeptidyl peptidase-4 inhibitor, sitagliptin, compared with the sulfonylurea, glipizide, in patients with type 2 diabetes inadequately controlled on metformin alone: a randomized, double-blind, non-inferiority trial. Diabetes Obes Metab 2007; 9(2): 194–205.
28. Nikolaidis LA, Mankad S, Sokos GG et al. Effects of glucagon like peptide -1 in patients with accute myoacardial infarction and left ventricular dysfunction after successful reperfusion. Circulation 2004; 109(8): 962–965.
29. Owens DR, Swallow R, Dugi KA et al. Efficacy and safety of linagliptin in persons with type 2 diabetes inadequately controlled by a combination of metformin and sulphonylurea: a 24-week randomized study. Diabet Med 2011; 28(11):1352–1361.
30. Pratley RE, Rosenstock J, Schweizer A et al. Management of Type 2 diabetes in treatment –naive elderly patients. Diabetes Care 2007; 30(12): 3017–3020.
31. Read PA, Khan FZ, Heck PM et al. DPP-4 inhibition by sitagliptin improves myocardial response to dobutamine stress and mitigate stunning in a pilot study of patients with acute coronary syndrome. Circ Cardiovasc Image 2010; 3 : 195–201.
32. Scheen A, Paquot N. Gliptin versus a sulphonylurea as add-on to metformín. The Lancet 2012; 380(9840): 450–452.
33. Schweizer A, Dejager S, Bosi E. Comparison of vildagliptin and metformín monotherapy in elderly patients with type 2 diabetes: a 24-week, double-blind, randomized trial Diabetes, Obesity and Metabolism 2009; 11(8): 804–812.
34. Schweizer A, Couturier A, Foley JE et al. Comparison between vildagliptin and metformin to sustain reductions in HbA1c over 1 year in drug-naive patients with Type 2 diabetes. Diabetic Medicine 2007; 24(9): 955–961.
35. Schweizer A, Dejager S, Foley JE et al. Assessing the cardio-cerebrovascular safety of vildagliptin: meta-analysis of adjudicated events from a large Phase III type 2 diabetes population. Diabetes Obes Metab 2010; 12(6): 485–494.
36. Takahashi M Role of the SDF-1/CXCR4 system in myocardial infarction. Circ J 2010; 74(3): 418–423.
37. Taskinen MR, Rosenstock J, Tamminen I et al. Safety and efficacy of linagliptin as add-on therapy to metformin in patients with type 2 diabetes: a randomized, double-blind, placebo-controlled study. Diabetes Obesity and Metabolism 2011; 13(1): 65–74.
38. Gerstein HC, Miller ME, Byington RP (eds) et al. The Action to Control Cardiovascular Risk in Diabetes Study Group. Effect of intensive glucose lowering in patients with type 2 diabetes. N Engl J Med 2008; 358(24): 2545–2559.
39. Patel A, MacMahon S, Chalmers J (eds) et al. The ADVANCE Collaborative Goup. Intensive blood glucose kontrol and Vascular Outcomes in type 2 diabetes. ADVANCE N Engl J Med 2008; 358(24): 2560–2569.
40. Finfer S, Chittock DR, Su SY (eds) et al. The NICE-SUGAR Study Investigators. Intensive versus Conventional Glucose Control in Critically Ill Patients. N Engl J Med 2009; 360(13): 1283–1297.
41. Gerstein HC, Bosch J, Dagenais GR (eds) et al. The Origin Trial Investigators. Basal Insulin and Cardiovascular and Other Outcomes in Dysglycemia. N Engl J Med 2012; 367(4): 319–328.
42. Trajenta® (linagliptin) tablets. EMA Summary of Product Characteristics. Approval 25 September 2011. Dostupné z WWW: <http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_-Product_Information/human/002110/WC500115745.pdf>.
43. Vilsboll T, Rosenstock J, Yki-Järvinen H et.al. Efficacy and safety of sitagliptin when added to insulin therapy in patients with type 2 diabetes. Diabetes Obes Metab 2010; 12(2): 167–177.
44. Zaruba MM, Theiss HD et al. Synergy between CD26/DPP-IV inhibition and G-CSF improves cardiac function during acute myocardial infarction. Cell Stem Cell 2009; 4(4): 313–323.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Forum Diabetologicum

2013 Issue 2
-
All articles in this issue
- Dermoepidermálne štepy v liečbe chronických defektov diabetickej nohy: kazuistika
- Syndrom diabetické nohy: nezávislý prediktor kardiovaskulární a cerebrovaskulární morbidity a mortality?
- Diabetická neuropatia: klinický obraz a súčasné možnosti diagnostiky a liečby
- Diabetická nefropatia: epidemiológia a diagnostika
- „Ušitie inzulínovej liečby na mieru pacientovi“: kazuistika
- Léčba hypertenze u pacientů s diabetes mellitus 2. typu
- Diabetická noha: epidemiologické údaje a aktuálne možnosti lokálnej liečby
- Patofyziologické aspekty syndrómu diabetickej nohy
- Rádiointervenčná diagnostika a terapia diabetickej nohy
- Aktuálne indikačné obmedzenia pre gliptíny, agonisty GLP1-receptorov a bazálne analógy inzulínu
- Manažment hypertriacylglycerolémie z pohľadu najnovších odporúčaní Americkej endokrinologickej spoločnosti (The Endocrine Society)
- Forum Diabetologicum
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Diabetická neuropatia: klinický obraz a súčasné možnosti diagnostiky a liečby
- Manažment hypertriacylglycerolémie z pohľadu najnovších odporúčaní Americkej endokrinologickej spoločnosti (The Endocrine Society)
- Diabetická nefropatia: epidemiológia a diagnostika
- Patofyziologické aspekty syndrómu diabetickej nohy
