Diabetická noha: epidemiologické údaje a aktuálne možnosti lokálnej liečby
Diabetic foot: epidemiological data and current topical treatment options
Risk of diabetic foot amputation is 15–40 times higher than in the general population and is linked to diabetic foot syndrome (SDN), a condition defined as infection, ulceration and / or tissue destruction as a result of foot neuropathy and / or ischemia. SDN in the course of the disease may develop in up to 15% of patients with diabetes mellitus. SDN prevalence in developed form (presence of defects / ulceration), according to several authors in the range of 3–10% of all diabetics, the annual incidence is 2–11%. Advanced stages as defects complicated by osteomyelitis or gangrene, develop in about 2.2 to 4% of patients. Amputation power leg is still evaded about 0.25 to 1.8% of patients per year. According to data from NCZI in 2011, when the total number of reported patients with diabetes mellitus was 336,552, foot lesions were observed in 2.3% of patients, what represents just a slight decline in comparison to the previous years. According to the various sources, the risk of amputation could be reduced by up to 40–85%. It requires active search for patients at risk, early detection of defects, good organization of care, establishing podiatric centers, functioning interdisciplinary care (cooperation between diabetologist, surgeon, podiatrist, neurologist, orthoprotetist or dermatologist), well-led treatment and education and cooperation of patients . In addition to traditional pillars of treatment, such as optimization of metabolic control, treatment of blood circulation, treatment of neuropathy, infection or relieving a local treatment with lots of modern dressings materials, has recently appeared several newer methods that are currently now in Slovakia.
Maggot therapy. In the treatment of diabetic wounds larvae successfully used on infected wounds, especially in multi-drug resistant pathogens cultured (for example, Pseudomonas aeruginosa, MRSA, etc). They are used to aseptically reared larvae of Lucilia sericata. They are applied directly to the dregs of the defect. Feed on dead and infected tissue and act as “biological knife” and defect perfectly mechanically cleaned, and do not attack healthy tissue. Debridement is essential for the subsequent start of the process of healing and even accentuate their biologically active substances contained in the saliva of the larvae.
Treatment with controlled vacuum (Vacuum assisted Closure Therapy – VAC). It is used as an effective method for promoting granulation and speed up the natural healing process in larger defects including. When applying negative pressure to the puncture increases capillary blood flow, reduces the interstitial edema and also bacterial colonization defect suction inflammatory debris that contributes to the promotion of granulation base of the defect and fundamental accelerating all phases of healing.
Treatment with live cell lines – Apligraf. It is a method intended primarily for the treatment of chronic, non-healing wounds are long using live cells from human skin (fibroblasts and keratinocytes) technologically processed into double-layer formulation, which in structure resembles the skin. This is not a skin graft. Essence of the method lies in the fact that the cells produce a product delivered to the wound a number of biologically active factors what exactly are growth factors and cytokines that promote the healing process of the wound itself.
Other newer methods include treatment with blood concentrate rich in platelets, special dressings and other materials.
Key words:
diabetic foot – maggot therapy – treatment with controlled vacuum – treatment with live cell lines
Authors:
E. Martinka
Authors‘ workplace:
MMM Consulting, Bratislava
; Národný endokrinologický a diabetologický ústav, diabetologické oddelenie, primár doc. MUDr. Emil Martinka, PhD., Ľubochňa
Published in:
Forum Diab 2013; 2(2): 74-83
Category:
Overview
Riziko amputácie nohy u diabetikov je 15–40-krát vyššie než v bežnej populácii a súvisí so syndrómom diabetickej nohy (SDN), čo je stav definovaný ako infekcia, ulcerácia alebo deštrukcia tkanív nohy v dôsledku neuropatie alebo ischémie. SDN sa v priebehu ochorenia môže rozvinúť až u 15 % pacientov s diabetes mellitus. Prevalencia SDN v rozvinutej forme (prítomnosť defektu/ulcerácie) sa podľa viacerých autorov pohybuje v rozsahu 3–10 % všetkých diabetikov, pričom ročná incidencia je 2–11 %. Pokročilé štádiá, ako defekty komplikované osteomyelitídou alebo gangrénou, sa vyvinú asi u 2,2–4 % pacientov. Amputačnému výkonu na nohe sa ešte stále nevyhne asi 0,25–1,8 % pacientov ročne. Podľa údajov UZIŠ z roku 2011 bola pri celkovom počte vykázaných pacientov s diabetes mellitus 336 552, noha s léziou zaznamenaná u 2,3 % pacientov, čo predstavuje oproti predošlým rokom mierny pokles. Podľa viacerých zdrojov by sa riziko amputácie dalo znížiť až o 40–85 %. Vyžaduje si to aktívne vyhľadávanie rizikových pacientov, včasnú detekciu defektov, dobrú organizáciu starostlivosti, zakladanie podiatrických centier, fungujúcu medziodborovú starostlivosť (spolupráca medzi diabetológom, chirurgom, podiatrom, neurológom, ortoprotetikom, prípadne dermatológom), dobre vedenú liečbu, ako aj edukáciu a spoluprácu pacientov. Okrem klasických pilierov liečby, ako je optimalizácia metabolickej kontroly, úprava prekrvenia, liečba neuropatie, infekcie či odľahčenie a lokálna liečba s množstvom moderných preväzových materiálov, sa v poslednom období objavilo aj niekoľko novších metód, ktoré sú v súčasnej dobe už aj na Slovensku
Larvoterapia. Pri liečbe diabetických rán sa larvy s úspechom používajú pri infikovaných ranách, obzvlášť pri vykultivovaní multirezistentných patogénov (napr. Pseudomonas aeruginosa, MRSA a pod). Využívajú sa sterilne chované larvy bzučivky zelenej (Lucilia sericata). Aplikujú sa priamo na spodinu defektu. Požierajú mŕtve a infikované tkanivo a pôsobia ako „biologický nôž“ a defekt dokonale mechanicky vyčistia, pričom zdravé tkanivo nenapádajú. Vyčistenie rany je základným predpokladom pre následné naštartovanie procesov hojenia a akcentujú ich aj biologicky aktívne látky obsiahnuté v slinách lariev.
Liečba riadeným podtlakom (Vacuum Assited Closure Therapy – VAC). Využíva sa ako účinná metóda pre podporu granulácie a urýchlenie prirodzeného hojenia pri rozsiahlejších defektoch. Pri aplikácii podtlaku sa v defekte zvyšuje kapilárny prietok krvi, redukuje sa edém interstícia a tiež kolonizácia defektu baktériami odsávaním zápalového detritu, čo prispieva k podpore granulácie spodiny defektu a zásadnému urýchleniu všetkých fáz hojenia.
Liečba pomocou živých bunkových línií – Apligraf. Ide o metódu primárne určenú na liečbu chronických, dlhodobo sa nehojacich rán pomocou aplikácie živých buniek z ľudskej kože (fibroblasty a keratinocyty) technologicky spracovaných do dvojvrstvového preparátu, ktorý sa svojou štruktúrou podobá koži. Nejde však o kožný transplantát. Podstata metódy spočíva v tom, že bunky prípravku produkujú a do rany dodávajú celý rad biologicky aktívnych pôsobkov, čo sú vlastne rastové faktory a cytokíny, ktoré podporujú proces hojenia v samotnej rane.
Medzi ďalšie novšie metódy patrí liečba pomocou krvného koncentrátu bohatého na trombocyty, špeciálne preväzové materiály a iné.
Kľúčové slová:
diabetická noha – larvoterapia – liečba pomocou živých bunkových línií – liečba riadeným podtlakom
Diabetická noha: epidemiologické údaje
Diabetické komplikácie nohy sú v rozvinutých krajinách najčastejšou príčinou amputácií na dolných končatinách z iných ako poúrazových príčin, pričom riziko amputácie nohy u diabetikov je 15–40-krát vyššie než v bežnej populácii. Drvivá väčšina diabetických komplikácií nohy vedúcich k amputácii súvisí so syndrómom diabetickej nohy. Takýto nález predchádza amputácii až v 85 % [19].
Syndróm diabetickej nohy
Komplikácia označovaná ako syndróm diabetickej nohy (alebo zjednodušene „diabetická noha”) je podľa WHO definovaná ako infekcia, ulcerácia alebo deštrukcia tkanív nohy v dôsledku neuropatie alebo ischémie. Táto komplikácia sa v priebehu ochorenia môže rozvinúť až u 15 % pacientov s diabetes mellitus (tab. 1).

Z hľadiska pacienta ide o komplikáciu, ktorá silne ovplyvňuje jeho ďalší život, a to zdravotne, psychicky aj sociálne. Z hľadiska každodennej praxe ide o medicínsky, časovo aj finančne veľmi náročný problém a o jednu z najčastejších príčin hospitalizácie diabetických pacientov. Hospitalizácie pre diabetickú nohu patria zároveň k najdlhšie trvajúcim. Priemerná doba hojenia diabetickej ulcerácie sa pohybuje medzi 11–14 týždňami. V NEDU v Ľubochňi bolo v roku 2012 z dôvodu indikácie diabetickej nohy vyšetrených spolu 625 pacientov, z toho hospitalizovaných bolo 265 pacientov, čo predstavovalo cca 19 % spomedzi všetkých hospitalizácií.
Prevalencia diabetickej nohy (DN) v rozvinutej forme (prítomnosť defektu/ulcerácie) sa podľa viacerých autorov pohybuje v rozsahu 3–10 % všetkých diabetikov, pričom ročná incidencia sa uvádza medzi 2–11 % (tab. 1, obr. 3) Pokročilé štádiá, ako sú defekty komplikované osteomyelitídou alebo gangrénou, sa vyvinú asi u 2,2–4 % pacientov. Môžu viesť k odumretiu tkanív postihnutej časti nohy a vyžadovať amputáciu, ale tiež k rýchlemu šíreniu sa infekcie a ohrozovať život pacienta septickou reakciou. Amputačnému výkonu na nohe sa ešte stále nevyhne asi 0,25–1,8 % pacientov ročne, pričom v prevahe prípadov ide o amputácie pod členkom. Komplikácia je častejšia u mužov (1,6-krát), výskyt narastá s vekom pacienta (maximum medzi 45.–65. rokom života) a závisí aj od etnickej príslušnosti. Rekurencia zhojenej ulcerácie v priebehu 5 rokov sa uvádza až 50–70 %. Mortalita po amputácii v priebehu 5 rokov sa uvádza u 39–68 % pacientov a je porovnateľná s mortalitou pri malignitách [19].
Podľa údajov NCZI z roku 2011, bola pri celkovom počte vykázaných pacientov s diabetom (336 552) noha s léziou zaznamenaná u 2,3 % pacientov, čo predstavuje oproti predošlým rokom iba minimálny pokles. V porovnaní s údajmi vo svete sa síce jedná o výskyt na dolnej hranici, amputačný výkon sa však v rovnakom roku uskutočnil až u 1,23 % z celkového počtu diabetikov, čo predstavovalo cca 41% amputovanosť. Podobne ako pri iných komplikáciách aj pri diabetickej nohe je v našej krajine pozoruhodná rozdielna prevalencia tejto komplikácie. V roku 2011 bola najvyššia prevalenia nohy s diabetickou léziou vykázaná v Trnavskom kraji (4,3 %), najnižšia v Prešovskom kraji (1,6 %). V Prešovskom kraji však bola najvyššia amputovanosť a to až 87 % pri celoslovenskom priemere 53 % [25].
Typy diabetických defektov na nohách a ich hlavné príčiny
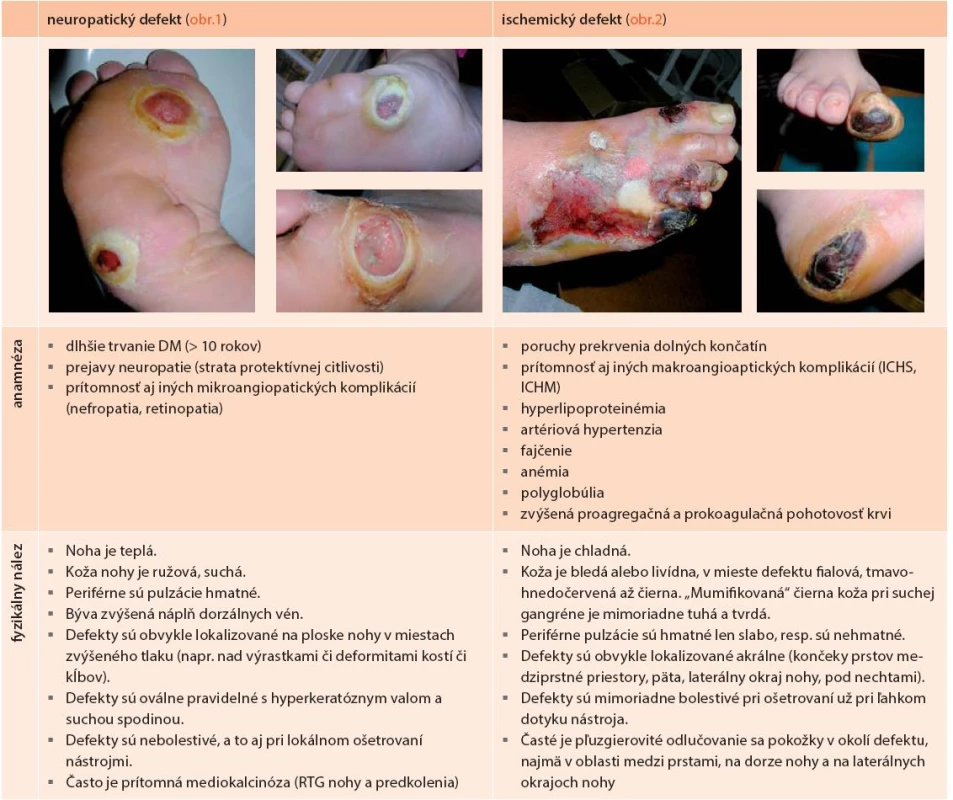
Diabetes mellitus k rozvoju diabetickej nohy prispieva hneď niekoľkými spôsobmi. Kľúčovú úlohu však zohráva prítomnosť neuropatie s oslabením až stratou ochrannej citlivosti, v dôsledku čoho dochádza k nespoznaným poraneniam kožného krytu s následnou infekciou, k čomu napomáha aj autonómna neuropatia vedúca k tvorbe zníženej potivosti, tvorbe hyperkeratóz, ich praskaniu a zníženej odolnosti kože na tlak či trenie pri chôdzi. Ďalším dôležitým faktorom sú poruchy prekrvenia z makro ale aj mikrovaskulárneho poškodenia a vyššia vnímavosť k infekciám. Diabetické defekty na nohách sa obvykle delia na neuropatické (45–62 %), ischemické (7–13 %) a neuroischemické (25–45 %), a tie na infikované a bez klinických prejavov infekcie. Pre klasifikáciu nálezu na nohe (napriek niektorým nedostatkom) najčastejšie používame klasifikáciu podľa Wagnera (tab. 3), ktorá vychádza z rozsahu poškodenia (defektu) a má aj dokázanú prognostickú hodnotu (obr. 4). V poslednej dobe, najmä v prípade infikovaného defektu, sa využíva aj klasifikačný systém PEDIS (tab. 4). Hlavné charakteristiky neuropatického (obr. 1) a ischemického (obr. 2) defektu sú uvedené v tab. 2.


Predisponujúcim terénom zvyšujúcim riziko syndrómu diabetickej nohy sú vrodené a získané deformity nôh a poruchy biomechaniky chôdze. Riziko rozvoja diabetickej nohy sa tiež zvyšuje, ak je pacient fajčiar, má vysoký krvný tlak, poruchu metabolizmu tukov, resp. ak má rozvinuté ďalšie mikrovaskulárne a makrovaskulárne komplikácie (najmä diabetickú nefropatiu a retinopatiu). Pri ich liečbe sa postupuje podľa štandardných postupov [19,21].
Novšie metódy lokálnej liečby diabetických ulcerácií
V podpornej neuroprotektívnej liečbe sa veľmi dobré výsledky dosahujú podávaním kyseliny thioktovej, s významným ústupom subjektívnych ťažkostí (parestézie, dysestézie), ale aj objektívnych prejavov, potvrdených v randomizovaných placebom kontrolovaných štúdiách. Ďalším prípravkom s potvrdeným priaznivým efektom sú vitamíny skupiny B (benfotiamín, kyanokobalamín) vo forme rozpustnej v tukoch. V liečbe neuropatickej bolesti sa s dobrým efektom využívajú antiepileptiká, najmä gabapentín a pregabalín a novšie antidepresíva (duloxetin).
V rámci lokálnej liečby neuropatických defektov je kľúčovým faktorom dôsledný debridement (odstránenie nekrotického, devitalizovaného a infikovaného tkaniva). Uprednostňujú sa vlhké resp. nevysúšajúce antimikrobiálne, neadhezívne a neadherujúce preväzové techniky.
Pri ischemickej nohe a ischemických defektoch je okrem základnej liečby nevyhnutným predpokladom zlepšenie (obnovenie) prekrvenia, pričom za najúčinnejší spôsob možno považovať intervenčnú revaskularizáciu. Z farmakologických možností s priaznivým ovplyvnením ischémie treba spomenúť liečbu prostaglandínom (alprostadil). V lokálnej liečbe gangrény dominujú suché dezinfekčné postupy a nekrektómia s následnou podporou granulácie a epitelizácie nevysušujúcimi prípravkami s antimikrobiálnymi vlastnosťami.
V poslednej dobe k vyššie uvedeným základným faktorom pribudli aj ďalšie dôležité momenty ako znížená odolnosť voči infekcii, funkčné zmeny mikrocirkulácie a abnormality v expresii a aktivite rastových faktorov a cytokínov, ktoré sa zúčastňujú hojenia. Tieto faktory sa podieľajú predovšetkým na zhoršenom hojení diabetických defektov (ulkusov a rán).
Keďže základným terapeutickým prístupom v liečbe diabetickej nohy bolo v posledných rokoch v slovenskej literatúre venované pomerne veľa prác [16,18–21], na tomto mieste sa zaoberáme len niektorými novšími možnosťami liečby ako je podpora granulácie riadeným podtlakom, biologický debridement s využitím lariev, podpora granulácie a epitelizácie u dlhodobo sa nehojacich defektov pomocou cytokínov, rastových faktorov a ďalších komponentov prostredníctvom aplikácie živých bunkových línií, či liečba defektov a ischémie terapeutickou angiogenézou pomocou autotransplantácie kmeňových/progenitorových buniek z kostnej drene alebo periférnej krvi.
Biologický debridement s využitím lariev bzučivky zelenej (maggot therapy)
Využívanie lariev bzučivky zelenej larvoterapia alebo v anglickej literatúre maggot therapy ako metódy biologického debridementu pri liečbe rán má svoju dlhú históriu, ktorá siaha až do dôb antiky, či mayskej kultúry. Po zavedení antibiotík (ATB) táto metóda ustúpila. V posledných rokoch sa opäť teší záujmu najmä v súvislosti s chronickými, dlhodobo sa nehojacimi diabetickými ulkusmi infikovanými multirezistentnými bakteriálnymi kmeňmi [29,30].
Debridement (odstránenie devitalizovaných, nekrotických a infikovaných tkanív) sa považuje za základný predpoklad pre hojenie chronických diabetických defektov. Mnohé neuropatické a venózne defekty sú infikované multirezistentnými baktériálnymi kmeňmi ako Staphylococcus aureus, methicilín rezistentný Stahylococcus aureus (MRSA), Pseudomonas aeruginosa a pod. Klasický debridement býva náročný pre bolesť (venózne defekty) alebo anatomický charakter defektu a ATB ani lokálna liečba nevedú k zlepšeniu klinického nálezu. Alternatívou u takýchto pacientov môže byť práve aplikácia lariev Bzučivky zelenej (Lucilia sericata), ktoré sa využívajú pre ich schopnosť diferencovane prostredníctvom svojich tráviacich štiav požierať mŕtve a infikované tkanivá, čím ranu dokonale vyčistia. Zdravé tkanivo zostáva nedotknuté. Okrem mechanického efektu sa tiež predpokladá, že niektoré výlučky lariev (obsahujú allantoin, ureu, proteolytické enzýmy a ďalšie látky) majú aj antimikrobiálne účinky, čím eliminujú bakteriálne osídlenie defektu a tiež podporujú aj procesy hojenia, a to prostredníctvom amplifikácie hojivého efektu epidermálneho rastového faktora a IL6. Dochádza k stimulácii tvorby granulačného tkaniva, stimulácii rastu fibroblastov, proliferácii chondrocytov, syntéze kolagénu typ II a úlohu zohráva pravdepodobne aj „mikromasáž“. Všetky tieto účinky v konečnom dôsledku podporujú hojenie diabetických defektov [26,32].
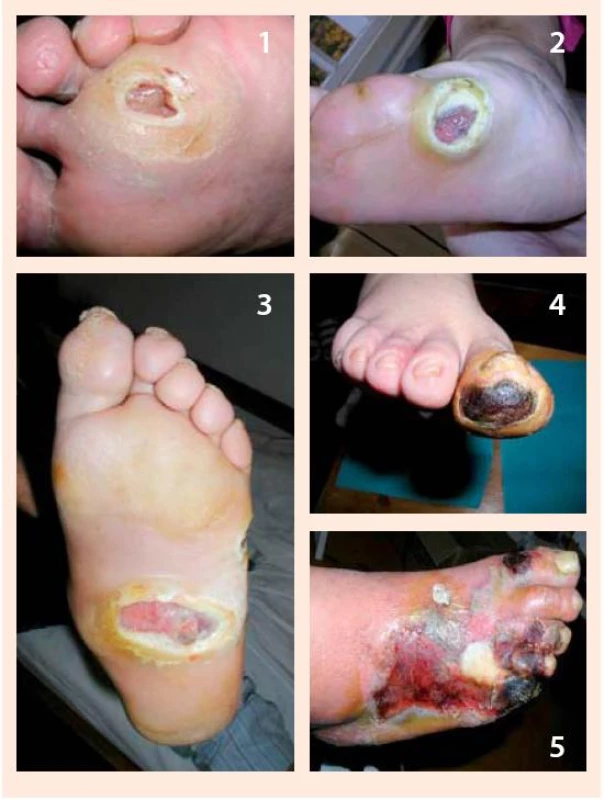
Larvy sa aplikujú priamo na spodinu defektu v počte cca 5–8/cm2 a prekryjú sa preväzom vo forme vzdušnej „klietky“, ktorá im umožňuje dýchať a súčasne bráni ich úniku z defektu. Klietka pozostáva z jednostranne lepivej hydrokoloidnej podložky, ktorá sa adaptuje na okolie defektu ako prstenec, na túto podložku sa následne pripevní jemná vzdušná tkanina dostatočne hustá aby larvy cez ňu neunikli. Larvy sa v rane ponechávajú 1–3 dni. Počas tejto doby znásobia svoju veľkosť, pričom ich metabolickú aktivitu charakterizuje žltozelený sekrét s charakteristickým pachom. Následne sa z rany vypláchnu a zničia sa ako biologický odpad benzín-alkoholom. Podľa potreby možno celý liečebný proces viackrát zopakovať. Po aplikácii lariev je možné konštatovať vyčistenie a oživenie defektu a dochádza k podstatnému urýchleniu hojenia defektu [11,23,27,29,30], obr. 5.
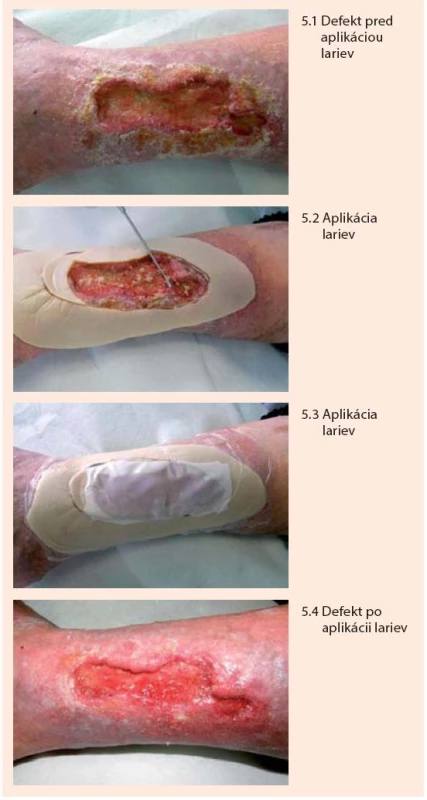
Podpora granulácie riadeným podtlakom
Liečba pomocou riadeného podtlaku, tzv. Vacuum Assited Closure Therapy (VAC) sa v ostatnom čase čoraz častejšie využíva ako veľmi účinná metóda pre podporu granulácie a urýchlenie prirodzeného hojenia diabetických neuropatických ulcerácií a postamputačných defektov z rôznych príčin. K dispozícii je viacero randomizovaných kontrolovaných štúdií, ktoré dokázali, že pri použití podtlaku sa zvyšuje podiel uzatvorených diabetických defektov, skracuje sa čas hojenia a znižuje sa riziko amputácií [2–4, 8, 9, 22]. Pri tejto metóde sa na celý rozsah defektu (po predošlom dôkladnom debridemente) aplikuje špeciálna podložka zo sieťovaného polyuretánu, alebo viacvrstvovej tkaniny, ktorá slúži ako zabezpečenie mechanického rozloženia podtlaku a tiež ako „nárazníková“ zóna mechanicky ochraňujúca spodinu a okraje defektu. Na túto podložku a okolie defektu v šírke cca 2–3 cm sa adaptuje vzduchotesná fólia, ktorej súčasťou je sacia (odvádzacia) hadička, ktorá sa pripája na samotnú pumpu. Pumpa vytvára podtlak v rozsahu od mínus 50 po mínus 250 mm Hg. Podtlak je možné aplikovať kontinuálne alebo prerušovane. Dnes je na trhu viacero podtlakových púmp, kde sa podtlak dosahuje pomocou motora alebo ručným pumpovaním. Princíp liečby je rovnaký, odlišnosti sú v postupe adaptácie odsávacieho setu na defekt, možnostiach nastavenia niektorých parametrov a prenosnosti pumpy.
Pri aplikácii podtlaku sa v defekte zvyšuje kapilárny prietok krvi, redukuje sa edém interstícia a tiež kolonizácia defektu baktériami odsávaním zápalového detritu, čo komplexným spôsobom prispieva k podpore granulácie spodiny defektu a zásadnému urýchleniu hojenia [3,4,13,22,28]. Systém sa ponecháva 2–3 dni. Metóda je bezpečná a celý proces možno viackrát zopakovať (obr. 6).
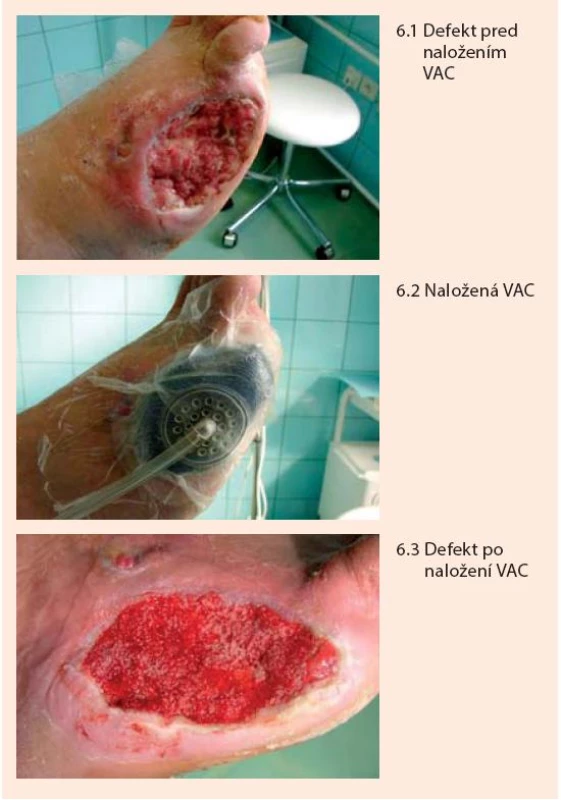
Liečba riadeným podtlakom sa využíva predovšetkým na urýchlenie liečby rozsiahlejších a hlbších neuropatických defektov a postamputačných defektov. Existujú však určité rozdiely v taktike aplikácie podtlaku v závislosti, či sa jedná o postamputačný defekt pre ischémiu alebo neuropatiu resp. osteomyelitídu. Pri neuroaptických defektoch, ktoré sú dobre prekrvené, je možné aplikovať vyšší podtlak (obvykle mínus 150 až mínus 175 mm Hg) a to kontinuálne, bez prerušenia počas celých troch dní. Pri postamputačných defektoch, dôvodom ktorých bola ischémia (gangréna), indikácia použitia pumpy závisí od kvality prekrvenia a je vhodné ak súčasťou chirurgického výkonu bol aj revaskularizačný zákrok. Aj v tom prípade je vhodnejšie podtlak aplikovať v nižšej úvodnej intenzite 50–75 mm Hg (aby nedošlo ku kolapsu mikrocirkulácie) a prerušovane, v trvaní do dvoch dní s následným vyhodnotením efektu. V týchto prípadoch sa ako výhodné javí doplniť liečbu podtlakom paralelným podávaním prostaglandínov v intravenóznej infúzii. Aplikácia vyššieho podtlaku u pacientov s ischémiou býva bolestivá a výsledok môže byť kontraproduktívny. Granulácie (pokiaľ sa dosiahnu) nie sú plnohodnotné a dobre prekrvené rýchlo zanikajú, čo môže viesť aj k zhoršeniu lokálneho nálezu. Pri defektoch a postamputačných ranách, pri ktorých sú odkryté kosti, resp. ich pahýle, je rozhodujúcim momentom dosiahnutie ich prekrytia plnohodnotným granulačným tkanivom. VAC možno použiť aj na „zlepenie“ podmínovaných okrajov defektu k spodine. Predpokladom je vždy predošlé vyriešenie známok eventuálnej infekcie. Po vyplnení defektu možno aj u ischemických defektov použiť vyššiu a kontinuálnu aplikáciu podtlaku. Samotné gangrény ani postamputačné ischemické defekty bez súčasnej revaskularizácie a osteomyelitické komplikácie liečiť podtlakom nie je vhodné.
Dermoepidermálne štepy a „mesh“ plastika
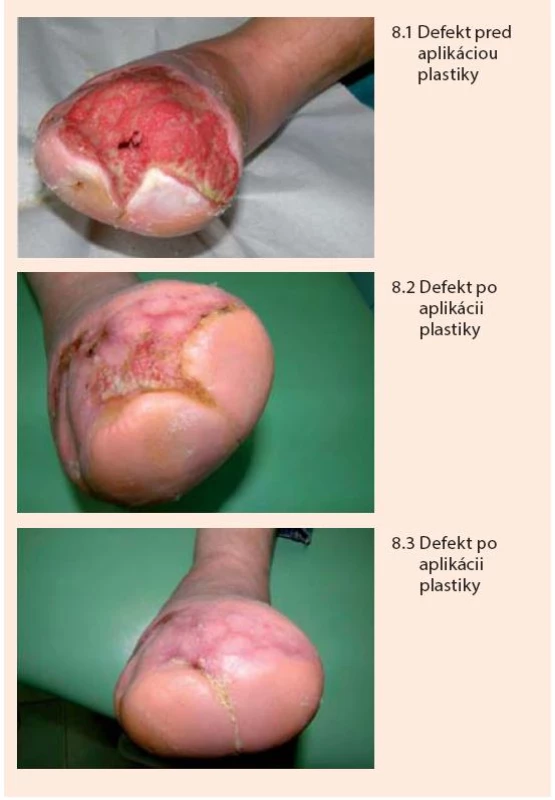
V prípade rozsiahlych defektov a postamputačných rán (nezávisle na etiológii), ktoré by sa hojili veľmi dlho a boli by vystavené riziku infekcie a mechanickému dráždeniu, je potrebné po zvládnutí eventuálnej infekcie podporiť vyplnenie defektu zdravým, dobre prekrveným granulačným tkanivom a následne podľa klinickej úvahy defekt prekryť dermoepidermálnym autotransplantátom. Možno použiť väčšie kožné štepy prekrývajúce celý defekt, alebo viacero menších (niekoľko milimetrov) štepov, ktoré sa transplantujú na spodinu defektu ako ostrovčeky (tzv. mesh plastika). Ostrovčeky sa obvykle odoberajú z prednej strany a hornej polovice kože stehna.
Po naložení sa ostrovčeky rozrastú a prepitelizujú okolie, čím sa následne spoja do súvislého kožného krytu (obr. 8).
Liečba pomocou živých bunkových biopreparátov
Porucha hojenia rán a ich častý prechod do chronicity, je charakteristickým problémom u pacientov s diabetes mellitus. Takéto defekty sú vystavené riziku infekcie a jej progresie na hlbšie štruktúry vrátane kosti a kĺbov, keď často jediným riešením zostáva amputácia. Pri dlhodobo sa nehojacich defektoch napriek využitiu obvyklých terapeutických postupov, po zvládnutí infekcie a pri dostatočnom krvnom zásobení je aktuálnou metódou snaha o nabudenie hojivých procesov vlastnej kože vytvorením prostredia (cytokíny, rastové faktory) pomocou živých bunkových prípravkov podobných koži, ktoré takéto prostredie vytvárajú. Takouto metódou je použitie bunkového preparátu Apligraf (obr. 7). Ide o biologicky aktívny biopreparát (nie transplantát) pozostávajúci z dvoch vrstiev živých buniek kože (keratinocyty, fibroblasty) v extracelulárnej matrix, technologicky spracovaný spôsobom, že sa podobá ľudskej koži. Na rozdiel od kože však neobsahuje melanocyty, makrofágy, lymfocyty, cievy, vlasové folikuly ani potné žľazy. Bunky pre prípravu preparátu sa získavajú z kmeňových línií buniek prvotne získaných z predkožky novorodencov, ktoré sa vyznačujú vysokou proliferačnou a hojivou aktivitou. Prípravok je zdrojom viac ako 46 rastových faktorov, cytokínov, antimikrobiálne a analgeticky pôsobiacich produktov buniek (EGF, VEGF, Stem Cell Factor, PDGF, matricové proteíny, antimikrobiálne peptidy), ktoré aktivujú hojivé procesy v samotnej rane a súčasne pôsobí ako ochranná bariéra [1,6,25]. Aplikuje sa priamo na spodinu defektu po predošlej príprave, ktorá spočíva v dôslednom agresívnom debridemente až po zdravé dobre prekrvené tkanivá. Prípravok tak súčasne slúži aj ako bariéra proti infekcii, mechanickému tlaku a vysychaniu defektu [1]. Indikáciou pre aplikovanie Apligrafu u pacientov s diabetes mellitus sú dlhodobo sa nehojace neuropatické defekty a venózne defekty (ulcera cruris) napriek využitiu bežných dostupných postupov. Randomizované štúdie v oboch indikáciách dokázali signifikatne väčší podiel vyhojených defektov (cca o 30–50 %) v porovnaní so štandardnou liečbou ako aj signifikantné skrátenie času (cca o 30–50 %) potrebného na zhojenie defektu a nižšiu rekurenciu defektov [7,10,31]. Kontraindikáciou použitia je prítomnosť klinicky významnej infekcie a známa alergia na bovinný kolagén obsiahnutý v extracelulárnej matrix prípravku. Efektívnosť liečby znižuje nedostatočné arteriálne prekrvenie. Apligraf po jeho „vyrobení“ má životnosť cca 5 dní a musí byť uskladňovaný pri teplote cca 21–30 ºC. Po otvorení balenia musí byť aplikovaný v priebehu niekoľkých minút. Pred naložením Apligrafu je nutné preparát „aktivovať“ vytvorením drobných rezov pomocou skalpela na niekoľkých miestach. Zmyslom tohto postupu je zvýšiť intenzitu uvoľňovania humorálnych faktorov do rany. Apligraf je potrebné po okrajoch prifixovať k okolitej koži, aby sa zabránilo jeho posunutiu a znehodnoteniu. Na prekrytie Apligrafu sa používajú špeciálne neadhezívne a nesavé silikónové preväzy, aby sa zabránilo odsávaniu humorálnych faktorov do preväzu a prirasteniu preväzu do rany. Na takýto primárny preväz sa potom naloží sekundárny preväz pozostávajúci obvykle zo sterilných štvorcov gázy v niekoľkých vrstvách a ktorý súčasne slúži aj ako tlaková fixácia Apligrafu na ranu. Primárny preväz je potrebné nechať bez zásahu cca 7–10 dní. Sekundárny preväz je možné aktualizovať po 4–5 dňoch od naloženia. V našej praxi sme sa pri venóznych ulkusoch stretli aj so situáciou, keď sa epitelizácia aktivovala nielen po okrajoch, ale aj v strede defektu, kde sa začali vytvárať akési epitelizačné ostrovčeky. Domnievame sa, že by to mohlo súvisieť s aktiváciou a následnou diferenciáciou prítomných prekurzorových (kmeňových) buniek kože príslušnými rastovými faktormi. Tieto nálezy však bude potrebné vyhodnotiť u viacerých pacientov. Efekt liečby je v niektorých prípadoch možné zvýšiť opakovaným podaním Apligrafu [31].
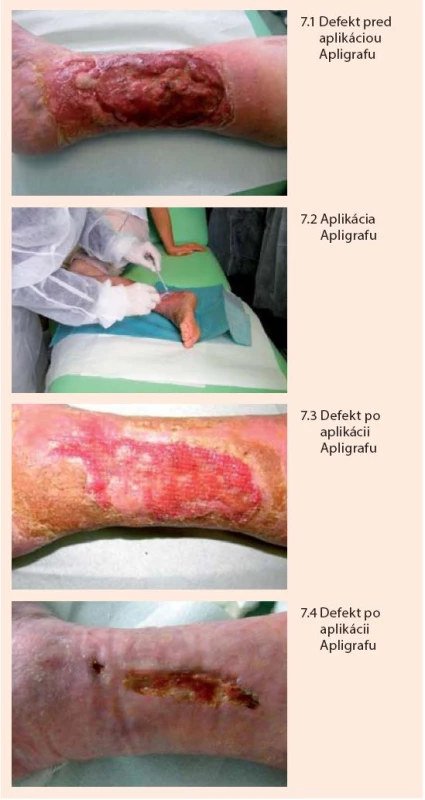
Rastové faktory
Aplikácia rastových faktorov (recombinant human platelet-derived growth factor-BB, granulocyte colony-stimulating factor), ktoré sa aplikujú na spodinu alebo okraje defektu (formou spreju, gélu, alebo injekčnou aplikáciou) je perspektívnou metódou v súčasnej dobe už v praxi ale aj v rôznych fázach skúšania [17].
Liečba ischémie autotransplantáciou kmeňových/progenitorových buniek z kostnej drene alebo krvi
Využívanie kmeňových buniek v medicíne je predmetom reálnej nádeje a súčasne témou vážnych etických a právnych diskusií, nakoľko viaceré výskumy predpokladali použitie embryonálnych mezenchýmových kmeňových buniek schopných diferencovať sa na akékoľvek tkanivá. To však predpokladá zahubenie vyvíjajúceho sa jedinca a je teda z etického hľadiska neprípustné.
Kmeňové bunky podobné embryonálnym kmeňovým bunkám z rôznym potenciálom diferenciácie, ale aj iné typy kmeňových progenitorových buniek sa však nachádzajú aj v pupočníkovej krvi, a niektoré typy kmeňových progenitorových buniek pretrvávajú aj v dospelom organizme. Nachádzajú sa v tkanivách a orgánoch tela a sú zodpovedné za reparačné procesy po poranení.
Viacero štúdií z posledných rokov ukázalo, že autotransplantácia (kmeňových/progenitorových) buniek z kostnej drene alebo mononukleárnych buniek periférnej krvi, ktoré obsahujú aj progenitorové endoteliálne bunky, môže zlepšiť prognózu u pacientov s kritickou ischémiou dolných končatín, u ktorých nie je možná klasická revaskularizácia (obvyklým riešením je amputácia s vysokým podielom mortality), a to vďaka novotvorbe ciev, ktoré sú transplantované bunky schopné navodiť v postihnutom tkanive [5,12,14,15,33]. Za týmto účelom sa v jednotlivých prácach podávali neselektované bunky kostnej drene, neselektované kmeňové bunky z periférnej krvi alebo novšie, selektované bunky získané z drene alebo periférnej krvi so znakmi CD133+ a CD34+ charakteristickými pre funkčné progenitorové endoteliálne bunky. Predpokladajú sa viaceré možnosti uplatnenia sa priaznivého účinku takejto liečby. Jednou z nich je nepriamy, parakrinný efekt, že kmeňové/progenitorové bunky produkujú angiogénne faktory, ako napr. vascular endotelial growth factor, basic fibroblast growth factor, ktoré podporujú angiogenézu. Druhou možnosťou je priama tvorba nových ciev (angiogenéza) prostredníctvom prítomných progenitorových endotelových buniek [5,12,15,33].
Kmeňové/progenitorové endoteliálne bunky za účelom liečby ischémie dolných končatín sa získavajú buď z kostnej drene alebo z periférnej krvi po predošlej stimulácii humánnym rekombinantným G-CSF (granulocyte colon-stimulating factor, Neupogen), po ktorej sa zvýšene vyplavujú do krvi. Krvotvorné kmeňové bunky tvoria v periférnej krvi totiž len veľmi malú populáciu, asi 0,1 % patriacu medzi mononukleárne bunky. Majú schopnosť sa rozmnožovať a deliť na jednotlivé rady krviniek (erytrocyty leukocyty trombocyty). Po stimulácii sa ich podiel násobne zvýši (cca 10-krát) [5,15,33].
Pri separácii sa využíva diferenciálna centrifugácia (aferéza) s využitím analýzy CD-znakov pomocou prietokovej cytometrie, resp. ďalšie selekčné metódy. Získané bunky sa potom aplikujú intramuskulárne do svalov predkolenia a nohy (v niektorých prácach aj intraarteriálne), kde vyvolávajú novotvorbu ciev. Pacientovi sa teda transplantujú jeho vlastné bunky (autológna transplantácia). Keďže pacienti s diabetom a ischémiou dolných končatín obvykle majú aj koronárnu chorobu srdca, pacient by mal byť pred zákrokom vyšetrený kardiológom. Počas stimulácie Neupogenom (obvykle 10 µg/kg/deň počas 4–5 dní) vzhľadom k prokoagulačnému vedľajšiemu efektu Neupogenu by mal pacient dostávať terapeutickú antikoagulačnú liečbu [15,33]. Kmeňové bunky boli s úspechom použité tiež v liečbe nehojacich sa rán a poranení.
doc. MUDr. Emil Martinka, PhD.
martinka@nedu.sk
Národný endokrinologický a diabetologický ústav v Ľubochni
www.nedu.sk
Doručené do redakcie 17. apríla 2013
Prijaté do tlače po recenzii 17. mája 2013
Sources
1. Alvarez OM et al. A novel treatment for venous leg ulcers. Wounds 1998; 10(1): 97–104.
2. Argenta LC, Mokykwas MJ. Vacuum assisted closure – new method for wound control and treatment: clinical experience. Ann Plast Surg 1997, 38(6): 563–576.
3. Banwell P, Withey S, Holten I. The use of negative pressure to promote healing. Br J Plast Surg 1998; 51(1): 79.
4. Blume PA, Walters J, Payne W et al. Comparison of negative pressure wound therapy using vacuum-assisted closure with advanced moist wound therapy in the treatment of diabetic foot ulcers. Diabetes Care 2008; 31(4): 631–636.
5. Burt RK, Testoti A, Oyama Z et al. Autologous peripheral blood CD133+ cell implantation for limb salvage in patients with critical limb ischemia. Bone Marrow Transplantation 2010; 45(1): 111–116.
6. DeCarbo WT. Special Segment: Soft tissue matrices – Apligraf bilayered skin substitute to augment healing of chronic wounds in diabetic patients. Foot and Ankle specialist 2009; 2(6): 299–302.
7. Edmonds M. Apligraf in the treatment of neuropathic diabetic foot ulcers. Int J Low Extrem Wounds 2009; 8(1): 11–18.
8. Eneroth M, van Houtum WH. The values of debridement and vacuum-assisted closure (VAC). Therapy in diabetic foot ulcers. Diabetes Med Res Rev 2008; 24(Suppl 1): S76–80.
9. Etoz A, Kahveci R. Negative Pressure wound therapy on diabetic foot ulcers. Wounds 2007; 19(9): 250–254.
10. Falanga V, Margolis D, Alvarez O (eds) et al (Human Skin Equivalent Investigators Group). Rapid healing of venous ulcers and lack of clinical rejection with an allogenic cultured human skin equivalent. Arch Dermatol 1998, 134(3): 293–300.
11. FleischmannW, Russ M et al. Maggots? Are they really the better surgeons? Chirurg 1999; 70(11): 1340–1346.
12. Gordon PR, Leimig T, Babarin-Dorner A et al. Large – scale isolation of CD 133+ progenitor cells from G-CSF mobilized peripheral blood stem cells. Bone Marow Transplant 2003; 31(1): 17–22.
13. Greene AK, Puder M, Roy R et al. Micro deformational wound therapy: effects on angiogenesis and matrix metalloproteinases in chronic wounds of 3 debilitated patients. Ann Plast Surg 2006; 56(4): 418–422.
14. Hirsch AT. Critical limb ischemia and stem cell: research anchoring hope with informed adverse event reporting. Circulation 2006; 114(24): 2581–2583.
15. Huang P, Li S, Han M et al. Autologous transplantation of granulocyte colony – stimulating factor-mobilized peripheral blood mononuclear cells improves critical limb ischemia in Diabetes. Diabetes Care 2005; 28(9): 2155–2160.
16. Krahulec B. Diabetická polyneuropatia. In: Mokáň M, Martinka E, Galajda P (eds). Diabetes mellitus a vybrané metabolické ochorenia. Vydavateľstvo P+M: Martin 2008.
17. Kumar N, Verma A, Mishra A et al. Platelet Derived Growth Factor in Healing of Large Diabetic Foot Ulcers in Indian Clinical Set-up: A Protocol-based Approach. WebmedCentral WOUND HEALING 2013;4(2):WMC003985. Dostupné z WWW: <http://www.webmedcentral.com/article_view/3985>.
18. Martinka E. Novšie metódy v konzervatívnej limbe diabetickej nohy. Súč Klin Prax 2010; 7(1): 11–19.
19. Martinka E. Syndróm diabetickej nohy. In: Mokáň M, Martinka E, Galajda P (eds). Diabetes mellitus a vybrané metabolické ochorenia. Vydavateľstvo P+M: Martin 2008.
20. Martinka E. Manažment a liečba chronických komplikácií diabetes mellitus. Metodický list racionálnej farmakoterapie 2007; 11(41): 1–8.
21. Mištuna D. Cievne choroby dolných končatín u diabetikov. In: Mokáň M, Martinka E, Galajda P (eds). Diabetes mellitus a vybrané metabolické ochorenia. Vydavateľstvo P+M: Martin 2008.
22. Mullner T, Mrkonjic L, Kwasny O et al. The use of negative pressure to promote the healing of tissue defects: a clinical trial using the vacuum sealing technique. Br J Plast Surg 1997; 50(3): 194–199.
23. Mumcuoglu KZ, Ingber A, Gilead L et al. Maggot therapy for the treatment of diabetic foot ulcers. Diabetes Care 1998; 21(11): 2030–2031.
24. NCZI. Činnosť diabetologických ambulancií v SR 2011. Dostupné z WWW: <http://www.nczisk.sk>.
25. Organogenesis Inc. Apligraf (graftskin) label. Dostupné z WWW: <http://www.apligraf.com/professional/>.
26. Pavillard ER, Wright EA. An antibiotics from Maggots. Nature 1957; 180(4592): 916–917.
27. Rayman A, Stansfield G Woollard T et al. Use of larve in the treatment of the diabetic necrotic foot. The Diabetic Foot 1998; 1 : 7–13.
28. Saxena V, Hwang CW, Huang S et al. Vacuum assisted closure : micro deformations of wound and cell proliferation. Plast Reconst Surg 2004; 114(5): 1086–1096.
29. Sherman RA. Maggot therapy for treating diabetic foot ulcers unresponsive to conventional therapy. Diabetes Care 2003; 26(2): 446–451.
30. Sherman RA, Wyle FA, Vulpe M. Maggot debridement therapy for treatment of pressure ulcersin spinal cord injury patients. J Spinal Cord Med 1995; 18(2): 71–74.
31. Veves A, Falanga V et al. The Apligraf diabetic foot ulcers study. Graftskin, a human skin equivalent is effective in management of no infected neuropathic diabetic foot ulcers: a prospective randomized multicenter clinical trial. Diabetes Care 2001; 24(2): 290–295.
32. Vistnes LM, Lee R, Ksander GA. Proteolytic activity of blowfly larvae secretions in experimental burns. Surgery 1981; 90(5): 835–841.
33. Yang X, Wu Y, Wang H et al. Transplantation of mobilized peripheral blood mononuclear cells for peripheral arterial occlusive disease of the lower extremity. J Geriatr Cardiol 2006; 3(3): 181–183.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Forum Diabetologicum

2013 Issue 2
-
All articles in this issue
- Dermoepidermálne štepy v liečbe chronických defektov diabetickej nohy: kazuistika
- Syndrom diabetické nohy: nezávislý prediktor kardiovaskulární a cerebrovaskulární morbidity a mortality?
- Diabetická neuropatia: klinický obraz a súčasné možnosti diagnostiky a liečby
- Diabetická nefropatia: epidemiológia a diagnostika
- „Ušitie inzulínovej liečby na mieru pacientovi“: kazuistika
- Léčba hypertenze u pacientů s diabetes mellitus 2. typu
- Diabetická noha: epidemiologické údaje a aktuálne možnosti lokálnej liečby
- Patofyziologické aspekty syndrómu diabetickej nohy
- Rádiointervenčná diagnostika a terapia diabetickej nohy
- Aktuálne indikačné obmedzenia pre gliptíny, agonisty GLP1-receptorov a bazálne analógy inzulínu
- Manažment hypertriacylglycerolémie z pohľadu najnovších odporúčaní Americkej endokrinologickej spoločnosti (The Endocrine Society)
- Forum Diabetologicum
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Diabetická neuropatia: klinický obraz a súčasné možnosti diagnostiky a liečby
- Manažment hypertriacylglycerolémie z pohľadu najnovších odporúčaní Americkej endokrinologickej spoločnosti (The Endocrine Society)
- Diabetická nefropatia: epidemiológia a diagnostika
- Patofyziologické aspekty syndrómu diabetickej nohy