Je možný návrat k pôvodnej biologickej liečbe u pacienta s Crohnovou chorobou?
Is it possible to reintroduce original biological therapy in a relapsed Crohn’s disease patient?
Biological therapy has brought progress in the treatment of inflammatory bowel disease. It significantly improves the quality of patient’s life and postpones the surgical intervention. On the other hand, it raises the problem of its side effects, such as lymphoproliferative diseases in particular. Due to the risk of adverse side-effects of long-term treatment with biological agents, it is necessary to consider the options for stopping biological treatment without increasing the risk of relapse. In the case of relapse following discontinuation of biological therapy due to deep remission, it should be noted that in most cases it is possible to return to the previous biological therapy. In the vast majority of patients, the reintroduction of therapy is successful, and well tolerated. In our case we present a patient with Crohn‘s disease in deep remission during infliximab therapy and acute exacerbation after its discontinuation. The readministration was successful and no complications were recorded one and half years after the cessation of infliximab therapy.
Key words:
biological therapy – infliximab antibodies – TNF-alpha inhibitors risk of malignancy
:
T. Zamborský; B. Desatová; I. Páv; M. Bátovský
:
Gastroenterologická klinika SZU a UNB Bratislava
:
Gastroent Hepatol 2011; 65(1): 33-35
:
IBD: Case Report
Biologická liečba priniesla pokrok v liečení nešpecifických črevných zápalov. Pacientom na jednej strane výrazne zlepšuje kvalitu života a vzďaľuje ich od chirurgickej intervencie, avšak na druhej strane vyvstáva problém jej nežiaducich účinkov, akými sú najmä lymfoproliferatívne ochorenia. Práve z dôvodu rizika vzniku nežiaducich účinkov dlhodobej liečby biologikami je potrebné zamyslieť sa nad možnosťami, kedy biologickú liečbu ukončiť tak, aby sme minimalizovali riziko relapsu ochorenia. V prípade, že relaps ochorenia po vysadení biologickej liečby z dôvodu hlbokej remisie predsa vznikne, je potrebné si uvedomiť, že vo väčšine prípadov je možné sa k pôvodnej biologickej liečbe znovu vrátiť. U veľkej väčšiny pacientov je znovunasadenie liečby úspešné a pacienti ju dobre tolerujú. V našom prípade prezentujeme pacienta s Crohnovou chorobou v hlbokej remisii pri liečbe infliximabom, u ktorého došlo po jeho vysadení k akútnej exacerbácii ochorenia. Napriek jeden a pol ročnej prestávke v liečbe infliximabom bolo zahájenie jej opätovného podávania úspešné, bez akýchkoľvek komplikácií.
Kľúčové slová:
biologická liečba – protilátky proti infliximabu – riziko malignity anti-TNF liečby
Vlastný prípad
21-ročný pacient, muž, fajčiar s diagnózou Crohnovej choroby s postihnutím terminálneho ilea a hrubého čreva stanovenou v roku 2004, bol v úvode terapie liečený systémovými kortikoidmi v kombinácii s derivátmi kyseliny 5-aminosalicylovej (5-ASA). V januári 2005 bol do liečby pridaný azatioprín (AZA). Vzhľadom na nedostatočný efekt imunosupresívnej liečby AZA v kombinácii s 5-ASA bola v apríli 2005 zahájená biologická liečba infliximabom v dávke 5 mg/kg telesnej hmotnosti. Pri kombinácii biologickej liečby, AZA a 5-ASA sa stav pacienta postupne zlepšil. V novembri 2007 bol pacient v kompletnej klinickej, laboratórnej a endoskopickej remisii, na základe čoho bola liečba infliximabom ukončená. Celkovo mu bolo podaných 18 dávok infliximabu. Ďalej sa pokračovalo v liečbe AZA + 5-ASA, avšak pri tejto liečbe došlo k postupnému zhoršovaniu klinického stavu, objavili sa subfebrility, celková slabosť a únava, zhoršil sa aj laboratórny nález v zmysle zvýšenia zápalových parametrov (Tr 487 → 628x109/l; CRP 11,9 → > 90 mg/l). Vzhľadom k relapsu ochorenia bola v auguste 2008 u pacienta zahájená liečba iným biologikom (adalimumab). Liečba bola započatá v štandardnom dávkovaní indukčnou dávkou 80 mg 40 mg s.c. a následne s udržiavacou dávkou 40 mg s.c. á 2 týždne. Počas tohto obdobia sa pacient kvôli štúdiu na vysokej škole presťahoval do Bratislavy. V decembri 2008 musel byť pacient urgentne operovaný pre klinické príznaky akútnej peritonitídy a CT nález zápalového pseudotumoru v oblasti céka a teminálneho ilea. Z operačného nálezu sa potvrdila difúzna peritonitída, bola realizovaná resekcia terminálneho ilea a časti pravého kolonu s ileoascendentoanastomózou (obr. 1). Postoperačne začal byť pacient sledovaný v Centre biologickej liečby Gastroenterologickej kliniky SZU a UN v Bratislave. Rana po operácii sa hojila per secundam intentionem, preto sa v liečbe adalimumabom a AZA nepokračovalo od operácie až do marca 2009, kedy bola znovuzahájená liečba len adalimumabom v kombinácii s 5-ASA. Opätovne sa pokračovalo v dávkovaní 40 mg á 2 týždne, naďalej však u pacienta pretrváva zvýšená únava, kašovitá stolica 2–3× denne, v laboratórnom obraze anémia ľahkého stupňa mikrocytová, hypochrómna. Pre poruchu resorpcie železa bol pacient sledovaný hematológom s opakovanou intravenóznou substitúciou železa. V decembri 2009 naďalej pretrvávala zvýšená únava, subfebrility, ľahká pozitivita tzv. nešpecifických zápalových parametrov (FW 15/30, Leu 11,9 × 109/l, Tr 410 × 109/l, CRP 7,49 mg/l), CDAI 81. Pri kolonoskopickej kontrole nález ojedinelých áft až drobných ulcerácií v ľavej časti kolonu, od lienálnej flexúry orálne pseudopolypózne zmeny so suspektnou stenózou ileoascendentoanastomózy. Pri CT vyšetrení brucha a malej panvy nález zhrubnutej steny do 1 cm proximálneho úseku kolon descendens, transversum a ascendens až po ileoascendentoanastomózu s jej naznačenou stenózou. V okolí známky „dirty fat“, miernej hyperémie mezentéria s lokoregionálnou lymfadenopatiou (obr. 2–4). Na základe týchto nálezov boli do liečby pridané systémové kortikoidy. Pacientovi bolo navrhnuté skrátenie intervalu podávania biologickej liečby (40 mg s.c. á 1 týždeň), s čím však pacient nesúhlasil. Vzhľadom na nesúhlasné stanovisko pacienta k pokračovaniu v liečbe adalimumabom a anamnesticky dobrý efekt infliximabu bola v marci 2010 opätovne zahájená liečba infliximabom (reindukcia v dávke 5 mg/kg telesnej hmotnosti i.v. v týždni 0., 2. a 6. + udržiavacia dávka 5 mg/kg i.v. á 8 týždňov). V súčasnosti je pacient pri tejto liečbe klinicky bez ťažkostí, denne má 1–2 formované stolice, v laboratórnom obraze pretrváva anémia ľahkého stupňa, bez elevácie zápalových parametrov.
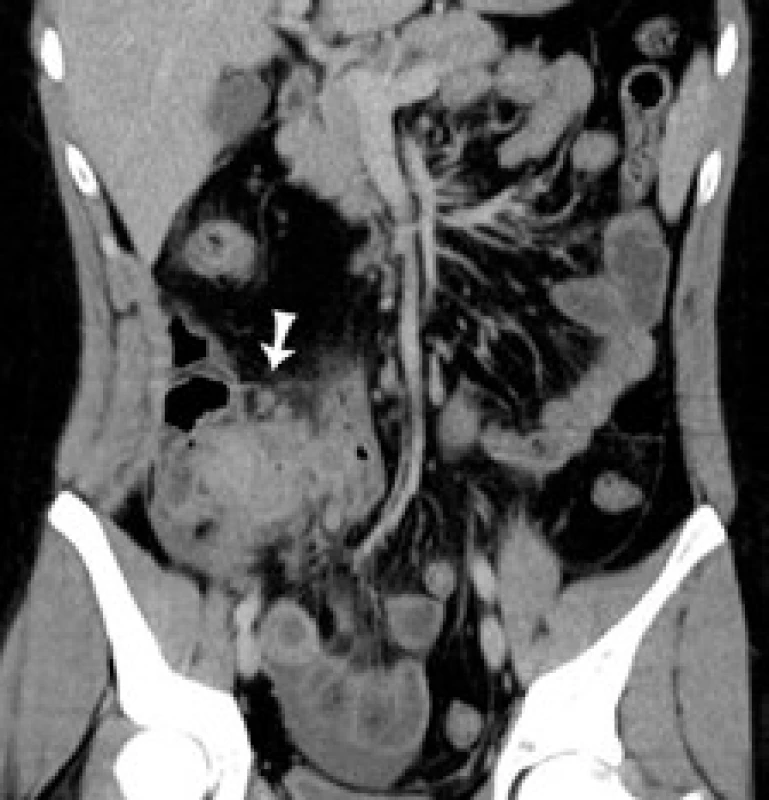
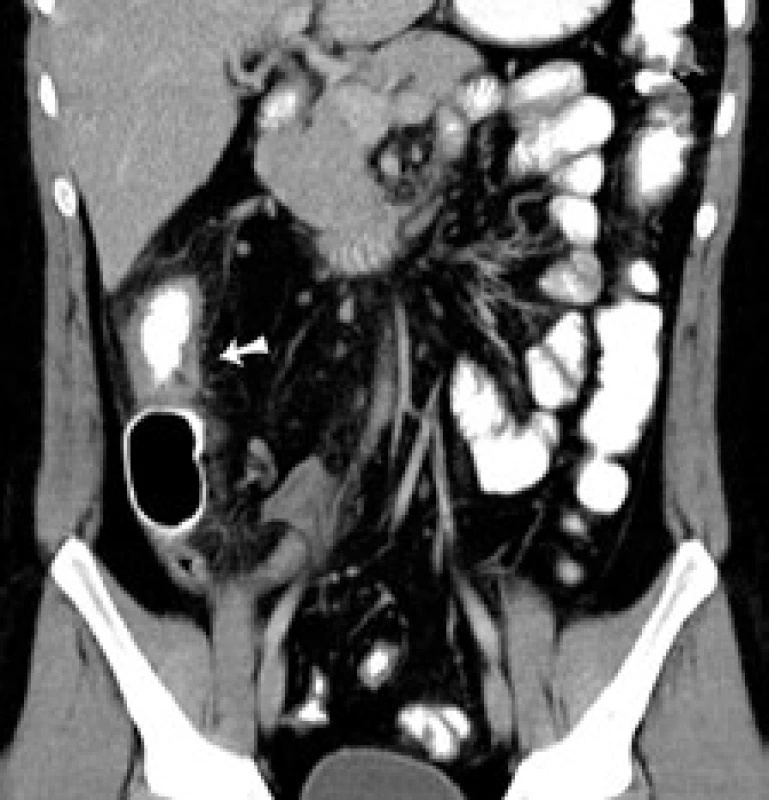
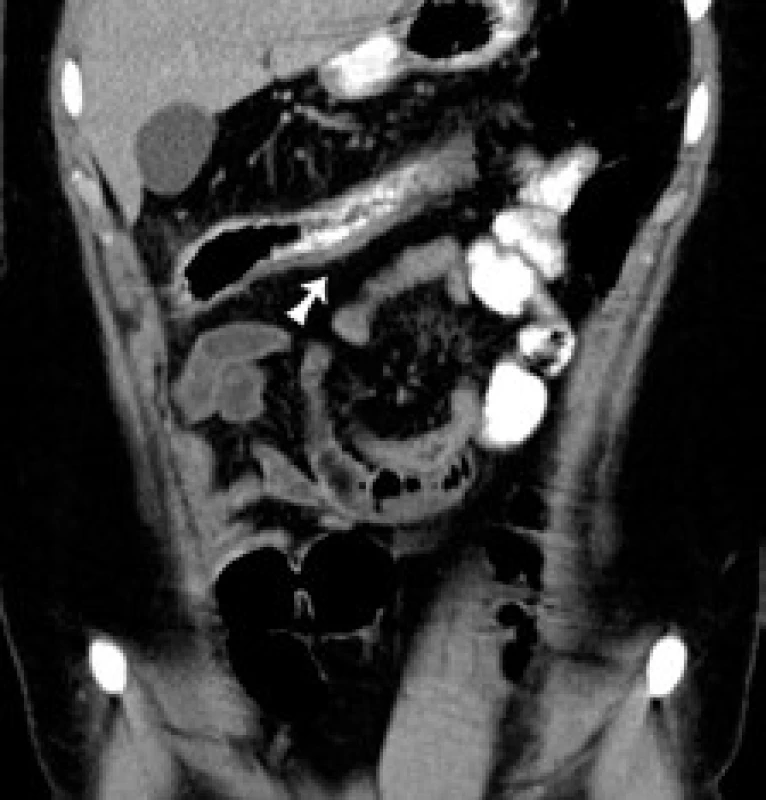
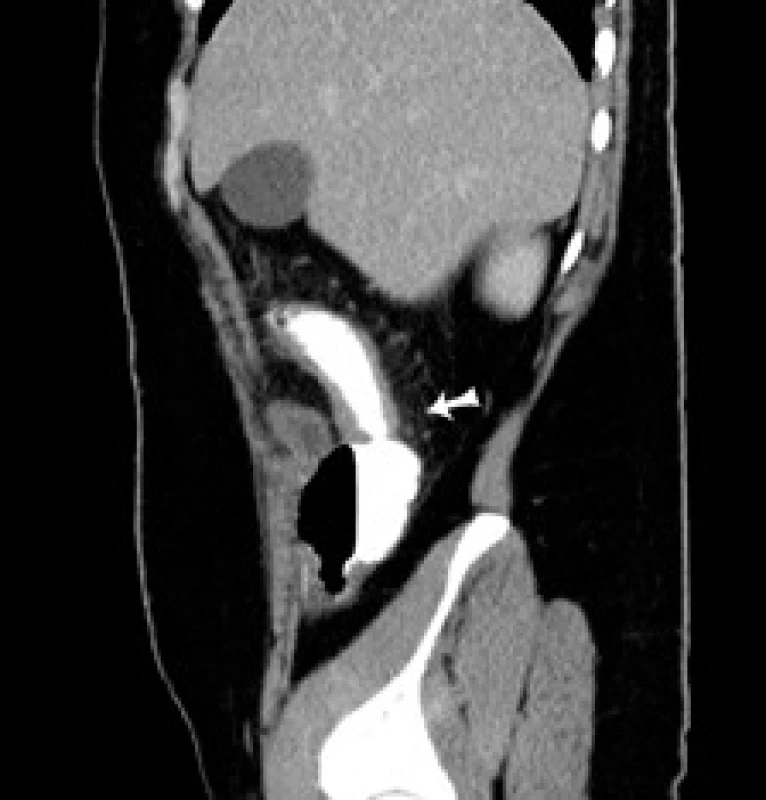
Diskusia
Jednou z častých otázok, ktoré si kladieme u pacientov s nešpecifickým črevným zápalom (IBD) liečených biologickou liečbou je, kedy môže alebo kedy by mala byť terapia biologickou liečbou ukončená. V štúdii STORI sa uvádza, že IBD pacient liečený kombináciou biologickej liečby a imunosupresívom, ktorý je počas 2 rokov liečby v hlbokej klinickej, laboratórnej aj endoskopickej remisii a minimálne 6 mesiacov bez potreby aditívnej kortikoterapie, má po vysadení jedného z dvojice liekov nízke riziko relapsu ochorenia. Za hlbokú laboratórnu remisiu sa pritom považuje hodnota CRP < 5 mg/l a o endoskopickej remisii sa hovorí v prípade dosiahnutia „mucosal healing“ a endoskopického indexu CDEIS < 2 [1].
V súčasnosti nepoznáme medicínsky dôvod, prečo anti-TNF liečbu ukončiť, avšak je známe, že kombinovaná imunosupresívna a anti-TNF liečba zvyšuje riziko vzniku lymfoproliferatívnych ochorení. V poslednej dobe boli zaznamenané viaceré prípady T-bunkového hepatosplenického lymfómu [2]. Z ďalších malignít sú to leukémie, melanómy a solídne nádory. U pacientov liečených vyššími dávkami biologík sa malignity vyskytujú signifikantne častejšie v porovnaní s pacientmi, ktorí dostávali nižšie dávky biologík. Práve malignity sú dôvodom, prečo je po určitom čase kombinovanej liečby biologikami a imunosupresívami vhodné pokračovať v liečbe len jedným z nich [3]. Na druhej strane sú však štúdie, ktoré zvýšené riziko vzniku lymfómov a leukémií pri liečbe biologikami nepotvrdzujú [4]. Rovnako klesá aj výskyt infekcií (sepsa), ak sa nepodáva infliximab v kombinácii s imunosupresiou [5]. V prípade uvedeného pacienta sa ošetrujúci gastroenterológ rozhodol pre vysadenie infliximabu a ponechanie liečby azatioprínom. Druhým častým problémom v liečbe je rozhodnutie, či je možné po vysadení infliximabu a následnom relapse ochorenia znovu zahájiť liečbu infliximabom, alebo prejsť na liečbu iným biologikom. Podľa našich skúseností, ak bola pôvodná biologická liečba u pacienta efektívna, tzn. došlo k navodeniu a udržaniu remisie, prikláňame sa k odporúčaniu pokračovať v pôvodne podávanom biologiku. V prípade, ak bol pacient v medziobdobí liečený azatioprínom, alebo iným imunosupresívom, sa riziko vzniku alergickej reakcie po readministrácii biologickej liečby znižuje [6].
Závažným problémom pri terapii biologikami je vznik neutralizujúcich protilátok. Ich tvorba je asociovaná so zvýšeným rizikom infúznych reakcií, so znížením a skrátením účinku liečby a s potrebou zvýšenia dávky infliximabu alebo skrátenia intervalu podávania jednotlivých dávok [7]. Protilátky proti infliximabu vytvárajú ťažšie alergické reakcie, vznikajú totiž proti myšej časti chimérickej molekuly infliximabu. Na rozdiel od adalimumabu, kde protilátky vznikajú proti čisto humánnej molekule a spôsobujú tak menej závažné reakcie [8,9]. V Belgicku prebehla v roku 2003 štúdia, ktorá skúmala klinický význam protilátok proti infliximabu u pacientov s Crohnovou chorobou. Jedným zo záverov tejto štúdie bolo, že koncentrácia protilátok proti IFX > 8,0 mcg/mL pred podaním ďalšej dávky predikuje skrátenie trvania odpovede na podanú dávku. Priemerná doba trvania odpovede na IFX bola u týchto pacientov iba 35 dní v porovnaní so 71 dňami u pacientov s koncentráciou anti-IFX protilátok < 8,0 mcg/mL [10].
Záver
Indikácia biologickej liečby musí byť u každého pacienta dôkladne zvážená na základe klinického stavu, laboratórnych a zobrazovacích vyšetrení. Avšak na druhej strane je vždy potrebné počítať aj s potenciálnym rizikom vzniku malígnych ochorení, resp. nežiadúcich účinkov liečby. V prípade relapsu IBD, po vysadení biologickej liečby z dôvodu hlbokej remisie, je možné a aj vhodné vrátiť sa znovu k pôvodne podávanému a účinnému biologiku.
Autoři deklarují, že
v souvislosti s předmětem studie nemají žádné
komerční zájmy.
The authors declare they have no
potential conflicts of interest concerning drugs, products, or
services used in the study.
Redakční rada potvrzuje, že
rukopis práce splnil ICMJE kritéria pro publikace zasílané do
biomedicínských časopisů.
The Editorial Board declares that
the manuscript met the ICMJE „uniform requirements“ for
biomedical papers.
MUDr. Tomáš Zamborský
Gastroenterologická klinika SZU a UN
Bratislava
Univerzitná
nemocnica sv. Cyrila a Metoda
Antolská 11, 851 07 Bratislava
batovsky@pe.unb.sk
Sources
1. Baert F, Moortgat L, Van Assche G. Mucosal healing predicts sustained clinical remission in patients with early-stage Crohn´s disease. Gastroenterologigy 2010; 138(2): 463–468.
2. Baert F, Noman M, Vermeire S et al. Influence of immunogenicity on the long-term efficacy of infliximab in Crohn’s disease. N Engl J Med 2003; 348(7): 601–608.
3. Rutgeers P, Sandborn WJ, Feagan BG et al. Infliximab for induction and maintenance therapy for ulcerative colitis. N Engl J Med 2005; 353(23): 2462–2476.
4. Bongartz T, Sutton AJ, Sweeting MJ et al. Anti-TNF antibody therapy in rheumatoid arthritis and the risk of serious infections and malignancies: systematic review and meta-analysis of rare harmful effects in randomized controlled trials. JAMA 2006; 295(19): 2275–2285.
5. Miehsler W, Novacek G, Wenzl H et al. A decade of infliximab: The Austrian evidence based consensus on the safe use of infliximab in inflammatory bowel diseasea. JCC 2010; 4 : 221–256.
6. Askling J, Fored CM, Baecklund E. Haematopoietic malignancies in rheumatoid arthritis: lymphoma risk and characteristics after exposure to tumour necrosis factor antagonists. Ann Rheum Dis 2005; 64 (10): 1414–1420.
7. Wolbink GJ, Vis M, Lems W. Development of antiinfliximab antibodies and relationship to clinical response in patients with rheumatoid arthritis. Arthritis Rheum 2006; 54(3): 711–715.
8. Radstake TR, Svenson M, Eijsbouts AM. Formation of antibodies against infliximab and adalimumab strongly correlates with functional drug levels and clinical responses in rheumatoid arthritis. Ann Rheum Dis 2009; 68(11): 1739–1745.
9. Bartelds GM, Wolbink GJ, Stapel S. High levels of human anti-human antibodies to adalimumab in a patient not responding to adalimumab treatment. Ann Rheum Dis 2006; 65(9): 1249.
10. Bartelds GM, Wijbrandts CA, Nurmohamed MT. Clinical response to adalimumab: relationship to anti-adalimumab antibodies and serum adalimumab concentrations in rheumatoid arthritis. Ann Rheum Dis 2007; 66(7): 921–926.
Labels
Paediatric gastroenterology Gastroenterology and hepatology SurgeryArticle was published in
Gastroenterology and Hepatology
2011 Issue 1
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Metamizole vs. Tramadol in Postoperative Analgesia
- Spasmolytic Effect of Metamizole
- The Importance of Limosilactobacillus reuteri in Administration to Diabetics with Gingivitis
-
All articles in this issue
- Editor-in-chief´s lead article
- No country for young men
- Dynamic scintigraphy of the oesophagus in the diagnostics of gastro-oesophageal reflux disease
- Autoimmune form of chronic pancreatitis and IgG4 positive mastitis
- Cytomegaloviral colitis in organ transplant recipients
- Successful use of OTSC® (Over-The-Scope Clip) in the treatment of iatrogenic colon perforation
- Is it possible to reintroduce original biological therapy in a relapsed Crohn’s disease patient?
- What should be done in patients with inflammatory bowel diseases those lose a response to biological therapy?
- Not only NOTES in Barcelona
- Acute mesenteric ischemia
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Cytomegaloviral colitis in organ transplant recipients
- Is it possible to reintroduce original biological therapy in a relapsed Crohn’s disease patient?
- Acute mesenteric ischemia
- Autoimmune form of chronic pancreatitis and IgG4 positive mastitis
