Standardní diagnostický a terapeutický postup u chronické infekce virem hepatitidy C (HCV)
Authors:
P. Urbánek; P. Husa; J. Galský; J. Šperl
; V. Hejda; P. Kümpel; V. Němeček
; S. Plíšek; M. Volfová
Authors‘ workplace:
Pracovní skupina pro virové hepatitidy České hepatologické společnosti ČLS JEP, Pracovní skupina pro virové hepatitidy Společnosti infekčního lékařství ČLS JEP
Published in:
Gastroent Hepatol 2012; 66(3): 214-229
Category:
Hepatology: Best Practises
Níže uvedená doporučení pro diagnostiku a terapii infekce virem hepatitidy C byla vytvořena členy pracovních skupin pro virové hepatitidy ČHS ČLS JEP a Společnosti infekčního lékařství ČLS JEP. Jsou založena především na aktualizovaných doporučeních Americké asociace pro studium jaterních chorob z roku 2011 (AASLD) a na doporučeních vydaných ve stejném roce Evropskou asociací pro studium jater (EASL). Doporučení představují preferovaný přístup k řešení všech níže probíraných aspektů péče o pacienty s virovou hepatitidou C. Nedílnou součástí dokumentu jsou i doporučení racionálních preventivních opatření bránících přenosu viru hepatitidy C.
Maximální možné dodržování odborných doporučení je podmínkou dosažení efektivní péče o nemocné s virovou hepatitidou C v celostátním měřítku. Předkládaný dokument je oporou při jednání obou odborných společností se státními orgány a s plátci zdravotní péče.
1. Epidemiologie HCV
Celosvětová prevalence infekce HCV se pohybuje v běžné populaci kolem 3 %. V roce 2001 bylo pomocí sérologického přehledu zjištěno, že prevalence protilátek anti-HCV v běžné populaci ČR je 0,2 %. HCV infekce je nejčastější příčinou jaterních onemocnění ve vyspělých zemích světa.
Infekce virem hepatitidy C patří mezi krví přenosné infekce. Hlavními cestami šíření HCV infekce jsou:
- přenos krevními deriváty
- injekční aplikace drog
- pravidelné dialyzační léčení (PDL)
- profesionální riziko expozice HCV
- sexuální kontakt s osobou HCV pozitivní
- rodinný kontakt s osobou HCV pozitivní
- vertikální přenos z HCV pozitivní matky na novorozence (perinatální přenos)
- iatrogenní přenos transplantovanými orgány
Recentní studie ukazují na to, že až v 90 % se podaří některý z rizikových faktorů u infikované osoby identifikovat, nicméně je zapotřebí velmi podrobného a aktivního dotazování.
1.1 Prevence přenosu HCV
HCV pozitivní osoba musí být poučena, jak zabránit přenosu HCV na další osoby, zejména:
- HCV pozitivní osoba nesmí darovat krev, orgány, tkáně či sperma (sperma lze darovat jen své partnerce, orgány lze darovat jen HCV pozitivním příjemcům).
- HCV pozitivní osoba by si měla řádně ošetřit každou otevřenou ránu tak, aby nedošlo k jakékoli expozici jiné osoby infikovanou krví.
- HCV pozitivní uživatelé drog by měli být zařazeni do programu kontrolované výměny injekčního instrumentaria a všech dalších potřeb, pokud nejsou indikováni k odvykací léčbě.
- HCV pozitivní osoba by měla být poučena, že riziko přenosu HCV sexuální cestou je malé a infekce sama o sobě není indikací k používání bariérové antikoncepce v dlouhodobém monogamním vztahu. Metody bezpečného sexu jsou dostatečnou prevencí přenosu. Doporučení použití bariérové antikoncepce při náhodném sexu tím není dotčeno.
- HCV pozitivní osoba by měla bránit i náhodnému použití svého zubního kartáčku, holicích potřeb, nůžek na nehty a dalších nástrojů na manikúru či pedikúru dalšími osobami.
2. Laboratorní vyšetřovací metody
2.1 Sérologické detekční metody
Jedná se o sérologickou detekci anti-HCV protilátek. Protilátky jsou markerem expozice – kontaktu dané osoby s virem hepatitidy C. Protilátky anti-HCV nemají neutralizační efekt, nejsou nositelem imunity organizmu. Přetrvávají ve značném titru i u pacientů úspěšně vyléčených. Technicky se jedná o detekci protilátek metodou EIA či některých jejích variant. V současné době se používají metody III. generace, které mají senzitivitu 97 % a specificitu až 99 %.
2.1.1 Indikace k vyšetření protilátek anti-HCV
Vyšetření anti-HCV protilátek je možno chápat jako vyšetření screeningové u všech osob, u kterých je podezření, že byly někdy v průběhu života virem exponovány.
Na základě znalostí o možnostech přenosu je doporučováno testování HCV infekce zejména u těchto skupin osob:
- osoby s anamnézou injekční aplikace drog, a to i v případě jediné aplikace před více lety
- osoby ve skupinách s vysokou prevalencí HCV infekce
- příjemci krevních derivátů či příjemci orgánových transplantátů před rokem 1992
- HIV pozitivní osoby
- hemofilici léčení před rokem 1987
- osoby s anamnézou hemodialýzy (i akutní a krátkodobé)
- osoby s nevysvětlitelnou elevací aminotransferáz
- děti narozené HCV pozitivním matkám (testování až po 18. měsíci věku)
- zdravotničtí pracovníci a další osoby s anamnézou poranění injekční jehlou (bez ohledu na sérologický stav, event. zdroje) nebo osoby s mukozální expozicí krvi HCV pozitivní osoby
- sexuální partneři HCV pozitivní osoby
2.2 Molekulárně genetické metody
Molekulárně genetické metody prokazují přítomnost virové nukleové kyseliny (HCV RNA) v séru či tkáních infikovaného jedince. Všechny používané metody jsou dnes dostupné ve variantě kvalitativní i kvantitativní. Vzhledem k poslednímu vývoji terapeutických možností a z toho vyplývajících požadavků na molekulárně genetická vyšetření provádí většina pracovišť rutinně kvantitativní hodnocení. Z dostupných metod nalezla největší rozšíření metoda amplifikace nukleové kyseliny v reálném čase – real time PCR. Molekulárně genetické metody umožňují určit i genotyp viru HCV.
2.2.1 Indikace k vyšetření HCV RNA
- osoby anti-HCV pozitivní
- osoby s nevysvětlitelnou jaterní chorobou, které jsou anti-HCV negativní a lze je považovat za imunokompromitované
- kvantitativní stanovení viremie – osoby, u kterých je zvažována protivirová léčba; v těchto případech by také měl být určen genotyp HCV
3. Přirozený průběh HCV infekce
Studie o přirozeném průběhu HCV infekce ukazují, že 55–85 % pacientů, kteří se infikují virem hepatitidy C, není schopno přirozeným způsobem virus eliminovat a infekce u nich přejde do chronického stadia. U 5–20 % osob z tohoto počtu dojde během 20–25 let k rozvoji jaterní cirhózy. Osoby s jaterní cirhózou při chronické HCV infekci mají riziko rozvoje nevratného selhání jater (cca 30 % během 10 let) a riziko vzniku hepatocelulárního karcinomu (HCC, 2–8 %, resp. u SVR 9,2 % a u NR 13,1 % za 5 let). Faktory asociované s progresí jaterního postižení při chronické HCV infekci jsou:
- přenos infekce ve vyšším věku (riziko narůstá po 40.–45. roce věku)
- konzumace alkoholu ≥ 50 g denně
- obezita a jaterní steatóza z jakéhokoli jiného důvodu
- koinfekce HCV/HBV a HCV/HIV
- vyšší stupeň jaterní fibrózy nežli portální fibróza v iniciální jaterní biopsii (METAVIR ≥ 2 a Ishak ≥ 3)
Chronická HCV infekce je rovněž asociována s řadou tzv. extrahepatálních manifestací. Nejdůležitějším stavem z této skupiny je smíšená kryoglobulinemie. Symptomatická smíšená kryoglobulinemie je indikací k protivirové léčbě bez ohledu na stupeň fibrózy jaterního postižení.
4. Používaná terminologie
4.1 Chronická HCV infekce
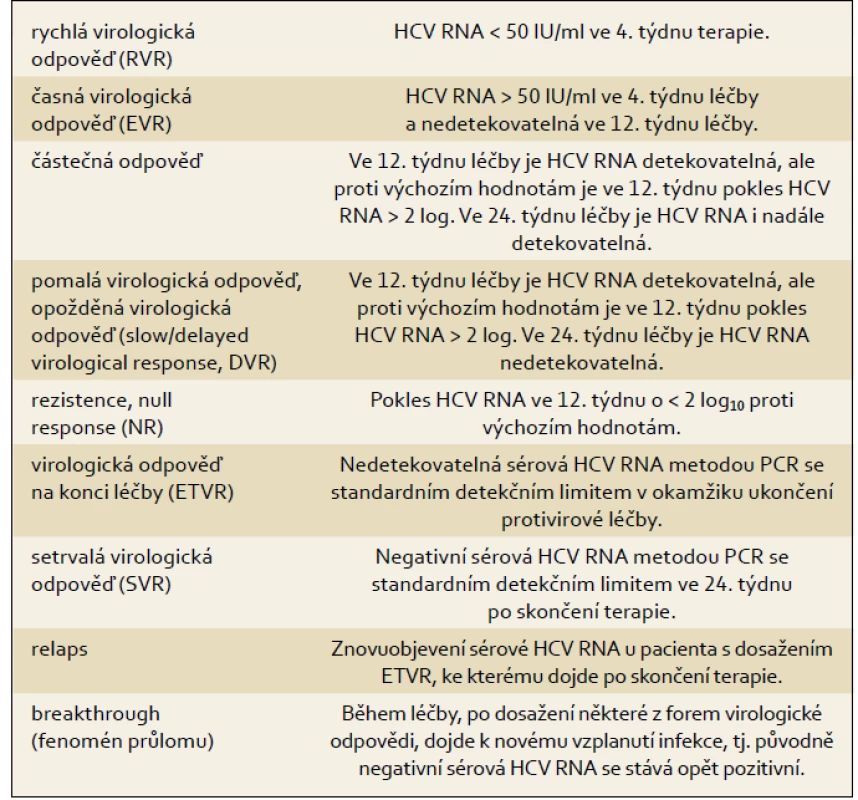
Chronická HCV infekce je definována jako prokazatelná přítomnost viru v organizmu po dobu delší než šest měsíců – pozitivní průkaz sérové HCV RNA metodou polymerázové řetězové reakce (PCR) s detekčním limitem 50 IU/ml a méně. Za chronickou infekci je nutno považovat dále každou prokázanou infekci s neznámým okamžikem vzniku.
4.2 Akutní HCV infekce
Akutní HCV infekce je diagnostikována velmi vzácně pro častou absenci klinických příznaků v akutním stadiu HCV infekce. Naše znalosti jsou proto velmi limitovány. Stejně tak neexistuje terminologická jednota. Za akutní HCV infekci někteří považují pouze prokazatelnou sérokonverzi z anti-HCV negativity na anti-HCV pozitivitu a HCV RNA pozitivitu v daném období. Jiní autoři k tomuto kritériu ještě přidávají nutnost prokázané elevace ALT ≥ 10 × ULN (horní limit normy) současně s první sérologickou pozitivitou nebo v období 6–12 měsíců před prvním pozitivním sérologickým vyšetřením.
4.3 Standardní detekční limit stanovení HCV RNA
Za standardní detekční limit je považována citlivost použité techniky (polymerázové řetězové reakce) 50 IU/ml HCV RNA a méně. Protože řada laboratoří používá metody na stanovení HCV RNA, jejichž citlivost nedosahuje požadovaného standardního detekčního limitu, je třeba, aby lékař zadávající vyšetření v souvislosti s hodnocením terapie dle těchto standardních postupů požadoval na laboratoři informaci, že citlivost jejich stanovení splňuje uvedený limit.
4.4 Virologická odpověď a její klasifikace během protivirové léčby
Terminologii pro hodnocení virologické odpovědi uvádí tab. 1.
5. Kritéria pro zahájení terapie chronické infekce virem hepatitidy C
Všichni pacienti s chronickou HCV infekcí jsou potenciálními kandidáty protivirové léčby. Terapie je jednoznačně doporučena pro pacienty se zvýšeným rizikem vzniku jaterní cirhózy. Tito pacienti jsou charakterizováni detekovatelnou sérovou HCV RNA metodou PCR, jaterní biopsií s portální nebo přemosťující fibrózou a s alespoň střední aktivitou zánětu. Většina těchto pacientů má také trvale vyšší aktivitu ALT. Trvale normální aktivita ALT není kontraindikací zahájení protivirové léčby. V některých zvláštních skupinách pacientů nejsou rizika a přínosy terapie přesně definovány. Případná léčba těchto pacientů by měla být zahájena po pečlivém individuálním zvážení konkrétního případu.
6. Cíle terapie chronické infekce virem hepatitidy C
Cílem terapie je zabránit rozvoji komplikací HCV infekce, což je podmíněno dosažením eradikace infekce. Eradikací infekce je myšleno dosažení SVR ve smyslu výše uvedené definice (tab. 1). Zlepšení jaterní histologie, včetně poklesu stupně (stage) jaterní fibrózy, bylo dosaženo u pacientů po kombinované terapii pegylovanými interferony a ribavirinem (viz dále), zejména u osob, které dosáhly SVR. U osob se SVR dochází k významnému snížení jaterní morbidity i mortality.
7. Iniciální terapie HCV infekce
Dosavadním terapeutickým standardem pro pacienty s chronickou HCV infekcí bylo užití kombinace pegylovaného interferonu (PEG-IFN) a ribavirinu (RBV). Délka kombinované léčby je 48 týdnů pro genotypy HCV 1, 4, 5 a 6 a 24 týdnů pro genotypy HCV 2 a 3. U pacientů infikovaných genotypem HCV 1 je tímto postupem dosahováno SVR ve 40–50 % případů, u genotypů HCV 2 a 3 je SVR dosahováno v 80 % (i více).
Od poslední aktualizace českých standardních postupů došlo na poli HCV infekce ke dvěma podstatným změnám:
- Byla vyvinuta a do léčby zavedena přímo působící virostatika (Directly Acting Antivirals, DAA).
- Byly identifikovány jednonukleotidové polymorfizmy (Single Nucleotide Polymorphism, SNP) se vztahem ke spontánní i léčbou indukované eliminaci viru.
Z těchto důvodů považují autoři doporučeného postupu za nutné přikročit k aktualizaci doporučení. Aktualizace léčebných doporučení se týká především pacientů infikovaných genotypem HCV 1.
7.1 Přímo působící virostatika, DAA
Jedná se o zcela novou skupinu preparátů pronikající do terapie HCV infekce. Jde v současné době celkem o pět tříd látek, které inhibují některý z kroků replikačního cyklu HCV. V současnosti je v různých fázích klinického zkoušení několik desítek těchto preparátů. Souhlas regulačních orgánů (FDA, EMA) k užití při léčbě chronické HCV infekce mají od roku 2011 zatím pouze dva inhibitory NS3/4A serinové proteázy viru – boceprevir a telaprevir. Boceprevir i telaprevir vykázaly během dosavadních klinických zkoušek významnou aktivitu proti genotypu HCV 1, telaprevir má aktivitu i vůči genotypu HCV 2, nikoli však 3. Boceprevir má pravděpodobně aktivitu i proti genotypům HCV 2 a 3. Nicméně žádný z těchto preparátů by neměl být v současné době užit k léčbě infekcí těmito dvěma genotypy. Stejně tak nelze boceprevir ani telaprevir použít v monoterapii, protože dochází k velmi rychlé selekci rezistentních variant HCV.
7.2 Naivní (dosud neléčený) pacient s chronickou HCV infekcí vyvolanou genotypem HCV 1
Optimálním léčebným režimem pacientů s chronickou HCV infekcí vyvolanou genotypem HCV 1 je užití bocepreviru nebo telapreviru v kombinaci s PEG-IFN a RBV. Boceprevir i telaprevir musí být užity k léčbě v kombinaci s PEG-IFN a RBV ve váhově definovaném režimu dávkování.
Níže rozebírané studie byly zorganizovány s použitím principů tzv. Response Guided Therapy (RGT), tj. léčby vedené (zkrácení, či prodloužení léčby) podle dosažené virologické odpovědi.
7.2.1 Publikované studie s použitím BOCEPREVIRU
Studie SPRINT-2: Schéma studie fáze III s boceprevirem ukazuje obr. 1. Boceprevir nebyl podáván od počátku protivirové léčby, ale až po čtyřtýdenní tzv. lead in fázi vedené kombinací PEG-IFN + RBV. Podkladem pro toto uspořádání byly studie nižších fází a analýzy vzniku rezistencí na boceprevir. Pokud byl podáván boceprevir od počátku léčby, docházelo k rozvoji virologické rezistence a prolomení příznivého efektu léčby. Kontrolní větev označená jako PR 48 týdnů představuje standardní dvojkombinační léčbu. Výsledky studie rozdělené podle rasy ukazuje graf 1. Vyčlenění černé rasy bylo provedeno z důvodu výrazně odlišné prevalence jednotlivých genotypů polymorfizmů lokusu rs12979860 genu IL28B (blíže viz kapitola 9). V populaci jiného původu než afroamerického je při použití bocepreviru dosahováno SVR v cca 67 % případů vs 40 % při použití standardní dvojkombinace PEG-IFN + RBV.
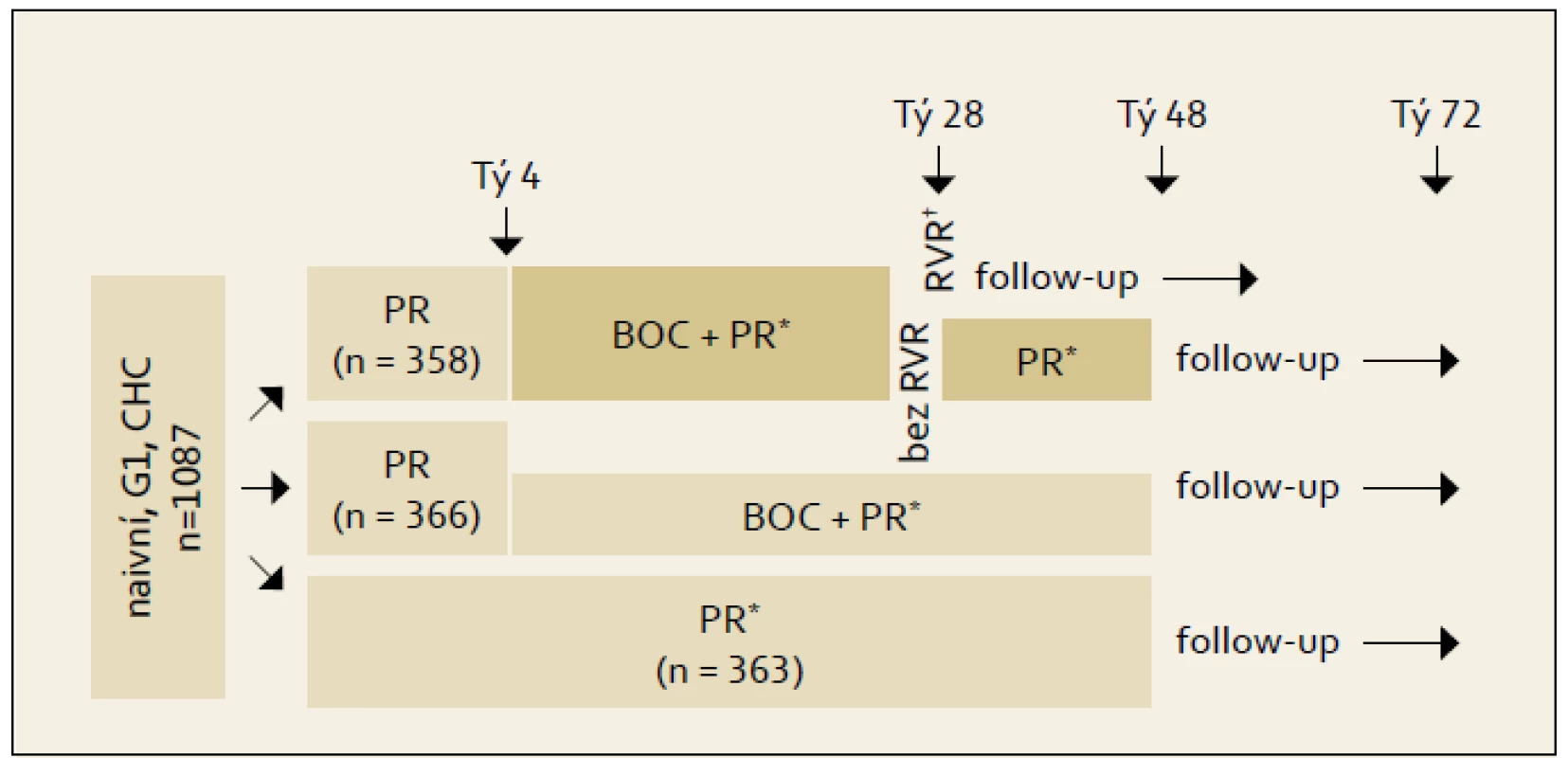

Vyšší úspěšnosti (% SVR) léčby obsahující boceprevir bylo dosaženo i při analýze účinku léčby v podskupinách definovaných podle známých predikčních faktorů efektu léčby PEG-IFN + RBV. Především ve skupinách osob s vyšším stupněm jaterní fibrózy i s vyšší výchozí hladinou sérové HCV RNA. SVR byla přitom srovnatelná ve skupinách s RGT a s fixním trváním léčby. Z tohoto důvodu je RGT doporučována pro pacienty bez jaterní cirhózy. RGT není zatím doporučována pro pacienty s jaterní cirhózou, resp. léčba u nich nemá být zkracována. Nicméně v tomto ohledu není zatím dostatek dat a v budoucnu může dojít ke změně tohoto doporučení.
FDA dále doporučuje poněkud odlišné schéma než bylo použito v klinických studiích pro pacienty s tzv. pomalou odpovědí (tab. 1, nesplňují kritérium pro vedení RGT). V těchto případech by léčba s boceprevirem měla trvat 32 týdnů (tj. od 4. do 36. týdne léčby) a pak by měla následovat ještě 12týdenní léčba kombinací PEG-IFN + RBV.
7.2.2 Pravidla léčby s použitím BOCEPREVIRU
- Doporučená dávka bocepreviru je 800 mg 3× denně, užití je vhodné kombinovat s požitím alespoň menšího množství jídla. Podání bocepreviru je indikováno po čtyřech týdnech terapie kombinací PEG-IFN + RBV (tzv. lead in fáze). Délka trojkombinační léčby má být 24–44 týdnů.
- Pacienti bez jaterní cirhózy, kteří jsou HCV RNA negativní, léčení trojkombinací PEG-IFN, RBV + boceprevir se čtyřtýdenní lead in fází v týdnu 8 a 24 mohou být léčeni po dobu 28 týdnů celkově (tj. 4 týdny lead in a 24 týdnů trojkombinace).
- Pacienti s jaterní cirhózou by měli být léčeni po dobu 48 týdnů (tj. 4 týdny lead in a 44 týdnů trojkombinace).
- Trojkombinace obsahující boceprevir by měla být ukončena, pokud je HCV RNA > 100 IU/ml ve 12. týdnu léčby nebo je HCV RNA detekovatelná ve 24. týdnu léčby.
7.2.3 Publikované studie s použitím TELAPREVIRU
Studie ADVANCE: Schéma organizace studie ukazuje obr. 2. Osoby, které dosáhly ve studii tzv. eEVR (extended Early Virological Response, prodloužená časná virologická odpověď = negativní sérová HCV RNA ve 4. a ve 12. týdnu léčby) byly VŽDY léčeny 24 týdnů. Část osob ze skupiny s eEVR byla léčena trojkombinací s telaprevirem 8 a část 12 týdnů. Osoby bez eEVR byly vždy léčeny 48 týdnů, telaprevir užívaly rovněž 8 či 12 týdnů. Kontrolní větví byla větev s léčbou standardní dvojkombinací PEG-IFN + ribavirin. Výsledky ITT analýzy studie ukazuje graf 2. Je patrno, že větve používající telaprevir se navzájem nelišily ve smyslu dosažení RVR a SVR, ale významně častěji v nich bylo dosaženo RVR i SVR ve srovnání se standardní léčbou.
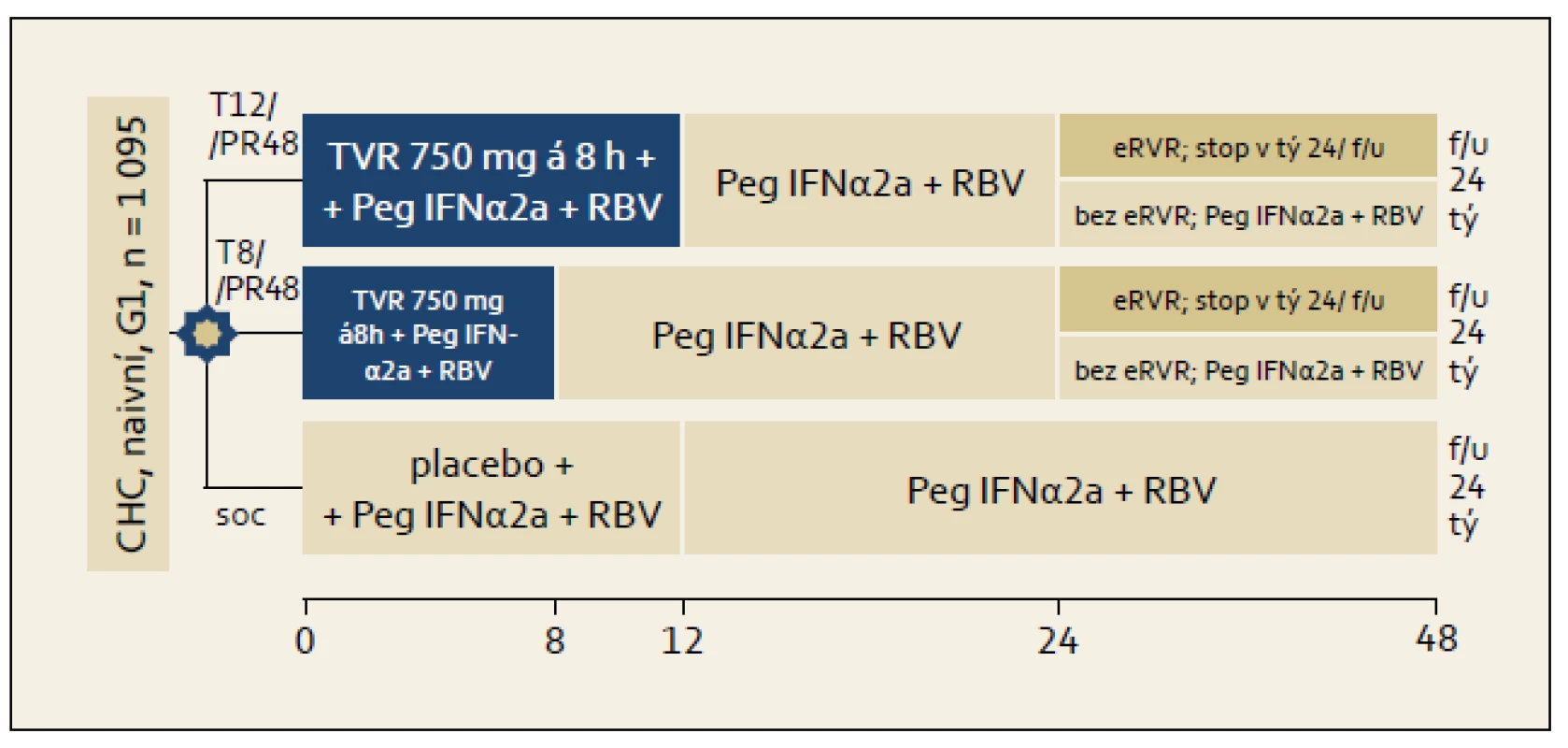

Mezi pacienty s pokročilou jaterní fibrózou bylo dosaženo SVR v 62 % ve větvi s 12týdenní léčbou telaprevirem a v 53 % při 8týdenní léčbě telaprevirem. Pokud pacienti s pokročilou fibrózou dosáhli eEVR, bylo SVR dosaženo v 80 % případů. Výchozí viremie měla přitom minimální prediktivní hodnotu pro dosažení SVR. Při viremii ≥ 800 000 IU/ml bylo dosaženo SVR v 74 % případů, při viremii < 800 000 IU/ml byla SVR dosažena v 78 % případů. Prediktivní hodnota výchozí viremie je proto menší než při použití kombinace PEG-IFN + RBV.
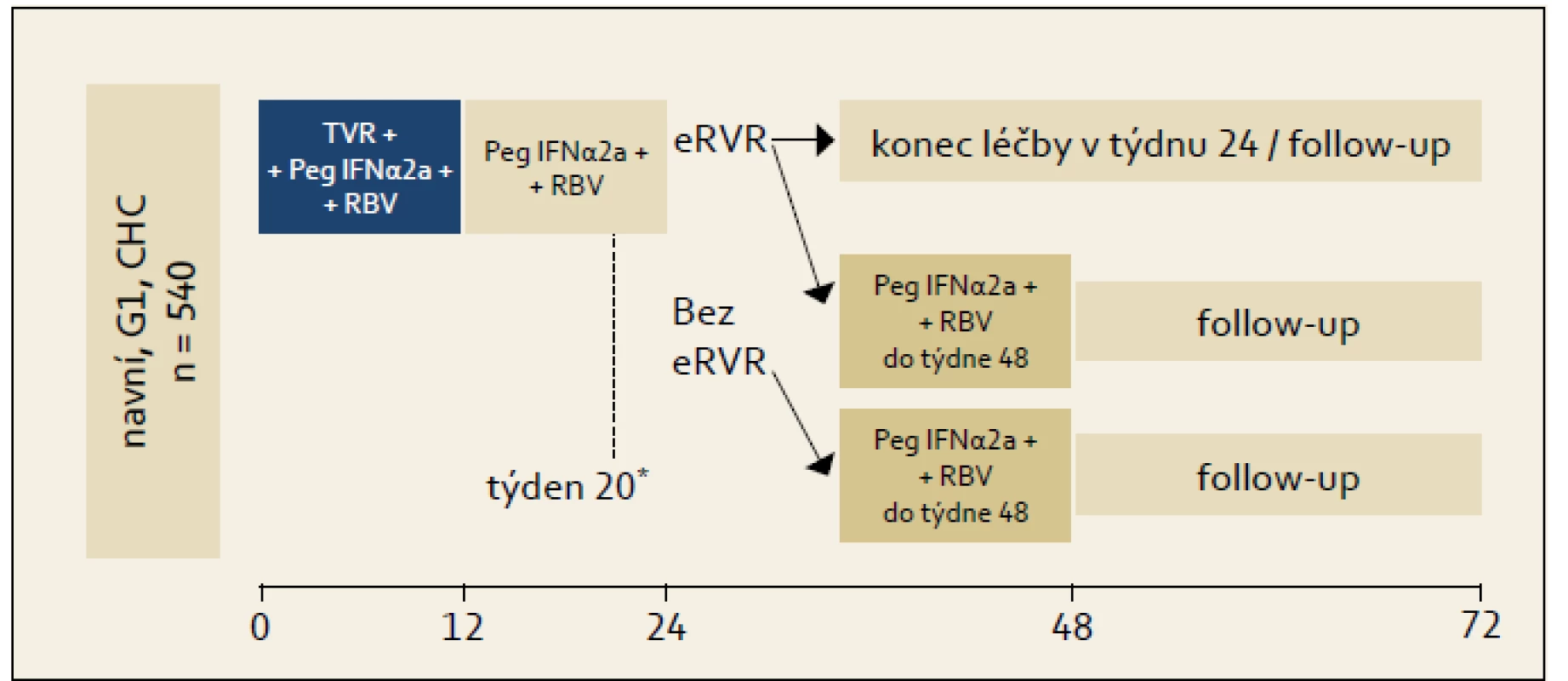
Studie ILLUMINATE: Studie byla uspořádána na základě znalostí výsledků studie ADVANCE, její schéma ukazuje obr. 3. Studie byla uspořádána pro ujasnění významu RGT u pacientů s eEVR. Princip RGT zde byl uplatněn tak, že pacienti, kteří dosáhli eEVR, byli ve 20. týdnu randomizováni k ukončení léčby ve 24. týdnu léčby nebo k pokračování léčby kombinací PEG-IFN + RBV až do 48. týdne. Graf 3 ukazuje výsledky. Je patrno, že celková účinnost ve smyslu dosažení SVR byla 72 %. Prakticky stejnou účinnost 24týdenní a 48týdenní léčby pak lze interpretovat tak, že pro osoby, které dosáhnou eEVR na trojkombinační léčbě, je dostačující léčba trvající 24 týdnů, naopak pro osoby, které eEVR nedosáhnou, je indikována léčba na dobu 48 týdnů s tím, že v druhé polovině léčby je tato vedena kombinací PEG-IFN + RBV. eEVR byla dosažena celkem u 65 % pacientů, takže u těchto pacientů je možno uvažovat o léčbě trvající celkem 24 týdnů. RGT není ani v tomto případě doporučována pro pacienty s jaterní cirhózou, nicméně opět z důvodu absence většího množství klinických dat.

7.2.4 Pravidla léčby s použitím TELAPREVIRU
Doporučená dávka telapreviru je 750 mg 3× denně spolu s jídlem, nejlépe tučným. Telaprevir se podává od počátku léčby v trojkombinaci (není lead in fáze) po dobu 12 týdnů a následuje 12–36 týdnů dvojkombinační léčby PEG-IFN + RBV.
Pacienti bez jaterní cirhózy léčení trojkombinací PEG-IFN + RBV + telaprevir, kteří jsou HCV RNA negativní v týdnu 4 a 12, mohou být léčeni po dobu jenom 24 týdnů.
- Pacienti s jaterní cirhózou by měli být léčeni po dobu 48 týdnů.
- Trojkombinace obsahující telaprevir by měla být ukončena, pokud je HCV RNA > 1 000 IU/ml ve 4. nebo 12. týdnu léčby nebo detekovatelná ve 24. týdnu léčby.
7.3 Naivní (dosud neléčený) pacient s chronickou HCV infekcí vyvolanou genotypem HCV 2 nebo 3
Pro pacienty infikované genotypy HCV 2 nebo 3 platí nadále stejná pravidla jako před zavedením DAA. Standardní léčbou je kombinace PEG-IFN + RBV, tak jak je podrobně rozebráno v kap. 10. Terapeutický algoritmus pro genotypy HCV 2 a 3 ukazuje obr. 7.
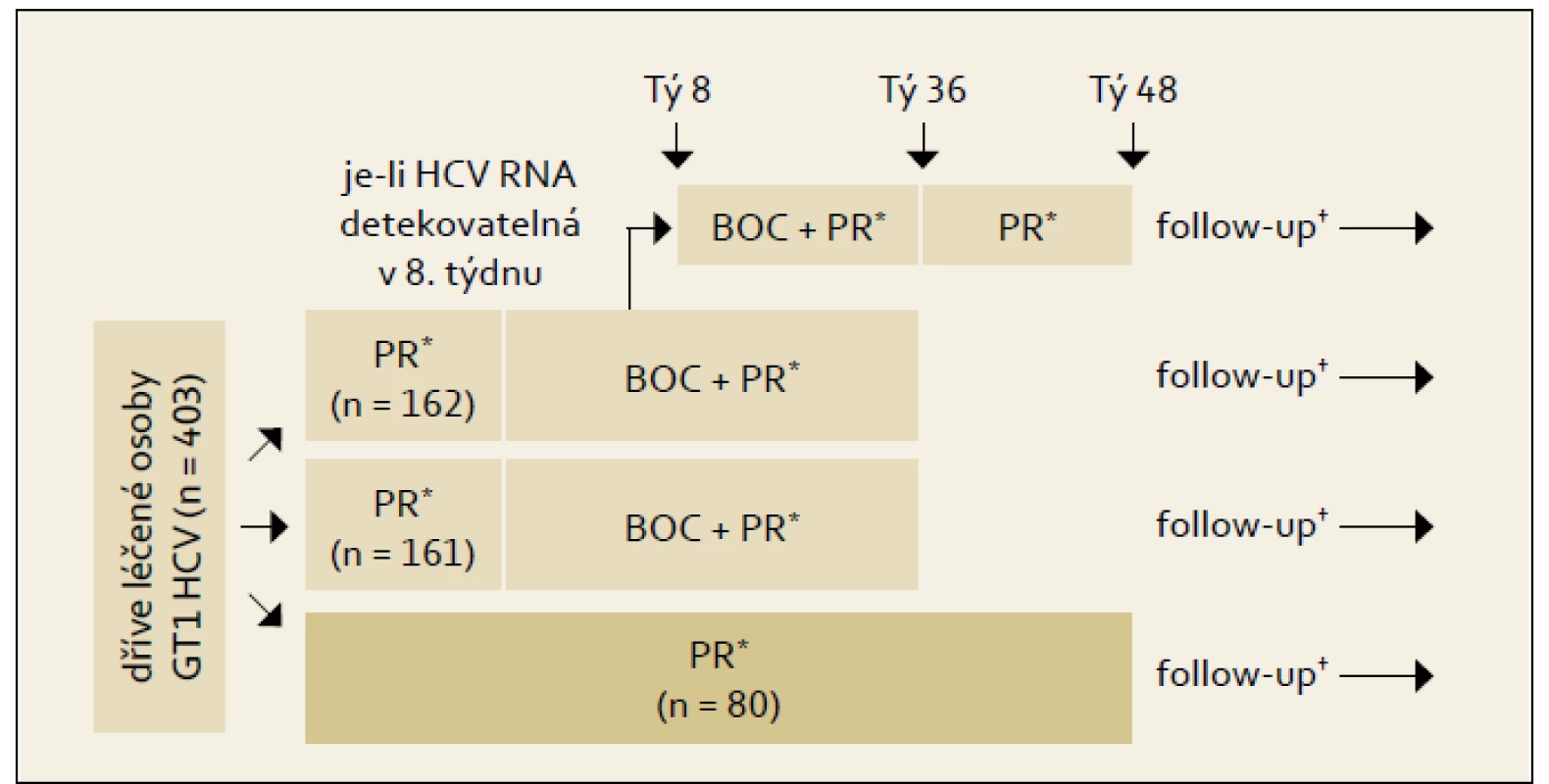
8. Opakovaná léčba pacientů s genotypem HCV 1 a předchozí neúspěšnou protivirovou terapií
8.1.1 Publikované studie s použitím BOCEPREVIRU
Studie RESPOND-2: Schéma uspořádání studie ukazuje obr. 4 a výsledky graf 4. Pro srovnání s jinými studiemi je nutné si uvědomit, že skupina zde označená jako předchozí „non-responders“ byla definována jako skupina osob, u nichž při předchozí terapii došlo ve 12. týdnu léčby k poklesu HCV RNA ≥ 2 log proti výchozím hodnotám, ale nikdy nebyla HCV RNA negativní. Z výsledků je patrno významné navýšení odpovědi ve smyslu SVR u obou skupin pacientů při použití fixního léčebného trojkombinačního schématu s boceprevirem proti opakování standardní protivirové léčby PEG-IFN + RBV.

8.1.2 Publikované studie s použitím TELAPREVIRU
Studie REALIZE: Schéma studie ukazuje obr. 5. Při hodnocení všech skupin pacientů bylo dosaženo SVR v 65 % při použití trojkombinace PEG-IFN/RBV + TVR. V kontrolní větví (Standard of Care – SOC) bylo SVR dosaženo pouze v 17 % případů. Zajímavější jsou přirozeně výsledky v jednotlivých skupinách podle odpovědi na předchozí protivirovou léčbu, které ukazuje graf 5. Je patrno, že i ve skupině osob rezistentních na předchozí léčbu (null response) je dosahováno přibližně šestkrát vyšší účinnosti (% SVR) než při použití opakované standardní léčby kombinací PEG-IFN a RBV.


8.1.3. Pravidla opakované léčby s použitím BOCEPREVIRU nebo TELAPREVIRU
- Opakovaná léčba s boceprevirem nebo telaprevirem v kombinaci s PEG-IFN a RBV je doporučena pro pacienty, kteří relabovali nebo měli částečnou odpověď při předchozí protivirové léčbě v jakékoli variantě.
- Pro pacienty s null response je možno zvážit podání kombinace telaprevir + PEG-IFN + RBV. Pro užití bocepreviru v této indikaci není v současnosti dostatek klinických dat, nicméně studie nadále probíhají.
- Léčba vedená podle odpovědi (Response Guided Therapy – RGT) s použitím bocepreviru nebo telapreviru v kombinaci s PEG-IFN a RBV může být použita u pacientů s částečnou odpovědí a relapserů.
- U pacientu s null response není RGT indikována.
- Léčba by měla být ukončena u pacientů s opakovanou léčbou vedenou trojkombinací s boceprevirem, pokud mají ve 12. týdnu léčby HCV RNA > 100 IU/ml. Důvodem je vysoká pravděpodobnost rozvoje virové rezistence při dalším pokračování léčby.
- Léčba by měla být také ukončena u pacientů s opakovanou léčbou vedenou trojkombinací s telaprevirem, pokud mají ve 4. nebo 12. týdnu léčby HCV RNA > 1 000 IU/ml. Důvodem je opět vysoké riziko vzniku virové rezistence.

9. Jednonukleotidové polymorfizmy (SNP) genu IL28B a jejich význam
IL28B je gen kódující interferon typu III, IFN-λ3, který je lokalizován na 19. chromozomu. V oblasti genu IL28B bylo dosud identifikováno několik jednonukleotidových polymorfizmů (SNP) s úzkým vztahem k nejrůznějším parametrům HCV infekce. Mechanizmus, jakým je pozitivní efekt příznivého genotypu zprostředkován, nebyl dosud objasněn.
Dosud nejvýznamnějším SNP lokalizovaným v oblasti genu IL28B je SNP rs12979860. Tento SNP má silný vztah k efektu protivirové léčby ve smyslu predikce její úspěšnosti. Rozlišovány jsou varianty tvořené alelami C a T. Genotyp CC v této lokalizaci je asociován s 2,5× vyšší účinností protivirové terapie než genotypy TT a CT. Různý výskyt tohoto výhodného genotypu v různých geografických oblastech a populacích vysvětluje do značné míry různou účinnost protivirové léčby v různých etnikách a rasách. Asociace genotypu CC rs12979860 s dosažením SVR představuje dosud nejpřesnější a nejcitlivější prediktivní hostitelský faktor efektu léčby dostupný před zahájením léčby. Polymorfizmy genu IL28B se staly standardním kritériem, podle kterého jsou stratifikováni pacienti s chronickou HCV infekcí ve všech klinických studiích s moderními variantami protivirové léčby. Předpovědní hodnota genotypů IL28B pro efekt protivirové terapie je vyšší než předpovědní hodnota výchozí hladiny HCV RNA, stupně jaterní fibrózy, věku, pohlaví a je vyšší u genotypu HCV 1 než pro genotypy HCV 2 a 3.
V současné době není dostatek dat k tomu, aby bylo možno na základě znalostí genotypů IL28B doporučit selekci pacientů vhodných ke kombinaci PEG-IFN + RBV nebo DAA+PEG-IFN + RBV. Stejně tak není dostatek důkazů pro modifikaci léčebné dávky či délky léčby pro pacienty s rozdílnými genotypy IL28B.
Kromě již zmíněného polymorfizmu bylo popsáno v genu pro IL28B dalších 6 SNP v této oblasti se vztahem k HCV. Tyto SNP rovněž umožňují predikci šance na virologickou odpověď ještě před zahájením léčby, ale žádný z nich nedosáhl takové významnosti jako SNP rs12979860.
10. Současné postavení a role kombinace PEG-IFN + RBV
DAA nejsou v současné době v ČR dostupná k běžnému rutinnímu užití. K léčbě chronické HCV infekce proto zatím nelze podat ani boceprevir ani telaprevir. Česká hepatologická společnost ČLS JEP a Společnost infekčního lékařství ČLS JEP podnikají od roku 2011 veškeré kroky nutné k tomu, aby v pokud možno nejkratší době byla tato virostatika v ČR dostupná.
Je však nepochybné, že po určitou přechodnou dobu zůstane kombinace pegylovaných interferonů a ribavrinu terapeutickou možností pro pacienty s chronickou HCV infekcí. Pro toto přechodné období by měly být použity následující doporučené postupy, které vychází především z modifikovaných doporučení pro léčbu HCV infekce publikované Evropskou asociací pro studium jater v červnu 2011.
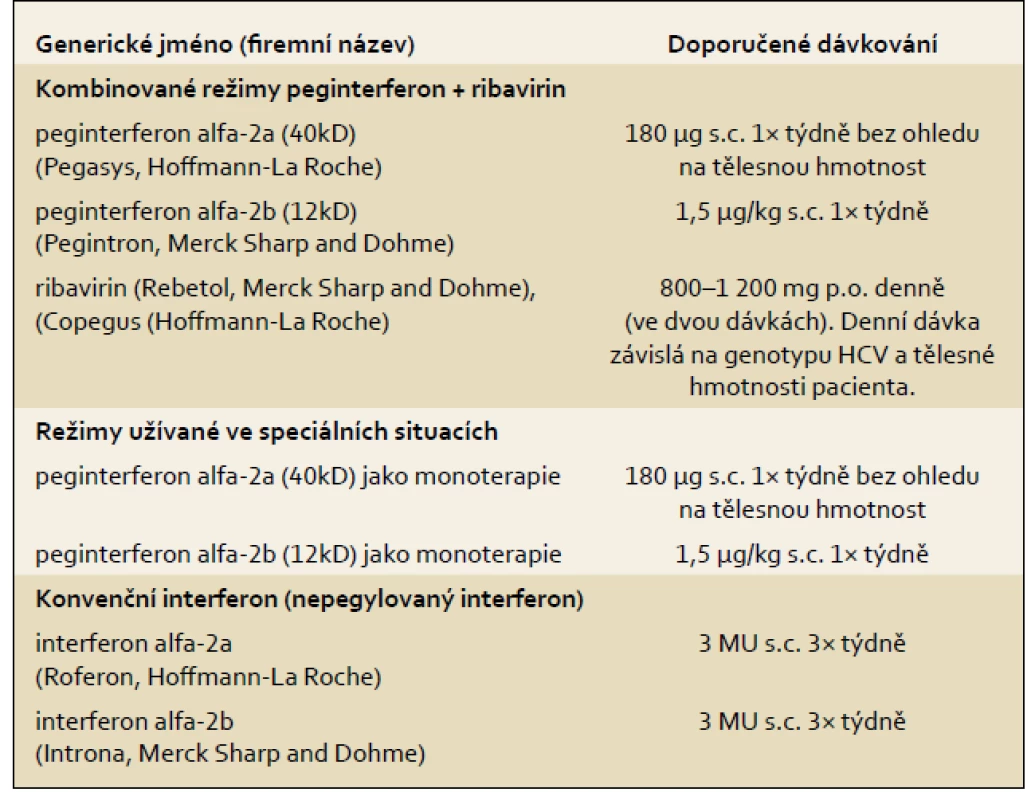
10.1 Účinnost terapie PEG-IFN + RBV a předpovědní faktory odpovědi na terapii
V současné době jsou pro terapii HCV infekce schváleny dva typy pegylovaných interferonů dvou různých výrobců (tab. 2). Uvedená dávkovací schémata byla schémata užitá ve třech registračních studiích s kombinovanou terapií PEG-IFN + RBV.
Výsledky terapie kombinací PEG-IFN ++ RBV ze tří registračních studií v závislosti na základních výchozích parametrech a použitém terapeutickém schématu ukazují tab. 3 a 4.

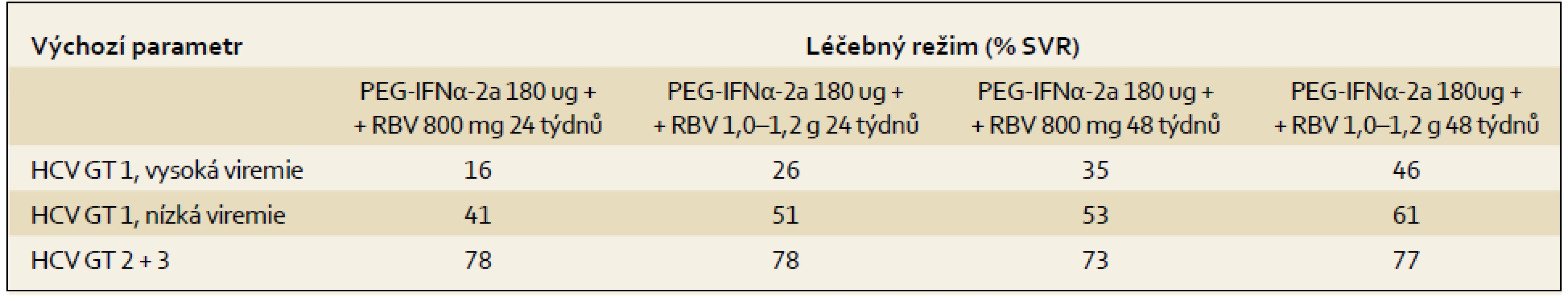
Nejdůležitější faktory asociované s dosažením SVR jsou:
- genotypy HCV 2 a 3
- nízká viremie (udávaná různými autory v rozmezí 400 000–800 000 IU/ml)
- nižší stupeň fibrózy (F1, F2)
- nižší tělesná hmotnost či menší povrch těla
- dosažení RVR
- genotyp IL28B
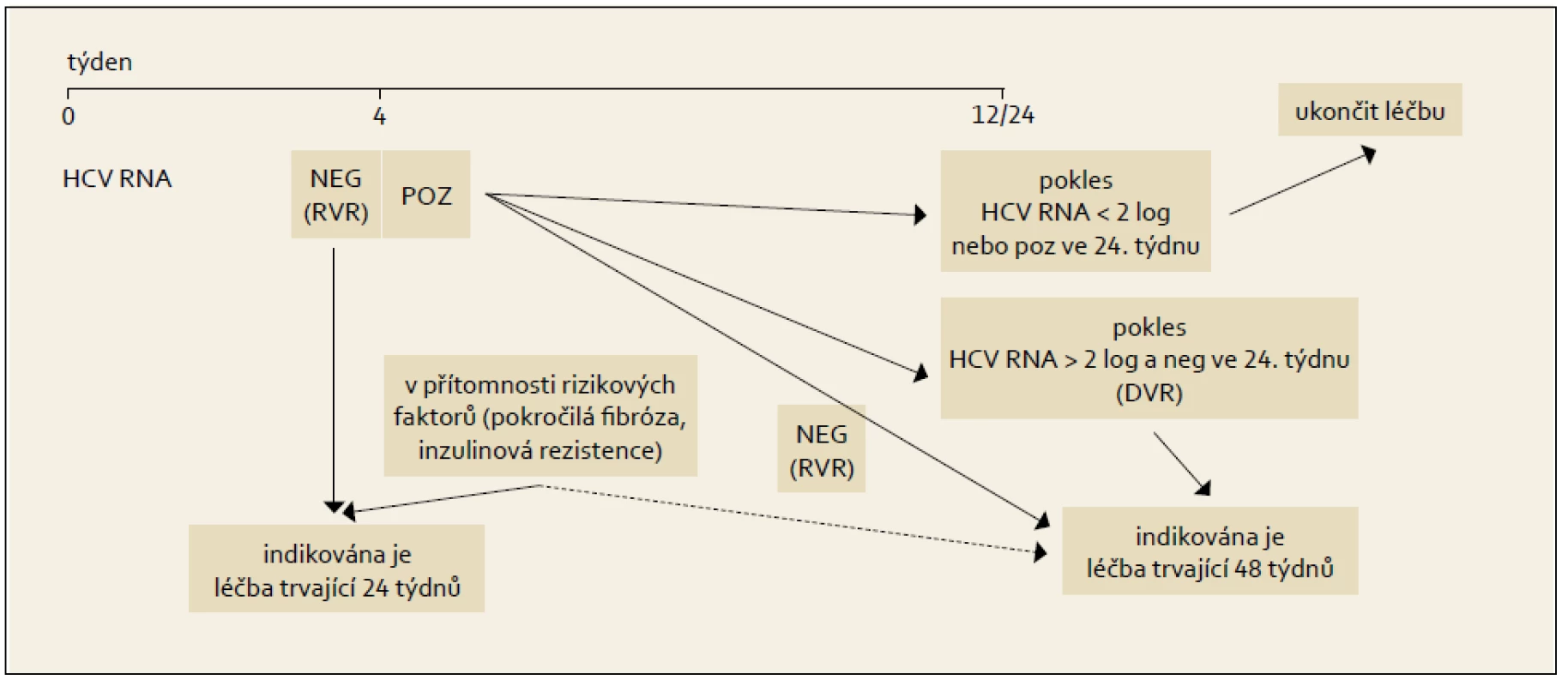
10.2 Modifikovaný terapeutický algoritmus dosud neléčeného pacienta s chronickou HCV infekcí
Po roce 2001 byla publikována řada klinických studií, které se snažily dosáhnout větší individualizace léčebného schématu, než byla fixní schémata použitá v registračních studiích s pegylovanými interferony. Jedná se o první kroky ve smyslu zavádění již zmíněné Response Guided Therapy (RGT), tedy léčby modifikované podle dosažené odpovědi v počátcích protivirové léčby.
Princip RGT obsahuje modifikovaný algoritmus kombinované léčby PEG-IFN+RBV, který ukazuje obr. 6 a 7.
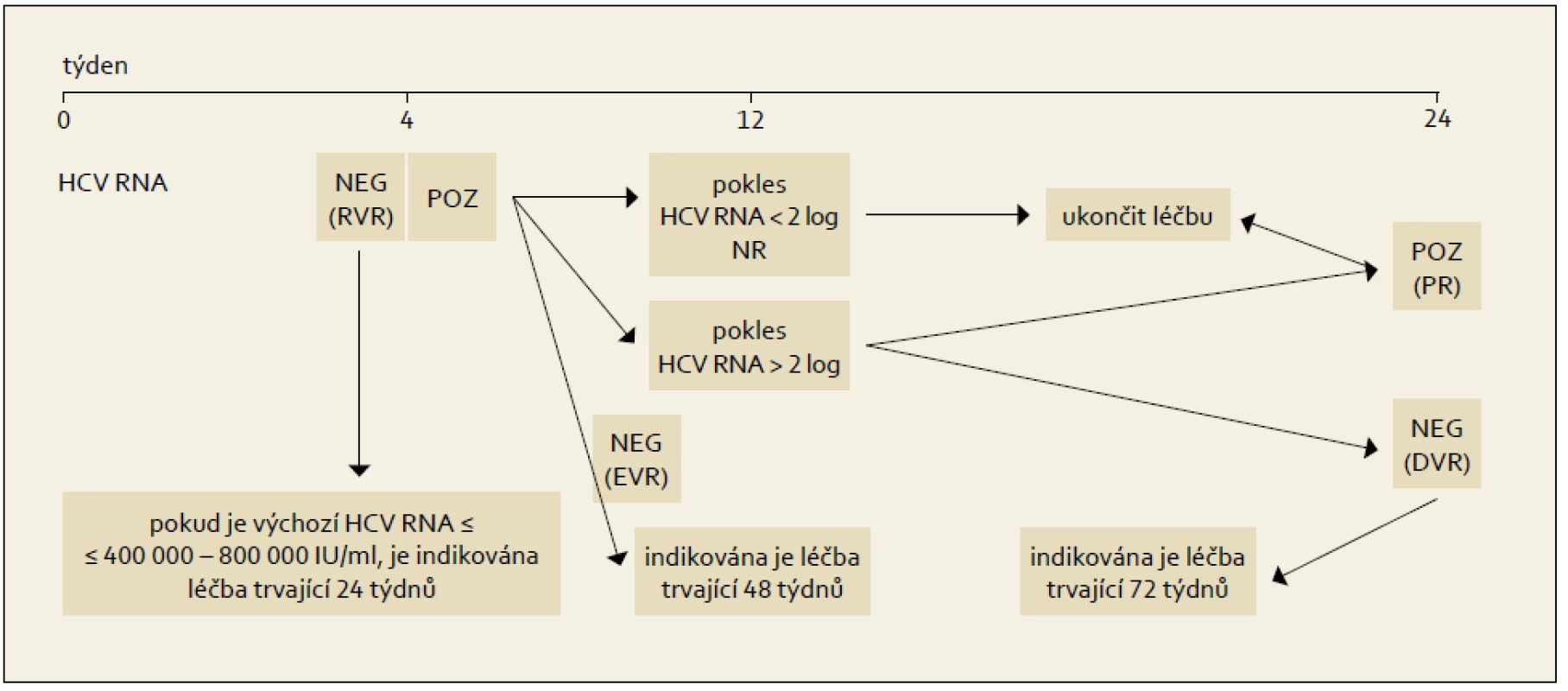
10.3 Terapie při kontraindikaci ribavirinu
Při kontraindikaci ribavirinu je odůvodnitelná monoterapie IFN, např. u pacientů na hemodialýze. Monoterapií IFN lze dosáhnout významně nižší SVR než kombinovanou terapií. Monoterapie má být přednostně vedena pegylovaným IFN.
10.4 Opakovaná terapie PEG-IFN + RBV
U pacientů infikovaných genotypem HCV 1, u kterých došlo k selhání předchozí protivirové léčby, je třeba v současné době pečlivě zvážit, zda je nezbytně nutné léčbu zahájit ještě před uvedením DAA na trh v ČR. U těchto pacientů je dosaženo při terapii založené na podání DAA významně vyšší účinnosti než při opakovaném použití kombinace PEG-IFN + RBV (více viz kap. 8). Tato vyšší pravděpodobnost dosažení SVR může odůvodnit odložení opakované léčby. Pacienti musí být o této skutečnosti informováni před případným zahájením opakované léčby kombinací PEG-IFN + RBV.
Pacienti infikovaní genotypy HCV 2 a 3, u nichž léčba PEG-IFN + RBV podle pravidel pro první léčbu selhala, mohou být pravděpodobně léčeni opakováním kombinace PEG-IFN + RBV podle běžných pravidel pro genotyp HCV 1 (tj. 48 týdnů při váhově definovaném režimu dávkování RBV).
Při úvahách o opakované léčbě pacientů s chronickou HCV infekcí je třeba zvážit následující faktory:
- genotyp HCV
- předchozí léčebný režim a rozdíl v účinnosti mezi současnými léčebnými možnostmi a tímto režimem
- pravděpodobnou příčinu selhání dosavadní léčby (např. virologická rezistence vs nízké dávkování)
- genotyp IL28B – pokud je znám
- závažnost existujícího jaterního postižení (stupeň jaterní dysfunkce)
- spolupráci a motivaci pacienta pro další léčbu
- epidemiologická rizika
- genotyp HCV a další prediktivní (pozitivní i negativní) faktory terapie
- toleranci léčby
Pro opakování léčby s použitím kombinace PEG-IFN + RBV platí následující skutečnosti a pravidla.
10.4.1 Pacienti relabující a pacienti s NR na předchozí terapii PEG-IFN + RBV
Znalosti o průběhu virologické odpovědi v počátcích léčby a o jejím vztahu k dosažení SVR ukazují na to, že reálnou naději na dosažení SVR mají pouze pacienti, kteří jsou ve 12. týdnu opakované léčby HCV RNA negativní (EVR ve smyslu výše uvedené definice). Pacienti, kteří byli ve 12. týdnu léčby pozitivní, dosáhli SVR pouze v 7 % případů (studie EPIC-3). Podobných výsledků bylo dosaženo ve studii REPEAT s použitím kombinace PEG-IFNα-2a a RBV.
Opakovaná léčba by měla být vedena po dobu delší než 12 týdnů pouze v těch případech, kdy je ve 12. týdnu dosaženo negativní sérové HCV RNA metodou PCR se standardním detekčním limitem. Optimální trvání léčby je v těchto případech 72 týdnů.
Revidovaná aktuální znění SPC preparátů PEG-IFN umožňují v indikaci opakované léčby použít PEG-IFNα-2a i PEG-IFNα-2b. Oba preparáty by měly být podávány v kombinaci s ribavirinem.
Při úvahách o zahájení opakované léčby je třeba pečlivě zvážit, zda stupeň jaterní dysfunkce u daného pacienta není již indikací ke zvážení jaterní transplantace. V těchto případech by protivirová léčba měla být vedena pouze v transplantačních centrech.
U pacientů s NR na předchozí léčbu je nutno počítat s významně nižší pravděpodobností úspěchu léčby než u pacientů relabujících.
10.4.2 Pacienti léčení režimy s konvenčním IFN
Počet pacientů, kteří byli v minulosti léčeni pouze některým z režimů založených na podání nepegylovaného rekombinantního či přirozeného interferonu, je v současné době v ČR pravděpodobně velmi malý. V těchto případech je možno použít analogický terapeutický postup jako pro pacienta dosud neléčeného. Kvalifikace odpovědí i prediktivní hodnoty jednotlivých typů virologické odpovědi a dalších faktorů jsou velmi podobné jako v případech dosud neléčených pacientů.
SVR lze dosáhnout u 25–40 % pacientů, u kterých selhala monoterapie konvenčním IFNα a u cca 10 % pacientů, u kterých selhala kombinace konvenční IFN + RBV. Pacienti s genotypy HCV 2 a 3 odpovídají na opakovanou léčbu lépe než pacienti s genotypem HCV 1.
11. Terapie chronické infekce virem hepatitidy C u zvláštních skupin pacientů
11.1 Pokročilé jaterní onemocnění (jaterní cirhóza)
Současné znalosti o účinku či rizicích a nežádoucích účincích protivirové terapie s použitím DAA u pacientů s jaterní cirhózou jsou limitované a byly probrány v kap. 7. S ohledem na nedostupnost DAA lze i nadále uvažovat o nutnosti léčit tyto pacienty kombinací PEG-IFN + RBV.
Znalosti o bezpečnosti a účinnosti interferonu (konvenčního či pegylovaného) s ribavirinem, či bez ribavirinu u pacientů s pokročilým jaterním onemocněním jsou odvozeny z analýzy podskupin ve větších klinických studiích. SVR je dosahováno významně méně často než u pacientů bez cirhózy. Pro pacienty s dekompenzovanou jaterní cirhózou je terapií volby jaterní transplantace. Studie s protivirovou terapií u pacientů čekajících na jaterní transplantaci v současné době probíhají, u některých pacientů však byly pozorovány potenciálně život ohrožující vedlejší účinky protivirové léčby. Průběh léčby v řadě případů vyžaduje doplnění protivirové léčby o podpůrnou terapii hluboké myelosuprese růstovými faktory. Terapie by v této indikaci měla být vedena pouze v rámci klinických studií v transplantačních centrech.
11.2 Děti ve věku do 18 let
Doporučení týkající se diagnostiky (včetně jaterní biopsie) u dětí s podezřením na HCV infekci jsou stejná jako pro dospělé osoby. V této věkové skupině nebyla DAA dosud zkoumána. Děti narozené anti-HCV pozitivním matkám mají velmi často transplacentárně přenesené protilátky a trvání pozitivity je závislé na titru, většinou přetrvává méně než 12–15 měsíců po narození. K vyloučení perinatální akvirace může být využit rt-PCR na HCV RNA ve čtvrtém měsíci života. U dětí do 2–3 let je pozorována spontánní eradikace viru, proto není doporučováno rutinní testování HCV RNA u novorozenců HCV RNA pozitivních matek. Testování anti-HCV a HCV RNA by mělo být provedeno až po 18. měsíci věku dítěte i s přihlédnutím, že kombinovaná terapie je do tří let života kontraindikována.
Extrahepatální manifestace, včetně kryoglubulinemie, vaskulitidy a membranoproliferativní glomerunefritidy, nejsou u dětí popisovány. Děti mohou být koinfikovány HBV nebo HIV, zvláště při perinatální akviraci infekce. U dětí mohou být přítomny protilátky, anti--LKM1 (v evropských studiích až v 10 %), ANA a ASMA. Děti s anti-LKM1 pozitivitou mají ve vzorku jaterní biopsie vyšší skóre fibrózy, těžší průběh jaterního onemocnění a horší odpověď na terapii.
V roce 2003 byla FDA schválena kombinovaná léčba interferonam alfa a ribavirinem u dětí ve věku od 3–17 let, v roce 2009 ve stejné věkové skupině byla schválena kombinovaná léčba peginterferonem alfa-2b a ribavirinem. Léčba peginterferonem alfa-2b je i v indikacích v SPC Pegintronu (EMA).
Studie s monoterapií IFN dosahovaly poněkud vyšší účinnosti (% SVR) než u dospělých, cca 33–45 % (podle systematického přehledu 36 %), SVR u kombinované terapie konvenčním IFN a ribavirinem 43–60 % (49 %). Studie s monoterapií PEG-IFN jsou zcela ojedinělé se SVR 43 %. Kombinovaná terapie PEG-IFN + RBV podle systematického přehledu dosahuje SVR v 69 %, u GT 1 51 %, u GT 2,3 98 % a v malých studiích u GT 4,9 a 12 75 %, resp. 80 % Léčba konvečním IFN, pegylovaným interferonem a ribavirinem u dětí do tří let věku je považována za kontraindikovanou. V současné době je doporučena kombinovaná terapie s individuálním přístupem u dětí starších tří let pegylovaným interferonem a ribavirinem s lepší adherencí i vyšším SVR než u konvenčního interferonu alfa v kombinaci s ribavirinem. Obvyklé dávkování je u PEG-IFNα-2b 1,5 µg/kg 1× týdně a ribavirin 15 mg/kg denně, resp. u PEG-IFNα-2a 180µg/1,73m2 1× týdně a ribavirin 15 mg/kg denně. Optimální doba zahájení antivirové terapie u dětí není jednoznačně dána. Při vertikálním přenosu infekce nebo v časném dětství je HCV infekce asociována s minimálním klinickým nálezem a pomalou progresí jaterní fibrózy. Na druhé straně negativním prediktivním faktorem úspěšnosti terapie je doba od přenosu infekce k zahájení terapie a věk při přenosu infekce. Známky progredující fibrózy by měly být indikací k zahájení terapie. Kritický věk pro rozvoj fibrózy, a tedy pro zahájení terapie, je osm let věku dítěte u vertikáního přenosu nebo u přenosu v časném dětství.
U starších dětí a adolescentů je indikována terapie u potvrzené přítomnosti viru po dobu delší než šest měsíců. V současnosti je doporučována jako standardní kombinovaná léčba dětí pegylovaným interferonem a ribavirinem s lepší adherencí i vyšším SVR než u konvenčního interferonu alfa v kombinaci s ribavirinem. Obvyklé dávkování je u PEG-IFNα-2b 1,5 µg/kg 1× týdně a ribavirin 15 mg/kg denně, resp. u PEG-IFNα-2a 180 µg/1,73 m2 1× týdně a ribavirin 15 mg/kg denně, alternativou může být kombinace konvenčního rekombinantního interferonu alfa v minimální dávce 1,75 IU/m2 3× týdně s ribavirinem 15 mg/kg/den, což odpovídá u ribavirinu nejvyšší odpovědi na terapii při minimalizaci vzniku vedlejších účinků. Podle genotypu by měla být u genotypu 1 a 4 léčba vedena 48 týdnů, u genotypu 2 a 3 pak 24–48 týdnů podle dosažení EVR, resp. RVR.
Léčba dětí a adolescentů v ČR může být upravena odlišně v samostatném dodatku těchto doporučených postupů.
11.3 Dialyzovaní nemocní
Pacienti zařazení do pravidelného dialyzačního léčení (PDL) představují velmi speciální skupinu nemocných s chronickou HCV infekcí. Důležitým kritériem pro rozhodování o zahájení protivirové léčby pacienta v PDL je perspektiva transplantace ledviny. V ostatních případech je třeba uplatnit individuální přístup, zvážení závažnosti a především možných rizik vyplývajících z podání protivirové léčby. Léčba pacientů v PDL by měla být vedena na pracovišti majícím s touto skupinou nemocných zkušenosti.
Terapie by měla být vedena zpočátku redukovanou dávkou PEG-IFN za současné a trvalé blízké monitorace stavu pacienta. Pro PEG-IFNα-2a bylo prokázáno, že dávka 135 µg vede u HD pacientů k dosažení podobných hladin léku jako dávka 180 µg. Optimální dávka ribavirinu pro kombinaci není jednoznačně definována. Jako bezpečné se jeví podávání RBV v dávce 200–400 mg týdně. Na základě několika menších pilotních studií lze při dobré toleranci za frekeventní monitorace stavu pacienta uvažovat i o podání dávek vyšších.
Odmítnutí protivirové terapie pacientem není absolutní kontraindikací transplantace ledviny. Protivirová léčba podaná po provedení transplantace ledviny je spojena s vysokým rizikem rejekce a selhání štěpu, podání interferonu (konvenčního i pegylovaného) je proto v této situaci kontraindikováno, výjimkou je fibrotizující cholestatická hepatitida s progredujícím selháním jater.
11.4 Aktivní uživatelé drog
Drogová závislost je uvedena v Mezinárodní statistické klasifikaci nemocí a přidružených zdravotních problémů. Na pacienta drogově závislého je proto nutné pohlížet jako na člověka nemocného. Ani medicínsky ani eticky není tedy odůvodnitelné odmítnutí jakékoli léčby uživatelům drog. Rozhodující je vždy zvážení přínosu a rizika pro individuálního pacienta.
Aktivní abúzus alkoholu a drog negativně ovlivňuje adherenci k léčbě. Drogově závislí mají častější výskyt poruch mentálního zdraví, častější psychiatrické onemocnění. Obojí dále zhoršuje adherenci k terapii. Studie léčených pacientů s aktivní drogovou závislostí ukazují srovnatelný efekt terapie chronické HCV infekce s jinými skupinami infikovaných osob. Rychlá inhibice replikace viru hepatitidy C (již během 8 hod po aplikaci interferonu) zabraňuje dalšímu šíření infekce.
Zcela zásadní podmínkou pro zahájení terapie je motivace pacienta a jeho adherence k terapii. Zvýšení adherence lze dosáhnout pravidelnými kontrolami a aplikací pegylovaného interferonu v ordinaci jednou týdně. Předčasné ukončení terapie na základě špatné adherence je častější v prvních 12 týdnech. Kontrolou pomůcek a další intervencí u uživatelů drog lze snížit riziko reinfekce.
K léčbě musí být pacient motivován a musí spolupracovat, aby bylo možno snížit riziko rozvoje závažných nežádoucích účinků terapie. Tyto často souvisejí se současným užívání drog a kombinované protivirové terapie. Léčba drogově závislých je multifaktoriální a multioborová. Předpokládá zajištění psychiatrické intervence, sociálního šetření. Drogově závislý musí být před léčbou vyšetřen psychiatrem nebo lékařem pro léčbu závislostí. Často se jeví jako výhodné zahájení terapie antidepresivy (SSRI) nejméně 14 dní před zahájením terapie PEG-IFN a RBV. K uživatelům drog musí být vždy individuální přístup.
Pacienti na substituční léčbě jsou považováni za pacienty s kontrolovaným psychiatrickým onemocněním. Postup, diagnostika a terapie virové hepatitidy C u spolupracujícího pacienta, u pacienta s aktivní drogovou závislostí (nebo na substituční terapii) jsou shodné s doporučeným postupem u pacientů bez závislosti.
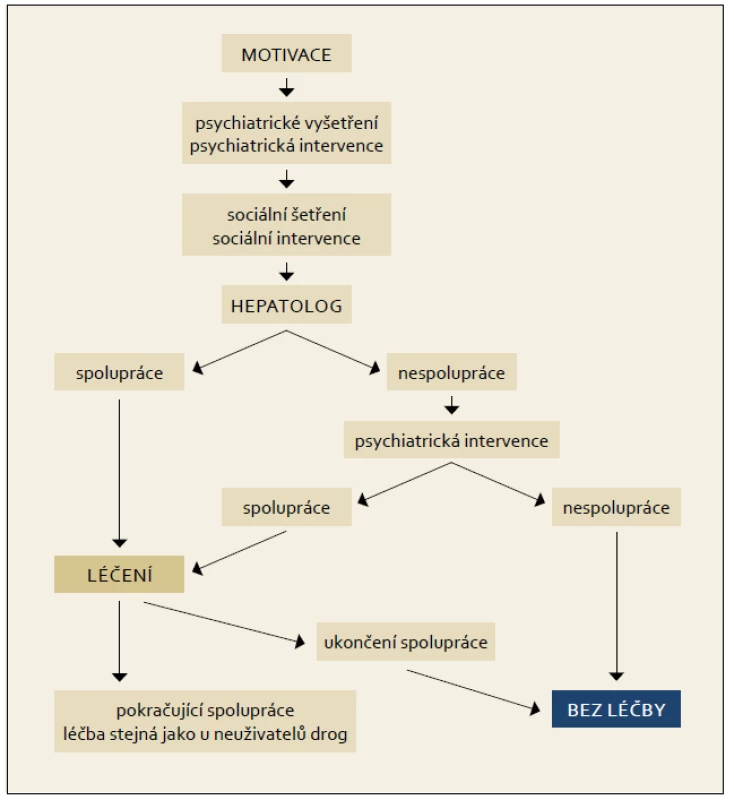
11.5 Pacienti s koinfekcí HCV + HIV
11.5.1 Základní fakta
- HIV negativně ovlivňuje průběh akutní i chronické HCV infekce. Pacienti HIV pozitivní s chronickou infekcí HCV mají 3× vyšší riziko rozvoje jaterní cirhózy než osoby HIV negativní. Vyšší riziko je i pro rozvoj hepatocelulárního karcinomu.
- Jaterní choroby, zejména vzniklé v souvislosti s chronickou HCV infekcí, jsou v současnosti nejčastější příčinou úmrtí mezi HIV pozitivními pacienty.
- HIV/HCV koinfikované osoby mají významně vyšší viremii než osoby infikované jenom HCV.
- Hladina CD4+-lymfocytů je nejspolehlivějším prediktorem progrese jaterního postižení u osob HIV/HCV pozitivních. Dalšími predikčními faktory jsou: pohlaví, trvání HCV infekce a konzumace alkoholu.
- Přes možné hepatotoxické vlivy kombinované antiretrovirové terapie (cART) se zdá, že její podání výrazně zpomaluje progresi jaterního postižení u HCV/HIV osob. Všem koinfikovaným osobám by proto měl být podán některý z režimů cART.
- Data o průběhu HIV infekce u koinfikovaných osob, tj. jak průběh HIV ovlivňuje HCV infekce, nejsou dosud jednoznačná a nelze z nich dělat žádné závěry.
11.5.2 Diagnóza HCV/HIV koinfekce
Všechny osoby HIV pozitivní by měly být vyšetřeny na HCV infekci. Zde je třeba myslet na skutečnost, že část osob s HIV infekcí (a především s nízkým počtem CD4+-lymfocytů) je anti-HCV negativní nebo že titr anti-HCV je minimální, a je proto neprokazatelný. U všech HIV pozitivních osob je tedy správné uvažovat vždy o vyšetření sérové HCV RNA metodou PCR. U všech HIV pozitivních osob, u kterých je sérová HCV RNA negativní (zejména u těch, které jsou přitom anti-HCV pozitivní), je třeba vyšetření několikrát opakovat.
Jaterní biopsie se týkají stejná doporučení jako u HIV negativních osob (viz kap. 13). Vzhledem k vyššímu riziku závažnějšího jaterního postižení je u koinfikovaných osob jaterní biopsie jednoznačně indikována. Všem osobám HIV pozitivním by měla být doporučena vakcinace proti HBV (pokud jsou HBsAg a anti-HBs negativní) a vakcinace proti viru hepatitidy A (HAV). Samozřejmostí je minimalizace expozice všem ostatním hepatotoxickým vlivům (zejména alkoholu).
11.5.3 Terapie
Standardním terapeutickým postupem je kombinace PEG-IFN a ribavirinu v běžném dávkování jako u osob HIV negativních. Kombinovaná terapie chronické HCV infekce při koinfekci HIV je plně indikována u pacientů s normálním počtem CD4+-lymfocytů, i když SVR je dosahováno méně často (ve 20–44 % případů) než u samotné infekce HCV. Častější je výskyt vedlejších účinků terapie.
Ribavirin je inhibitorem IMPDH (nozin monofosfát dehydrogenázy), proto je kontraindikovaná kombinace s purinovým analogem didanosinem. Současná terapie ribavirinem a didanosinem zvyšuje mitochondriální toxicitu, může vést k pankreatitidě, k laktátové acidóze a k dekompenzaci jaterní cirhózy. Terapie stavudinem také zvyšuje toxicitu. Současná terapie se zidovudinem zvyšuje riziko dřeňového útlumu (kombinace interferonu, zidovudinu a samotného HIV). Opatrnost musí být i při podání nenukleosidového inhibitoru RT efavirenzu, který zhoršuje neuropsychický efekt interferonu. U koinfekce HIV a HCV by měla být zahájena včasná cART, jež je pozitivním prediktivním faktorem úspěšnosti terapie chronické HCV infekce. Někteří experti doporučují zahájení cART u sníženého počtu CD4+-lymfocytů pod 500/µl. Ve stávajícím doporučeném postupu je zahájení cART při absolutním počtu CD4+-lymfocytů < 350/µl. Zahájení cART zavisí nejen na počtu CD4+-lymfocytů, ale i na virové náloži HIV RNA a klinické stavu pacienta.
Zhodnocení histologického nálezu z jaterní biopsie je důležité v rozhodovacím procesu terapie. Pokud je chronická virová hepatitida zjištěna v iniciálních stadiích HIV infekce, je zahájena nejdříve terapie chronické virové hepatitidy. Při absolutním počtu CD4+-lymfocytů < 200/µl je nutná nejprve restaurace pomocí cART a následné rozhodnutí o terapii HCV infekce. U akutní virové hepatitidy by měla být pro velké riziko rozvoje chronické HCV infekce zahájena terapie HCV vždy, a to buď monoterapií interferonem alfa, nebo kombinací PEG-IFN + RBV. Nejpříznivějším predikčním faktorem efektu terapie je genotyp jiný než 1, nízká virová nálož a dobrá adeherence k terapii. Monoterapie PEG-IFN je účinnou variantou (SVR v 20 %) pro pacienty s některou kontraindikací či nesnášenlivostí ribavirinu.
Terapie HCV infekce má pozitivní efekt i pro pacienty bez dosažení SVR: > 30 % osob bez dosažení virologické odpovědi během léčby vykázalo významné histologické zlepšení. Zdá se tedy, že u pacientů HCV/HIV koinfikovaných s pokročilou fibrózou či již rozvinutou jaterní cirhózou představuje udržovací terapie racionální postup. Pokles CD4+-lymfocytů, ke kterému obligatorně dochází, je ve většině případů reverzibilní po skončení léčby. Snížení virové nálože HIV během terapie (anti-HIV aktivitou interferonu alfa) se po ukončení terapie vrací k původním hodnotám.
U osob, u kterých i přes výše uvedené postupy dojde k progresi jaterní cirhózy, lze uvažovat o provedení jaterní transplantace. V ČR tuto indikaci nelze zatím považovat za standardní.
11.6 Pacienti s koinfekcí HCV + HBV
Neexistují zatím žádná obecně platná doporučení pro léčbu pacientů s koinfekcí HBV/HCV. Je nutný individuální přístup a postupné uplatňování nových zkušeností s léčbou těchto problémových pacientů. U naprosté většiny těchto pacientů replikace HCV tlumí replikaci HBV, proto lze zpravidla v séru prokázat HCV RNA, zatímco sérová hladina HBV DNA je pod hranicí detekovatelnosti. Pro současnou infekci potom svědčí pozitivita HBsAg, někdy jen průkaz celkových protilátek anti-HBc. Podle výsledků klinických studií je kombinovaná terapie PEG-IFN a RBV u koinfikovaných pacientů stejně účinná vzhledem k infekci HCV jako při samostatné infekci HCV. K trvalému zvládnutí infekce HBV však nedochází a naopak útlum replikace HCV může vést k výraznému nárůstu replikace HBV s následnou akutní exacerbací chronické hepatitidy B s možnými závažnými klinickými následky (rychlá progrese chronické hepatitidy do jaterní cirhózy, dekompenzace cirhózy). U osob, u kterých i přes výše uvedené postupy dojde k progresi jaterní cirhózy, lze uvažovat o provedení jaterní transplantace. V ČR díky nízké prevalenci HIV nebyl takový pacient k transplantaci indikován a program transplantace pro HCV + HIV nebyl dosud zahájen.
11.7 Pacienti se symptomatickou smíšenou kryoglobulinemií
Indikace protivirové léčby se v těchto případech řídí stejnými zásadami jako v typických případech infekce HCV. Ohledně vhodného terapeutického schématu není jednoznačné doporučení. Iniciální terapie by měla spočívat v podání standardní dvojkombinace PEG-IFN + ribavirin po dobu vždy alespoň 48 týdnů (bez ohledu na genotyp viru). Tento režim poskytuje nejvyšší naději na dosažení SVR, která podmiňuje trvalé vymizení produkce kryoglobulinů. Pokud tato léčba selže, dojde k relapsu infekce nebo je pacient rezistentní, je možno uvažovat o dlouhodobé (v některých případech i o doživotní) monoterapii PEG-IFN, která ve většině případů vede k omezení virové replikace, a tím k omezení (či dokonce k vymizení) produkce kryoglobulinů, v důsledku čehož dochází k udržení klinické remise onemocnění.
11.8 Pacienti s chronickou HCV infekcí a s klinickou manifestací porfyria cutanea tarda
Porfyria cutanea tarda (PCT) je považována za jednu z extrahepatálních manifestací chronické HCV infekce. Mechanizmus ovlivnění aktivity uroporfyrinogen dekarboxylázy (URO-D) v případě HCV infekce není dosud znám. Zdá se, že při úvahách o podání protivirové léčby se v těchto případech lze rovněž řídit stejnými zásadami jako v typických případech infekce HCV. Dosud není jasné, zda dosažení remise PCT (klinické i laboratorní) je podmínkou pro zahájení protivirové terapie. Podle současných znalostí se zdá vhodnější nejdříve dosáhnout remise PCT terapií antimalariky (např. chlorochinem) a teprve poté zahájit protivirovou terapii. Zdá se, že samotná protivirová léčba k navození remise PCT nevede.
12. Kritéria vyléčení HCV infekce
Kritériem vyléčení HCV infekce je dosažení setrvalé virologické odpovědi (viz kap. 4.4).
Pozn.: Z definice setrvalé odpovědi byla vypuštěna normální aktivita ALT. Zvýšená aktivita ALT může v některých případech přetrvávat a je dána pokročilostí jaterního poškození (významná fibróza, cirhóza jater). Výše zmíněné kritérium vyléčení se proto týká pouze infekce virem hepatitidy C, nikoli vyléčení jaterního onemocnění.
13. Role a postavení jaterní biopsie
13.1 Jaterní biopsie před léčbou
Hlavním přínosem jaterní biopsie provedené před léčbou je poskytnutí informací o stadiu fibrózy a stupni zánětu jaterní tkáně. Oba tyto parametry jsou významnou informací jak pro lékaře, tak i samotného pacienta. Znalost histologického nálezu umožňuje s vysokou pravděpodobností identifikovat pacienty s vysokým rizikem progrese jaterního onemocnění, případně s již rozvinutou jaterní cirhózou, kteří nemusí mít jedinou laboratorní či klinickou známku takto pokročilého jaterního onemocnění.
Jaterní biopsie je indikována u pacientů s trvale normální aktivitou ALT při chronické HCV infekci. Tito pacienti mají ve 14–40 % případů významnější než portální fibrózu. Osoby s takto pokročilou fibrózou jsou ve vysokém riziku progrese fibrózy bez ohledu na trvale normální biochemickou aktivitu. U osob s trvale normální biochemickou aktivitou a pokročilou fibrózou až cirhózou je indikována protivirová terapie zcela jednoznačně a jaterní biopsie je jedinou metodou, která může k tomuto rozhodnutí vést.
Jaterní biopsie je i nadále standardní součástí diagnostického procesu v případech chronické HCV infekce. V současnosti neexistuje alternativní metoda, která by byla schopna poskytnout analogické informace jinou (neinvazivní) cestou. Stanovení různých markerů fibroprodukce umožňuje stanovení pokročilých stupňů fibrózy jater, nikoli však dřívějších stadií onemocnění. Ani jiné metody (aktivita ALT, výpočet diskriminačního skóre ap.) nenahrazují histologické hodnocení aktivity v plném rozsahu.
Samotný fakt neprovedení jaterní biopsie (při kontraindikacích výkonu či při odmítnutí pacientem) nelze považovat za kontraindikaci zahájení protivirové terapie.
13.2 Jaterní biopsie po léčbě
Jaterní biopsie po ukončení terapie není standardní součástí terapeutického procesu. U pacientů se SVR lze předpokládat histologické zlepšení.
13.3 Opakování jaterní biopsie
U pacientů neléčených pro minimální stupeň jaterní fibrózy v iniciální biopsii může být opakovaná jaterní biopsie vhodným nástrojem ke zhodnocení progrese postižení. V těchto případech je doporučován interval mezi biopsiemi 4–5 let. O opakování jaterní biopsie je možno uvažovat také v případech neúspěšné terapie.
14. Možnosti histologického hodnocení
Základem histologického hodnocení je podrobný slovní popis se zhodnocením dle současné nomenklatury. Druhá část hodnocení spočívá v použití skórovacích systémů. Největšího rozšíření se dostalo Ishakově modifikaci původního Knodellova hodnocení a systému METAVIR (tab. 2). Použití těchto systémů umožňuje:
- kvantitativní zhodnocení aktivity
- odlišit grade a stage
- posoudit progresi, či naopak regresi změn u každého konkrétního pacienta
- vzájemné srovnání různých skupin nemocných
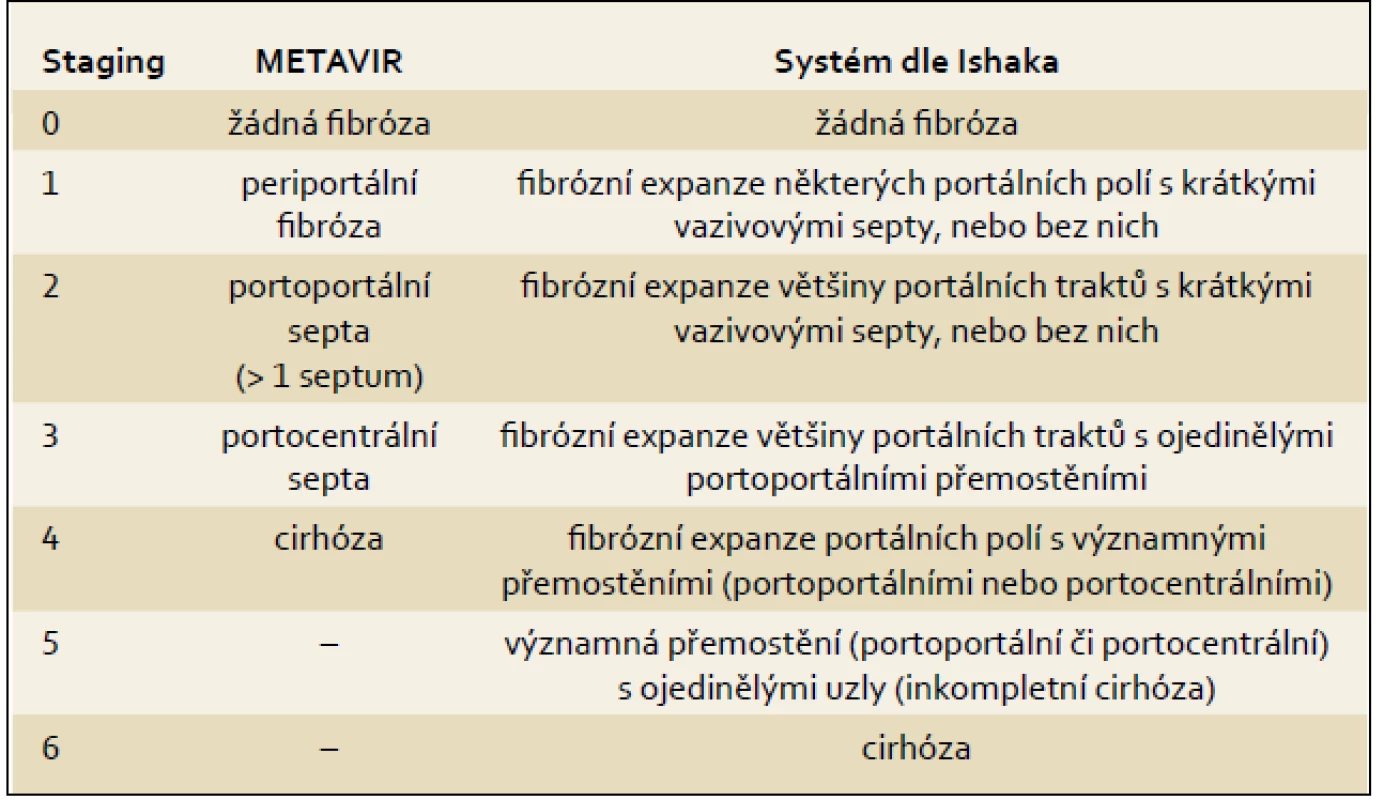
15. Dispenzarizace pacientů s infekcí virem hepatitidy C
15.1 Během léčby
Je doporučováno následující schéma laboratorních a klinických kontrol (v týdnech): 0, 2, 4, 8 a 12. V dalším období lze intervaly individualizovat podle dosaženého účinku a tolerance. Intervaly mezi klinickými a laboratorními kontrolami by však neměly přesáhnout 8 týdnů.
15.2 Po ukončení léčby
Není jednoznačné doporučení k dispenzarizaci pacientů po skončení léčby. Během prvních tří měsíců po skončení terapie je nutné zkontrolovat pacienta z pohledu odeznění nežádoucích účinků terapie (anémie, leukopenie apod.). K posouzení odpovědi na léčbu je indikováno vyšetření sérové HCV RNA 24 týdnů po skončení terapie.
Dosáhne-li pacient setrvalé virologické odpovědi, je v nekomplikovaných případech indikována klinická i laboratorní kontrola v intervalu jednoho roku, po dvou letech mohou být pravděpodobně pacienti bez známek pokročilé jaterní fibrózy či cirhózy uvolněni z dispenzarizace. Pacienti se stupněm fibrózy F3 a F4 v iniciální biopsii mají zůstat v dispenzarizaci a má jim být prováděn screening HCC.
15.3 Pacienti s trvale normální aktivitou ALT
Tito pacienti, pokud nejsou léčeni, by měli být dispenzarizováni a pravidelně kontrolováni v intervalu šesti měsíců.
15.4 Pacienti s jaterní cirhózou při chronické HCV infekci
Dispenzarizace nemocných s jaterní cirhózou se neliší od doporučení pro jiné etiologie jaterní cirhózy.
16. Vyšetřování sérové HCV RNA
Vyšetření HCV RNA je indikováno:
- v rámci prvotního vyšetření při ověřené pozitivitě anti-HCV
- v odůvodněných případech i při anti--HCV negativitě (koinfekce HCV/HIV, pacienti v PDL apod.)
- v průběhu léčby ve 24. týdnu terapie a ve 48. týdnu terapie
- po skončení terapie ve 24. týdnu
- dále kdykoli při podezření na breakthrough fenomen
- před zahájením protivirové léčby
- ve 4., 8. a 12. týdnu léčby
16.1 Genotypizace HCV
Genotypizace HCV je indikována před zahájením protivirové léčby.
17. Vakcinace proti ostatním virovým infekcím jater
Všichni pacienti s chronickou HCV infekcí by měli být očkováni proti virové hepatitidě A. Séronegativní pacienti (tj. HBsAg a anti-HBs negativní) by měli být očkováni i proti virové hepatitidě B.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.
Datum aktualizace: 4. 1. 2012.
Datum schválení výborem ČHS ČLS JEP: 13. 3. 2012.
doc. MUDr. Petr Urbánek, CSc.
Interní klinika 1. LF UK a ÚVN Praha
U Vojenské nemocnice 1200
169 01 Praha 6
petr.urbanek@uvn.cz
Sources
1. European Association for the Study of the Liver: EASL Clinical Practice Guidelines: Management of hepatitis C virus infection. J Hepatol 2011; 55(2): 245–264.
2. Ghany MG, Nelson DR, Strader DB et al. An Update on Treatment of Genotype 1 Chronic Hepatitis C Virus Infection: 2011 Practice Guideline by the American Association for the Study of Liver Diseases. Hepatology 2011; 54(4): 1433–1444.
3. Poordad F, McCone J Jr., Bacon BR et al. Boceprevir for untreated chronic HCV genotype 1 infection. N Engl J Med 2011; 364(13): 1195–1206.
4. Jacobson IM, McHutchison JG, Dusheiko G et al. Telaprevir for previously untreated chronic hepatitis C virus infection. N Engl J Med 2011; 364(25): 2405–2416.
5. Sherman KE, Flamm SL, Afdhal NH et al. Response-guided telaprevir combination treatment for hepatitis C virus infection. N Engl J Med 2011; 365(11): 1014–1024.
6. Bacon BR, Gordon SC, Lawitz E et al. Boceprevir for previously treated chronic HCV genotype 1 infection. N Engl J Med 2011; 364(13): 1207–1217.
7. Zeuzem S, Andreone P, Pol S et al. Telaprevir for retreatment of HCV infection. N Engl J Med 2011; 364(25): 2417–2428.
8. Strader DB, Wright T, Thomas DL et al. Diagnosis, Management, and treatment of hepatitis C. AASLD Practice Guideline. Hepatology 2004; 39(4): 1147–1171.
9. Manns MP, McHutchison JG, Gordon SC et al. PEG-interferon alfa-2b in combination with ribavirin compared to interferon alfa 2b plus ribavirin for initial treatment of chronic hepatitis C. Lancet 2001; 358(9286): 958–965.
10. Fried MW, Shiffman ML, Reddy KR et al. Peginterferon alfa-2a plus ribavirin for chronic hepatitis C virus infection. N Engl J Med 2002; 347 : 975–982.
11. Hadziyannis SJ, Sette H, Morgan TR et al. Peginterferon alfa-2a (40 kilodaltons) and ribavirin combination therapy in chronic hepatitis C: randomized study of the effect of treatment duration and ribavirin dose. Ann Intern Med 2004; 140(5): 346–355.
12. Zeuzem S, Buti M, Ferenci P et al. Efficacy of 24 weeks treatment with peginterferon alfa-2b plus ribavirin in patients with chronic hepatitis C infected with genotype 1 and low pretreatment viremia. J Hepatol 2006; 44(1): 97–103.
13. Zeuzem S, Pawlotsky J-M, Lukasiewicz E et al. International, multicenter, randomized, controlled study comparing dynamically individualized versus standard treatment in patients with chronic hepatitis C. J Hepatol 2005; 43(2): 250–257.
14. Recommendations for prevention and control of hepatitis C virus (HCV) infection and HCV-related chronic disease. Centers for Disease Control and Prevention. MMWR Recomm Rep 1998; 47(RR-19): 1–39.
15. Hu J, Doucette K, Hartling L et al. Treatment of Hepatitis C in Children: A Systematic Review. PLoS One 2010; 5(7): e11542.
16. Schwarz KB et al. Peginterferon with or without ribavirin for chronic hepatitis C in children and adolescents: final results of the PEDS-C trial. Hepatology 2008; 48 (4 Suppl): 418A.
17. Wirth S et al. Children with HCV infection show high sustained virologic response on peginterferon alfa-2b plus ribavirin treatment. Hepatology 2008; 48 (4 Suppl): 392A.
18. Wirth S, Ribes-Kominckx C, Calzado MA et al. High sustained virologic response rates in children with chronic hepatitis C receiving peginterferon alfa-2b plus ribavirin. J Hepatol 2010; 52(4): 501–507.
Labels
Paediatric gastroenterology Gastroenterology and hepatology SurgeryArticle was published in
Gastroenterology and Hepatology
2012 Issue 3
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Metamizole vs. Tramadol in Postoperative Analgesia
- Spasmolytic Effect of Metamizole
- The Importance of Limosilactobacillus reuteri in Administration to Diabetics with Gingivitis
-
All articles in this issue
- Jak kvalitní je Vaše kolonoskopie?
- Endosonografie v diagnostice choledocholitiázy
- Využití NBI v diagnostice a sledování pacientů s Barrettovým jícnem
- Endoskopický trénink na neživém zvířecím modelu zlepšuje endoskopické dovednosti
- Snížení dyskomfortu spojeného s kolonoskopií použitím kombinace vodní imerze a insuflace oxidu uhličitého
- Endosonograficky navigovaná alkoholová ablácia cystickej neoplázie pankreasu
- Pozitivita imunoglobulinu IgG4 v krevním séru u osob s karcinomem slinivky břišní
- Korelace indikace k resekci pankreatu s následným histopatologickým nálezem
- Antibiotická profylaxe u akutní pankreatitidy
- Očekávané počty nádorů jater, žlučníku a pankreatu ve světě
- Primární sklerozující cholangoitida u pacientů s idiopatickými střevnímí záněty
- Standardní diagnostický a terapeutický postup u chronické infekce virem hepatitidy C (HCV)
- Highlights of the 34th Czech and Slovak endoscopic days
- Zpráva o DDW 2012
- Ostrava Live Endoscopy
- Prof. MUDr. Julius Špičák, CSc., šedesátníkem
- Prim. MUDr. Karel Lukáš, CSc., sedmdesátiletý
- Moviprep® – moderní příprava střeva před vyšetřením
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Moviprep® – moderní příprava střeva před vyšetřením
- Antibiotická profylaxe u akutní pankreatitidy
- Primární sklerozující cholangoitida u pacientů s idiopatickými střevnímí záněty
- Snížení dyskomfortu spojeného s kolonoskopií použitím kombinace vodní imerze a insuflace oxidu uhličitého
