Karboxymaltóza železa: vysoce efektivní a bezpečná léčba nedostatku železa
:
M. Bortlík
:
Klinické a výzkumné centrum pro střevní záněty ISCARE I. V. F. a. s. a Interní klinika 1. LF UK a ÚVN, Praha
:
Gastroent Hepatol 2014; 68(1): 85-87
:
Drug Profile
Sideropenie a anémie z nedostatku železa patří k nejčastějším symptomům onemocnění gastrointestinálního traktu. Až 15 % pacientů přichází do gastroenterologických ambulancí k vyšetření z těchto důvodů. Cílem gastroenterologické péče je zjistit příčinu, která vedla k nedostatku železa, resp. anémii, a také tuto situaci adekvátně léčit. V současnosti se jako nejvhodnější varianta substituční terapie železem u pacientů vyžadujících rychlou korekci sideropenie nebo sideropenní anémie jeví intravenózní aplikace karboxymaltózy železa.
Podle kritérií WHO je anémie definována hodnotami Hgb pod 130 g/l u muže a 120 g/l u ženy, v graviditě se fyziologická dolní hranice snižuje na 110 g/l. Za těžkou anémii pak považujeme pokles Hgb pod 100 g/l. Sideropenní anémie je doprovázena kritickým snížením zásob železa. K jejich posouzení používáme hodnoty sérového feritinu (fyziologicky 30–100 µg/l) a saturace transferinu (fyziologicky 25–50 %), nikoli hodnoty sérového železa, jehož hladina rychle kolísá. Sideropenie je charakterizována poklesem feritinu pod 30 µg/l a saturací transferinu pod 16 %. U nemocných s aktivním zánětem se dolní hranice feritinu posouvá na 100 µg/l, neboť feritin je současně proteinem akutní fáze při zánětlivé reakci organizmu [1]. Klinické projevy anémie z nedostatku železa závisí především na rychlosti vzniku takového stavu. Nemocní s pomalým poklesem koncentrace hemoglobinu jsou obvykle na tento stav velmi dobře adaptováni. Typickými symptomy jsou únava, slabost, celková nevýkonnost, spavost, dušnost při minimální námaze, omezená fyzická výkonnost a porucha kognitivních funkcí. U predisponovaných pacientů pak rychlejší rozvoj obtíží – např. stenokardie, palpitace nebo tachykardie u nemocných s kardiovaskulárními chorobami.
Charakteristika karboxymaltózy
Karboxymaltóza železa je makromolekulární komplex obsahující trojmocné železo, který byl vyvinut s cílem napodobit fyziologické vlastnosti feritinu [2]. Celý komplex sestává z jádra tvořeného hydroxidem železitým a polysacharidového obalu – karboxymaltózy. Jeho molekulová hmotnost se pohybuje kolem 150 kD (díky tomu renální eliminace dosahuje méně než 0,1 %), má neutrální pH (pH 5–7) a fyziologickou osmolaritu. Vysoká stabilita komplexu snižuje riziko uvolňování volných iontů železa do krevní plazmy, a tím minimalizuje toxicitu látky. Další charakteristickou vlastností je absence dextranu či jeho derivátů, díky čemuž je minimalizován imunogenní potenciál karboxymaltózy železa. Nebyla prokázána ani zkřížená reaktivita s protilátkami proti dextranu. Schéma komplexu karboxymaltózy železa ukazuje obr. 1.
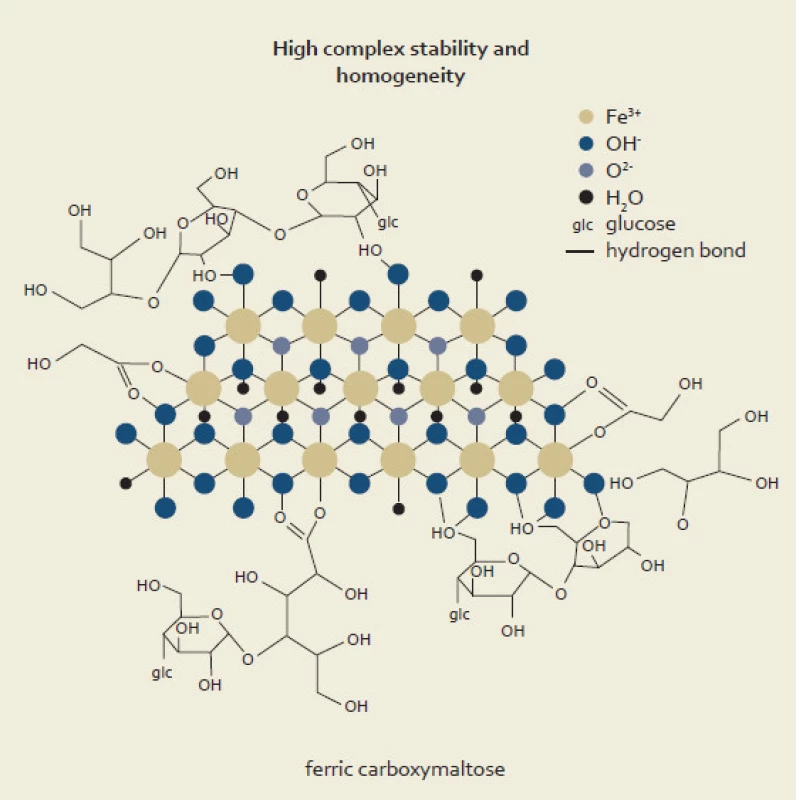
Farmakokinetika a farmakodynamika
Makromolekulární komplex karboxymaltózy je po intravenózním podání urychleně vychytáván především v kostní dřeni, v menší míře v játrech a slezině. Koncentrace látky v kostní dřeni dosahuje za 8 hod po aplikaci více než stonásobku průměrné koncentrace ve zbytku organizmu. Distribuční objem se pohybuje kolem tří litrů [3]. Celá makromolekula je přednostně zachycena v makrofázích procesem endocytózy, následně je trojmocné železo působením lyzozomálních enzymů redukováno na dvojmocné a vyloučeno do cytosolu buňky. Část takto uvolněného železa je poté exportována membránovým přenašečem feroportinem zpět do krve, působením ceruloplazminu oxidována zpět na železo trojmocné a uložena v transportní bílkovině transferinu. Zbytek volného železa je v makrofázích navázán na bílkovinu apoferitin a uložen, opět v trojmocné formě, jako feritin. Maximálních koncentrací sérového feritinu je dosahováno 48–120 hod po podání léčiva [2]. Aplikace karboxymaltózy železa vede ke zvýšení počtu retikulocytů a zvýšení hladiny feritinu v závislosti na množství podaného léčiva a výchozím stavu zásob železa. Radioaktivně značené železo obsažené v tomto preparátu je velmi efektivně využito k erytropoéze; během 24 dnů bylo spotřebováno 91–99 % takto podaného železa. V klinické praxi považujeme za adekvátní vzestup hladiny hemoglobinu o 20 g/l v průběhu 2–4 týdnů od podání léku. Nedostatečná odpověď na léčbu by měla vést k navýšení dávky, popř. přehodnocení příčiny anémie a volbě jiného způsobu léčby [4].
Způsob aplikace a dávkování
Karboxymaltóza železa je aplikována formou intravenózní injekce nebo infuze. Celkovou dávku podávaného železa v současnosti stanovujeme empiricky pomocí jednoduché tabulky (tab. 1) založené na výchozí hodnotě hemoglobinu a tělesné hmotnosti pacienta. Tento způsob je v praxi výhodnější než složitá kalkulace pomocí tzv. Ganzoniho formule.
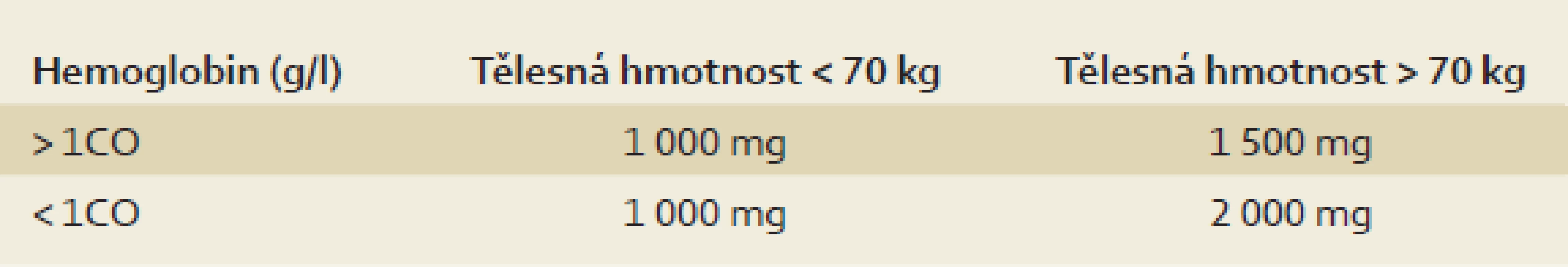
Karboxymaltóza železa je na českém trhu k dispozici v preparátu Ferinject. V 1 ml roztoku je obsaženo 50 mg železa ve formě karboxymaltózy. V případě bolusové aplikace formou neředěné intravenózní injekce je při podání dávky 200–500 mg nutno dodržet rychlost aplikace 100 mg/min. Jednorázově lze aplikovat dávku až 1 000 mg, v takovém případě je vhodnější forma intravenózní infuze. K ředění je možno použít pouze fyziologický roztok, dávku 1 000 mg obvykle podáváme v infuzi o objemu 250 ml. Interval do další aplikace by neměl být kratší než jeden týden [5].
Indikace
Gastrointestinální příčiny sideropenní anémie zahrnují poruchy vstřebávání železa nebo krvácení v oblasti trávicí trubice. U nemocných se zánětlivým onemocněním (např. idiopatické střevní záněty, IBD) může být příčina anémie kombinovaná (sideropenní anémie + anémie chronických chorob). Sideropenní anémie je častým symptomem u nemocných s celiakií, IBD, postižením trávicí trubice nesteroidními antirevmatiky, acidopeptickými chorobami gastroduodenální oblasti, nádory trávicí trubice, stavy po operacích (zejména resekcích) a dalšími méně obvyklými chorobami. Sideropenní anémie je všeobecně považována za tzv. alarmující symptom – její přítomnost je jednoznačně důvodem k pátrání po příčině, zejména je třeba provést endoskopické vyšetření. Výhodou intravenózní aplikace železa oproti léčbě perorální je především vyšší efektivita a nižší výskyt nežádoucích účinků léčby.
V gastroenterologii máme nejvíce informací o použití karboxymaltózy železa u pacientů s Crohnovou chorobou a ulcerózní kolitidou. V práci Kulniggové et al, která zahrnula 200 pacientů s IBD a sideropenní anémií, byl porovnáván efekt karboxymaltózy železa oproti perorálnímu sulfátu železa [6]. Intravenózní léčba vedla k rychlejší odpovědi (vzestupu hladiny Hgb o 20 g/l ve 2. a 4. týdnu po zahájení léčby) a méně často musela být ukončena (1,5 % vs 8 %). Ve studii FERGIcor byl na souboru 485 nemocných s IBD a sideropenickou anémií různého stupně hodnocen efekt karboxymaltózy železa oproti železu vázanému na sacharózu [7]. Po 12 týdnech od zahájení terapie vykazovalo signifikantně více pacientů léčených karboxymaltózou železa odpověď (vzestup hemoglobinu alespoň o 20 g/l) nebo normalizaci hladiny hemoglobinu (rozdíl 12,2 %, resp. 11 %). V uvedené studii byla prokázána i ekonomická výhodnost léčby karboxymaltózou železa. Vzhledem k vysokému výskytu nežádoucích účinků perorálního železa, včetně možnosti indukce relapsu IBD, lze karboxymaltózu považovat za lék volby v terapii sideropenní anémie pacientů se střevními záněty. Recentně publikovaná analýza, které se zúčastnilo 16 gastroenterologů ze 16 zemí Evropy, ukázala, že intravenózní podání vysokodávkovaného železa je považováno za nejvhodnější způsob léčby, a to bez ohledu na hloubku anémie u nemocných s IBD [8].
Mezi další, negastroenterologické indikace léčby karboxymaltózou železa patří nemocní s anémií na podkladě chronické renální insuficience nebo pacienti s anémií po chirurgických výkonech, včetně operací traumatologických. Obecně je léčba tímto preparátem vhodná u nemocných s prokázanou sideropenní anémií těžkého stupně, u nemocných s anémií lehkou, avšak nereagující na perorální léčbu nebo při její intoleranci. Lék můžeme využít i v terapii sideropenie bez anémie při neúčinnosti či intoleranci perorálního železa.
Kontraindikace a nežádoucí účinky
Mezi hlavní kontraindikace patří hypersenzitivita na jakoukoli složku přípravku a stavy spojené s nadbytkem železa v organizmu (např. hemochromatóza). Relativní kontraindikací je gravidita (lék patří do kategorie C podle klasifikace FDA). Zejména v prvním trimestru existují obavy z možného ovlivnění vývoje skeletu, v dalších fázích pak podání závisí na zvážení rizika a přínosu. I přes minimum dat se zdá být aplikace karboxymaltózy železa bezpečná v době kojení. Nejčastějšími nežádoucími účinky jsou bolesti hlavy, pocity nevolnosti, reakce v místě vpichu a přechodné zvýšení tzv. jaterních testů, především ALT. Akutní alergická reakce je extrémně vzácnou komplikací.
Závěr
Karboxymaltóza železa představuje v současné době nejefektivnější způsob léčby sideropenní anémie na našem trhu. S přihlédnutím k vysoké efektivitě, bezpečnosti a komfortu léčby (nižší počet dávek ve srovnání s jinými preparáty) lze konstatovat, že je lékem volby u pacientů vyžadujících intravenózní podání železa.
MUDr. Martin Bortlík, Ph.D.
Klinické a výzkumné centrum
pro střevní záněty ISCARE I.V.F. a. s.
Jankovcova 1569/2c, 170 00 Praha 7
mbortlik@seznam.cz
Sources
1. Hrdlička L, Kohout P, Liberda M et al. Doporučený postup pro diagnostiku a léčbu anémie u IBD. Gastroent Hepatol 2012; 66(4): 280–285.
2. Cada DJ, Levien TL, Baker DE. Ferric carboxymaltose. Hosp Pharm 2014; 49(1): 52–59. doi: 10.1310/hpj4901-52.
3. Beshara S, Sörensen J, Lubberink M et al. Pharmacokinetics and red cell utilization of 52Fe/59Fe-labelled iron polymaltose in anaemic patients using positron emission tomography. Br J Haematol 2003; 120(5): 853–859.
4. Bátovský M. Súčasný prístup k anémii u pacientov s nešpecifickými črevnými zápalmi. Gastreont Hepatol 2012; 66(2): 131–135.
5. SÚKL. Ferinject: Souhrn údajů o přípravku. Dostupné z: http://www.sukl.cz/modules/me-dication/detail.php?code=0155379&tab=texts.
6. Kulnigg S, Stoinov S, Simanenkov V et al. A novel intravenous iron formulation for treatment of anémia in inflammatory bowel disease: the ferric carboxymaltose (FERINJECT) randomized controlled trial. Am J Gastroenterol 2008; 103(5): 1182–1192. doi: 10.1111/j.1572-0241.2007.01744.x.
7. Evstatiev R, Marteau P, Iqbal T et al. FERGIcor, a randomized controlled trial on ferric carboxymaltose for iron deficiency anémia in inflammatory bowel disease. Gastroenterology 2011; 141(3): 846–853. doi: 10.1053/j.gastro.2011.06.005.
8. Reinisch W, Chowers Y, Danese S et al. The management of iron deficiency in inflammatory bowel disease – an online tool developed by the RAND/UCLA appropriateness method. Aliment Pharmacol Ther 2013; 38(9): 1109–1118. doi: 10.1111/apt.12493.
Labels
Paediatric gastroenterology Gastroenterology and hepatology SurgeryArticle was published in
Gastroenterology and Hepatology
2014 Issue 1
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Metamizole vs. Tramadol in Postoperative Analgesia
- Spasmolytic Effect of Metamizole
- The Importance of Limosilactobacillus reuteri in Administration to Diabetics with Gingivitis
-
All articles in this issue
- Several notes to the new edition
- A little IBD introduction
- Fecal calgranulin C in patients with inflammatory bowel disease
- Infliximab does not increase the risk of early postoperative complications in UC patients after a three-stage restorative proctocolectomy with IPAA
- Potentially harmful radiation exposure rate among inflammatory bowel disease patients treated with biological therapy
- Inflammatory bowel disease in patients with primary sclerosing cholangitis – a unique phenotype of IBD
- Tuberculous ileocolitis – a case report
- Leading Change in IBD 2014 – conference aimed at improving care for IBD patients showed perspectives of further development
- Does probiotic application improve clinical outcomes in colorectal surgery?
- Standards for surgical treatment of IBD – Karlovy Vary, 6.–9. 11. 2013
- Gastroforum 2014
- From XIX. Gastroforum upward to the jubilee anniversary in 2015
- Birthday anniversary of Professor Jan Bureš
- Ferric carboxymaltose: a highly effective and safe treatment of iron deficiency
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Ferric carboxymaltose: a highly effective and safe treatment of iron deficiency
- Tuberculous ileocolitis – a case report
- Birthday anniversary of Professor Jan Bureš
- Inflammatory bowel disease in patients with primary sclerosing cholangitis – a unique phenotype of IBD
