Dispenzarizace nemocných po zavedení transjugulární intrahepatální portosystémové spojky – diagnostika dysfunkce zkratu a možnosti intervence
Dispensarisation of patients after introduction of transjugular intrahepatic portosystemic shunt – diagnostics of shunt dysfunction and the possibilities of intervention
An article focuses on the overview of dispensarisation of patients after the introduction of transjugular intrahepatic portosystemic shunt mainly from the viewpoint of the diagnostics of shunt dysfunction and the possibilities of its solution.
Key words:
dispensarisation – portal hypertension – transjugular intrahepatic – portosystemic shunt
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.
Submitted:
17. 2. 2014
Accepted:
25. 3. 2014
Authors:
V. Jirkovský 1; P. Hůlek 1,2; A. Krajina 3; T. Fejfar 1; J. Žižka 3; V. Chovanec 3; Miroslav Lojík 3
; J. Raupach 3; Š. Šembera 1; V. Šafka 4; T. Vaňásek 1; O. Renc 3
Authors‘ workplace:
II. interní gastroenterologická klinika LF UK a FN Hradec Králové
1; Interní klinika LF OU, Ostrava
2; Radiologická klinika LF UK a FN Hradec Králové
3; Katedra fyziologie LF UK Hradec Králové
4
Published in:
Gastroent Hepatol 2014; 68(2): 132-138
Category:
Hepatology: Review article
Overview
Přehledový článek je zaměřen na problematiku dispenzarizace nemocných po zavedení transjugulární intrahepatální portosystémové spojky především z hlediska diagnostiky dysfunkce zkratu a možnosti jejího řešení.
Klíčová slova:
dispenzarizace – portální hypertenze – transjugulární intrahepatální portosystémová spojka
Ačkoli se již transjugulární intrahepatální portosystémová spojka (TIPS) stala integrální součástí péče o nemocné se závažnými komplikacemi portální hypertenze, stenózy zkratu jsou stále jejím hlavním problémem. Zpočátku, když byly všechny TIPS vytvořeny pomocí nepotahovaných kovových stentů, dosahovala primární průchodnost TIPS cca 50 % v prvním roce a cca 25–30 % v druhém roce po jeho vytvoření [1–5]. S příchodem dedikovaného potaženého stentu (stentgraftu) expandovaným polytetrafluoroetylenem (e-PTFE) došlo k významnému zlepšení primární průchodnosti TIPS na 80–86 % jeden rok po vytvoření TIPS [6–9].
Dysfunkce zkratu vede k rekurenci portální hypertenze s opětovným rizikem vzniku objemného ascitu či dalšího varikózního krvácení. Toto je hlavní důvod nutnosti pravidelné dispenzarizace nemocných po zavedení TIPS s aktivním sledováním a hodnocením funkce zkratu. Důležité je i sledování nemocných stran možného rozvoje či zhoršení jaterní encefalopatie po TIPS, kdy je refrakterní encefalopatie indikací k redukci zkratu.
Definice dysfunkce zkratu
Ve zcela obecné rovině zahrnuje pojem dysfunkce TIPS jak hypofunkci zkratu, která může být primární (např. při použití krátkého stentu) nebo sekundární (při stenóze či okluzi zkratu), tak i hyperfunkci zkratu, která se manifestuje jaterní encefalopatií, jaterním selháním či pravostranným srdečním selháním a vyžaduje redukci či okluzi zkratu. V literatuře je tento pojem často užíván jen v jeho užším slova smyslu, a to pouze pro sekundární nedostatečnost (insuficienci) TIPS vyžadující intervenci. Proto i my v dalším textu užíváme tento pojem v tomto jeho užším významu.
Dysfunkce TIPS je dána klinicky znovuobjevením příznaků portální hypertenze nebo morfologicky přítomností okluze či hemodynamicky významné stenózy. Ačkoli neexistuje jednotně uznávaná definice dysfunkce TIPS, většina autorů ji definuje jako zúžení zkratu o více než 50 % a/nebo vzestup portosystémového gradientu (PSG) nad 12 mmHg.
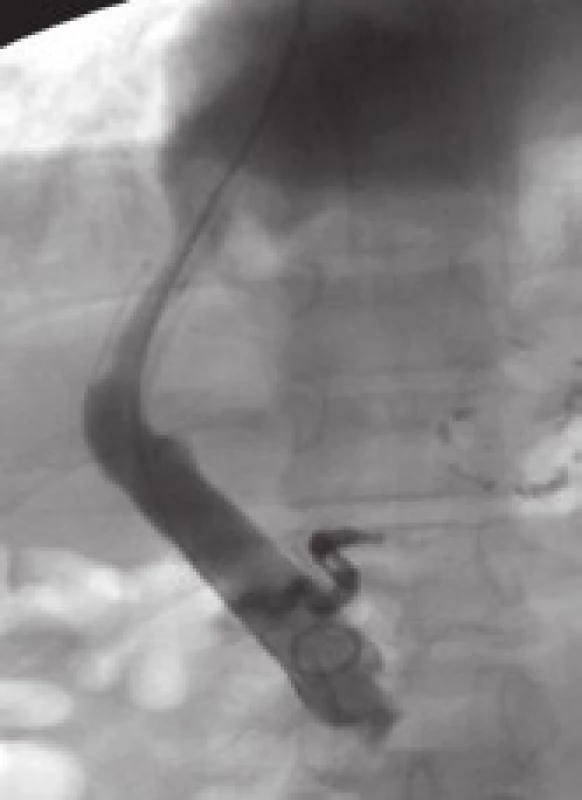
Podle časového hlediska se dělí dysfunkce TIPS na časnou, která je dána výskytem do 30 dnů od výkonu, a pozdní vyskytující se za více než 30 dnů od vytvoření spojky [10]. Podle lokalizace se dělí stenózy TIPS na vtokovou (inflow), intraparenchymovou a výtokovou (outflow) stenózu (obr. 1).
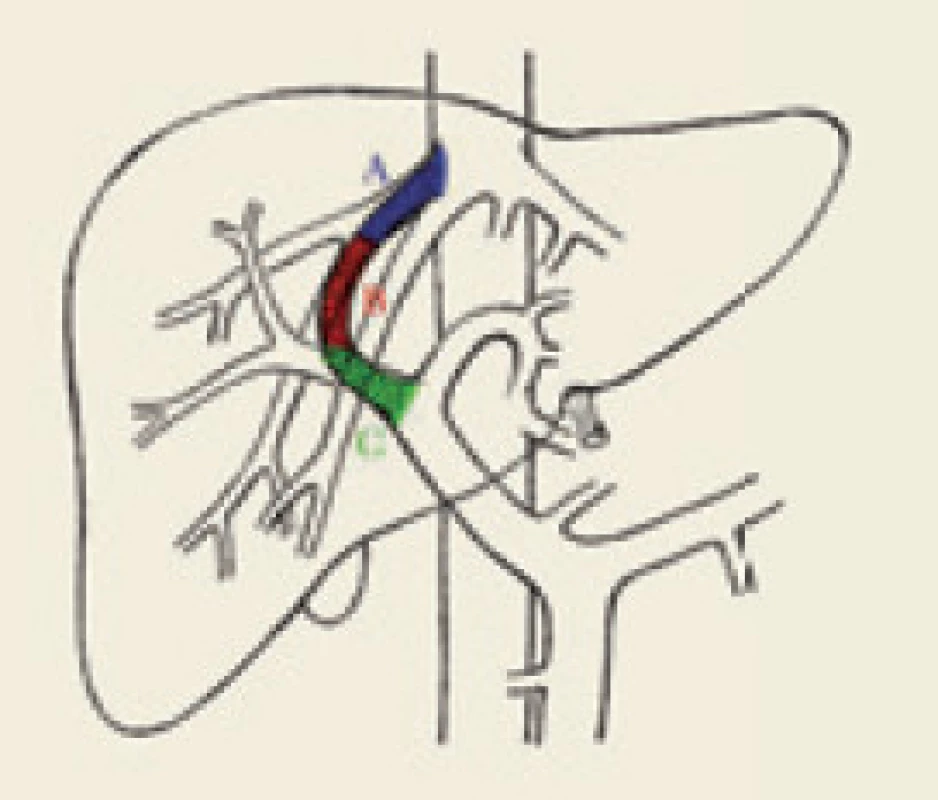
Inflow stenóza se nachází v portální žíle a je relativně málo častá. Intraparenchymová stenóza má více či méně tendenci být difuzní v celé intraparenchymové části zkratu, způsobuje převážně časnou dysfunkci TIPS a častěji vede k recidivě projevů portální hypertenze. Outflow stenóza je lokalizována ve výtokové části TIPS, obvykle v nestentované, ale i stentované jaterní žíle, je častá, vyskytuje se hlavně v pozdní fázi a méně často vede k recidivě klinických projevů portální hypertenze. Výtoková a intraparenchymová stenóza se často vyskytují současně. Dle Saxona není rozdíl v manifestaci klinických příznaků portální hypertenze u časné a pozdní dysfunkce TIPS (55 % vs 56 %), ale tento rozdíl je patrný u intraparenchymové a výtokové stenózy (75 % vs 32 %), což platí hlavně pro pozdní dysfunkci TIPS [4]. V souladu s tím prokazují i naše výsledky [11] fakt, že čím více je morfologická příčina dysfunkce TIPS lokalizována kaudálněji, tím častější jsou klinické příznaky portální hypertenze, jako je krvácení či ascites. Naopak, čím více je morfologická příčina kraniálněji, tím méně často jsou tyto klinické známky portální hypertenze přítomny. Statisticky významného rozdílu však bylo dosaženo pouze mezi kaudálně uloženými (vtokovými) a kraniálně uloženými (výtokovými) stenózami (80 % vs 25 % symptomatických).
Patofyziologie dysfunkce TIPS
Maturace zkratu je komplexní proces, který je zahájen ihned po vytvoření zkratu intrahepatální balonovou dilatací se zavedením stentu. Již během 15 min po implantaci stentu adherují trombocyty a leukocyty a vytvoří tenkou vrstvu primárního trombu (obr. 2). Vznik primárního trombu neovlivňuje pouze intraluminální povrchová trombogenicita, ale i schopnost krve se srážet a mechanické síly krevního proudu ve zkratu. Velikost primárního trombu ovlivňuje aktivitu následného pseudointimálního růstu. Po dvou týdnech je již celý zkrat pokryt fibrózní vrstvou, která je na povrchu tvořena kontinuální vrstvou endotelu. Tuto vrstvu nazýváme pseudointima (obr. 3). Její tloušťka se může pohybovat od 50 do 3 500 µm, ale pokud přesáhne 1 000 µm, mluvíme o pseudointimální hyperplazii [12]. Zdá se, že pseudointimální přerůstání je jev, který se sám zpomalí a zastaví. Vzestupná fáze trvá prvních šest měsíců po zavedení TIPS a poté následuje fáze plato [13].
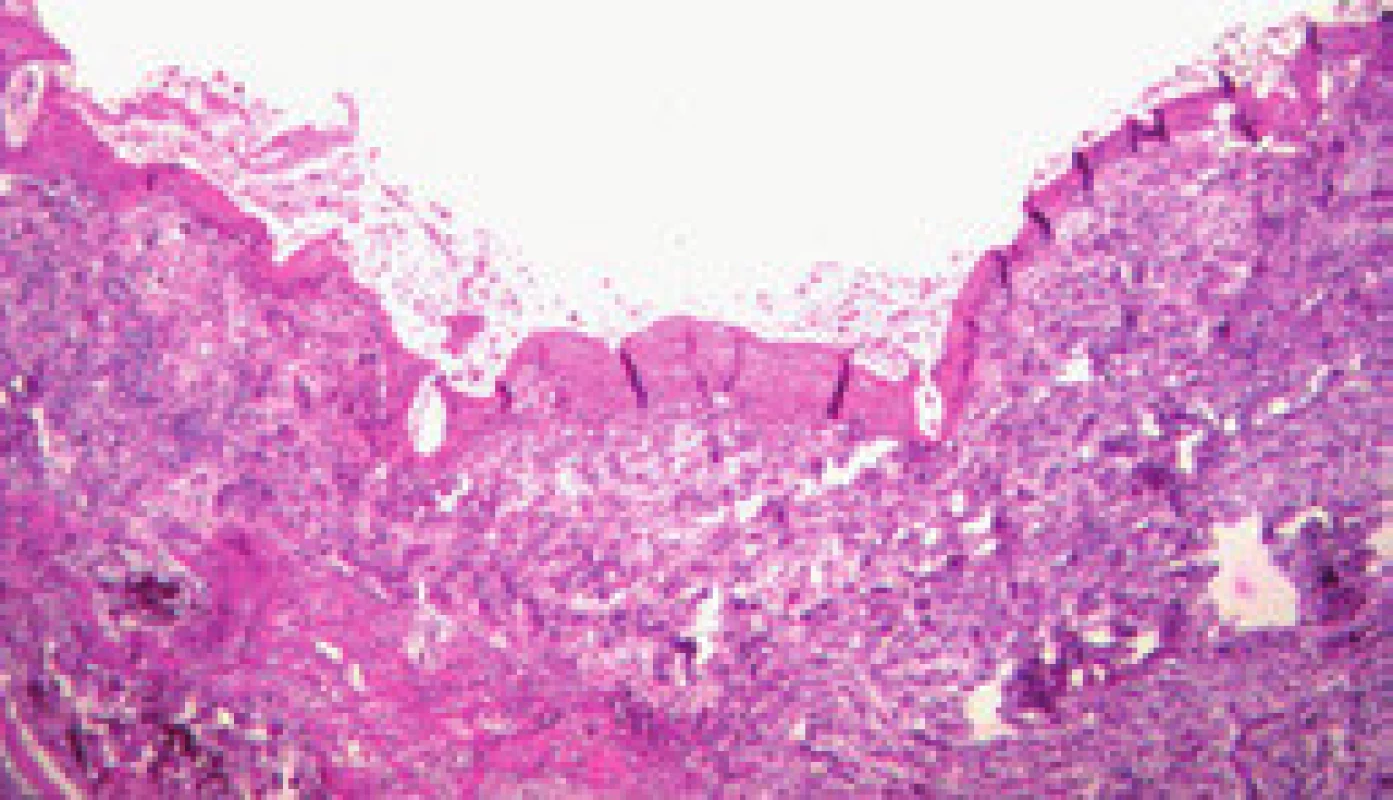
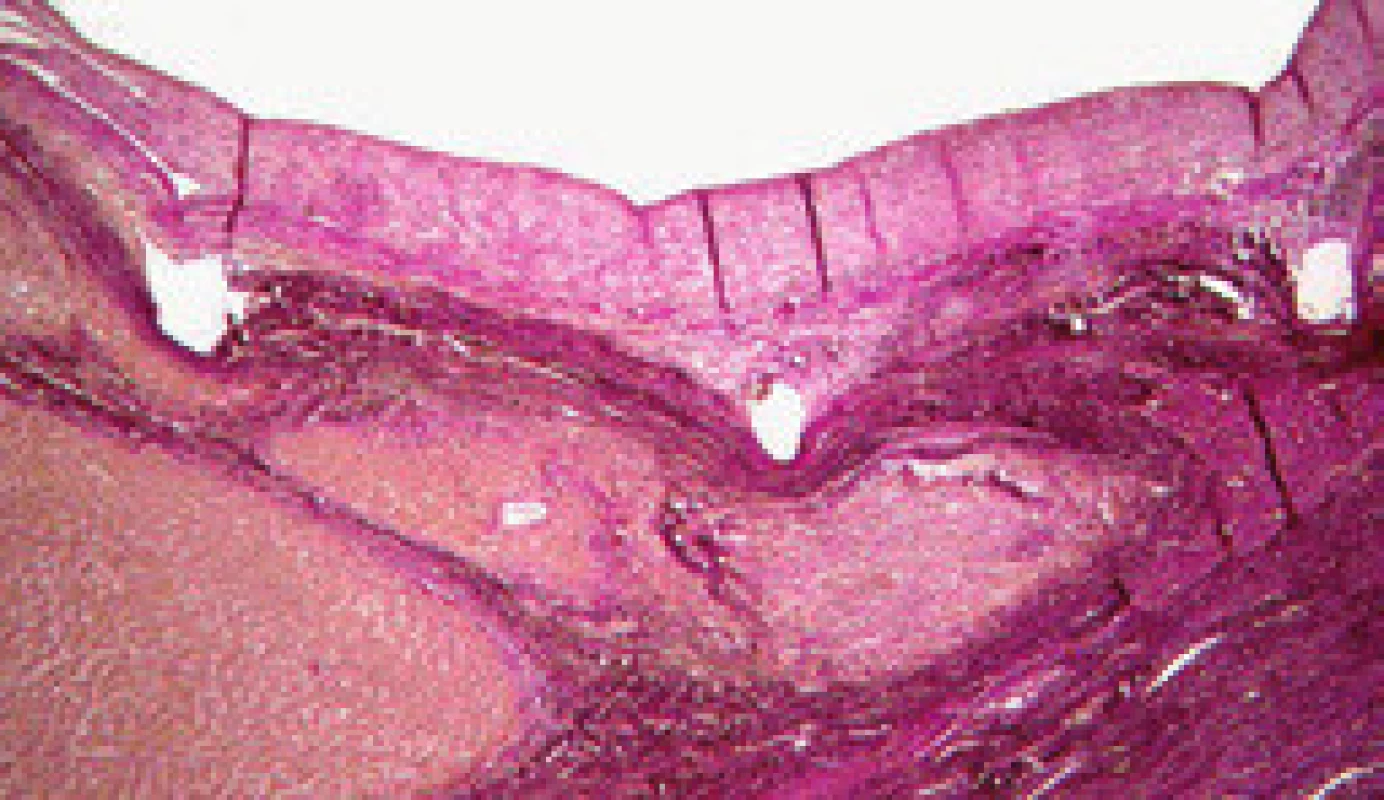
Mezi hlavní příčiny dysfunkce TIPS patří akutní trombóza zkratu (obr. 4), pseudointimální hyperplazie v intraparenchymové části zkratu (obr. 5) a intimální hyperplazie v oblasti jaterní žíly (obr. 6).
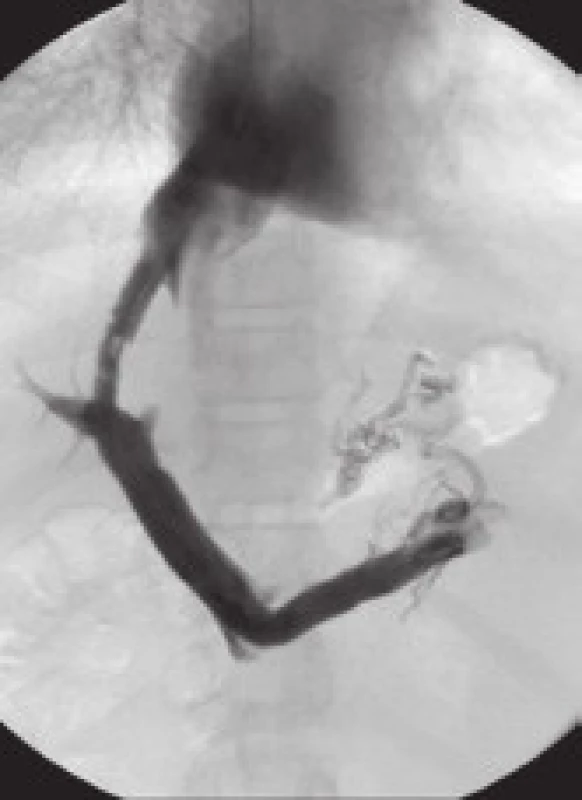
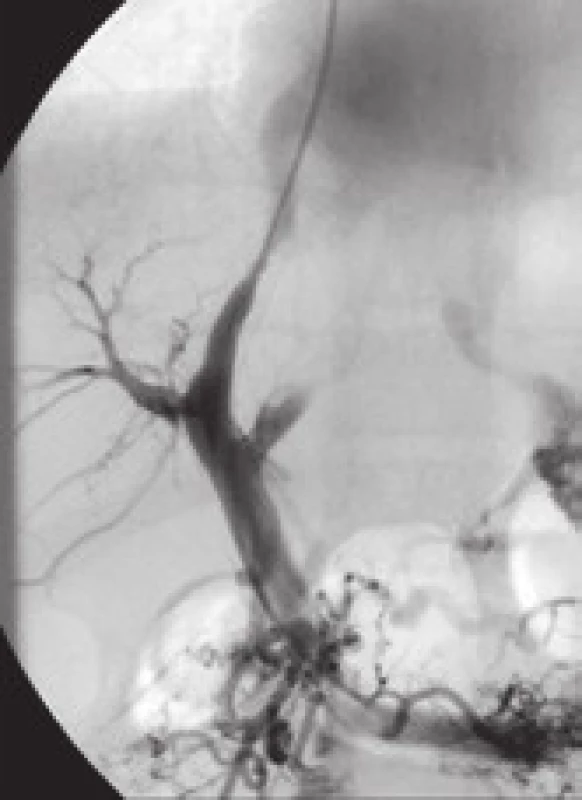
Pacienti s Budd-Chiari syndromem na podkladě protrombotického stavu mají vyšší riziko trombózy či stenózy zkratu než ostatní nemocní léčení metodou TIPS [14]. Naopak nemocní s více pokročilou jaterní cirhózou mohou mít díky trombocytopenii a koagulopatii nižší riziko trombózy a díky menší velikosti primárního trombu i nižší riziko pseudointimální hyperplazie.
Dilatace intraparenchymové části zkratu způsobuje laceraci žlučových kanálků, které mohou mít různý vliv na vytvoření lokálního trombu dle velikosti jejich průměru. Opakovaně byla prokázána přítomnost biliární píštěle u pacientů s akutní nebo opakující se trombózou TIPS [15–19]. Dále je biliární sekrece z hyperplastického biliárního epitelu spojována se značným zánětlivým potenciálem, který může způsobit chronickou intraparenchymální stenózu [19]. Zásadní se zdá být práce Tenga et al [20], která prokazuje, že žluč je paradoxně silným inhibitorem proliferace hladkých svalových buněk in vitro a že inhibuje vyzrávání endoteliálních buněk, což ve svých důsledcích může vést k růstu trombu a následné hyperplazii pseudointimy. Týž autor později prokázal, že inhibiční vliv žluče na endoteliální buňky je významný, pokud je koncentrace žluče vyšší než 20 % [21].
Výtoková stenóza TIPS vzniká na podkladě hyperplazie intimy v úrovni výtokového traktu, tedy v oblasti jaterní žíly. Její vznik se dává do souvislosti s chronicky zvýšeným průtokem krve jaterní žilou po vytvoření TIPS, což vede k tzv. „shear stressu“, který je známým mechanizmem vzniku stenóz v tepenném řečišti u chirurgických anastomóz (AV píštěle pro dialýzu, bypassy) [22,23].
Vtoková stenóza může být způsobena vrůstáním hepatocelulárního karcinomu do portální žíly nebo jejích hlavních větví nebo technickou chybou při zavedení TIPS, kdy je stent umístěn příliš kraniálně.
Z dalších parametrů, které mohou ovlivnit průchodnost TIPS, jako jsou třeba šíře portální žíly, anatomická lokalizace a angulace (zalomení) stentu, krevní obraz (počet trombocytů), byl pouze u věku prokázán statisticky významný rozdíl mezi skupinou pacientů s dlouhodobě dobrou a dlouhodobě špatnou průchodností TIPS. Pacienti se špatnou průchodností TIPS byli statisticky významně mladší [24].
Diagnostika dysfunkce TIPS
Ačkoli méně než třetina nemocných s dysfunkcí TIPS má klinické příznaky, při recidivě klinických známek portální hypertenze, pro které byl TIPS vytvořen (krvácení z jícnových varixů, ascites, hydrothorax), bývá prakticky u všech nemocných přítomna významná stenóza či okluze zkratu. Protože dysfunkce TIPS je častá, opakující se a dopředu neodhadnutelná, je nutná rutinní dispenzarizace všech pacientů se zavedeným TIPS.
Nejlepší dispenzarizační schéma není známo, proto se mezi jednotlivými centry liší, ale obecně se nedoporučuje pouze čekat na recidivu symptomů portální hypertenze. To je teoreticky možné pouze u nemocných léčených pomocí TIPS pro ascites, ale nikdy ne u nemocných léčených pro krvácení, kde může být další ataka variceálního krvácení fatální [25]. Také se v jednotlivých centrech liší, kdo pacienta stran průchodnosti TIPS sleduje. Někde je to intervenční radiolog a někde hepatolog. Vzhledem k tomu, že je u každého nemocného se zavedeným TIPS nutno kromě pouhé průchodnosti zkratu sledovat i jaterní funkce, eventuální rozvoj jaterní encefalopatie a také provádět screening hepatocelulárního karcinomu, preferuje naše centrum dispenzarizaci hepatologem, který ale s radiologem úzce spolupracuje.
Průchodnost TIPS lze sledovat portální venografií, dopplerovským ultrazvukem, spirální CT angiografií, scintigrafií a nebo ji hodnotit nepřímo endoskopicky (pouze u pacientů léčených pro krvácení z varixů). Taktika dispenzarizace je založena na získání základních údajů (např. portogram a PSG bezprostředně po vytvoření TIPS či ultrazvukové parametry sledované při dopplerovském ultrazvuku během prvních pár dnů po vytvoření TIPS), které jsou v čase porovnávány s následujícími vyšetřeními.
Dopplerovský ultrazvuk se stal primárním zobrazením při screeningu stenóz či okluzí TIPS vzhledem k jeho neinvazivitě, dobré dostupnosti a relativně nízké ceně v porovnání s jinými možnými zobrazovacími modalitami. Nicméně je používáno mnoho různých ultrazvukových parametrů ke zhodnocení průchodnosti zkratu s různou variabilitou výsledků, proto není přesnost ultrazvuku v detekci dysfunkce TIPS dobře stanovena. Je publikována řada studií s různou senzitivitou a specificitou dopplerovského ultrazvuku v detekci dysfunkce TIPS, ale obecně lze říci, že čím více parametrů se sleduje a porovnává, tím je jeho přesnost lepší. Mezi sledované ultrazvukové parametry průchodnosti TIPS patří rychlost toku v průběhu celého zkratu, rychlost toku v kmenu portální žíly, směr toku v portální žíle a směr toku v přijímací jaterní žíle. Při sledování těchto parametrů (tab. 1) bylo na našem pracovišti dosaženo 96% senzitivity a 100% specificity pro detekci okluze zkratu a 94% senzitivity pro detekci stenózy TIPS s 96% pozitivní prediktivní hodnotou [26].
![Základní dopplerovská kritéria pro zhodnocení funkce TIPS [26].
Tab. 1. Basic Doppler criteria for the evaluation function TIPS [26].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/de31f06256df04d3c43a3efc9738b533.png)
Portální venografie je stále zlatým standardem při vyšetření průchodnosti TIPS, protože poskytuje přímé zobrazení stenózy či eventuální zobrazení plnicích se jícnových varixů a zároveň poskytuje možnost přímého změření PSG a současně i provedení eventuální intervence. Nicméně vzhledem k její ceně a invazivitě je většinou indikována až jako sekundární vyšetření po ultrazvuku, i když v některých centrech je prováděna i ambulantně. Ale nemocní, kteří již mají klinické symptomy recidivy závažných komplikací portální hypertenze (recidiva variceálního krvácení či refrakterního ascitu), jsou indikovaní přímo k portální venografii s navazující intervencí.
Na našem pracovišti je při každé kontrole pacienta se zavedeným TIPS rutinně proveden dopplerovský ultrazvuk zkratu a dále je zhodnocen celkový klinický stav nemocného (encefalopatie, recidiva komplikací portální hypertenze, laboratorní nález). V některých sporných případech může pomoci i horní endoskopie (velikost jícnových varixů, tíže portální gastropatie). Při suspekci na dysfunkci TIPS je indikována hospitalizace s provedením portální venografie, změřením PSG a eventuální intervencí. Základní ultrazvukové charakteristiky jsou většinou měřeny první nebo druhý den po zavedení TIPS a slouží k porovnání s hodnotami získanými při následné dispenzarizaci. Další již ambulantní kontroly jsou obvykle časovány jeden, tři a šest měsíců po zavedení TIPS a dále dle potřeby po třech až šesti měsících. U nemocných s dedikovaným ePTFE stentgraftem a stabilními UZ parametry průchodnosti zkratu mohou být další kontroly časovány až po jednom roce, ale ve spádu musí probíhat kontroly zaměřené na monitoraci jaterních funkcí a screening hepatocelulárního karcinomu v minimálně šestiměsíčních intervalech. Základní dopplerovská kritéria pro zhodnocení funkce TIPS používaná na našem pracovišti jsou uvedena v tab. 1 [26].
Intervence a prevence dysfunkce TIPS
Při podezření na dysfunkci TIPS je nutno o dalším postupu rozhodnout v kontextu celkového klinického stavu nemocného. Neměly by být léčeny pouze „radiologické nálezy“ bez znalosti klinických údajů. Obecně u nemocných primárně indikovaných k TIPS pro variceální krvácení není při ultrazvukovém podezření na stenózu TIPS vhodné dlouho čekat na recidivu krvácení, ale indikovat časnou portální venografii s eventuální intervencí. Při sporných ultrazvukových nálezech může pomoci gastroskopie se zhodnocením endoskopických známek portální hypertenze. Naopak u nemocných primárně indikovaných k TIPS pro refrakterní či intraktabilní ascites je možno při podezření na stenózu TIPS z ultrazvuku (bez známek recidivy či progrese ascitu) s eventuální intervencí vyčkávat. Zdrženlivější postup se doporučuje hlavně u nemocných s anamnézou jaterní encefalopatie a u nemocných s pokročilejším jaterním onemocněním, kde plné zprůchodnění zkratu může vést k recidivě encefalopatie či jaternímu selhání. Taktéž u nemocných již zařazených na čekací listinu k transplantaci jater nemusí být revize zkratu nezbytná vzhledem k reálné šanci časné transplantace [25].
Při intervenci pro stenózu TIPS mluvíme o revizi zkratu, při intervenci pro okluzi o rekanalizaci. Stenóza může být dilatována pomocí balonové angioplastiky samostatně nebo v kombinaci se zavedením dalšího stentu [27]. Akutní trombóza TIPS může být řešena mechanickou fragmentací, aspirací nebo dislokací trombu a u pacientů s nízkým rizikem krvácení i lokální trombolýzou. Plicní embolizace vzniklá při těchto manévrech zpravidla nebývá klinicky významná. V současnosti je akutní trombóza TIPS indikací k zavedení ePTFE potahovaného stentu [18,28–30]. Pokud jde o chronickou trombózu zkratu, kterou se již nepodaří zrekanalizovat či je pokles PSG po revizi TIPS nedostatečný, je alternativou vytvoření nového paralelního TIPS. Na našem pracovišti bývá intervence prováděna pouze u hospitalizovaných pacientů po minimálně šestihodinovém lačnění v mírné analgosedaci. Výkon je prováděn ve sterilním režimu angiografického sálu, proto rutinní antibiotická profylaxe není vyžadována, ale přistupujeme k ní vždy, pokud je během výkonu zaváděn nový potahovaný stent. Přístupovým místem k intervenci je téměř vždy pravá jugulární žíla.
Jak již bylo řečeno, dysfunkce TIPS má různé příčiny a bývá lokalizována v různých místech zkratu, proto by měl preventivní zásah vedoucí k prodloužení průchodnosti TIPS ideálně postihovat všechny možné příčiny. Z toho vyplývá, že hledání prostředků, které by vedly primárně či sekundárně k prodloužení průchodnosti TIPS, bylo zaměřeno několika směry (farmakoterapie, brachyterapie, lokální použití antiproliferativní látky, použití stentgraftu).
U pacientů s normální krevní srážlivostí (Child-Pugh A) nebo u pacientů s hyperkoagulačním stavem (Budd-Chiariho syndrom při myeloproliferativním syndromu) můžeme předejít časné trombóze zkratu podáním heparinu či warfarinu. Antikoagulační terapie však neovlivní výskyt pozdních stenóz zkratu, proto dlouhodobá léčba není, vyjma nemocných s hyperkoagulačním stavem, indikována [31].
Podávání antiagregační terapie (kyselina acetylsalicylová) neovlivní průchodnost TIPS [32]. Výskyt výtokové stenózy TIPS však může být redukován podáním trapidilu (látka s anti-PDGF aktivitou) v kombinaci s ticlopidinem [33].
Preventivní brachyterapie (intraluminální ozařování zkratu) může být bezpečně provedena jako součást revize TIPS [34,35]. Dlouhodobé výsledky, doposud známé pouze z malého počtu nemocných, se jeví slibně spíše u pacientů s jaterní cirhózou etylické etiologie [35]. Studie s větším souborem nemocných již však nebyly provedeny.
V experimentu na prasatech se jeví úspěšně lokální podání paclitaxelu (látka blokující mitotickou aktivitu buněk) v době vytvoření TIPS na inhibici pseudointimální hyperplazie [36].
Jako nejslibnější v prevenci jak časné, tak i pozdní dysfunkce TIPS se zdá použití stentgraftu, který vytvoří bariéru mezi krví a jaterním parenchymem. V experimentu byly zkoušeny stentgrafty pokryté různým materiálem (jako např. PET – polyester, PETP – polyetylentereftalát, PU – polyuretan, PCU – polykarbonuretan, silikon, ePTFE – expandovaný polytetrafluoretylen) nebo stejným materiálem s různou permeabilitou. Nejlepší výsledky byly dosaženy se stentgraftem potaženým ePTFE. Ostatní materiály nevedly ke zlepšení průchodnosti TIPS ve srovnání s nepotahovanými stenty hlavně díky jejich poréznosti, vyšší trombogenicitě a zánětlivé reakci [12].
Poprvé byl u člověka použit stengraft (Palmaz stent potažený ePTFE) v roce 1996 při rekanalizaci trombotizovaného TIPS u pacienta s dokumentovanou biliární píštělí [37]. Od té doby se začaly používat nejprve podomácku vyráběné a později komerčně dostupné ePTFE stentgrafty jak pro revizi, tak i primoimplantaci TIPS se zlepšením dlouhodobé průchodnosti zkratu [18,28,29,38–42]. U prvních stentgraftů, které měly potah pouze v oblasti intraparenchymálního traktu zkratu, došlo k poklesu výskytu intraparenchymových stenóz a okluzí zkratu, ale nebyl zaznamenán efekt na výskyt výtokových stenóz [12,43].
V současnosti je pro TIPS nejčastěji používaným stentgraftem komerčně dostupný stent Viatorr od firmy W. L. Gore & Associates (obr. 7), který byl vyvinut přímo pro TIPS a na trhu je od roku 2001. Základem je flexibilní nitinolový samoexpandibilní stent, který tvoří kostru pro ePTFE protézu s redukovanou permeabilitou. Na konci stentu, který směřuje do portální žíly, je nepotažená část v délce 2 cm, zbylá část stentu je již potažená. Délka této části se pohybuje od 4 do 8 cm a vždy by měla dosahovat až k ústí jaterní žíly do dolní duté žily [44,45]. Při použití tohoto dedikovaného ePTFE stentgraftu bylo dosaženo primární průchodnosti TIPS 87,4 % za šest měsíců, 80,8–85,6 % za jeden rok a sekundární průchodnost TIPS 98,1 % za jeden rok [6–9]. Nicméně byly publikovány pouze dvě randomizované studie porovnávající dysfunkci TIPS po zavedení prostého nepotahovaného stentu a dedikovaného stentgraftu [6,46], kdy v té poslední z letošního roku bylo dosaženo signifikantně nižší dvouleté hodnoty dysfunkce TIPS ve skupině s dedikovaným stentgraftem než ve skupině s prostým nepotahovaným stentem (44,0 % vs 63,6 %). Nebyl zaznamenán statisticky významný rozdíl ve výskytu jaterní encefalopatie či úmrtnosti v obou skupinách [46]. Taktéž v sekundární prevenci bylo dosaženo lepší průchodnosti TIPS po intervenci se zavedením dedikovaného stentgraftu než při intervenci s pouhou angioplastikou či v kombinaci se zavedením nepotahovaného stentu či nededikovaného stentgraftu (tab. 2) [11]. Statisticky významného rozdílu však bylo v této studii dosaženo jen v porovnání intervencí se zavedením stentgrafu s prostou angioplastikou (p ≤ 0,01) a při porovnání intervencí se zavedeným nepotahovaným stentem a prostou angioplastikou (p ≤ 0,01) [11].

![Následná průchodnost zkratu po dané intervenci [11].
Tab. 2. Subsequent shunt patency after the intervention [11].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/56eb81dc7ed9839b747fdb2af06e8c96.png)
Závěr
S příchodem dedikovaného ePTFE stentgraftu pro TIPS došlo k významné redukci výskytu dysfunkce TIPS a v současnosti je to nejlepší prostředek primární i sekundární prevence dysfunkce TIPS. Nicméně ani tento stentgraft problém dysfunkce TIPS zcela nevyřešil. Navíc je jeho cena stále vysoká, takže není v našich ekonomických podmínkách používán paušálně. Proto je nutno i nadále pacienty po zavedení TIPS pravidelně dispenzarizovat a screeningově vyšetřovat stran dysfunkce TIPS, což platí obzvláště pro nemocné indikované k TIPS pro variceální krvácení.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 17. 2. 2014
Přijato: 25. 3. 2014
MUDr. Václav Jirkovský
II. interní gastroenterologická klinika
LF UK a FN Hradec Králové
Sokolská 581, 500 05 Hradec Králové
vrtula@post.cz
Sources
1. Haskal ZJ, Pentecost MJ, Soulen MC et al. Transjugular intrahepatic portosystemic shunt stenosis and revision: early and midterm results. Am J Roentgenol 1994; 163(2): 439–444.
2. Lind CD, Malisch TW, Chong WK et al. Incidence of shunt occlusion or stenosis following transjugular intrahepatic portosystemic shunt placement. Gastroenterology 1994; 106(5): 1277–1283.
3. Nazarian GK, Ferral H, Castaneda-Zuniga WR et al. Development of stenoses in transjugular intrahepatic portosystemic shunts. Radiology 1994; 192(1): 231–234.
4. Saxon RS, Ross PL, Mendel-Hartvig J et al. Transjugular intrahepatic portosystemic shunt patency and the importance of stenosis location in the development of recurrent symptoms. Radiology 1998; 207(3): 683–693.
5. Sterling KM, Darcy MD. Stenosis of transjugular intrahepatic portosystemic shunts: presentation and management. Am J Roentgenol 1997; 168(1): 239–244.
6. Bureau C, Garcia-Pagan JC, Otal P et al. Improved clinical outcome using polytetrafluoroethylene-coated stents for TIPS: results of a randomized study. Gastroenterology 2004; 126(2): 469–475.
7. Hausegger KA, Karnel F, Georgieva B et al. Transjugular intrahepatic portosystemic shunt creation with the Viatorr expanded polytetrafluoroethylene-covered stent-graft. J Vasc Interv Radiol 2004; 15(3): 239–248.
8. Charon JP, Alaeddin FH, Pimpalwar SA et al. Results of a retrospective multicenter trial of the Viatorr expanded polytetrafluoroethylene-covered stent-graft for transjugular intrahepatic portosystemic shunt creation. J Vasc Interv Radiol 2004; 15(11): 1219–1230.
9. Rossi P, Salvatori FM, Fanelli F et al. Polytetrafluoroethylene-covered nitinol stent-graft for transjugular intrahepatic portosystemic shunt creation: 3-year experience. Radiology 2004; 231(3): 820–830.
10. Saxon RR, Barton RE, Keller FS et al. Prevention, detection and treatment of TIPS stenosis and occlusion. Sem Interv Radiol 1995; 12 : 375–383.
11. Jirkovsky V, Fejfar T, Safka V et al. Influence of the secondary deployment of expanded polytetrafluoroethylene-covered stent grafts on maintenance of transjugular intrahepatic portosystemic shunt patency. J Vasc Interv Radiol 2011; 22(1): 55–60. doi: 10.1016/j.jvir.2010.09.016.
12. Krajina A, Lojik M, Chovanec V et al. Stent-grafts in TIPS. Abdom Imaging 2004; 29(1): 53–59.
13. Rössle M, Haag K, Ochs A et al. The transjugular intrahepatic portosystemic stent-shunt procedure for variceal bleeding. N Engl J Med 1994; 330(3): 165–171.
14. Cejna M, Peck-Radosavljevic M, Schroder M et al. Repeat interventions for maintenance of transjugular intrahepatic portosystemic shunt function in pacients with Budd-Chiari syndrome. J Vasc Iterv Radiol 2002; 13(2 Pt 1): 193–199.
15. Jalan R, Harrison DJ, Redhead DN et al. Transjugular intrahepatic portosystemic stent-shunt (TIPSS) occlusion and the role of biliary venous fistulae. J Hepatol 1996; 24(2): 169–176.
16. LaBerge JM, Ferrell LD, Ring EJ et al. Histopathologic study of stenotic and occluded transjugular portosystemic shunts. J Vasc Interv Radiol 1993; 4(6): 779–786.
17. Sanyal AJ, Contos MJ, Yager D et al. Development of pseudointima and stenosis after transjugular intrahepatic portosystemic shunts: characterization of cell phenotype and function. Hepatology 1998; 28(1): 22–32.
18. Saxon RR, Timmermans HA, Uchida BT et al. Stent-grafts for revision of TIPS stenoses and occlusions: a clinical pilot study. J Vasc Interv Radiol 1997; 8(4): 539–548.
19. Stout LC, Lyon RE, Murray NG et al. Pseudointimal biliary epithelial proliferation and Zahn’s infarct associated with a 6 1/2-month-old transjugular intrahepatic portosystemic shunt. Am J Gastroenterol 1995; 90(1): 126–130.
20. Teng GJ, Bettmann MA, Hoopes PJ et al. Transjugular intrahepatic portosystemic shunt: effect of bile leak on smooth muscle cell proliferation. Radiology 1998; 208(3): 799–805.
21. Teng GJ, Lu Q. Bile leakage during transjugular intrahepatic portosystemic shunt creation: in vitro effect of bile on growth and function of human umbilical vein endothelium. Radiology 2005; 235(3): 867–871.
22. Mattsson EJ, Kohler TR, Vergel SM et al. Increased blood flow induces regression of intimal hyperplasia. Arterioscler Thromb Vasc Biol 1997; 17(10): 2245–2249.
23. Zarins CK, Zatina MA, Giddens DP et al. Shear stress regulation of artery lumen diameter in experimental atherogenesis. J Vasc Surg 1987; 5(3): 413–420.
24. Chovanec V, Krajina A, Skrabkova Z et al. Potential factors influencing TIPS patency (abstract). Cardiovasc Intervent Radiol 2001; 24 (Suppl 1): 137.
25. Darcy M. Evaluation and management of transjugular intrahepatic portosystemic shunts. Am J Roentgenol 2012; 199(4): 730–736.
26. Zizka J, Eliás P, Krajina A et al. Value of Doppler sonography in revealing transjugular intrahepatic portosystemic shunt malfunction: a 5-year experience in 216 patients. Am J Roentgenol 2000; 175(1): 141–148.
27. Ferral H, Banks B, Wholey M et al. Techniques for transjugular intrahepatic portosystemic shunt revision. Am J Roentgenol 1998; 171(4): 1041–1047.
28. DiSalle RS, Dolmatch BL. Treatment of TIPS stenosis with ePTFE graft-covered stents. Cardiovasc Intervent Radiol 1998; 21(2): 172–175.
29. Haskal ZJ. Improved patency of transjugular intrahepatic portosystemic shunts in humans: creation and revision with PTFE stent-grafts. Radiology 1999; 213(3): 759–766.
30. Hůlek P, Krajina A et al. Current practice of TIPS. 1. ed. Hradec Králové: Olga Štambergová 2001 : 183–197.
31. Sauer P, Theilmann L, Richter G et al. Phenprocoumon for transjugular intrahepatic portosystemic shunt (TIPS): results of a randomized trial (abstract). Gastroenterology 1995; 108: A1164.
32. Theilmann L, Sauer P, Roeren T et al. Acetylsalicylic acid in the prevention of early stenosis and occlusion of transjugular intrahepatic portal-systemic stent shunts: a controlled study. Hepatology 1994; 20(3): 592–597.
33. Siegerstetter V, Huber M, Ochs A et al. Platelet aggregation and platelet-derived growth factor inhibition for prevention of insufficiency of the transjugular intrahepatic portosystemic shunt: a randomized study comparing trapidil plus ticlopidine with heparin treatment. Hepatology 1999; 29(1): 33–38.
34. Dvorák J, Hůlek P, Raupach J et al. Endovascular brachytherapy of transjugular intrahepatic portosystemic shunt. Cardiovasc Radiat Med 2000; 2(1): 3–6.
35. Pokrajac B, Cejna M, Kettenbach J et al. Intraluminal 192Ir brachytherapy following transjugular intrahepatic portosystemic shunt revision: long-term results and radiotherapy parameters. Cardiovasc Radiat Med 2001; 2(3): 133–137.
36. Park SW, Cha IH, Lee SH et al. Inhibition of pseudointimal hyperplasia in swine TIPS models: the efficacy of local delivery of paclitaxel using a perforated balloon catheter. Br J Radiol 2007; 80(957): 702–707.
37. Cohen GS, Young HY, Ball DS. Stent-graft as treatment for TIPS-biliary fistula. J Vasc Interv Radiol 1996; 7(5): 665–668.
38. Beheshti MV, Dolmatch BL, Jones MP. Technical considerations in covering and deploying a Wallstent endoprosthesis for the salvage of a failing transjugular intrahepatic portosystemic shunt. J Vasc Interv Radiol 1998; 9(2): 289–293.
39. Boyvat F, Cekirge S, Balkanci F et al. Treatment of a TIPS-biliary fistula by stent-graft in a 9-year-old boy. Cardiovasc Intervent Radiol 1999; 22(1): 67–68.
40. Haskal ZJ, Weintraub JL, Susman J. Recurrent TIPS thrombosis after polyethylene stent-grafts use and salvage with polytetrafluoroethylene stent-grafts. J Vasc Interv Radiol 2002; 13(12): 1255–1259.
41. Patel NH, McLennan G, Shah H. Introduction of a ePTFE-covered long, spiral-articulated Palmaz stent through a 10-F sheat using umbilical wrapping technique. J Vasc Interv Radiol 1999; 10(8): 1063–1066.
42. Sze DY, Vestring T, Liddell RP et al. Recurrent TIPS failure associated with biliary fistulae: treatment with PTFE-covered stents. Cardiovasc Intervent Radiol 1999; 22(4): 298–304.
43. Andrews RT, Saxon RR, Bloch RD. Stent-grafts for de novo TIPS: technique and early results. J Vasc Interv Radiol 1999; 10(10): 1371–1378.
44. Cejna M, Peck-Radosavljevic M, Thurnher SA et al. Creation of transjugular intrahepatic portosystemic shunts with stent-grafts: initial experiences with a polytetrafluoroethylene-covered nitinol endoprosthesis. Radiology 2001; 221(2): 437–446.
45. Otal P, Smayra T, Bureau C et al. Preliminary results of a new expanded-polytetrafluoroethylene-covered stent-graft for transjugular intrahepatic portosystemic shunt procedures. Am J Roentgenol 2002; 178(1): 141–147.
46. Perarnau JM, Le Gouge A, Nicolas C et al. Covered vs. uncovered stents for transjugular intrahepatic portosystemic shunt: A randomized controlled trial. J Hepatol 2014. doi: 10.1016/j.jhep.2014.01.015.
Labels
Paediatric gastroenterology Gastroenterology and hepatology SurgeryArticle was published in
Gastroenterology and Hepatology
2014 Issue 2
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Metamizole vs. Tramadol in Postoperative Analgesia
- Spasmolytic Effect of Metamizole
- The Importance of Limosilactobacillus reuteri in Administration to Diabetics with Gingivitis
-
All articles in this issue
- 1 000 TIPS ve FN Hradec Králové: indikace a přežívání nemocných
- Budd-Chiari syndrom a TIPS – 21 let zkušeností
- Transjugulární intrahepatální portosytémová spojka v terapii refrakterního ascitu: současný pohled jednoho pracoviště
- Dispenzarizace nemocných po zavedení transjugulární intrahepatální portosystémové spojky – diagnostika dysfunkce zkratu a možnosti intervence
- Transplantace jater pro hepatocelulární karcinom, dlouhodobé přežití a faktory ovlivňující rekurenci tumoru (zkušenosti jednoho centra)
- Využití EUS navigované choledochoduodenostomie v léčbě biliární obstrukce
- Hereditárny angioedém ako príčina bolestí brucha
- Moderní diagnostika Lynchova syndromu
- EUS workshop v Jablonci nad Nisou
- 13th Czech-Slovak IBD symposium
- 9th Congress of ECCO, Copenhagen, Denmark
- Oznámení
- Omluva
- Remsima™ – první biosimilární infliximab
- Hepatologie nejen z Hradce Králové
- Léčba portální hypertenze pomocí transjugulární intrahepatální portosystémové spojky – prvních 1 000 výkonů ve FN Hradec Králové
- Malígny melanóm konečníka – zriedkavá kazuistika a prehľad literatúry
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Budd-Chiari syndrom a TIPS – 21 let zkušeností
- Hereditárny angioedém ako príčina bolestí brucha
- Léčba portální hypertenze pomocí transjugulární intrahepatální portosystémové spojky – prvních 1 000 výkonů ve FN Hradec Králové
- Moderní diagnostika Lynchova syndromu
