Rizikové faktory lokální reziduální neoplazie po endoskopické mukózní resekci
Risk factors for local residual neoplasia after endoscopic mucosal resection
Introduction:
Endoscopic mucosal resection (EMR) is considered an effective endoscopic treatment of sessile polyps and non-polypoid colorectal neoplasia. A limitation of this technique is the risk of incomplete endoscopic resection, which can lead to local residual neoplasia development.
Aim:
Identification of the risk factors associated with local residual neoplasia (LRN) onset.
Methods:
Retrospective analysis was performed on colorectal neoplasia EMRs in one high-volume tertiary-referral endoscopic center in 2013–2015. Individuals with at least one follow-up colonoscopy after the initial EMR were included. LRN was defined as the histopathological presence of neoplastic tissue at the post-EMR site. Univariate and multivariate analysis of factors associated with LRN were performed.
Results:
280 EMRs of sessile polyps and non-polypoid colorectal neoplasia (size ≥ 10 mm) including laterally spreading tumors (LST) were analyzed and surveillance endoscopy was carried out on 186 lesions (66.4% of all EMRs) in 163 patients (66.3% male; mean age 67 years). The mean follow-up interval was 7.8 months. LRN was verified in 33 lesions (17.7%) resected by EMR. Single variate analysis showed evidence of an increased risk of residual neoplasia for lesions ≥ 20 mm (p = 0.006), LST with granular type (p = 0.002), villous component of adenomas with low grade dysplasia (p < 0.001), and with high grade dysplasia (p = 0.005), and piece meal EMR (p = 0.006). In multivariate analysis, there were no statistically significant factors associated with LRN.
Conclusion:
The risk factors for local residual neoplasia include lesion size ≥ 20 mm, villous component of adenomas, piece meal EMR technique, and LST lesions of the granular type. In these cases, earlier endoscopic post-EMR surveillance or alternative endoscopic or surgical techniques should be considered.
Key words:
endoscopic mucosal resection – local residual neoplasia – risk factors – laterally spreading tumor
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.
Submitted:
20.9.2017
Accepted:
27.9.2017
:
N. Brogyuk 1; T. Grega 1; M. Voška 1; O. Ngo 2; O. Májek 2; L. Dušek 2; M. Zavoral 1; Š. Suchánek 1
:
Interní klinika 1. LF UK a ÚVN – VFN Praha
1; Institut biostatistiky a analýz, LF MU, Brno
2
:
Gastroent Hepatol 2017; 71(5): 394-400
:
Gastrointestinal Oncology: Original Article
prolekare.web.journal.doi_sk:
https://doi.org/10.14735/amgh2017394
Úvod:
Endoskopická mukózní resekce (EMR) je považována za efektivní endoskopickou léčbu přisedlých polypů a nepolypózních kolorektálních neoplazií. Limitací této techniky je riziko inkompletní endoskopické resekce vedoucí ke vzniku lokální reziduální neoplazie (LRN).
Cíl:
Identifikace četnosti a rizikových faktorů vzniku LRN.
Metodika:
Retrospektivní studie EMR kolorektálních neoplazií provedených v jednom specializovaném endoskopickém centru v letech 2013–2015. Do analýzy byli zahrnuti jedinci, kteří měli alespoň jednu endoskopickou kontrolu po EMR. Kritériem pro diagnostiku LRN byla histologická verifikace z místa po resekci. Byla hodnocena jednorozměrná a vícerozměrná analýza faktorů spojených s LRN.
Výsledky:
Z 280 EMR přisedlých polypů a nepolypózních kolorektálních lézí velikosti ≥ 10 mm vč. horizontálně se šířících lézí LST (laterally spreading tumors) bylo do analýzy zahrnuto 186 lézí (66,4 % ze všech provedených EMR) u 163 pacientů (66,3 % mužů, průměrný věk 67 let). Průměrný interval dispenzární kontroly byl 7,8 měsíce. U 33 lézí odstraněných pomocí EMR (17,7 %) byla histologicky verifikována LRN. Z jednorozměrné analýzy byla statisticky významně vyšší asociace LRN s lézemi ≥ 20 mm (p = 0,006), s horizontálně se šířícímí granulárně-nodularnímí lézemi smíšeného typu (LST GM) (p = 0,002), s lézemi s vilózní složkou s low-grade dysplazií (p < 0,001) a high-grade dysplazií (p = 0,005) a s technikou piece meal EMR (p = 0,006). V rámci vícerozměrné analýzy nebyl nalezen žádný statisticky významný faktor asociovaný s LRN.
Závěr:
Rizikové faktory LRN zahrnují velikost léze ≥ 20 mm, adenomy s vilózní složkou, piece meal technika EMR a LST GM léze. V těchto případech by měla být zvážena časnější dispenzární endoskopická kontrola nebo alternativní endoskopická či chirurgická technika.
Klíčová slova:
endoskopická mukózní resekce – lokální reziduální neoplazie – rizikové faktory – laterally spreading tumor
Úvod
Kolorektální karcinom (CRC – colorectal cancer) představuje ve vyspělých zemích významný zdravotnický a socioekonomický problém. V Evropě je druhým nejčastějším zhoubným onemocněním u obou pohlaví (za karcinomem plic u mužů a karcinomem prsu u žen) a čtvrtou nejčastější příčinou úmrtí na malignitu (po karcinomu plic, jater a žaludku) [1].
Nejčastějším prekurzorem sporadického CRC je adenom (85 %) ve formě polypózní či nepolypózní LST (laterally spreading tumors) léze [1–2]. Koloskopie patří mezi zlatý standard v diagnostice a terapii časných kolorektálních neoplazií vedoucí ke snížení incidence a mortality CRC [1–4]. V terapii časných kolorektálních lézí ≥ 10 mm lze využít metodu endoskopické mukózní resekce (EMR), v případě lézí ≥ 20 mm lze kromě EMR využít metodu endoskopické submukózní disekce (ESD).
Cílem endoskopické léčby je odstranění léze v jedné části (en bloc resekce), ideálně s histopatologicky verifikovanými negativními horizontálními i vertikálními okraji (R0 resekce). V případě časných kolorektálních lézí větší velikosti neumožňuje technika EMR resekci en bloc vzhledem k vyššímu riziku perforace. Léze jsou odstraňovány po částech, metodou piece meal EMR. Dle doporučení ESGE (European Society of Gastrointestinal Endoscopy) jsou k piece meal EMR indikovány kolorektální neoplazie ≥ 20 mm v tračníku a ≥ 25 mm v rektu [5]. Nevýhodou této techniky je nemožnost en bloc i R0 resekce a riziko neúplné resekce s rozvojem lokální reziduální neoplazie (LRN) [6–18]. Z tohoto důvodu je dle platných amerických i evropských standardů doporučována po piece meal EMR časná endoskopická kontrola (follow-up) s odstupem 2–6 měsíců [5,19–22].
Morfologický vzhled LRN je variabilní (obr. 1) a jejich detekce může být někdy obtížná, proto se doporučuje po provedené piece meal EMR označit dané místo tetováží. Endoskopická léčba LRN je dostatečně účinná v 91 % [23]. Kromě EMR se stále častěji využívá s výhodou ESD, díky které lze dosáhnout R0 resekce častěji i pro velké léze. Nevýhodou této techniky je však značná technická i časová náročnost.
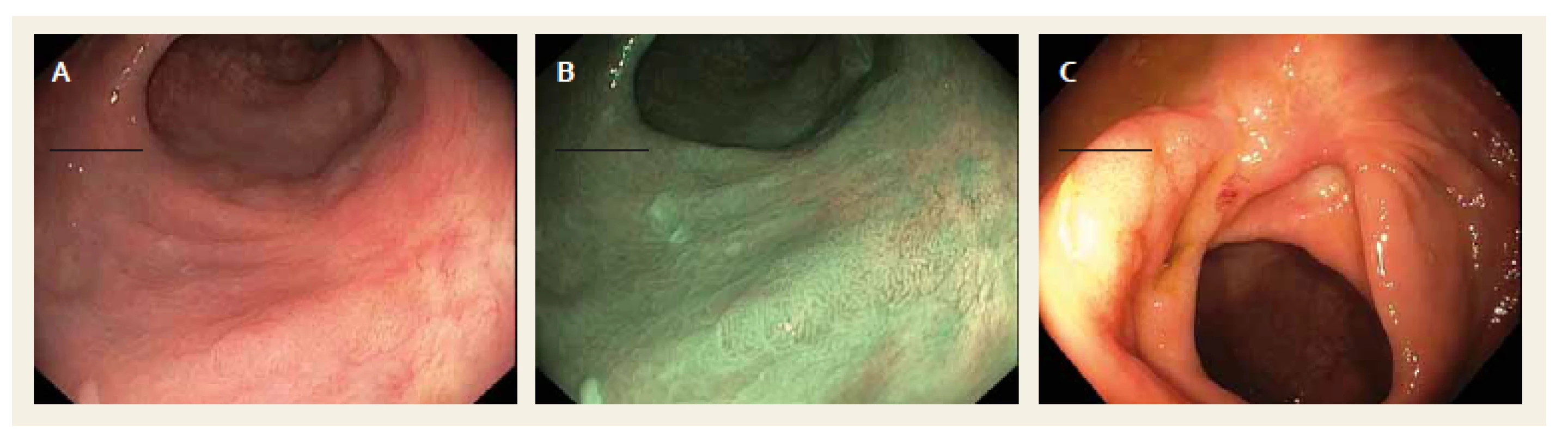
Cílem této studie je analýza výskytu rizikových faktorů LRN u pacientů, kteří podstoupili endoskopickou resekci časné kolorektální léze pomocí techniky EMR.
Metodika
Do retrospektivní analýzy byli zahrnuti pacienti, u kterých byla v období od ledna 2013 do prosince 2015 provedena EMR kolorektálních lézí. Výkony byly provedeny na jednom specializovaném endoskopickém pracovišti (Oddělení gastrointestinální endoskopie, ÚVN – VFN Praha). Koloskopie byly indikovány z důvodu sekundární prevence CRC (pozitivita testů na okultní krvácení, screening, dispenzarizace) a symptomů (zejména anémie, enteroragie, zácpa). Do analýzy nebyly zahrnuty léze diagnostikované při koloskopii při chronickém nespecifickém střevním zánětu a stopkaté polypy. Všem pacientům bylo doporučeno kontrolní endoskopické vyšetření s odstupem 2–12 měsíců po EMR v závislosti na histopatologickém nálezu.
Do analýzy byli zahrnuti všichni jedinci s negativním nálezem endoskopickou kontrolou. Vyřazeni byli pacienti s pozitivním nálezem při první endoskopické kontrole provedené až po 12 měsících, který byl hodnocen jako rekurence (celkem tři pacienti). Do finální analýzy bylo celkem zahrnuto 186 kolorektálních přisedlých a nepolypózních lézí odstraněných metodou EMR u 163 pacientů. Průměrná doba sledování byla 7,8 měsíce (1–30 měsíců).
Vstupním kritériem pro EMR byla velikost léze ≥ 10 mm. Na základě makroskopického vzhledu byly všechny léze klasifikované dle Pařížské klasifikace [24] na léze přisedlé (0–Is), LST GH (0–IIa, 0–IIb) nebo LST GM (0–IIa + 0–IIb, 0–Is + 0–IIa, 0–IIa + 0–IIc). En bloc a piece meal EMR technika byla definována jako odstranění léze vcelku, resp. po částech. Úplná endoskopická resekce byla definována jako resekce celé endoskopicky viditelné nádorové tkáně.
LRN byla definována jako histologický průkaz neoplazie z biopsie jizvy po EMR. Jizva bez endoskopických známek recidivy po vyšetření v bílém světle, NBI (narrow band imaging) či po barvení indigokarmínem (Novaplus, Lake Forrest, USA) či metylenovou modří nebyla bioptována a byla považována za negativní.
Pacienti před endoskopií absolvovali standardní střevní přípravu jedním z uvedených přípravků (Fortrans, Beaufour Ipsen; Moviprep, Pharma Swiss; Picoprep, Ferring Pharmaceuticals; Eziclen, Ipsen Pharma) v neděleném nebo děleném režimu.
EMR byla provedena ve standardní analgosedaci Midazolamem (Roche Pharma AG) a Fentanylem (Ratiopharm) v nízkých dávkách, popřípadě v analgosedaci Propofolem (B. Braun) za asistence anesteziologa. V rámci endoskopického výkonu byly použity endoskopy CF-145L, CF-Q180AL, CF-H185AL, CF-Q140L, CF-H190L, PCF-H180AL, GIF-HQ190 (Olympus Europe, Hamburg, Germany). K hodnocení léze bylo použito bílé světlo, NBI nebo barvení indigokarmínem či metylenovou modří. Při EMR byl pro submukózní injekci použit roztok Patent Blue ředěný Adrenalinem (1 : 10 000–20 000). Roztok byl aplikován injekční jehlou Interject 23ga (Boston Scientific Way, Mariborough, USA) a léze byla následně odstraněna polypektomickou kličkou SnareMaster SD-210U-10, SD-210U-15, SD-210U-25 (Olympus Europe, Hamburg, Germany) za použití elektrokoagulační jednotky ESD-100 (Olympus Europe, Hamburg, Germany) v režimu Pulse Cut Fast Level 40 Watt.
Pro ošetření okrajů u 9 lézí byla použita argon plasmakoagulace ERBE APC2 (Erbe Elektromedizin, Germany) 20–30 Watt. U 24 lézí byly okraje ošetřeny koagulací pomocí polypektomické kličky v režimu Soft Coag 40 Watt. U 126 lézí byla spodina po odstranění uzavřena pomocí klipu. Intraprocedurální krvácení bylo řešeno pomocí hemoklipů (Olympus Europe, Hamburg, Germany; Boston Scientific Way, Mariborough, USA; Cook Medical, Bloomington, USA) nebo koagulačními kleštěmi (Coagrasper) v režimu Soft Coag 60 Watt za použití elektrokoagulační jednotky ESD 100 (Olympus European, Hamburg, Germany). Pro přesnější hodnocení velikosti byly resekované léze po extrakci pomocí Rothové síťky změřeny pravítkem. Následně byly resekované vzorky velikosti ≥ 20 mm rozloženy na korek nebo uloženy do fixačního roztoku formaldehydu a odeslány na histologické vyšetření. U všech lézí byla provedena fotodokumentace.
Celkem 117 jedinců z celkového souboru 251 pacientů bylo po výkonu hospitalizováno k observaci. Průměrná délka hospitalizace byla 2,3 dne.
Odstraněné léze byly histologicky klasifikovány dle Vídeňské klasifikace. R0 resekce byla potvrzena, pokud nebyla prokázána neoplazie v bočních ani vertikálních okrajích.
V případě adenomu s high-grade dysplazií (HGD) a karcinomu byla za kurativní resekci považována přítomnost negativních okrajů (vertikální, horizontální) bez průkazu invaze do sm2 (čili do 1 000 µm submukózy), bez přítomnosti lymfatické (L0) či vaskulární (V0) invaze. Pět pacientů bylo indikováno k chirurgické resekci pro invazivní karcinom.
K hodnocení prognostických faktorů výskytu LRN byla použita metoda logistické regrese. Jednotlivé faktory byly hodnoceny v rámci jednorozměrné i vícerozměrné regresivní analýzy a výsledný poměr šancí byl doplněn o 95% interval spolehlivosti. Hladina významnosti byla stanovena na 0,05. Veškeré statistické zpracování dat bylo provedeno v softwaru STATA/IC 13.
Výsledky
Celkem bylo hodnoceno 186 EMR lézí ≥ 10 mm u 163 pacientů (66,3 % mužů, průměrný věk 67 let, 44–88 let) (tab. 1).
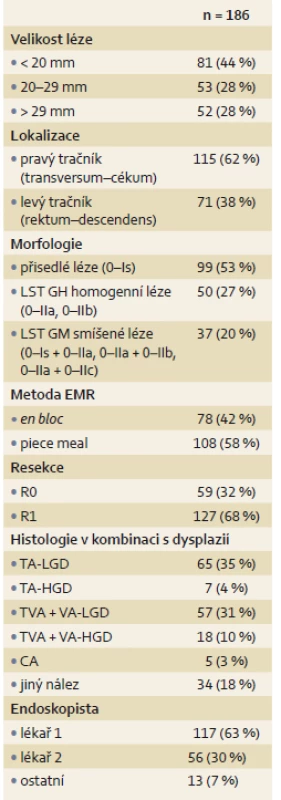
Celkem 42 % lézí bylo odstraněno metodou en bloc EMR, 58 % lézí metodou piece meal EMR. Ve 32 % případů byla dosažena R0 resekce a celkem 33 pacientů (17,7 %) mělo histologicky prokázanou LRN po EMR. Metodou piece meal bylo odstraněno 58 % lézí a následně se LRN objevila v 26 % případů. Naopak u lézí odstraněných en bloc EMR byla LRN pozorována pouze v 6 %. U adenomů s vilózní složkou bylo vyšší zastoupení LRN oproti tubulárním adenomům (tab. 2).
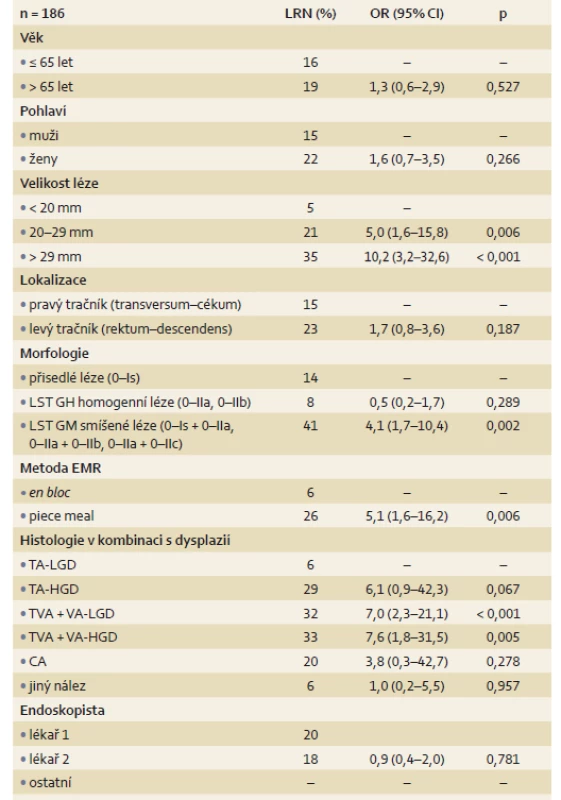
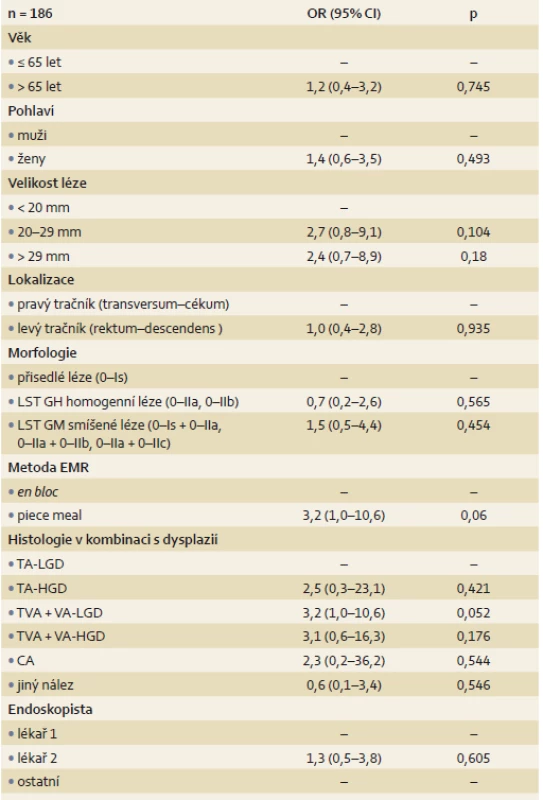
Použitím jednorozměrné statistické analýzy byla LRN spojena statisticky významně s lézemi ≥ 20 mm (pro léze velikosti 20–29 mm dosahovala p hodnota 0,006 a u lézí > 29 mm byla p hodnota < 0,001), s lézemi LST GM (p = 0,002), dále s lézemi s vilózní složkou s low-grade dysplazií (LGD) (p < 0,001), s tubulovilozním adenomem + vilozním adenomem (TVA + VA) s HGD (p = 0,005) a s technikou piece meal EMR (p = 0,006) (tab. 2). V rámci vícerozměrné analýzy nebyl nalezen žádný statisticky významný faktor asociovaný s LRN. Na hranici statistické významnosti byly nalezeny rizikové faktory – léze TVA + VA s LGD (p = 0,052) a metoda piece meal EMR (p = 0,06) (tab. 3). Sledované parametry, jako je věk pacienta, lokalizace léze a endoskopista, nebyly prokázány jako rizikové faktory LRN.
Komplikace byly ve 13 případech z 280 EMR – 1× bylo nutné chirurgické ošetření pro arteriální krvácení, 1× endoskopická hemostáza pro odložené krvácení, 1× krevní převody pro odložené krvácení, 1× byla intraprocedurální perforace ošetřena endoskopicky a postupovalo se konzervativně a 13× byl prokázán postkoagulační syndrom, řešený konzervativně.
V 33 případech (17,7 %) byla histologicky prokázána LRN. V 16 případech šlo o TA (primární neoplazie byla hodnocena jako TVA ve 12 případech, 1× jako vilózní adenom, 2× jako TA) a v 17 případech o TVA (primární neoplazie byla hodnocena jako TVA u 5 případů, 4× jako vilózní adenomy, 2× jako pilovité léze a 6× jako TA). Celkem 26 lézí diagnostikovaných během dispenzární koloskopie bylo hodnoceno jako LGD (u 15 neoplazií byla primárně HGD), u 1 léze s LGD byla při při follow-up prokázána HGD. Žádná LRN nebyla indikována k chirurgickému řešení.
Všech 33 LRN bylo řešeno endoskopicky; 22 LRN velikosti ≤ 5 mm bylo odstraněno bioptickými kleštěmi, 6 LRN bylo odstraněno kombinací kleště a argon plasmakoagulace (APC), 1 LRN byla řešena re-EMR a 4 LRN kombinací re-EMR a APC.
Diskuze
Makroskopický vzhled a velikost kolorektální léze patří mezi hlavní kritéria volby typu endoskopické resekce (en bloc vs. piece meal). Stopkaté polypy (0–Ip) jsou indikovány k endoskopické terapii technikou endoskopické polypektomie. Vkleslé léze s ulcerací či prohloubené léze (typ 0–IIc, 0–III) jsou indikovány k ESD (tab. 4) [24]. Léze typu 0–Is, 0–IIa, 0–IIb velikosti ≤ 20 mm (v rektu velikosti ≤ 25 mm) mohou být odstraněny metodou en bloc s dosažením vysokého procenta R0 resekcí. Větší léze lze odstranit po částech technikou piece meal [5,25,26]. Tato metoda je efektivní a bezpečná, nicméně mezi její nevýhody patří absence histologické verifikace R0 resekce a vyšší výskyt LRN. Riziko vzniku LRN po EMR kolísá od 5 do 55 % [7,26–32]. Morfologie LRN je většinou variabilní a endoskopická léčba LRN je účinná ve většině případů [23]. Je nutné brát do úvahy také několik faktorů. Zaprvé, každá LRN je potenciálním rizikovým faktorem invazivního karcinomu. Mezi další rizikové faktory patří compliance pacientů s follow-up a správná endoskopická vizualizace místa po předešlé EMR.
![Indikace k endoskopické resekci podle morfologického vzhledu léze [24].
Tab. 4. Indications for endoscopic resection according to the endoscopic appearance of the lesion [24].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/7a18b7438ed725d399fa92766e89f82f.png)
V retrospektivním souboru pacientů bylo identifikováno 186 kolorektálních lézí odstraněných metodou EMR. Celkem 58 % lézí bylo odstraněno metodou piece meal EMR a LRN byla pozorována u 17,7 %. Tato data jsou v souladu s výsledky českých a zahraničních autorů (tab. 5) [6,17,30–33].
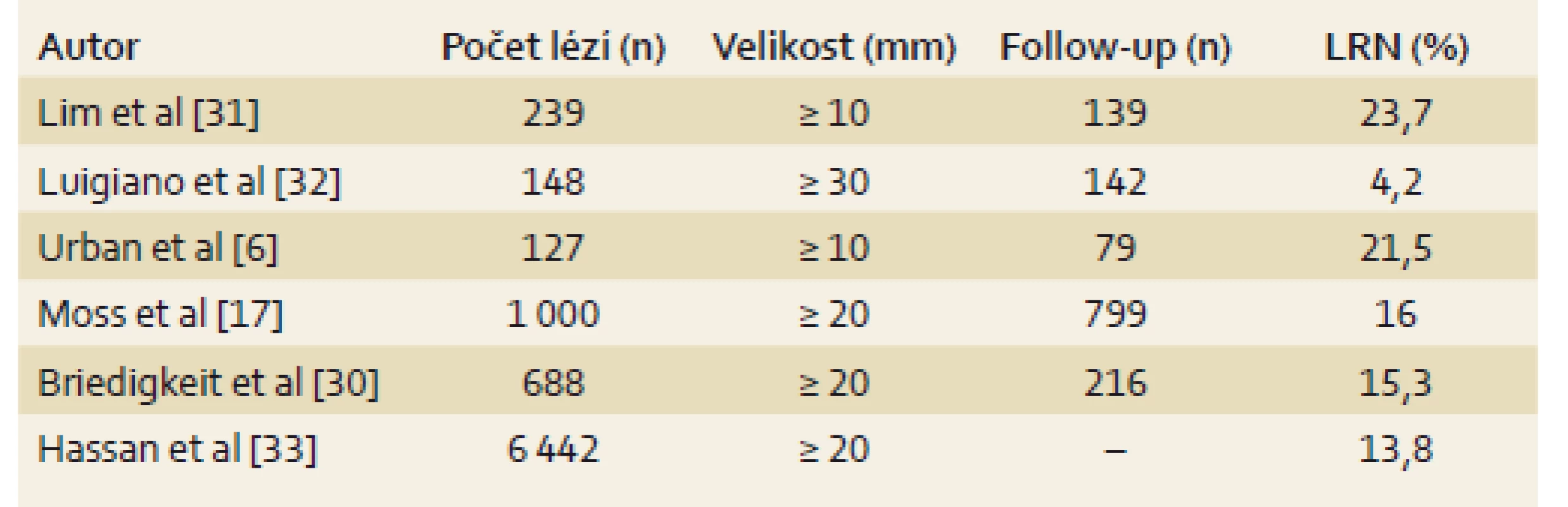
Primárním cílem publikované studie bylo identifikovat rizikové faktory spojené s vyšším výskytem LRN po EMR (tab. 2 a 3). Mnoho z výše uvedených faktorů bylo popsáno v literatuře (tab. 6) [9,13,17,18,34–36].
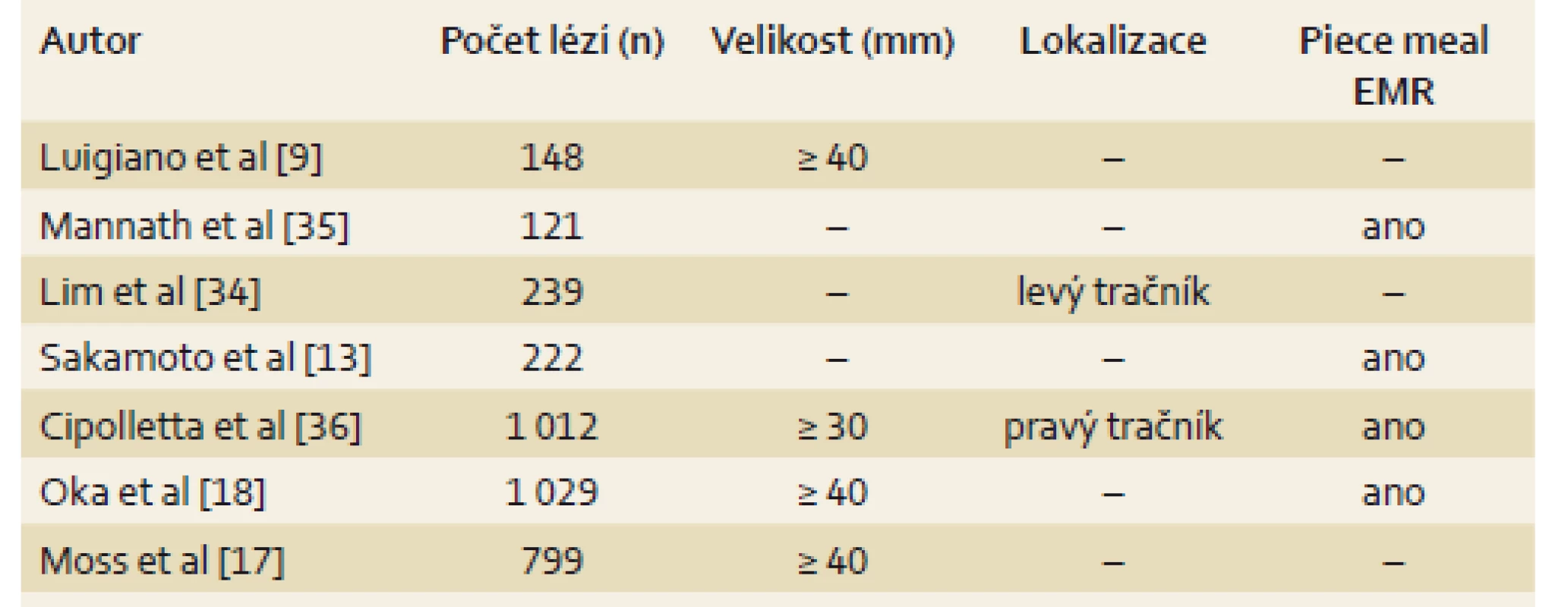
Dle jednorozměrné analýzy bylo statisticky významně vyšší riziko LRN spojeno s lézemi velikosti ≥ 20 mm, lézemi typu LST GM, lézemi s vilózní složkou s LGD, TVA + VA s HGD a u lézí odstraňovaných technikou piece meal (tab. 2). V rámci vícerozměrné analýzy nebyl nalezen žádný statisticky významný faktor asociovaný s LRN. Na hraně statistické významnosti lze hodnotit jako rizikové faktory léze TVA + VA s LGD a metodu piece meal EMR (tab. 3). Sledované parametry jako věk pacienta, lokalizace léze a endoskopující lékař nebyly prokázané jako rizikový faktor LRN.
Bylo také potvrzeno, že kolorektální EMR patří mezi bezpečnou terapeutickou techniku. Celkový počet komplikací představoval 7 % případů (13 jedinců).
Mezi limitace naší studie patří zejména retrospektivní design, nedostatečná compliance pacientů s doporučeným dispenzárním intervalem, krátký interval sledování, vyšší počet lézí velikosti ≤ 20 mm.
Závěr
Závěrem lze konstatovat, že mezi nejvýraznější rizikové faktory LRN patří zejména velikost léze ≥ 20 mm, morfologie LST GM, adenomy s vilózní složkou a metoda piece meal resekce. U těchto lézí se jeví jako výhodná metoda ESD anebo, v případě provedení piece meal EMR, těsná endoskopická dispenzarizace.
Podpořeno z programového projektu Ministerstva zdravotnictví ČR s reg. č. 17-31909A.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 20.9.2017
Přijato: 27.9.2017
MUDr. Nagyija Brogyuk
Interní klinika 1. LF UK a
ÚVN – VFN Praha
U Vojenské nemocnice 1200
169 00 Praha 6
nagyija.brogyuk@uvn.cz
Sources
1. Zavoral M, Vojtěchová G, Májek O et al. Populační screening kolorektálního karcinomu v České republice. Čas Lék Čes 2016; 155 : 7–12.
2. Brenner H, Stock C, Hoffmeister M et al. Effect of screening sigmoidoscopy and screening colonoscopy on colorectal cancer incidence and mortality: systematic review and meta-analysis of randomised controlled trials and observational studies. BMJ 2014; 348: g2467. doi: 10.1136/bmj.g2467.
3. Løberg M, Kalager M, Holme Ø et al. Long-term colorectal-cancer mortality after adenoma removal. N Engl J Med 2014; 371 (9): 799–807. doi: 10.1056/ NEJMoa1315870.
4. Zauber AG, Winawer SJ, O’Brien MJ et al. Colonoscopic polypectomy and long-term prevention of colorectal-cancer deaths. N Engl J Med 2012; 366 (8): 687–696. doi: 10.1056/NEJMoa1100370.
5. Ferlitsch M, Moss A, Hassan C et al. Colorectal polypectomy and endoscopic mucosal resection (EMR): European Society of Gastrointestinal Endoscopy (ESGE). Endoscopy 2017; 49 (3): 270–297. doi: 10.1055/s-0043-102569.
6. Urban O, Kijonkova B, Kajzrlikova IM et al. Local residual neoplasia after endoscopic treatement of laterally spreading tumors during 15 months of follow-up. Eur J Gastroenterol Hepatol 2013; 25 (6): 733–738. doi: 10.1097/MEG.0b013e32835eda96.
7. Belderbos GE, Leenders M, Moons LM et al. Local recurrence after endoscopic mucosal resection of nonpedunculated colorectal lesions: systematic review and meta-analysis. Endoscopy 2014, 46 : 388–400. doi: 10.1055/s-0034-1364970.
8. Khashab M, Eid E, Rusche M et al. Incidence and predictors of “late” recurrences after endoscopic piecemeal resection of large sessile adenomas. Gastrointest Endosc 2009; 70 (2): 344–349. doi: 10.1016/j.gie.2008.10.037.
9. Luigiano C, Consolo P, Scaffidi MG et al. Endoscopic mucosal resection for large and giant sessile and flat colorectal polyps: a single-center experience with long-term follow-up. Endoscopy 2009; 41 (10): 829–835. doi: 10.1055/s-0029-1215091.
10. Ferrara F, Luigiano C, Ghersi S et al. Efficacy, safety and outcomes of ‘inject and cut’ endoscopic mucosal resection for large sessile and flat colorectal polyps. Digestion 2010; 82 (4): 213–220. doi: 10.1159/000284397.
11. Ah Soune P, Ménard C, Salah E et al. Large endoscopic mucosal resection for colorectal tumors exceeding 4 cm. World J Gastroenterol 2010; 16 (5): 588–595.
12. Buchner AM, Guarner-Argente C, Ginsberg GG et al. Outcomes of EMR of defiant colorectal lesions directed to an endoscopy referral center. Gastrointest Endosc 2012; 76 (2): 255–263. doi: 10.1016/j.gie.2012.02.060.
13. Sakamoto T, Matsuda T, Otake Y et al. Predictive factors of local recurrence after endoscopic piecemeal mucosal resection. J Gastroenterol 2012; 47 (6): 635–640. doi: 10.1007/s00535-011-0524-5.
14. Woodward TA, Heckman MG, Cleve-land P et al. Predictors of complete endoscopic mucosal resection of flat and depressed gastrointestinal neoplasia of the colon. Am J Gastroenterol 2012; 107 (5): 650–654. doi: 10.1038/ajg.2011.473.
15. Carvalho R, Areia M, Brito D et al. Endoscopic mucosal resection of large colorectal polyps: prospective evaluation of recurrence and complications. Acta Gastroenterol Belg 2013; 76 (2): 225–230.
16. Maguire LH, Shellito PC. Endoscopic piecemeal resection of large colorectal polyps with long-term followup. Surg Endosc 2014; 28 (9): 2641–2648. doi: 10.1007/ s00464-014-3516-8.
17. Moss A, Williams SJ, Hourigan LF et al. Long-term adenoma recurrence following widefield endoscopic mucosal resection (WFEMR) for advanced colonic mucosal neoplasia is infrequent: results and risk factors in 1000 cases from the Australian Colonic EMR (ACE) study. Gut 2015; 64 (1): 57–65. doi: 10.1136/gutjnl-2013-305516.
18. Oka S, Tanaka S, Saito Y et al. Local recurrence after endoscopic resection for large colorectal neoplasia: a multicenter prospective study in Japan. Am J Gastroenterol 2015; 110 (5): 697–707. doi: 10.1038/ ajg.2015.96.
19. Davila RE, Rajan E, Baron TH et al. ASGE guideline: colorectal cancer screening and surveillance. Gastrointest Endosc 2006; 63 (4): 546–557. doi: 10.1016/j.gie.2006.02.002.
20. Hassan C, Quintero E, Dumonceau JM et al. Post-polypectomy colonoscopy surveillance: European Society of Gastrointestinal Endoscopy (ESGE) Guideline. Endoscopy 2013; 45 (10): 842–851. doi: 10.1055/s-0033-1344548.
21. Pox C, Aretz S, Bischoff SC et al. S3-guideline colorectal cancer version 1.0. Z Gastroenterol 2013; 51 (8): 753–854. doi: 10.1055/s-0033-1350264.
22. Tanaka S, Kashida H, Saito Y et al. JGES guidelines for colorectal endoscopic submucosal dissection/ endoscopic mucosal resection. Dig Endosc 2015; 27 (4): 417–434. doi: 10.1111/den.12456.
23. Urban O, Pipek B, Mikoviny Kajzrlikova I et al. The efficacy of treatment of local residual neopasia under standardized conditions. Vnitř Lék 2016; 62 (5): 365–369.
24. The Paris endoscopic classification of superficial neoplastic lesions: esophagus, stomach, and colon: November 30 to December 1, 2002. Gastrointest Endosc 2003; 58 (6 Suppl): S3–43.
25. Ferlitsch M, Moss A, Hassan C et al. Colorectal polypectomy and endoscopic mucosal resection (EMR): European Society of Gastrointestinal Endoscopy (ESGE). Endoscopy 2017; 49 (03): 270–297. doi: 10.1055/ s-0043-102569.
26. Urban O. Endoskopická léčba časných kolorektálních neoplazií. Onkologie 2013; 7 (4): 183–187.
27. Moss A, Bourke MJ, Williams SJ et al. Endoscopic mucosal resection outcomes and prediction of submucosal cancer from advanced colonic mucosal neoplasia. Gastroenterology 2011; 140 (7): 1909–1918. doi: 10.1053/j.gastro.2011.02.062.
28. Hotta K, Fujii T, Saito Y et al. Local recurrence after endoscopic resection of colorectal tumors. Int J Colorectal Dis 2009; 24 (2): 225–230. doi: 10.1007/s00384-008-0596-8.
29. Pohl H, Srivastava A, Bensen SP et al. Incomplete polyp resection during colonoscopy – results of the complete adenoma resection (CARE) study. Gastroenterology 2013; 144 (1): 74–80. doi: 10.1053/j.gastro.2012.09.043.
30. Briedigkeit A, Sultanie O, Sido B et al. Endoscopic mucosal resection of colorectal adenomas > 20 mm: risk factors for recurrence. World J Gastrointest Endosc 2016; 8 (5): 276–281. doi: 10.4253/wjge.v8.i5.276.
31. Lim TR, Mahesh V, Singh S et al. Endoscopic mucosal resection of colorectal polyps in typical UK hospitals. World J Gastroenterol 2010; 16 (42): 5324–5328.
32. Luigiano C, Consolo P, Scaffidi MG et al. Endoscopic mucosal resection for large and giant sessile and flat colorectal polyps: a single-center experience with long-term follow-up. Endoscopy 2009; 41 (10): 829–835. doi: 10.1055/s-0029-1215091.
33. Hassan C, Repici A, Sharma P et al. Efficacy and safety of endoscopic resection of large colorectal polyps: a systematic review and meta-analysis. Gut 2016; 65 (5): 806–820. doi: 10.1136/gutjnl-2014-308481.
34. Lim TR, Mahesh V, Singh S et al. Endoscopic mucosal resection of colorectal polyps in typical UK hospitals. World J Gastroenterol 2010; 16 (42): 5324–5328.
35. Mannath J, Subramanian V, Singh R et al. Polyp recurrence after endoscopic mucosal resection of sessile and flat colonic adenomas. Dig Dis Sci 2011; 56 (8): 2389–2395. doi: 10.1007/s10620-011-1609-y.
36. Cipolletta L, Rotondano G, Bianco MA et al. Endoscopic resection for superficial colorectal neoplasia in Italy: a prospective multicentre study. Dig Liver Dis 2014; 46 (2): 146–151. doi: 10.1016/j.dld.2013.09. 019.
Labels
Paediatric gastroenterology Gastroenterology and hepatology SurgeryArticle was published in
Gastroenterology and Hepatology
2017 Issue 5
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Metamizole vs. Tramadol in Postoperative Analgesia
- Spasmolytic Effect of Metamizole
- The Importance of Limosilactobacillus reuteri in Administration to Diabetics with Gingivitis
-
All articles in this issue
- 31st Hildebrand Bardejov Gastroenterology Days
- The selection from international journals
- Meteospasmyl – a fixed combination of alverine citrate and simethicone in the treatment of digestive tract functional disorders
- Good news in uncertain times
- Participation of the Czech population in the Colorectal Cancer Screening Programme – trends and current situation
- Comments on the article ‘Participation of the Czech population in colorectal cancer screening – trends and current situation’ in light of the National Colorectal Cancer Screening Programme in Slovakia
- Risk factors for local residual neoplasia after endoscopic mucosal resection
-
Endosonograficky navigovaná drenáž pankreatických kolekcí
– vlastní zkušenosti - Modern treatment of oesophageal cancer, gastroesophageal junction and stomach – 2017 update
- An example of a multidisciplinary approach for the treatment of metastatic rectal carcinoma
- Diagnosis and therapy of hepatitis B virus infection – Czech national guidelines
- An unusual case of gallstone ileus
- In memoriam: Professor Henri Sarles, one of the founders of modern pancreatology
- Inflammatory bowel disease and gastrointestinal malignancies – risks, incidence and management
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Meteospasmyl – a fixed combination of alverine citrate and simethicone in the treatment of digestive tract functional disorders
-
Endosonograficky navigovaná drenáž pankreatických kolekcí
– vlastní zkušenosti - Risk factors for local residual neoplasia after endoscopic mucosal resection
- Modern treatment of oesophageal cancer, gastroesophageal junction and stomach – 2017 update
