Novinky ve farmakoterapii obezity
News of pharmacological treatment of obesity
Weight reduction can improve comorbidities and reduce risk factors in obese individuals and requires a comprehensive and individual approach. Pharmacotherapy of obesity is eligible to individuals who do not respond satisfyingly to changes in dietary and exercise regime. Pharmacotherapy is recommended for patients with body mass index (BMI) ≥ 27 and associated comorbidities or with BMI ≥ 30. Excluding Orlistat, the effect of antiobesitic medication is to reduce the food intake through changes in appetite and feeling of hunger. Treatment can be continued if weight loss after 3 months is ≥ 5% of the individual’s original weight, without undesirable effects. In the Czech Republic, obesity is treated with orlistat, limited prescription phentermine for short-term use, a new bupropion-naltrexone combination drug, and injectable liraglutide (available from November 2018) at a dosage of 3 mg/ d. GLP-1 analogues and SGLT-2 blockers are recommended for treatment of diabetes, along with their antidiabetic impact, they improve the blood glucose level and support weight loss. There is a broader range of options in the USA. In addition to already mentioned medication there is lorcaserin, the combination of phentermine and bupropion, pramlintide and bromocriptine for patients with T2DM. Currently available anti-obesity drugs lead to weight reductions averaging 5– 10% of the individual’s original weight per year. Orlistat has the smallest effect (– 2.9 kg/ year), but the least adverse effects. The phentermine/ topiramate combination has the greatest effect (– 10.2 kg/ year). The etiology of obesity combines genetic and environmental factors and influences the patient throughout his life. Alike other chronic diseases such as hypercholesterolaemia or hypertension, the obesity treatment is for lifelong. The short-term therapy results in the yo yo effect. Contraindications should be respected when prescribing anti-obesity drugs, and obese individuals should be educated about the need to reduce food intake and increase physical activity.
Key words:
obesity – pharmacotherapy – orlistat – combination of bupropion and naltrexone – liraglutide
Submitted: 22. 9. 2018
Accepted: 10. 10. 2018
The author declares she has no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.
Authors:
Šrámková P.
Authors‘ workplace:
OB klinika, Praha
Published in:
Gastroent Hepatol 2018; 72(6): 495-500
Category:
doi:
https://doi.org/10.14735/amgh2018495
Overview
Redukce hmotnosti je cesta ke zlepšení komorbidit a snížení rizikových faktorů, vždy vyžaduje komplexní ale i individuální přístup. Přípravky určené k léčbě obezity spolu se změnou životního stylu jsou určeny pro ty, u kterých dietní opatření a pohybová aktivita nejsou dostatečně efektivní. Farmakoterapie je doporučena u pacientů s body mass indexem (BMI) ≥ 27 spolu s přidruženými komorbiditami nebo u BMI ≥ 30. Obecně kromě orlistatu je cílem farmak ovlivnění chuti k jídlu a snížení příjmu potravy. Je-li snížení hmotnosti s farmaky za 3 měsíce ≥ 5 % původní hmotnosti, bez nežádoucích účinků, můžeme pokračovat v léčbě. V současné době je v České republice k dispozici orlistat, fentermin s omezenou preskripcí určený pouze ke krátkodobé léčbě, z nových léků kombinace bupropionu s naltrexonem a od listopadu 2018 injekční liraglutid v dávce 3 mg/ den – tedy odlišné od léčby diabetu. U diabetiků jsou doporučeny GLP-1 analoga a SGLT-2 blokátory vedoucí krom zlepšení glykemie k statisticky významné změně hmotnosti. V USA jsou možnosti již mnohem širší, z farmak jsou schváleny lorcaserin, kombinace fentermin + bupropion a u diabetiků též pramlintid a bromokriptin. Současná farmaka určená k léčbě obezity vedou k redukci váhy v průměru 5– 10 % původní hmotnosti za rok. Nejmenší efekt má orlistat – 2,9 kg/ rok, avšak s nejméně nežádoucími účinky. Nejvyšší redukci váhy pozorujeme u kombinace fentermin + topiramat – 10,2 kg/ rok. Pokud vycházíme z etiologie onemocnění – genetické nastavení a vlivy zevního prostředí, které budou na pacienta působit neustále – celoživotně, je perspektivní léčba celoživotní, stejně např. jako léčba hypercholesterolemie či hypertenze, neboť krátkodobá opatření posilují jojo efekt. Při nasazení antiobezitik je třeba respektovat kontraindikace a zároveň edukovat pacienta o nutném dodržování redukční diety a pohybové aktivitě.
Klíčová slova:
obezita – farmakoterapie – orlistat – kombinace bupropionu a naltrexonu – liraglutid
Na úvod zamyšlení – proč redukovat hmotnost?
Při strohém statistickém pohledu má každý druhý nadváhu a každý čtvrtý je obézní! Vzhledem k velkému množství nemocných obezitou a nadváhou je vhodné pacie ntům nabídnout celou škálu možností, kde lze sofistikovaně redukovat hmotnost dle tíže jejich onemocnění, od redukčních klubů Stop obezitě ( STOB), internetových aplikací po ambulance praktických lékařů, specialisty až po bariatrická centra. Podle stupně obezity je též nutno dosáhnout požadované – dostatečné redukce, která vede ke snížení incidence komorbidit či tyto komorbidity zlepší, vyléčí a také prodlouží život, který je u obézních předpokládaně kratší. Obezitu již všichni vnímáme jako těžké chronické onemocnění s multifaktoriálním původem. Není to kosmetický defekt, zejména sociální důsledky nemoci jsou individuálně důležité.
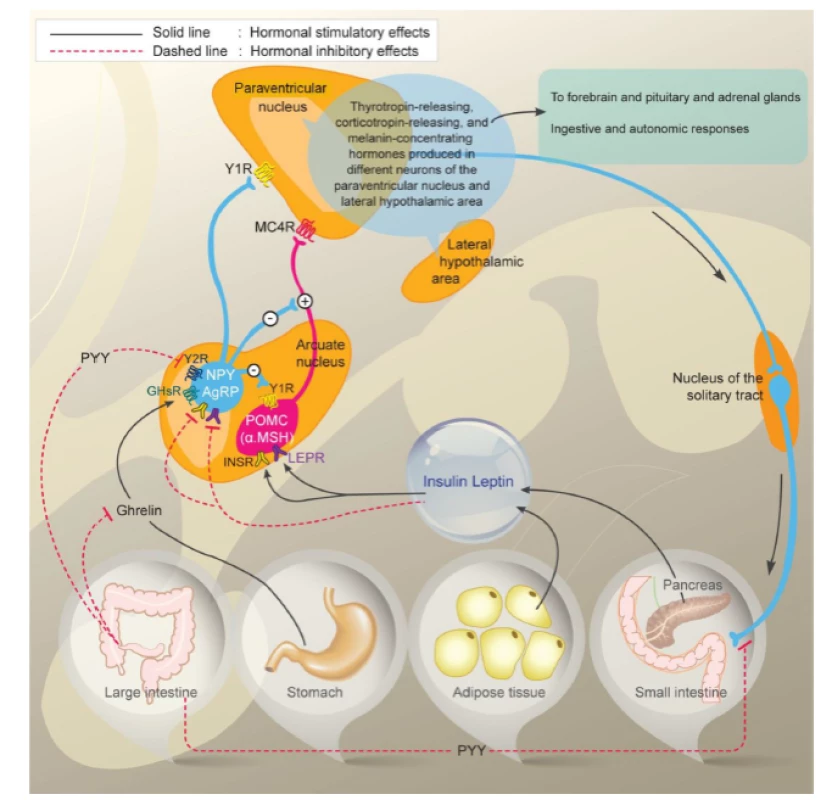
Obezita je multifaktoriálně podmíněné onemocnění, kdy interakce vlivu prostředí s genetickými predispozicemi vede k pozitivní energetické bilanci, která má za následek nadměrné hromadění tukové tkáně. Navození pocitu sytosti i preference potravin jsou významně geneticky determinovány. To znamená, že energetický příjem je vedle vlivu toxicko-obezitogenního prostředí významně ovlivňován faktory hereditárními. Stejně jako příjem energie jsou významně geneticky determinovány všechny složky energetického výdeje. Mezi tyto složky patří klidový energetický výdej, postprandiální termogeneze a spontánní fyzická aktivita. Obezitu můžeme též vnímat jako neuroendokrinní dysregulaci energetického příjmu a energetického výdeje (obr.1) [1].
Fig. 1. Interaction of hormonal and neural pathways regulating food intake and fatty tissue. Source: Korner J, Liebel RL. To eat or not to eat-how the gut talks to the brain. N Engl J Med 2003; 349(10): 926–928.
Základem léčby obezity je změna životosprávy = redukční dieta, pohybová aktivita a změna chování. Dalším důležitým bodem je vhodná farmakoterapie. Stejně jako nyní přistupujeme k léčbě hypertenze, hyperlipoproteinemie či jiných nemocí, měli bychom vhodnou farmakologickou léčbu podávat obézním pacientům prakticky celoživotně. Toto vyplývá z podstaty onemocnění, kdy velký podíl mají genetické vlivy, které zatím nelze ovlivnit. Obecná očekávání od farmakoterapie je redukce 7– 10 % původní hmotnosti a její udržení po dobu užívání léků.
Farmakoterapie
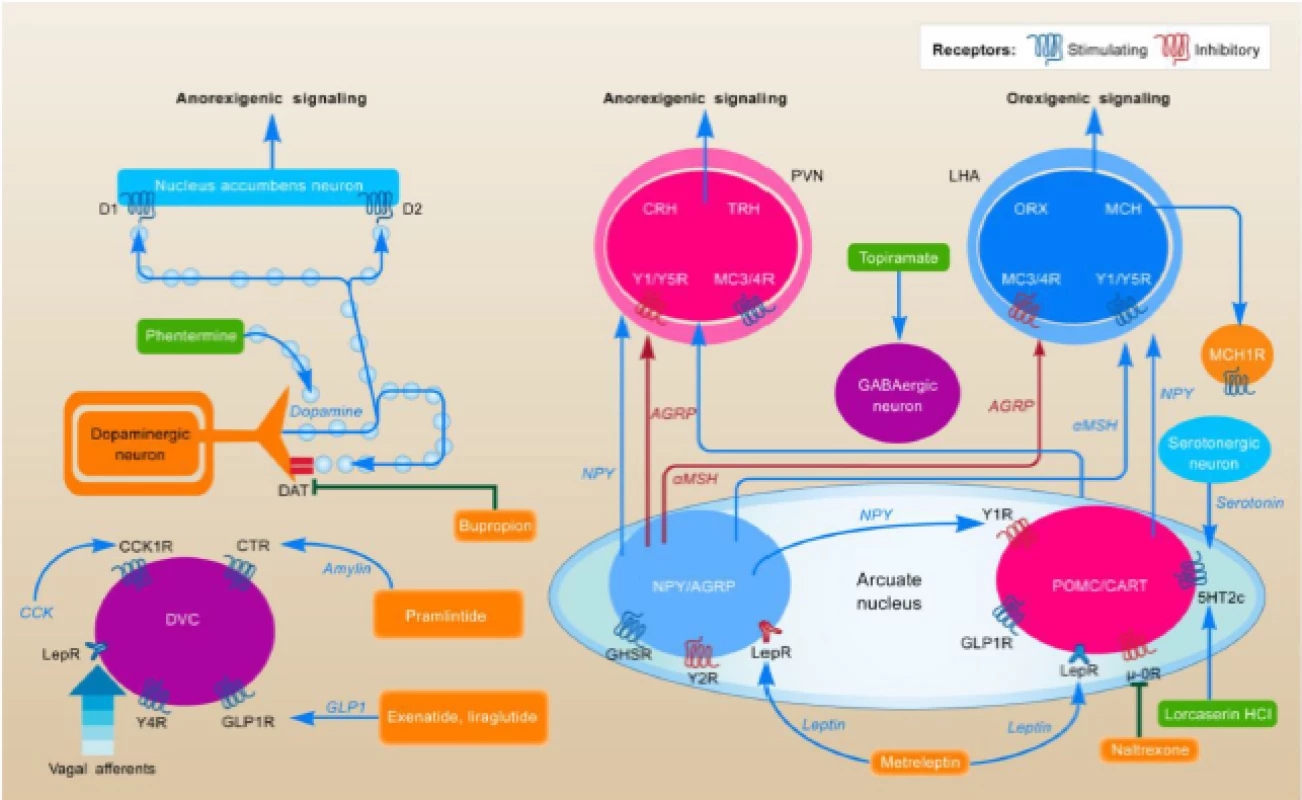
Obezita je nemoc těla i duše, proto jsou účinné zejména centrálně působící látky. K terapii nelze v praxi zatím použít léčiva ovlivňující energetický výdej pro jejich přílišnou toxicitu, proto se snažíme ovlivňovat energetický příjem. Na příjmu potravy v mozku se podílejí dva systémy – homeostatický (leptin, ghrelin atd.) a hédonický (dopamin, endokanabioidy atd.), které spolu v tomto komplexním procesu trvale soupeří. Dopamin je nervový přenašeč, který se podílí na zprostředkování odměny a vzniku závislosti (obr. 2) [2].
Fig. 2. Mechanism of action of anti-obesity. Source: Kim GW, Lin JE, Blomain ES et al. Antiobesity pharmacotherapy: new drugs and emerging targets. Clin Pharmacol Ther 2014; 95(1): 53–66. doi: 10.1038/clpt.2013.204.
Indikací farmakoterapie je selhání nefarmakologické léčby vedené po dobu 3 měsíců u pacientů s BMI ≥ 30 nebo u pacientů s BMI ≥ 27, jsou-li přítomna kardiovaskulární a metabolická rizika související s obezitou. Farmakoterapie obezity se nedoporučuje u pacientů nad 65 let a u dětí. Kontraindikace vyplývají z mechanismu působení jednotlivých farmak a s ním spojeným možným výskytem nežádoucích účinků [3].
Současnými dostupnými antiobezitiky v ČR jsou orlistat, novinkami kombinace naltrexon + bupropion (Mysimba®) a od listopadu 2018 liraglutid (Saxenda®).
Orlistat
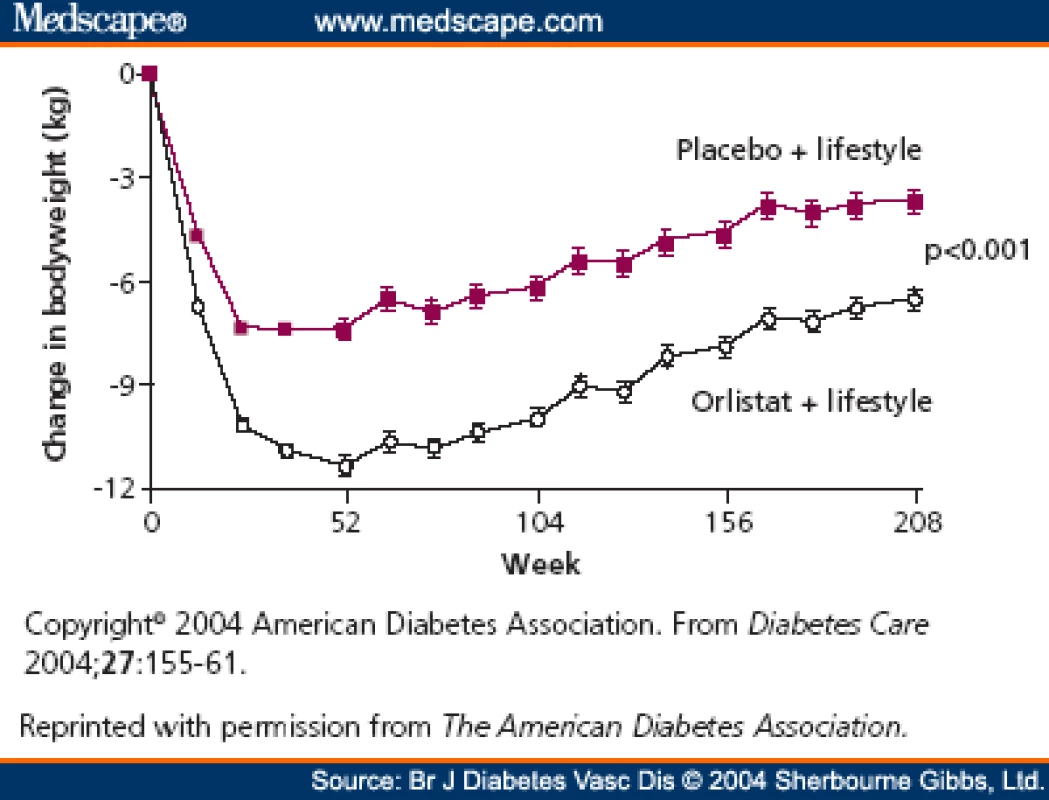
Antiobezitikum vyzkoušené více než 8 miliony pacientů, je používané v klinické praxi od roku 1998 u dospělých a od roku 2004 v USA a Kanadě i u adolescentů. Orlistat (Xenical®) je inhibitor střevní lipázy – inhibuje část účinku enzymů trávících tuky. Redukce hmotnosti zde dosahujeme sníženým vstřebáváním tuků ze střeva, a to asi o 30 % při dávce 120 mg (25 % při dávce 60 mg), čímž se sníží kalorický obsah jídla o cca 600 kJ/ den. Pokud dochází k nedodržování diety hlavně ve smyslu zvýšeného příjmu tuků, má pacient nadýmání, odchod stolice spolu s nevstřebaným tukem, mastný až imperativní průjem. V tomto směru působí „jako výukový lék“. Je třeba zmínit, že nežádoucí účinky se mohou objevit i přes dodržování dietních opatření, citlivost k léku je individuální. Průměrný pokles hmotnosti je 5,5 kg/ rok. Vidíme i významné zlepšení v lipidovém spektru, zlepšení citlivosti k inzulínu, pokles glykovaného hemoglobinu, u obézních nediabetiků dochází k významnému snížení rizika vzniku diabetu 2. typu o 37 %. Léky lze podávat dlouhodobě i po dobu 4 let, min. však 3 měsíce k zjištění efektu. Orlistat jako účinné antiobezitikum je vhodný ke komplexní léčbě metabolického syndromu. Po 4 letech užívání je pokles hmotnosti o 2,8 kg větší než placebo (obr. 3) [4]. Ačkoli tento váhový efekt není velký, je zde prokázána 37% redukce incidence diabetu [5]. Při srovnání samotné diety je redukcí hmotnosti spolu s Xenicalem dosaženo i zlepšení kardiovaskulárních rizikových faktorů, jako jsou hypertenze a patologie lipidového spektra.
Fig. 3. Weight decrease over 4 years in the XENDOS study. Source: Torgerson JS, Hauptman J, Boldrin MN et al. XENical in the prevention of diabetes in obese subjects (XENDOS) study: a randomized study of orlistat as an adjunct to lifestyle changes for the prevention of type 2 diabetes in obese patients. Diabetes Care 2004; 27(1): 155–161.
Fentermin
Fentermin je v ČR registrován jako Adipex ret® 15 mg v tabletách. Fentermin byl vyroben roku 1971 a u nás na trhu je již od roku 1991. V současné době nejsou dostupné signifikantní údaje týkající se změny morbidity a mortality, v době uvedení na trh tehdy nebyly požadovány. Fentermin vede k uvolňování dopaminu v centrální nervové soustavě (CNS) a při jeho podávání je možný vznik závislosti. Preparát lze používat pouze omezenou dobu – max. 3 měsíce (dle souhrnu údajů o léčivém přípravku). Podává se jako doplněk k redukční dietě u pacientů s BMI ≥ 30 vždy 1× denně ráno, často zvláště na počátku redukce váhy pro usnadnění omezení množství potravy. I když je krátkodobě efektivní, prakticky vždy vede k jojo efektu, a to proto, že ho lze podat jen krátkou dobu. Poměrně dobře snižuje chuť k jídlu. Nicméně má mnoho závažných nežádoucích účinků, které se projevují až při delším užívání (≥ 3 měsíce), a to zejména rozvoj závislosti na tomto léku. Z tohoto důvodu byl již v mnoha zemích EU stažen z trhu. V ČR je možnost preskripce omezena na předpis na opiátový recept s modrým pruhem. Důvodem velkého omezení bylo zneužívání látky k výrobě návykové látky pervitinu. U některých pacientů, kteří dostávali anorektika tohoto typu, byly zaznamenány případy závažné, často fatální pulmonální hypertenze. Dlouhodobá léčba tímto přípravkem je spojena s rizikem farmakologické tolerance, závislosti a abstinenčními příznaky. Nejběžnější nežádoucí účinky, které byly popsány, jsou psychotické reakce nebo psychózy, deprese, nervozita, agitovanost, poruchy spánku a vertigo, tachykardie, palpitace, hypertenze. Léky se zachovaným psychostimulačním účinkem jsou všechny zatíženy určitým rizikem vzniku drogové závislosti.
O tomto starším preparátu se zmiňujeme zejména proto, že v USA je stále široce předepisován a trvale tvoří asi 60– 70 % z preskripce antiobezitik, nicméně jeho zásadní význam má současně v USA nabízená kombinace topiramatu s fenterminem.
Topiramat ER s fenterminem
Fixní kombinace byla schválena Food nad Drug Administration (FDA) na jaře 2012. Preparáty jako Qnexa a Qsymia lze nyní získat pouze v USA. Kombinovaný preparát má mnohem větší efekt než monoterapie. Fentermin sám o sobě cestou amfetaminu a fenyletylaminu potlačuje chuť k jídlu, antiepileptikum topiramat vede k redukci hmotnosti. V kombinaci snižuje topiramat závislost na fenterminu. Největší studií je CONQUER, do níž bylo zařazeno 2 487 nemocných s BMI 27– 45 kg/ m2 a min. dvěma komorbiditami souvisejícími s metabolickým syndromem. Po roce sledování klesla hmotnost u osob v placebové skupině o 1,4 kg, ve skupině s nižší dávkou fentermin/ topiramat (7,5 mg/ 46 mg) o 8,1 kg a ve skupině s dávkou vyšší 15 mg/ 92 mg o 10,2 kg. Nejčastějšími nežádoucími účinky bylo sucho v ústech, parestezie, zácpa, nespavost a motání hlavy. Depresivní epizody prodělalo 7 % pacientů ve skupině na vyšší dávce kombinačního preparátu; podobně úzkostné poruchy se v této skupině vyskytly v 8 %. Dávkování je přísně individuální podle doporučeného schématu dle poklesu hmotnosti s kontrolami po 6 a následně 12 týdnech a následné pokračování v léčbě jen u těch, kteří z léčby profitují. FDA podmínila použití důslednou edukací a antikoncepcí žen ve fertilním věku s ohledem na teratogenní riziko, přítomné ale jen v některých studiích [6].
Prospektivní studie AQCLAIM je 4letá studie v EU s 16 000 obézními pacienty s vysokým kardiovaskulárním rizikem. Ukončení studie se očekává koncem letošního roku. Sledován byl dlouhodobý efekt na výskyt MACE (major adverse cardiovascular event) a dále hospitalizace pro srdeční selhání, nestabilní anginu pectoris a srdeční revaskularizaci. Data těsně před ukončením studie jsou velmi povzbudivá, preparát nemá vliv na kardiovaskulární onemocnění (KVO) (ECO Vídeň 2018).
Lorkaserin
Schválení lorkaserinu HCl jako Lorquess či Belviq v květnu 2012 se opět dočkalo pouze USA cestou FDA. Jedná se o látku ze skupiny agonistů serotoninových receptorů. Látka zvyšuje pocit sytosti. Protože působí na 5-HT2C serotoninové receptory, které se vyskytují výhradně v mozku, nemá prakticky nežádoucí účinky. Centrum působení je v hypothalamu ovlivněním produkce proopiomelanokortinu. Podává se v dávce 10 mg 2× denně.
Obecně ve studiích popisovaná redukce hmotnosti je > 10 % původní hmotnosti po 1 roce užívání, což odpovídalo v průměru 8 kg. Po 2 letech je průměrný váhový úbytek 6 kg. Celkem 22 % pacientů zhubne více než 10 % hmotnosti, 5 % hmotnosti zhubne polovina pacientů.
Ve studiích pacientů s diabetem je pokles hmotnosti menší: po 1 roce zhublo o 4,7 kg 16 % pacientů více než 10 % hmotnosti, 37 % diabetiků zhublo 5 % hmotnosti. Kritériem respondentů je 12 týdnů od zahájení podávání pokles váhy o více než 5 % hmotnosti. Zhodnocení pacientů nediabetiků: 85 % si udrželo po 52 týdnech terapie hmotnost sníženou o 5 % a 50 % pacientů dokonce o 10 % původní hmotnosti [7,8].
Několikaletými studiemi nebylo prokázáno riziko vzniku plicní hypertenze či chlopňových vad, byla prokázána absolutní bezpečnost rizika vzniku KVO. Nejčastějšími nežádoucími účinky jsou bolesti hlavy, infekty horních cest dýchacích a nauzea, zvláště v počátku podávání. V Evropě je k dispozici zatím ve fázi 3b/ 4 klinických studií. Studie se jmenuje CAMELLIA-TIMI. Jedná se o randomizovanou, multicentrickou, dvojitě slepou studii u velmi rizikové populace 12 000 pacientů s KVO a diabetes mellitus. Studie probíhala od roku 2014 do července 2018. Studie prokázala KVO bezpečnost, bez výskytu MACE oproti placebu.
Naltrexon s bupropionem
Bupropion – aktivátor proopiomelanokortinové osy jako antidepresivum dohromady s antagonistou opioidních receptorů naltrexonem vede spolu s kognitivně behaviorální terapií k redukci hmotnosti. Předpokládá se stimulace melanokortinové osy a synergické efekty na systém mezencefalu [9].
Tato kombinace se jistě rychle zařadí na přední příčku antiobezitik. V současné době je od června 2015 dostupná v USA a Jižní Koreji. Na těchto trzích preparát najdeme pod názvem Contrave® (naltrexone HCl/ bupropion HCl – 8 mg/ 90 mg). Vyvinuta byla firmou Orexigen. Od roku 2015 je též schválena Evropskou agenturou pro léčivé přípravky (EMA) jako Mysimba® 8 mg/ 90 mg prolonged-release tablets. Od druhé poloviny roku 2016 je k dostání v zemích EU. Lék je určen k redukci váhy pacientů s BMI ≥ 30 a ≥ 27 s komorbiditami. Na její oblibě bude mít bezesporu vliv i to, že obě látky samostatně jsou již na trhu více než 30 let a nemají zásadní nežádoucí účinky, a to hlavně výskyt KVO a depresí.
Bupropion byl primárně určen k terapii depresivních onemocnění a také k odvykání kouření (od 1989). Snižuje příjem potravy – inhibuje zpětné vychytávání dopaminu a noradrenalinu + aktivuje hypothalamickou proopiomelanokortin-anorexigenní osu, potlačuje chuť k jídlu, zvyšuje kontrolu nad jídlem a snižuje craving.
Naltrexon je opioidní antagonista užívaný při léčbě závislosti na opiodech a alkoholu (od 1984). Naltrexon snižuje příjem potravy: inhibuje opioidní neurony tlumící hypothalamickou melanokortinovou anorexigenní osu + inhibuje „odměňovací“ („reward“) systém v CNS.
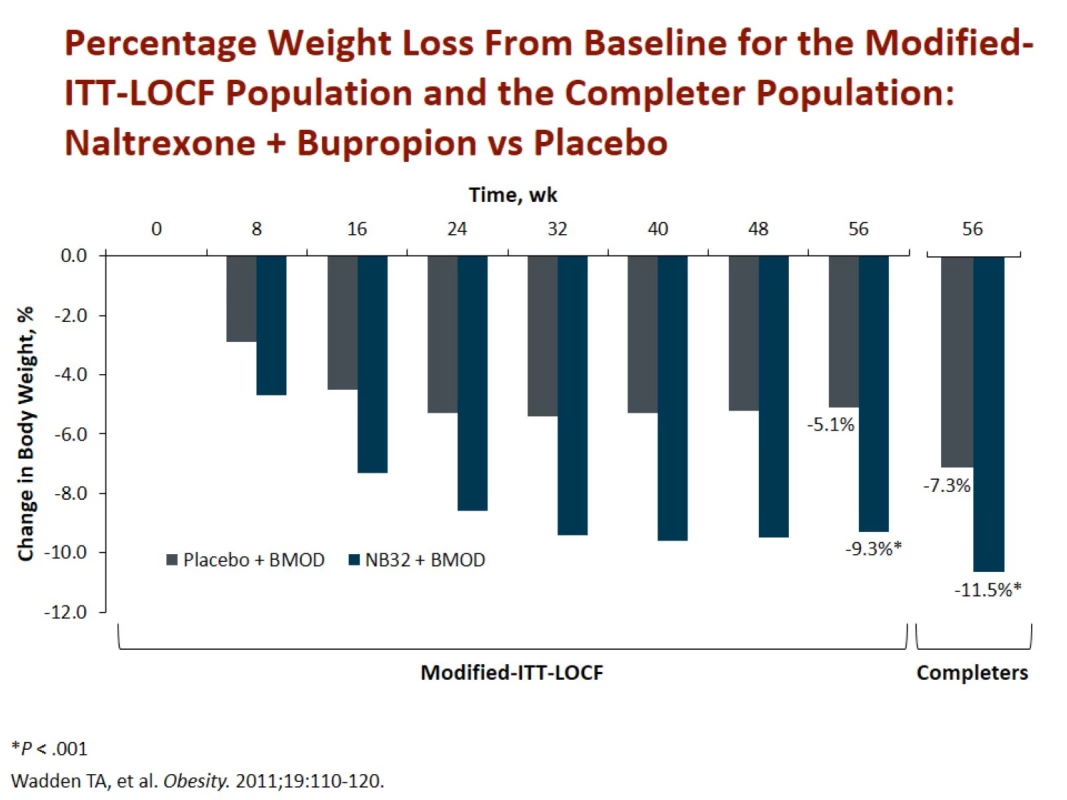
Ve studiích byla průměrná redukce 9,3 % hmotnosti (8,2 kg) a zmenšení obvodu pasu o 6,2 cm za 56 týdnů léčby. Celkem 34 % pacientů zredukovalo svou původní váhu o ≥ 10 %. Redukce o 11,5 % hmotnosti a zmenšení obvodu pasu o 10 cm byla dokumentována ve studii spolu s intenzivní kognitivně-behaviorální terapií. V této větvi zredukovalo 55 % pacientů ≥ 10 % své původní váhy (obr. 4) [10].
Fig. 4. Wadden TA, Foreyt JP, Foster GD et al. Weight loss with naltrexone SR/bupropion SR combination therapy as an adjunct to behavior modification: the COR-BMOD trial. Obesity (Silver Spring) 2011; 19(1): 110–120. doi: 10.1038/oby.2010.147.
Více než 50 % diabetiků dosáhlo glykHb < 7 % (jednotky diabetes control and complications trial) – cílové hodnoty guidelines Americké diabetologické asociace. Stejně pozitivní dopad vidíme na zmenšení obvodu pasu, snížení hladiny triglyceridů, LDL, HbA1c, glyk, diastolického tlaku krve a zvýšení HDL cholesterolu. Nemá vliv na tepovou frekvenci. Do studií s kardiovaskulární bezpečností je zahrnuto 13 000 pacientů.
Zatím nejčastějšími nežádoucími účinky se jeví nauzea (32 %), zácpa (19 %), cefalea (18 %), zvracení (11 %), závrať a sucho v ústech. Kontraindikací jsou těžké psychiatrické poruchy, epilepsie, léková či alkoholová závislost, současné podávání léků se stejným složením či MAO (monoaminooxidáza), podávání dětem.
Bupropion SR s zonisamidem SR
Dále z této skupiny lze zmínit též kombinaci bupropionu SR a zonisamidu SR – s předpokládaným prodejním názvem Empatic™. Kombinace je stále ve fázi 3 klinických studií v USA. Mezi nejčastějšími nežádoucími efekty jsou popisovány nespavost, bolesti hlavy, nauzea, nejsou zaznamenány deprese.
Liraglutid
První GLP(glukagon-like peptid)-1 analog schválený FDA v roce 2014 k léčbě obezity je k dispozici pod názvem Saxenda®. Schválení v Evropě agenturou EMA proběhlo v lednu 2015, v ČR je preparát schválen Státním ústavem pro kontrolu léčiv až nyní a možnost preskripce je možná od listopadu 2018. Jedná se o injekční preparát, který se podává 1× denně subkutánně. Má prakticky dvojnásobné dávkování než při léčbě diabetu. Saxenda obsahuje v jedné dávce 3,0 ml liraglutidu (obr. 5). V léčbě diabetu používáme GLP-1 analoga již běžně, a proto máme i vlastní bohaté zkušenosti. Tyto látky tlumí zvýšenou sekreci glukagonu, zvyšují sekreci inzulínu, potlačují apoptózu beta buněk pankreatu a zároveň navozují pocit sytosti v mozku, snižují chuť k jídlu, zpomalují vyprazdňování žaludku, zvyšují pocit plnosti a snižují příjem potravy [11]. V bílé tukové tkáni snižují ukládání tuku stimulací lipolýzy a inhibicí lipogeneze. Při redukci váhy nedochází ke snížení klidového energetického výdeje [12,13]. Tato tzv. inkretinová léčba má kromě antidiabetického působení i řadu dalších potenciálně velmi zajímavých předpokládaných kardioprotektivních a neuroprotektivních účinků. Konzistentně též snižuje krevní tlak a má pozitivní vliv na lipidové parametry a v některých studiích též snižuje subklinickou zánětlivou reakci. Inkretinová mimetika vedou k trvalé redukci hmotnosti diabetiků v průměru o 2– 5 kg s dokumentovaným efektem přetrvávajícím po dobu 2 let. GLP-1 agonisté jsou efektivní k navození a udržení váhového úbytku po dobu 104 týdnů s dobrou tolerovaností a bezpečností. U nediabetiků/ respondérů je váhový úbytek 10,3 kg/ rok a 9,7 kg/ 2 roky aplikace (Astrup A, ICO 2010 Stockholm) (obr. 6 a 7) [14,15].
Fig. 5. Liraglutide 3.0 mg pre-filled pen. Source: Novo Nordisk

Fig. 6. Changes of weight in relation to the length and dose of liraglutide compared to placebo and orlistat. Source: Astrup A, Carraro R, Finer N et al. Safety, tolerability and sustained weight loss over 2 years with the once-daily human GLP-1 analog, liraglutide. Int J Obes 2012; 36: 843–854. doi: 10.1038/ijo.2011.158.
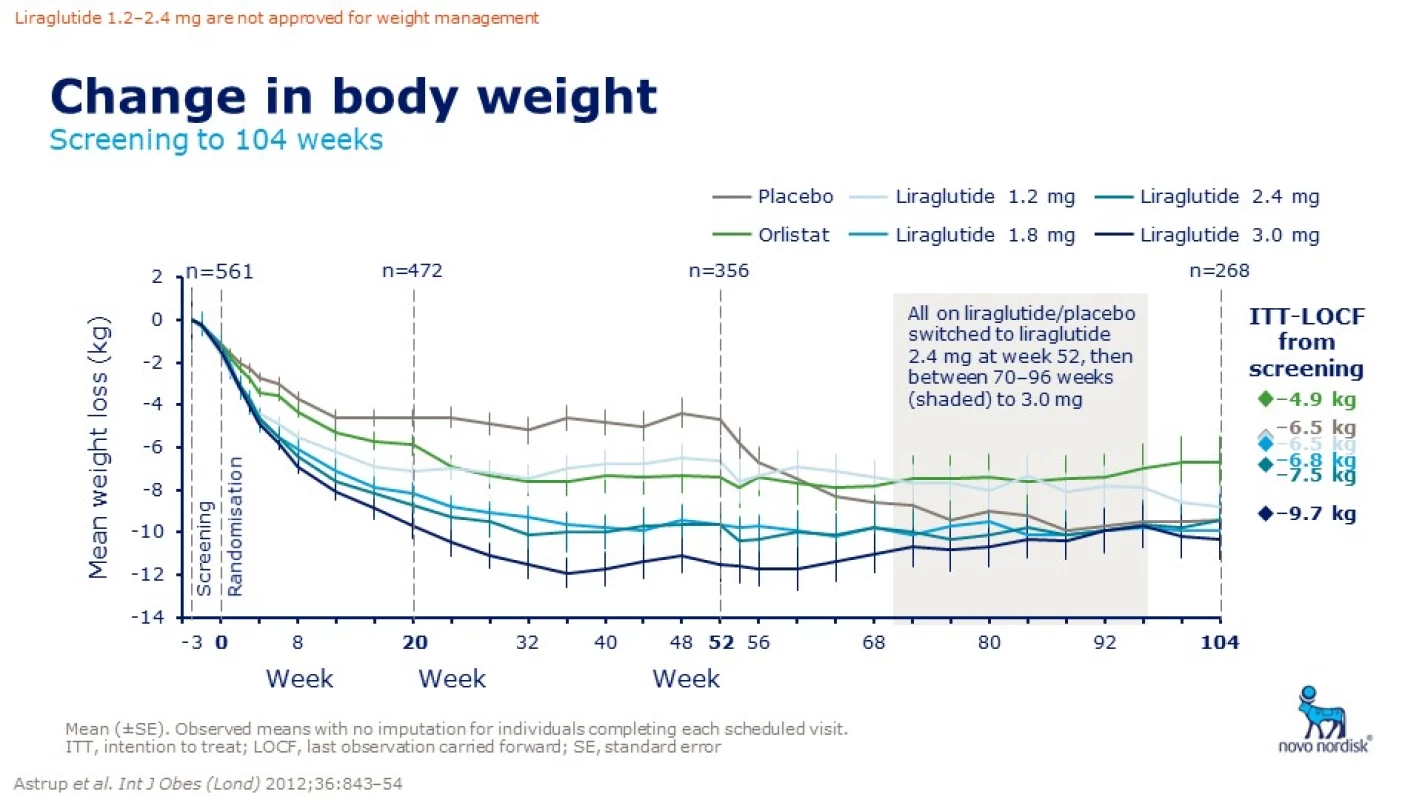
Fig. 7. Weight change when liraglutide vs. placebo over 1 year. Source: Pi-Sunyer X, Astrum A, Fujioka K et al. A randomized, controlled trial of 3.0 mg of Liraglutide in weight management. N Engl J Med 2015; 373: 11–22. doi: 10.1056/NEJMoa1411892.
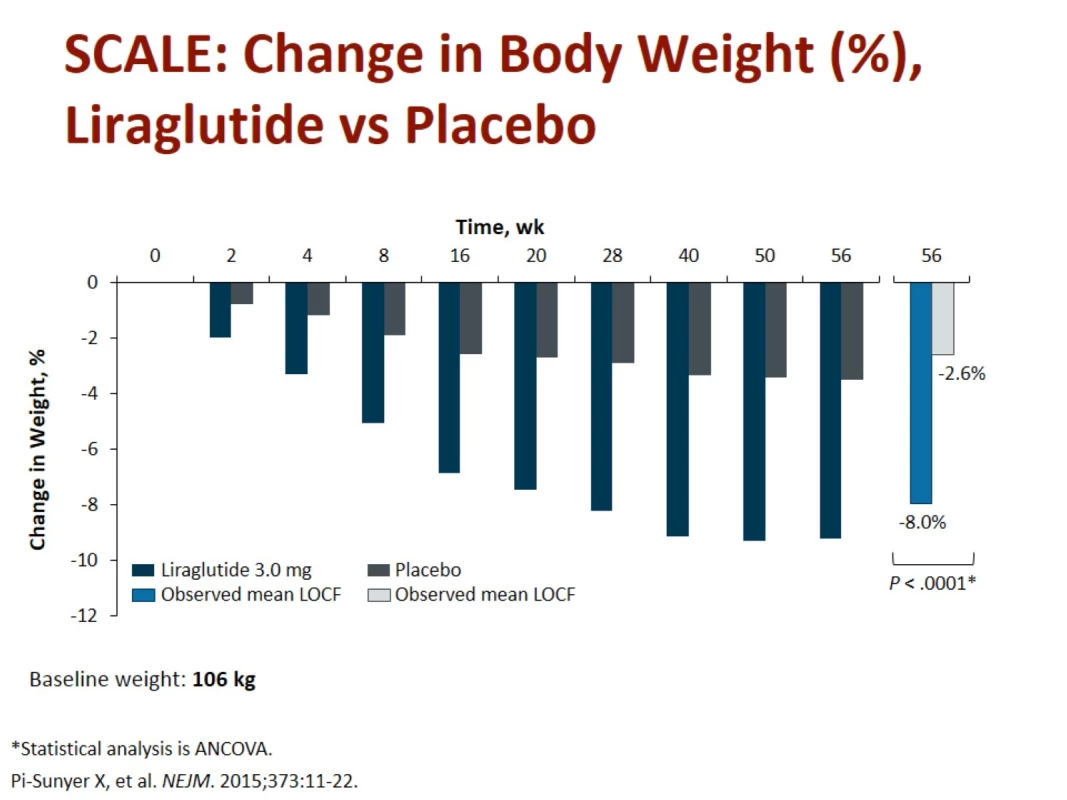
Z nežádoucích účinků je zmiňována nauzea 40 %, zvracení 16 %, průjem, zácpa, bolesti břicha, nazofaryngitida, cefalea, únava, atralgie a také sporadický výskyt pankreatitidy.
Kontraindikací podání je medulární karcinom štítné žlázy nebo pankreatitida v anamnéze.
Efekt terapie je posuzován dle FDA po 16 týdnech, kdy by měl být efekt redukce ≥ 4 % původní hmotnosti, dle EMA je kontrola po 12 týdnech a úbytek váhy by měl být ≥ 5 % původní hmotnosti.
Uchování pera před použitím je doporučeno v chladničce při 2– 8 °C. Při aplikaci pak uchování pera v pokojové teplotě mezi 15 a 30 °C nebo v chladničce.
Je zde třeba zmínit ještě semaglutid, který je zatím zkoušen v rámci studií, nicméně je velmi perspektivní a při jeho aplikaci dochází k redukci 15 % původní hmotnosti za 1 rok (ECO Vídeň 2018).
Elsinorské prášky
Jedná se o magistraliter připravenou kombinaci efedrinu s kofeinem podávanou ráno a v poledne. Předpokládáme zvýšení termogeneze. Prášky nejsou akceptovány všemi obezitology, nicméně dle vlastní zkušenosti u některých pacientů jsou účinné. Kvůli jejich nežádoucím účinkům a možnosti lékové závislosti je jejich užívání omezeno na 3 měsíce.
Farmaka snižující hmotnost, primárně nedeklarovaná jako antiobezitika, indikovaná u specifických diagnóz
Bromokriptin
FDA schválila bromokriptin mesylat v roce 2009 i jako antidiabetikum, kdy kromě poklesu HbA1c dochází k mírnému poklesu hmotnosti. Antidiabetikum se jmenuje Cycloset. Zatím vlastní mechanismus zlepšení glykemické kontroly není objasněn. Patří do skupiny agonistů dopaminových receptorů. Předpokládá se, že diabetici mají bazálně po ránu nižší dopaminový tonus, který spolu s inzulinovou rezistencí vede k deficitu B buňky pankreatu a následně k diabetu 2. typu. Vidíme zlepšení HbA1c o – 0,5 %, v částech studií věnovaných kardiovaskulárnímu riziku je i zde patrný pokles. Cycloset spolu s dietou, pohybovou aktivitou, samotný či spolu s další antidiabetickou terapií snižuje glykémie a hmotnost u diabetiků 2. typu. Vyrábí se jako p.o. tablety, v použití u diabetu je podáván ráno spolu s jídlem do 2 hod po probuzení. U nás preparát používáme jako Parlodel zatím pouze k léčbě zejména hyperprolaktinemie, dále amenorey, infertility, hypogonadismu, akromegalismu a Parkinsonovy choroby.
Antidepresiva
Dále využíváme sekundárních efektů léků primárně určených k léčbě jiných nemocí. Řada substancí – antidepresiv – ovlivňuje příjem potravy tím, že působením v CNS vyvolávají pocit nasycení nebo tlumí pocit hladu, a to prostřednictvím neuropřenašečů, jako jsou serotonin, noradrenalin a dopamin. Z látek ovlivňujících zpětné vychytávání (reuptake inhibitors) to jsou bupropion, fluoxetin, duloxetin, venflaxin a další.
Další skupinou jsou léky, které působí prostřednictvím hormonálních mechanismů přes leptin, neuropeptid Y, agouti-related peptide, proopiomelanokortin, ghrelin, peptid YY, amylin, glukagon-like-peptide-1(GLP-1), cholecystokinin, oxyntomodulin, pankreatický polypeptid.
Amylin
Pramlintid je syntetický analog amylinu, opět používaný v USA od roku 2005 k léčbě diabetiků obou typů. Zpomaluje postprandiální glykémie a evakuaci žaludku, zvyšuje sytost, vede k mírné redukci hmotnosti. Současně s inzulinem u obou typů diabetiků i s použitím inzulinové pumpy vidíme pokles hmotnosti. U diabetiků 1. typu – 1,7 kg za 1 rok s léčbou pramlintid 60 μg 3× denně, zatímco diabetici 2. typu zhubli o 3,7 kg za 16 týdnů při medikaci pramlintid 120– 240 μg 3× denně. V předběžných výsledcích klinických studií u obézních bez diabetu vedl pramlintid 360 μg 2× denně k redukci o 7,2 kg za 12 měsíců. V USA jsou velmi dynamičtí ve schvalování antiobezitik [16].
GLP-1 analoga
V dnešní době běžně používáme látky, které tlumí zvýšenou sekreci glukagonu a zvyšují sekreci inzulínu. Výhodou této léčby je mírná redukce hmotnosti. Dávkování liraglutidu v léčbě diabetu je menší než u Saxendy a také redukce váhy u diabetiků je vždy menší než u nediabetiků.
Od roku 2005 schválil FDA exanatid (Byetta) injekčně aplikovaná 2× denně, dále Bydureon injekčně 1× týdně. Od roku 2009 máme k dispozici liraglutid (Victosa) injekčně 1× denně, od 2014 lixisenatid (Lyxumia) 20 µg injekčně 1× denně, dále dulaglutid (Trulicity) injekčně 1× týdně.
Využití těchto preparátů v léčbě obezity bylo inspirováno zkušenostmi s bariatrickou chirurgií.
Gliflloziny
Další novou lékovou skupinou k léčbě diabetu, ale využívající synergického efektu jak snížení glykémie a glykovaného hemoglobinu, tak hmotnosti, jsou glifloziny. Glifloziny jsou inhibitory SGLT2 receptoru v proximálním tubulu. Vlastním efektem je částečné zablokování zpětného vstřebávání glukózy z primární moči v proximálním tubulu glomerulu. Tím dochází k arteficiální glukosurii. Nadbytečná glukóza je vyloučena do moči (~70 g/ den = 1 200 kJ/ den) (obr. 8). Množství vyloučené glukózy odpovídá typu preparátu. Od roku 2015 máme k dispozici dapagliflozin (Forxiga®), canagliflozin (Invokana®), empagliflozin (Jardiance®). Dávkování je 1 × denně kdykoli během dne. Schváleny EMA i FDA jsou dále kombinované preparáty s metforminem: dapagliflozin/ metformin (Xigduo®), canagliflozin/ metformin (Vokanamet®), empagliflozin/ metformin (Synjardy®). V Japonsku je k dispozici ipragliflozin (Suglat®). Průměrná redukce hmotnosti je 2– 3 kg/ rok. Je také třeba zmínit, že díky svému účinku dochází ke zvýšenému odpadu glukózy do moči, a tedy pozitivnímu močovému nálezu na obsah cukru. S tím souvisí u malého procenta pacientů výskyt urogenitálních infekcí, které obvykle dobře reagují na běžnou léčbu a nejsou důvodem k přerušení antidiabetické terapie.
Fig. 8. Explanation of urine glucose loss. Source: AstraZeneca.
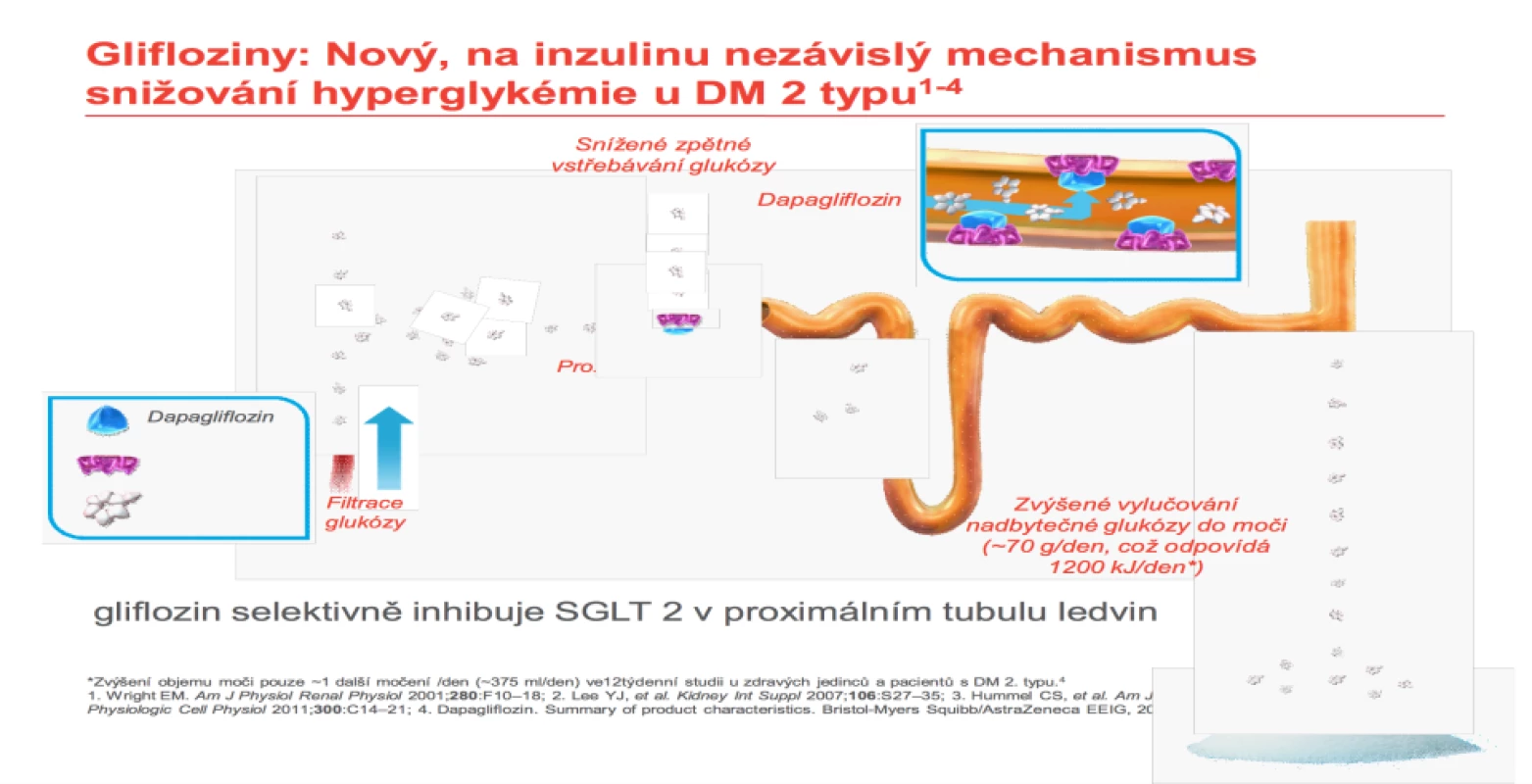
V léčbě obezity jsou úspěšně zkoušeny léky na principu inhibitorů SGLT1 + SGLT2 – působící zejména v tračníku, nyní v poslední fázi klinických studií.
Potravinové doplňky
Dnes již nikdo nepochybuje o efektu ve vodě rozpustné vlákniny (glukomanan, galaktomanan, algináty, inulin). Vláknina zpomaluje vyprazdňování žaludku, snižuje vstřebávání glukózy, snižuje cholesterol, pozitivně působí na tvorbu prospěšné střevní mikroflóry. Vláknina se užívá před jídlem a je ji třeba zapít nejméně 250 ml vody. Dalšími pochutinami s prokázaným pozitivním efektem je kofein – káva, zelený čaj a kapsaicin z chilli papriček aktivující hnědou tukovou tkáň (ICO 2014, Malajsie).
Doručeno: 22. 9. 2018
Přijato: 10. 10. 2018
MU Dr. Petra Šrámková
OB Klinika, a. s.
Centrum pro léčbu obezity a metabolických poruch
Pod Krejcárkem 975
130 00 Praha 3
Autorka deklaruje, že v souvislosti s předmětem studie nemá žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Sources
1. Korner J, Liebel RL. To eat or not to eat – how the gut talks to the brain. N Engl J Med 2003; 349(10): 926– 928. doi: 10.1056/ NEJMp038114.
2. Kim GW, Lin JE, Blomain ES et al. Antiobesity pharmacotherapy: new drugs and emerging targets. Clin Pharmacol Ther 2014; 95(1): 53– 66. doi: 10.1038/ clpt.2013.204.
3. Hainer V et al. Základy klinické obezitologie. 2. vyd. Praha: Grada Publishing 2011 : 277– 280.
4. JS Torgerson, Hauptman J, Boldrin MN et al. XENical in the prevention of diabetes in obese subjects (XENDOS) study: a randomized study of orlistat as an adjunct to lifestyle changes for the prevention of type 2 diabetes in obese patiens. Diabetes Care 2004; 27(1): 155– 161.
5. Torgerson JS, Hauptman J, Boldrin MN et al. Xenical in the prevention of diabetes in obese subject (XENDOS) study: a randomized study of orlistat as an adjunct to lifestyle changes for prevention of type 2 diabetes in obese patients. Diabetes Care 2004; 27(1): 155– 161.
6. Gadde KM, Allison DB, Ryan DH et al. Effects of low-dose, controlled-release, phentermine plus topiramate combination on weight and associated comorbidities in overweight and obese adults (CONQUER): a randomised, placebo-controlled, phase 3 trial. Lancet 2011; 16; 377(9774): 1341– 1452. doi: 10.1016/ S0140-6736(11)60205-5.
7. Smith SR, Weissman NJ, Anderson CM et al. Multicenter, placebo-controlled trial of lorcaserin for weight management. N Engl J Med 2010; 363(3): 245– 256. doi: 10.1056/ NEJMoa0909809.
8. Nigro SC, Luon D, Baker WL. Lorcaserin: a novel serotonin 2C agonist for the treatment of obesity. Curr Med Res Opin 2013; 29(7): 839– 848. doi: 10.1185/ 03007995.2013.794776.
9. Billes SK, Sinnayah P, Cowley MA. Naltrexone/ bupropion for obesity: An investigational combination pharmacotherapy for weight loss. Pharmacol Res 2014; 84 : 1– 11. doi: 10.1016/ j.phrs.2014.04.004.
10. Waden TA, Foreyt JP, Foster GD et al. Weight loss with naltrexone SR/ bupropion SR combination therapy as an adjunct to behavior modification: the COR-BMOD trial. Obesity (Silver Spring) 2011; 19(1): 110– 120. doi: 10.1038/ oby.2010.147.
11. Jelsing J, Vrang N, Raun K et al. Liraglutide induced anorexia is not mediated via brainstem GLP-1 neurons. Diabetes 2011; 60 (Suppl 1): A1083.
12. Flint A, Raben A, Ersbøll AK et al. The effect of physiological levels of glucagon-like peptide-1 on appetite, gastric emptying, energy and substrate metabolism in obesity. Int J Obes Relat Metab Disord 2001; 25(6): 781– 792. 10.1038/ sj.ijo.0801627.
13. Deacon CF, Nauck MA, Toft-Nielsen M et al. Both subcutaneously and intravenously administered glucagon-like peptide 1 are rapidly degraded from the NH2-terminus in type II diabetic patients and in healthy subjects. Diabetes 1995; 44(9): 1126– 1131.
14. Astrup A, Carraro R, Finer N et al. Safety, tolerability and sustained weight loss over 2 years with the once-daily human GLP-1 analog, liraglutide. Int J Obes (Lond) 2012; 36(6): 843– 854. doi: 10.1038/ ijo.2011.158.
15. Pi-Sunyer X, Astrup A, Fujioka K et al. A randomized, controlled trial of 3.0 mg of liraglutide in weight management. N Engl J Med 2015; 373(1): 11– 22. doi: 10.1056/ NEJMoa1411892.
16. Dunican KC, Adams NM, Desilets AR. The role of pramlintide for weight loss. Ann Pharmacother 2010; 44(3): 538– 545. doi: 10.1345/ aph.1M210.
Labels
Paediatric gastroenterology Gastroenterology and hepatology SurgeryArticle was published in
Gastroenterology and Hepatology
2018 Issue 6
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Metamizole vs. Tramadol in Postoperative Analgesia
- Spasmolytic Effect of Metamizole
- The Importance of Limosilactobacillus reuteri in Administration to Diabetics with Gingivitis
-
All articles in this issue
- Detská gastroenterológia a hepatológia
- Obezitologie a bariatricko-metabolická chirurgie
- Ultrasonografické hodnotenie steatózy pečene u obéznych pediatrických pacientov
- Vliv expozice anti-TNFα in utero na vývoj imunitního systému exponovaných dětí – kontrolovaná multicentrická studie
- Wilsonova choroba v dětském věku – dvě kazuistiky
- Parciální jejunální diverze – technické aspekty a počáteční zkušenosti
- Novinky ve farmakoterapii obezity
- Psychologické aspekty chirurgické léčby obezity
- Hepatopatie jako první projev systémové AL amyloidózy
- Meckelův divertikl jako příčina náhlé příhody břišní
- Intrapankreaticky uložená akcesorní slezina jako raritní solidní léze pankreatu
- Krvácení jako komplikace chronické pankreatitidy
- Správná praxe při oplachu endoskopů
- Endoskopická léčba rektálního syndromu při lipomu rekta technikou „loop and let go“
- Výběr z mezinárodních časopisů
- Široká problematika žlučových kyselin a jejich účinků pohledem XXV. Bile Acid Meeting: Bile Acids in Health and Disease 2018
- Správná odpověď na kvíz
- Poděkování recenzentům
- První biosimilární adalimumab – SB5
- Hepatitida B u osob infikovaných virem lidské imunodeficience v Porto-Novo – prevalence a související faktory
-
Novel developments in endoscopy of the proximal GIT
Oliver Pech (Germany) – Gastro Update Europe 2018, Prague
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Meckelův divertikl jako příčina náhlé příhody břišní
- Hepatopatie jako první projev systémové AL amyloidózy
- Wilsonova choroba v dětském věku – dvě kazuistiky
- Endoskopická léčba rektálního syndromu při lipomu rekta technikou „loop and let go“
