Fenotyp akútneho hepatálneho zlyhania pri inaparentnom malobunkovom karcinóme pľúc
Phenotype of acute liver failure in inapparent small cell lung cancer
Acute liver failure is defined by the manifestation of liver failure from 7th to 21st day in a previously healthy liver. The most frequent causes are viral hepatitis B, A, E, drug or toxin-induced hepatotoxicity (Amanita phalloides), rarely Wilson’s disease, autoimmune hepatitis, HELLP (hemolysis, elevated liver enzymes, low platelets) syndrome, or vascular causes (Budd-Chiari syndrome, hypoxic hepatitis). We present a 71-year - -old female patient with metabolic syndrome admitted to hospital with cholestasis, progression of weakness, abdominal pain, and breathlessness. Because of suspected pleuropneumonia, the treatment with ceftriaxone/metronidazole was initiated. Due to cholestasis progression and suspicion of drug-induced liver toxicity, the treatment was stopped on 5th day. Imaging methods (ultrasonography, CT, magnetic resonance imaging) found multiple small liver lesions, suspected metastatic involvement, which was not confirmed by positron emission tomography – computed tomography. Due to the rapid progression of the patient’s condition with the onset of icterus, ascites, encephalopathy, a liver biopsy was not done. The patient died on the 17th day of hospitalization. The primary tumour was not detected during her life, and not by pathological section. The diffuse metastasis of small cell lung cancer (SCLC) in the liver was found by histological post mortem examination. The case report suggests high invasiveness of SCLC with a possibility of unusual manifestation in a form of acute hepatic failure.
Keywords:
acute liver failure – small cell lung cancer – hepatotoxicity – diffuse metastasis
Authors:
Faktorová X. 1; Staškovanová T. 1; Bilíková K. 1; Hokša R. 2; Tvrdík T. 3; Ďurkovičová Z. 1; Szántová M. 1
Authors‘ workplace:
III. interná klinika LF UK a UN Bratislava, Slovenská republika 2 Ústav patologickej anatómie LF UK a UN Bratislava, Slovenská republika 3 I. rádiologická klinika LF UK, SZU a UN Bratislava, Slovenská republika
1
Published in:
Gastroent Hepatol 2020; 74(5): 404-409
Category:
Gastrointestinal Oncology: Case Report
Overview
Akútne zlyhanie pečene je definované prejavmi hepatálneho zlyhania od 7 do 21 dní u predtým zdravej pečene. Najčastejšími príčinami sú vírusová hepatitída B, A, E, hepatotoxicita indukovaná liekmi alebo toxínmi (Amanita phalloides), zriedka Wilsonova choroba, autoimunitná hepatitída, HELLP (hemolysis, elevated liver enzymes, low platelets) syndróm alebo cievne príčiny (Buddov-Chiariho syndróm, hypoxická hepatitída). Uvádzame popis 71-ročnej pacientky s metabolickým syndrómom prijatej s cholestázou, progresiou slabosti, bolesťami brucha a dyspnoe. Pre suspektnú pleuropneumóniu bola započatá liečba ceftriaxon/metronidazol, ktorú sme na 5. deň pre progresiu cholestázy a suspektnú liekovú hepatotoxicitu vysadili. Zobrazovacie metódy (ultrasonografia, CT, magnetická rezonancia) zistili mnohopočetné drobné ložiská v pečeni, suspektné z metastatického postihnutia, ktoré pozitronová emisná tomografia s výpočtovou tomografiou nepotvrdila. Vzhľadom na rýchlu progresiu stavu s rozvojom ikteru, ascitu, hepatálnej encefalopatie sa nepodarilo zrealizovať biopsiu pečene a pacientka na 17. deň hospitalizácie exitovala. Origo neoplázie sa intravitálne ani pri patologicko-anatomickej sekcii nezistili. Až histologické vyšetrenie post mortem odhalilo malobunkový karcinóm pľúc (SCLC – small cell lung cancer) s difúznou hepatálnou disemináciou. Kazuistika pripomína vysokú invazivitu SCLC s možnosťou nezvyčajnej manifestácie formou akútneho hepatálneho zlyhania.
Klíčová slova:
akútne hepatálne zlyhanie – malobunkový karcinóm pľúc – hepatotoxicita – difúzne metastázy
Úvod
Akútne hepatálne zlyhanie (ALF – acute liver failure) je definované ako akútna epizóda pečeňovej dysfunkcie u predtým zdravej pečene. Ide o zriedkavý syndróm charakterizovaný abnormalitami pečeňových krvných testov s rozvojom koagulopatie hepatálnej etiológie, hyperbilirubinémie a hepatálnej encefalopatie. ALF sa často nesprávne používa na opis akútneho zhoršenia pečeňových funkcií u pacientov s chronickým ochorením pečene (tento stav sa nazýva akútne hepatálne zlyhanie pri chronickom ochorení pečene ACLF (acute on chronic liver failure) [1].
Malobunkový karcinóm pľúc (SCLC –small cell lung cancer) predstavuje skupinu biologicky agresívnych tumorov s rýchlym rastom a skorým metastázovaním do uzlín a vzdialených orgánov (najčastejšie do mozgu) [2]. SCLC predstavuje približne 13 – 15 % všetkých pľúcnych tumorov. Zobrazovacie metódy (vrátane CT s kontrastom) dokážu identifikovať väčšinu metastatických lézií v pečeni. Difúzny typ metastáz v pečeni pri SCLS je zriedkavý, môže byť horšie zobraziteľný, čo môže sťažiť diagnostický proces. SCLC je asociovaný s nepriaznivou prognózou a limitovanými možnosťami terapie, zvlášť v prípade pečeňových metastáz [3].
Popis prípadu
Pacientka, 71 rokov, s anamnézou artériovej hypertenzie, ischemickej choroby srdca, chronickej obštrukčnej choroby pľúc GOLD IIB, diabetes mellitus 2. typu na perorálnych antidiabetikách, obezity a abúzom dlhodobého fajčenia bola hospitalizovaná pre niekoľko dňovú dýchavicu pri minimálnej fyzickej záťaži, pobolievanie brucha a celkovú slabosť.
Z osobnej anamnézy bola u pacientky známa steatóza pečene v rámci metabolického syndrómu, dovtedy bez klinických prejavov a bez liečby. Pacientka bola po cholecystektómii v minulosti, bez choledocholitiázy. Vo vstupnom fyzikálnom vyšetrení dominovala palpačná citlivosť v epigastriu, bez hmatnej rezistencie v bruchu, perimaleolárne opuchy dolných končatín bilaterálne, auskultačne bolo dýchanie vezikulárne, s vrzotmi a piskotmi bilaterálne. Predhospitalizačne bola pacientka afebrilná, anikterická, bez prejavov krvácania.
Laboratórne pri prijatí sme zaznamenali mierne zvýšený C-reaktívny proteín (25 mg/l), pri negatívnom prokalcitoníne, miernu hyperbilirubinémiu (bilirubín celkový 37 μmol/l, bilirubín konjugovaný 20 μmol/l) a 2,5-násobky aminotransferáz (aspartátaminotransferáza (AST) 1,41 μkat/l, alaninaminotransferáza (ALT) 1,49 μkat/l) a 3 – 7-násobok cholestatických enzýmov (gama-glutamyltransferáza (GMT) 7,67 μkat/l, alkalická fosfatáza (ALP) 3,50 μkat/l). V krvnom obraze dominovala leukocytóza s neutrofíliou bez anémie a trombocytopénie. Vírusovú hepatitídu, vrodené metabolické ochorenie pečene (Wilsonovu chorobu, hereditárnu hemochromatózu) ani primárnu biliárnu cirhózu či autoimunitnú hepatitídu sme nezistili.
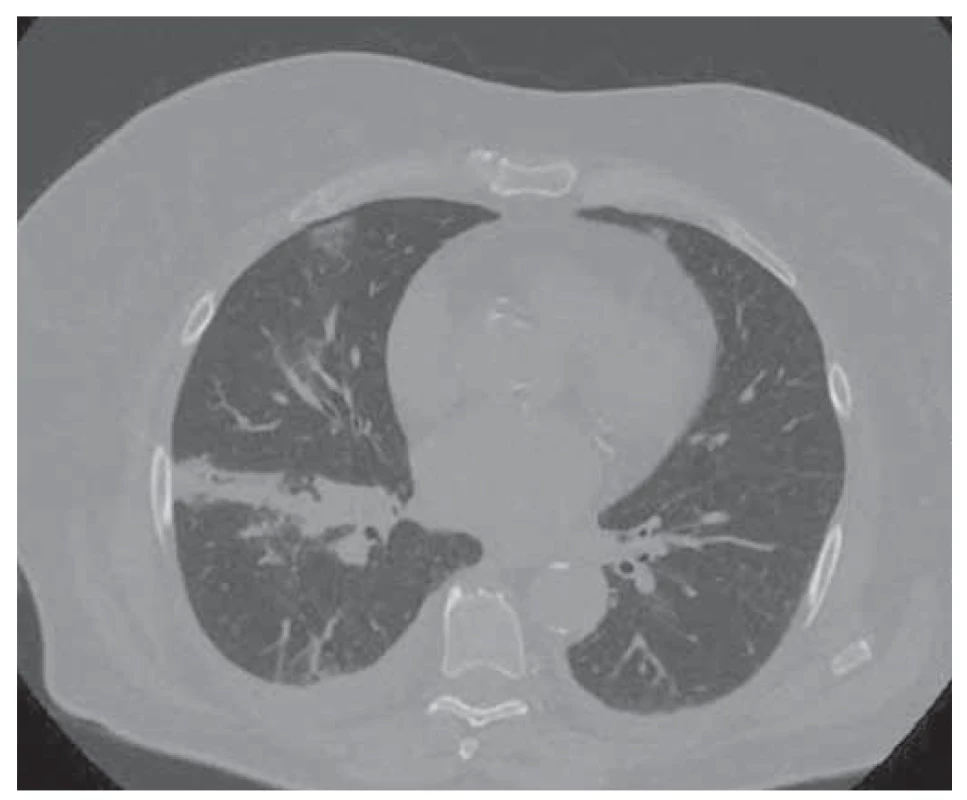
V rámci diferenciálnej diagnostiky dýchavice a zápalového syndrómu sme realizovali rentgenový snímok hrudníka s nálezom pruhovitého zatienenia perihilózne vpravo a tekutinou v interlóbiu (zápalová infiltrácia) (obr. 1). CT pulmoangiografia nezistila embóliu do pľúc, jednoznačne nepotvrdila ani nevylúčila zápal, zobrazila lymfadenopatiu mediastina (obr. 2). Mikrobiologické vyšetrenia (tampón z nosa / tonzíl / moč) boli negatívne.
Fig. 1. Chest X-ray – stripe shading perihilously on the right
with fl uid in the interlobium – infl ammatory infi ltration.
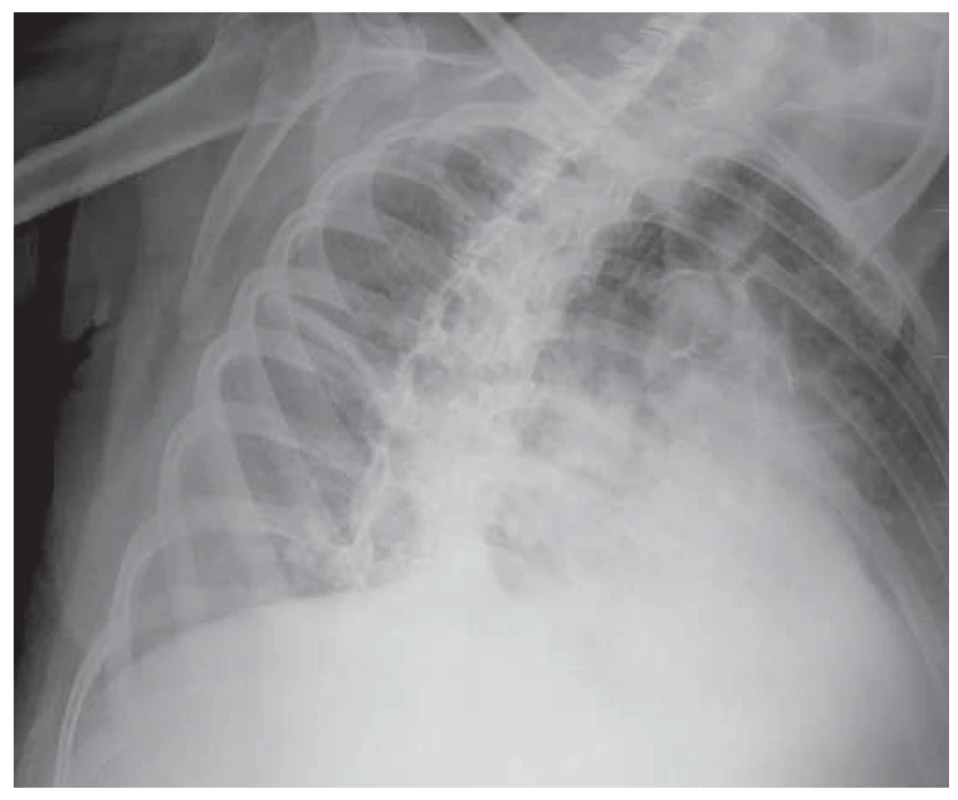
Fig. 2. CT – stripe formation perihilously on the right – dystelectasis,
mediastinal lymphadenopathy.
Empiricky bola započatá liečba dvojkombináciou antibiotík (ceftriaxon/metronidazol), avšak bez očakávaného efektu. Naopak, po 4 dňoch sme zaznamenali vzostup pečeňových enzýmov a s predpokladom hepatotoxicity indukovanej antibiotikami sme ich na 5. deň vysadili. Zahájili sme hepatoprotektívnu liečbu silymarínom v kombinácii s kyselinou ursodeoxycholovou. U pacientky postupne progredovala slabosť, opuchy dolných končatín, bolesti brucha, pridružil sa ikterus kože a sklér. Sérologické vyšetrenie hepatotropných vírusov (HAV, HBV, HCV, HEV, CMV, EBV) bolo negatívne vrátane anti-toxoplazma protilátok, orgánovo-špecifických autoprotilátok a protilátok imunoglobulínu G4.
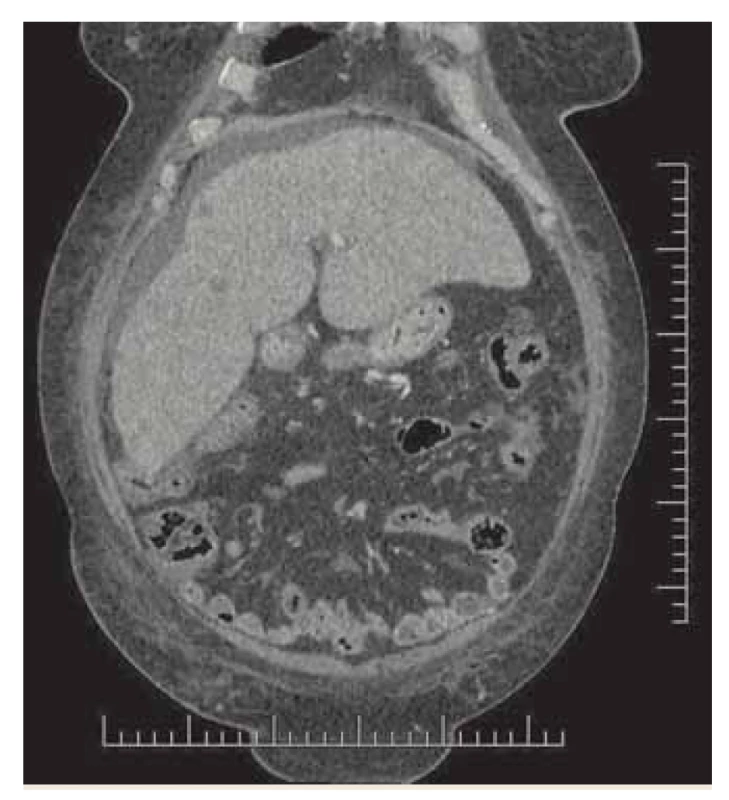
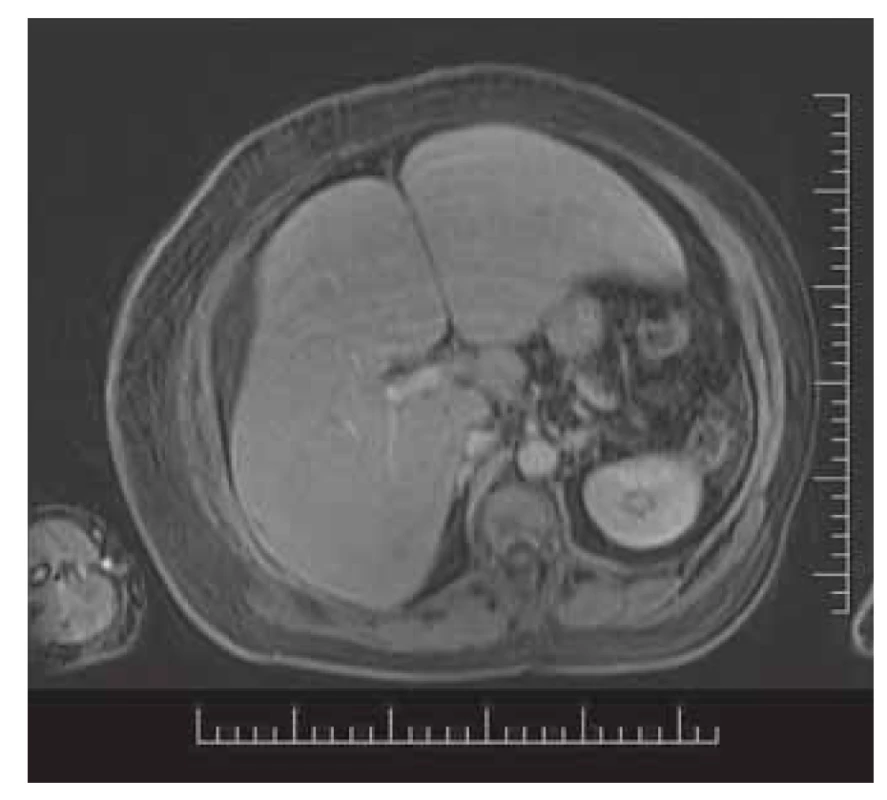
Pri ultrasonografickom (USG) vyšetrení abdomenu sa zobrazil minimálny ascites (nevhodný na punkciu) a mnohopočetné drobné ložiská pečene. CT brucha a malej panvy (obr. 3) potvrdilo viacpočetné neostro ohraničené hypodenzné lézie veľkosti 3 – 24 mm prevažne v pravom laloku pečene s podozrením na metastázy pri negatívnom náleze na pankrease i ďalších orgánoch. Celotelová pozitronová emisná tomografia s výpočtovou tomografiou (PET-CT) nebola výpovedná v zmysle patologického vychytávania glukózy, svedčiaceho pre metastázy, či primárnu neopláziu heparu alebo iných orgánov.
Fig. 3. CT – coronary multiplanar reconstruction,
venous phase, hypodense lesions
in the right lobe, ascites.
V ďalšom priebehu sme u pacientky zaznamenali niekoľkonásobné zvýšenie onkomarkerov (CA 19-9 : 18 215 IU/ml; CA 125 : 378 IU/ml; Ca 15,3 : 220 IU/ml; CEA: 28 ng/ml; Cyfra 21-1 : 10,44 ng/ml; NSE: 213; AFP v norme), opätovnú leukocytózu s neutrofíliou, vzostup bilirubínu (bilirubín celkový 167 μmol/l, bilirubín konjugovaný 93 μmol/l) a objavenie hyperamonémie (112 μmol/l) s prejavmi klinicky manifestnej hepatálnej encefalopatie II. – III. stupňa. Aj pri pokračovaní symptomatickej liečby vrátane rifaximínu a esenciálnych aminokyselín, hepatálne, najmä cholestatické enzýmy vykazovali trvalý vzostup s maximálnymi hodnotami (AST 2,7 μkat/l, ALT 1,5 μkat/l, GMT 34,2 μkat/l, ALP 9,7 μkat/l).
Pre nevýpovednosť PET-CT vyšetrenia sme doplnili kontrastnú USG brucha (obr. 4) a magnetickú rezonančnú cholangiopankreatikografiu (MRCP) (obr. 5). Uvedené vyšetrenia popísali hepatomegáliu s viacpočetnými ložiskami takmer vo všetkých segmentoch pečene, ktoré nemali charakter cýst ani hemangiómov, bez bližšej špecifikácie. Pre objavenie ascitu a prehlbujúci sa hypokoagulačný stav bola biopsia pečene kontraindikovaná, transjugulárny prístup sme nemali k dispozícii. Od plánovanej koloskopie, v snahe pátrania po origu suspektnej neoplázie, sme pre progresiu celkového stavu ustúpili. Uvažovali sme o možnej hepatotoxicite indukovanej ceftriaxonom, alebo nejasnej generalizovanej neoplázii.
Fig. 4. Contrast-enhanced ultrasonography – the view of the right lobe from an intercostal approach, two lesions with
washout in the venous phase.
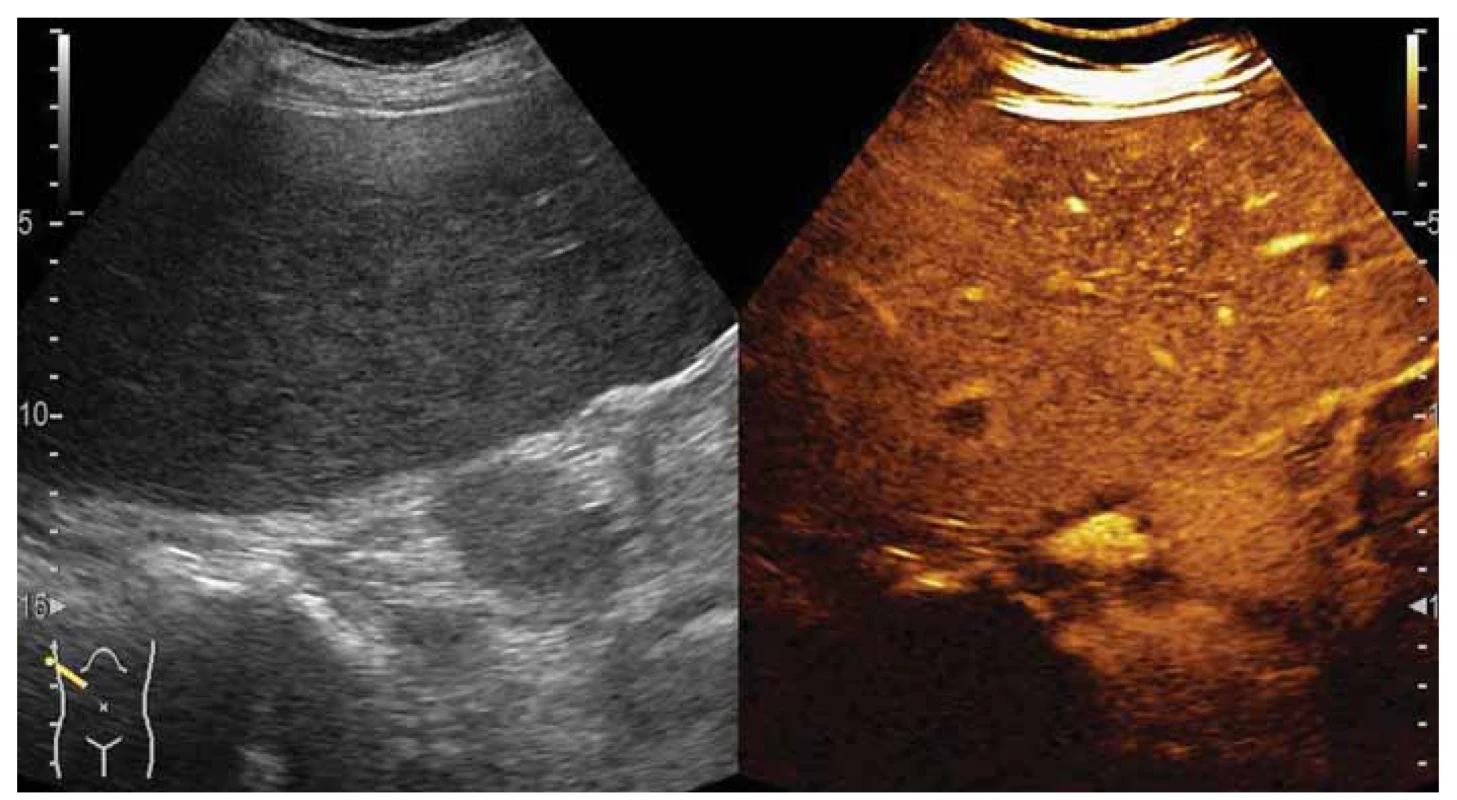
Fig. 5. T1-weighted image, venous
phase, several lesions with washout in
both lobes, ascites.
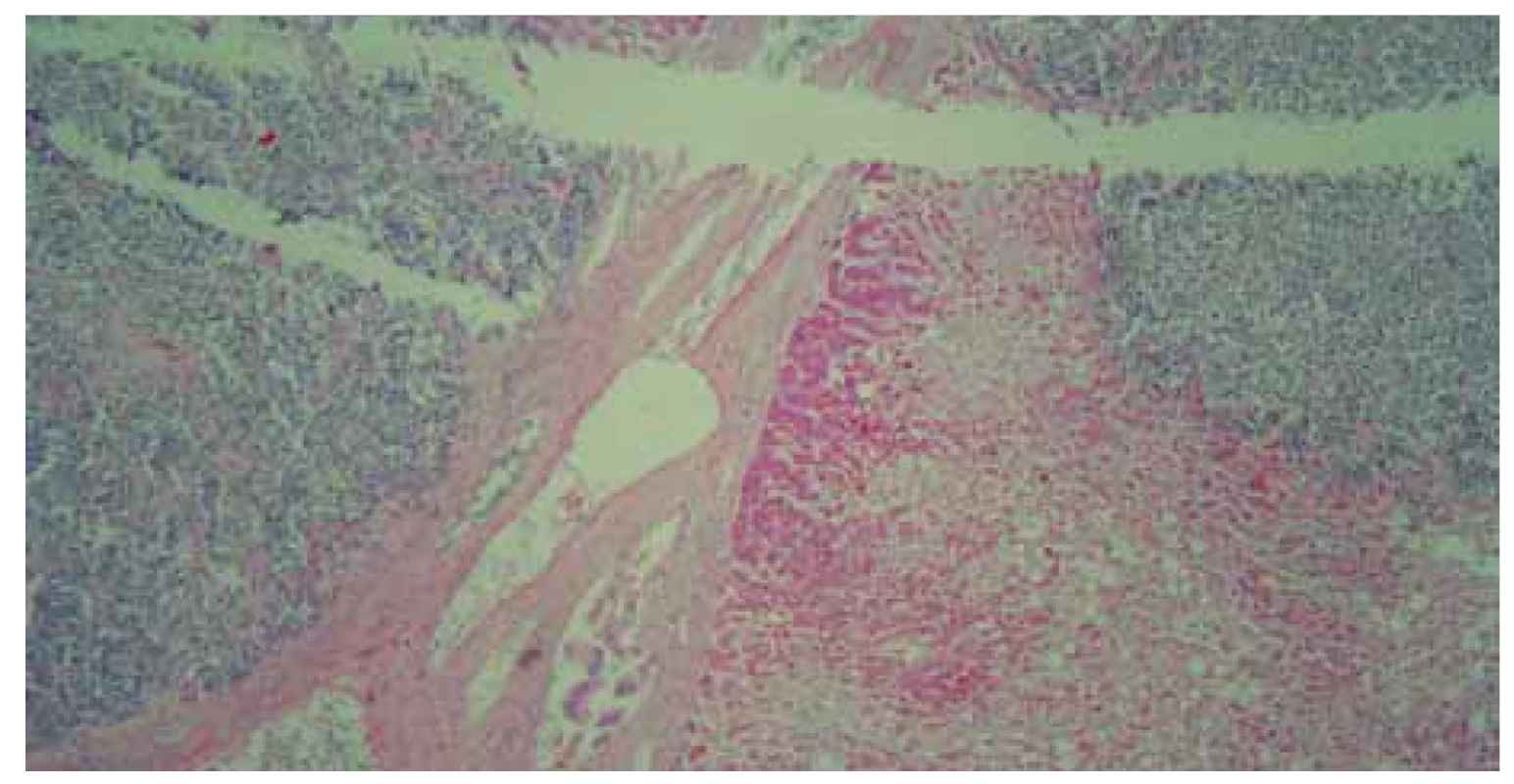
Pacientka zomrela po 17 dňoch hospitalizácie so známkami akútneho zlyhania pečene. Histologické vyšetrenie post mortem preukázalo metastázy malobunkového karcinómu pľúc v pečeni (obr. 6 – 9). Nález primárneho tumoru pľúc sa nezobrazil pri RTG ani CT vyšetrení, dokonca ani počas patologicko-anatomickej sekcie sa origo v pľúcach nenašlo.
Fig. 6. Macroscopic view of the liver at autopsy.

Fig. 7. Histology – liver parenchyma infi ltrated by small cell tumour proliferation,
hematoxylin eosin staining, magnifi cation 40×.
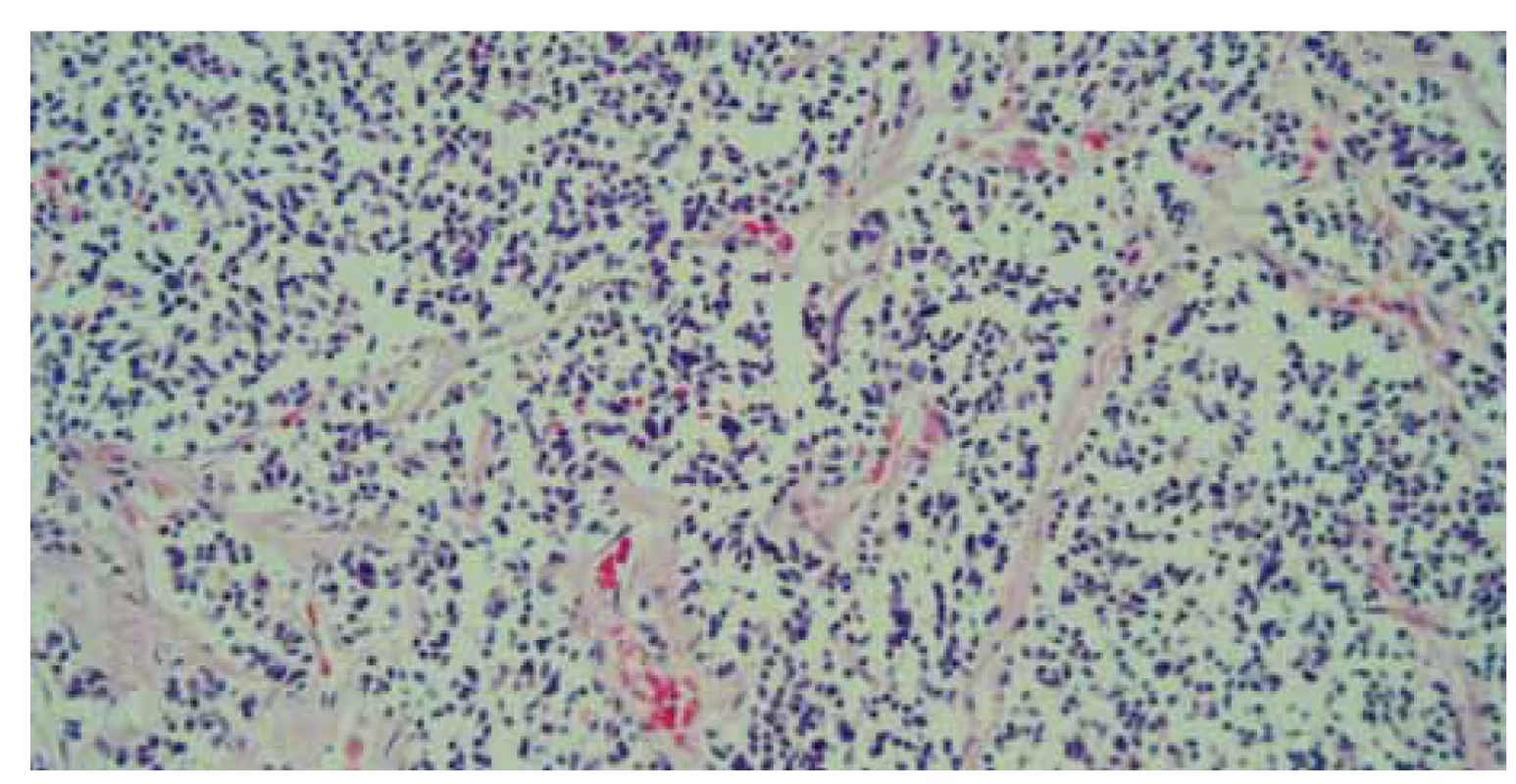
Fig. 8. A more detailed view of small cell tumour proliferation, hematoxylin eosin
staining, magnifi cation 200×.
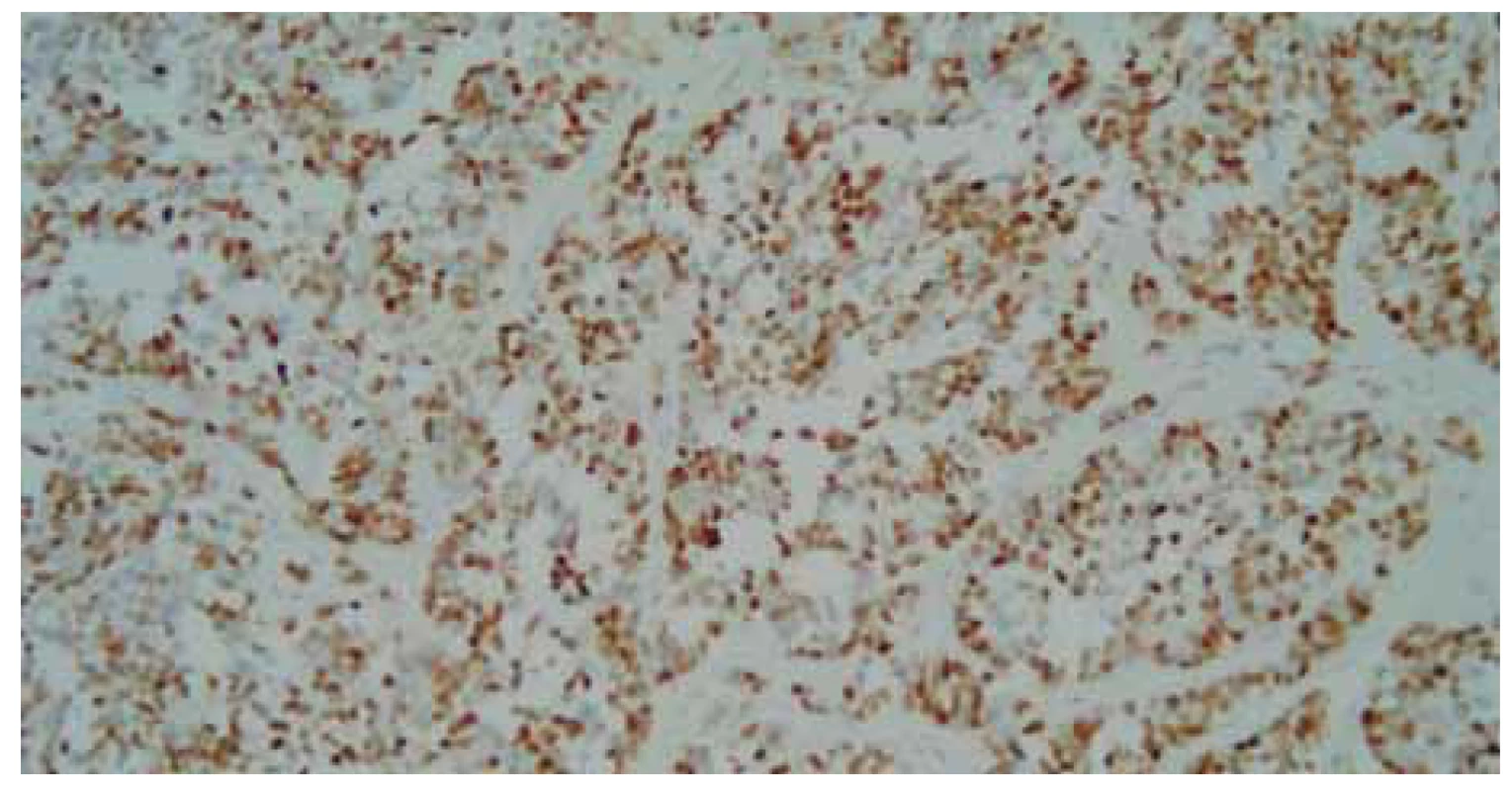
Fig. 9. Immunohistochemical staining of TTF-1, positivity in tumour cells suggesting
pulmonary origo.
Diskusia
Zo všetkých pľúcnych tumorov predstavuje SCLC asi 13 – 15 %. SCLC je vysoko invazívny tumor s vysokou možnosťou metastáz do pečene. Napriek tomu je však akútne zlyhanie pečene v prípade metastáz extrémne zriedkavé. Vo väčšine prípadov je prognóza pacientov so SCLC veľmi nepriaznivá z dôvodu neskorého stanovenia diagnózy [4]. Pri difúznom poškodení pečene v rámci SCLC je náročné určiť diagnózu neinvazívnou cestou a často sa stanoví až post mortem [5–13].
V mnohých, doteraz opísaných prípadoch, boli klinické príznaky z poškodenia pečene jediné a dominujúce, vo väčšine bez akýchkoľvek pľúcnych prejavov. Pri podozrení na pečeňové metastázy pri zlyhávaní pečene v rámci diagnostiky využívame dostupné zobrazovacie metódy vrátane MRCP a PET-CT, avšak v prezentovanom prípade tieto nepreukázali jednoznačný onkologický proces u pacientky. RTG, CT ani PET-CT vyšetrenie pľúc taktiež onkologický proces v pľúcach neodhalili. CT-pulmoangiografia nezistila embolizáciu do pľúc, nie je však metódou na pátranie po ložiskových zmenách v pľúcach. Ani PET-CT neidentifikovalo zvýšený obrat glukózy v mieste origa a sekundarizmov. Na zamyslenie stojí prínos CT s vysokým priestorovým rozlíšením pľúc, ktoré mohlo posunúť diagnostický proces k správnemu určeniu diagnózy.
Hepatotoxicita indukovaná ceftriaxonom nie je zriedkavá, zvlášť na pracoviskách, kde je tento často používaný (napr. neurochirurgia). Liekovou hepatotoxicitou sú všeobecne častejšie postihnuté osoby s nadváhou, obezitou a preexistujúcou nealkoholovou tukovou chorobou pečene, ako bola i naša pacientka. Vzostup hepatálnych enzýmov bol razantnejší po začatí antibiotickej liečby, čo nás viedlo k úvahe o hepatotoxicite. Po vysadení liečby sme však nezaznamenali očakávaný pokles enzýmov a klinické zlepšenie. Napriek úvahe o malígnej povahe ložísk pri primárnej neoplázii sa nám origo nepodarilo identifikovať.
Raritne, asi v 2–4 % prípadov, sa malobunkový karcinóm vyskytuje ako primárny tumor pečene, či iných orgánov a tkanív, ako napríklad: slinné žľazy, štítna žľaza, hrtan, trachea, pohrudnica, pažerák, týmus, žalúdok, črevá, pankreas, močový mechúr, cervix, maternica, prostata, koža, hlava a krk [14–16].
Domnievame sa, že i keď by sa nám podarilo objasniť intravitálne príčinu hepatálnej insuficiencie včas indikovanou cielenou hepatálnou biopsiou, v danom štádiu a rozsahu choroby by sme ochorenie nedokázali zvrátiť.
Akútne hepatálne zlyhanie podľa odporúčaní Európskej spoločnosti pre výskum pečene (EASL – European Association for the Study of the Liver) môžeme rozdeliť na primárne a sekundárne (tab. 1) [1]. Kým pri primárnom je potrebné zvážiť urgentnú transplantáciu pečene, pri sekundárnom táto úvaha odpadá. Terminologicky správne išlo o chronickú chorobu pečene (nealkoholová steatóza s difúznymi metastázami) s fenotypom akútneho hepatálneho zlyhania. Hlavnými prejavmi sú ikterus, koagulopatia a hepatálna encefalopatia do 12 týždňov od vzniku ikteru. Podľa dynamiky prejavov rozlišujeme hyperakútne (do 1 týždňa), akútne (do 4 týždňov) a subakútne hepatálne zlyhanie (do 12 týždňov). Zo sekundárnych neoplázií sú najčastejšou príčinou akútnej hepatálnej infiltrácie lymfómy. I keď SCLC je raritne príčinou akútneho hepatálneho zlyhania, vysoký invazívny potenciál SCLC umožňuje i takúto manifestáciu. Kazuistika pripomína potrebu myslieť na túto možnosť.
Tab. 1. Primary and secondary causes of acute liver failure and need for
transplantation [1].
![Primárne a sekundárne príčiny akútneho hepatálneho zlyhania
a potreba transplantácie [1]<br>
Tab. 1. Primary and secondary causes of acute liver failure and need for
transplantation [1].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image_pdf/2329145f94b83cf89c46ece8628d5e57.png)
Záver
Prípad opisuje raritné akútne zlyhanie pečene sekundárnej etiológie na podklade iniciálne metastatického SCLC. Náročná vizualizácia zobrazovacími modalitami, agresivita tumoru a zriedkavosť pľúcnych príznakov prispievajú k neskorému stanoveniu diagnózy, v mnohých prípadoch až po smrti. Pri podozrení na difúzny metastatický proces bez nálezu primárneho origa hrá včasná biopsia pečene významnú úlohu. Otázny je však efekt terapie aj v prípade úspechu identifikácie SCLC v takomto pokročilom štádiu ochorenia.
Doručené/Submitted: 14. 3. 2020
Prijaté/Accepted: 29. 3. 2020
MUDr. Xénia Faktorová
III. interná klinika LF UK a UN Bratislava
Limbova 5
833 05 Bratislava
Slovenská republika
Konflikt záujmov: Autori deklarujú, že text článku zodpovedá etickým štandardom, bola dodržaná anonymita pacientov, a vyhlasujú, že v súvislosti s predmetom článku
nemajú finančné, poradenské ani iné komerčné záujmy.
Publikačná etika: Príspevok nebol doteraz publikovaný ani nie je v súčasnosti zaslaný do iného časopisu na posúdenie. Autori súhlasia s uverejnením svojho mena a e-mailového
kontaktu v publikovanom texte.
Dedikácia: Článok nie je podporený grantom ani nevznikol za podpory žiadnej spoločnosti.
Redakčná rada potvrdzuje, že rukopis práce splnil ICMJE kritériá pre publikácie zasielané do bio medicínskych časopisov.
Conflict of Interest: The authors declare that the article/ manuscript complies with ethical standards, patient anonymity has been respected, and they state that they have no
financial, advisory or other commercial interests in relation to the subject matter.
Publication Ethics: This article/ manuscript has not been published or is currently being submitted for another review. The authors agree to publish their name and e-mail in
the published article/ manuscript.
Dedication: The article/ manuscript is not supported by a grant nor has it been created with the support of any company.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for bio medical papers.
Sources
1. European Association for the Study of the Liver, Clinical practice guidelines panel, Wendon J et al. EASL Clinical Practical Guidelines on the management of acute (fulminant) liver failure. J Hepatol 2017; 66 (5): 1047–1081. doi: 10.1016/j.jhep.2016.12.003.
2. Kohútek F, Bystrický B, Tamášová M. Liečba iniciálne metastatického malobunkového karcinómu pľúc. Onkológia (Bratislava) 2013; 8 (5): 303–306.
3. Mishima S, Nozaki Y, Mikami S et al. Diffuse liver metastatis of small-cell lung cancer presenting as acute liver failure and diagnosed by transjugular liver biopsy: a rare case in whom nodular lesions were detected by enhanced CT examination. Case Rep Gastroenterol 2015; 9 (1): 81–87. doi: 10.1159/000381 140.
4. Guerriero M, Carbone A, Colusurdo F et al. Sudden onset acute liver failure in a patient with clinically occult small cell lung carcinoma: autopsy report and review of the medical literature. Autops Case Rep 2019; 9 (2): e2019089. doi: 10.4322/acr.2019.089.
5. Elliott JA, Osterlind K, Hirsch FR et al. Metastatic patterns in small-cell lung cancer: correlation of autopsy findings with clinical parameters in 537 patients. J Clin Oncol 1987; 5 (2): 246–254. doi: 10.1200/JCO.1987.5.2.246.
6. Ihara N, Yashiro N, Kinoshita T et al. Diffuse intrasinusoidal liver metastasis of small cell lung cancer causing fulminant hepatic failure: CT findings – a case report. Radiat Med 2001; 19 (5): 275–277.
7. Sato K, Takeyama Y, Tanaka T et al. Fulminant hepatic failure and hepatomegaly caused by diffuse liver metastasis from small cell lung carcinoma: 2 autopsy cases. Respir Investig 2013; 51 (2): 98–102. doi: 10.1016/j.resinv.2012.12.004.
8. Athanasakis E, Mouloudi E, Prinianakis G et al. Metastatic liver disease and fulminant hepatic failure: presentation of a case and review of the literature. Eur J Gastroenterol Hepatol 2003; 15 (11): 1235 – –1240. doi: 10.1097/00042737-200311000-00014.
9. Krauss EA, Ludwig PW, Sumner HW. Metastatic carcinoma presenting as fulminant hepatic failure. Am J Gastroenterol 1979; 72 (6): 651–654.
10. McGuire BM, Cherwitz DL, Rabe KM et al. Small-cell carcinoma of the lung manifesting as acute hepatic failure. Mayo Clin Proc 1997; 72 (2): 133–139. doi: 10.4065/72.2.133.
11. Kaira K, Takise A, Watanabe R et al. Fulminant hepatic failure resulting from small-cell lung cancer and dramatic response of chemotherapy. World J Gastroenterol 2006; 12 (15): 2466–2468. doi: 10.3748/wjg.v12.i15.2466.
12. Gilbert J, Rutledge H, Koch A. Diffuse malignant infiltration of the liver manifesting as a case of acute liver failure. Nat Clin Pract Gastroenterol Hepatol 2008; 5 (7): 405–408. doi: 10.1038/ncpgasthep1154.
13. Vaideeswar P, Munot S, Rojekar A et al. Hepatic diffuse intra-sinusoidal metastases of pulmonary small-cell carcinoma. J Postgrad Med 2012; 58 (3): 230–231. doi: 10.4103/0022-3859.101654.
14. Lo AA, Lo EC, Li H et al. Unique morphologic and clinical features of liver predominant/primary small cell carcinoma – autopsy and biopsy case series. Ann Diagn Pathol 2014; 18 (3): 151–156. doi: 10.1016/j.anndiagpath.2014.02.007.
15. Kaman L, Iqbal J, Pallet M et al. Primary small cell carcinoma of liver: a rare tumor. Gastroenterology Res 2010; 3 (4): 180–184. doi: 10.4021/gr2010.06.215w.
16. Jo JM, Cho YK, Hyun CL et al. Small cell carcinoma of the liver and biliary tract without jaundice. World J Gastroenterol 2013; 19 (44): 8146–8150. doi: 10.3748/wjg.v19.i44.8146.
Labels
Paediatric gastroenterology Gastroenterology and hepatology SurgeryArticle was published in
Gastroenterology and Hepatology

- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Metamizole vs. Tramadol in Postoperative Analgesia
- Spasmolytic Effect of Metamizole
- The Importance of Limosilactobacillus reuteri in Administration to Diabetics with Gingivitis
-
All articles in this issue
- Gastroenterologie v době pandemie covid-19
- Gastrointestinální onkologie
- Kvíz z klinické praxe
- Prediktory pokročilé kolorektální neoplazie ve screeningu kolorektálního karcinomu – průběžné výsledky multicentrické prospektivní studie
- Fenotyp akútneho hepatálneho zlyhania pri inaparentnom malobunkovom karcinóme pľúc
- Prevalencia hypovitaminózy D a poruchy glukózovej tolerancie u pacientov s neuroendokrinnými tumormi podstupujúcich liečbu somatostatínovými analógmi
- Covid-19 a hepatogastroenterologie
- Srdeční selhání u pacientky s cirhotickou kardiomyopatií jako neobvyklá indikace k transplantaci jater
- První použití single-use duodenoskopu v České republice
- Inhibitory protonové pumpy – známe je dobře? Jsou skutečně tak bezpečné? – část 1
- Kreditovaný autodidaktický test: gastrointestinální onkologie
- Prof. MUDr. Jiří Ehrmann, CSc., osmdesátiletý
- Nová členka redakční rady MUDr. Kristýna Zárubová
- Výběr z mezinárodních časopisů
- Budesonid v léčbě idiopatických střevních zánětů
- Primární biliární cholangitida – zacíleno na farnesoidní X receptor
- Správná odpověď na kvíz Endometrióza postihující serózní povrch (okruží) terminálního ilea
- Surveillance hepatocelulárneho karcinómu na Slovensku
- Současné možnosti predikce léčebné odpovědi na neoadjuvantní chemoradioterapii u karcinomu konečníku
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Inhibitory protonové pumpy – známe je dobře? Jsou skutečně tak bezpečné? – část 1
- Budesonid v léčbě idiopatických střevních zánětů
- Nová členka redakční rady MUDr. Kristýna Zárubová
- Prediktory pokročilé kolorektální neoplazie ve screeningu kolorektálního karcinomu – průběžné výsledky multicentrické prospektivní studie
