Neinvazivní metody v posuzování závažnosti portální hypertenze
Portal hypertension represents a wide spectrum of complications of chronic liver diseases and may present by ascites, oesophageal varices, splenomegaly, hypersplenism, hepatorenal and hepatopulmonary syndrome or portopulmonary hypertension. Portal hypertension and its severity predicts the patient‘s prognosis: as an invasive technique, the portosystemic gradient (HPVG – hepatic venous pressure gradient) measurement by hepatic veins catheterisation has remained the gold standard of its assessment. A reliable, non-invasive method to assess the severity of portal hypertension is of paramount importance; the patients with clinically significant portal hypertension have a high risk of variceal bleeding and higher mortality. Recently, non-invasive methods enabling the assessment of liver stiffness have been introduced into clinical practice in hepatology. Not only may these methods substitute for liver biopsy, but they may also be used to assess the degree of liver fibrosis and predict the severity of portal hypertension. Nowadays, we can use the quantitative elastography (transient elastography, point shear-wave elastrography, 2D-shear-wave elastography) or magnetic resonance imaging. We may also assess the severity of portal hypertension based on the non-invasive markers of liver fibrosis (i.e. ELF test) or estimate clinically significant portal hypertension using composite scores (LSPS – liver spleen stiffness score), based on liver stiffness value, spleen diameter and platelet count. Spleen stiffness measurement is a new method that needs further prospective studies. The review describes current possibilities of the non-invasive assessment of portal hypertension and its severity.
Conflict of Interest: The authors declare that the article/ manuscript complies with ethical standards, patient anonymity has been respected, and they state that they have no financial, advisory or other commercial interests in relation to the subject matter.
Publication Ethics: This article/ manuscript has not been published or is currently being submitted for another review. The authors agree to publish their name and e-mail in
the published article/ manuscript.
Dedication: This work was supported by the program project of the Ministry of Health of the Czech Republic with Reg. No. 16-274546A. All rights under intellectual property
regulations are reserved.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for bio medical papers.
Keywords:
HVPG – liver stiff ness – shear-wave elastography – transient elastography – portal hypertension – blood bio markers
Authors:
Fraňková S.; Šperl J.
Authors‘ workplace:
Klinika hepatogastroenterologie, IKEM, Praha
Published in:
Gastroent Hepatol 2021; 75(2): 125-133
Category:
doi:
https://doi.org/10.48095/ccgh2021125
Overview
Portální hypertenze představuje spektrum komplikací chronických onemocnění jater a cirhózy a může se manifestovat ascitem, varixy jícnu, splenomegalií, hypersplenizmem, hepatorenálním a hepatopulmonálním syndromem či portopulmonální hypertenzí. Portální hypertenze predikující prognózu pacienta může být různě závažná a zlatým standardem posouzení její tíže zůstává invazivní měření portosystémového gradientu (HVPG) pomocí katetrizace jaterních žil. Spolehlivá diagnostika portální hypertenze je důležitá, neboť pacienti s klinicky významnou portální hypertenzí mají vysoké riziko variceálního krvácení a vyšší mortalitu. V posledních letech nacházejí v klinické hepatologii stále větší uplatnění neinvazivní metody vyšetření tuhosti jater. Mohou nahradit nejen jaterní biopsii a určit stupeň fibrózy, tedy pokročilost jaterního onemocnění, ale je též možno je využít ke stanovení tíže portální hypertenze. V současnosti je možné k posouzení tuhosti jater a predikci portální hypertenze využít metody kvantitativní elastografie (tranzientní elastografie, point shear-wave elastrografie, 2D-shear-wave elastografie) či metody využívající magnetickou rezonanci. Stupeň portální hypertenze lze rovněž stanovit na základě vyšetření neinvazivních markerů jaterní fibrózy (např. ELF test) nebo je možno na klinicky signifikantní portální hypertenzi usuzovat z kompozitních skóre, jako je např. LSPS skóre vycházející z tuhosti jater, průměru sleziny a počtu trombocytů. Měření tuhosti sleziny je metodou novou vyžadující další prospektivní studie. Přehledný článek popisuje současné možnosti neinvazivní diagnostiky portální hypertenze a stanovení její závažnosti.
Klíčová slova:
HVPG – tuhost jater – tuhost sleziny – shear-wave elastografie – tranzientní elastografie – portální hypertenze – krevní biomarkery
Úvod
Chronické onemocnění jater (CLD) vzniká na podkladě poškození hepatocytů z různých příčin. Pokud není onemocnění léčeno, může dospět až do stadia jaterní cirhózy. CLD a komplikace s ním spojené jsou významnou příčinou morbidity i mortality, v USA je onemocnění jater na osmém místě v příčině úmrtí [1,2]. Nejčastějšími příčinami CLD jsou alkoholická choroba jater, virové hepatitidy B a C, cholestatická onemocnění jater (primární biliární cholangitida a primární sklerozující cholangitida) a nealkoholová tuková choroba jater/ nealkoholická steatohepatitida (NAFLD/ NASH). Počet pacientů s CLD se navíc bude zvyšovat kvůli vzrůstající prevalenci osob s NASH v populaci [3], zatímco počet pacientů s HBV a HCV klesá díky vakcinaci a účinné protivirové léčbě [4–7].
Patogeneze CLD je variabilní, onemocnění může progredovat zvolna až do stadia jaterní cirhózy a z ní vyplývajících závažných komplikací, jako jsou chronické jaterní selhání, hepatocelulární karcinom (HCC) a portální hypertenze (PH). PH je hlavní komplikací jaterní cirhózy vedoucí k život ohrožujícím komplikacím tohoto onemocnění. V patofyziologii vzniku PH se uplatňuje narušení architektoniky jaterní tkáně způsobené progredující fibrózou, mikrovaskulární trombózy, dysfunkce jaterních endoteliálních sinusoidálních buněk spolu s aktivací buněk hvězdicových, což v konečném důsledku vede ke zvýšení vaskulární rezistence na sinusoidální úrovni a vzniku PH [8]. Zvýšená vaskulární rezistence v játrech vede dále ke splanchnické a systémové arteriální vazodilataci, hyperkinetické cirkulaci a rozvoji portosystémových kolaterál (obr. 1). Tyto adaptivní změny mohou vést k dalšímu zvýšení portálního tlaku [9].
Fig. 1. Portal bed and visible portosystemic collaterals in a patient with liver cirrhosis
during the introduction of a transjugular intrahepatic portosystemic shunt
(TIPS). Kindly lent by Prof. Jan H. Peregrin, MD, PhD, IKEM.
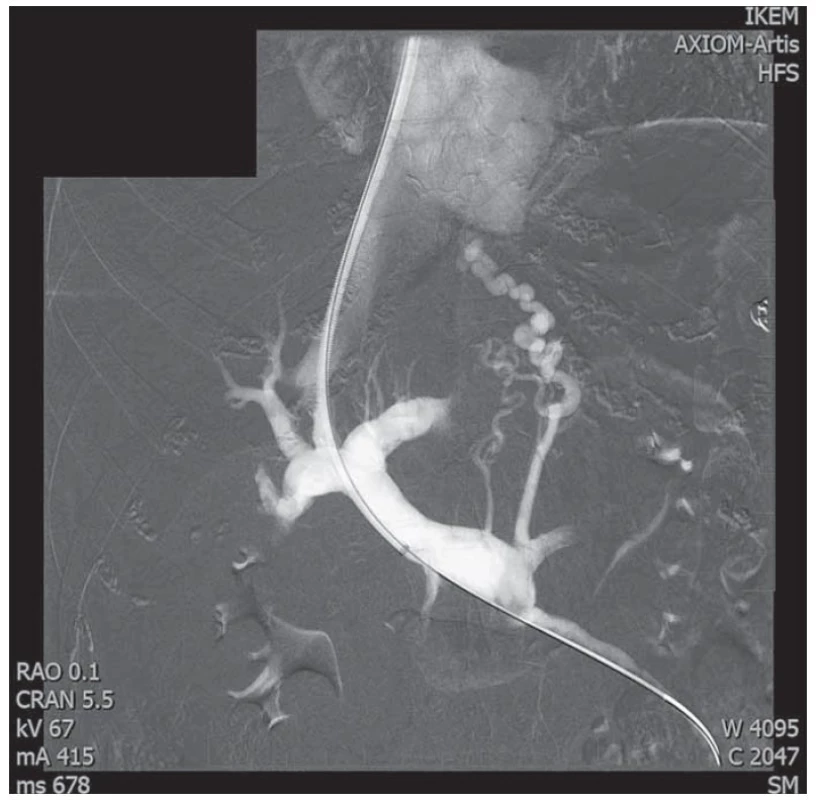
Portosystémový tlakový gradient (HVPG – hepatic venous pressure gradient), tj. rozdíl mezi tlakem ve volné jaterní žíle a v zaklínění jaterní žíly, představuje v klinické hepatologii zlatý standard posouzení přítomnosti a závažnosti PH u pacientů s jaterní cirhózou a je stále, dle Baveno VI guidelines, považován za referenční vyšetření ke stanovení diagnózy PH [10]. HVPG je rovněž nejlépe validovanou metodu k posouzení rizika závažných komplikací jaterní cirhózy a PH [11].
Portosystémový tlakový gradient (HVPG) > 5 mmHg potvrzuje PH, HVPG > 10 mmHg je pak již považován za klinicky významnou portální hypertenzi (CSPH) [12]. Pacienti s CSPH mají riziko vzniku varixů jícnu, vyvinou ascites a může u nich dojít k dekompenzaci cirhózy [13–16]. HVPG > 12 mmHg je spojen s rizikem krvácení z varixů jícnu, při HVPG > 16 mmHg mají pacienti vyšší mortalitu a hodnota > 20 mmHg predikuje riziko selhání endoskopického ošetření při krvácení z varixů jícnu (tab. 1) [17,18].
Tab. 1. Prognostic significance of HVPG [19].
![Prognostický význam HVPG [19].<br>
Tab. 1. Prognostic significance of HVPG [19].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image_pdf/9d884a6195b8c88b2a2e5a8b0743c226.jpeg)
Měření HVPG pomocí katetrizace jaterních žil je metoda invazivní, proto je snaha o nalezení jednoduché a přesné neinvazivní metody, která by měření HVPG nahradila. Z tohoto důvodu bylo v posledních deseti letech velice podrobně studováno měření tuhosti jater (LS) jakožto spolehlivé a zároveň neinvazivní metody schopné určit pokročilost jaterního onemocnění. Úsilí bylo zaměřeno zejména na neinvazivní predikci hodnot HVPG ≥ 10 mmHg, tedy k predikci CSPH, a existuje dosud pouze omezené množství studií zaměřených na predikci HVPG v hodnotách > 10 mmHg, které pomohou určit riziko život ohrožujících komplikací. V některých studiích tento přístup selhal při hodnotách HVPG > 10 mmHg [19], naopak další autoři prokázali dobrou korelaci mezi LS a HVPG i pro vysoké hodnoty HVPG [20]. Cílem tohoto přehledu je definovat současné místo neinvazivních vyšetřovacích metod v posuzování závažnosti PH.
Měření tuhosti jater jako neinvazivní prediktor HVPG
Hodnota tuhosti jater (LS) může být stanovena pomocí elastografických technik, které mohou neinvazivně posoudit stadium jaterní fibrózy. Měření LS (LSM) se rozšířilo v klinické hepatologii v posledních 20 letech a téměř kompletně nahradilo provádění jaterní biopsie za účelem stanovení stadia jaterního onemocnění, zejména v diagnostice virových hepatitid [21]. Krom stanovení stadia jaterní fibrózy nabízí LSM také možnost neinvazivního posouzení stupně PH. Patologické změny při onemocnění jater, zejména zvýšená depozice kolagenu, vedou ke zvýšení LS a k progresi jaterní choroby. Rozsáhlé klinické zkušenosti prokázaly, že LS představuje jedinečný parametr, který odráží morfologické (fibróza jater) a cirkulační změny, které jsou spojeny s progresí chronického jaterního onemocnění. Je zřejmé, že hodnota LS je složena ze dvou komponent: statické (fibróza) a dynamické (PH). Jaterní fibróza je obecně akceptována jako určující faktor progrese jaterní dysfunkce a PH; dvě studie provedené na lidech prokázaly, že korelace mezi obsahem kolagenu v játrech (CPA – collagen proportionate area) a portální hypertenzí (HVPG) je slabší než korelace LS a HVPG [22,23]. Proto se zdá pravděpodobné, že u pacientů s jaterní cirhózou je hlavní komponentou LS portální hypertenze, nikoli obsah kolagenu v játrech [24–26]. Změny LS provázející cirhózu a PH mohou být kvantifikovány na základě neinvazivních metod.
Elastografie
Metoda kvantitativní elastografie je založena na propagaci střižné vlny vybranou oblastí jaterního parenchymu [27]. Záznam pulzního ultrazvuku je poté použit k měření propagace střižné vlny a k měření rychlosti jejího šíření – čím je tuhost jater vyšší, tím rychleji se vlna jaterním parenchymem šíří.
Tranzientní elastografie
Tranzientní elastografie (TE) pomocí přístroje Fibroscan®, Echosens, Francie, byla prvním komerčním systémem k měření LS, který vstoupil do klinické praxe v roce 2003, a je v současnosti nejčastěji užívanou metodou v klinické hepatologii a nejlépe validovaným systémem k vyšetření LS [21,28]. Součástí osy ultrazvukové sondy je mechanický vibrátor. Vibrace o nízké amplitudě a frekvenci (50 Hz) vytvářejí v jaterním parenchymu rázové vlny. Rychlost jejich šíření je pak následně detekována pomocí ultrazvukové sondy. TE měří LS 25 a 35 mm pod povrchem kůže, v závislosti na typu sondy použité sondy (M, resp. XL), v konstantním objemu jaterní tkáně, který odpovídá válečku širokému 1 cm a dlouhému 4 cm. Vyšetření TE je bezbolestné, rychlé (trvá < 5 min) a je jednoduše proveditelné v ambulantním provozu. V případě potřeby je možné vyšetření opakovat v pravidelných časových intervalech k posouzení progrese jaterního onemocnění.
K vyloučení větších cév a žlučovodů se zacílení provádí pomocí ultrazvukového 1D obrazu. Stisknutím tlačítka na sondě provedeme měření, kterých je třeba provést nejméně deset. Výsledek je vyjádřen v kilopascalech (kPa) a odpovídá mediánu z deseti validních měření. LS může nabývat hodnot od 2,5 do 75 kPa. Validita výsledku TE závisí na dvou základních parametrech:
- poměru interkvartilního rozpětí ku mediánu (IQR/ M), který vypovídá o variabilitě získaných výsledků a neměl by přesáhnout 30 %;
- na dosažené úspěšnosti měření.
Poměr úspěšných měření by měl být alespoň šest z deseti (obr. 2).
Fig. 2. TE result sheet. LS 10.5 Pa corresponds to severe liver fibrosis in HCV infection.
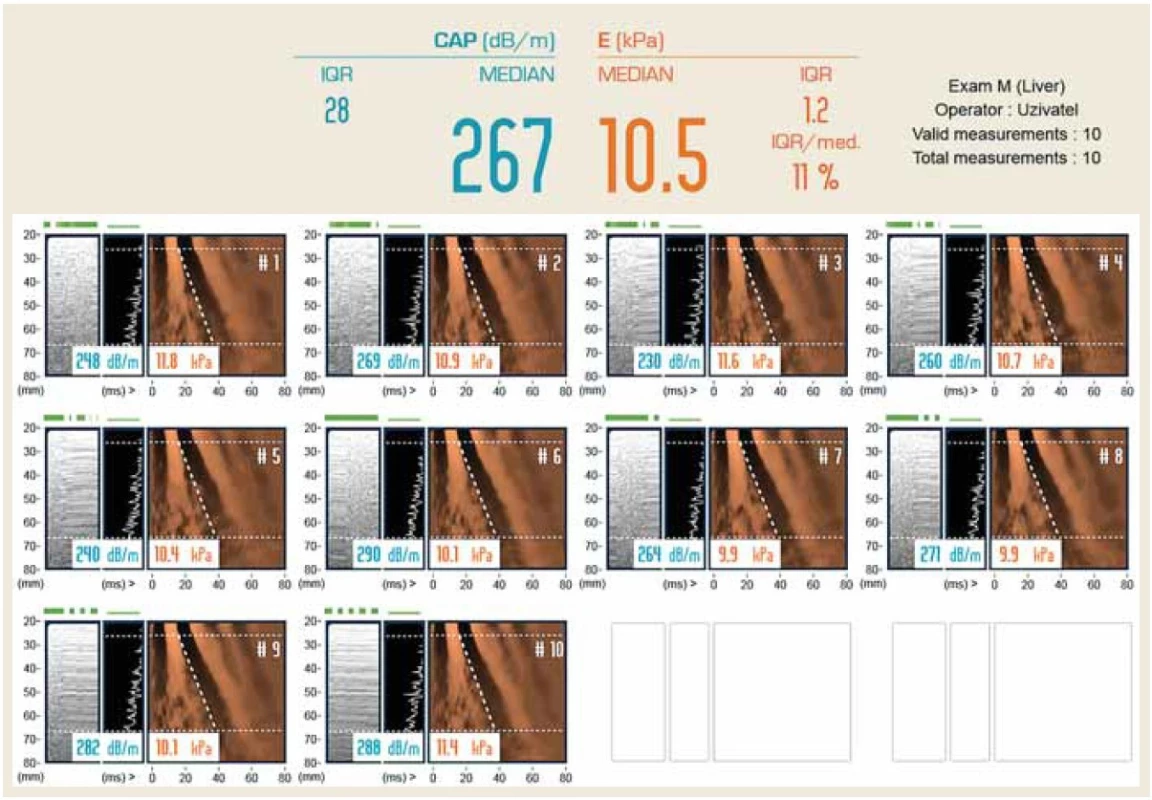
I když je výhodou Fibroscanu® krátký čas vyšetření a možnost provádět jej u lůžka pacienta či v ambulantní péči, je téměř nemožné získat spolehlivé hodnoty u pacientů s ascitem. Vrstva tekutiny představuje překážku pro mechanickou vibraci šířící se břišní stěnou do jater. LS může být rovněž nadhodnocena u pacientů s cholestázou, významnou zánětlivou aktivitou jaterní léze, městnavým srdečním selháním a je rovněž ovlivněna příjmem potravy krátce před vyšetřením. U obézních pacientů je třeba použít XL sondu [21,28].
Tranzientní elastografie (TE) má excelentní diagnostickou přesnost v diagnóze cirhózy, jak bylo prokázáno v několika metaanalýzách, s hodnotami AUROC křivek > 0,9 [29–34]. TE je vhodnější k vyloučení než k potvrzení cirhózy, s negativní prediktivní hodnotou > 90 % v těchto metaanalýzách. TE má rovněž excelentní výpovědní hodnotu v predikci CSPH, ve dvou metaanalýzách s hodnotami AUROC ≥ 0,9 [35,36].
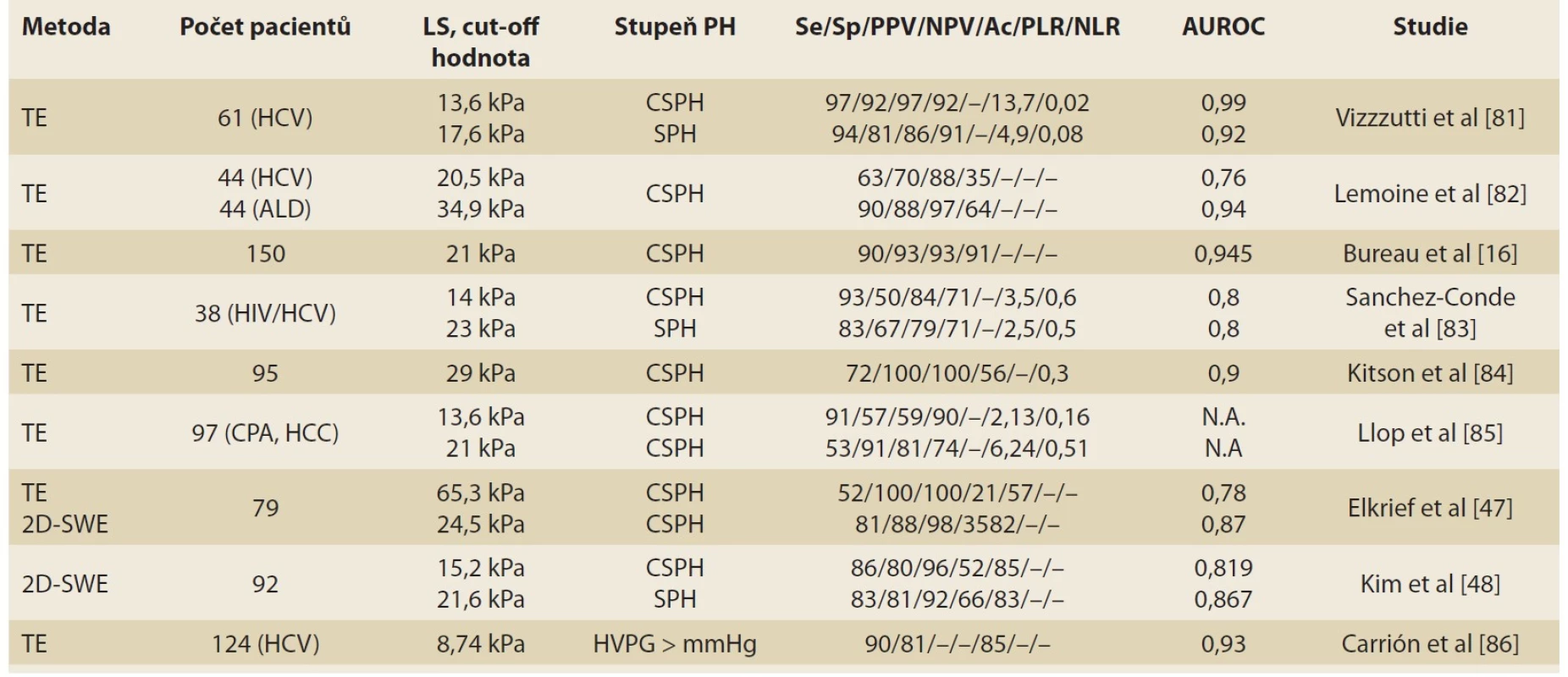
Měření LS pomocí TE prokázalo dobrou prediktivní hodnotu pro HVPG ≥ 10 mmHg pro přítomnost varixů jícnu. Počet trombocytů a průměr sleziny byly identifikovány jako parametry, které dále zlepšují přesnost predikce. Počet trombocytů byl zahrnut i do doporučení Baveno VI: gastroskopii k posouzení varixů jícnu není třeba provádět u pacientů s kompenzovanou jaterní cirhózou a LS < 20 kPa, pokud počet trombocytů je >150 × 109/ l. Naopak pacienti s LS ≥ 20–25 kPa jsou v riziku CSPH a měla by jim být provedena screeningová gastroskopie k vyloučení varixů jícnu [10,37,38]. Přehled studií s použitím TE v predikci CSPH je uveden v tab. 2.
Ultrazvuková kvantitativní elastografie
Ultrazvuková kvantitativní elastografie byla v nedávné době zavzata jako standardní nástroj do většiny sonografických přístrojů a díky tomu se rychle rozšířila v běžné klinické praxi. Střižná vlna v ultrazvukových systémech je generována pomocí akustického radiačního silového impulzu. Technika přináší rovněž výhodu zobrazení v reálném čase, sondou je možno zaměřit cíleně určitou vybranou oblast jater. Je k dispozici ve dvou variantách:
- bodová (point) shear-wave elastografie (pSWE);
- dvojrozměrná shear wave elastografie (2D-SWE).
Obě techniky umožňují LSM i u pacientů s pokročilou jaterní cirhózou, kteří mají ascites. Navíc tyto metody vykazují skvělou diagnostickou přesnost v predikci CSPH a přítomnosti varixů jícnu [39–42].
Acoustic radiation force impulse (ARFI) nebo point shear wave elastografie (p-SWE) jsou po TE druhým nejdéle používaným systémem LSM. Rázová vlna je generována krátkodobým impulzem v trvání 100–262 μs. V sonografickém B-módu je možné volit cílovou vyšetřovanou oblast (region of interest). Výsledkem je údaj o rychlosti šíření střižné vlny v metrech za sekundu (rozmezí 0,5–4,4 m/ s). ARFI detekuje s vysokou přesností cirhózu (AUROC 0,81–0,89) [21], studie dokládají i možnost predikace CSPH, včetně přítomnosti rizikových jícnových varixů [39,43].
Později byla zavedena do klinické praxe dvojrozměrná shear-wave elastogrfie (2D-SWE) [19,44], jenž umožňuje měření LS a v současnosti i měření tuhosti sleziny (SS), a to včetně pacientů s ascitem. Na rozdíl od předchozích systémů indukuje metoda kontinuální příčné vlnění a zobrazuje elastogram v reálném čase (obr. 3).
Fig. 3. LS measurement using 2D-SWE with focus on region of interest and Q box.
Kindly lent by Renáta Šenkeříková, MD, IKEM.
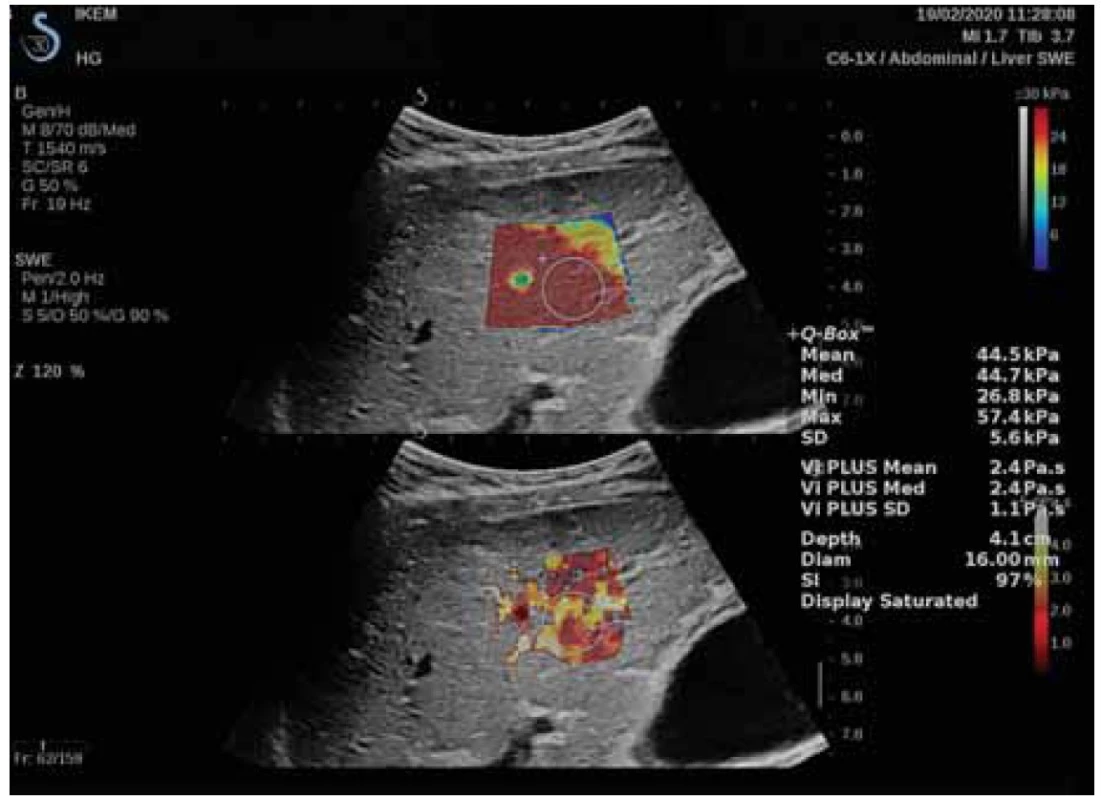
Dva algoritmy založené na měření LS a SS pomocí 2D-SWE byly navrženy Jansenem et al [45,46] a validovány Elkriefem et al [40,47] a mají excelentní diagnostickou přesnost. Kim et al prokázali dobrou schopnost měření LS pomocí 2D-SWE k predikci HVPG ≥ 12 mm [48]. Ascites nepředstavuje překážku měření LS při použití 2D-SWE, jak již bylo dříve popsáno ve studii Contiho et al [49]. Přehled studií s použitím 2D-SWE je rovněž uveden v tab. 2.
Tab. 2. Overview of publications describing the correlation between LS and the degree of PH.
Magnetická rezonance a magnetickorezonanční elastografie
Magnetická rezonance (MR) je v současné době standardní metodou k vyšetření jater a žlučových cest. V případě, že je vybavena speciálním hardwarem a softwarem, je metodou, která umí spolehlivě kvantifikovat i stupeň jaterní fibrózy. Magnetickorezonanční elastografie (MRE) byla uvedena do klinické praxe v roce 2007 a je v současnosti považována za zlatý standard v kvantitativní elastografii [21]. Tato technika umožňuje měření tuhosti jater během klinického MR vyšetření, kdy je propagace střižných vln zavzata do MR fázového signálu. MRE prokázala excelentní schopnost detekce jaterní fibrózy i cirhózy [50,51]. Ve studii Abe et al predikovala MRE CSPH, ve vícečetné regresní analýze představovaly LS (OR 2,362) a SS (OR 1,489) pomocí MRE nezávislé prediktory přítomnosti varixů jícnu [52].
Neinvazivní predikce HVPG ≥ 16 mmHg pomocí MR byla popsána ve studii Gouyi et al [53]. Autoři hodnotili průtok v portální žíle, ve vena azygos a aortě pomocí kontrastní MR a prokázali, že průtok ve vena azygos je spolehlivým prediktorem hodnot HVPG ≥ 16 mmHg. Ztráta nebo nízká korelace mezi LS a HVPG > 10 mmHg byla důvodem ztížené predikce závažnější PH ve většině publikovaných studií [20]. Slabá korelace může být vysvětlena faktem, že nárůst LS odráží zejména zvýšenou intrahepatální rezistenci způsobenou fibrózou jater a sinusoidální dysfunkcí, zatímco hyperkinetická cirkulace zhoršuje PH pouze při vysokých hodnotách portálního tlaku [54].
Měření tuhosti sleziny
Měření tuhosti sleziny (SS) je v poslední době předmětem výzkumu, zejména v predikci přítomnosti varixů jícnu [55–58]. Dosud však nebyla k predikci rutinně využívána, zejména kvůli chybění B-módu sonografického zobrazení TE přístroje Fibroscan®, kdy je ultrazvuk nezbytný ke správnému nastavení polohy sondy k měření SS.
Měření SS pomocí 2D-SWE ve studii Procopeta et al měla nižší AUROC k diagnóze CSPH ve srovnání s LS [19]. Jansen et al později prokázali, že měření LS pomocí 2D-SWE korelovalo s HVPH lépe než měření SS [45], a navrhli sekvenční měření LS a SS ke stanovení diagnózy CSPH. Tento sekvenční algoritmus byl následně validován Elkriefem et al [47]. 2D-SWE není nyní považována za vhodnou metodu k měření SS [54]. Vibracemi kontrolovaná tranzientní elastografie (VCTE, Fibroscan®) kombinovaná s ultrazvukem v B-módu k lokalizaci sleziny nebo p-SWE se zdá být slibnější metodou k potvrzení diagnózy CSPH a k predikci přítomnosti varixů jícnu [59–62]. Stefanescu et al použili k měření SS nový model přístroje Fibroscan® 630 Expert, který využívá 100Hz sondy k měření SS se zaměřením sleziny konvenční ultrazvukovou sondou. Studie zahrnující 260 pacientů prokázala dobrou přesnost pro predikci přítomnosti varixů jícnu (AROC 0,728) a zejména dokázala lépe vyloučit varixy s rizikem krvácení (AUROC 0,782) oproti TE s použitím klasické 50Hz sondy [62].
Hodnocení účinnosti podávání neselektivních betablokátorů neinvazivními metodami
Několik studií zkoumalo změny v LS při léčbě neselektivními betablokátory (NSBB) pro PH. Studie Reibergera et al prokázala, že podávání NSBB zlepšilo korelaci mezi LS a HVPG u pacientů s HVPG > 12 mmHg [63]. NSBB nejspíše zlepšují obojí – hyperkinetickou cirkulaci i sinusoidální dysfunkci [64]. Ve studii Piechy et al [65] klesl HVPG při podávání NSBB nezávisle na změně LS. Avšak u pacientů, u kterých došlo k vzestupu LS i přes pokles HVPG, bylo zaznamenáno vyšší riziko úmrtí nebo nutnosti transplantace. Další studie, autorů Piyachaturawat et al [66] hodnotila změnu LS v korelaci s tepovou frekvencí. Jako odpověď na léčbu propranololem (respondenti) bylo hodnoceno snížení tepové frekvence o > 25 % původních hodnot. V průběhu tříměsíční léčby došlo ke snížení LS měřené pomocí TE v obou skupinách pacientů bez ohledu na odpověď na léčbu propranololem, korelace s tepovou frekvencí však nebyla statisticky významná.
Ve studii Kima et al [67] byla zkoumána pSWE hodnotící LS a SS v odpovědi na profylaktické podávání carvedilolu. Hemodynamické odpovědi dosáhlo 55,7 % pacientů. V multivariantní logistické regresi byla změna SS jediným signifikantním prediktorem hemodynamické odpovědi na carvedilol (OR 0,039; 95% CI 0,008–0,135; p < 0,0001).
Ve studii Marasca et al [68] poklesl HVPG po tříměsíčním podávání NSBB u 15 z 20 pacientů. Změny v LS s poklesem HVPG nekorelovaly, naopak změna SS excelentně korelovala s poklesem HVPG (r = 0,784; p < 0,0001; AUROC 0,973). Nejlepší cut-off hodnota změny SS u respondentů na léčbu byla –10 %, se 100% senzitivitou a 60% specificitou.
I přes zaznamenané slibné výsledky v neinvazivním hodnocení odpovědi na NSBB je zapotřebí dalších výsledků a jejich standardizace.
Další potenciální neinvazivní prediktory PH
MELD skóre
MELD skóre (model for end-stage liver disease) je složený prediktor přežití u pacientů s cirhózou, vypočtený na základě celkového sérového bilirubinu, sérového kreatininu a protrombinového času (za použití INR (international normalization ratio)). MELD skóre bylo nejprve používáno k predikci časné mortality pacientů s dekompenzovanou cirhózou [69], pozdější studie prokázaly, že MELD skóre koreluje s hodnotami MRE, přítomností varixů jícnu a mortalitou pacientů při variceálním krvácení [70,71]. V současné době je MELD skóre používáno k alokaci orgánů pro pacienty v čekací listině k transplantaci jater [69,72,73].
Liver spleen stiffness score
Liver spleen platelets score (LSPS) je rovněž kompozitní prediktor kombinující LS, počet trombocytů a průměr sleziny [74]. LSPS je vypočten dle následujícího vzorce: [LS (v kPa) × průměr sleziny (v cm)] / počet trombocytů (× 109/ l). LSPS bylo přesnější než LS samotná k identifikaci pacientů s CSPH ve studii Berzigotti et al [74], ale prediktivní hodnota LSPS pro vyšší hodnoty HVPG nebyla studována. Skupina Berzigotti et al [74] zařadila do studie zejména cirhotiky s Child-Pugh skóre A (CPS-A), pouze několik pacientů s Child-Pugh skóre B (CPS-B) a nebyl zařazen žádný pacient funkční pokročilosti Child-Pugh skóre C (CPS-C). Ve studii Fraňkové et al [75] zahrnující pacienty s pokročilejším onemocněním byla ve více než 70 % případů funkční klasifikace B a C dle Childa a Pugha korelace LSPS s HVPG slabší při hodnocení celé skupiny (r = 0,449; p < 0, 0001). Korelace byla slabší i ve skupině CPS-B a C, přestože počet zařazených pacientů byl dostatečný. Vzhledem k tomu, že AUROC pro LSPS nepřesáhla 0,8 pro hodnotu HVPG > 16 ani 20 mmHg, můžeme shrnout, že LSPS není lepším prediktorem než LS sama v predikci PH u pacientů s pokročilou jaterní cirhózou, schopnost predikce HVPG pomocí LSPS však zůstává excelentním prediktorem u pacientů s kompenzovanou cirhózou jater (CPS-A) [74].
Krevní biomarkery portální hypertenze
Některé krevní biomarkery byly identifikovány jako neinvazivní markery PH, ale jejich diagnostická výpovědní hodnota je nižší ve srovnání s LSM. Krevní biomarkery mohou sloužit jako rychlé diagnostické testy, ale v tomto ohledu je třeba dalšího výzkumu [76,77].
Buck et al [78] popsali dobrou korelaci mezi krevními biomarkery zánětu a HVPG a navrhli složený diagnostický test založený na čtyřech biomarkerech (IL-6, IL1-Ra/ IL-1-F3, a VCAM-1), který dokázal identifikovat 86 % kompenzovaných cirhotiků s HVPG < 12 mmHg. Osteopontin, klíčová komponenta kostní matrix a multifunkční cytokin, rovněž koreloval s hodnotou HVPG u lidí [77].
ELF skóre
Enhanced liver fibrosis (ELF) skóre bylo nejprve navrženo jako neinvazivní prediktor stadia jaterní fibrózy u pacientů bez cirhózy, s chronickými jaterními onemocněními [79,80]. V nedávno publikované studii autorů Simbrunner et al [76] byla prokázána dobrá korelaci mezi ELF skóre a HVPG. Většina pacientů však byla funkční klasifikace CPS-A a autoři dosáhli signifikantní korelace mezi ELF skóre a HVPG pouze ve skupině CPS-A, nikoli ve skupině CPS-B a CPS-C. Autoři také prokázali, že síla korelace mezi ELF skóre a HVPG klesá s vyššími hodnotami HVPG. Díky významnému zastoupení pacientů CPS-A byli autoři schopni predikovat HVPG s vysokou přesností (AUROC 0,833) i při vztažení na celou kohortu pacientů. Výsledky naznačují, že ELF skóre může být užitečným nástrojem neinvazivní predikace HVPG, ale s významně lepší spolehlivostí ve skupině méně pokročilých cirhotiků.
Závěr
Recentně publikované studie dokazují, že díky rozvoji neinvazivních metod nahradí měření LS a SS v brzké době invazivní měření HVPG, a budeme tak moci neinvazivně hodnotit rizika asociovaná s pokročilým jaterním onemocněním.
doc. MU Dr. Jan Šperl, CSc.
Klinika hepatogastroenterologie
Institut klinické a experimentální medicíny
Vídeňská 1958/9
140 21 Praha 4
Doručeno/ Submitted: 5. 2. 2020
Přijato/ Accepted: 6. 3. 2020
Konflikt zájmů: Autoři deklarují, že text článku odpovídá etickým standardům, byla dodržena anonymita pacientů a prohlašují, že v souvislosti s předmětem článku nemají finanční, poradenské ani jiné komerční zájmy.
Publikační etika: Příspěvek nebyl dosud publikován ani není v současnosti zaslán do jiného časopisu pro posouzení. Autoři souhlasí s uveřejněním svého jména a e-mailového kontaktu v publikovaném textu.
Dedikace: Tato práce byla podpořena z programového projektu Ministerstva zdravotnictví ČR s reg. č. 16-274546A. Veškerá práva podle předpisů na ochranu duševního vlastnictví jsou vyhrazena.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Sources
- Tapper EB, Parikh ND. Mortality due to cirrhosis and liver cancer in the United States, 1999–2016: observational study. BMJ 2018; 362: k2817. doi: 10.1136/ bmj.k2817.
- Asrani SK, Larson JJ, Yawn B et al. Underestimation of liver-related mortality in the United States. Gastroenterology 2013; 145(2): 375–382. doi: 10.1053/ j.gastro.2013.04.005.
- Estes C, Razavi H, Loomba R et al. Modeling the epidemic of nonalcoholic fatty liver disease demonstrates an exponential increase in burden of disease. Hepatology 2018; 67(1): 123–133. doi: 10.1002/ hep.29466.
- Nahon P, Bourcier V, Layese R et al. Eradication of hepatitis C virus infection in patients with cirrhosis reduces risk of liver and non-liver complications. Gastroenterology 2017; 152(1): 142–156. doi: 10.1053/ j.gastro.2016.09.009.
- Kao JH, Chen DS. Global control of hepatitis B virus infection. Lancet Infect Dis 2002; 2(7): 395–403. doi: 10.1016/ s1473-3099(02)00315-8.
- Zanetti AR, Van Damme P, Shouval D. The global impact of vaccination against hepatitis B: a historical overview. Vaccine 2008; 26(49): 6266–6273. doi: 10.1016/ j.vaccine.2008.09.056.
- Jafri SM, Lok AS. Antiviral therapy for chronic hepatitis B. Clin Liver Dis 2010; 14(3): 425–438. doi: 10.1016/ j.cld.2010.05.005.
- McConnell M, Iwakiri Y. Biology of portal hypertension. Hepatol Int 2018; 12(Suppl 1): 11–23. doi: 10.1007/ s12072-017-9826-x.
- Berzigotti A, Bosch J. Pharmacologic management of portal hypertension. Clin Liver Dis 2014; 18(2): 303–317. doi: 10.1016/ j.cld.2013.12.003.
- de Franchis R, Baveno VIF. Expanding consensus in portal hypertension: report of the Baveno VI Consensus Workshop: stratifying risk and individualizing care for portal hypertension. J Hepatol 2015; 63(3): 743–752. doi: 10.1016/ j.jhep.2015.05.022.
- Bosch J, Abraldes JG, Berzigotti A et al. The clinical use of HVPG measurements in chronic liver disease. Nat Rev Gastroenterol Hepatol 2009; 6(10): 573–582. doi: 10.1038/ nrgastro.2009.149.
- Lebrec D, De Fleury P, Rueff B et al. Portal hypertension, size of esophageal varices, and risk of gastrointestinal bleeding in alcoholic cirrhosis. Gastroenterology 1980; 79(6): 1139–1144.
- Garcia-Tsao G, Groszmann RJ, Fisher RL et al. Portal pressure, presence of gastroesophageal varices and variceal bleeding. Hepatology 1985; 5(3): 419–424. doi: 10.1002/ hep.1840050313.
- Groszmann RJ, Garcia-Tsao G, Bosch J et al. Beta-blockers to prevent gastroesophageal varices in patients with cirrhosis. N Engl J Med 2005; 353(21): 2254–2261. doi: 10.1056/ NEJMoa044456.
- Ripoll C, Groszmann R, Garcia-Tsao G et al. Hepatic venous pressure gradient predicts clinical decompensation in patients with compensated cirrhosis. Gastroenterology 2007; 133(2): 481–488. doi: 10.1053/ j.gastro.2007.05.024.
- Bureau C, Metivier S, Peron JM et al. Transient elastography accurately predicts presence of significant portal hypertension in patients with chronic liver disease. Aliment Pharmacol Ther 2008; 27(12): 1261–1268. doi: 10.1111/ j.1365-2036.2008.03701.x.
- Silva-Junior G, Baiges A, Turon F et al. The prognostic value of hepatic venous pressure gradient in patients with cirrhosis is highly dependent on the accuracy of the technique. Hepatology 2015; 62(5): 1584–1592. doi: 10.1002/ hep.28031.
- Abraldes JG, Villanueva C, Banares R et al. Hepatic venous pressure gradient and prognosis in patients with acute variceal bleeding treated with pharmacologic and endoscopic therapy. J Hepatol 2008; 48(2): 229–236. doi: 10.1016/ j.jhep.2007.10.008.
- Procopet B, Berzigotti A, Abraldes JG et al. Real-time shear-wave elastography: applicability, reliability and accuracy for clinically significant portal hypertension. J Hepatol 2015; 62(5): 1068–1075. doi: 10.1016/ j.jhep.2014.12.007.
- Stefanescu H, Rusu C, Lupsor-Platon M et al. Liver stiffness assessed by ultrasound shear wave elastography from general electric accurately predicts clinically significant portal hypertension in patients with advanced chronic liver disease. Ultraschall Med 2019; 41(5): 526–533. doi: 10.1055/ a-0965-0745.
- European Association for Study of Liver, Asociacion Latinoamericana para el Estudio del Higado. EASL-ALEH clinical practice guidelines: non-invasive tests for evaluation of liver disease severity and prognosis. J Hepatol 2015; 63(1): 237–264. doi: 10.1016/ j.jhep.2015.04.006.
- Calvaruso V, Dhillon AP, Tsochatzis E et al. Liver collagen proportionate area predicts decompensation in patients with recurrent hepatitis C virus cirrhosis after liver transplantation. J Gastroenterol Hepatol 2012; 27(7): 1227–1232. doi: 10.1111/ j.1440-1746.2012.07136.x.
- Nielsen K, Clemmesen JO, Vassiliadis E et al. Liver collagen in cirrhosis correlates with portal hypertension and liver dysfunction. APMIS 2014; 122(12): 1213–1222. doi: 10.1111/ apm.12287.
- Yin M, Kolipaka A, Woodrum DA et al. Hepatic and splenic stiffness augmentation assessed with MR elastography in an in vivo porcine portal hypertension model. J Magn Reson Imaging 2013; 38(4): 809–815. doi: 10.1002/ jmri.24049.
- Yarpuzlu B, Ayyildiz M, Tok OE et al. Correlation between the mechanical and histological properties of liver tissue. J Mech Behav Biomed Mater 2014; 29 : 403–416. doi: 10.1016/ j.jmbbm.2013.09.016.
- Yang C, Yin M, Glaser KJ et al. Static and dynamic liver stiffness: an ex vivo porcine liver study using MR elastography. Magn Reson Imaging 2017; 44 : 92–95. doi: 10.1016/ j.mri.2017.08.009.
- Kennedy P, Wagner M, Castera L et al. Quantitative elastography methods in liver disease: current evidence and future directions. Radiology 2018; 286(3): 738–763. doi: 10.1148/ radiol. 2018170601.
- Sandrin L, Fourquet B, Hasquenoph JM et al. Transient elastography: a new noninvasive method for assessment of hepatic fibrosis. Ultrasound Med Biol 2003; 29(12): 1705–1713. doi: 10.1016/ j.ultrasmedbio.2003.07.001.
- Li Y, Huang YS, Wang ZZ et al. Systematic review with meta-analysis: the diagnostic accuracy of transient elastography for the staging of liver fibrosis in patients with chronic hepatitis B. Aliment Pharmacol Ther 2016; 43(4): 458–469. doi: 10.1111/ apt.13488.
- Tsochatzis EA, Gurusamy KS, Ntaoula S et al. Elastography for the diagnosis of severity of fibrosis in chronic liver disease: a meta-analysis of diagnostic accuracy. J Hepatol 2011; 54(4): 650–659. doi: 10.1016/ j.jhep.2010.07.033.
- Stebbing J, Farouk L, Panos G et al. A meta-analysis of transient elastography for the detection of hepatic fibrosis. J Clin Gastroenterol 2010; 44(3): 214–219. doi: 10.1097/ MCG.0b013e3181b4af1f.
- Friedrich-Rust M, Ong MF, Martens S et al. Performance of transient elastography for the staging of liver fibrosis: a meta-analysis. Gastroenterology 2008; 134(4): 960–974. doi: 10.1053/ j.gastro.2008.01.034.
- Talwalkar JA, Kurtz DM, Schoenleber SJ et al. Ultrasound-based transient elastography for the detection of hepatic fibrosis: systematic review and meta-analysis. Clin Gastroenterol Hepatol 2007; 5(10): 1214–1220. doi: 10.1016/ j.cgh.2007.07.020.
- Shaheen AA, Wan AF, Myers RP. FibroTest and FibroScan for the prediction of hepatitis C-related fibrosis: a systematic review of diagnostic test accuracy. Am J Gastroenterol 2007; 102(11): 2589–2600. doi: 10.1111/ j.1572-0241.2007.01466.x.
- Shi KQ, Fan YC, Pan ZZ et al. Transient elastography: a meta-analysis of diagnostic accuracy in evaluation of portal hypertension in chronic liver disease. Liver Int 2013; 33(1): 62–71. doi: 10.1111/ liv.12003.
- You MW, Kim KW, Pyo J et al. A meta-analysis for the diagnostic performance of transient elastography for clinically significant portal hypertension. Ultrasound Med Biol 2017; 43(1): 59–68. doi: 10.1016/ j.ultrasmedbio.2016.07.025.
- Maurice JB, Brodkin E, Arnold F et al. Validation of the Baveno VI criteria to identify low risk cirrhotic patients not requiring endoscopic surveillance for varices. J Hepatol 2016; 65(5): 899–905. doi: 10.1016/ j.jhep.2016.06.021.
- Augustin S, Pons M, Maurice JB et al. Expanding the Baveno VI criteria for the screening of varices in patients with compensated advanced chronic liver disease. Hepatology 2017; 66(6): 1980–1988. doi: 10.1002/ hep.29363.
- Morishita N, Hiramatsu N, Oze T et al. Liver stiffness measurement by acoustic radiation force impulse is useful in predicting the presence of esophageal varices or high-risk esophageal varices among patients with HCV-related cirrhosis. J Gastroenterol 2014; 49(7): 1175–1182. doi: 10.1007/ s00535-013-0877-z.
- Elkrief L, Rautou PE, Ronot M et al. Prospective comparison of spleen and liver stiffness by using shear-wave and transient elastography for detection of portal hypertension in cirrhosis. Radiology 2015; 275(2): 589–598. doi: 10.1148/ radiol.14141210.
- Cassinotto C, Charrie A, Mouries A et al. Liver and spleen elastography using supersonic shear imaging for the non-invasive diagnosis of cirrhosis severity and oesophageal varices. Dig Liver Dis 2015; 47(8): 695–701. doi: 10.1016/ j.dld.2015.04.008.
- Thiele M, Hugger MB, Kim Y et al. 2D shear wave liver elastography by Aixplorer to detect portal hypertension in cirrhosis: an individual patient data meta-analysis. Liver Int 2020; 40(6): 1435–1446. doi: 10.1111/ liv.14439.
- Takuma Y, Morimoto Y, Takabatake H et al. Measurement of spleen stiffness with acoustic radiation force impulse imaging predicts mortality and hepatic decompensation in patients with liver cirrhosis. Clin Gastroenterol Hepatol 2017; 15(11): 1782–1790. doi: 10.1016/ j.cgh.2016.10.041.
- Choi SY, Jeong WK, Kim Y et al. Shear-wave elastography: a noninvasive tool for monitoring changing hepatic venous pressure gradients in patients with cirrhosis. Radiology 2014; 273(3): 917–926. doi: 10.1148/ radiol.14140008.
- Jansen C, Bogs C, Verlinden W et al. Algorithm to rule out clinically significant portal hypertension combining Shear-wave elastography of liver and spleen: a prospective multicentre study. Gut 2016; 65(6): 1057–1058. doi: 10.1136/ gutjnl-2016-311536.
- Jansen C, Bogs C, Verlinden W et al. Shear-wave elastography of the liver and spleen identifies clinically significant portal hypertension: a prospective multicentre study. Liver Int 2017; 37(3): 396–405. doi: 10.1111/ liv.13243.
- Elkrief L, Ronot M, Andrade F et al. Non-invasive evaluation of portal hypertension using shear-wave elastography: analysis of two algorithms combining liver and spleen stiffness in 191 patients with cirrhosis. Aliment Pharmacol Ther 2018; 47(5): 621–630. doi: 10.1111/ apt.14488.
- Kim TY, Jeong WK, Sohn JH et al. Evaluation of portal hypertension by real-time shear wave elastography in cirrhotic patients. Liver Int 2015; 35(11): 2416–2424. doi: 10.1111/ liv.12846.
- Conti CB, Weiler N, Casazza G et al. Feasibility and reproducibility of liver and pancreatic stiffness in patients with alcohol-related liver disease. Dig Liver Dis 2019; 51(7): 1023–1029. doi: 10.1016/ j.dld.2018.12.017.
- Singh S, Venkatesh SK, Loomba R et al. Magnetic resonance elastography for staging liver fibrosis in non-alcoholic fatty liver disease: a diagnostic accuracy systematic review and individual participant data pooled analysis. Eur Radiol 2016; 26(5): 1431–1440. doi: 10.1007/ s003 30-015-3949-z.
- Singh S, Venkatesh SK, Wang Z et al. Diagnostic performance of magnetic resonance elastography in staging liver fibrosis: a systematic review and meta-analysis of individual participant data. Clin Gastroenterol Hepatol 2015; 13(3): 440–451. doi: 10.1016/ j.cgh.2014.09.046.
- Abe H, Midorikawa Y, Matsumoto N et al. Prediction of esophageal varices by liver and spleen MR elastography. Eur Radiol 2019; 29(12): 6611–6619. doi: 10.1007/ s00330-019-06230-8.
- Gouya H, Grabar S, Vignaux O et al. Portal hypertension in patients with cirrhosis: indirect assessment of hepatic venous pressure gradient by measuring azygos flow with 2D-cine phase-contrast magnetic resonance imaging. Eur Radiol 2016; 26(7): 1981–1990. doi: 10.1007/ s00330-015-3991-x.
- Mandorfer M, Hernandez-Gea V, Garcia-Pagan JC et al. Noninvasive diagnostics for portal hypertension: a comprehensive review. Semin Liver Dis 2020; 40(3): 240–255. doi: 10.1055/ s-0040-1708806.
- Colecchia A, Montrone L, Scaioli E et al. Measurement of spleen stiffness to evaluate portal hypertension and the presence of esophageal varices in patients with HCV-related cirrhosis. Gastroenterology 2012; 143(3): 646–654. doi: 10.1053/ j.gastro.2012.05.035.
- Colecchia A, Ravaioli F, Marasco G et al. A combined model based on spleen stiffness measurement and Baveno VI criteria to rule out high-risk varices in advanced chronic liver disease. J Hepatol 2018; 69(2): 308–317. doi: 10.1016/ j.jhep.2018.04.023.
- Stefanescu H, Grigorescu M, Lupsor M et al. Spleen stiffness measurement using Fibroscan for the noninvasive assessment of esophageal varices in liver cirrhosis patients. J Gastroenterol Hepatol 2011; 26(1): 164–170. doi: 10.1111/ j.1440-1746.2010.06325.x.
- Sharma P, Kirnake V, Tyagi P et al. Spleen stiffness in patients with cirrhosis in predicting esophageal varices. Am J Gastroenterol 2013; 108(7): 1101–1107. doi: 10.1038/ ajg.2013.119.
- Berzigotti A. Non-invasive evaluation of portal hypertension using ultrasound elastography. J Hepatol 2017; 67(2): 399–411. doi: 10.1016/ j.jhep.2017.02.003.
- Takuma Y, Nouso K, Morimoto Y et al. Portal hypertension in patients with liver cirrhosis: diagnostic accuracy of spleen stiffness. Radiology 2016; 279(2): 609–619. doi: 10.1148/ radiol. 2015150690.
- Attia D, Schoenemeier B, Rodt T et al. Evaluation of liver and spleen stiffness with acoustic radiation force impulse quantification elastography for diagnosing clinically significant portal hypertension. Ultraschall Med 2015; 36(6): 603–610. doi: 10.1055/ s-0041-107971.
- Stefanescu H, Marasco G, Cales P et al. A novel spleen-dedicated stiffness measurement by FibroScan® improves the screening of high-risk oesophageal varices. Liver Int 2020; 40(1): 175–185. doi: 10.1111/ liv.14228.
- Reiberger T, Ferlitsch A, Payer BA et al. Non-selective beta-blockers improve the correlation of liver stiffness and portal pressure in advanced cirrhosis. J Gastroenterol 2012; 47(5): 561–568. doi: 10.1007/ s00535-011-0517-4.
- Ling L, Li G, Meng D, Wang S et al. Carvedilol ameliorates intrahepatic angiogenesis, sinusoidal remodeling and portal pressure in cirrhotic rats. Med Sci Monit 2018; 24 : 8290–8297. doi: 10.12659/ MSM.913118.
- Piecha F, Paech D, Sollors J et al. Rapid change of liver stiffness after variceal ligation and TIPS implantation. Am J Physiol Gastrointest Liver Physiol 2018; 314(2): G179–G187. doi: 10.1152/ ajpgi.00239.2017.
- Piyachaturawat P, Siramolpiwat S, Sonsiri Ket al. Changes in transient elastography in early cirrhotic patients after receiving nonselective B-blocker for primary variceal bleeding prophylaxis: three-month follow up. JGH Open 2018; 2(5): 172–177. doi: 10.1002/ jgh3.12063.
- Kim HY, So YH, Kim W et al. Non-invasive response prediction in prophylactic carvedilol therapy for cirrhotic patients with esophageal varices. J Hepatol 2019; 70(3): 412–422. doi: 10.1016/ j.jhep.2018.10.018.
- Marasco G, Dajti E, Ravaioli F et al. Spleen stiffness measurement for assessing the response to beta-blockers therapy for high-risk esophageal varices patients. Hepatol Int 2020; 14(5): 850–857. doi: 10.1007/ s12072-020-10062-w.
- Kamath PS, Kim WR, Advanced Liver Disease Study G. The model for end-stage liver disease (MELD). Hepatology 2007; 45(3): 797–805. doi: 10.1002/ hep.21563.
- Hoffman DH, Ayoola A, Nickel D et al. MR elastography, T1 and T2 relaxometry of liver: role in noninvasive assessment of liver function and portal hypertension. Abdom Radiol (NY) 2020; 45(9): 2680–2687. doi: 10.1007/ s00261-020-02432-7.
- Conejo I, Guardascione MA, Tandon P et al. Multicenter external validation of risk stratification criteria for patients with variceal bleeding. Clin Gastroenterol Hepatol 2018; 16(1): 132–139. doi: 10.1016/ j.cgh.2017.04.042.
- Wiesner RH, McDiarmid SV, Kamath PS et al. MELD and PELD: application of survival models to liver allocation. Liver Transpl 2001; 7(7): 567–580. doi: 10.1053/ jlts.2001.25879.
- Wiesner R, Edwards E, Freeman R et al. Model for end-stage liver disease (MELD) and allocation of donor livers. Gastroenterology 2003; 124(1): 91–96. doi: 10.1053/ gast.2003.50016.
- Berzigotti A, Seijo S, Arena U et al. Elastography, spleen size, and platelet count identify portal hypertension in patients with compensated cirrhosis. Gastroenterology 2013; 144(1): 102–111. doi: 10.1053/ j.gastro.2012.10.001.
- Frankova S, Lunova M, Gottfriedova H et al. Liver stiffness measured by two-dimensional shear-wave elastography predicts hepatic vein pressure gradient at high values in liver transplant candidates with advanced liver cirrhosis. PLoS One 2021; 16(1): e0244934. doi: 10.1371/ journal.pone.0244934.
- Simbrunner B, Marculescu R, Scheiner B et al. Non-invasive detection of portal hypertension by enhanced liver fibrosis score in patients with different aetiologies of advanced chronic liver disease. Liver Int 2020; 40(7): 1713–1724. doi: 10.1111/ liv.14498.
- Bruha R, Jachymova M, Petrtyl J et al. Osteopontin: a non-invasive parameter of portal hypertension and prognostic marker of cirrhosis. World J Gastroenterol 2016; 22(12): 3441–3450. doi: 10.3748/ wjg.v22.i12.3441.
- Buck M, Garcia-Tsao G, Groszmann RJ et al. Novel inflammatory biomarkers of portal pres-sure in compensated cirrhosis patients. Hepatology 2014; 59(3): 1052–1059. doi: 10.1002/ hep.26755.
- Miele L, De Michele T, Marrone G et al. Enhanced liver fibrosis test as a reliable tool for assessing fibrosis in nonalcoholic fatty liver disease in a clinical setting. Int J Biol Markers 2017; 32(4): e397–e402. doi: 10.5301/ ijbm.5000292.
- Jabor A, Kubicek Z, Frankova S et al. Enhanced liver fibrosis (ELF) score: reference ranges, biological variation in healthy subjects, and analytical considerations. Clin Chim Acta 2018; 483 : 291–295. doi: 10.1016/ j.cca.2018.05.027.
- Vizzutti F, Arena U, Romanelli RG et al. Liver stiffness measurement predicts severe portal hypertension in patients with HCV-related cirrhosis. Hepatology 2007; 45(5): 1290–1297. doi: 10.1002/ hep.21665. PubMed PMID: 17464971.
- Lemoine M, Katsahian S, Ziol M et al. Liver stiffness measurement as a predictive tool of clinically significant portal hypertension in patients with compensated hepatitis C virus or alcohol-related cirrhosis. Aliment Pharmacol Ther 2008; 28(9): 1102–1110. Epub 2008/ 08/ 12. doi: 10.1111/ j.1365-2036.2008.03825.x. PubMed PMID: 18691352.
- Sanchez-Conde M, Montes Ramirez ML, Bellon Cano JM et al. Impact of liver steatosis on the correlation between liver stiffness and fibrosis measured by transient elastography in patients coinfected with human immunodeficiency virus and hepatitis C virus. J Viral Hepat 2011; 18(7): e278–283. doi: 10.1111/ j.1365-2893.2010.01407.x.
- Kitson MT, Roberts SK, Colman JC et al. Liver stiffness and the prediction of clinically significant portal hypertension and portal hypertensive complications. Scand J Gastroenterol 2015; 50(4): 462–469. doi: 10.3109/ 00365521.2014.964758.
- Llop E, Berzigotti A, Reig M et al. Assessment of portal hypertension by transient elastography in patients with compensated cirrhosis and potentially resectable liver tumors. J Hepatol 2012; 56(1): 103–108. doi: 10.1016/ j.jhep.2011.06.027.
- Carrion JA, Navasa M, Bosch J et al. Transient elastography for diagnosis of advanced fibrosis and portal hypertension in patients with hepatitis C recurrence after liver transplantation. Liver Transpl 2006; 12(12): 1791–1798. doi: 10.1002/ lt.20857.
Labels
Paediatric gastroenterology Gastroenterology and hepatology SurgeryArticle was published in
Gastroenterology and Hepatology
2021 Issue 2
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Spasmolytic Effect of Metamizole
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- The Importance of Limosilactobacillus reuteri in Administration to Diabetics with Gingivitis
-
All articles in this issue
- Editorial
- Kvíz z klinické praxe
- Význam sarkopénie a krehkosti v manažmente cirhózy
- Doporučené postupy ČNS a ČHS JEP pro diagnostiku a léčbu akutního poškození ledvin u jaterní cirhózy
- Neinvazivní metody v posuzování závažnosti portální hypertenze
- Laparoskopická nebo klasická splenektomie?
- Posuzování funkce ledvin u pacientů s jaterním onemocněním
- Liver injury after the use of anabolic steroids to promote muscle growth – single-center experience
- Impact of methodical guidelines of gastric scintigraphy on patients’ radiation exposure
- Benign asymptomatic pneumoperitoneum in the patient after CT colonography
- Teduglutide, a glucagon-like peptide-2 analogue (REVESTIVE), in the treatment of short bowel syndrome with dependence on home parenteral nutrition
- The selection from international journals
- Kreditovaný autodidaktický test
- Diagnostic accuracy of the R-Factor in differentiating between neonatal hepatitis and biliary atresia in infants
- Managing IBD therapy during pregnancy demands a multidisciplinary approach
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Liver injury after the use of anabolic steroids to promote muscle growth – single-center experience
- Teduglutide, a glucagon-like peptide-2 analogue (REVESTIVE), in the treatment of short bowel syndrome with dependence on home parenteral nutrition
- Laparoskopická nebo klasická splenektomie?
- Posuzování funkce ledvin u pacientů s jaterním onemocněním
