Bradykininem indukovaný angioedém a jeho diferenciální diagnostika
Bradykinin-induced angioedema and its differential diagnosis
A significant proportion of population has experience with angioedema. According to the pathophysiology it is possible to subdivide angioedema into histamine - or bradykinin induced. They fundamentally differ from each other in aetiology, clinical picture and management. This article is focused on bradykinin-induced angioedema, comprising: hereditary angioedema, ACE-inhibitors induced-angioedema and acquired angioedema. These diagnoses are often neglected. Inadequate treatment could lead to a patient’s death. C1 inhibitor substitution and bradykinin-receptor blocker play key roles in the management of the condition. Corticosteroids, antihistamines or adrenalin are ineffective in such cases.
Key words:
angioedema, bradykinin, hereditary, C1 inhibitor, icatibant
:
P. Králíčková 1; E. Malá 1; P. Rozsíval 2; Jana Krtičková 3
; I. Krčmová 1
:
Univerzita Karlova v Praze, Lékařská fakulta a Fakultní nemocnice Hradec Králové
; Ústav klinické imunologie a alergologie, Přednosta: prof. RNDr. Jan Krejsek, CSc.
1; Dětská klinika, Přednosta: prof. MUDr. Milan Bayer, CSc.
2; Klinika otorinolaryngologie a chirurgie hlavy a krku, Přednosta: prof. MUDr. Viktor Chrobok, Ph. D.
3
:
Prakt. Lék. 2012; 92(7): 378-382
:
Reviews
Zkušenost s angioedémem má významná část populace. Z patogenetického hlediska ho lze rozdělit na histaminem či bradykinem indukovaný. Oba se zásadně liší původem, klinickým obrazem i léčbou. Článek klade důraz zejména na angioedém indukovaný bradykininem zahrnující klinické jednotky: hereditární angioedém, angioedém indukovaný ACE inhibitory a získaný angioedém. Jedná se často o poddiagnostikovaná onemocnění, která bez adekvátní léčby mohou vést i k úmrtí. Klíčovými v léčbě jsou C1 inhibitor či blokátor bradykininových receptorů. Léčba kortikoidy, antihistaminiky či adrenalinem v těchto případech selhává.
Klíčová slova:
angioedém, bradykinin, hereditární, C1 inhibitor, icatibant
Úvod
Angioedém je definován jako dobře ohraničený, lokalizovaný otok hlubších vrstev kůže a podkoží, popř. sliznice střev či dýchacího traktu. Charakter klinických obtíží se odvíjí podle postiženého místa. Může vyvolat i život ohrožující komplikace. Zkušenost s angioedémem má až 15 % populace. V 50 % je doprovázen urtikárií (23).
Nejen z patogenetického hlediska je vhodné rozlišovat angioedém indukovaný histaminem či bradykininem, na který se koncentruje náš článek. Rozdílnému mechanizmu vzniku také následně odpovídá účinná léčba, která se diametrálně liší a chyba pak může mít fatální následky pro další osud nemocného.
Angioedém indukovaný histaminem
Tento typ angioedému bývá alergického původu (léky, hmyzí alergeny, potraviny). V četných případech se však jedná o angioedém idiopatický, kdy se přes veškerou snahu nakonec nepodaří jasnou příčinu odhalit. K jeho vzniku často přispívá několik precipitujících faktorů. Angioedém může být spojen s urtikárií i anafylaxí. Při pátrání po možných příčinách se zaměříme zejména na anamnézu užívání kyseliny acetylsalicylové či dalších nesteroidních antirevmatik, jakoukoliv hormonální léčbu obsahující zejména estrogenní složku (hormonální antikoncepce, substituční léčba v perimenopauzálním období). Na uvolnění histaminu se mohou taktéž spolupodílet různé fyzikální podněty (např. chlad, teplo, vibrace). Často nacházíme souvislost s autoimunitní thyreopatií či přítomností infekčního fokusu (v oblasti stomatologické, ORL, ale i urogenitální). Velmi vzácně je diagnostikován angioedém asociovaný s cytokiny (tzv. Gleichův syndrom – horečka, eozinofílie, 10–20% úbytek hmotnosti, elevace IgM, zvýšení hladin IL-3, IL-5 a IL-6) (23, 32, 37).
S vysokým počtem alergiků s vazbou na inhalační alergeny je vhodné se zmínit o „orálním alergickém syndromu“ či „zkřížené potravinové alergii“. V tomto případě se jedná o zkříženou alergickou reakci danou existencí podobných či dokonce totožných bílkovin (alergenů), obsažených jak v potravině, tak i v pylovém zrnu. Potravina musí být tedy produktem takové rostliny, která je nějakým způsobem botanicky spřízněna s rostlinou, na kterou je pacient inhalačně alergický. Klinicky se projevuje pálením a svěděním patra, jazyka a rtů. Reakce bývá spojena s poruchou polykání, ale i kýcháním a obstrukcí nosu, exantémy a otoky v obličeji. Nástup je zpravidla promptní. Typicky se jedná o peckovice (např. broskev, meruňky, třešně), malvice (jablka), kořenovou zeleninu (mrkev, celer, petržel), koření (kopr, pepř, fenykl, kmín), ořechy, luštěniny (37). Naštěstí riziko celkové reakce je v tomto případě minimální.
V prevenci vzniku agioedému indukovanému histaminem je zásadní eliminace vyvolávající příčiny či alespoň snaha o maximální korekci komplikujících faktorů. Při vzniku vlastního edému jsou klíčovými léky kortikoidy, antihistaminika, případně adrenalin (záleží na lokalizaci a rozsahu) (32).
Angioedém indukovaný bradykinenem
Tento typ zahrnuje tyto klinické jednotky: hereditární angioedém, získaný angioedém a angioedém indukovaný ACE inhibitory (tabulka č.1).
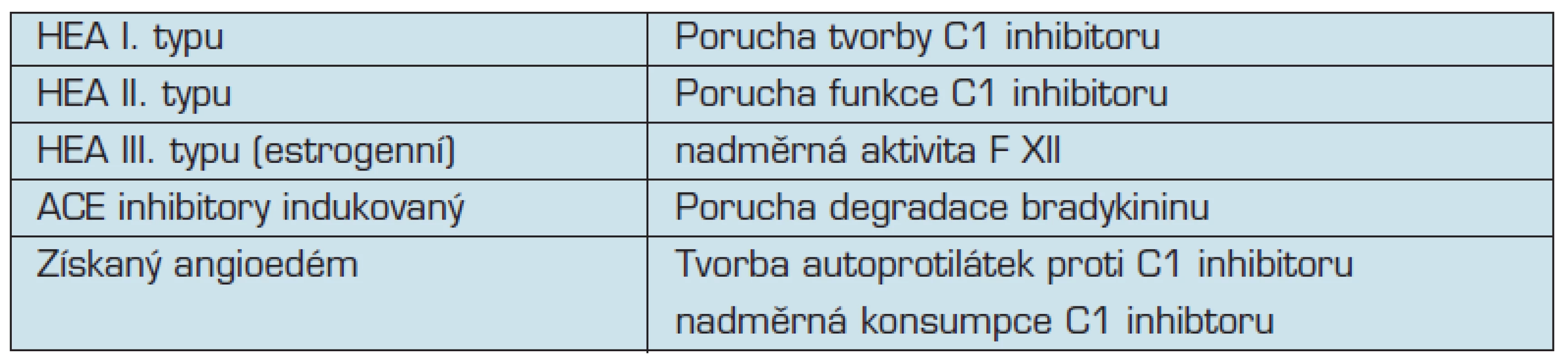
ACE inhibitory indukovaný angioedém
Angioedém spojený s užíváním ACE inhibitorů se vyskytuje poměrně nečetně u 0,1–2,2 % léčených pacientů (34). Z klinického hlediska je však velmi významný. Může vzniknout kdykoliv v průběhu léčby, dokonce i řadu let od jejího zahájení. Většina případů však vzniká v prvním týdnu léčby a až 25 % v průběhu prvního měsíce (30). Rizikovými faktory zvyšujícími pravděpodobnost vzniku jsou ženské pohlaví, věk nad 65 let, kuřáctví, užívání nesteroidních antirevmatik, sezónní alergie, ACE-indukovaný kašel (25) či léčba statiny a inhibitory mTOR v anamnéze (19).
V patogenezi hraje klíčovou roli snížené odbourávání bradykininu. Důležitou úlohu hraje pravděpodobně i genetická variabilita aktivity enzymu aminopeptidázy P, účastnící se jeho odbourávání (1).
Při diagnóze jsou nenahraditelná anamnestická data. K potvrzení diagnózy bohužel neexistuje žádný specifický laboratorní test. Angioedém většinou postihuje kůži, horní cesty dýchací, typicky rty a jazyk. Byly však i popsány případy spojené s bolestmi břicha, ascitem, či dilatací střevních kliček (36).
Léčebně je samozřejmostí přerušení léčby. Převedení na léčbu blokátory angiotenzinových receptorů nemusí vždy znamenat úlevu. U těchto nemocných byl angioedém následně zaznamenán až v 9 %. Je vždy na uvážení lékaře přihlédnout k tíži a frekvenci atak na straně jedné a na straně druhé nezbytnosti podávání ACE inhibitorů, např. v indikaci městnavého srdečního selhávání či diabetu (24).
V léčbě akutní ataky je klíčové, že se jedná o otok způsobený bradykininem (nikoliv histaminem), a proto léčba antihistaminiky, kortikoidy či dokonce adrenalinem selhává! Na místě je postiženého sledovat, v případě nutnosti intubovat či provést urgentní tracheotomii. Léčba analogická s léčbou hereditárního angioedému je jednoznačně efektivní, nicméně se jedná o léčbu vysoce finančně náročnou. V tomto směru neexistují jednotná doporučení, spíše se opíráme o zkušenosti získané z jednotlivých kazuistik či jejich souborů. Čelní místo zde zaujímá podkožní podání icatibantu (antagonisty bradykininových receptorů) (3).
Získaný angioedém
Získaný angioedém neboli získaná deficience C1 inhibitoru byla poprvé popsána v roce 1972 Caldwellem (6). Z klinického pohledu se obraz zásadně neliší od angioedému hereditárního s jediným rozdílem – vyskytuje se u osob vyššího věku. Objevuje se naprosto nepredikovatelně jako defigurující, nesvědivé, bělavé otoky kůže (obličej, končetiny, genitálie) či těžké břišní bolesti kolikovitého charakteru. Byly zaznamenány i případy život ohrožujícího otoku v oblasti horních cest dýchacích, včetně jazyka. Tento druh angioedému nebývá spojen s urtikárií (38).
Patogeneticky vzniká konzumpčními mechanizmy či přítomností neutralizujících autoprotilátek proti C1 inhibitoru. Byl zaznamenán u nemocných s maligními lymfomy, s lymfoproliferativními onemocněními včetně monoklonálních gamapatií nejasného významu. Byl však popsán i u nemocných s dalšími typy nádorových či autoimunitních onemocnění (především systémový lupus – SLE).
Laboratorně nalézáme sníženou hladinu C4 složky komplementu a C1 inhibitoru. Užitečné bývá stanovení hladiny C1Q složky komplementu, která bývá často snížená (na rozdíl od nositelů hereditární formy) (11).
V léčbě je klíčová léčba základního onemocnění. Protože se jedná o bradykininem – indukovaný typ otoku, je třeba opakovat, že léčba kortikoidy a antihistaminiky je neúčinná. Zásadní je zajištění průchodnosti dýchacích cest. V kazuistických sděleních byla použita čistá zmražená plasma, koncentrát C1 inhibitoru, inhibitor kalikreinu či bradykininových receptorů (21). Často je doporučována léčba antifibrinolytiky (22).
Hereditární angioedém (HEA)
Jedná se o autozomální, dominantně dědičné onemocnění, pro které je charakteristická tvorba nebolestivých, nesvědivých otoků podkoží a sliznic. Příčinou je genová mutace, která způsobuje absolutní či relativní nedostatek (tvorba afunkčního proteinu) C1 inhibitoru. V populaci se vyskytuje s frekvencí 1 : 50 000 až 1 : 150 000 bez závislosti na rase či pohlaví (29, 7, 23).
C1 inhibitor je multifunkční inhibitor serinových proteáz, které se vyskytují v plazmě. Je tvořen hepatocyty, aktivovanými makrofágy a dalšími buňkami. Je jediným známým inhibitorem aktivovaných proteáz klasické dráhy komplementu – C1r, C1s a serinových proteáz (MASP-1 a 2) aktivovaných lektinovou cestou. Dále významně inhibuje aktivovaný faktor XI, XII, kalikrein a trombin v koagulačním systému a tkáňový aktivátor plasminogenu (tPA) a plasmin ve fibrinolytickém systému (14).
C1 inhibitor blokádou přeměny prekalikreinu na kalikrein reguluje tvorbu bradykininu, který je u pacientů s hereditárním angioedémem zásadní pro vznik klinických příznaků. Deficit C1 inhibitoru vede k spontánní aktivaci C1 složky komplementu za současného spotřebovávání C2 a C4 složek komplementu. Výsledkem je produkce anafylaktických, chemotaktických a vazoaktivních mediátorů. Dochází ke zvýšení permeability cév a tvorbě otoků (28, 27). Nadprodukce bradykininu je místní záležitostí např. v postižené končetině ( 31). Klinicky se HEA projevuje až při snížení aktivity C1 inhibitoru o více než 50 %, z toho vyplývá nezbytná přítomnost dalších faktorů, které regulují míru transkripce funkční alely (s ohledem na heterozygotní povahu onemocnění) (14).
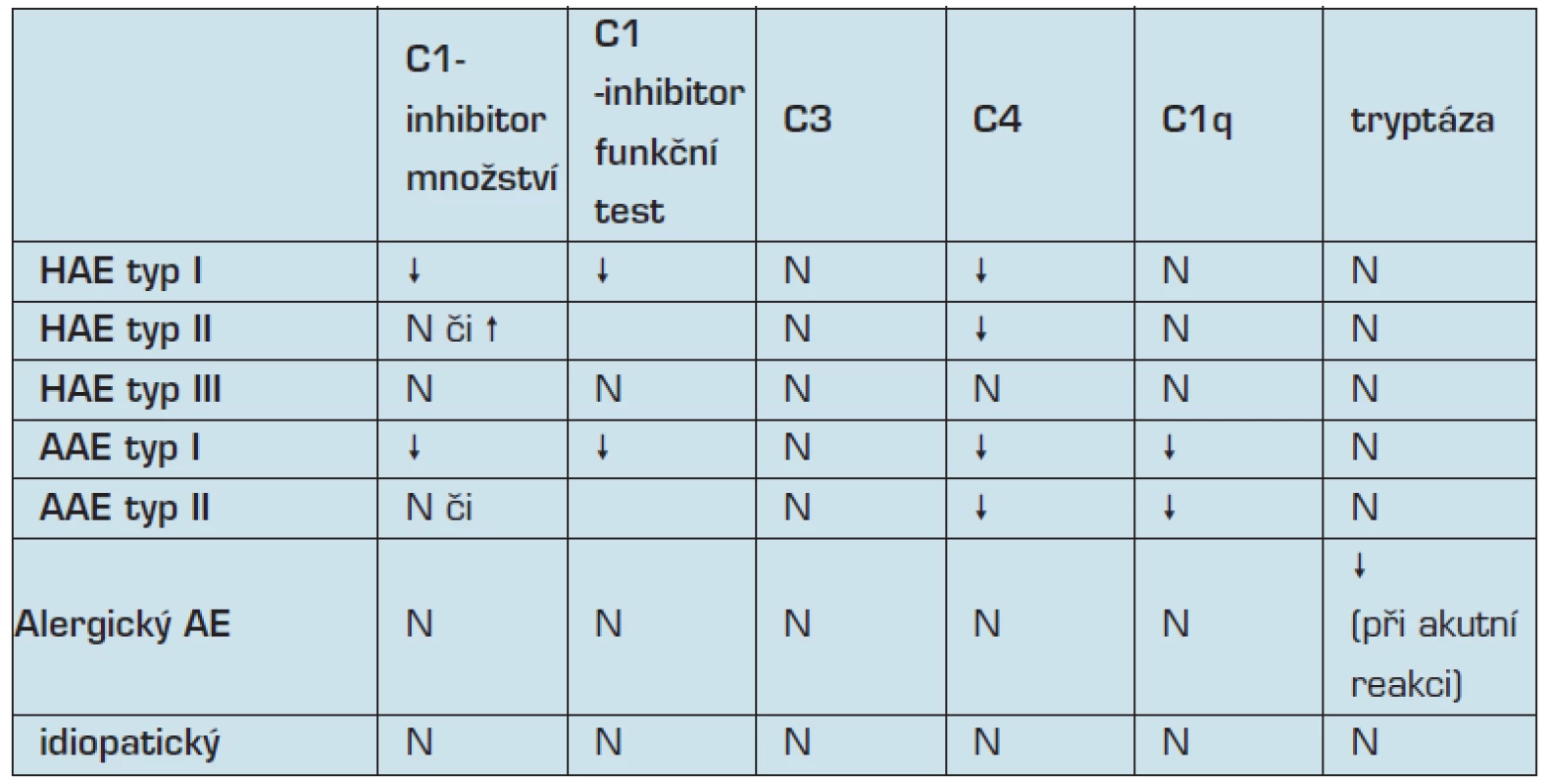
Diagnostika onemocnění je založena na kvantitativním stanovení snížené hladiny či funkční aktivity C1 inhibitoru ve dvou vzorcích se vzájemným odstupem 1 až 3 měsíců. Jako screeningové vyšetření je vhodné (jako dostupné a zároveň finančně nenáročné) využít stanovené sérové hladiny C4 složky komplementu. Jeho normální hladina prakticky vylučuje možnost hereditárního angioedému. K definitivní diagnóze je možné využít genetického vyšetření (7). Podrobnější laboratorní diagnostiku shrnuje (tabulka č. 2).
Genetické poradenství: Jedná se o onemocnění s vysokou penetrancí (až 95 % nositelů mutace rozvíjí někdy v průběhu života klinické příznaky onemocnění), nicméně s velmi variabilní tíží příznaků, které se mohou významně lišit od ostatních postižených členů rodiny. Prenatální diagnostika je možná, i když využívaná jen v ojedinělých případech. Je možné využít biopsii choriových klků či amniocentézu v případě, že je známá příčinná mutace u rodičů. Další možností je i preimplantační genetická diagnostika u plánovaného IVF, tzn. následně se implantují pouze embrya bez prokázané mutace. Jedná se však o postup zatížený rizikem hormonální stimulace, vysokou cenou, a pravděpodobnost otěhotnění je poměrně nízká (9).
Diagnostika u novorozenců a malých dětí: Hladina C1 inhibitoru dosahuje definitivních koncentrací kolem 3. roku věku, proto je u mladších lépe využít genetické vyšetření. Genetické testování novorozenců je možné z periferní či pupečníkové krve. Výhodou je časná identifikace první ataky postiženého dítěte. Rutinně se opět neprovádí. Záleží na přání rodičů (9).
Klinická klasifikace hereditárního angioedému
- I. typ (85 % případů) – nacházíme sníženou koncentraci C1inhibitoru za současného snížení C4 složky komplementu;
- II. typ (15 % případů) – normální či zvýšené hladiny C1 inhibitoru, který je dysfunkční;
- III. typ (velmi vzácný) – estrogen dependentní, s normálními hladinami C1 inhibitoru i C4 složky komplementu. U části nemocných byla odhalena funkční mutace v genu pro FXII, který je umístěn na 5. chromozomu. Tato mutace ve svém důsledku vede k nadměrnému hromadění bradykininu. Hladina FXII je zásadním způsobem regulována estrogeny, a proto dochází ke klinické manifestaci právě v průběhu těhotenství či v souvislosti s užíváním estrogenní hormonální léčby. Klinicky se projevy neliší od hereditárního angioedému, včetně silných abdominálních bolestí provázených ascitem. V ojedinělých případech vede i k úmrtí plodu (33, 13, 7).
Klinický obraz
Ke klinické manifestaci onemocnění může dojít v jakémkoli věku. S prvními projevy se četně setkáváme kolem 10. roku věku, typicky se zvýšením frekvence atak v peripubertálním období. Spouštěcími mechanizmy pro vznik otoků bývají lokální fyzikální působení (mechanické trauma, či iatrogenně-stomatologický výkon, endoskopické vyšetření, intubace), infekce, nelze opomenout ani psychické vlivy (stres). Z farmak to pak bývá nasazení hormonální léčby s obsahem estrogenů či léčba ACE inhibitory. Otoky se rozvíjejí během několika hodin, přetrvají obvykle déle než 12 hod, často 2–3 dny a poté spontánně vymizí. Nejčastěji postihují podkoží v oblasti obličeje, končetin a genitálu. Jsou bělavého charakteru a nesvědí. Nemocní spíše popisují velmi nepříjemné pnutí až bolest. Nekonstantně můžeme zaznamenat v prodromálním stádiu i mimo něj kožní změny charakteru mapovitých obrazců na kůži, nazvané erythema marginatum. V oblasti gastrointestinálního traktu vedou k vyčerpávajícím, krutým, křečovitým bolestem, které bývají provázeny zvracením a vodnatými průjmy. V jejich důsledku dochází k významné hemokoncentraci s nebezpečím vzniku hypovolemického šoku. Pacienti s takovými projevy jsou často vyšetřováni a operováni s podezřením na náhlou příhodu břišní. Na rozdíl od nich však kromě známek hemokoncentrace nenacházíme leukocytózu či vysoký C-reaktivní protein (CRP). Z klinických zkušeností vyplývá, že pacienti jsou sice prvních 72–96 hodin po atace refrakterní k dalšímu vzniku otoku, ale s větším odstupem jsou v důsledku invazivních vyšetřovacích metod vystavováni významnému riziku vyvolání dalšího záchvatu (35).
Nejrizikovější je vznik otoku v oblasti laryngu, uvuly, měkkého patra či jazyka, které mohou končit bez adekvátní pomoci úmrtím. Klinicky však může docházet k manifestaci v řadě dalších orgánů (CNS – s projevy bolestí hlavy a pestrými neurologickými nálezy, dále pak urogenitálního traktu, svalů, kloubů apod.) (7, 28).V průměru je zaznamenáván těžší průběh u žen a u pacientů s časnou manifestací (4). Pro lékaře pečující o tyto nemocné je důležité si uvědomit, že i nemocní, kteří po mnoho let rozvíjejí pouze projevy kožní či gastrointestinální, jsou v doživotním riziku vzniku otoku i v oblasti laryngu.
Léčba
Po stanovení diagnózy je nezbytné s nemocnými navázat úzkou spolupráci. Opakovaně vysvětlit podstatu onemocnění, rizika a možnosti léčby. U dětí je vhodné pomoci při volbě zaměstnání a výběru volnočasových aktivit s vynecháním kontaktních sportů s rizikem traumatických příhod. Nelze opomenout i možnost vstoupit do pacientské organizace, která v naší republice sdružuje nemocné s hereditárním i získaným angioedémem. Je napojena na mezinárodní organizaci a je schopna svým členům poskytnout řadu cenných rad, včetně právní pomoci.
Léčbu je třeba členit na léčbu preventivní a léčbu akutní ataky. Svá specifika má léčba angioedému v dětství a v průběhu gravidity, porodu či kojení.
Dlouhodobá profylaxe je indikována u klinicky závažných případů. Vždy je třeba zohlednit četnost a závažnost atak, postižený orgán, ale i přání pacienta ve smyslu jeho vnímání snížení kvality života, dnů pracovní neschopnosti či strachu ze závažných atak (15). Nezbytné je vyvinout maximální snahu o redukci spouštěčů atak: léčba infekčních fokusů, eradikace Helicobacter pylori, kontraindikace podání ACE inhibitorů a estrogenní hormonální léčby, u žen s estrogen dependentním karcinomem prsu by měla být dávána přednost inhibitorům aromatáz (např. letrozolu) před antiestrogeny (tamoxifen) pro možnost jejich duálního působení na estrogenní receptory. V profylaxi je lékem první linie kyselina tranexamová. Inhibuje aktivaci plazminogenu a tím snižuje počet a sílu atak. Její efektivnost je však poměrně nízká. Před dlouhodobým podáváním je vždy vhodné vyloučení trombofilních stavů. Jako nežádoucí účinek může působit nauzeu, závratě, průjem a stavy vyčerpání. Profylaktické dávkování dospělých činí 1g 3x denně (5 ,8).
Další lékovou skupinou používanou v dlouhodobé profylaxi jsou atenuované deriváty androgenů, v podmínkách České republiky (v rámci schválení zvláštního dovozu revizním lékařem) danazol, který zvyšuje syntézu C1 - inhibitoru v játrech. Úvodní podávaná dávka je 400–600 mg/den, kterou se snažíme postupně snižovat na nejnižší účinnou dávku (např. 100 mg 3x týdně). Tato léková skupina však není vhodná pro děti, ženy ve fertilním věku či v průběhu těhotenství a kojení. Provází ji četné nežádoucí účinky (přírůstek hmotnosti, akné, hirzutizmus, poruchy menstruačního cyklu, hypertenze, hepatopatie ve formě peliózy či adenomů, poruchy metabolizmu lipidů s akcentací aterosklerózy a nelze opominout ani zvýšení rizika trombembolizmu či intrakraniální hypertenze, apod. Při používání obou skupin léků pravidelně kontrolujeme jaterní testy, lipidy a provádíme UZ jater (8).
Kromě dlouhodobé profylaxe lze zvolit profylaxi nárazově před plánovaným rizikovým výkonem (stomatologické ošetření, endoskopické vyšetření, operace, porod), a to tranexamovou kyselinou v dávce 4 g/den u dospělého podanou ode dne -2 do dne +2, či častěji danazolem 600 mg ode dne -5 do dne +3 po výkonu. V současné době je však dávána jednoznačně přednost použití koncentrátu C1 inhibitoru 500-1000j i.v. před výkonem (18).
Třetí formou je profylaxe intermitentní podávaná v rizikových obdobích života pacienta (infekce, menstruace, stres) (5, 8,10, 23).
Léčba akutních atak
Léčba akutních atak prodělává v současné době v naší zemi zásadní legislativní změny. Léky první volby pro dospělé pacienty jsou v současné době icatibant a conestat alfa. Předpisem oba vázány na léková centra (tab. č. 3.)
Icatibant je selektivní kompetitivní antagonista bradykininových receptorů typu 2 (B2). Jedná se o syntetický dekapeptid, strukturálně velmi podobný bradykininu. Aplikuje se podkožně do oblasti břicha, přičemž jednotlivá dávka činí 30 mg účinné látky a počet podání je závislý na klinickém obrazu. K plné úlevě od příznaků dochází v průměru do 4 hodin od podání. Byl schválen i pro domácí použití samotným pacientem bez nutného dozoru zdravotnického personálu. Nežádoucí reakce se vyskytují nečetně až na poměrně frekventní nezávažné lokální, samovolně odeznívající reakce v místě aplikace (2, 12, 20,26).
Rekombinantní C1 inhibitor (conestat alfa) je získáván z mléka geneticky manipulovaných králíků. Je čištěný řadou technik zahrnujících chromatografii a nanofiltraci k odstranění virů. Ze 70 % se shoduje v amininokyselinových sekvencích s lidským C1 inhibitorem a prokazuje obdobnou účinnost při dobré toleranci a minimu nežádoucích účinků, i když nelze samozřejmě vyloučit možnost anafylaktické reakce. Z těchto důvodů je indikován pouze u dospělých pacientů se zjištěnou negativní kožní reaktivitou v prick testech a současně i v séru nepřítomnou hladinou specifických IgE protilátek proti králičím alergenům. Nevýhodou kromě nezbytnosti opakovaného ověřování, zda nedošlo v průběhu léčby k senzibilizaci na králičí antigeny ( a to jedenkrát ročně či po 10 podáních), je i i.v. cesta podávání a kratší biologický poločas ve srovnání s přirozeným C1 inhibitorem. Výhodou pak beze sporu je jeho nižší cena. Dávka u osoby do 84 kg činí 50 j/kg, v případě nedostatečné klinické odpovědi může být podána dodatečná dávka (8,17).
Koncentrát C1 inhibitoru, do nedávné doby v naší republice používaný k prevenci i léčbě atak, je v současné době možno podat pouze v preventivní indikaci. K léčbě akutních atak je ho možné použít na základě platné legislativy pouze při kontraindikaci výše uvedených preparátů. Což v praxi odpovídá v převážné většině případů dětských pacientů, gravidních a kojících žen. Doporučovaná dávka činí 20j/kg, dávku dle efektu opakujeme (obvykle přehodnocujeme po 2 hodinách po podání). Ke zlepšení příznaků obvykle dochází do 30–60 minut. Příznaky zcela mizí do 24 hodin (2, 16, 18, 26). V případě podezření na náhlou příhodu břišní u pacienta s prokázanou diagnózou hereditárního angioedému je doporučováno v první řadě podání léku pro léčbu akutní ataky. Následovat byl pak mělo vyšetření markerů zánětu a zobrazovací vyšetření (UZ břicha). Teprve v druhé době volit chirurgické řešení.
Další možnosti léčby
V USA byl schválen pro léčbu akutních atak ecallantide, rekombinantní protein produkovaný kvasinkami Pichia pastoris, který váže plazmatický kalikrein a ve svém důsledku inhibuje přeměnu HMW kininogenu na bradykinin (15). Slibné se zdá jeho uplatnění v případě získaného angioedému s přítomnými autoprotilátkami (14). Jsou však hledány i další cesty např. ve formě mutant C1 inhibitoru. Jedná se o „varianty“ serpinů, které mají funkční neutralizační kapacitu ve vztahu k proteázám, a proto jsou schopny šetřit zbytkově přítomný přirozený C1 inhibitor (2).
Specifika žen fertilního věku
Puberta s nástupem menarche zhoršuje tíži i frekvenci atak HEA u 56, 7 % žen. Při indikaci kontraceptiv je jednoznačně kontraindikovaná jakákoliv estrogenní složka. Kromě bariérových metod je možné využít čistě progesteronové preparáty (s individuální snášenlivostí). Nitroděložní tělíska včetně Mireny bývají dobře tolerována. Progestiny ve vyšších dávkách (norethisteron, medroxyprogesteron) sice nezvyšují počet atak HEA, nicméně u současné dlouhodobé profylaktické léčby antiandrogeny hrozí významnější nežádoucí účinky). Koncepci je u žen v dlouhodobé profylaxi nezbytné plánovat s včasným vysazením zejména atenuovaných androgenů pro možnou virilizaci plodu (doporučovány 2 měsíce předem). Spontánní aborty a předčasné porody nejsou u četných atak vyloučeny. Příznaky HEA se v graviditě mohou mírnit, neměnit či naopak zintenzivnit. Frekvence atak v průběhu těhotenství není predikovatelná ani dle průběhu minulých těhotenství. Častěji se zhoršuje v o průběhu prvního trimestru (neuroendokrinní změny – nevolnosti, ukončení dlouhodobé profylaxe, vyšší sérové hladiny estrogenů). Druhý trimestr bývá nejklidnější. Ve třetím se opět frekvence atak může zvyšovat v důsledku estrogenů i placentárního laktogenu. Nelze také vyloučit spotřebu mateřského C1 inhibitoru sdíleného plodem. V průběhu porodu není plošná profylaxe obecně doporučována, záleží na charakteru vlastního onemocnění. Riziko otoků rodidel je nejvyšší během 72 hodin po porodu. Proto by ženy neměly být propuštěny do domácího ošetření před tímto limitem. Při použití kleští, vakuumextrakce či císařského řezu je nutná vždy profylaxe. Upřednostňovaná je jednoznačně epidurální anestezie.
Léčba v období těhotenství
Lékem první volby je přirozený koncentrát C1 inhibitoru, při jeho nedostupnosti čerstvě zmražená plazma. Těhotná žena by měla mít po celou dobu těhotenství u sebe dispozici minimálně 20U/kg C1 inhibitoru. U četných atak je na místě dlouhodobá profylaxe, opět koncentrátem C1 inhibitoru. Antiandrogeny jsou kontraindikované s ohledem na riziko virilizace plodu a s kyselinou tranexamovou nejsou dostatečné zkušenosti.
U 13 % žen se v období menopauzy ataky zmírňují, avšak u 32 % žen dochází ke zhoršení. Opětovně se musíme vyvarovat estrogenní složky HRT (9).
Závěr
Diferenciální diagnostika angioedémů není jednoduchá. Z pohledu léčby a potažmo prognózy nemocného je zásadní, zda se jedná o angioedém indukovaný histaminem či bradykininem. Podezření na angioedém indukovaný bradykininem musíme mít vždy, pokud se setkáme nemocným, který trpí periferními otoky bez urtikárie a/nebo faryngolaryngeálním otokem, které neodpovídají na léčbu optimálními dávkami adrenalinu, antihistaminik, a/nebo kortikoidů. Dále v případě abdominálních křečí, kdy ultrazvukové vyšetření odhalí ascites, ztluštění střevní stěny a zároveň negativní laboratorní známky zánětu nesvědčí pro možnost zánětlivé příhody břišní. Ostražití musíme být zejména u nemocných užívajících ACE inhibitory. V těchto případech je indikováno podání icatibantu, koncentrátu C1 inhibitoru, či při jejich nedostupnosti čerstvě zmražené plasmy.
Užitečné kontakty:
Občanské sdružení na ochranu pacientů s hereditárním angioedémem
www.hae-imuno.cz
www.vzacna-onemocneni.cz
www.allabouthae.com/consumer
MUDr. Pavlína Králíčková
Ústav imunologie a alergologie,
Lékařská fakulta a Fakultní nemocnice Hradec Králové
Sokolská 581
500 05 Hradec Králové
E-mail: pavlina.kralickova@fnhk.cz
Sources
1. Adam, A., Cugno, M., Molinaro, G., et al. Aminopeptidase P in individuals with a history of angio-oedema on ACE inhibitors. Lancet 2002, 359(9323), p. 2088–2089.
2. Antoniu, S.A. Therapeutic approaches in hereditary angioedema. Clinic Rev Allerg Immunol 2011, 41(1), p. 114–122.
3. Bas, M., Grepe, J., Shelter, K., et al. Therapeutic efficacy of icatibant in angioedema induced by angiotensin-converting enzyme inhibitors: a case series. Ann Emerg Med 2010, 56(3), p. 278–282.
4. Bork, K. Hereditary angioedema: New findings concerning symptome, affected organs, and course. Am J Med 2006, 119(3), p. 267–274.
5. Bowen, T. Management of hereditary angioedema: a Canadian approach. Transfus Apher Sci 2003, 29(3), p. 205–214.
6. Caldwell, J.R., Ruddy, S., Schur, P.H. Acquired C1 inhibitor deficiency in lymphosarcoma. Clin Immunol Immunopathol 1972, 1, p. 39–42.
7. Caballero, T., Baeza, M.L., Cabañas, R., et al. Consensus statement on the diagnosis, management, and treatment of angioedema mediated by bradykinin. Part I. Classification, epidemiology, pathyphysiology, genetics, clinical symptoms, and diagnosis. J Investig Allergol Clin Immunol 2011, 21(5), p. 333–347.
8. Caballero, T., Baeza, M.L., Cabañas, R., et al. Consensus statement on the diagnosis, management, and treatment of angioedema mediated by bradykinin. Part II. Treatment, follow-up, and special situations. J Investig Allergol Clin Immunol 2011, 21(6), p. 422-441.
9. Caballero T. International consensus and practical guidelines on the gynecologic and obstetric management of female patients with hereditary angioedema caused by C1 inhibitor deficiency. J Clin Immunol 2012, 129(2), p. 308–320.
10. Cicardi, M. How do we treat patients with hereditary angioedema. Transfus Apher Sci 2003, 29(3), p. 221–227.
11. Cicardi, M., Zanichelli, A. Acquired angioedema. Allergy Asthma Clin Immunol 2010, 6(1), p. 14.
12. Cicardi, M. Icatibant, a new bradykinin-receptor antagonist, in hereditary angioedema. N Engl J Med 2010, 363(6), p. 532–541.
13. Cichon, S. Increased activity of coagulation factor XII (Hageman factor) cause hereditary angioedema type III. Am J Hum Gen 2006, 79(6), p. 1098–1104.
14. Cugno, M. C1-inhibitor deficiency and angioedema: molecular mechanisms and clinical progress. Trend Mol Med 2009, 15(2), p. 69–78.
15. Craig, T. When is prophylaxis for hereditary angioedema necessary? Ann Allergy Astma Immunol 2009, 102(5), p. 366–372.
16. Craig, T.J. Efficacy of human C1 esterase inhibitor concentrate compared with placebo in acute hereditary angioedema attacks. J Allergy Clin. Immunol 2009, 124(4), p. 801-808.
17. Davis, B., Bernstein, J.A. Conestat alfa for the treatment of angioedema attacks. Ther Clin Risk Manag 2011, 7, p. 265–273.
18. DeSerres, J. Safety and efficacy of pasteurized C1 inhibitor concentrate (Berinet P) in hereditary angioedema: a review. Transf Apher Sci 2003, 29(3), p. 247–254.
19. Duerr, M., Glander, P., Diekmann F., et al. Increased incidence of angioedema with ACE inhibitors in combination with mTOR inhibitors in kidney transplant recipients. Clin J Am Soc Nephrol 2010, 5(4), p. 703–708.
20. Fincham, C.I. Bradykinin receptor antagonist - a review of the patent literature 2005-2008. Expert Opin Ther Pat 2009, 19(7), p. 919–941.
21. Frank, M.M., Juany, H. New therapies for hereditary angioedema: disease outlook changes dramatically. J Allergy Clin Immunol 2008, 121(1), p. 272–280.
22. Frank, M.M., Sergent, J.S., Kane, M.A., et al. Epsilon aminocaproic acid therapy of hereditary angioneurotic edema. A double-blind study. N Engl J Med 1972, 286(15), p. 808–812.
23. Gompels, M. M., Lock R.J., Abinun M., et al. C1 inhibitor deficiency: consensus document. Clin Exp Imunol 2005, 139(3), p. 379–394.
24. Haymore, B.R., Yoon, J., Mikita, C.P., et al. Risk of angioedema with angiotensin receptor blockers on patients with prior angioedema associated angiotensin-converting enzyme inhibitors: a meta-analysis. Ann Allergy Asthma Immunol 2008, 101(5), p. 495–499.
25. Hoover, T., Lippmann, M., Grouzmann, E., et al. Angiotensin converting enzyme inhibitor induced angio-oedema: a review of the pathophysiology and risk factors. Clin Exp Allergy 2010, 40(1), p. 50–61.
26. Christiansen, S.C. Update on therapeutic developments for hereditary angioedema. Allergy Astma Proc 2009, 30(5), p. 500–505.
27. Krejsek, J. Kopecký, O. Klinická imunologie. Hradec Králové: Nucleus, 2004, s. 181–196.
28. Kuklínek, P. Hereditární a získaný angioedém (deficit C1-INH). In: Špičák, V. a kol. Alergologie. Praha: Galén, 2004, s. 257–262.
29. Longhurst, H., Cicardi, M. Hereditary angio-oedema. Lancet 2012, 379(9814), p. 474–481.
30. Malde, B., Regalado, J., Greenberger, P.A. Investigation of angioedema associated with the use of angiotensin-converting enzyme inhibitors and angiotensin receptor blockers. Ann Allergy Asthma Immunol 2007, 98(1), p. 57–63.
31. Nussberger, J., Cugno, M., Cicardi, M., et al. Local bradykinin generation in hereditary angioedema. J Allergy Clin Immunol 1999, 104(6), p. 1321–1322.
32. Petrů V., Krčmová I. Anafylaktické reakace. Praha: Jessenius Maxdorf, 2006, s. 18-53, 60–67.
33. Picone, O., Donnadieu, A.C., Briket, F.G., et al. Obstetrical complications and outcome in two families with hereditary angioedema due to mutationn in the F12 gene. Obstet Gynecol Int 2010; 957507. Published online 2010 May 13. doi: 10.1155/2010/957507.
34. Quan, M. Case study. ACE inhibitor-induced angioedema. Clin Cornerstone 2009, 9(3), p. 34–35.
35. Rosen, F.S. Deficiencies of C1 inhibitor. Best Pract Res Clin Gastroenterol 2005, 19(2), p. 251–261.
36. Scheirey, C.D., Schulz, F.J., Shortsleeve, M.J., et al. Angiotensin-converting enzyme inhibitor-induce small-bowel angioedema: clinical and imaging findings in 20 patients. Am J Roentgenol 2011, 197(2), p. 393–398.
37. Špičák, V., Panzner, P. Alergologie. Praha: Galén, 2004, s. 246-252, 272–176.
38. Zingale, L.C, Castelli, R., Zanicheli,, A., Cicardi, M. Acquired deficiency of the inhibitor of the first complement component: presentation, diagnosis, course, and convential management. Immunol Allergy Clin North Am 2006, 26(4), p. 669–690.
Labels
General practitioner for children and adolescents General practitioner for adultsArticle was published in
General Practitioner

2012 Issue 7
- Advances in the Treatment of Myasthenia Gravis on the Horizon
- Hope Awakens with Early Diagnosis of Parkinson's Disease Based on Skin Odor
- Memantine in Dementia Therapy – Current Findings and Possible Future Applications
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Memantine Eases Daily Life for Patients and Caregivers
-
All articles in this issue
-
Základy kognitivní, afektivní a sociální neurovědy
XXI. Emoce a kognitivní funkce - Bradykinin-induced angioedema and its differential diagnosis
- First experience with undergraduate teaching of assessment medicine at medical faculties
- Narrative perspective in medicine
- Will we vaccinate against smoking?
- Evaluating the validity of select fall risk assessment tools in hospitalized elderly
- Comprehensive assessment of elderly in long-term care institutions
- Sublingual allergen immunotherapy – progress in the treatment of allergic rhinitis and conjunctivitis
- So called problem prone patients
- Gender differences in food preferences in adolescents - are they projected into consumption?
-
Základy kognitivní, afektivní a sociální neurovědy
- General Practitioner
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Bradykinin-induced angioedema and its differential diagnosis
- Evaluating the validity of select fall risk assessment tools in hospitalized elderly
- Sublingual allergen immunotherapy – progress in the treatment of allergic rhinitis and conjunctivitis
- So called problem prone patients
