Inhibitory protonové pumpy: nové molekuly, nové poznatky
Proton pump inhibitors – new mole-cules, new knowledge
Proton pump inhibitors are the most important drugs in the treatment of acid-related diseases. All proton pump inhibitors are weak bases selectively metabolized in an acid environment and blocking active proton pump function. Proton pump inhibitors provide effective treatment of gastroesophageal reflux disease, Helicobacter pylori eradication, functional dyspepsia, and NSAID-associated gastropathy. First-generation proton pump inhibitors include omeprazole, pantoprazole, and lansoprazole, with second-generation ones represented by esomeprazole and rabeprazole. While proton pump inhibitors differ in their pharmacokinetic properties, these differences do not necessarily have clinically relevant sequels. Generally, second-generation proton pump inhibitors provide a faster onset of effect, longer gastric secretion inhibition and, specifically, the effect of rabeprazole is less dependent on the route of administration and has a smaller effect on cytochrome P450 function. The effect of proton pump inhibitors, especially the first-generation ones, is modified by genetic variability of the CYP2C19 enzyme being significantly lower with rapid metabolizers. Proton pump inhibitors are very safe and immediate complications are exceptional. They can cause progression of gastritis in Helicobacter infection. Despite hypergastrinemia, they do not have a malignant potential. Their long-term use is associated with an increased risk of pelvic and hip fractures, community-acquired pneumonia, and clostridium infection. Proton pump inhibitors may reduce the effect of antiplatelet therapy with clopidogrel thus increasing the risk of recurrent cardiovascular events. Package leaflets for patients are generally not well structured and often lack important information.
Keywords:
proton pump inhibitors (PPI) – H2 receptor antagonists (H2RA) – physiology – equipotent doses – oesophageal reflux disease – Helicobacter pylori eradication – NSAID gastropathy – complications – interactions
:
J. Špičák
:
Klinika hepatogastroenterologie
; Přednosta: prof. MUDr. Julius Špičák, CSc.
; Institut klinické a experimentální medicíny, Praha
:
Prakt. Lék. 2013; 93(5): 207-216
:
Reviews
Hlavními medikamenty v léčbě acidopeptických onemocnění jsou IPP. Všechny IPP jsou slabé zásady selektivně se metabolizující v kyselém prostředí a blokující funkci aktivní protonové pumpy. IPP poskytují účinnou léčbu u refluxní nemoci jícnu, eradikace Helicobacter pylori, funkční dyspepsie a gastropatie z nesteroidních antirevmatik. IPP první generace zahrnují omeprazol, pantoprazol a lansoprazol, druhé generace esomeprazol a rabeprazol. IPP se liší ve farmakokinetických charakteristikách, tyto rozdíly však nemusí mít klinicky relevantní důsledky. Obecně IPP druhé generace zajišťují rychlejší nástup účinku, protrahovanější inhibici žaludeční sekrece a zejména účinek rabeprazolu je méně závislý na způsobu podávání a méně ovlivňuje funkce cytochromu P450. Účinnost IPP zejména první generace ovlivňuje genetická variabilita enzymu CYP2C19 a je významně nižší u rychlých metabolizátorů. IPP jsou velmi bezpečné a bezprostřední komplikace jsou výjimečné. U helikobakterové infekce vedou k progresi gastrititidy. Přes hypergastrinémii nemají IPP maligní potenciál. Jejich dlouhodobé podávání je spojeno s vyšším rizikem fraktur páteře a kyčlí, komunitních pneumonií a klostridiové střevní infekce. Mohou vést ke snížení účinnosti antiagregační léčby s clopidogrelem se zvýšeným rizikem recidivujících kardiovaskulárních příhod. Příbalové letáky jsou vesměs nevhodně konstruovány a chybí v nich často zásadní informace.
Klíčová slova:
inhibitory protonové pumpy (IPP) – antagonisté H2 receptorů (AH2R) – fyziologie – ekvipotence – refluxní nemoc jícnu – eradikace Helicobacter pylori – gastropatie u nesteroidních antirevmatik – komplikace – interakce
ÚVOD
Patologické souvislosti žaludeční acidity jsou známy od počátku civilizace. Léky, které ji ovlivňují, jsou jedny z nejužívanějších vůbec a z tohoto pohledu jsou jejich účinnost a bezpečnost trvale významná témata. V současné době máme k dispozici léky účinné, přesto však populační zatížení acidopeptickými chorobami a jejich komplikacemi včetně nádorových onemocnění neklesá. Významu také nabývají interakce léků snižujících aciditu s léky běžně podávanými u jiných indikací. Objevují se nové a nové poznatky, které by měla zohlednit klinická praxe. Napomoci tomuto procesu je cílem následujícího přehledu.
Hlavními medikamenty v léčbě acidopeptických onemocnění jsou inhibitory protonové pumpy (IPP). Jsou podstatně účinnější než antagonisté H (histamin) 2 receptorů (AH2R) a zatlačily všechny jiné léky ovlivňující žaludeční sekreci do pozadí. Jako první byl zaregistrován omeprazol v roce 1989 a následovaly jej lansoprazol (1995), pantoprazol (1997), rabeprazol (1999) a S-enantiomer omeprazolu v roce 2001. Registrace některých z nich u nás následovala bezprostředně, jiných, například posledních dvou, s těžko pochopitelným zpožděním.
IPP jsou různě substituované benzimidazoly a slabé zásady, které se proto jako primárně neúčinné pro-léky téměř výlučně akumulují v kyselém prostředí parietálních buněk žaludku. Jejich disociační konstanta (pKa) je přibližně 4 u omeprazolu a lansoprazolu, 3,9 u pantoprazolu a 5 u rabeprazolu. V opačném poměru probíhá jejich konverze: rabeprazol 4,71 > omeprazol 4,09 > lansoprazol 3,92 > pantoprazol 3,89. Zde dochází k jejich přeměně na kyselinu sulfonovou a deriváty sulfenamidů, které se vážou na SH skupiny cysteinových reziduí na α-podjednotce protonové pumpy, tj. H+K+ATP-áze. Vazebná místa jednotlivých prazolů, a tedy typy cysteinových podjednotek, jsou různá. Kovalentní inhibice enzymu H+K+-ATP-ázy vede k specifickému a dlouhodobému zablokování této jedinečné pumpy, která pracuje proti iontovému gradientu 1 : 1 000 000 s výsledkem pH 0,8–1,0 uvnitř kanalikulu parietální buňky. IPP jsou nejaktivnější při plné sekreci HCl postprandiálně, což má bezprostřední klinický důsledek. Protože protonová pumpa je nejaktivnější po dlouhodobém lačnění, IPP by se měly s výjimkou rabeprazolu podávat před prvním denním jídlem. Bylo prokázáno, že při požití omeprazolu 30 minut před snídaní byla doba pH < 4,0, a tedy pro hojení slizničních lézí nedostatečná, pouhých 17,2 % z 24 hodin oproti 42,0 %, pokud jídlo nenásledovalo (1). Během jednoho jídla nejsou aktivní ani všechny parietální buňky ani všechny protonové pumpy. Protože IPP blokují pouze aktivní protonové pumpy, pokles sekrece po jednorázovém podání není optimální, a stane se tak až po několika dnech. Tento interval může být zkrácen při více denních dávkách. Z těchto důvodů nelze od příležitostného podávání on-demand očekávat dostatečný efekt na rozdíl od AH2R, které působí bezprostředně. Plné účinnosti IPP také brání současné podávání s jinými léky snižujícími sekreci. Poločas existence bílkoviny protonové pumpy je 54 hodin u krys a snad i u člověka, takže denně je syntetizováno přibližně 20 % nových pump. Po přerušení léčby nastává obnovení žaludeční sekrece za 24–48 hodin (2, 3).
SROVNÁNÍ INHIBITORŮ PROTONOVÉ PUMPY S ANTAGONISTY H2 RECEPTORŮ
Účinek AH2R je relativně krátkodobý a trvá 4–8 hodin s malou závislostí na požití jídla. K dosažení klinického efektu je často nutné podávat je ve více denních dávkách. Sekrece HCl po jídle je snížena podstatně méně, než je tomu u IPP. Další nevýhodou je tolerance, která se dostavuje již po 2 týdnech a podstatně snižuje účinnost léčby. Vysvětluje se zvýšenou sekrecí histaminu indukovanou gastrinem a up-regulací histaminových a gastrinových receptorů. Vhodná indikace AH2R je omezena na velmi mírné formy obtíží spojených s refluxní nemocí jícnu a někdy funkční dyspepsií. Mohou se uplatnit v kombinaci s podáním IPP, kdy se aplikují před nočním spánkem, což ovšem rozvoji tolerance nezabrání (4).
OMEPRAZOL
Podává se v racemické směsi dvou enantiomerů. Je acido-labilní a vyžaduje acidorezistentní úpravu. Rychle se vstřebává a jeho metabolity se vylučují převážně močí. Omeprazol je metabolizován játry enzymy cytochromu P450, zejména CYP2C19 na hydroxyl - a desmetyl-metabolity a CYP3A4 na sulfony. Polymorfismus CYP2C19 významně ovlivňuje jeho metabolismus (méně esomeprazolu – viz dále). Podle metabolické účinnosti enzymu lze klasifikovat jedince na homozygotní rychlé metabolizátory, heterozygotní rychlé metabolizátory a pomalé metabolizátory. Prevalence pomalých metabolizátorů je do 3,8 % v euroatlantické populaci a až 23 % v populaci asijské. Pomalá metabolizace vyúsťuje ve větší účinnost s násobně větší plochou pod křivkou (AUC – area under the curve) sledovaných funkčních parametrů. Tak například podle recentní studie byla expozice omeprazolu vyjádřena AUC po perorálním podání 40 mg 1 : 2,7 : 9,0 u homozygotních rychlých metabolizátorů, heterozygotních metabolizátorů a pomalých metabolizátorů. Rozdíly se poněkud smazávají ve stáří. Objevují se nové a nové varianty alel kódujících nefunkční proteiny (tab. 1).
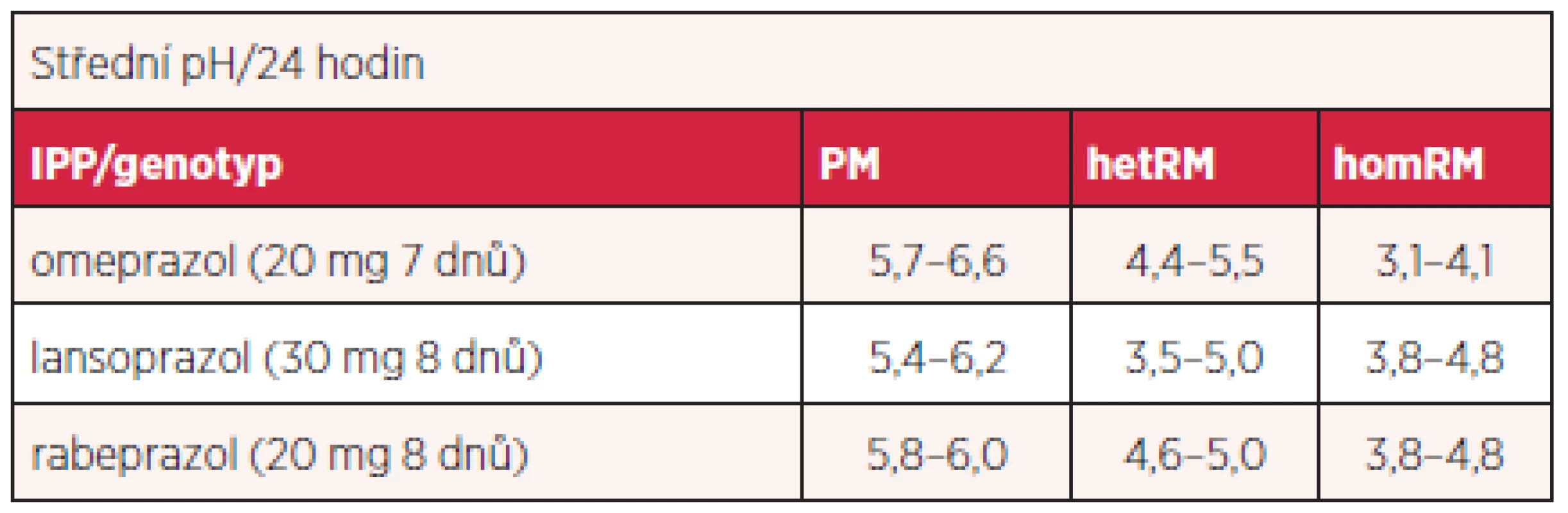
LANSOPRAZOL
Lansoprazol se rychle vstřebává a jeho farmakokinetika po opakovaném podávání je stejná jako po jednorázové aplikaci. Metabolizuje se enzymy CYP3A4 a CYP2C19, z čehož plyne problém interakcí, například s klaritromycinem, který zvyšuje jeho účinnost.
PANTOPRAZOL
I pantoprazol se po orální aplikaci enterosolventních tablet rychle vstřebává. Jeho vysoká biologická dostupnost není ovlivněna výší dávky ani příjmem jídla. Je metabolizován méně CYP2C19 a více CYP3A4 a nevykazuje interakce kromě těch, které vyplývají z potlačení kyselé žaludeční sekrece. Jeho hladinu klaritromycin nezvyšuje (5).
ESOMEPRAZOL
Většina léků se podává ve formě racemických směsí. Řada biologických procesů je ovšem prostorově selektivních, z čehož vyplývá, že prostorově opačně orientovaná „dvojčata“ mohou mít různou účinnost. Například receptory metabolizujících enzymů mohou preferenčně vázat jednu z obou prostorových variant (enantiomerů). Poměrně nedávno (ale s velkým zpožděním proti západoevropským zemím) byl na náš trh uveden S-enanthiomer omeprazolu – esomeprazol. Jeho specifickými vlastnostmi jsou vyšší biologická dostupnost, menší interindividuální variabilita a relativně odlišná metabolizace v játrech: Jestliže racemická směs omeprazol je z 90 % metabolizován CYP2C19, u esomeprazolu je to jen 70 %. Esomeprazol je relativně více metabolizován CYP3A4, a je tedy méně závislý na geneticky podmíněné variabilitě prvního z enzymů s možným důsledkem méně významné interakce, například s clopidogrelem. Podobně se zkoumají prostorově selektivní enanthiomery ostatních prazolů, ale zdá se, že žádný z nich nevykazuje komplexně příznivější předpoklady než užívané racemické směsi (6).
RABEPRAZOL
Rabeprazol je spolu s esomeprazolem představitel tzv. druhé generace IPP. Na náš trh byl uveden nedávno a s velkým zpožděním proti zemím západní Evropy. Jeho pKa1 je nejvyšší, tudíž je nejvyšší také jeho aktivace v sekrečním kanálku parietální buňky, a to i v méně kyselém prostředí. Parietální buňky vznikají na povrchu fundických žlázek a stárnutím migrují k jejich dnu, kde je acidita slabší. Rabeprazol se proto aktivuje v relativně větším počtu parietálních buněk než ostatní IPP. Neovlivňuje také negativně recyklaci jejich tubulovezikulárního aparátu. Inhibice protonových pump je při podávání rabeprazolu prakticky konzistentně 100 % ve srovnání s lansoprazolem (66–100 %), omeprazolem (47–83 %), a pantoprazolem (20–49 %) (7, 8). Rychle se vstřebává a jeho biologická dostupnost se dalšími dávkami nezvyšuje. Jeho farmakokinetické parametry se nemění u specifických věkových skupin, jako jsou malé děti a senioři, a neovlivňuje renální a jaterní dysfunkce. Současné podávání s jídlem zpomaluje jeho vstřebávání, ale neovlivňuje biologickou dostupnost tak výrazně jako ostatní IPP (9). V poslední době byla vyvinuta nová formule obsahující specifickou úpravu, umožňující uvolňování rabeprazolu bez ohledu na pH v celém průběhu tenkého i tlustého střeva, což zvyšuje dobu účinné koncentrace v plazmě. Bylo prokázáno, že nová formule poskytuje protrahovanější vzestup pH žaludku ve srovnání s esomeprazolem i běžnou úpravou rabeprazolu (10). Metabolismus rabeprazolu je jedinečný, protože se na inaktivní thioeter nemetabolizuje cytochromem P450. Účast CYP2C19 a CYP3A4 v jeho metabolizaci je menší než u ostatních IPP, takže jeho účinnost i interakce vykazují minimální ovlivnění polymorfismem těchto enzymů. AUC hodnoty u jednotlivých metabolizátorů byly 1,0 : 1,3 : 1,8, a tedy daleko méně rozdílné, než je tomu u omeprazolu.
JAK SE LIŠÍ JEDNOTLIVÉ IPP – EKVIPOTENTNÍ DÁVKY
Jednotlivé farmakokinetické a farmakodynamické vlastnosti se u IPP liší. Otázkou je, nakolik jsou tyto odlišnosti klinicky relevantní (tab. 2). Jednotlivé IPP byly vystaveny velkému počtu pre - i klinických studií s nutně kontraverzními výsledky. Obecně převládá názor, že účinnost v běžných indikacích je u všech dostatečná. Nicméně je zřejmé, že rabeprazol a esomeprazol dosahují rychlejší inhibice sekrece než ostatní IPP. Tyto léky by se proto měly upřednostnit například v případě podávání on-demand. Vzhledem k odlišné metabolizaci je u rabeprazolu a esomeprazolu inter-individuální variabilita méně významná a účinek předvídatelnější. Všechny prazoly jsou do určité míry metabolizovány v játrech cytochromem P450 a vykazují různou míru inhibice jeho enzymů CYP2C9, CYP2C19, CYP2D6 a CYP3A4, z čehož vyplývají další důsledky, například v oblasti lékových interakcí. Již před lety byla publikována studie srovnávající tento inhibiční potenciál in vitro na modelových reakcích. Největší míru inhibice dosahoval lansoprazol, zatímco pantoprazol a esomeprazol vykazovaly menší inhibiční aktivitu než omeprazol. Samotný rabeprazol vykazoval nízkou inhibiční aktivitu, ta je však do určité míry vlastní jeho metabolitu thioeteru (11). Je přirozenou snahou IPP srovnávat a u jednotlivých molekul stanovovat dávku se stejnou účinností (tzv. ekvipotentní dávky). Je to lákavý, avšak ne zcela definitivně dosažitelný cíl, neboť ve hře je celá řada různých faktorů – od genetických po nejasné definice cílů. Je otázkou, jak posuzujeme snížení žaludeční sekrece, či zda se orientujeme podle symptomů nebo endoskopických nálezů. Účinnost IPP stoupá s výší dávky, u jejich komplikací je tento vztah méně jednoznačný. Této skutečnosti bylo patrně chytře využito při deklarování základní terapeutické dávky u esomeprazolu v hodnotě 40 mg, která sama o sobě, bez ohledu na výhodný metabolismus S-enanthioimeru, zajišťuje vyšší účinnost. Lze očekávat, že i u nových preparátů se budou preferovat vyšší základní dávky, je tomu tak již u dexlansoprazolu (tablety o 30 a 60 mg) (12).
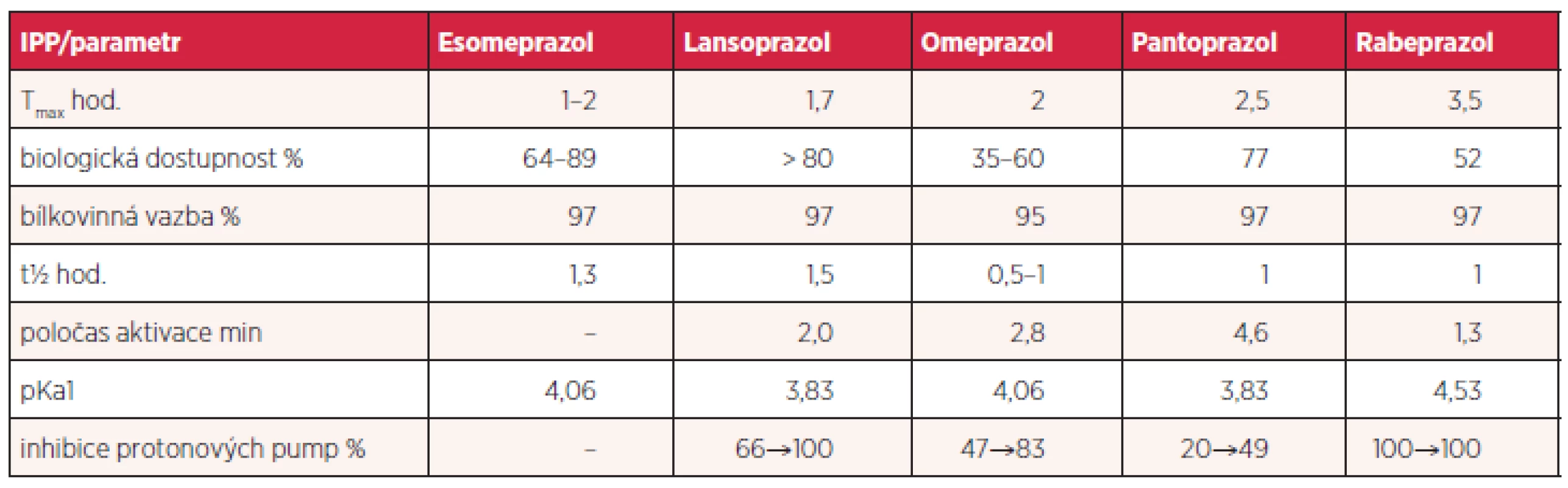
Mimořádně významná metaanalýza zahrnující celkem 57 studií srovnávajících vliv na žaludeční sekreci byla publikována Julií Kirchheiner v roce 2009. Jednotlivé studie byly zaměřeny na všechny běžně dostupné IPP v různých dávkách. Vliv na pH jednotlivých medikamentů byl srovnáván podle jednotného farmakodynamického vzorce. Konstatovala mimo jiné, že vliv na aciditu je ovlivněn přítomností refluxní nemoci jícnu a helikobakterové infekce. K dosažení stejné změny pH je u refluxní nemoci jícnu nutná 1,9krát vyšší dávka, naopak u helikobakterové infekce pouze 15% dávka ve srovnání s kontrolami. Při nárůstu dávky nestoupá efekt lineárně, ale parabolicky a nejstrměji u rabeprazolu. Podle zmíněného vzorce byla účinnost jednotlivých IPP ve srovnání s omeprazolem: pantoprazol 0,23, lansoprazol 0,902, esomeprazol 1,60 a rabeprazol 1,82. Jednotlivé národní a mezinárodní doporučené postupy se od sebe poněkud liší. WHO Collaborating Centre for Drug Statistics Methodology navrhuje základní dávkování u refluxní nemoci jícnu takto: omeprazol 20 mg, esomeprazol 30 mg, lansoprazol 30 mg, pantoprazol 40 mg a rabeprazol 20 mg. Canadian Association of Gastroenterology doporučuje při zahájení léčby erozivní ezofagitidy respektovat následující ekvivalenty: omeprazol 20 mg, lansoprazol 40 mg, pantoprazol 40 mg, rabeprazol 20 mg. FDA v léčbě symptomatické ezofagitidy udává tyto poměrné ekvivalenty: esomeprazol 1, lansoprazol 0,75, pantoprazol 2, rabeprazol 1 (13, 14).
REFLUXNÍ NEMOC JÍCNU
Cílem léčby obecně je léčba slizničních lézí, prevence rekurence a komplikací a úleva obtíží a zlepšení kvality života. Poslední cíle jsou více zvažovány v posledních letech s narůstajícím zájmem o ne-erozivní refluxní ezofagititidu a extraezofageální symptomatologii refluxu. Nejčastějším kritériem je žaludeční pH v důsledku nestandardizovaného hodnocení pH jícnového refluxátu. Nejčastějším zástupným markerem účinnosti jednotlivých farmak je doba, během které je pH žaludku > 4. Objevují se názory, že vhodnějším parametrem by bylo pH > 3, nebo dokonce > 2. Refluxní nemoc jícnu je primárně multifaktoriální motorická porucha, v jejímž důsledku, zjednodušeně řečeno, se obsah žaludku ve zvýšené míře dostává do oblasti jícnu. Abnormální expozice jícnu žaludečnímu obsahu, a tedy HCl není obvykle spojena s její hypersekrecí. Protože léky upravující dostatečně a specificky poruchu motility při refluxní nemoci jícnu chybí, léčba spočívá v aplikaci antisekreční léčby, přičemž klinická účinnost IPP převažující účinek AH2R byla prokázána jednoznačně v mnoha srovnávacích studiích (15, 16). Podle již historické metaanalýzy Chiby a kol. dosáhla léčba IPP vyhojení slizničních lézí u 85 % ve srovnání s 52 % úspěšností u AH2R (17), což je v přímé souvislosti s delším a hlubším útlumem sekrece HCl. Existuje řada studií srovnávajících jednotlivá IPP. Podle jedné z nich obsahující deset studií poskytuje esomeprazol přibližně o 5 % vyšší úspěšnost než ostatní bez přímého srovnání s rabeprazolem (18). Naopak v dalších studiích dosáhl rabeprazol nejvyšší 90% účinnosti (19). Protože jen 30 % nemocných s refluxní nemocí jícnu vykazuje slizniční erozivní změny, je úleva od obtíží hlavním cílem u zbývajících 70 % nemocných. Podle již citované studie Chiby 77 % nemocných udávalo při IPP úlevu po 8 týdnech léčby ve srovnání s 48 % uživatelů AH2R.
Srovnáním rabeprazolu s esomeprazolem se zabývá studie zaměřená na mírnou a střední formu erozivní ezofagititidy. Na rozdíl od většiny jiných studií se u obou skupin podával IPP v dávce 40 mg. Ve všech zkoumaných parametrech (symptomy, endoskopický nález, kvalita života) předčil rabeprazol esomeprazol statisticky významně. U endoskopického nálezu byl rozdíl v normalizaci 30 % a zlepšení 55 % ve prospěch rabeprazolu (20). Refluxní nemoc jícnu je jedním z nejběžnějších onemocnění, všechny účinné lékové skupiny jsou volně dostupné bez nutnosti preskripce, většinu lékařské péče poskytují praktičtí lékaři a důležitou roli hrají i ekonomické aspekty.
ERADIKACE HELICOBACTER PYLORI
IPP v násobné dávce jsou nedílnou součástí jakéhokoliv eradikačního schématu. Eradikaci hypoteticky ovlivňuje genotyp CYP2C19, protože u rychlých metabolizátorů omeprazolu a lansoprazolu lze očekávat sníženou účinnost inhibice žaludeční sekrece. Recentní metaanalýza zahrnující celkem 25 studií a 5998 nemocných se zabývala srovnáním výsledků při podávání IPP tzv. druhé generace, tj. rabeprazolu a esomeprazolu s ostatními IPP. Úspěšnost rabeprazolu činila 80,5 % vs. 76,2 %, úspěšnost esomeprazolu 82,3 % vs. 77,6 % a tento rozdíl se zvýšil při subanalýze esomeprazolu ve vyšším dávkování. Naopak rabeprazol potvrdil svoji vyšší úspěšnost i při nižším dávkování. Genetická subanalýza prokázala, že vyšší rozdíl v úspěšnosti mezi první a druhou generací IPP vykazují rychlí metabolizátoři (21). Zcela recentně byla publikována metaanalýza studií zaměřených na účinnost eradikace v souvislosti s variantami CYP2C19 zahrnující 16 studií. Byly zjištěny významné rozdíly mezi homozygotními a heretozygotními rychlými metabolizátory (OR 0,724), mezi homozygotními rychlými a pomalými metabolizátory (OR 0,507) i mezi heterozygotními rychlými a pomalými metabolizátory (OR 0,688). Subanalýza prokázala rozdíly mezi jednotlivými IPP: U omeprazolu byl rozdíl mezi homozygotními a heterozygotními metabolizátory OR 0,329, zatímco u lansoprazolu OR 0,692. Mezi homozygotními rychlými a pomalými metabolizátory byl o omeprazolu rozdíl OR 0,232, a u lansoprazolu OR 0,441. U esomeprazolu a rabeprazolu nebyla účinnost eradikace genetickými variantami ovlivněna. Rozdíl mezi generacemi v dosažení očekávaných výsledků vyznívá jednoznačně ve prospěch druhé generace, genetickou variabilitou je nejvíce zatížen omeprazol (22). Gastroenterologické pracoviště v Nagoy zavedlo genetické testování CYP2C19. Před tím byla účinnost eradikační léčby s lansoprazolem 80,0 %, po jeho zavedení se u rychlých metabolizátorů nasadila kombinace s rabeprazolem, který je na genetické variabilitě CYP2C19 méně závislý, a úspěšnost eradikace stoupla na 88,7 % (23).
V úspěšnosti eradikace ovšem hrají roli další faktory, z nichž nejvýznamnější je rezistence na antibiotika, a systémy eradikace se v posledních letech změnily ve prospěch sekvenčního a konkomitantního podávání farmak (24).
PREVENCE GASTROPATIE A JEJÍCH DŮSLEDKŮ
Aspirin a další nesteroidní antirevmatika (NSAID) jsou vůbec nejužívanější léky v populaci, ať už z indikace antiagregace či pro antirevmatické a analgetické působení. Jejich gastrotoxicita je různá, nicméně vychází z inhibice syntézy prostaglandinů a do určité míry z přímého poškození sliznice žaludku. Snižuje se angiogeneze, průtok kapilárami, produkce bikarbonátu a hlenu, agregace trombocytů, zvyšuje adherence leukocytů a zpětná difuze kyseliny. Výsledky jednotlivých studií se liší podle definice toxických lézí a způsobu detekce. Přibližné riziko gastrotoxicity u uživatelů nízkých dávek aspirinu ukazuje tabulka 3.
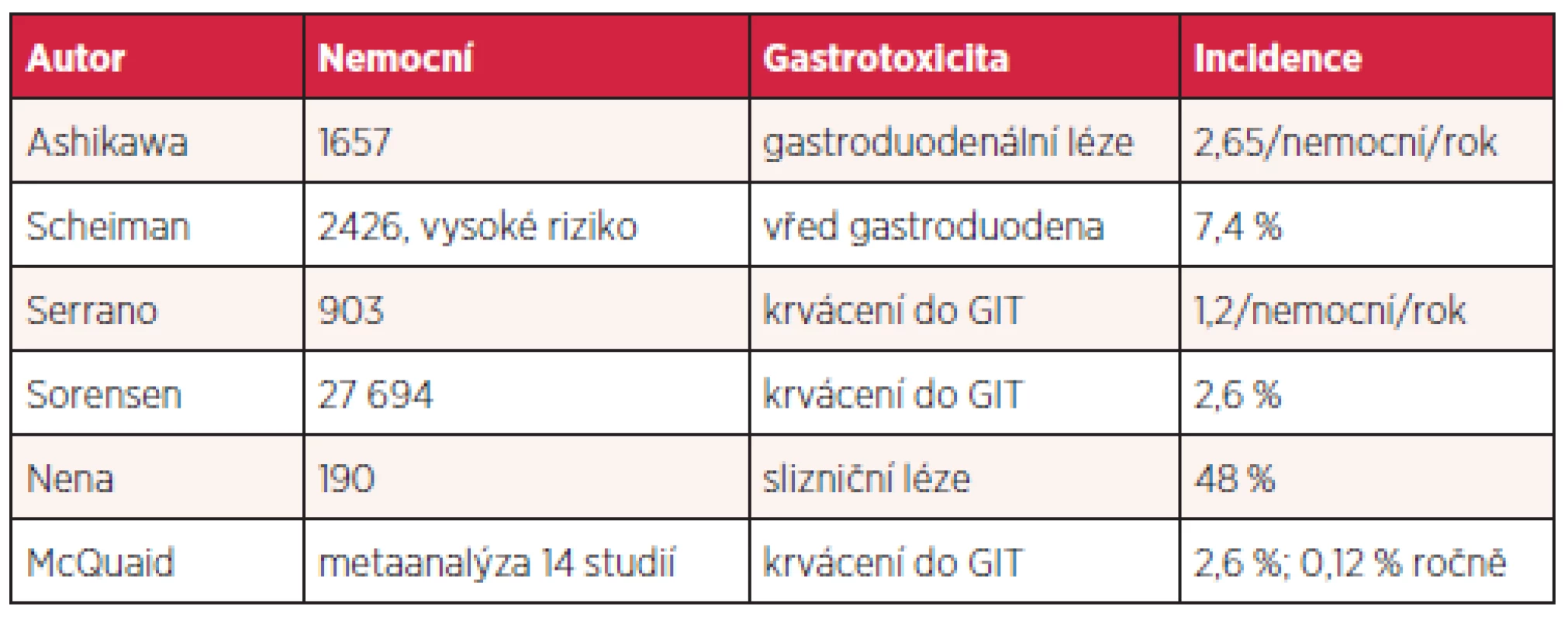
Ulcerózní léze po aspirinu se nejčastěji vyskytují v těle žaludku, na angulární řase a v bulbu duodena a bývají mnohočetné. Podle studie na dobrovolnících vznikají často již během prvních 24 hodin. Riziko lézí do určité míry závisí na dávce a též do určité míry protektivně působí enterosolventní úprava medikamentu.
V prevenci a léčbě gastropatie a jejích důsledků a komplikací připadá v úvahu podávání méně gastrotoxických COX-2 inhibitorů a simultánní podávání gastroprotektivních léků. Odůvodnění podávání prostaglandinů spočívá v substituci jejich deplece způsobené NSAID. Misoprostol (u nás není dostupný) redukuje žaludeční léze, avšak nemá vliv na případné dyspeptické obtíže a další vedlejší gastrointestinální účinky. V současné době se zkouší kombinace misoprostolu s diclofenacem v jedné tabletě. Na poškození žaludku při léčbě NSAID se podílí kyselý obsah a zvýšení pH hraje v prevenci a léčbě gastropatie zásadní roli. AH2R jsou účinné v hojení slizničních lézí, mají však malý vliv na doprovodné krvácení. IPP jsou účinnější, nejpřesvědčivější výsledky dosáhly esomeprazol a rabeprazol podobně jako v jiných indikacích. Zkouší se kombinace omeprazol a ketoprofen v jedné tabletě. Nevýhodou PPI je, že dostatečně nepůsobí na další komplikace NSAIDs jako kolopatie a enteropatie a v případě helikobakterové pozitivity negativně ovlivňují vývoj gastritidy.
Další možností je podávání COX-2 inhibitorů, nevýhodou je kardiotoxicita v důsledku inhibice syntézy prostacyklinu. Řada prací se zabývá mírou rizika gastrointestinálních změn u uživatelů aspirinu a dalších NSAID. Evropská metaanalýza kvalifikuje rizikové faktory na jednoznačné (vysoký věk nad 65–70 let, vřed v anamnéze, současné užívání antikoagulancií, kortikosteroidů, aspirinu a více druhů NSAID), kontraverzní (vysoké dávky NSAID, současné užívání clopidogrelu či SSRI – selective serotonin reuptake inhibitor, gastrointestinální symptomy v anamnéze, obtěžující revmatoidní artritida a choroby kardiovaskulární) a additivní, kterým je helikobakterová infekce (25). Jiná metaanalýza zjistila, že helikobakterová infekce zvyšuje riziko vředu gastroduodena u uživatelů NSAID 3,56krát a je nezávislým rizikovým faktorem. Eradikace je tedy žádoucí, nicméně stran další gastroprotekce se výsledky studií různí a spíše se zdá, že je nutná (26, 27). Vzhledem ke komplexnosti problému odůvodněné upřednostnění jednotlivého IPP není reálné. V prevenci se uplatňují AH2R i IPP (tab. 4) a přirozeně existují i studie srovnávací jednotlivé medikamenty.
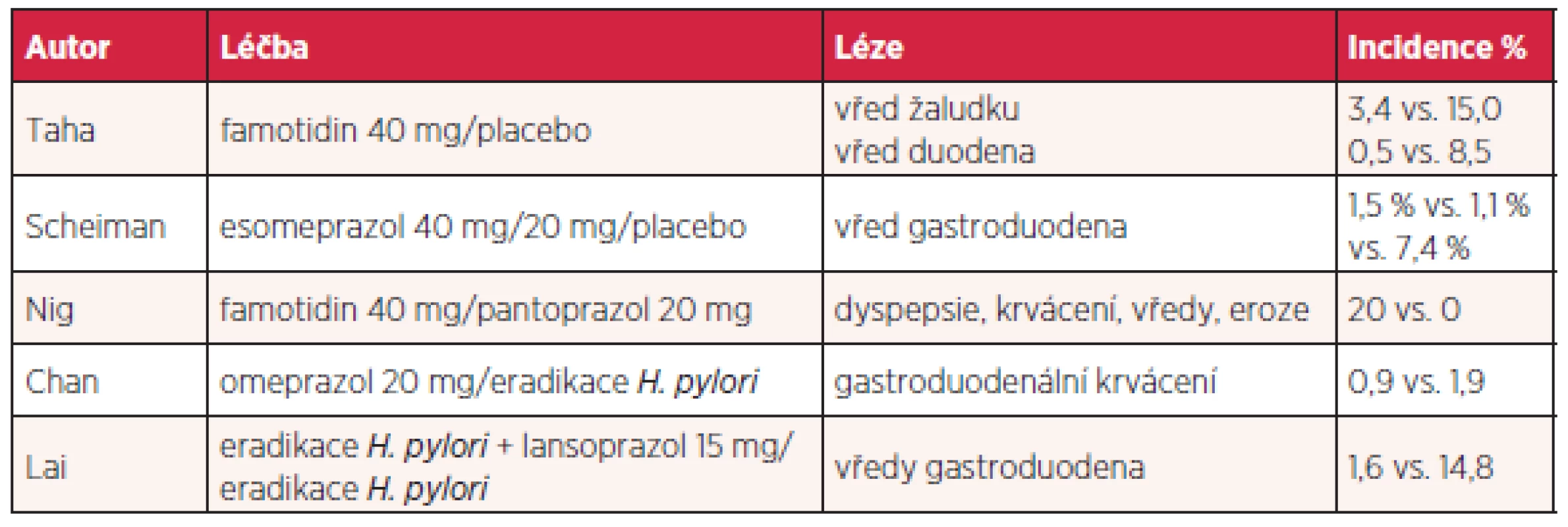
Problematiku konečně shrnuje podrobný doporučený postup Americal College of Gastroenterology. Konstatuje se, že u 25 uživatelů NSAD vzniká vřed, gastrotoxicita zapříčiňuje ročně v USA 100 000 hospitalizací a až 10 000 úmrtí. Rizikové faktory přibližně odpovídají evropské metaanalýze, zdůrazňuje se potřeba eradikace Helicobacter pylori. U AH2R se soudí, že zabrání vzniku vředu duodenálního, nikoliv však žaludečního a účinnější jsou ve vysokých dávkách. Podle jednotlivých srovnávacích studií IPP byly účinnější než AH2R i misoprostol, rozdíly mezi esomeprazolem 20 a 40 mg byly bezvýznamné. Léčba AH2R je levnější. COX-2 inhibitory snižují významně riziko gastropatie, ale tento efekt mizí při společném užívání aspirinu. Vždy se individuálně zvažují kardiovaskulární a gastrointestinální rizika (tab. 5) (28).
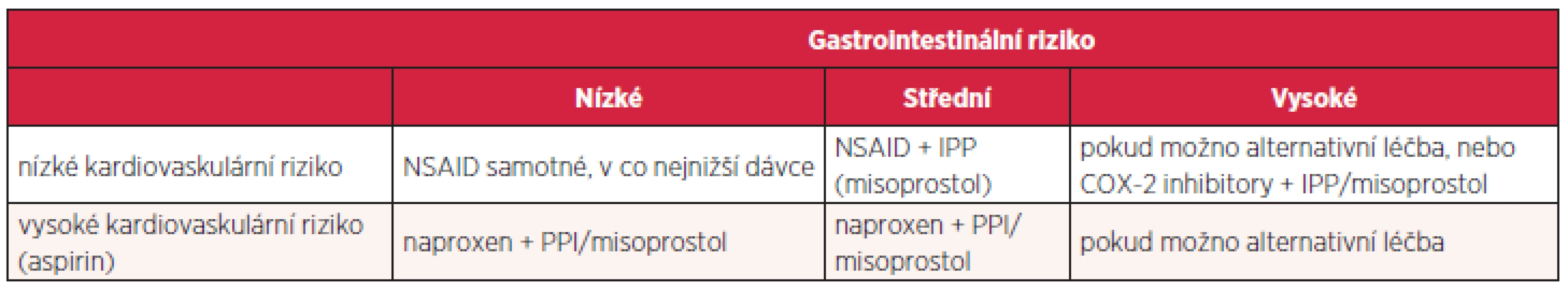
Střední gastrointestinální riziko: jeden nebo dva rizikové faktory; vysoké riziko: předchozí vřed, současné užívání kortikoidů či antikoagulancií nebo dva a více dalších rizikových faktorů. Naproxen vykazuje kardioprotektivní a nikoliv kardiotoxické vlastnosti.
Pozoruhodným fenoménem je NSAID enteropatie. Vzniká s odstupem, podílí se na ní enterohepatální oběh NSAID, změny v metabolismu prostaglandinů a gram-negativní bakterie. IPP enteropatii zhoršuje výskyt vředů v důsledku snížení acidity žaludku a změn bakteriálního složení. Pomoci může misoprostol (29).
FUNKČNÍ DYSPEPSIE
Vzhledem k nejasné patogenezi a variabilitě dyspepsie ve všech ohledech je nutné brát výsledky studií obecně s nadhledem. Ve srovnávací studii s esomeprazolem po vyřazení nemocných s refluxem a pozitivitou Helicobacter pylori se účinek IPP nelišil od placeba (30). Systematická analýza studií srovnávajících IPP s placebem obsahuje čtyři práce zahrnující 2032 nemocných. Rozdíl v úspěšnosti (33 % vs. 23 %) byl statisticky významný. Výsledky nebyly závislé na dávce IPP. Několik doporučených postupů vyznívá v souhrnu přibližně takto: IPP jsou indikovány jako lék první volby v oblastech s nízkou prevalencí helikobakterové infekce a dále tam, kde příznaky přetrvávají po její eradikaci. Dávka má být standardní, ale v případě úspěchu má být držena na co nejnižší úrovni, naopak v případě snížení účinnosti může být zdvojnásobena. IPP jsou vhodné zejména u pseudoulocerózní dyspepsie a pyrózy. V případě pozitivního účinku lze po 4–8 týdnech zvážit převedení na AH2R (31). Randomizovaná studie s omeprazolem, ranitidinem a placebem prokázala nejvyšší účinnost u omeprazolu (32).
KOMPLIKACE
Vzhledem k objemu veškeré medikace jsou IPP léky neobyčejně bezpečné. Vážné bezprostřední komplikace jsou mimořádně vzácné a zahrnují ojedinělé případy intesticiální nefritidy po omeprazolu, hepatitidy po omeprazolu a lansoprazolu a poruch vidění po pantoprazolu a omeprazolu. Nicméně dlouhodobé podávání je zvažováno v souvislosti se zvýšeným rizikem řady vážných onemocnění (33).
Obvyklé nezávažné komplikace se vyskytují u maximálně 5 % uživatelů IPP. Podle dat z více počátečních studií s omeprazolem se bolest hlavy vyskytla u 2,4 %, průjem u 1,4 %, nauzea u 0,9 % a urtika u 1,1 %, což přibližně odpovídá údajům při podávání AH2R. Podobný profil vedlejších účinků byl zaznamenán u pantoprazolu a rabeprazolu a v podstatě se nelišil od placeba v kontrolních skupinách.
Předpokládaný a sám o sobě fyziologický důsledek dlouhodobého podávání IPP je zvýšená hladina gastrinu. Je relativně vyšší při podávání rabeprazolu a lansoprazolu a relativně nižší při podávání pantoprazolu, rozdíly však nejsou významné (34).
GASTRITIDA A NEOPLAZIE ŽALUDKU
U osob bez helikobakterové infekce IPP nevyvolávají atrofickou gastrititidu a případný pre-existující zánět mohou dokonce zmírnit. U osob Helicobacter pylori pozitivních může podávání IPP vést k progresi zánětu a k změně antrum-predominantní gastrititidy na gastrititidu převážně lokalizovanou v oblasti těla žaludku. Eradikace Helicobacter pylori může vést k regresi zánětlivých změn, výsledky jednotlivých studií však nejsou zcela jednoznačné (35). Poslední konsenzuální konference o helikobakterové infekci doporučila eradikaci u nemocných s předpokládanou dlouhodobou léčbou IPP (36).
Bylo zmíněno, že podávání IPP vede k hypergastrinémii nezávisle na infekci Helicobacter pylori. Zvýšení počtu enterochromafiních-like buněk (ECL) hypoteticky v důsledku hypergastrinémie není v jednotlivých studiích jednoznačné. Významnou informaci poskytuje LOTUS trial srovnávající vliv dlouhodobé medikace esomeprazolem a fundoplikace. Při podávání esomeprazolu došlo u helikobakter pozitivní podskupiny během 5 let k poklesu zánětlivé aktivity v antru a snížení koncentrace osídlení bakteriemi Helicobacter pylori. Změny v těle žaludku nebyly analyzovány. Ač došlo ke zvýšení koncentrace ECL buněk, nebyly zaznamenány dysplastické změny (37).
Gastrin vykazuje trofický vliv na gastrointestinální sliznici obecně a například u perniciózní anémie je vyšší riziko rakoviny žaludku. Naopak hypergastrinémie při Zollinger-Ellisonově syndromu obvykle nevede ke zvýšení počtu ECL a karcinom žaludku byl u tohoto onemocnění popsán zcela ojediněle. V souvislosti s hypergastrinémií také nebyl zaznamenán nárůst výskytu karcinoidu. V důsledku užívání IPP se objevuje hyperplazie parietálních buněk a zvýšený výskyt polypů z fundických žlázek (38). Podobně je tomu u helikobakterové infekce. Po eradikaci a vyloučení IPP dochází k regresi. Polypy z fundických žlázek nevykazují dysplastické změny a adenomy vznikají jen vzácně u familiární adenomové polypózy.
DEFICIENCE ŽELEZA A VITAMINU B12
Vzhledem ke snížené žaludeční sekreci může dojít ke snížení intestinální absorpce organického i anorganického železa, nicméně hyposiderémie a sideropenická anémie nevzniká. Důsledkem snížené kyselé sekrece dochází k snížení aktivace pepsinogenu, čehož důsledkem je snížení uvolňování vitaminu B12 vázaného na složky potravy. U starších osob s gastritidou může dojít ke snížené koncentraci B12. Ta bývá také redukována u Zollinger-Ellisonova syndromu, léčeného vysokými dávkami IPP. U mladších jinak zdravých osob ke snížení koncentrace vitaminu B12 nedochází (38).
OSTEOPORÓZA, OSTEOPENIE, FRAKTURY
V důsledku léčby IPP nedochází ke změnám metabolismu vitaminu D a vliv na absorpci kalcia je velmi variabilní. Hypoteticky snížení žaludeční sekrece vede ke snížení uvolnění ionizovaného, a tedy vstřebatelného kalcia z nerozpustných kalciových solí. Dlouhodobé užívání IPP zvyšuje riziko fraktur 1,62krát. Podle další studie bylo sedmileté a delší užívání spojeno s rizikem 4,55násobným. Hrozí zejména osteoporotické fraktury páteře a kyčlí. Podle recentní metaanalýzy jedenáct studií bylo riziko fraktur kyčle u uživatelů IPP (RR) 1,30, riziko fraktury páteře RR 1,56 a riziko fraktur obecně RR 1,16 bez ohledu na pohlaví. Užívání AH2R bylo zatíženo rizikem fraktur nesignifikantně (RR 1,12). Nicméně do statistik mohou zasahovat další faktory a specifická opatření se u uživatelů IPP nedoporučují (39).
HYPOMAGNEZÉMIE
Přibližně u více než 20 nemocných byla publikována hypomagnezémie obvykle také s hypokalémií a hypokalcémií manifestující se tetanickými křečemi. Je ovšem možné, že je výskyt hypomagnezémie podceněn, protože se hladina magnézia ne vždy stanovuje. Přesná příčina není jasná, pravděpodobně u disponovaných jedinců dochází ke snížení absorpce magnézia. Komplikace není závislá na výši dávky IPP. Na výskyt hypomagnézemie zareagovala ve Spojených státech FDA varovným prohlášením (40).
NOZOKOMIÁLNÍ A KOMUNITNÍ PNEUMONIE
Hypoacidita žaludku znamená snížení přirozené funkce baktericidního filtru. Dochází ke kolonizaci žaludku aerobními bakteriemi, jejich mikroaspiraci a následné kolonizaci dýchacích cest, nevyjasněně ovšem i bakteriemi v žaludku se nevyskytujícími. Byla publikována řada prací zabývajících se souvislostí léčby IPP s komunitními pneumoniemi a dalšími respiračními infekcemi. V roce 2008 se metaanalýza zaměřila na výskyt všech respiračních infekcí v sedmi kontrolovaných studiích. Jednotlivé infekce stejně jako diagnostické metody byly nedostatečně specifikovány. Pouze v jedné studii s vyšším dávkováním esomeprazolu bylo riziko statisticky významné. Celkové relativní riziko OR 1,42 nedosáhlo statistické významnosti (41). Další metaanalýza si kladla za cíl posoudit vliv IPP i AH2R na veškeré pneumonie. Zahrnovala osm studií a prokázala zvýšené riziko jak IPP (OR 1,27), tak AH2R (OR 1,22) (42). Běžné riziko komunitní pneumonie je přibližně 0,6 na 100 pacient – roků a užívání IPP je zvyšuje 1,89krát. Podle jiných názorů je krátkodobé užívání IPP rizikovější než dlouhodobé. IPP obecně nezvyšuje riziko nozokomiální pneumonie vyjma nemocných s nazogastrickou sondou. Podle recentní metaanalýzy zvyšovalo riziko současného podávání IPP riziko komunitní pneumonie 1,39krát, podávání vysoké dávky 1,50krát a podávání nízké dávky 1,17krát a tyto rozdíly byly statisticky významné. Konstatuje se, že lékaři by si měli být vědomi tohoto rizika a v případě hrozby komunitní pneumonie zvážit namísto IPP alternativní léčbu (43).
STŘEVNÍ INFEKCE
IPP nevykazují konzistentní vliv na střevní mikrobiom. Průjmy jsou nejčastější komplikací užívání IPP a také nejčastějším důvodem přerušení léčby, nicméně vztah ke změnám mikrobiomu nebyl u většiny případů prokázán. Zvyšuje se však riziko infekce salmonellou 2,6–11,2krát a kampylobacterem 1,7–11,7krát. Vztah mezi antisekreční léčbou a infekcí Clostridium difficile byl poprvé zmíněn v roce 1993. Clostridium difficile je nejčastější příčinou střevní infekce u hospitalizovaných pacientů. Riziko zvyšuje věk a užívání širokospektrých antibiotik. Důležitá vlastnost spor Clostridium difficile je rezistence, naopak vegetativní fáze je na kyselinu velmi senzitivní. Cuningham a kol. prokázal, že IPP zvýšilo riziko klostridiové kolititídy u hospitalizovaných 2,5krát (44). Recentně publikovaná metaanalýza zahrnula 30 studií a zjistila riziko klostridiové infekce zvýšené 2,15krát. Mechanismus je nejasný (45).
LÉKOVÉ INTERAKCE
Značná pozornost se v poslední době obrací k lékovým interakcím. IPP jako běžně dlouhodobě podávané léky se nevyhnutelně kombinují s jinými medikamenty, s nimiž se dostávají do interakce v důsledku styčných metabolických principů.
Farmakokinetické mechanismy interakcí se různí. Vyšší pH v trávicí trubici může vést k poruše absorpce. IPP vedou k snížení absorbce ketoconazolu a itraconazolu, nikoliv však fluconazolu. Pantoprazol snížil hladinu mykofenolátu-mofetilu (AUC) až o 30 %. Naopak, omeprazol zvyšuje absorbci bismutu při podávání dicitrát bismutát tripotassia. IPP zasahují do metabolismu inhibitorů proteáz podávaných u AIDS. Lansoprazol vedl ke snížení AUC atazanaviru o 90 %, omeprazol snižuje AUC indinaviru, nalfinaviru, darunaviru a fosamprenaviru. Naopak zvyšuje se biologická dostupnost penicilinů. Omeprazol, nikoliv pantoprazol, také zvyšuje biologickou dostupnost digoxinu o 10 % interakcí s cytochromem P450. Vliv (snížení clearence) na digoxin je podmíněn etnickou genetickou výbavou. Alterací renální eliminace mohou IPP zpomalit vylučování metothrexátu. Omeprazol zvyšuje AUC phenytoinu, nifedipinu a carbamazepinu o 26–89 %. Lansoprazol zvyšuje AUC tacrolimu. Zvýšenou afinitou k CYP2C19 jsou více zatíženy interakcemi omeprazol a lansoprazol než pantoprazol a rabeprazol. Opatrnost je na místě při současném podávání diazepamu, imipraminu a citalopramu, jejichž hladiny mohou být zvýšené. V případě užívání kumarinových preparátů se doporučuje monitorovat koagulační parametry. K vzájemnému zvýšení AUC může dojít při současném podávání omeprazolu a klarithromycinu (46).
Velmi významná je interakce s antiagregancii clopidogrelem a aspirinem. Clopidogrel se užívá jako alternativa či v kombinaci s aspirinem k redukci kardiovaskulárních příhod, zejména při akutním koronárním syndromu a po zavedení koronárního stentu. Clopidogrel není primárně ulcerogenní, zvyšuje však riziko krvácení z preexistujících lézí. Riziko krvácení při léčbě clopidogrelem je dvojnásobné proti běžné populaci a dvojnásobně také zvyšuje riziko dané podáváním aspirinu. Proto má být léčba antiagregancii u nemocných se zvýšeným rizikem doprovázena podáváním IPP. Clopidogrel se aktivuje v játrech cytochromem P450, jehož součástí je CYP2C19, kde dochází ke kompetici s IPP, což může vést ke snížení účinku antiagregační léčby a ke zvýšení rizika kardiovaskulárních příhod. Největším inhibitorem CY2C19 je lansoprazol s inhibiční konstantou Ki 0,4 až 1,5 µmol/l, následují omeprazol Ki 2–6 µmol/l, esomeprazol Ki 8 µmol/l, pantoprazol Ki 14–69 µmol/l a rabeprazol Ki 17 až 29 µmol/l. Pantoprazol je ovšem největším inhibitorem CYP3A4. CYP2C19 je značně variabilní a ohroženi jsou zejména nositelé afunkčních alel. Interakce zkoumaly desítky studií a metaanalýz, z nichž některé jsou zaměřeny na agregační vlastnosti trombocytů, jiné na genetiku a další na klinické důsledky. Agregometrii (index vazoaktivně stimulovaného fosfoproteinu nebo agregometrii stimulovanou adenosin difosfátem) zkoumalo více než 20 studií, 19 prokázalo statisticky významné snížené antiagregační aktivity, zatímco čtyři nikoliv. Nebyl zaznamenán vliv separovaného podávání farmak a ve třech srovnávacích studiích nebyly zaznamenány rozdíly mezi jednotlivými IPP (omeprazol, lansoprazol, pantoprazol a rabeprazol), jejich výsledky však byly různé. Z klinických studií 20 shledalo častější výskyt kardiovaskulárních příhod u IPP, zatímco 14 nikoliv. Tři metaanalýzy shledaly častější výskyt infarktu myokardu i závažných kardiovaskulárních příhod obecně, nedošlo však ke zvýšení mortality, v jedné byla mortalita u IPP častější. Dvě metaanalýzy se zabývaly jednotlivými IPP. Hulot shledal častější výskyt závažných kardiovaskulárních příhod u omeprazolu (RR 1,37), zatímco v metaanalýze Sillera-Matuly zaměřené na omeprazol a pantoprazol byly rozdíly nesignifikantní. Tři metaanalýzy zaznamenaly opačnou souvislost s výskytem interakcí a kvalitou metodiky studií (47).
Řada studií se naopak zabývala krvácením do GIT a vředovou nemocí v souvislosti s užíváním antiiagregační léčby a IPP, pouze dvě však byly randomizované. U šesti byla zjištěna významná redukce krvácivých příhod, u sedmi nikoliv a u tří byly výsledky s IPP horší. Obě metaanalýzy prokázaly významný projektivní účinek IPP (48).
Jediná dvojslepá randomizovaná studie byla ukončena předčasně pro finanční problémy sponzora. Zkoumala obvyklou duální antiagregaci v aktivní skupině v kombinaci s omeprazolem a zahrnula 3873 nemocných. Ve skupině s omeprazolem byl menší výskyt krvácivých příhod, v kar-diovaskulárních parametrech (smrt, infarkt myokardu, ischemická cévní mozková příhoda a koronární revaskularizace) nebyly mezi skupinami statisticky významné rozdíly (49).
Metabolická aktivita CYP2C19 je značně interindividuálně variabilní, což může vést k závažným klinickým důsledkům. Byla popsána řada genetických variant, z nichž alela CYP2C19*2 (nebo polymorfismus G681A) určuje 90 % pomalých metabolizátorů. Jejich nositelé (až 30 % Evropanů) vykazují sníženou účinnost clopidogrelu a zvýšený výskyt rekurujících kardiovaskulárních příhod ve srovnání s rychlými metabolizátory. CYP2C19 je také inhibován IPP, zejména omeprazolem a lansoprazolem.
Vlivem genetických variant na účinek clopidogrelu se zabývala řada studií a jedna recentně publikovaná metaanalýza zahrnující 23 studií a 11 959 nemocných. Nositelé alely CYP2C19*2 (28 %, n = 3418) vykázali 30% nárůst závažných kardiovaskulárních příhod ve srovnání s ostatními (9,7 % vs. 7,8 %, OR 1,29). Ještě vyšší rozdíl byl v mortalitě (1,8 % vs. 1 %) a trombóze stentů (2,9 % vs. 0,9 %). Riziko bylo stejné u homozygotů i heterozygotů a bylo nezávislé na výši kardiovaskulárního rizika. Uživatelé IPP (42 %) byli zatíženi větším rizikem závažných kardiovaskulárních příhod (21,8 % vs. 16,7 %; OR 1,41) a mortalitou (12,7 % vs. 4,4 %; OR 1,18). Tento rozdíl byl však ovlivněn mírou kardiovaskulárního rizika (50).
Byla publikována řada prací zkoumající předpokládané odlišné riziko interakcí mezi jednotlivými IPP a clopidogrelem. Japonští dobrovolníci užívali ve třech skupinách aspirin (A), clopidogrel (C), oba medikamenty (AC) a konečně obě látky s rabeprazolem (ACR) a prováděla se endoskopie, stanovení acidity a vyšetření aktivity trombocytů. Bylo zjištěno, že poškození žaludeční sliznice bylo podobné u A, C i AC skupin. Rabeprazol zvyšoval průměrné pH účinněji u helicobacter-pozitivních než helicobacter-negativních jedinců. Různým genotypům CYP2C19 odpovídalo u helicobacter-pozitivních jedinců různé poškození žaludeční sliznice, výdej kyseliny i funkce trombocytů a rabeprazol neměl na tyto výsledky vliv. Rabeprazol účinně snižoval slizniční poškození indukované duální terapií zejména u helicobacter-negativních intermediálních a pomalých metabolizátorů bez ovlivnění protisrážlivého účinku. Nebyl však dostatečně účinný u rychlých metabolizátorů. V budoucnu by kandidáti kombinované antiagregační léčby a IPP se zvýšeným rizikem krvácení měli podstoupit vyšetření genetiky CYP2C19 a u rychlých metabolizátorů by se dávka IPP měla zdvojnásobit (51).
Jiná studie zkoumala vliv esomeprazolu a rabeprazolu na antiagregační aktivitu clopidogrelu. U 239 nemocných se provedla genotypizace CYP2C19 a stanovila se agregace trombocytů při léčbě clopidogrelem (skupina C) a v kombinaci s esomeprazolem (CE) a rabeprazolem (CR). Index reaktivity trombocytů byl 20,7 ve skupině C, 19,1 ve skupině CR a 24,5 ve skupině CE. Výsledky nebyly ovlivněny genotypem CYP2C19 (52).
Na interakci IPP s antiagregancii reagují v doporučených postupech profesionální organizace a regulační úřady. American College of Gastroenterology a American Heart Association publikovali konsenzus v roce 2010. Instituce konstatují, že vliv IPP na antiagregační působení clopidogrelu je v jednotlivých studiích inkonzistentní a doporučují přístup podle individuálního gastroenterologického a kardio-vaskulárního rizika. FDA varuje před užíváním omeprazolu (i esomeprazolu) společně s clopidogrelem. Výslovně se udává, že varování neplatí pro ostatní IPP. Podobně se vyjadřuje European Medicines Agency. Nabádá, že v případě nutnosti u rizikových pacientů by se mělo IPP podávat v nejmenší účinné dávce. Toto doporučení poněkud postrádá logiku, uvědomíme-li si, že u rychlých metabolizátorů (genetické vyšetření se běžně neprovádí) je účinnost IPP snížena, a navíc krvácení u nemocných na antiagregační léčbě se obvykle objevuje bez varovných příznaků (49).
BUDOUCNOST INHIBICE ŽALUDEČNÍ SEKRECE
Přes spektakulární úspěch kontroly žaludeční sekrece IPP se přibližně u 20-30% nemocných očekávaný výsledek nedostavuje nebo je úspěch jen částečný za cenu zvýšení doporučené dávky. Je tomu tak zejména u refluxní nemoci jícnu a gastropatie z užívání nesteroidních antirevmatik. U řady nemocných je doba redukce žaludeční sekrece běžnou dávkou IPP nedostatečná, často v důsledku genetické predispozice (rychlí metabolizátoři).
Dalším snad i nejčastějším faktorem je nedostatečná compliance nemocných. Ideální preparát by měl dostatečně snižovat žaludeční sekreci v průběhu alespoň 20 hodin, užíval by se v jedné dávce, byl by prost vedlejších účinků a interakcí a jeho účinek by nebyl závislý na konzumaci potravy. Je zjevné, že jako všechny ideály je nedosažitelný, protože čím účinnější sekrece, tím nevyhnutelně větší riziko některých komplikací. Nadto neúspěch standardní léčby IPP mívá různou příčinu, což prosté zvýšení inhibice sekrece nevyřeší.
Tenatoprazol je imidazol-pyridin. Aktivuje se pomaleji než schválená IPP a jeho vazba je ireverzibilní. Jeho plazmatický poločas činí 6 hodin. Podobně působí ilaprazol.
Dex-lansoprazol je R-enantiomer lansoprazolu, který v důsledku prostorové orientace působí více protrahovaně než běžný lansoprazol. Příznivěji také vyznívají klinické studie s až 95% hojením erozivní refluxní ezofagititídy. Dex-lansoprazol byl již schválen FDA, avšak počet srovnávacích studií ve všech souvislostech je dosud nedostatečný.
Alevium je opět pro-léková forma omeprazolu, nicméně tento sulfonamidový derivát omeprazolu je acidorezistentní, pomalu se vstřebává v průběhu celého tenkého střeva, takže jeho poločas v plazmě je ve srovnání s omeprazolem podstatně delší.
Potassium-kompetitivní blokátory sekrece jsou imidazol pyridiny, které nevyžadují aktivaci kyselinou a jejich antisekreční působení je rychlé a dlouhodobé, nicméně výsledky klinických studií jsou dosud nepřesvědčivé.
Přes dobře zdůvodněné antagonistické působení různých principů inhibice sekrece vývoj spočívá i v jejich kombinování. IR (immediate-release) omeprazol kombinuje zmíněnou molekulu s bikarbonátem, který stimuluje protonovou pumpu. Zkouší se v podobě žvýkačky.
Objevují se nové kombinace AH2R, například emodin-kalcium karbonát a magnesium hydroxid. Ebrotidin vedle antisekrečního účinku chrání žaludeční epitel. Latifudin je dostupný v Japonsku a jeho účinek nastupuje velmi rychle, takže je lze užívat on-demand.
Spiroglumid a itriglumid jsou antagonisté gastrinových a CCK receptorů, které lze využívat v kombinaci s prazoly (53, 54).
INFORMACE NEMOCNÝM
Pro účinnou léčbu má vždy informovanost nemocných zásadní význam. Obecně optimalizuje spolupráci a správné užívání medikamentů, umožňuje předejít případně včas zareagovat na nežádoucí účinky a vyhnout se interakcím. U PPI je tato informovanost důležitá mimořádně, neboť správné podání léku ovlivňuje jeho účinnost zásadním způsobem. Je známo, že informace od lékařů je často nedostatečná, a autorovi tak přišlo na mysl přehlédnout doporučené postupy IPP, které jsou v České republice na trhu. Celkem prohlédl 17 příbalových letáků všech obvyklých molekul. Letáky se často od sebe významně liší, kupodivu velmi často bývají popsány jevy zcela podružné – jako nevýznamné komplikace a irelevantní interakce. Běžně se používají bez bližšího vysvětlení termíny jako AUC či CYP všeho druhu, kterýmžto běžný uživatel a čtenář nemůže rozumět. Naopak z informací důležitých jen u šesti byla zmínka o nutnosti podání před jídlem, nikoliv však před snídaní. Z významných interakcí a komplikací chyběla zmínka o clopidogrelu 7krát, metabolismu kostí 6krát, gastrointestinálních infekcích 7krát (a Clostridium difficile bylo zmíněno jen jednou), hypomagnezémie 6krát a informace o vhodné eradikaci Helicobacter pylori při dlouhodobém podávání IPP chybí úplně.
ZÁVĚR
Závěrem lze shrnout, že IPP poskytují účinnou léčbu u refluxní nemoci jícnu, eradikace Helicobacter pylori, funkční dyspepsie a gastropatie z nesteroidních antirevmatik u 70 až 80 % nemocných. Jejich farmakokinetické parametry se někdy výrazně liší, nicméně klinický efekt jednotlivých IPP je velmi podobný. Velmi zjednodušeně a přibližně lze soudit, že IPP nové generace, tj. rabeprazol a esomeprazol, zvyšují úspěšnost léčby přibližně o 5 %, což vzhledem k šíři problému není rozdíl zanedbatelný. IPP jsou celkově léky velmi bezpečné, jejich přímá toxicita je výjimečná. Závažné mohou být jejich interakce, a to zejména s podáváním antiagregační léčby, kdy může dojít ke zvýšení rizika závažných kardiovaskulárních příhod. Zde je riziko jednotlivých IPP různé, nejnižší patrně u rabeprazolu. Účinnost IPP je významně ovlivněna polymorfismem cytochromu P450 a genetické vyšetření se bude v budoucnu využívat ve zvýšené míře. Od nových IPP lze očekávat menší závislost na příjmu potravy a jistě i větší účinnost v inhibice sekrece, což se ovšem nemůže neprojevit na některých vedlejších účincích. Vždy je třeba mít na paměti, že žaludeční sekrece a vysoká acidita žaludku jsou primárně fyziologické fenomény.
ADRESA PRO KORESPONDENCI:
prof. MUDr. Julius Špičák, CSc.
Institut klinické a experimentální medicíny
Klinika hepatogastroenterologie
Vídeňská 1958/9, 140 21 Praha 4
e-mail: jusp@medicon.cz
Sources
1. Hatlebakk JG, Katz PO, Camacho-Lobato J, et al. Proton pump inhibitors: better acid supression when taken before a meal than without a meal. Aliment Pharmacol Ther 2000; 14(10): 1267–1272.
2. Sachs G. Proton pump inhibitors and acid-related diseases. Pharmacotherapy 1997; 17(1): 22–37.
3. Huang JQ, Hunt RH. Pharmacological and pharmacodynamic essentials of H2-receptor antagonists and proton pump inhibitors for the practicing physicians. Best Pract Res Clin Gastroenterol 2001; 15(3): 355–370.
4. Rackoff A, Agrawal A, Hilla A, et al. Histamine-2 receptor antagonists at night improve gastroesophageal reflux disease symptoms for patients on proton pump inhibitor therapy. Dis Esophagus 2005; 18(6): 370–373.
5. Martínek J, Lukáš M. Inhibitory protonové pumpy – up to date. Gastroent Hepatol 2011; 65(6): 331–342.
6. Andersson T, Weidolf L. Stereoselective disposition of proton pump inhibitors. Clin Drug Investig 2008; 28(5): 263–279.
7. Sachs G. Improving on PPI-based therapy of GORD. Eur J Gastroenterol Hepatol 2001; 13 Suppl. 1: S35–41.
8. Besancon M, Simon A, Sachs G, et al. Sites of reaction of the gastric H, K – ATP-ase with extracytoplasmic thiol reagents. J Biol Chem 1997; 272(36): 22438–22446.
9. Horn J. Review article: understanding the pharnacodynamic and pharmacokinetic differences between proton pump inhibitors – focus on pKa and metabolism. Aliment Pharmacol Ther 2006; 2(2): 340–350.
10. Morelli G, Chen H, Rossiter G, et al. An open-label, parallel, multiple-dose study comparing the pharmacokinetics and gastric acid suppression of rabeprazole extended-release with esomeprazole 40 mg and rabeprazole delayed-release 20 mg in healthy volunteers. Aliment Pharmacol Ther 2011; 33(7): 845–854.
11. Li XQ, Andersson TB, Ahlström M, et al. Comparison of inhibitory effects of the proton pump-inhibiting drugs omeprazole, esomeprazole, lansoprazole, pantoprazole and rabeprazole on human P450 activities. Drug Metab Dispos 2004; 32(8): 821–827.
12. Friedlander EA, Pallentino J, Miller SK, et al. The evolution of proton pump inhibitors for the treatment of gastroesophageal reflux disease. J Am Acad Nurse Pract 2010; 22(12): 674–683.
13. Kirchheiner J, Glatt S, Fuhr U, et al. Relative potency on proton-pump inhibitors-comparison of effects on intragastric pH. Eur J Clin Pharmacol 2009; 65(1): 19–31.
14. Klotz U. Clinical impact of CYP2C19 polymorphism on the action of proton pump inhibitors: a review of a special problem. Int J Clin Pharmacol Ther 2006; 44(7): 297–302.
15. Katz PO, Tutuian R. Histamine receptor antagonists, proton pump inhibitors and their combination in the treatment of gastro-oesophageal reflux disease. Best Pract Res Clin Gastroenterol 2001; 15(3): 371–384.
16. Pace F, Sonnenberg A, Bianchi Porro G. The lessons learned from randomized clinical trials of GERD. Dig Liver Dis 2007; 39(11): 993–1000.
17. Chiba N, De Gara CJ, Wilkinson JM, et al. Speed of healing and symptom relief in grade II to IV gastroesopohageal reflux disease: a metaanalysis. Gastroenterology 1997; 112(6): 1798–1810.
18. Vakil N, Fennerty MB. Direct comparative trials of the efficacy of proton pump inhibitors in the management of gastroesophageal reflux disease and peptic ulcer disease. Aliment Pharmacol Ther 2003; 18(6): 559–568.
19. Holtmann G, Bytzer P, Metz M, et al. A randomized, double-blind, comparative study of standard-dose rabeprazole and high dose omeprazole in gastro-oesophageal reflux disease. Aliment Pharmacol Ther 2002; 16(3): 479–485.
20. Maiti R, Jaida J, Israel PL, et al. Rabeprazole and esomeprazole in mild-to-moderate erosive gastroesophageal reflux disease: A comparative study of efficacy and safety. J Pharmacol Pharmacother 2011; 2(3): 150–157.
21. Altman KW, Prufer N, Vaezi MF. A review of clinical practice guidelines for reflux disease: toward creating a clinical protocol for the otolaryngologist. Laryngoscope 2011; 121(4): 717–723.
22. McNicholl AG, Linares PM, Nyssen OP, et al. Meta-analysis: esomeprazole or rabeprazole vs. first-generation pump inhibitors in the treatment of Helicobacter pylori infection. Aliment Pharmacol Ther 2012; 36(5): 414–425.
23. Tang HL, Li Y, Hu YF, et al. Effects of CYP2C19 Loss-of-function variants on the eradication of H. pylori infection in patients treated with proton pump inhibitor-based triple therapy regimens: A meta-analysis of randomized clinical trials. PLoS One 2013; 8(4):e62162. doi: 10.1371/journal.pone.0062162.
24. Tamura T, Kurata M, Inoue S, et al. Improvements in Helicobacter pylori eradication rates through clinical CYP2C19 genotyping. Nagoya J Med Sci 2011; 73(1-2): 25–31.
25. Selgrad M, Bornschein J, Malfertheiner P, et al. Guidelines for treatment of Helicobacter pylori in the East and West. Expert Rev Anti Infect Ther 2011; 9(8): 581–588.
26. Tielemans MM, Eikendal T, Jansen JB, et al. Identification of NSAID users at risk for gastrointestinal complications: a systematic review of current guidelines and consensus agreements. Drug Saf 2010; 33(6): 443–453.
27. Iwamoto J, Saito Y, Honda A, et al. Clinical features of gastroduodenal injury associated with long-term low dose aspirin therapy. World J Gastroenterol 2013; 19(11): 1673–1682.
28. Laine L. Review article: gastrointestinal bleeding with low-dose aspirin-what´s the risk? Aliment Pharmacol Ther 2006; 24(6): 897–908.
29. Lanza FL, Chan FK, Quigley EM, et al. Guidelines for prevention of NSAID-related ulcer complications. Am J Gastroenterol 2009; 104(3): 728–738.
30. Wallace JL. NSAID gastropathy and enteropathy: distinct pathogenesis likely necessitates distinct prevention strategies. Br J Pharmacol 2012; 165(1): 67–74.
31. Vakil N. Proton pump inhibitors for dyspepsia. Dig Dis 2008; 26(3): 215–217.
32. Ford AC, Moayyedi P. Current guidelines for dyspepsia management. Dig Dis 2008; 26(3): 225–230.
33. Veldhuyzen Van Zante SJ, Chiba N, Armstrong B, et al. A randomized trial comparing omeprazole, ranitidine, cisapride or placebo in Helicobacter pylori negative, primary care patiens with dyspepsia: The CADET-HN study. Am J Gastroenterol 2005; 100(7): 1477–1488.
34. Thomson AB, Sauve MD, Kassam N, et al. Safety of the long-term use of proton pump inhibitors. World J Gastroenterol 2010; 16(19): 2323–2330.
35. Lodato F, Azzaroli F, Turco L, et al. Adverse effects of proton pump inhibitors. Best Pract Res Clin Gastroenterol 2010; 24(2): 193–201.
36. Lamberts R, Brunner G, Solcia E, et al. Effects of very long (up to 10 years) proton pump blockade on human gastric mucosa. Digestion 2001; 64 : 205–213
37. Malfertheiner P, Megraud F, O´Morain C, et al. Management of Helicobacter pylori infection: the Maastricht IV/ Florance consensus report. Gut 2012; 61(5): 646–664.
38. Fiocca R, Mastracci L, Attwood SE, et al. Gastric exocrine and endocrine cell morfology under prolonged acid inhibition therapy: results of 5-year follow-up in the LOTUS trial. Aliment Pharmacol Ther 2012; 36(10): 959–971.
39. Jalving M, Koornstra JJ, Wesseling J, et al. Increased risk of fundic gland polyps during long-term proton pump inhibitor therapy. Aliment Pharmacol Ther 2006; 24(9): 1341–1348.
40. Yu EW, Bauer SR, Bain PA, et al. Proton pump inhibitors and risk of fractures: a meta-analysis of 11 international studies. Am J Med 2011; 124(6): 519–526.
41. Shabajee N, Lamb EJ, Sturgess I, et al. Omeprazole and refractory hypomagnesaemia. BMJ 2008; 337(7662): a425.
42. The U.S. Food and Drug Administration. FDA Drug Safety Communication. Low magnesium levels can be associated with long-term use of Proton Pump Inhibitor drugs (PPIs)[online]. 2011-02-03 [cit. 2013-05-10]. Dostupný na: www.fda.gov/Drugs/DrugSafety/ucm245011.htm
43. Sultan N, Nazareno J, Gregor J, et al. Association between proton pump inhibitors and respiratory infections: A systematic review and meta-analysis of clinical trials. Can J Gastroenterol 2008; 22(9): 761–766.
44. Eom CH-S, Jeon ChY, Lim J-W, et al. Use of acid-suppressive drugs and risk of pneumonia: a systematic review and meta-analysis. CMAJ 2011; 183(3): 310–319.
45. Giuliano C, Wilhem SM, Kale-Pradhan PB. Are proton pump inhibitors associated with the development of community-acquired pneumonia? A meta-analysis. Expert Rev Clin Pharmacol 2012; 5(3): 337–344.
46. Cunningham R, Dale B, Undy B, et al. Proton pump inhibitors as a risk factor for Clostridium difficile diarrhoea. J Hosp Infect 2003; 54(3): 243–245.
47. Deshpande A, Pant Ch, Pasupuleti V, et al. Association between proton pump inhibitor therapy and clostridium difficile in a meta-analysis. Clin Gastroenterol Hepatol 2012; 10(3): 225–233.
48. Ogawa R, Echizen H. Drug-drug interactions profiles of proton pump inhibitors. Clin Pharmacokinet 2010; 49(8): 509–533.
49. Drepper MD, Spahr L, Frossard JL. Clopidogrel and proton pump inhibitors – where do we stand in 2012? World J Gastroenterol 2012; 18(18): 2161–2171.
50. Chen J, Yuan YC, Leontiadis GI, et al. Recent safety concerns with proton pump inhibitors. J Clin Gastroenterol 2012; 46(2): 93–114.
51. Bhatt DL, Cryer BL, Contant CF, et al. Clopidogrel with or without omeprazole in coronary artery disease. N Engl J Med 2010; 363(20): 1909–1917.
52. Hulot JS, Collet JP, Silvain J, et al. Cardiovascular risk in clopidogrel-treated patients according to cytochrome P450 2C19*2 loss-of-function allele or proton pump inhibitor coadministration. J Am Coll Cardiol 2010; 56(2): 134–143.
53. Uotani T, Sugimoto M, Nishino M, et al. Ability od rabeprazole to prevent gastrin mucosal damage from clopidogrel and low doses of aspirin depends on CYP2C19. Clin Gastroenterol Hepatol 2012; 10(8): 879–885.
54. El-Halabi MM, Zgheib N, Mansour NM, et al. CYP2C19 genetic polymorphism, rabeprazole and esomeprazole have no effect on the anti-platelet action of clopidogrel. J Cardiovasc Pharmacol 2013 Mar 7. [Epub ahead of print].
55. DeVault KR, Talley NJ. Insights into the future of gastric acid suppression. Nat Rev Gastroenterol Hepatol 2009; 6 : 524–532.
56. Sachs G, Shin JM, Hunt R. Novel approaches to inhibition of gastric acid secretion. Curr Gastroenterol Rep 2010; 12 : 437–447.
Labels
General practitioner for children and adolescents General practitioner for adultsArticle was published in
General Practitioner

2013 Issue 5
- Advances in the Treatment of Myasthenia Gravis on the Horizon
- Hope Awakens with Early Diagnosis of Parkinson's Disease Based on Skin Odor
- Memantine in Dementia Therapy – Current Findings and Possible Future Applications
- Memantine Eases Daily Life for Patients and Caregivers
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
-
All articles in this issue
- Functional anatomy of parenting
- Proton pump inhibitors – new mole-cules, new knowledge
- Differential diagnosis of the most frequent perianal lesions in a general practitioner’s surgery
- Monitoring of nutritional status of elderly patients during hospitalisation
- Risk factors of working environment and occupational diseases reported in the Czech Republic in 2012
- Warfarin skin necrosis without protein S, protein C deficiency or other procoagulant state
- General Practitioner
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Warfarin skin necrosis without protein S, protein C deficiency or other procoagulant state
- Differential diagnosis of the most frequent perianal lesions in a general practitioner’s surgery
- Proton pump inhibitors – new mole-cules, new knowledge
- Risk factors of working environment and occupational diseases reported in the Czech Republic in 2012
