Syndróm z rozpadu nádoru – tumor lysis syndrome
Tumor lysis syndrome
Tumor lysis syndrome with hypeuricemia, also known as TLS, is a potentially serious complication of cancer chemotherapy and it can result in life–threatening complications such as renal failure and cardiac arrhythmias. The aim of this paper is to provide a general overview of the pathophysiology and corresponding signs and symptoms of TLS and review clinical and laboratory monitoring parameters. An understanding of the pathophysiology of TLS and meticulous assessment of signs and symptoms and monitoring of the laboratory data, as well as early recognition of problems are essential for optimal patient outcomes. Both allopurinol and rasburicase offer flexibility in the management of TLS and may allow for further avoidance of the consequences of inadequate management of this syndrome.
Key words:
tumor lysis syndrome – chemotherapy – pathophysiology – treatment – prevention
Authors:
A. Kafková; E. Tóthová
Authors‘ workplace:
Klinika hematológie a onkohematológie Lekárskej fakulty UPJŠ a FNsP Košice, Slovenská republika, prednosta prof. MUDr. E. Tóthová, CSc.
Published in:
Vnitř Lék 2005; 51(2): 216-220
Category:
Reviews
Overview
Syndróm spôsobený rozpadom nádoru – tumor lysis syndrome (TLS) je považovaný za závažnú komplikáciu protinádorovej chemoterapie. Môže vyústiť do závažných život ohrozujúcich stavov, ako sú renálne zlyhanie alebo srdcová arytmia. Cieľom našej práce bolo poskytnúť prehľad o patofyziológii, klinickom obraze a laboratórnych abnormalitách sprevádzajúcich TLS. Pochopenie patofyziológie a dôsledné poznanie klinických symptómov a laboratórnych abnormalít sprevádzajúcich TLS je základom pre jeho optimálnu liečbu. Najvýznamnejšia je však prevencia TLS. Aplikácia allopurinolu alebo rekombinantnej urátoxidázy (rasburikáza), spolu s dostatočnou hydratáciou pacienta môžu predchádzať vzniku tohoto syndrómu.
Kľúčové slová:
syndróm z rozpadu nádoru – patofyziológia – klinický obraz – liečba – prevencia
Úvod
Tumor lysis syndrome (TLS) je závažná komplikácia protinádorovej chemoterapie (CHT). Rozvinutý TLS môže vyústiť do renálneho zlyhania alebo srdcovej arytmie, preto jeho rozpoznanie, správna liečba, ale predovšetkým prevencia, môžu zabrániť vzniku a rozvoju týchto život ohrozujúcich komplikácii [3,8,14,31]. Najčastejšou príčinou TLS je rýchly rozpad veľkého množstva nádorových buniek po špecifickej CHT [4,17,33]. Tento syndróm však môže sprevádzať aj iný typ liečby. Lerza et al [21] a Milano et al [24] opísali TLS po hormonálnej terapii, iní autori po rádioterapii alebo aplikácii kortikoidov [21,23,37]. Barry et al [6] uvádza vznik závažného TLS po endoskopickej rádiofrekvenčnej intersticiálnej termálnej ablácii (RITA) u pacienta s pečeňovými metastázami kolorektálneho karcinómu [6]. V posledných rokoch sa dostáva do popredia liečby malignít aj aplikácia monoklonových protilátok. TLS po liečbe MabTherou (monoklonovou protilátkou namierenou proti antigénu CD20 na povrchu lymfocytov) u chorých s non-Hodgkinovými lymfómami, ako aj po liečbe protilátkou anti-CD52 (Campath 1H) u chorých s chronickou lymfocytovou leukémiou uvádzajú Lin et al [22] a Cerosimo [8,9]. Zriedkavo môže vzniknúť TLS aj spontánne (tzv. Spontánny TLS ) [1,2,5,20]. Poškodením nádorových buniek sa z nich uvoľňuje do krvi veľké množstvo substancií. Ku vzniku TLS dochádza vtedy, ak obličky chorého nedokážu veľké množstvo týchto látok uvoľnených z buniek odstrániť [2,13,14,31,36]. Metabolické abnormality, ktoré sprevádzajú TLS, uvádzame v tab. 1.

Hyperurikémia
Zvýšenie kyseliny močovej v krvi (hyperurikémia) nachádzame ako najčastejšiu abnormalitu u chorých s TLS a hyperurikémia je aj najčastejšou príčinou renálneho zlyhania. Akcelerovaný metabolizmus purínov spôsobený deštrukciou DNA a RNA vedie ku zvýšenej tvorbe kyseliny močovej, ktorá je rozpustná pri fyziologickom pH [7,4]. V prítomnosti kyslého pH vznikajú kryštály kyseliny močovej, ktoré sa ukladajú v obličkách, kĺboch a v mäkkých tkanivách [39]. Ak sa vytvoria kryštály kyseliny močovej (KM) v renálnych tubuloch a v zberných kanálikoch obličiek (moč má pH okolo 5,0), môžu viesť ku obštrukcii, zápalu a/alebo ku poškodeniu obličkového tkaniva. Kryštály KM uložené v kĺboch spôsobujú ich zápal a bolestivosť [37,38,39].
Hyperkalémia
Hyperkalémia vzniká v dôsledku uvoľňovania veľkého množstva kália z deštruovaných nádorových buniek.
Hyperfosfatémia/hypokalcémia
Hyperfosfatémia je ďalšou metabolickou komplikáciou spojenou s TLS. Hypokalcémia ju obyčajne sprevádza a vzniká sekundárne ako následok hyperfosfatémie. Hyperfosfatémia má za následok aktiváciu osteoklastov s následnou rezorpciou kosti a formovaním kalcium - fosfátových komplexov. Tieto môžu precipitovať v obličkovom parenchýme alebo v zberných kanálikoch a zapríčiniť akútne obličkové zlyhanie [14,31,36,39].
Azotémia
Azotémia je výsledným prejavom precipitácie kryštálov KM a/alebo kalcium - fosfátových kryštálov v renálnych tubuloch a v hlbokom cievnom systéme.
Incidencia a výskyt TLS
Spontánny výskyt TLS je zriedkavý a bol popísaný u pacientov s hematologickými malignitami, obzvlášť s Burkittovým lymfómom [3,25,30]. TLS vzniká najčastejšie počas prvých 24–48 hodín po iniciálnej dávke chemoterapie a jeho prejavy a symptómy môžu trvať 5–7 dní. V literatúre je málo prác, ktoré sa venujú incidencii TLS [4,7,12,34]. Presná incidencia TLS nie je známa, pretože väčšina pacientov, u ktorých je riziko vzniku TLS, dostáva v súčasnosti rutinne profylaxiu [33]. Vyšší výskyt TLS sa uvádza u pacientov s non-Hodgkinovými lymfómami [5,7]. Vplyvom prevencie sa však incidencia a závažnosť TLS aj u týchto malignít znížila. Renálne zlyhanie sa môže vyvinúť v dôsledku TLS alebo počas jeho priebehu [3,25]. Poškodenie obličiek je registrované u 10 až 42 % pacientov s pokročilým Burkittovým lymfómom, akútnou lymfoblastovou leukémiou z B-buniek (B-ALL) a s ďalšími non-Hodgkinovými lymfómami [20,29]. Dialýza bola potrebná u týchto chorých s TLS až v 16–40 % [15,25,30]. Rizikové faktory vzniku TLS uvádza tab. 2. Výskyt, závažnosť a trvanie TLS sú ovplyvnené typom nádoru, chemosenzitivitou, veľkosťou nádorovej masy, načasovaním a intenzitou CHT a stavom pacienta v čase liečby (hydratácia, stav acidobázy a renálne funkcie) [18,34,33].

Diagnóza a monitorovanie TLS
Laboratórne vyšetrenie renálnych funkcií a elektrolytov v sére je potrebné urobiť vždy pred CHT a monitorovať každých 12–24 hodín počas liečby až do doby 48–72 hodín od začiatku terapie. Vysoko rizikových pacientov je potrebné monitorovať každých 6–8 hodín. Základný metabolický panel (Na+, K+, Cl–, glukóza, kreatinín v sére a urea) sa dopĺňa aj o hladiny PO4 – , Ca++, kyseliny močovej a laktikodehydrogenázy (LDH). V moči je potrebné vyšetriť pH, dôkaz kryštálov a zhodnotiť moč vizuálne. Príjem a výdaj tekutín a hmotnosť pacienta je potrebné vyhodnotiť pred CHT a denne monitorovať s cieľom určenia retencie tekutín alebo dehydratácie. Je potrebné sledovať periodicky EKG a urobiť kardiologické vyšetrenie s cieľom včasnej identifikácie abnormalít rytmu, ktoré môže zapríčiniť hyperkalémia alebo hypokalcémia.
Laboratórny a klinický TLS
Pri laboratórnom dôkaze TLS nenachádzame žiadne klinické známky ochorenia [19]. Niektorí klinici vypracovali kritériá na odlíšenie medzi preklinickým, alebo laboratórnym TLS (L-TLS) a klinickým TLS (K-TLS) [11,15,16,23].
L-TLS definujeme ako prítomnosť 2 alebo viacerých metabolických zmien, ktoré sa vyskytujú počas 4 dní od začiatku CHT:
- 25 % zvýšenie hladiny fosforu v sére, kália, kyseliny močovej, alebo urey;
- 25 % pokles koncentrácie kalcia v sére.
K-TLS je definovaný ako prítomnosť jednej z nasledujúcich komplikácií v súvislosti s L-TLS [14,19,20,26,27]:
- kreatinín v sére ≥ 2,5 mg/dl (≥ 221 μmol/l) s klinickým dôkazom renálneho poškodenia;
- zvýšená hladina kália > 6 mekv/l (> 6 mmol/l) v sére;
- vznik závažnej srdcovej arytmie;
- náhla smrť;
- pokles kalcia v sére na < 1,55 mmol/l (< 6 mg/dl);
- ďalšie klinické známky a symptómy TLS:
- nauzea, zvracanie, nechutenstvo, hnačky;
- letargia;
- svalová slabosť, spazmy, kŕče, paralýzy;
- pokles diurézy, zmena farby moča;
- kŕče, poškodenie pamäte, delírium;
- bolesti kĺbov;
- abonormality EKG, zmena TK, arytmia;
- laryngospazmus.
Liečba TLS
Pri akútnom TLS, ktorý vzniká niekoľko hodín po podaní CHT, je potrebné pacienta hospitalizovať, monitorovať a zabezpečiť intravenózny prísun roztokov (striedavo fyziologický roztok a 5 % glukóza a k týmto sa podľa sérových hladín pridáva draslík, horčík a vápník). Je nutná špecifická terapia, ktorej cieľom je zníženie hladiny KM, kália a fosfátov, ako aj úprava hladiny kalcia a zvýšenie diurézy. S podávaním allopurinolu je potrebné začať 24 hodín pred začiatkom antineoplastickej terapie v dávke 600–800 mg denne. Podávanie by malo pokračovať po dobu 2–3 dní. Udržiavacia dávka závisí od úpravy hladiny kyseliny močovej. Liečba s rasburikázou (Elitek) je finančne náročná, avšak vedie rýchlo k úprave. Typ použitej liečby závisí od závažnosti symptómov a stavu pacienta. V priebehu TLS je potrebné časté a starostlivé monitorovanie kardiálnych funkcií. V prípade ťažkého renálneho poškodenia, akútneho renálneho zlyhania alebo pri nutnosti rýchlej korekcie metabolických abnormalít, je potrebná dialýza buď klasická, alebo kontinuálna venovenózna hemodialýza. Väčšina pacientov odpovedá na liečbu dobre a môže dôjsť ku normalizácii obličkových funkcií [10,28,29].
Prevencia TLS
Pre rizikových pacientov má byť hlavným cieľom prevencia. Cieľom prevencie TLS je dôležité sledovanie pacienta už 24–48 hodín pred začatím CHT. Okrem nutnosti zvýšenej hydratácie (3–6 l/m2/deň), je potrebné alkalizovať moč (udržiavanie pH od 7,0–7,5); podávať pacientom natrium bikarbonát i.v. alebo per os/i.v. acetazolamid; udržiavať adekvátny výdaj tekutín; znížiť hladinu fosfátov (per os aplikácia hydroxidu hliníka, úprava diéty).
Dôležité je zníženie hladiny KM (allopurinolom alebo Elitekom – rasburikázou). Za najúčinnejšiu látku, ktorá vedie ku zníženiu hladiny KM, sa považuje v súčasnosti rasburikáza. Ide o rekombinantný urát-oxidázový enzým, ktorý katalyzuje premenu KM na solubilný produkt – alantoin, ktorý môžu obličky ľahko vylúčiť [4,10,26,29,38).
Rasburikáza pôsobí rýchlo, znižuje hladinu KM už 4 hodiny po 1. dávke a v 100 % do 96 hodín od prvého podania. Rasburikáza zabráni akumulácii prekurzorov KM [32,35].
Mechanizmus pôsobenia allopurinolu a rasburikázy znázorňuje obrázok 1 a 2.
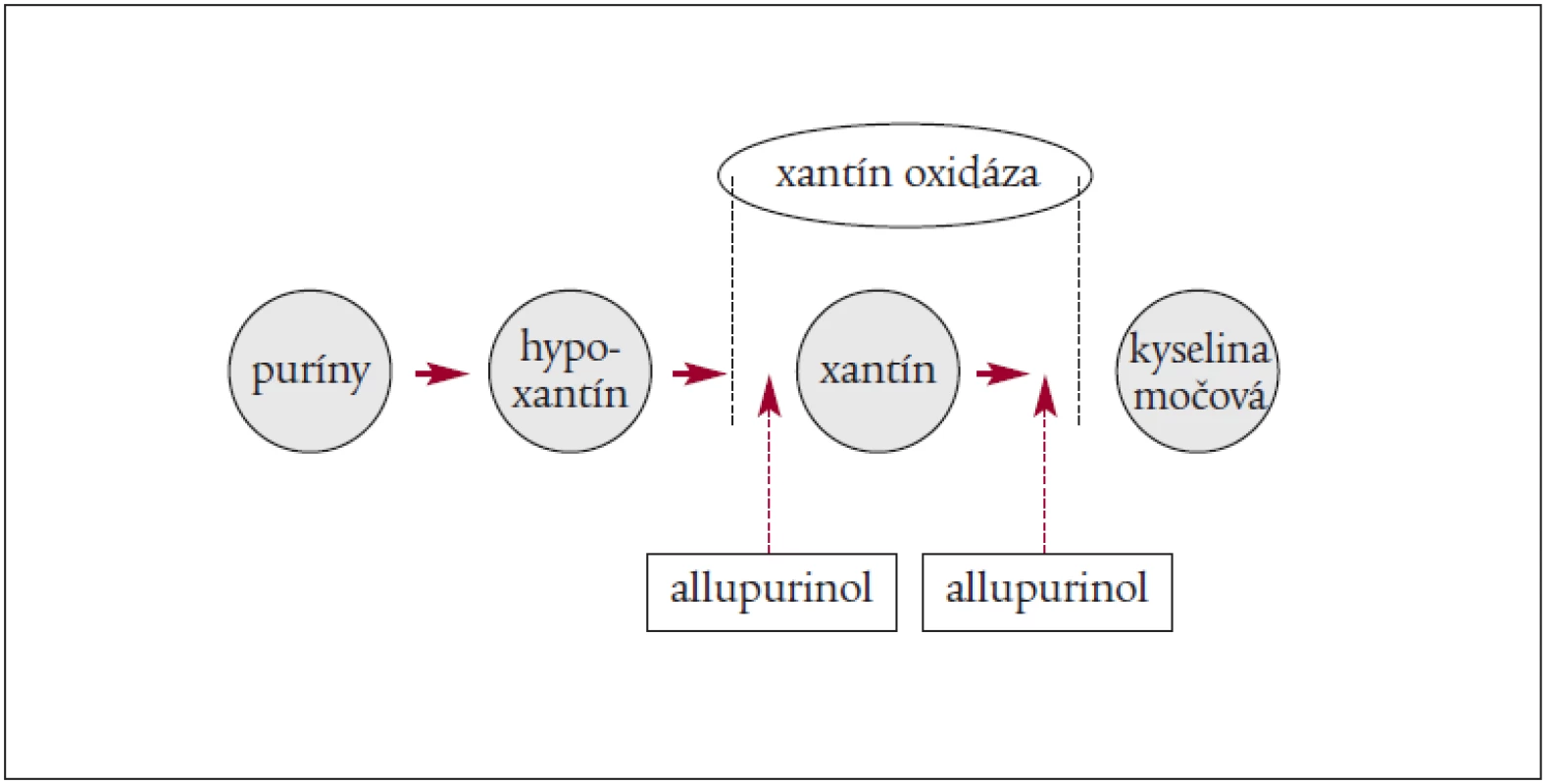
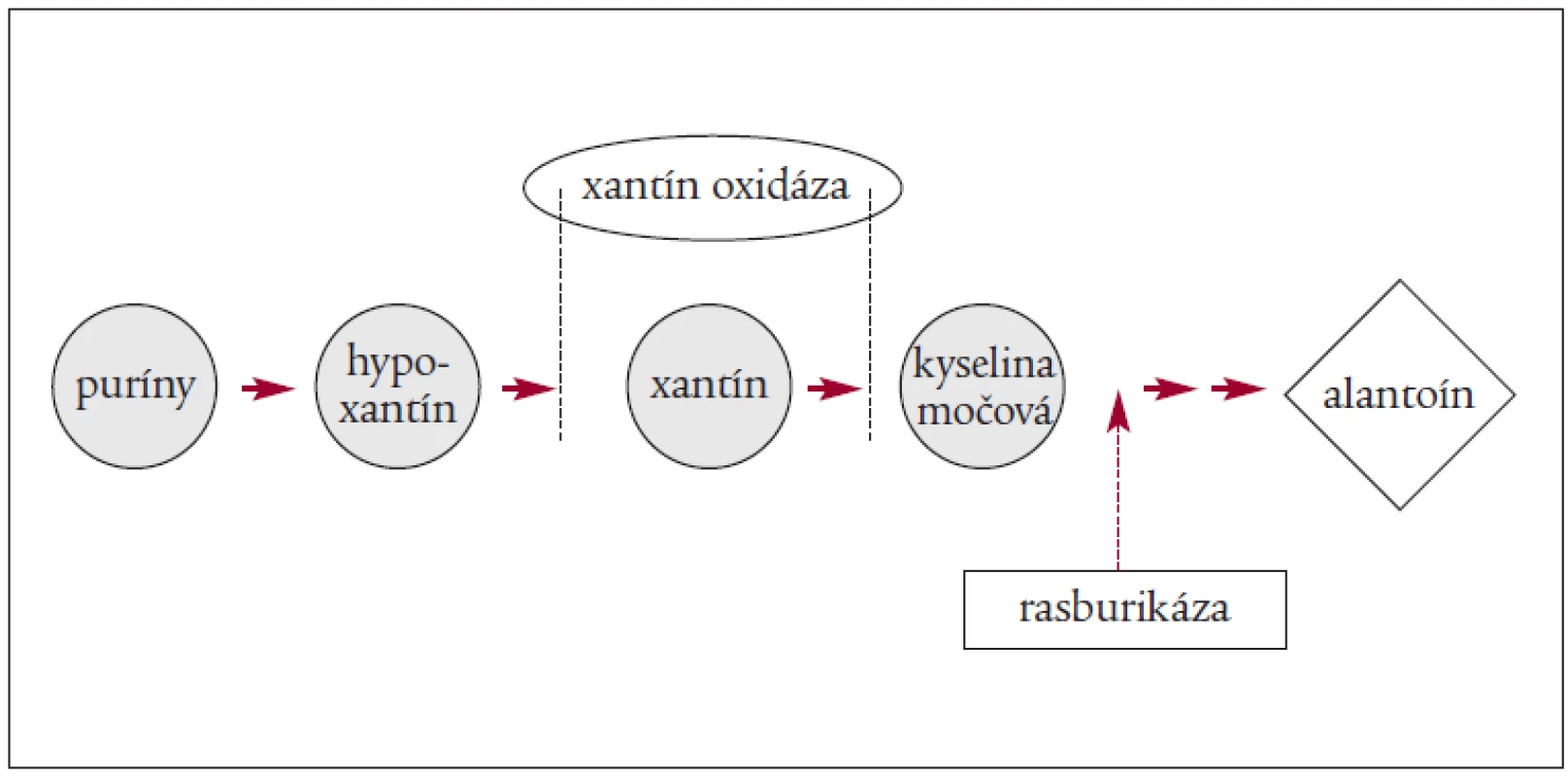
Je dôležité vedieť, že aj konkomitantná liečba môže prispieť k metabolickým abnormalitám u pacientov s TLS, preto je nutné vynechať lieky s možným nepriaznivým efektom v čase CHT ako sú: orálne alebo i.v. elektrolyty; thiazidy a kálium šetriace diuretiká; acylpyrín; Probenecid; ACE-inhibítory, ktoré zvyšujú hladinu kália; nefrotoxické lieky (aminoglykozidy); a rádiografické kontrastné látky.
Záver
Pochopenie patofyziológie a včasné rozpoznanie klinických symptómov a laboratórnych zmien sprevádzajúcich TLS sú základom pre jeho optimálnu liečbu. U vysokorizikových chorých je nutná prevencia TLS.
MUDr. Adriana Kafková
www.upjs.sk
e-mail: kafkova1@post.sk
Doručeno do redakce: 2. 2. 2004
Přijato po recenzi: 29. 3. 2004
Sources
1. Abou Mourad Y, Taher A, Shamseddine A. Acute tumor lysis syndrome in large B-cell non-Hodgkin’s lymphoma induced by steroids and anti-CD20. Hematol J 2003; 4(3): 222–224.
2. Alkhuja S, Ulrich H. Acute renal failure from spontaneous acute tumor lysis syndrome: A case report and review. Ren Fail 2002; 24(2): 227–232.
3. Altman A. Acute tumor lysis syndrome. Semin Oncol 2001; 28(Suppl 5): 3–8.
4. Annemans L, Moeremans K, Lamotte M et al. Pan-European multicentre economic evaluation of recombinant urate oxidase (rasburicase) in prevention and treatment of hyperuricaemia and tumor lysis syndrome in haematological cancer patients. Support Care Cancer 2003; 1154 : 249–257.
5. Basile C, Montranaro A. An exceptionally severe hyperuricemia in acute renal failure from spontaneos tumor lysis syndrome (TLS). G Ital Nefrol 2003; 20(5): 525–528.
6. Barry BD, Kell MR, Redmond HP. Tumor lysis syndrome following endoscopic radiofrequency intestinal thermal ablation of colorectal liver metastases. Surg Endosc 2002; 16(7): 1109.
7. Bishop MR, Coccia PF. Tumor lysis syndrome. In: Abeloff MD et al. Clinical Oncology. 2nd ed. New York: Churchill Livingstone 2000 : 750–753.
8. Cersosimo RJ. Monoclonal antibodies in the treatment of cancer. Part II. Am J Health Syst Pharm 2003; 60(16): 1631–1641.
9. Cersosimo RJ. Monoclonal antibodies in the treatment of Cancer Part I. Am J Health Syst Pharm 2003; 60(15): 1531–1548.
10. Coiffier B, Mounier N, Bologna S et al. Efficacy and safety of rasburicase (recombinant urate oxidase) for the prevention and treatment of hyperuricemia during induction chemotherapy of aggressive non-Hodgkin’s lymphoma: Results of the GRAAL 1 (Groupe d’Etude des lymphomes de l’adulte trial on rasburicase activity in adult lymphoma) study. J Clin Oncol 2003; 21(23): 4402–4406.
11. Doane L. Overview of tumor lysis syndrome. Semin Oncol Nurs 2002; 18 (Suppl 3): 2–5.
12. Flombaum CD. Metabolic emergencies in the cancer patients. Semin Oncol 2000; 27 : 322–334.
13. Goldman SC. Rasburicase: Potential role in managing tumor lysis in patients with hematological malignancies. Expert Rev Anticancer Ther 2003; 3(4): 429–433.
14. Greenwood MJ, Dodds AJ, Garricik R et al. Posterior leukoencephalopathy in association with the tumor lysis syndrome in acute lymphoblastic leukaemia: A case with clinicopathological correlation: Leuk Lymphoma 2003; 44(4). 719–721.
15. Hande KR, Garrow GC. Acute tumor lysis syndrome in patients with high-grade non-Hodgkin’s lymphoma. Am J Med 1993; 94. 133–139.
16. Holdsworth MT, Nguyen P. Role of i.v. allopurinol and rasburicase in tumor lysis syndrome. Am J Health Syst Pharm 2003; 60(21): 2213–2222.
17. Hussain K, Mazza JJ, Clouse LH. Tumor lysis syndrome (TLS) following fludarabine therapy for chronic lymphocytic leukemia (CLL): case report and review of the literature. Am J Hematol 2003; 72(3): 212–215.
18. Jones DP, Mahmoud H, Chesney RW. Tumor lysis syndrome: Pathogenesis and management. Pediatr Nephrol 1995; 9(9): 206–212.
19. Kaplow R. Pathofysiology, sign, and symptoms of acute tumor lysis syndrome. Semin Oncol Nurs 2002; 18(Suppl 3): 6–11.
20. Kopečná L, Doležel Z, Osvaldová Z et al. The analysis of the risks for the development of tumor lysis syndrome in children. Bratisl Lek Listy 2002; 103(6): 206–209.
21. Lerza R, Botta M, Barsotti B et al. Dexamethazone-induced acute tumor lysis syndrome in T-cell malignant lymphoma. Semin Oncology 2002; 18(3): 6–9.
22. Lin TS, Lucas MS, Byrd JC. Rituximab in B-cell chronic lymphocytic leukemia. Semin Oncol 2003; 30(4): 483–492.
23. Linck D, Basara N, Tran V et al. Peracute onset of severe tumor lysis syndrome immediately after 4 Gy fractionated TBI as part of reduction intensity preparative regimen in patients with T-ALL with high tumor burden. Bone Marrow Transplant 2003; 31(10): 935–937.
24. Milano GM, deSio L, Cozza R et al. Tumor lysis syndrome and neuroblastoma. Med Pediatr Oncol 2003; 41(6): 542.
25. Mayer J, Starý J et al. Leukémie. Praha: Grada 2002 : 164–167.
26. Patte C, Sakiroglu C, Ansoborlo S et al. Urate-oxidase in the prevention and treatment of metabolic complications in patients with B-cell lymphoma and leukemia, treated in the Societe francaise d’Oncologie pediatrique LMB 89 protocol. Ann Oncol 2002; 13(5): 789–795.
27. Pui CH, Jeha S, Irwin D et al. Recombinant urate oxidase (rasburicase) in the prevention and treatment of malignancy–associated hyperuricaemia in pediatric and adult patients: Results/of a compassionate-use trial. Leukemia 2002; 15 : 1505–1509.
28. Pui CH, Mahmoud HH, Wiley JM. Recombinant urate oxidase for the prophylaxis or treatment of hyperuricemia in patients with leukemia or lymphoma. J Clin Oncol 2001; 19 : 697–704.
29. Ribeiro RC, Pui CH. Recombinant urate oxidase for prevention of hyperuricemia and tumor lysis syndrome in lymphoid malognancies. Clin Lymphoma 2003; 3(4): 225–232.
30. Stapleton FB, Strother DR, Roy S et al. Acute renal failure at oncet of therapy for aduanced stage Burkitt lymphoma and B cell acute lymphoblastic lymphoma. Pediatrics 1988; 82 : 863–869.
31. Seftel MD, Bruyere H, Copland M et al. Fulminant tumor lysis syndrome in acute myelogenous leukaemia with inv (16) (p13;q22). Eur J Haematol 2002; 69(4): 193–199.
32. Seidemann K, Meyer U, Jansen P et al. For the BFM-Study Group: Impaired renal function and tumor lysis syndrome in pediatrics patients with non-Hodgkin’s lymphoma and B-ALL. Klin Pädiatr 1998; 210 : 279–284.
33. Seki JT, Al–Omar HM, Amato D et al. Acute tumor lysis syndrome secondary to hydroxyurea in acute myeloid leukemia. Ann Pharmacother 2003; 37(5): 675–678.
34. Stucky LA. Acute tumor lysis syndrome: Assessment and nursing implications. Oncol Nurs Forum 1993; 20 : 49–59.
35. Tomera JF. Acute tumor lysis syndrome: Considerations of cause and prevention. Drugs Today (Barc) 1999; 35(2); 79–87.
36. Vaisban E, Braester A, Mosenzon O et al. Spontaneous tumor lysis syndrome in solid tumors: Really a rare condition? Am J Med Sci 325(1), 38–40.
37. Yang SS, Chau T, Dai MS et al. Stereoid-induced tumor lysis syndrome in a patient with preleukemia. Clin Nephrol 2003; 59(3); 201–205.
38. Yarpuzlu AA. A review of clinical and laboratory findings and treatment of tumor lysis syndrome. Clin Chim Acta 2003; 333(1): 13–18.
39. Yim BT, Sims-McCallum RP, Chong PH. Rasburicase for the treatment and prevention of hyperuricemia. Ann Pharmacother 2003; 37(7–8): 1047–1054.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2005 Issue 2
-
All articles in this issue
- Geriatrics as an inter-disciplinary science on the threshold of the 21st century
- Kmenové buňky: nový příslib v medicíně
- Syndróm z rozpadu nádoru – tumor lysis syndrome
- Adiponektin – nový adipocytární hormon se vztahem k obezitě a inzulinové rezistenci
- Kongenitální adrenální hyperplazie, defekt 17α−hydroxylázy jako vzácná příčina hypertenze a hypokalemie
- Heparinem indukovaná trombocytopenie u pacientky se stenózou kmene levé věnčité tepny
- Léčba chronické infekce virem hepatitidy C pegylovaným interferonem a ribavirinem u pacienta se smíšenou kryoglobulinemií
- Pedální bypass v léčbě ischemie diabetické nohy – střednědobé výsledky
- Pulzní tlak v mladé populaci stanovený 24hodinovým ambulantním monitorováním krevního tlaku a jeho vztah k metabolickým a antropometrickým parametrům
- Hodnocení apoptózy buněk akutní myeloidní leukemie a B−lymfocytární chronické lymfatické leukemie po kultivaci s cytostatiky a její vztah k mnohočetné rezistenci
- Vlastní zkušenosti se vznikem a trváním spontánní remise u dospělých diabetiků typu 1
- Vliv kombinovaného aerobního a silového tréninku na funkci levé komory srdeční u nemocných po akutním infarktu myokardu
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Pulzní tlak v mladé populaci stanovený 24hodinovým ambulantním monitorováním krevního tlaku a jeho vztah k metabolickým a antropometrickým parametrům
- Kongenitální adrenální hyperplazie, defekt 17α−hydroxylázy jako vzácná příčina hypertenze a hypokalemie
- Syndróm z rozpadu nádoru – tumor lysis syndrome
- Vlastní zkušenosti se vznikem a trváním spontánní remise u dospělých diabetiků typu 1
