Alogenní transplantace krvetvorných buněk u nemocných s chronickou myeloidní leukemií v České republice: retrospektivní hodnocení výsledků z let 1988 až 2005
Allogeneic hematopoietic stem cell transplantation in patients with chronic myeloid leukemia in the Czech Republic - a retrospective analysis of results in years 1988–2005
Analyses of hematopoietic stem cell transplantation (SCT) results are of high importance for treatment strategy decision-making in patients with SCT as a possible therapeutic alternative. the Czech National Registry of SCT and Transplantation Centre in Pilsen are presenting here their collaborative retrospective analysis of the results of allogeneic SCT in patients with chronic myeloid leukemia (CML) performed in the Czech Republic from 1988 to spring 2005. 295 patients (179 men and 116 women) at the age from 6.9 to 59.5 years (median 37.3) were transplanted. In most cases the donor was an HLA-identical sibling (164; 55.6 %) or a voluntary unrelated donor from the registry (110; 37.3 %), in minority of cases another relative of the patient (21; 7.1 %). Myeloablative conditioning was used in 90 % of patients. The source of hematopoietic stem cells was bone marrow in 57 %, peripheral blood in 41 % and combination of both in 2 % of cases. 83.4 % of patients were transplanted in chronic phase of the disease while 7.8 % in acceleration and 6.1 % in blastic phase, respectively. The median interval from the diagnosis to SCT was 316 days. Median follow-up after SCT was 2 years. SCT was complicated with acute graft versus host disease of grade II-IV in 33.7 % of patients and with chronic graft versus host disease in 36.3 % of patients. Median survival was not reached, 18 (6.1 %) of patients died due to the relapse of CML and the cause of 101 (34.2 %) deaths was transplant-related. Significant trends were observed during the study period: SCT were performed more frequently in elder patients, earlier than one year from the diagnosis, reduced-intensity conditioning was used more often and the source of hematopoietic stem cells was peripheral blood in more patients (p = 0.188 - < 0.0001). Also, transplantation activity changed - the annual rate of SCT was steadily increasing until 1999, while there was no such an increase between 2000 and 2005. The use of peripheral stem cells was associated with chronic graft versus host disease (p = 0.007). In Cox multivariate analysis the EBMT risk score and the interval from the diagnosis to SCT were identified as independent factors for survival of patients. An „ideal“ patient aged below 30, transplanted in the chronic phase of CML within one year since the diagnosis after 2000 had survival probability of 88% at three years after SCT. It can be concluded that results of allogeneic SCT in CML in the Czech Republic have been reflecting the actual trends in the world, they have been comparable with foreign studies and they have been continuously improving.
Key words:
chronic myeloid leukemia - allogeneic hematopoietic stem cell transplantation - EBMT risk score
Authors:
E. Faber 1; V. Koza 2; A. Vítek 3; J. Mayer 4; P. Sedláček 5; P. Žák 6; J. Zapletalová 7; K. Benešová 8; H. Krejčová 8; K. Steinerová 2; I. Marešová 1; P. Cetkovský 3
Authors‘ workplace:
Hemato-onkologická klinika Lékařské fakulty UP a FN Olomouc, přednosta prof. MUDr. Karel Indrák, DrSc.
1; Hematologicko-onkologické oddělení FN Plzeň, přednosta prim. MUDr. Vladimír Koza
2; Ústav hematologie a krevní transfuze Praha, ředitel prof. MUDr. Pavel Klener, DrSc.
3; Interní hematoonkologická klinika Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta prof. MUDr. Jiří Vorlíček, CSc.
4; Klinika dětské hematologie a onkologie 2. lékařské fakulty UK a FN Motol, Praha, přednosta prof. MUDr. Jan Starý, DrSc.
5; Oddělení klinické hematologie II. interní kliniky Lékařské fakulty UK a FN Hradec Králové, přednosta prof. MUDr. Jaroslav Malý, CSc.
6; Oddělení biometrie Ústavu biofyziky Lékařská fakulty UP Olomouc, přednosta prof. ing. Jan Hálek, CSc.
7; Český národní registr transplantací krvetvorných buněk, VFN Praha, vedoucí lékařka MUDr. Kateřina Benešová, CSc.
8
Published in:
Vnitř Lék 2006; 52(12): 1172-1180
Category:
Original Contributions
Overview
Analýzy výsledků transplantací krvetvorných buněk (TKB) mají zásadní význam pro rozhodování o strategii léčby nemocných, u nichž je provedení TKB možnou alternativou. Český národní registr TKB a transplantační centrum v Plzni zde předkládají společné retrospektivní hodnocení výsledků alogenních TKB u nemocných s chronickou myeloidní leukemií (CML) provedených v České republice od roku 1988 do jara roku 2005. Bylo transplantováno 295 nemocných (179 mužů a 116 žen) ve věku od 6,9 do 59,5 let (medián 37,3). Dárcem byl ve většině případů HLA identický sourozenec (164; 55,6 %) a dárce z registru (110; 37,3 %), v menšině případů jiný příbuzný nemocného (21; 7,1 %). Myeloablativní příprava byla použita u 90 % nemocných. Zdrojem krvetvorných buněk byla v 57 % kostní dřeň, ve 41 % periferní krev, u 2 % nemocných byla použita kostní dřeň i periferní krev. V chronické fázi onemocnění bylo transplantováno 86,1 % nemocných (7,8 % v akceleraci a 6,1 % v blastickém zvratu), přičemž medián intervalu od stanovení diagnózy do TKB byl 316 dní. Medián sledování po TKB byl 2 roky. TKB byla komplikována akutní reakcí štěpu vůči hostiteli II.-IV. stupně u 33,7 % a chronickou reakcí štěpu vůči hostiteli u 36,3 % nemocných. Medián přežití nebyl dosažen, 18 (6,1 %) nemocných zemřelo důsledkem relapsu CML a příčinou 101 (34,2 %) úmrtí byly komplikace TKB. Během sledovaného období byly zjištěny významné trendy pro častější provádění TKB u starších nemocných, TKB byly prováděny dříve než za 1 rok od stanovení diagnózy, více se využívaly nemyeloablativní přípravné režimy a zdrojem krvetvorných buněk byla častěji periferní krev (p = 0,188 až < 0,0001). Významně se měnila také transplantační aktivita - do roku 1999 každoročně narůstal počet provedených TKB, zatímco od roku 2000 k meziročnímu nárůstu nedocházelo. Použití periferních krvetvorných buněk bylo statisticky významně asociováno se vznikem chronické reakce vůči hostiteli (p = 0,007). Coxova regresní analýza identifikovala EBMT skóre rizika a interval od stanovení diagnózy do TKB jako nezávislé faktory ovlivňující přežití nemocných. Po roce 2000 měl „ideální“ nemocný ve věku do 30 let transplantovaný v chronické fázi CML do jednoho roku od stanovení diagnózy 88% pravděpodobnost přežití 3 roky. Lze konstatovat, že výsledky alogenních TKB u CML u nás odrážejí současné světové trendy, jsou srovnatelné s výsledky v zahraničí a významně se zlepšují.
Klíčová slova:
chronická myeloidní leukemie - alogenní transplantace krvetvorných buněk - EBMT skóre rizika
Úvod
Alogenní transplantace krvetvorných buněk (TKB) v současnosti představuje jedinou léčebnou metodu umožňující vyléčení nemocných s chronickou myeloidní leukemií (CML) [1,2]. Pět let po provedení TKB přežívá 50-80 % nemocných transplantovaných v chronické fázi CML [3]. Při dlouhodobém sledování nemocných po alogenní TKB v chronické fázi CML s využitím HLA identických sourozenců je pravděpodobnost přežití po 15 letech odhadována na 53 % [4]. Provedení alogenní TKB je však spojeno s několika významnými problémy:
- metoda není dostupná všem nemocným z důvodu chybění vhodného dárce nebo pro nesplnění kritérií k indikaci výkonu (zejména vysoký věk nebo komorbidita)
- přes veškerou péči zejména během prvních 2 let umírá 10-50 % nemocných na komplikace výkonu
- TKB může mít pro nemocné dlouhodobé následky (snížená práceschopnost, kvalita života, plodnost, apod.)
- existuje nezanedbatelné riziko relapsu CML i několik let po TKB [5].
Podle nedávných publikací je zřejmé, že ani zavedením novějších metod včetně nemyeloablativních přípravných režimů se výsledky přežití nemocných s CML po alogenní TKB významně nezlepšily - pravděpodobnost 5letého přežití se pohybuje kolem 60-80 % [6,7].
Zavedení cílené léčby CML imatinibem významně snížilo počet nemocných s CML, jimž byla po roce 1999 provedena alogenní TKB [8]. Dlouhodobé výsledky léčby imatinibem jsou v současnosti pouze odhadovány, nicméně doposud nic nenasvědčuje tomu, že by se prognóza nemocných měla v budoucnu zásadně zhoršit. Z posledních analýz studie IRIS je známo, že po 54 měsících mají nemocní léčeni imatinibem od diagnózy pravděpodobnost přežití 90 % a dosažení kompletní cytogenetické remise 86 % [9]. Imatinib je většinou velmi dobře tolerován, z čehož vyplývá velmi dobrá kvalita života nemocných [10]. Problémem je rozvoj rezistence, jež se může rozvinout u 1-5 % nemocných léčených od diagnózy ročně, a to, že lék neúčinkuje na primitivní leukemické progenitory [9,11]. Podle současných názorů je imatinib u dospělých nemocných indikován jako lék 1. volby. Alogenní TKB zůstává jako metoda 1. volby u dětí a lze ji zvažovat u dospělých s rizikovou CML, u nichž je předpoklad nízké mortality po TKB [12]. U ostatních nemocných je TKB indikována až při rozvoji rezistence na imatinib, při průkazu mutací tyrozinové kinázy Bcr/Abl anebo při intoleranci imatinibu.
V České republice byly popsány výsledky alogenních TKB u nemocných s CML pouze ve 2 sděleních [13,14]. Poslední příspěvek demonstruje významné zlepšení výsledků dosahovaných na Ústavu hematologie a krevní transfuze v Praze, které jsou srovnatelné s výsledky předních světových center [2,4].
Český národní registr TKB vznikl v roce 2003 s cílem monitorovat transplantační aktivitu, analyzovat výsledky TKB, sloužit jako podklad pro posuzování kvality péče a pro rozhodování samotných nemocných. Jedním z prvních navržených projektů bylo provedení retrospektivního hodnocení výsledků alogenních TKB u nemocných s CML. Tato analýza, jejíž výsledky právě předkládáme, je první svého druhu provedená u CML v České republice a prokazuje, že výsledky alogenních TKB u nemocných s CML v České republice jsou srovnatelné s výsledky ve světě, neustále se zlepšují a transplantační praxe odrážejí všechny soudobé moderní trendy.
Metody
Údaje o provedených TKB byly získány z centrální počítačové databáze Evropské skupiny pro transplantace krve a kostní dřeně (EBMT) PROMISE v Londýně. Sběr dat TKB provedených v transplantačních centrech v Praze, Brně, Hradci Králové a Olomouci byl proveden v Českém národním registru TKB v Praze. Data o TKB provedených v transplantačním centru v Plzni byly získány z databází PROMISE samostatně v tomto centru. Data se týkala nemocného (věk, pohlaví, datum stanovení diagnózy, fáze onemocnění, v níž byla provedena TKB), vlastního výkonu (datum TKB, typ přípravy, druh použitého štěpu), dárce (typ dárce a jeho pohlaví), komplikací po TKB (výskytu akutní a chronické reakce štěpu vůči hostiteli a jejich rozsahu) a sledování nemocného (datum a typ relapsu, datum a příčina úmrtí, datum poslední kontroly). Po kontrole a doplnění chybějících údajů přímo v jednotlivých centrech byly tyto dvě databáze sloučeny v jednu, pro jednotlivé TKB bylo vypočteno EBMT skóre rizika a data byla podrobena statistické analýze na Oddělení biometrie Ústavu biofyziky Lékařské fakulty UP v Olomouci. EBMT skóre rizika bylo vypočteno pro každou TKB sečtením bodů podle tab. 1 [15].
![EBMT skóre rizika pro nemocné s CML po alogenní transplantaci krvetvorných buněk [8].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/ca1e39243304b8c66c0e3f6c17edbed4.jpg)
Statistická analýza
K průkazu trendů numericky proměnných veličin během sledovaného období a jejich statistické významnosti byla použita korelační analýza a analýza rozptylu s ověřením testem podle Mann-Whitneyho. K průkazu trendů kategoricky proměnných veličin během sledovaného období byl použit Pearsonův χ2 test. Ke stanovení pravděpodobnosti přežití a přežití bez projevů onemocnění byly použity výpočty podle Kaplana a Meiera. Ke srovnání statistické významnosti rozdílů v pravděpodobnosti přežití mezi jednotlivými skupinami nemocných byl použit log-rank test. Ke zjištění nezávislých faktorů ovlivňujících pravděpodobnost přežití nemocných byla provedena Coxova regresní analýza rizika. Ke statistickému zpracování byl použit software SPSS v. 10 (SPSS Inc, Chicago, USA). Testy byly prováděny na hladině signifikance 0,05.
Výsledky
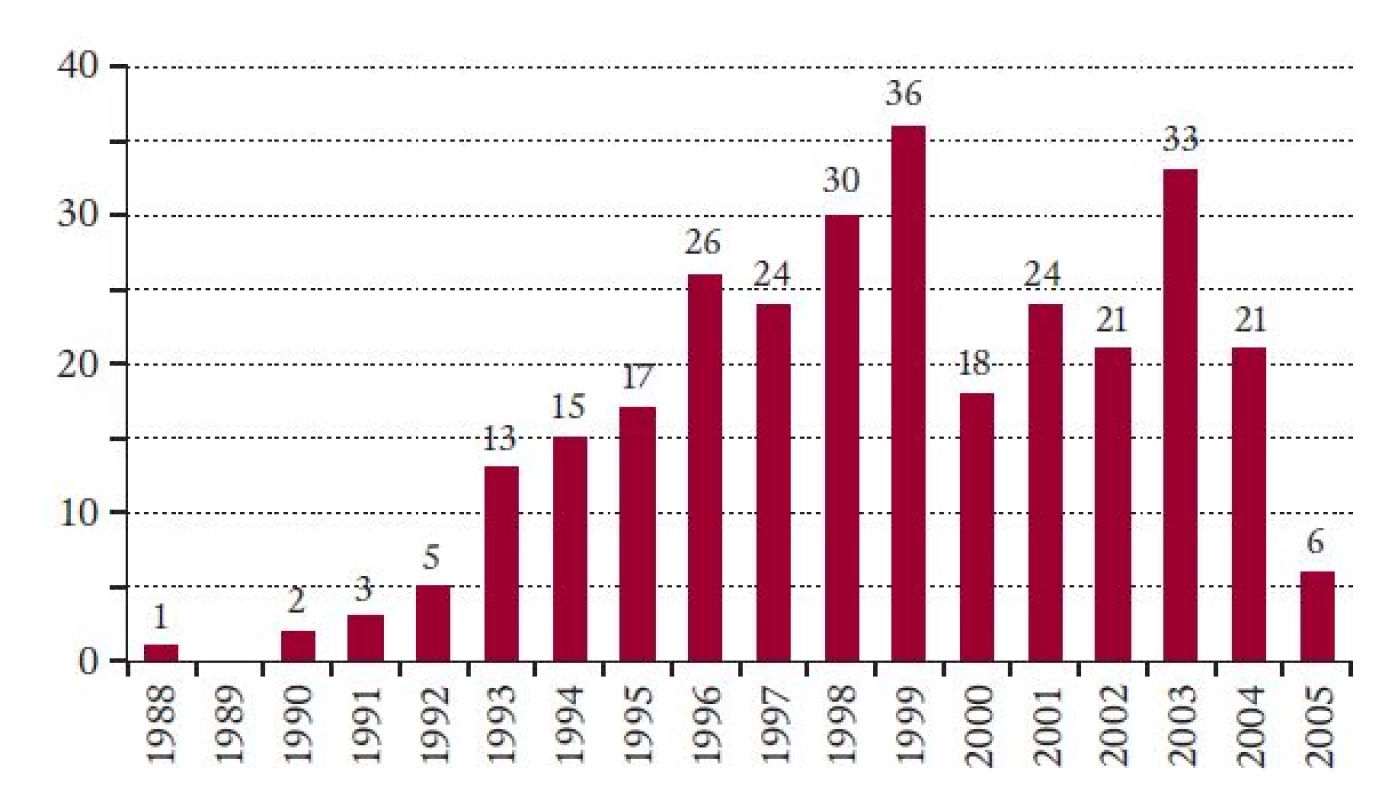
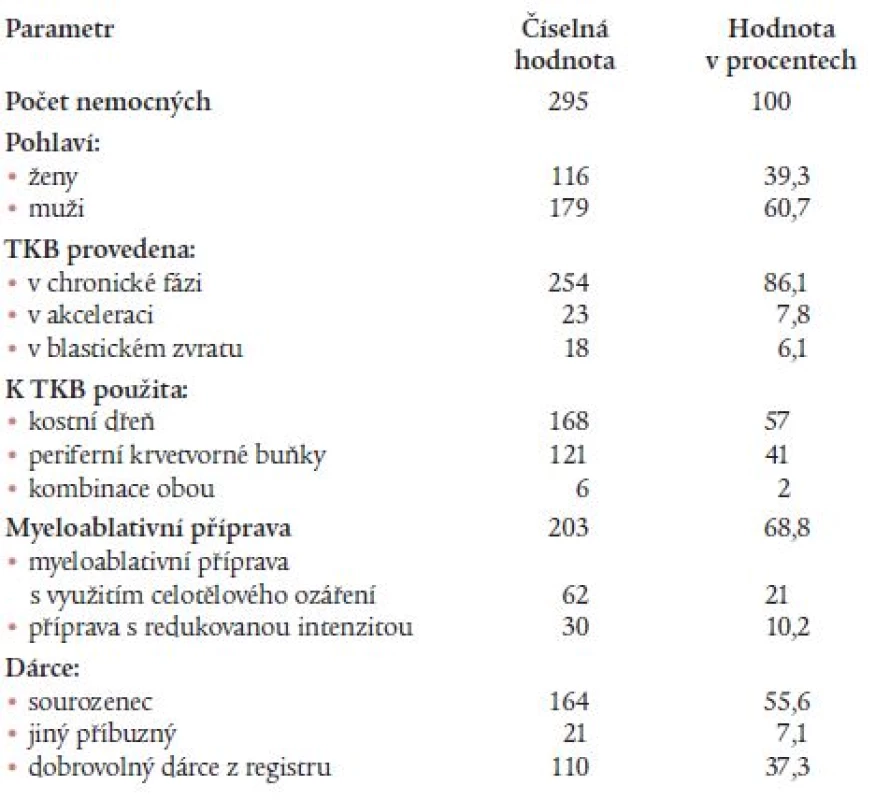
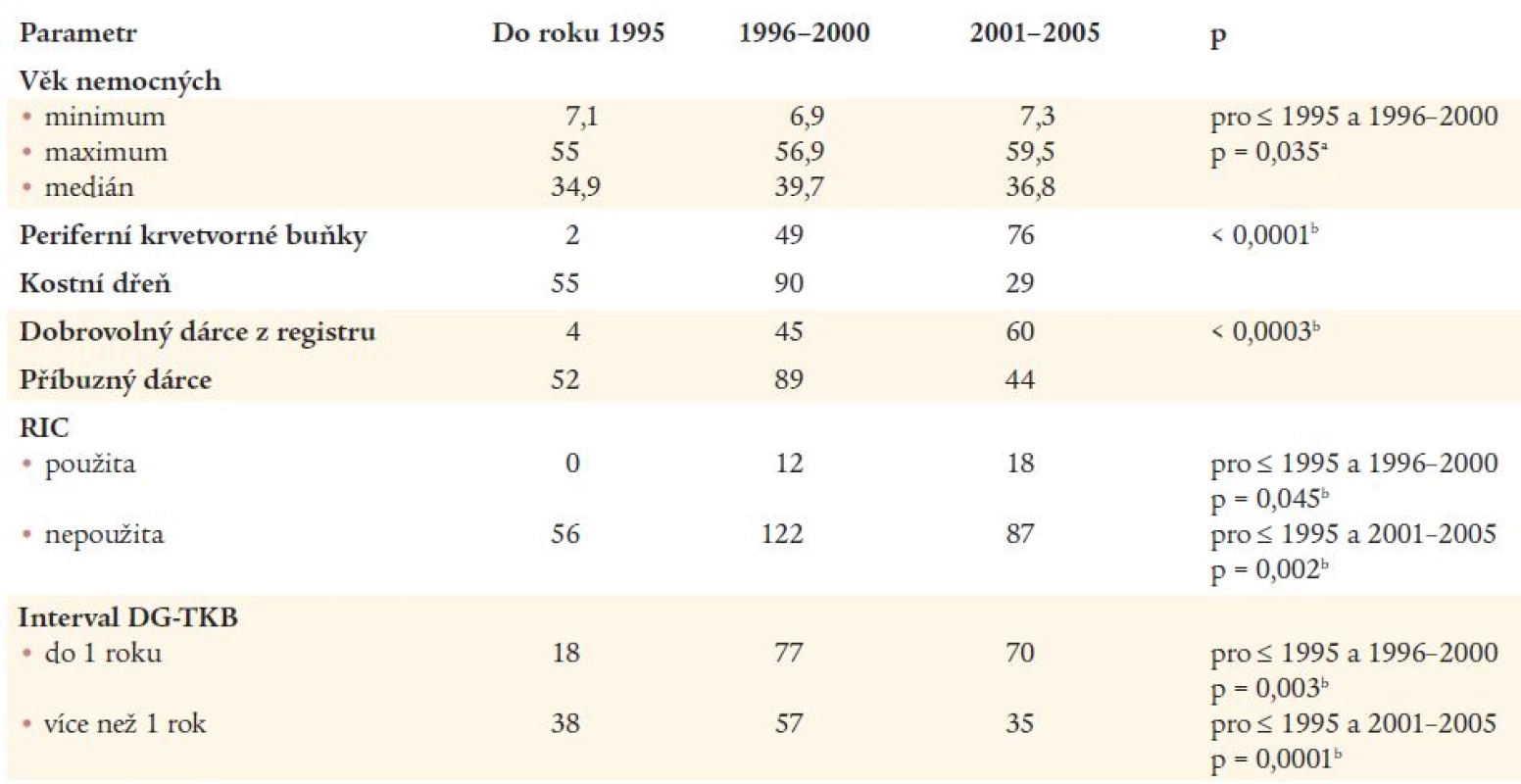
Pro sledované období byly v databázi EBMT registrovány údaje o 295 nemocných (179 mužů a 116 žen) ve věku od 6,9 do 59,5 let (medián 37,3). U dvou z nich byla před alogenní TKB provedena v minulosti autologní TKB. U dalších dvou nemocných byla provedena následně 2. alogenní TKB. Údaje o těchto dalších transplantacích nebyly při hodnocení brány v úvahu. Podobně nebyla prováděna ani žádná analýza výsledků jednotlivých center. Základní údaje o nemocných, TKB a dárcích jsou uvedeny v tab. 2. U 6 nemocných byla k transplantaci použita jak kostní dřeň, tak periferní krvetvorné buňky současně. Interval od stanovení diagnózy do TKB se pohyboval od 61 dní do 20,5 let s mediánem 316 dní. Medián sledování po TKB k datu hodnocení souboru (1. 5. 2005) byl 2 roky s rozmezím hodnot od 7 dní do 17,2 let. Další údaje o komplikacích TKB, sledování a osudu nemocných uvádíme v tab. 3. Počet TKB provedených v jednotlivých letech je uveden na obr. 1. Z tohoto grafu je na první pohled patrný pokles počtu TKB v roce 2000. V tento rok došlo ke změně trendu v počtech provedených transplantací, jež měly do roku 1999 vzestupnou tendenci, zatímco od roku 2000 se celoroční počty provedených TKB nemění (za rok 2005 jsou uvedeny pouze TKB provedené k datu hodnocení). Během sledovaného období byl potvrzen statisticky významný trend k provádění TKB u starších nemocných v letech 1996 až 2000 ve srovnání s obdobím do roku 1995 (p = 0,035) (tab. 4). Statistická významnost rozdílu ve věku nemocných do roku 1995 a po roce 2001 byla hraniční (p = 0,085). Do roku 1995 bylo ve srovnání s obdobím let 1996 až 2000 a také po roce 2001 transplantováno významně více nemocných později než jeden rok od stanovení diagnózy (p = 0,003 a 0,0001), zatímco rozdíl mezi lety 1996-2000 a 2001-2005 nebyl statisticky významný (p = 0,188). S ubíhajícím časem bylo prováděno signifikantně více TKB s využitím štěpů z periferních krvetvorných buněk (p < 0,0001). Zatímco do roku 1995 byly provedeny pouze 2 takové TKB, od roku 1996 a po roce 2001 jich bylo provedeno 49 a 76. Obdobně výrazné rozdíly byly zaznamenány ve využití dobrovolných dárců z registru, jejichž počet se v uvedených obdobích výrazně zvyšoval (p = 0,0003), po roce 2000 došlo dokonce k provedení více TKB od dobrovolných dárců než od sourozenců a ostatních příbuzných (60 vůči 44). Dále došlo ve výše uvedených časových intervalech k signifikantně častějšímu užití přípravných režimů s redukovanou intenzitou (p = 0,002). Zatímco do roku 1995 nebyla taková transplantace provedena ani jedna, od let 1996 a 2001 jich bylo provedeno 12 a 18. Rozdíl mezi posledními dvěmi intervaly nebyl statisticky významný, i když potvrzoval silný trend (p = 0,089) (tab. 4).

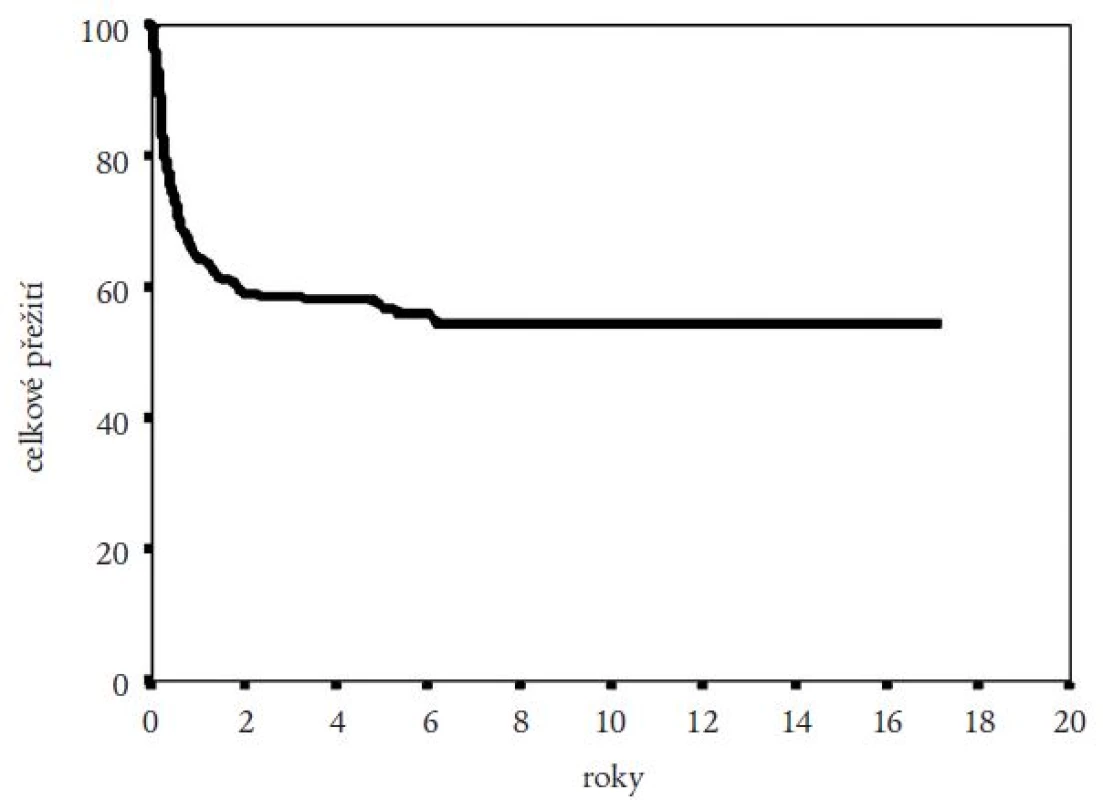
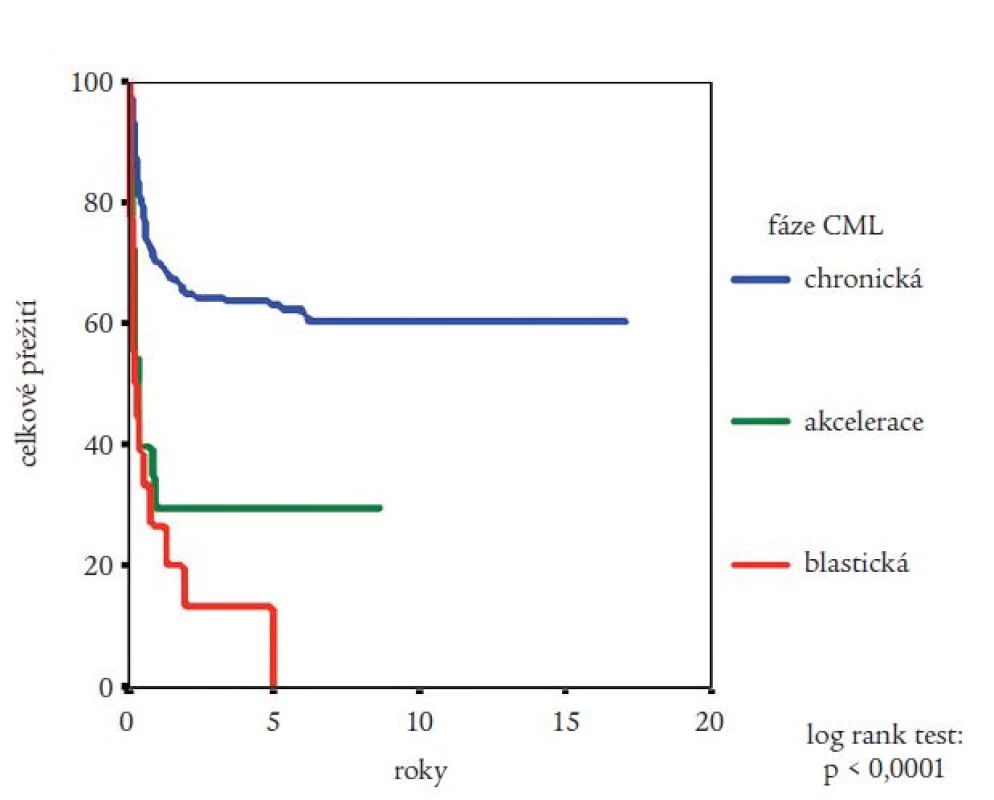
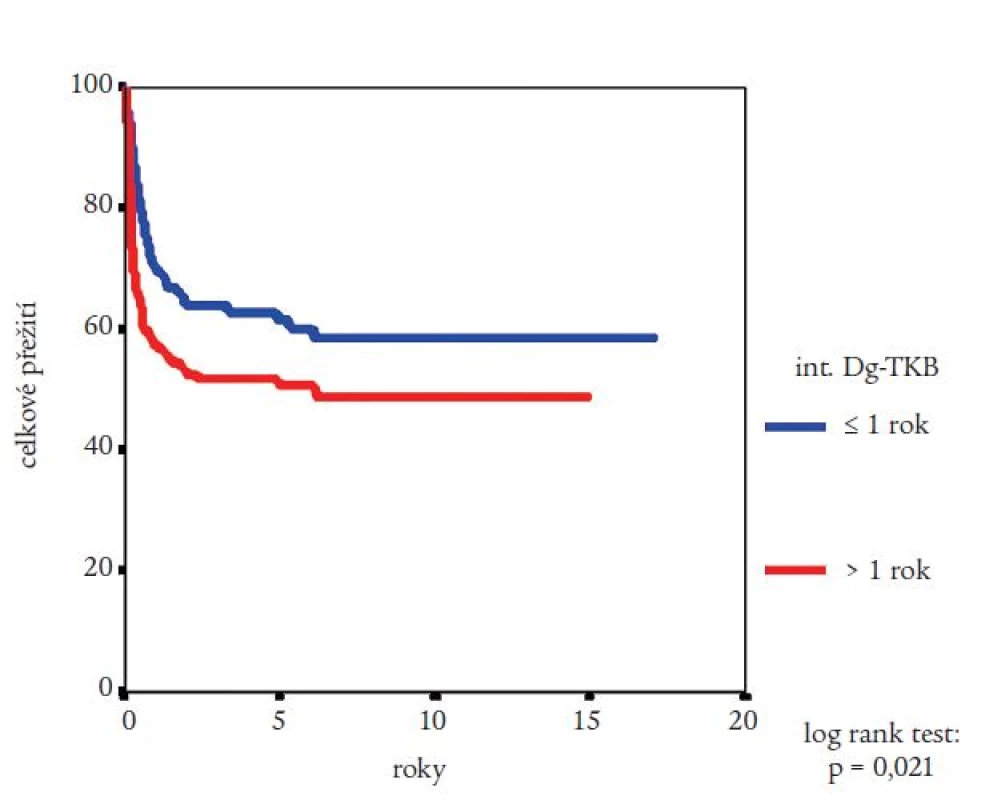
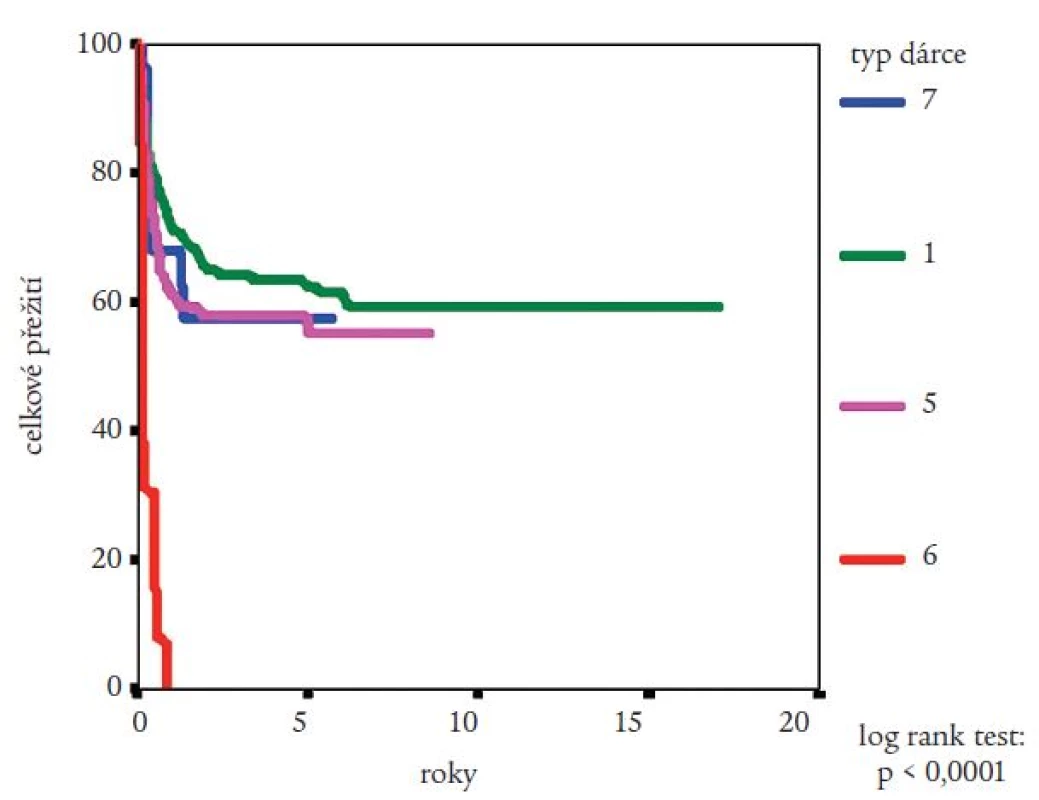
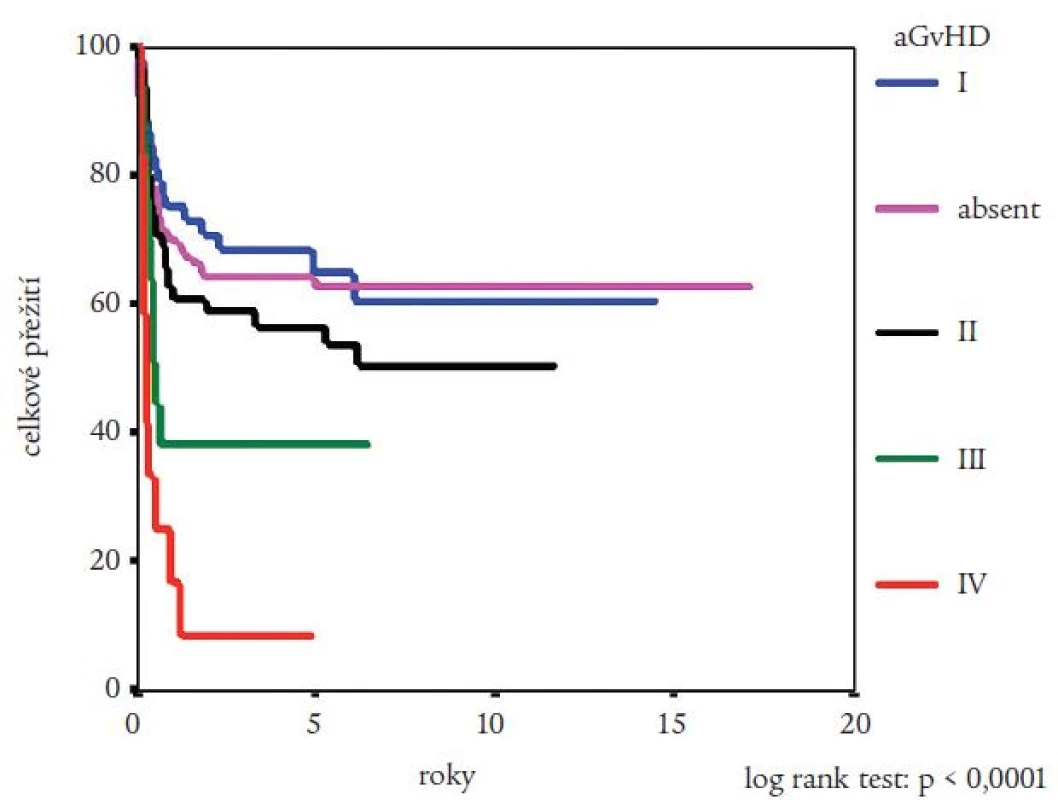
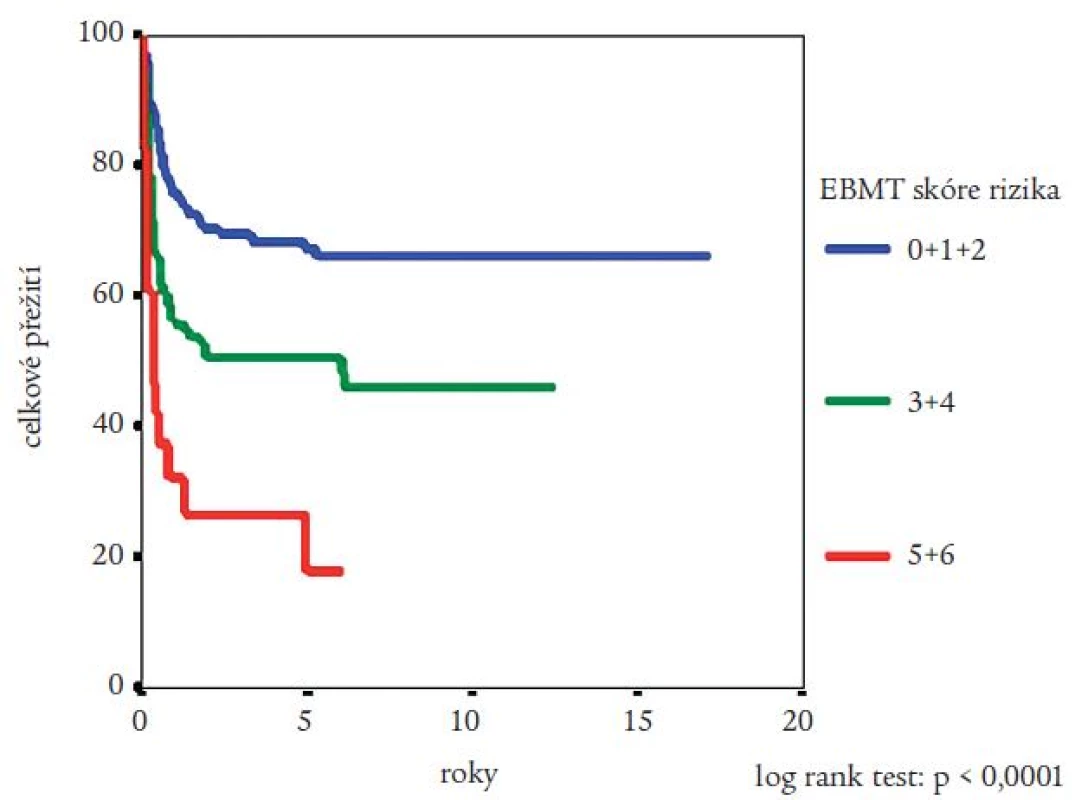
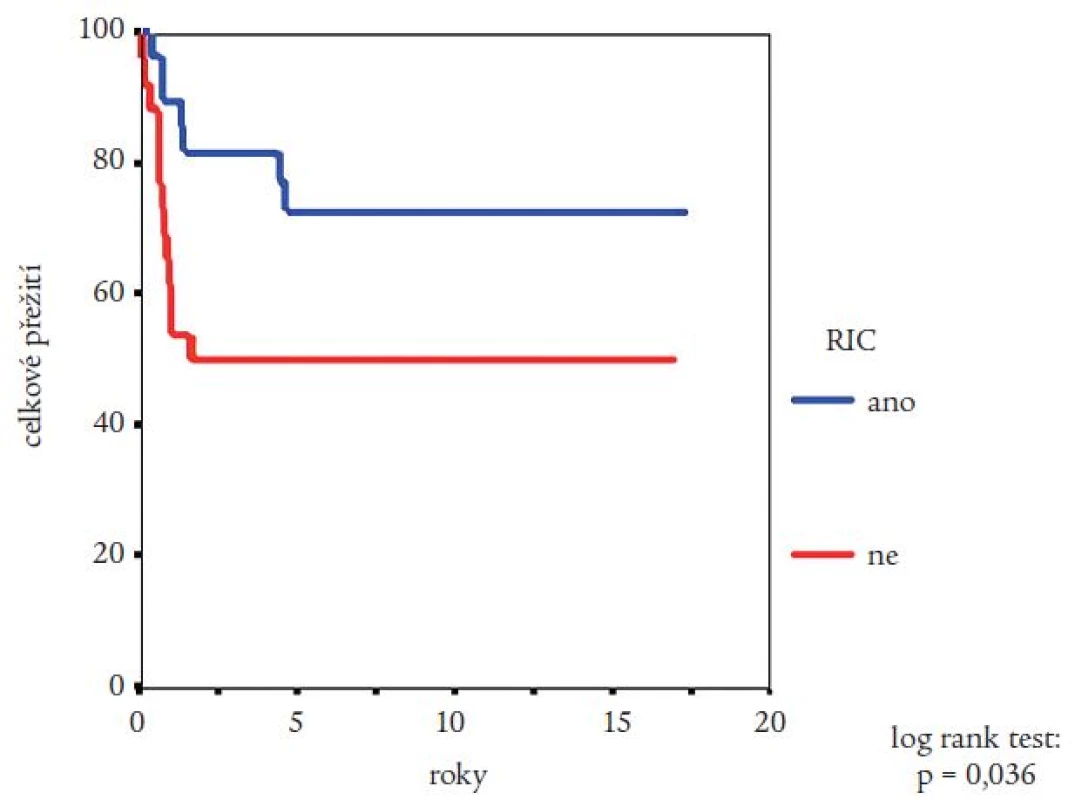
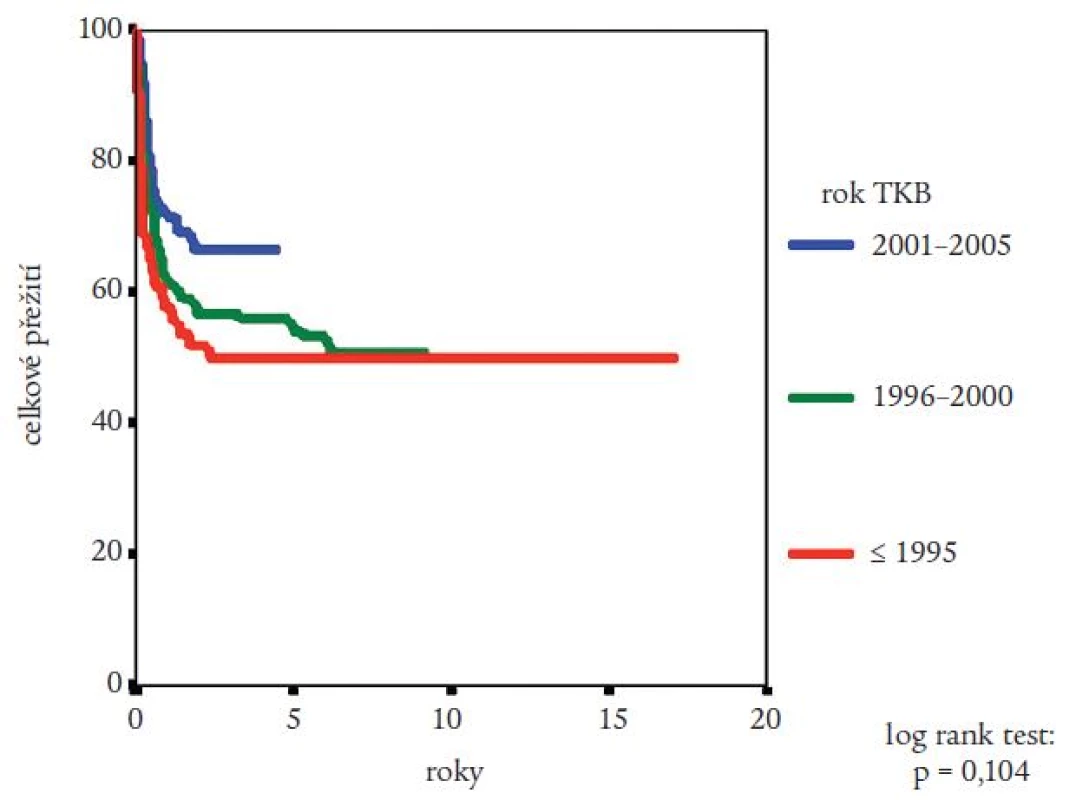
Medián přežití celého souboru nemocných nebyl dosažen (obr. 2). Pravděpodobnost přežití nemocných podle Kaplana a Meiera statisticky významně ovlivnila fáze CML, v níž byla TKB provedena, interval od stanovení diagnózy do provedení TKB (zde byla potvrzena významnost intervalu kratšího než jeden nebo dva roky) a typ dárce (obr. 3-5). Statisticky významně se projevil vliv výskytu a stupně akutní reakce štěpu vůči hostiteli (obr. 6), nikoli však výskyt chronické reakce štěpu vůči hostiteli. Výskyt chronické reakce štěpu vůči hostiteli byl statisticky významně asociován s použitím periferních krvetvorných buněk (p = 0,007). Statisticky významný vliv na přežití neměly dále zdroj krvetvorných buněk (kostní dřeň nebo periferní krvetvorné buňky), příprava s použitím celotělového ozáření a také kombinace pohlaví dárce a příjemce. Pro Coxovu regresní analýzu byly použity dva modely. V prvním byly z hlediska vlivu na přežití nemocných hodnoceny věk nemocných, typ dárce, fáze onemocnění, interval od diagnózy k TKB, rok provedení TKB a výskyt akutní reakce štěpu vůči hostiteli. Do druhého modelu bylo navíc zařazeno EBMT skóre rizika, jehož hodnota závisí na výše uvedených prognostických faktorech (tab. 1). V prvním modelu byl jako statisticky významné identifikován věk nemocného (RR = 1,032; 95% CI = 1,009-1,054; p = 0,005), fáze onemocnění (RR = 4,214; 95% CI = 1,9-9,346; p = 0,0004) a typ dárce (RR = 0,565; 95% CI = 0,334-0,955; p = 0,033). Ve druhém modelu byl jako statisticky nezávislý faktor ovlivňující přežití nemocných potvrzen EBMT skóre rizika (resp. tzv. Gratwohlův index) (RR = 1,744; 95% CI = 1,388-2,19; p < 0,0001) (obr. 7) a provedení TKB do roku po stanovení diagnózy CML (RR = 0,495; 95% CI = 0,28-0,875; p = 0,016). TKB provedené po přípravě s redukovanou intenzitou byly spojeny s vyšší pravděpodobností přežití, a to jak ve srovnání se zbytkem souboru, tak ve srovnání s vybranou skupinou nemocných srovnatelného věku, kteří byli transplantováni ve stejném období. Rozdíl v pravděpodobnosti přežití obou skupin nemocných byl statisticky významný (obr. 8). Po rozdělení všech TKB podle doby provedení výkonu (do roku 1995, v letech 1996-2000 a v letech 2001-2005) se podařilo prokázat silný trend ke zlepšování výsledků. Rozdíl v pravděpodobnosti přežití nemocných podle Kaplana a Meiera byl statisticky významný při srovnání období do roku 1995 s intervalem let 2001-2005 (p = 0,024), všechny ostatní rozdíly nebyly statisticky významné (obr. 9). Pokud byla selektována skupina nemocných ve věku do 30 let transplantovaných do jednoho roku od stanovení diagnózy po roce 2000, pravděpodobnost přežití dosahovala po 3 letech 88 %.
Diskuse
Léčba málokterého hematologického onemocnění a nádoru vůbec se změnila na přelomu tisíciletí tak výrazně, jako léčba CML. Tato nemoc byla ještě koncem 90. let minulého století rutinní indikací TKB jako léčby první linie u mladších nemocných. Konzervativní léčba interferonem byla po diagnóze indikována zejména u starších nemocných ve věku přes 40 let, kteří neměli k dispozici vhodného dárce krvetvorných buněk. Zavedení imatinibu do léčby CML v roce 2000 zásadně změnilo do té doby etablované postupy. Během tohoto i následujících let počet alogenních TKB provedených v Evropě významně klesl. Ke změně přitom došlo v čase, kdy výsledky klinických studií s imatinibem ještě nebyly k dispozici, tedy na základě jejich anticipace [8]. Je velmi důležité, že identická změna v počtech provedených TKB byla zaznamenána i v naší retrospektivní studii v České republice. Tento fakt (ale i další trendy - zejména v počtech TKB provedených s využitím dobrovolných dárců z registru, častějším aplikováním periferních krvetvorných buněk a přípravných režimů s redukovanou toxicitou) ukazuje na vysokou úroveň praxe českých center pro TKB.
Naší retrospektivní analýzou jsme potvrdily statisticky významný vliv téměř všech známých prognostických faktorů ovlivňujících pravděpodobnost přežití nemocných s CML po alogenní TKB. Nebyl prokázán pouze vliv kombinace pohlaví dárce a příjemce, pravděpodobně vzhledem k počtu hodnocených nemocných. Průkaz horšího přežití mužů, kteří byli transplantováni krvetvornými buňkami, od žen byl proveden na několikanásobně větším souboru nemocných [8].
Za velmi důležité považujeme, že se výrazně nelišila pravděpodobnost přežití nemocných transplantovaných od sourozence ve srovnání s přežitím nemocných transplantovaných od nepříbuzných dobrovolných dárců (obr. 6). Společně se stálým zlepšováním výsledků to svědčí o dobré úrovni transplantačních center. Vliv trendu časněji prováděných TKB po stanovení diagnózy zde pravděpodobně nemá tak výrazný vliv, jako zlepšování podpůrné péče a zvyšování zkušeností při výběru dárců a léčbě komplikací. Naopak je možné, že v budoucnosti dojde k opětovnému prodloužení tohoto intervalu díky pozdější indikaci TKB (po rozvoji rezistence na imatinib). Mohou se zde projevit další negativní vlivy - zvýšení biologického rizika onemocnění nebo horší celkový stav nemocných důsledkem komorbidity [16,17]. V souladu s doporučením European Leukemia Net jsme v naší studií prokázali, že nemocní ve věku do 30 let, transplantovaní v současnosti do jednoho roku od stanovení diagnózy, nemusí mít výrazně horší prognózu než nemocní léčení imatinibem. Zdá se tedy, že i v České republice je na základě těchto výsledků opodstatněné indikovat k TKB mladší nemocné s vysoce rizikovou CML (vysoký Sokalův nebo Euro index) a nízkým EBMT skóre rizika časně po stanovení diagnózy [12].
Nelze s určitostí vyloučit, že na zlepšující se výsledky TKB u CML v České republice má také vliv častější využívání režimů s redukovanou intenzitou. Mayer et al nedávno popsali nejen velmi dobré výsledky stran přežití nemocných, ale i úsporu nákladů při srovnání s hypotetickou léčbou imatinibem [18]. V naší retrospektivní analýze měli nemocní po tomto druhu přípravy signifikantní výhodu přežití ve srovnání s nemocnými stejného věku transplantovanými ve stejném období. Naše výsledky je však v tomto případě nezbytné hodnotit opatrně vzhledem k relativně malým skupinám nemocných a krátkému sledování. V jiných studiích (byť heterogenních) výsledky alogenních TKB po nemyeloablativních režimech nevycházejí lépe - snížení mortality je dosaženo pouze přechodně a během dalšího sledování mortalita opět stoupá důsledkem nárůstu výskytu reakcí štěpu vůči hostiteli po infuzích dárcovských lymfocytů indikovaných k léčbě relapsů [6,7].
Až dlouhodobé sledování nemocných léčených imatinibem přinese také odpověď na otázku, zda se naplní optimistické předpoklady vkládané do této dobře snášené léčby. K tomu, aby bylo možné výsledky této léčby srovnávat s výsledky transplantací, je nezbytné nadále shromažďovat informace jak o konzervativně léčených nemocných, tak o nemocných alogenně transplantovaných. V těchto analýzách mají nezastupitelné místo transplantační registry, a retrospektivní analýzy výsledků podobné té naší, která byla provedena jako první svého druhu v České republice. Prokázala, že praxe na transplantačních jednotkách hematologických center u nás reflektuje všechny existující moderní trendy ve světě. Dosažené výsledky jsou srovnatelné s výsledky publikovanými ze zahraničních registrů. Pravděpodobnost přežití nemocných s CML po alogenní TKB je v České republice ovlivňována standardními, dříve popsanými prognostickými faktory. Naše studie potvrdila významné trendy ve zlepšování výsledků a doložila oprávněnost časné indikace alogenní TKB u nemocných ve věku do 30 let s rizikovou CML při předpokladu nízké pravděpodobnosti morbidity vyplývající z komplikací transplantace.
Podpořeno grantem IGA MZ NR/8223-3.
MUDr. Edgar Faber, CSc.
www.fnol.cz
e-mail: edgar.faber@fnol.cz
Doručeno do redakce: 12. 7. 2006
Přijato po recenzi: 28. 8. 2006
Sources
1. Horowitz MM, Rowlings PA, Passweg JR. Allogeneic bone marrow transplantation for CML: a report from the International Bone Marrow Registry. Bone Marrow Transplant 1996; 17: S5-S6.
2. Clift RA, Storb R. Marrow transplantation for CML: the Seattle experience. Bone Marrow Transplant 1996; 17: S1-S3.
3. Radich JP, Olavarria E, Apperley JF. Allogeneic hematopoietic stem cell transplantation for chronic myeloid leukemia. Hematol Oncol Clin N Amer 2004; 18 : 685-702.
4. Robin M, Guardiola P, Devergie A et al. A 10-year median follow-up study after allogeneic stem cell transplantation for chronic myeloid leukemia in chronic phase from HLA-identical sibling donors. Leukemia 2005; 19 : 1613-1620.
5. Goldman JM, Sobocinski KA, Zhang MJ et al. Long-term outcome after allogeneic hematopoietic cell transplantation (HCT) for CML. Biol Blood Marrow Transplant 2006; 12: S17.
6. Crawley C, Szydlo R, Lalancette M et al. Outcomes of reduced-intensity transplantation for chronic myeloid leukemia: an analysis of prognostic factors from the Chronic Leukemia Working Party of the EBMT. Blood 2005; 106 : 2969-2976.
7. Quazilbash MH, Giralt SA, Champlin RE. Nonmyeloablative stem cell transplantation for chronic myeloid leukemia. Hematol Oncol Clin N Amer 2004; 18 : 703-714.
8. Gratwohl A, Baldomero H, Horisberger B et al. Current trends in hematopoietic stem cell transplantation in Europe. Blood 2002; 100 : 2374-2386.
9. Simonsson B on behalf of the IRIS (International Randomized IFN vs STI571) Study Group. Beneficial effects of cytogenetic and molecular response on long-term outcome in patients with newly diagnosed chronic myeloid leukemia in chronic phase (CML-CP) treated with imatinib (IM): update from the IRIS study. Blood 2005; 106 : 166a.
10. Hahn EA. Glendenning. Quality of life on imatinib. Semin Hematol 2003; 40(Suppl 2): 31-36.
11. Graham SM, Jorgensen HG, Allan E et al. Primitive, quiescent, Philadelphia-positive cells from patients with chronic myeloid leukemia are insensitive to STI571 in vitro. Blood 2002; 99 : 319-325.
12. Baccarani M, Saglio G, Goldman JM et al. Evolving concepts in the management of chronic myeloid leukemia. Recommendations from an expert panel on behalf of the European LeukemiaNet. Blood 2006 May 18; PMID: 16709930.
13. Hrabánek J, Lukášová M, Vítek A et al. Léčba chronické myeloidní leukemie transplantací kostní dřeně v ÚHKT Praha. Vnitř Lék 1995; 41 : 682-687.
14. Vítek A, Cetkovský P, Sajdová J et al. Výsledky transplantací od nepříbuzných dárců u nemocných s CML - I. CP se neliší od výsledků transplantací od HLA-identických sourozenců - zkušenosti jednoho centra. Sborník abstrakt XVIII. Olomouckých hematologických dnů 2.-5.6.2004 : 10-11.
15. Gratwohl A, Hermans J, Goldman JM et al. Risk assessment for patients with chronic myeloid leukaemia before allogeneic blood or marrow transplantation. Lancet 1998; 352 : 1087-1092.
16. Borhhäuser M, Kröger N, Schwerdtfeger R et al. Allogeneic haematopoietic cell transplantation for chronic myelogenous leukaemia in the era of imatinib: a retrospective multicentre study. Eur J Haematol 2006; 76 : 9-17.
17. Deininger M, Schleuning M, Greinix H et al. The effect of prior exposure to imatinib on transplant-related mortality. Haematologica 2006; 91 : 452-459.
18. Mayer J, Brychtová Y, Doubek M et al. Srovnání reálné ceny léčby chronické myeloidní leukemie nemyeloablativní transplantací krvetvorných buněk s hypotetickou terapií imatinibem (Glivec). Zamyšlení nad velmi drahými medicínskými postupy. Trans Hemat dnes 2006; 12 : 6-13.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2006 Issue 12
-
All articles in this issue
- Alogenní transplantace krvetvorných buněk u nemocných s chronickou myeloidní leukemií v České republice: retrospektivní hodnocení výsledků z let 1988 až 2005
- Elektrokardiogram u akutního infarktu myokardu s reperfuzí: co s Q-kmity a jejich dynamikou v dnešní době?
- Statiny a osteoporóza
- ZAP-70 u chronické B-lymfocytární leukemie: klinický význam a metody detekce
- Kolagenofibrotická glomerulopatia - raritná glomerulonefritída
- Ultrazvukové mapování žilního systému dolních končetin s ohledem na výskyt a anatomii přední přídatné velké safény
- Role EuroSCORE pro prospektivní odhad krátkodobého rizika u kandidátů pro kardiochirurgickou operaci: Je přesnost EuroSCORE pro odhad perioperačního rizika stejná jako pro odhad rizika nechirurgické léčby?
- Non-arrhythmic therapy of ventricular tachyarrhythmias and sudden cardiac death after acute myocardial infarction
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Statiny a osteoporóza
- Ultrazvukové mapování žilního systému dolních končetin s ohledem na výskyt a anatomii přední přídatné velké safény
- Role EuroSCORE pro prospektivní odhad krátkodobého rizika u kandidátů pro kardiochirurgickou operaci: Je přesnost EuroSCORE pro odhad perioperačního rizika stejná jako pro odhad rizika nechirurgické léčby?
- Kolagenofibrotická glomerulopatia - raritná glomerulonefritída
