Význam transezofageálnej echokardiografie v detekcii kardiogénnej a aortálnej embolizácie pri ložiskovej ischémii mozgu a tranzitórnych ischemických atakoch
The role of transesophageal echocardiopgraphy in detection of cardiogenic and aortic sources of embolism in stroke and transient ischaemic attacks
Objectives:
To prospectively investigate the prevalence of definite and potential sources of cardiogenic embolism and embolism from ascending aorta and aortic arch in patients with a cryptogenic stroke or transient ischaemic attack (TIA).
Material/methods:
The study group consisted of 218 consecutive patients (146 males, mean age 59.4 ± 11.5, range 38 - 83 years) without significant stenoses of carotic and vertebral arteries. All patients underwent biplane/multiplane transesophageal echocardiography (TEE). 77.5 % of patients suffered a stroke and 22.5 % had a TIA. Sinus rhythm was in 74.8 % of the patients, atrial fibrillation in 22.0 % and pacemaker rhythm in 3.2 %.
Results:
1. Definite source of embolism was identified in 21.6 % of patients. The most frequent finding was a thrombus of the left atrial (LA) appendage - 12.4 %. Less frequently found were mobile thrombus of aortic arch - 3.7 %, thrombus of LA body - 2.3 %, left ventricular thrombus - 2.3 %, thrombus of valvular prosthesis - 1.4 % and heart tumor - 0.5 %. 2. The total prevalence of potential sources of embolism was 61.5 %. Only potential source (without definite source) was demonstrated in 52.3 % of patients. Very frequently were found patent foramen ovale - 58.3 % and atherosclerosis of ascending aorta or aortic arch - 53.7 %. Further sources were LA spontaneous echocontrast - 21.1 %, reduced function of LA appendage - 18.3 %, atrial septal aneurysm - 7.8 %, atrial septal defect - 1.4 %, cardiac foreign body - 0.5 %. 3. TEE did not reveal any source of embolism in 26.1 % of patients.
Conclusions:
1. 21.6 % of the patients suffering from stroke/TIA without hemodynamically significant stenoses of extracranial cerebral arteries had a definite cardiogenic or aortic source of embolism, 2. additional 52.3 % of patients had only potential source of embolism (without definite source), 3. we consider TEE necessary in patients with stroke/TIA without a known etiology, despite complete neurological examination and transthoracic echocardography.
Key words:
stroke - transient ischaemic attack - cardiogenic embolism - aortic source of embolism - transesophageal echocardiography
Authors:
J. Dúbrava 1; R. Garay 2
Authors‘ workplace:
Oddelenie funkčnej diagnostiky FNsP Bratislava, pracovisko Petržalka, Slovenská republika, prednosta prim. MUDr. Juraj Dúbrava, Ph. D.
1; Neštátne neurologické oddelenie, NEURÓN PLUS, s. r. o., Bratislava, Slovenská republika, prednosta prim. MUDr. Róbert Garay, CSc.
2
Published in:
Vnitř Lék 2006; 52(2): 144-151
Category:
Original Contributions
Overview
Cieľ:
V prospektívnej štúdii určiť prevalenciu definitívnych a potenciálnych zdrojov kardiogénnej embolizácie a embolizácie z ascendentnej aorty a aortálneho oblúka u pacientov s kryptogénnou ložiskovou ischémiou mozgu (LIM)/tranzitórnymi ischemickými atakmi (TIA).
Súbor a metodika:
218 následných pacientov (146 mužov, priemerný vek 59,4 ± 11,5, rozsah 38 - 83 rokov) bez významných stenóz karotických a vertebrálnych artérií vyšetrených biplanárnou/multiplanárnou transezofagovou echokardiografiou (TEE). 77,5 % pacientov malo LIM a 22,5 % TIA. 74,8 % pacientov malo sínusový rytmus, 22,0 % fibriláciu predsiení a 3,2 % rytmus kardiostimulátora.
Výsledky:
1. Definitívny zdroj embolizácie malo 21,6 % pacientov. Najčastejší bol trombus uška ľavej predsiene (ĽP) - 12,4 %. Zriedkavejší bol mobilný trombus aortálneho oblúka - 3,7 %, trombus tela ĽP - 2,3 %, trombus ľavej komory - 2,3 %, trombus chlopňovej protézy - 1,4 %, tumor srdca - 0,5 %. 2. Potenciálny zdroj bol celkovo prítomný u 61,5 % pacientov. Len potenciálny zdroj embolizácie (bez definitívneho zdroja) malo 52,3 % pacientov. Veľmi časté bolo foramen ovale patens - 58,3 % a ateroskleróza ascendentnej aorty a oblúka - 53,7 %. Nasledovali spontánny echokontrast ĽP - 21,1 %, redukovaná funkcia uška ĽP - 18,3 %, aneuryzma predsieňového septa - 7,8 %, defekt predsieňového septa - 1,4 %, corpus alienum cordis - 0,5 %. 3. Žiadny zdroj embolizácie nebol u 26,1 % pacientov.
Závery:
1. 21,6 % pacientov s LIM/TIA bez hemodynamicky významných stenóz extrakraniálnych mozgových artérií malo definitívny kardiogénny alebo aortálny zdroj embolizácie, 2. ďalších 52,3 % pacientov malo len potenciálny zdroj embolizácie (bez definitívneho zdroja), 3. TEE považujeme za potrebné, ak komplexné neurologické vyšetrenie a transtorakálna echokardiografia nevysvetlia príčinu LIM/TIA.
Kľúčové slová:
ložisková ischémia mozgu - tranzitórny ischemický atak - kardiogénna embolizácia - aortálna embolizácia - transezofagová echokardiografia
Úvod
Náhle cievne mozgové príhody (NCMP) sú v západných krajinách druhou najčastejšou príčinou mortality a najčastejšou príčinou invalidity. Z nich dominantnú časť - asi 80 % - predstavujú ischemické NCMP. Podľa klasifikácie National Institute of Neurological Diseases existujú 4 typy ložiskovej ischémie mozgu (LIM): 1. aterotrombotické LIM na podklade významných stenóz karotických alebo vertebrálnych artérií, 2. kardioembolické LIM, 3. lakunárne LIM, 4. kryptogénne LIM (neznámej etiológie) [1]. 15 - 40 % mozgových infarktov spôsobuje kardiogénna embolizácia a 30 - 40 % infarktov má kryptogénnu etiológiu [2,3,4]. Relatívny podiel kardioembolických infarktov je najvyšší u mladých pacientov do 45 - 50 rokov.
Pacienti s kardioembolickou LIM majú spomedzi uvedených 4 typov najvyššiu nemocničnú aj dlhodobú mortalitu, najväčší rozsah neurologického deficitu a invalidity a najviac komplikácií [2,4]. V súbore Arboix et al bola nemocničná mortalita kardioembolickej LIM 27,3 %, pri aterotrombotických infarktoch 21,7 % a pri lakunárnych infarkoch 0,8 % [4]. Aj 5-ročná mortalita bola v štúdii Pettyho et al signifikantne najvyššia pri kardioembolickej LIM - 80,4 %, kým pri ostatných typoch bola podstatne nižšia - pri aterotrombotickej LIM 32,2 %, pri lakunárnych infarktoch 35,1 % a pri kryptogénnych infarktoch 48,6 % [1].
Rozpoznanie kardioembolickej etiológie je veľmi dôležité z 2 príčin: 1. včasná trombolytická liečba do 3 hodín od vzniku ischémie mozgu je v súčasnosti jediná potenciálne účinná kauzálna terapia LIM, 2. existuje účinná primárna aj sekundárna prevencia kardioembolizmu [5].
Cieľom prospektívnej štúdie bolo zhodnotenie prevalencie definitívnych a potenciálnych zdrojov kardiogénnej embolizácie a aortálnej embolizácie (t.j. z aorty ascendens a arcus aortae) u pacientov s LIM/tranzitórnymi ischemickými atakmi (TIA) bez významných stenóz karotických a vertebrálnych artérií.
Súbor pacientov a metodika
Súbor prospektívnej štúdie tvorilo 218 následných pacientov priemerného veku 59,4 ± 11,5 roka (medián 60 rokov, rozsah 38 - 83 rokov) vyšetrených pre LIM (n = 169 pacientov, 77,5 %) alebo TIA (n = 49 pacientov, 22,5 %). 146 bolo mužov (70,0 %) a 72 žien (30,0 %). Všetci pacienti boli podľa odosielajúceho neurológa bez hemodynamicky významných ultrasonografických nálezov na a. carotis communis, a. carotis interna a a. vertebralis l. utrq. Všetci pacienti absolvovali transezofagovú echokardiografiu (TEE). Vyšetrenia sme realizovali na prístrojoch Ultramark 9, fy ATL, USA (biplanárna sonda 5 MHz), Vivid 3, fy General Electrics, USA (multiplanárna sonda, 2,2 - 8,0 MHz) a Sonos 5500, fy Philips, Holandsko (multiplanárna sonda, 4,0 - 7,0 MHz). U 93 pacientov (42,7 %) sme použili i.v. kontrast (Levovist v koncentrácii 300 mg/ml, agitovaná 10 % glukóza alebo agitovaný fyziologický roztok). 163 pacientov (74,8 %) malo pri TEE sínusový rytmus, 48 pacientov (22,0 %) fibriláciu predsiení a 7 pacientov (3,2 %) rytmus kardiostimulátora.
Zdroje embolizácie sme klasifikovali na definitívne a potenciálne [6]. Za definitívne zdroje sme považovali: tromby v tele alebo ušku ľavej predsiene (ĽP), tromby ľavej komory (ĽK), mobilné tromby aortálneho oblúka alebo ascendentnej aorty, tromby chlopňových protéz v aortálnej alebo mitrálnej pozícii, vegetácie na aortálnej alebo mitrálnej chlopni a nádory ĽP alebo ĽK. Z potenciálnych zdrojov sme sledovali prevalenciu foramen ovale patens (PFO), aneuryzmy predsieňového septa (ASA), aterosklerózy ascendentnej aorty a/alebo aortálneho oblúka, spontánneho echokontrastu ĽP, redukovanej funkcie uška ĽP (vyprázdňovacia rýchlosť < 0,40 m/s), defektu predsieňového septa a corpus alienum cordis.
Výsledky
Definitívny zdroj embolizácie sme zistili u 21,6 % pacientov, len potenciálny zdroj embolizácie (bez definitívneho zdroja) u 52,3 % pacientov a žiadny zdroj embolizácie u 26,1 % pacientov (tab. 1). Celkovo malo potenciálny zdroj 61,5 % pacientov.
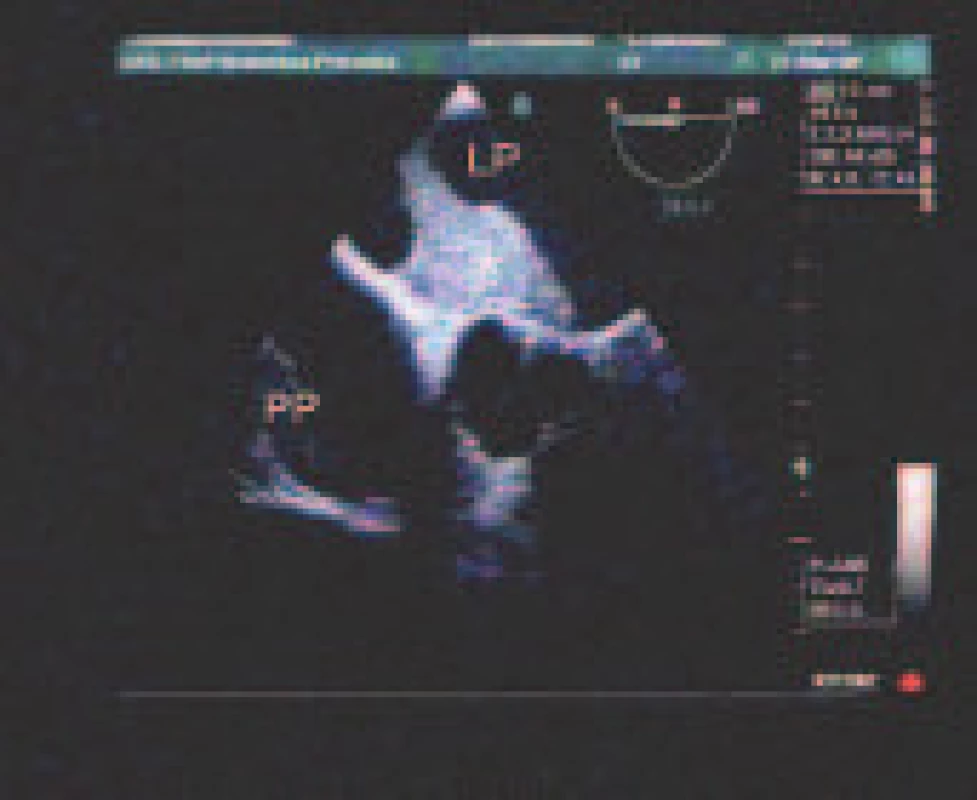
Jednoznačne najčastejším definitívnym zdrojom embolizácie bol trombus uška ĽP - 12,4 %, ktorý bol 5,4-krát častejší ako tromby ĽK a tela ĽP (obr. 1) - à 2,3 %. Druhým najčastejším zdrojom boli mobilné tromby aortálneho oblúka - 3,7 %. Sporadický bol nález trombov chlopňových protéz a tumoru ľavého srdca (1 pacient s myxómom ĽP) (tab. 2).

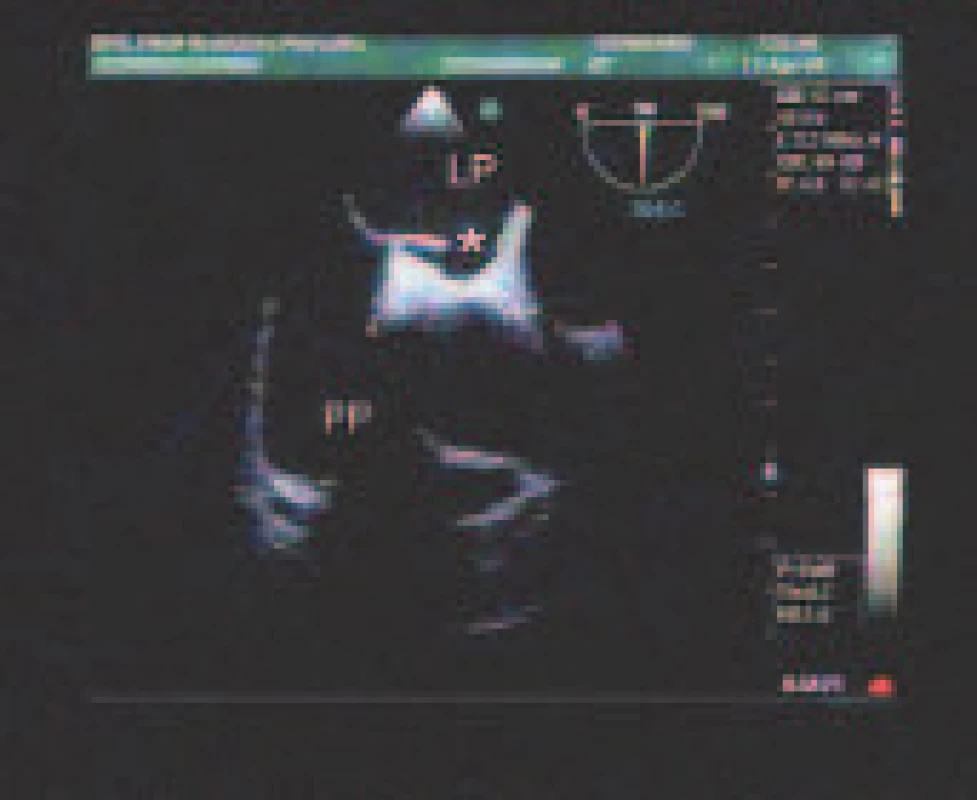
Potenciálne zdroje embolizácie sú uvedené v tab. 3. Veľmi častý bol nález PFO - 58,3 % (obr. 2). Priemerná veľkosť bola 2,0 ± 1,0 mm, medián 1,5 mm. Rozsah separácie septum primum a secundum bol 1,0 - 6,5 mm. PFO bolo v 105 prípadoch (82,7 %) zobrazené farebným dopplerovským mapovaním, resp. v tzv. Color M-mode. I.v. kontrast poskytol dodatočnú diagnostickú informáciu v 22 prípadoch (17,3 %), v ktorých nebolo PFO ináč detegovateľné. Porovnateľne častá bola ateroskleróza ascendentnej aorty alebo aortálneho oblúka - 53,7 %. Jej stupne sme hodnotili podľa modifikovanej klasifikácie French Study of Aortic Plaques in Stroke (FAP) [7]. Najčastejšie šlo o simplexnú aterosklerózu I. stupňa s hrúbkou plátov do 4 mm (33,0 %), nasledovali simplexná ateroskleróza II. stupňa s hrúbkou plátov nad 4 mm (13,3 %) a ateroskleróza III. stupňa s exulcerovanými alebo trombotizovanými plátmi nezávisle od ich hrúbky (7,3 %). Pomerne častý bol spontánny echokontrast ĽP (vždy v dilatovanej ĽP) - 21,1 % a redukovaná funkcia uška ĽP s vyprázdňovacou rýchlosťou < 0,4 m/s - 18,3 %. ASA sme našli u 7,8 % pacientov (obr. 3). Sporadicky sa vyskytol defekt predsieňového septa a corpus alienum ľavého srdca (1 pacientka po chirurgickom uzávere defektu predsieňového septa ante annos multos s rigídne prominujúcou časťou záplaty rozmeru 15 x 2 mm, ktorá odstupovala šikmo do ĽP).

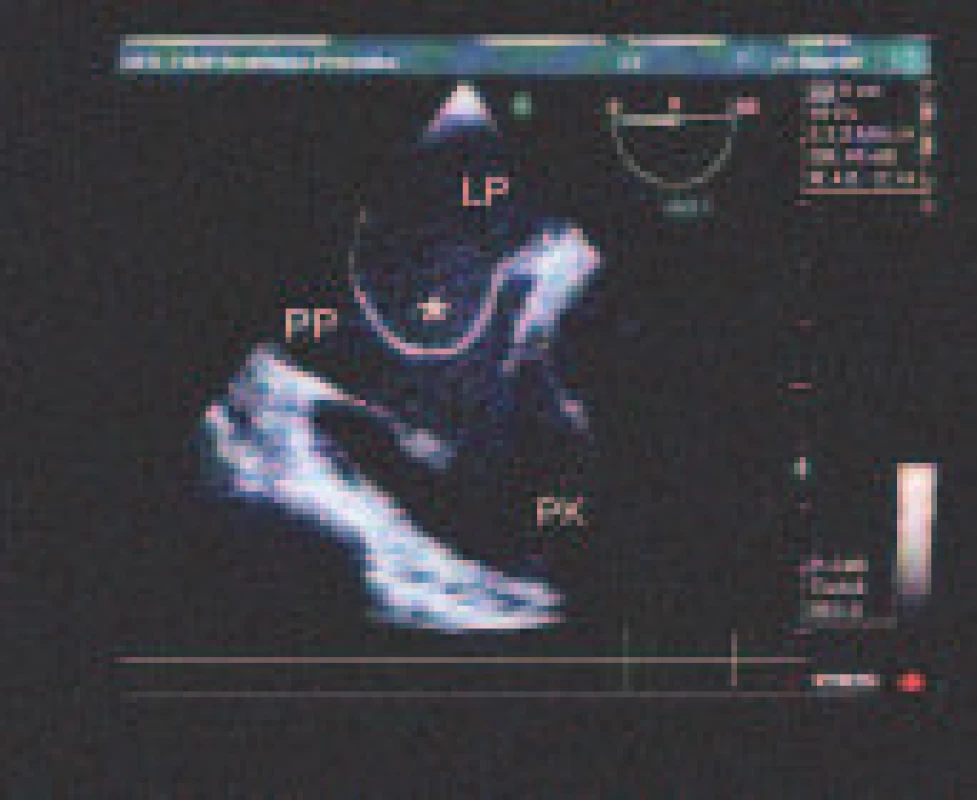
Eustachova chlopňa pravej predsiene sa vyskytla u 26 pacientov (21,1 %).
Diskusia
Prevalencia kardiogénnej etiológie LIM/TIA (a logicky nepriamo úmerne aj kryptogénnej embolizácie) závisí na rozsahu a kvalite kardiologického vyšetrenia a najmä transezofagovej echokardiografie (TEE) [5,6]. V rozsiahlej štúdii VOTE (Value of Transesophageal Echocardiography) u 847 pacientov s LIM/TIA viedol TEE nález k zmene manažmentu u 27 % pacientov [8].
TEE identifikuje definitívny zdroj kardiogénnej alebo aortálnej embolizácie u jedného z 5 - 6 pacientov s LIM bez hemodynamicky významných stenóz karotíd. Palazzuoli et al zistili definitívny zdroj embolizácie u 14 % zo 73 pacientov s LIM nejasnej etiológie [9]. Je to porovnateľný podiel s nálezom 21,6 % v našom súbore 218 pacientov. Je relatívne prekvapivé, že v literatúre sa viac pozornosti venuje prevalencii potenciálnych a nie definitívnych zdrojov embolizácie. Zrejme to odráža neistotu v manažmente sekundárnej prevencie LIM u pacientov s potenciálnym zdrojom a potrebu ďalších klinických štúdií.
Najčastejším definitívnym zdrojom embolizácie sú tromby uška ĽP. V našej štúdii bola ich prevalencia 12,4 %. Yahia et al ich detegovali pri kryptogénnej LIM v 3,4 % [10], Rauh et al v malom súbore 30 pacientov v 10 % [11]. Chen a Redberg uvádzajú ich výskyt v štúdiách publikovaných do roku 2001 5 - 17 % [6]. Najsilnejšími nezávislými prediktormi trombózy uška ĽP sú fibrilácia/flutter predsiení, mitrálna stenóza, systolická dysfunkcia ĽK [12] a vyprázdňovacia rýchlosť uška < 20 cm/s [6]. Títo pacienti s LIM sú vhodnými kandidátmi na TEE [12]. Nevalvulárna fibrilácia predsiení zvyšuje riziko infarktu mozgu 2 - 5-krát [13] a nevalvulárna fibrilácia 17-krát. 60 % pacientov s kardiogénnou LIM má fibriláciu predsiení [2]. Riziko recidívy LIM pri nevalvulárnej fibrilácii predsiení bez antikoagulačnej a antiagregačnej liečby je 10 % ročne. Antikoagulačná liečba znižuje riziko o 70 %, antiagregačná liečba o 22 % [14]. Pri absencii uvedených rizikových faktorov je pravdepodobnosť nálezu trombu uška alebo tela ĽP veľmi nízka. Senzitivita TEE pre nález trombu uška ĽP je 93 - 100 % a špecificita 99 - 100 % [15].
Tromby tela ĽP sú zriedkavejšie. Yahia et al ich zistili u 2,5 % pacientov [10], čo je takmer identický údaj ako 2,3 % v našej štúdii.
Publikované údaje o TEE nálezoch trombov ĽK pri LIM sú prekvapujúco chudobné. V literatúre sú dostupné len údaje o spoločnej prevalencii trombov ĽP a ĽK - 8 % [9] až 17 % [16]. V našom súbore bol nález trombov ĽK 2,3 % a sumárny podiel trombov ĽK a celej ĽP 17,0 %. Je možné, že limitovaný rozsah informácií súvisí s faktom, že vo všeobecnosti sú tromby ĽK lepšie detegovateľné pomocou transtorakálnej echokardiografie (TTE) ako TEE. Týka sa to najmä hrotu ĽK, v ktorom je lokalizovaná väčšina trombov ĽK.
Druhým najčastejším zdrojom embolizácie boli v našej štúdii mobilné tromby ascendentnej aorty alebo aortálneho oblúka - 3,7 %. Yahia et al ich zistili u 1,7 % z 237 pacientov s kryptogénnou LIM [10]. Palazzuoli et al našli komplexné aortálne plaky (t.j. trombotizované a/alebo ulcerované) v 11 % [9].
Zriedkavým zdrojom embolizácie sú tumory ľavého srdca. Ide najmä o myxómy a papilárne fibroelastómy. V literatúre sa uvádza ich prevalencia pri mozgových infarktoch 1,9 % [17], resp. 2 % [9]. V našom súbore sme zistili myxóm ĽP len u jedného pacienta (0,5 %). Embolizovať môžu nielen časti tumoru ale aj nasadajúce tromby.
Vegetácie chlopní ľavého srdca ako príčinu kardioembolizmu sme v našej štúdii nezistili. Stöllberger et al ich zistili pri LIM v 3,8 % [16] Benetka et al detegovali v súbore 327 pacientov s infekčnou endokarditídou cerebrálnu ambolizáciu v 17 % a periférnu embolizáciu v 14 % [18]. Nezávislými prediktormi embolizácie vegetácií sú: 1. dĺžka vegetácie (< 10 mm - 20 %, 10 mm - 58 %, > 15 mm - 69 %), 2. nízky pomer krčok/maximálna šírka vegetácie, 3. vysoká mobilita vegetácie (trieda III a IV podľa Sanfilippa), 4. veľký uhol maximálnej deviácie dlhej osi vegetácie počas srdcového cyklu.
V našom súbore pacientov sme identifikovali potenciálny zdroj embolizácie u 61,5 % pacientov. Len potenciálny zdroj (t.j. bez prítomnosti definitívneho zdroja) malo 52,3 % pacientov. Ide o údaje porovnateľné s literatúrou. Palazzuoli et al zistili takmer identickú prevalenciu potenciálneho zdroja pri kryptogénnej LIM - 61 % [9]. Lee et al [19] ho detegovali u 52 % pacientov s LIM/TIA nejasnej etiológie - najčastejšie šlo o chlopňové vlákna („strands“) chlopní ľavého srdca, nasledovali spontánny echokontrast (SEK) ĽP a PFO. Comess et al [20] našli potenciálny zdroj u 45 % pacientov s LIM/TIA - v zostupnom poradí ASA, interatriálne skraty a SEK.
Najčastejším potenciálnym zdrojom embolizácie tak v našej štúdii ako aj vo väčšine iných štúdií bolo PFO. Väčšina prác uvádza jeho výskyt pri kryptogénnych LIM v rozmedzí 19 - 25 % [9,10,11,21,22,23]. Steiner et al našli PFO u 45 % mozgových infarktov nejasnej etiológie [24] a Beattie et al u takmer polovice pacientov do 45 rokov [25]. Náš nález 58,3 % bol identický ako 58 % v štúdii Cujeca et al u pacientov do 60 rokov [26]. Analogicky v talianskej štúdii ASA-MI bola prevalencia PFO u pacientov s LIM mladších ako 55 rokov 58,8 % a prevalencia ASA 48,8 %. ASA aj PFO boli nezávislými prediktormi LIM u pacientov tejto vekovej kategórie s normálnymi karotídami [27]. Prevalencia PFO aj ASA je signifikantne vyššia u pacientov s LIM/TIA ako u zdravých. PFO je významne častejšie pri nelakunárnych ako lakunárnych infarktoch mozgu (41 % vs 17 %) [28]. PFO je veľmi časté najmä u pacientov s ASA - 56 - 89 % [27,29].
Charakteristiky vysokého rizika PFO sú: veľký rozmer (≥ 4 - 6 mm), významný pravo-ľavý skrat, trvalá prítomnosť skratu aj bez Valsalvovho manévra, prítomnosť ASA, výrazná mobilita septa. Diagnózu LIM/TIA spôsobenej paradoxnou embolizáciou podporujú pri dôkaze PFO s pravo-ľavým skratom: klinický a CT/MR obraz embolickej príhody, Valsalvov manéver v úvode iktu, nález hlbokej venóznej trombózy, protrombotické/trombofilné stavy, súčasná embolizácia do periférnych artérií alebo do a. pulmonalis [30].
Na klinickú manifestáciu ischémie mozgu je potrebná prahová veľkosť trombu 1 mm. Menší rozmer PFO v kľude a po uvoľnení Valsalvovho manévra sa nepovažuje za klinicky významný. V našom súbore bolo 17,3 % prípadov PFO detegovateľných len pomocou i.v. kontrastu, t.j. bez jednoznačného zobrazenia pri dvojrozmernej echokardiografii a farebnom dopplerovskom mapovaní, resp. v tzv. Color M-mode. Vzhľadom na rozmer PFO menší ako 1 mm sme nepredpokladali kauzálnu súvislosť PFO s LIM/TIA. Podanie i.v. kontrastu pri diagnostike PFO považujeme za veľmi prínosné najmä pri diagnostickej neistote, napr. pri „miznutí“ optimálnej roviny septa po uvoľnení Valsalvovho manévra. U pacientov s embolizačnými syndrómami a PFO treba pátrať po zdroji embolizácie. Obvykle ide o trombus v hlbokom venóznom systéme dolných končatín alebo vo venóznych plexoch malej panvy, zriedkavo vo vénach povodia hornej dutej žily. Výnimočne embolizuje netrombotický materiál - tuková alebo vzduchová embólia a v literatúre boli raritne popísané aj paradoxná embólia Grawitzovho tumoru prerastajúceho do pravej komory so vznikom metastáz v mozgu, resp. embólia ovariálneho karcinómu do mozgu. Najmä u mladých ľudí treba myslieť na kongenitálny trombofilný stav (APC rezistencia, deficit proteínov C, S, antitrombínu III, antifosfolipidový syndróm) a hyperhomocysteinémiu.
Prevalencia aneuryzmy predsieňového septa (ASA) u pacientov s neaterotrombotickou LIM/TIA má široký rozptyl 6,7 - 28 % [9,11,21,22,23,29], ktorý je daný nejednotnou definíciou ASA. V našej práci sme definovali ASA ako protrúziu časti alebo celého septa ≥ 15 mm z roviny predsieňového septa buď do ĽP alebo do pravej predsiene alebo pri fázickej exkurzii septa počas srdcového cyklu striedavo do oboch predsiení musel byť súčet celkovej amplitúdy exkurzií ≥ 15 mm. Vzhľadom na prísnejšiu definíciu ASA bola jej prevalencia v našej práci (7,8 %) nižšia ako vo väčšine iných prác, ktorých autori definovali ASA ako protrúziu septa > 11 mm, resp. > 10 mm. Viaceré štúdie verifikovali, že výskyt ASA je signifikantne vyšší u pacientov s LIM/TIA/periférnou embolizáciou ako u asymptomatických pacientov. Rovnako ako PFO aj ASA je signifikantne častejšia pri nelakunárnych ako lakunárnych infarktoch mozgu (16 % vs 6 %) [28]. Pravdepodobnosť embolickej príhody pri ASA zvyšuje skrat na úrovni predsiení.
Prevalencia spontánneho echokontrastu (SEK) ĽP v rôznych štúdiách výrazne varíruje, lebo správne zhodnotenie jeho prítomnosti/absencie veľmi závisí na nastavení ovládacích parametrov, najmä zisku obrazu a na frekvencii sondy. V literatúre sa uvádza výskyt SEK pri neaterotrombotických LIM 4,8 - 29 % [9,16,31]. V tomto rozmedzí je aj náš nález 21,1 %. SEK sa najčastejšie zisťuje pri mitrálnej stenóze, fibrilácii predsiení a dilatácii ĽP. TEE má podobne ako pri iných potenciálnych zdrojoch embolizácie vysoký diagnostický prínos, ale dosiaľ nie je zrejmý vplyv nálezu na voľbu terapie. Ani warfarín ani kyselina acetylsalicylová neovplyvňujú SEK ĽP.
Dôležitým zdrojom cerebrálnej embolizácie sú aterosklerotické plaky ascendentnej aorty alebo aortálneho oblúka, ktoré sa nachádzajú až u 60 % prípadov LIM bez inej zistenej príčiny [15]. V našom súbore sme ich zistili u 53,7 % pacientov. Najčastejšie boli simplexné plaky do hrúbky 4 mm (33,0 %). Signifikantne vyšší embolický potenciál majú plaky hrúbky ≥ 4 mm [7], ktoré sme našli u 13,3 % pacientov. Yahia et al detegovali takéto plaky u 8 % pacientov s kryptogénnou LIM/TIA [10], ale Matsumura et al až u 28 % pacientov [32]. Najvyššie riziko embolizácie majú komplexné plaky (trombotizované alebo ulcerované bez ohľadu na ich hrúbku). Yahia et al ich zistili u 25 % pacientov [10]. Vulnerabilita plaku a embolické riziko sa zvyšuje pri „mäkkých“ lipidových plakoch bez kalcifikátov. Treba zdôrazniť, že embolizovať môžu nielen nasadajúce tromby, ale aj samotný lipidový materiál.
Zriedkavo sa na patogenéze embolizácie podieľa defekt predsieňového septa (DPS). Na rozdiel od PFO pri DPS ide o ľavo-pravý skrat. Pri aktivitách typu Valsalvovho manévra dochádza k jeho otočeniu a možnosti centrálnej alebo periférnej embolizácie. V našom súbore sme ho zistili u 1,4 % pacientov rovnako ako Blum et al [33].
Ďalšie potenciálne zdroje embolizácie sú dilatácia ĽP, systolická dysfunkcia ĽK, aneuryzmy ĽK, kalcifikáty mitrálneho anulu, chlopňové vlákna mitrálnej alebo aortálnej chlopne. Tieto abnormality sme v prezentovanej štúdii cielene neanalyzovali.
V súčasnosti neexistuje konsenzus o vzťahu kalcifikátov mitrálneho anulu a LIM. Ich výskyt je častý tak v neselektovanej populácii starších pacientov ako aj pri LIM. Boon et al sledovali 657 pacientov s kalcifikátmi mitrálneho anulu a 562 pacientov bez nich priemerne 2,4 roka. Zistili, že kalcifikáty nie sú prediktorom LIM [34]. Naproti tomu iní autori uvádzajú lineárny vzťah mozgových infarktov a rozsahu kalcifikátov [15]. Nález kalcifikátov sa nepovažuje za indikáciu antikoagulácie.
Chlopňové vlákna („valvular strands“) sú jemné vlasovité útvary na predsieňovej ploche mitrálnych cípov alebo na komorovej ploche aortálnych cípov. Častejšie sú na mitrálnej chlopni. Väčšinou sa chápu ako degeneratívne zmeny chlopní, ale na ich vzniku sa môže podieľať aj trombotický materiál, fibrínové vlákna, rupturované chordy alebo redundantné cípy [6]. Predispozíciou je zhrubnutie alebo redundancia chlopne. Tice et al ich našli významne častejšie pri cerebrálnej ischémii ako u zdravých (6,3 % vs 0,3 %). Vo všeobecnosti sa ich výskyt pri kryptogénnej LIM uvádza 7 - 22,5 % [6,9]. Podľa súčasného názoru je význam chlopňových vlákien v patogenéze LIM pravdepodobne malý [6] a dopad na liečbu pacientov s LIM nie je jasný.
Prolaps mitrálnej chlopne sa nepovažuje za rizikový faktor systémovej embolizácie [6].
Nález potenciálneho zdroja embolizácie u pacienta s LIM/TIA treba posudzovať triezvo. Stanovenie kauzálnej súvislosti si vyžaduje spoluprácu neurológa a kardiológa. Vždy treba vylúčiť všetky ostatné možné príčiny ischémie mozgu. Hlavné problémy interpretácie potenciálnych zdrojov embolizácie pri LIM/TIA sú:
- častý až veľmi častý výskyt aj u asymptomatických osôb. Napr. Meissner et al vykonali TEE u 581 zdravých dobrovoľníkov starších ako 45 rokov. Prevalencia PFO bola 25,6 %, ASA 2,2 % a chlopňových vlákien až 46 % [35]. Podobne Roijer et al vyšetrili TEE u 68 asymptomatických dobrovoľníkov. Výskyt ASA bol 13 %, PFO 22 %, kalcifikátov mitrálneho anulu 22 % a protrudujúcich plakov aorty 7 % [36].
- zväčša nejasná kauzálna súvislosť. Asociácia potenciálnych zdrojov embolizácie (najmä PFO a ASA) a embolizačných príhod je síce verifikovaná na mnohých pomerne veľkých súboroch pacientov s kryptogénnymi príhodami, ale u individuálneho pacienta je príčinný súvis obvykle neistý. Napr. len výnimočne sa zobrazí pasážujúci venózny trombus cez PFO [15,30]. Úroveň dôkazov o kauzálnom súvise LIM/TIA a potenciálnych zdrojov embolizácie je pomerne nízka [6,37].
- nepresne definovaný dopad na liečbu a sekundárnu prevenciu podľa „evidence-based medicine“.
Žiadny zdroj embolizácie sme nezistili u 26,1 % pacientov, podobne ako Palazzuoli et al - 25 % [9] a Cerrato et al - 24 % [22]. Iní autori uvádzajú absenciu akéhokoľvek zdroja embolizácie až v 67 % [16]. Títo autori však analyzovali podstatne užšie spektrum potenciálnych zdrojov.
TEE identifikuje signifikantne viac definitívnych aj potenciálnych zdrojov embolickej mozgovej ischémie ako TTE. Je to logické, lebo TTE len výnimočne umožní vyšetriť uško ĽP a významne horšie zobrazuje ĽP, predsieňové septum, aortu, chlopne a chlopňové protézy. Až už 3/4 pacientov s LIM je TTE bez čo i len potenciálneho zdroja embolizácie [25]. Blum et al porovnali prínos TTE a TEE u 68 pacientov s LIM a nízkym klinickým rizikom kardioembolizmu. Až u 1/2 pacientov sa pri TEE zistil významný nález, ktorý zmenil manažment pacienta a pritom nebol stanovený pomocou TTE [33]. V neselektovanej populácii pacientov s LIM sa pri TTE nachádzajú masy ľavého srdca (tromby, tumory, vegetácie) v 4 %, kým pri TEE v 11 % [38]. Prínos TEE na detekciu potenciálnych zdrojov kardioembolizmu je podľa Tomana aspoň o 50 % vyšší ako pri TTE [15]. Negatívny nález TTE vôbec nevylučuje kardiogénny zdroj embolizácie, kým pri negatívnom náleze TEE je kardioembolizmus vysoko nepravdepodobný. Vzhľadom na vysokú prevalenciu nami zistených zdrojov embolizácie, ktoré je možné detegovať len z ezofagového prístupu, považujeme TEE za potrebné, ak neurologické vyšetrenie vrátane ultrasonografie extrakraniálnych mozgových tepien a TTE nevysvetlia príčinu LIM/TIA.
V západných krajinách sa vykonáva TEE u 28 - 40 % pacientov s LIM [16,31]. Na Slovensku tento podiel nie je známy, ale určite je oveľa nižší. Príčinou je nízka dostupnosť TEE a nízka úhrada zdravotnými poisťovňami (TEE je finančne stratové vyšetrenie).
V súčasnosti neexistuje konsenzus o tom, u ktorých pacientov s LIM/TIA treba vykonať len TTE, u ktorých aj TEE, resp. v akom poradí. McNamara et al zistili, že pomer „náklady-efektivita“ je najlepší pri vykonaní primárnej TEE oproti samotnému TTE alebo sekvencii TTE-TEE [39]. Rôzne pracoviská používajú rôzne schémy. Napr. Palazzuoli et al odporúčajú najprv TTE a až potom TEE [9]. Podľa Yahiu et al treba zvážiť TEE u všetkých pacientov s LIM/TIA neznámej príčiny [10], resp. podľa Mattioliho et al u každého pacienta s LIM bez signifikantného USG nálezu na karotídach [23]. Iní autori odporúčajú zvážiť TEE u každého pacienta s novovzniknutou LIM [33]. Rutinné TEE u všetkých pacientov s LIM je otázne kvôli nejasnému manažmentu pacientov s potenciálnymi zdrojmi embolizácie.
Podľa aktuálnych odporúčaní American College of Cardiology/American Heart Association je echokardiografia jednoznačne indikovaná u týchto pacientov s mozgovou príhodou [37]: 1. pacienti s klinickými znakmi náhlej oklúzie cerebrálnej tepny bez ohľadu na vek, 2. všetci mladší pacienti (typicky < 45 rokov), 3. starší pacienti (typicky > 45 rokov) bez významného postihnutia mozgových tepien alebo inej zrejmej príčiny, 4. pacienti, u ktorých rozhodnutie o terapii (antikoagulácia, atď.) závisí na echokardiografickom náleze. Je zaujímavé, že tieto mienkotvorné odporúčania sa vyhli bližšej špecifikácii, kedy je indikované TTE a kedy TEE.
V našej praxi sa orientujeme podľa nasledujúcej pozitívnej, resp. negatívnej predikcie. Kardioembolickú etiológiu LIM podporujú rizikové faktory tromboembolizmu (najmä fibrilácia predsiení), náhly vznik príhody v povodí a. cerebri anterior alebo media, maximum neurologického deficitu hneď v úvode príhody, postihnutie viacerých cerebrovaskulánych teritórií, zvýšená tendencia k hemoragickej transformácii a zvýšené riziko synkop a kŕčov v úvode príhody. Pravdepodobnosť kardioembolizmu znižujú signifikantná ateroskleróza mozgových tepien, postupná progresia neurologického deficitu a premonitórne TIA [3,4,37].
Záver
- 21,6 % pacientov s LIM/TIA bez hemodynamicky významných stenóz na extrakraniálnych mozgových tepnách malo definitívny kardiogénny alebo aortálny zdroj embolizácie.
- Ďalších 52,3 % pacientov malo len potenciálny zdroj embolizácie (bez definitívneho zdroja).
- TEE považujeme za potrebné, ak neurologické vyšetrenie vrátane ultrasonografie extrakraniálnych mozgových tepien a TTE nevysvetlia príčinu LIM/TIA.
MUDr. Juraj Dúbrava, Ph.D.
e-mail: dubrava@npba.sk
Doručeno do redakce: 19.9. 2005
Přijato po recenzi: 6. 12. 2005
Sources
1. 21,6 % pacientov s LIM/TIA bez hemodynamicky významných stenóz na extrakraniálnych mozgových tepnách malo definitívny kardiogénny alebo aortálny zdroj embolizácie.
2. Ďalších 52,3 % pacientov malo len potenciálny zdroj embolizácie (bez definitívneho zdroja).
3. TEE považujeme za potrebné, ak neurologické vyšetrenie vrátane ultrasonografie extrakraniálnych mozgových tepien a TTE nevysvetlia príčinu LIM/TIA.
Literatúra
1. Petty GW, Brown RD Jr, Whisnant JP et al. Ischemic stroke subtypes : a population-based study of functional outcome, survival, and recurrence. Stroke 2000; 31 : 1062-1068.
2. Becker EI, Jung A, Voller H et al. Cardiogenic embolism as the main cause of ischemic stroke in a city hospital: an interdisciplinary study. Vasa 2001; 30 : 43-52.
3. Kelley RE, Minagar A. Cardioembolic stroke: an update. South Med J 2003; 96 : 343-349.
4. Arboix A, Vericat MC, Pujades R et al. Cardioembolic infarction in the Sagrat Cor-Alianza Hospital of Barcelona Stroke Registry. Acta Neurol Scand 1997; 96 : 407-412.
5. Garay R. Kardioembolický infarkt mozgu z pohľadu neurológa. Kardiol prax 2003; 1 : 63-68.
6. Chen EW, Redberg RF. Echocardiographic evaluation of the patient with a systemic embolic event. In: Otto CM The practice of clinical echocardiography. Philadelphia: WB Saunders 2002 : 806-828.
7. The French Study of Aortic Plaques in Stroke Group. Atherosclerotic disease of the aortic arch as a risk factor for recurrent ischemic stroke. N Engl J Med 1996; 334 : 1216-1221.
8. Goldman M, Kronzon I, Goldstein S et al. Value of transesophageal echocardiography: results in 3,001 patients (abstract). Circulation 1994; 90 : 120.
9. Palazzuoli A, Ricci D, Lenzi C et al. Transesophageal echocardiography for identifying potential cardiac sources of embolism in patients with stroke. Neurol Sci 2000; 21 : 195-202.
10. Yahia AM, Shaukat AB, Kirmani JF et al. Treatable potential cardiac sources of embolism in patients with cerebral ischemic events: a selective transesophageal echocardiographic study. South Med J 2004; 97 : 1055-1059.
11. Rauh R, Fischereder M, Spengel FA. Transesophageal echocardiography in patients with focal cerebral ischemia of unknown cause. Stroke 1996; 27 : 691-694.
12. Sorescu D, Turk RJ, Cain M et al. Clinical and transthoracic echocardiographic predictors of abnormal transesophageal findings in patients with suspected cardiac source of embolism. Am J Med Sci 2003; 326 : 31-34.
13. Wolf PA, Abbott RD, Kannel WB Atrial fibrillation as an independent risk factor for stroke: the Framingham Study. Stroke 1991; 22 : 983-988.
14. Bornstein N, Corea F, Galllai V et al. Heart-brain relationship: atrial fibrillation and stroke. Clin Exp Hypertens 2002; 24 : 493-499.
15. Toman J. Nitrosrdeční útvary a zdroje embolií. In: Niederle P et al. Echokardiografie. 1. díl - Echokardiografie dospělých. Praha: Triton 2002 : 257-267.
16. Stöllberger C, Brainin M, Abzieher F et al. Embolic stroke and transoesophageal echocardiography: can clinical parameters predict the diagnostic yield? J Neurol 1995; 242 : 437-442.
17. Foniakin AV, Geraskina LA, Suslina ZA. Echocardiographic changes associated with risk of developing embolic complications in patients with ischemic stroke. Ter Arkh 2002; 74 : 71-74.
18. Benetka O, Block M, Sangha O et al. Clinical course of infective endocarditis in the late nineties: preliminary results of the ALKK endocarditis registry. Eur Heart J 1999; 20 : 362.
19. Lee RJ, Bartzokis T, Yeoh TK et al. Enhanced detection of intracardiac sources of cerebral emboli by transesophageal echocardiography. Stroke 1991; 22 : 734-739.
20. Comess KA, DeRook FA, Beach KW et al. Transesophageal echocardiography and carotid ultrasound in patients with cerebral ischemia: prevalence of findings and recurrent stroke risk. J Am Coll Cardiol 1994; 23 : 1598-1603.
21. Serafini O, Misuraca G, Greco F et al. Prevalence of structural abnormalities of the atrial septum and their association with recent ischemic stroke or transient ischemic attack: echocardiographic evaluation in 18631 patients. Ital Heart J Suppl 2003; 4 : 39-45.
22. Cerrato P, Grasso M, Imperiale D et al. Stroke in young patients: etiopathogenesis and risk factors in different age classes. Cerebrovasc Dis 2004; 18 : 154-159.
23. Mattioli AV, Aquilina M, Oldani A et al. Frequency of atrial septal aneurysm in patients with recent stroke: preliminary results from a multicenter study. Clin Cardiol 2001; 24 : 297-300.
24. Steiner MM, Di Tullio MR, Rundek T et al. Patent foramen ovale size and embolic brain imaging findings among patients with ischemic stroke. Stroke 1998; 29 : 944-948.
25. Beattie JR, Cohen DJ, Manning WJ et al. Role of routine transthoracic echocardiography in evaluation and management of stroke. J Intern Med 1998; 243 : 281-291.
26. Cujec B, Mainra R, Johnson DH. Prevention of recurrent cerebral ischemic events in patients with patent foramen ovale and cryptogenic strokes or transient ischemic attacks. Can J Cardiol 1999; 15 : 57-64.
27. Mattioli AV, Bonetti L, Aquilina M et al. Association between atrial septal aneurysm and patent foramen ovale in young patients with recent stroke and normal carotid arteries.
Cerebrovasc Dis 2003; 15 : 4-10.
28. Cerrato P, Imperiale D, Priano L et al. Transoesophageal echocardiography in patients without arterial and major cardiac sources of embolism: difference between stroke subtypes. Cerebrovasc Dis 2002; 13 : 174-183.
29. Agmon Y, Khandheria BK, Meissner I et al. Frequency of atrial septal aneurysms in patients with cerebral ischemic events. Circulation 1999; 99 : 1942-1944.
30. Dúbrava J. Foramen ovale patens. 1. časť - Epidemiológia, klinický význam a diagnostika. Kardiol prax 2004; 2 : 166-171.
31. Melcon CM, Rotta-Escalante R, Curatolo LM et al. Ischemic stroke: transesophageal echocardiographic findings. Rev Neurol 2003; 36 : 330-334.
32. Matsumura Y, Osaki Y, Fukui T et al. Protruding atherosclerotic aortic plaques and dyslipidaemia: correlation to subtypes of ischaemic stroke. Eur J Echocardiogr 2002; 3 : 8-12.
33. Blum A, Reisner S, Farbstein Y Transesophageal echocardiography (TEE) vs. transthoracic echocardiography (TTE) in assessing cardio-vascular sources of emboli in patients with acute ischemic stroke. Med Sci Monit 2004; 10: CR521-523.
34. Boon A, Lodder J, Cheriex E et al. Mitral annulus calcification is not an independent risk factor for stroke: a cohort study of 657 patients. J Neurol 1997; 244 : 535-541.
35. Meissner I, Whisnant JP, Khandheria BK et al. Prevalence of potential risk factors for stroke assessed by transesophageal echocardiography and carotid ultrasonography: the SPARC study. Stroke Prevention: Assessment of Risk in a Community. Mayo Clin Proc 1999; 74 : 862-869.
36. Roijer A, Lindgren A, Rudling O et al. Potential cardioembolic sources in an elderly population without stroke. A transthoracic and transoesophageal echocardiographic study in randomly selected volunteers. Eur Heart J 1996; 17 : 1103-1111.
37. Cheitlin MD, Armstrong WF, Aurigemma GP et al. ACC/AHA/ASE 2003 Guideline Update for the Clinical Application of Echocardiography: Summary Article: A Report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (ACC/AHA/ASE Committee to Update the 1997 Guidelines for the Clinical Application of Echocardiography). Circulation 2003; 108 : 1146-1162.
38. Kapral MK, Silver FL. Preventive health care. 1999 update: 2. Echocardiography for the detection of a cardiac source of embolus in patients with stroke. Canadian Task Force on Preventive Health Care. CMAJ 1999; 161 : 989-996.
39. McNamara RL, Lima JA, Whelton PK et al. Echocardiographic identification of cardiovascular sources of emboli to guide clinical management of stroke: A cost-effectiveness analysis. Ann Int Med 1997; 127 : 775-787.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2006 Issue 2
-
All articles in this issue
- Mutační analýza LQT genů u jedinců s polékovým prodloužením QT intervalu
- Význam kombinace změn fibrinogenu, mikro/makroalbuminurie a ateromatózy v karotickém řečišti pro posouzení rizika abnormálního nálezu zátěžového SPECT myokardu u asymptomatických diabetiků 2. typu
- Idiopatická komorová extrasystolie - katetrová ablace jako léčebná alternativa
- Autoimunitné tyreopatie u diabetikov
- Význam transezofageálnej echokardiografie v detekcii kardiogénnej a aortálnej embolizácie pri ložiskovej ischémii mozgu a tranzitórnych ischemických atakoch
- Význam virové kinetiky v počátcích léčby chronické hepatitidy C pegylovaným interferonem α a ribavirinem
- Přístroj Task Force Monitor v diagnostice synkopy pomocí testu na nakloněné rovině
- Role proteinů rodiny STAT v regulaci odpovědi na léčbu chronické hepatitidy C interferonem α
- Osteonekróza čelisti v průběhu léčby mnohočetného myelomu
- Tachykardií navozená kardiomyopatie: méně obvyklé příčiny, méně obvyklá řešení: 3 kazuistiky
- Je možné vyléčit typický flutter síní radiofrekvenční ablací do jedné hodiny?
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Idiopatická komorová extrasystolie - katetrová ablace jako léčebná alternativa
- Význam transezofageálnej echokardiografie v detekcii kardiogénnej a aortálnej embolizácie pri ložiskovej ischémii mozgu a tranzitórnych ischemických atakoch
- Je možné vyléčit typický flutter síní radiofrekvenční ablací do jedné hodiny?
- Osteonekróza čelisti v průběhu léčby mnohočetného myelomu