Imunoglobulin A a choroby ledvin
Immunoglobulin A and renal diseases
Immunoglobulin A (IgA) is a dominant immunoglobulin of the mucosal surfaces, but it is also present in plasma. In men and in hominoid primates it occurs in two subclasses: IgA1 and IgA2. Circulating IgA is mostly IgA1 monomer, secretory IgA is mostly dimer or tetramer with varying content of IgA1 and IgA2 on individual mucosal surfaces. Its main physiological function is a defence of the mucosal surfaces against infection. It binds either specifically to bacterial antigens or through its O-linked glycosidic chains, it binds to the lectins of bacterial cells and thus protects mucosal surfaces against bacterial adhesion and infection. On each of its heavy chain, IgA1 has at least two N-glycosidically bound oligosaccharides and 3 to 5 O-linked side-chains. The occurrence of O-glycosidically bound glycans on other circulating immunoglobulins is rare. An aberrant composition of these glycans may be an antigenic determinant for naturally occurring circulating antibodies. The resulting IgA-containing immune complexes, which are deposited in the glomeruli, may be the cause of IgA nephropathy. IgA glomerular deposits are also frequently present in many other primary and systemic glomerulonephritides.
Key words:
immunoglobulin A - urinary tract infection - IgA nephropathy - glomerulonephritis
Authors:
K. Matoušovic 1,2; J. Mestecky 3; M. Tomana 4; J. Novák 3
Authors‘ workplace:
Interní klinika 2. lékařské fakulty UK a FN Motol, Praha, přednosta doc. MUDr. Milan Kvapil, CSc.
1; I. interní klinika Lékařské fakulty UK a FN Plzeň, přednosta prof. MUDr. Karel Opatrný, jr., DrSc.
2; Departments of Microbiology, University of Alabama at Birmingham, Birmingham, Alabama, USA
3; Departments of Internal Medicine, University of Alabama at Birmingham, Birmingham, Alabama, USA
4
Published in:
Vnitř Lék 2006; 52(3): 256-262
Category:
Review
Overview
Imunoglobulin A (IgA) je dominantním imunoglobulinem slizničních povrchů, nalézáme jej ale také v plazmě. U člověka a u primátů se vyskytuje ve dvou podtřídách: IgA1 a IgA2. Cirkulující IgA je převážně monomer IgA1, sekretorní IgA je ponejvíce dimer nebo tetramer s různým poměrem IgA1 a IgA2 na jednotlivých sliznicích. Jeho hlavním fyziologickým úkolem je obrana slizničního povrchu proti rozvoji infekce. Rozvoji infekce (např. močové) zabraňuje buď specificky prostřednictvím antigen-vazebných míst nebo nespecificky tak, že se prostřednictvím svých cukerných řetězců váže na lektiny bakterií, a tím brání jejich adhezi na slizniční povrch. IgA1 má na každém ze svých těžkých řetězců nejméně dva N-glykozidicky vázané oligosacharidy a 3 až 5 O-glykozidicky vázaných cukerných řetězců. Výskyt O-glykozidicky vázaných oligosacharidů na cirkulujících glykoproteinech je vzácný. Odchylná skladba těchto řetězců může být antigenní determinantou pro přirozeně se vyskytující protilátky. Vznikají cirkulující imunitní komplexy obsahující IgA1, které se ukládají v glomerulech, a rozvíjí se IgA nefropatie. Uloženiny IgA v glomerulech se vyskytují rovněž u řady dalších primárních a systémových glomerulonefritid. Klíčová slova: imunoglobulin A - infekce močových cest - IgA nefropatie - glomerulonefritis
Úvod
Imunoglobulin A (IgA) je v souvislosti s ledvinovými chorobami vnímán obvykle jen v patogenetickém vztahu k IgA nefropatii. Uplatňuje se však i u řady dalších chorob. Sem patří jiné primární glomerulonefritidy, u nichž jsou vedle jiných imunoglobulinů častá i depozita IgA. Glomerulární uloženiny IgA jsou časté u alkoholické cirhózy a jiných chronických jaterních onemocnění, u nespecifických střevních zánětů, u dermatitis herpetiformis a u řady dalších chorob. Spolu s IgG hraje významnou roli v obraně proti rozvoji infekce močových cest. Jako sekreční imunoglobulin je přítomen v moči a v sekretech ženského i mužského pohlavního traktu a brání kolonizaci uropoetického traktu mikroogranizmy a rozvoji infekce.
Struktura IgA
Na rozdíl od IgG (molekula tvaru Y) má molekula IgA v roztoku tvar T. Skládá se ze dvou lehkých a ze dvou těžkých řetězců (obr. 1), vzájemně spojených kovalentní vazbou disulfidickými můstky. Dva vrcholy molekuly označujeme jako F(ab)2, bazální část jako Fc. Vazebné centrum pro antigeny je na dvou vrcholech molekuly a je součástí F(ab)2. Aminokyselinová skladba vazebného centra F(ab)2 je proměnná (variabilní část, značí se V), a proto je schopna vázat pro ni specifický antigen. Monomer IgA tedy má 2 vazebná místa pro tentýž antigen, sestávající z hypervariabilních segmentů lehkých a těžkých řetězců na vrcholu každého F(ab)2. Ostatní části (směrem k bázi Y) mají neměnné pořadí aminokyselin, stejné u všech molekul téže třídy IgA, a tvoří konstantní část molekuly, sestávající ze tří domén, označovaných jako Cα1, Cα2 a Cα3. Zcela na bázi molekuly je tzv. koncová část („tail“). Na Fc segment se váží různé receptory, které jsou přítomny hlavně na buňkách bílé krevní řady. Uprostřed molekuly, mezi C1 a C2 doménou těžkého řetězce, je tzv. pantová oblast („hinge region“).
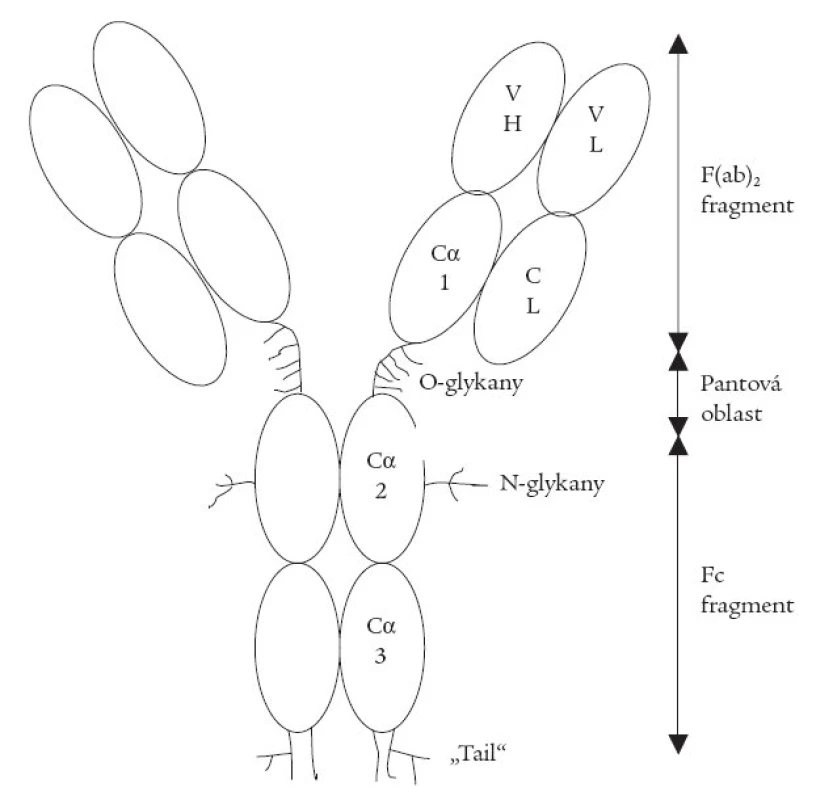
Molekuly IgA se snadno vzájemně spojují tzv. J-řetězcem a tvoří dimer až tetramer. Úměrně tomu přibývá specifických vazebných míst pro antigen (např. tetramer jich má 8).
IgA, stejně jako ostatní imunoglobuliny, je glykoprotein a v organizmu člověka a některých primátů se vyskytuje ve dvou podtřídách: IgA1 a IgA2. Obě podtřídy mají téměř shodnou skladbu aminokyselin bílkovinné kostry konstantní části molekuly. Výjimkou je pantová oblast. Fylogeneticky mladší IgA1 zde má navíc 13 aminokyselin, které byly inzertovány ve fylogeneze u člověka, šimpanze a gorily, ale chybí v IgA2 a v IgA ostatních obratlovců. Sedm z nich jsou hydroxyaminokyseliny serin a treonin. Tato část molekuly činí IgA výjimečným mezi cirkulujícími glykoproteiny, protože na hydroxylové skupiny serinu a treoninu se váží cukerné řetězce („O-linked“) [64], jimž je přisuzována významná úloha v rozvoji některých ledvinových chorob (IgA nefropatie, purpura Henochova-Schoenleinova). Tento typ cukerných řetězců se zřídka vyskytuje na cirkulujících glykoproteinech. Pantová oblast IgA1 člověka je též substrátem pro bakteriální IgA1 proteázy, produkované patogeny jako je Gonococcus, Meningococcus, Pneumococcus a Haemophilus, které IgA štěpí na F(ab)2 a Fc fragment, čímž interferují s jejich fagocytózou a blokují vazbu s protilátkami. Kromě toho má IgA na jiných místech těžkých řetězců další cukerné řetězce, vázané na postranní aminoskupinu argininu („N-linked“). Je to častá forma glykozylace i na cirkulujících glykoproteinech. Její vztah k rozvoji ledvinových chorob je však prozkoumán méně [48,66], přestože odchylná struktura tohoto cukerného řetězce na imunoglobulinu G byla popsána u systémového lupus erythematodes, revmatoidní artritidy a Crohnovy choroby [20,33,60].
Denní produkce IgA u člověka (50 mg/kg/24 h) daleko převyšuje produkci všech ostatních izotypů imunoglobulinů dohromady [38]. Jeho nižší plazmatická hladina (ve srovnání s IgG) je dána jeho krátkým poločasem. Na rozdíl od IgG a IgM dosahuje IgA hladin obvyklých v dospělosti až v době puberty.
IgA nacházíme jednak v cirkulaci, jednak na sliznicích (sekreční IgA - S-IgA). První je tvořen převážně v kostní dřeni, ve slezině a v lymfatických uzlinách, druhý převážně plazmatickými buňkami a lymfocyty ve sliznicích. Polymerický IgA produkovaný ve slizničních tkáních je po vazbě na transmembránový receptor, nazývaný polymerický imunoglobulinový receptor (polyIg R), selektivně transportován na slizniční povrchy spolu s částí receptoru nazývanou sekreční komponenta. Ta zvyšuje odolnost S-IgA k proteolytickým enzymům, zvláště v gastrointestinálním traktu.
Cirkulující IgA je tvořen především podtřídou IgA1 v monomérní formě (asi 85 %). Naopak S-IgA na sliznicích je převážně dimer nebo tetramer [20] s IgA1 jako dominantní podtřídou v dýchacím a horním gastrointestinálním traktu. V tlustém střevě a ženském pohlavním traktu je v mírné převaze IgA2. IgA2 má navíc dva alotypy, označované jako A2m(1) a A2m(2), jejichž zastoupení vykazuje rasovou závislost. Jde pouze o odlišnost struktury, specifický význam těchto podtříd není zatím dostatečně prozkoumán. Kromě IgA nacházíme na sliznicích také IgG a IgM. Pentamerní IgM je také vázán na polymerický imunoglobulinový receptor a secernován spolu s jeho zbytkem (sekreční komponenta) na povrchy sliznic. Jako slizniční imunoglobulin se uplatňuje hlavně při deficitu IgA (1 : 500 až 1 : 700 v Evropské a americké populaci, ale 1 : 18000 v Japonsku) [38]. Tito jedinci nemají vyšší výskyt infekcí močových cest (nikoliv však zánětů respiračního traktu) než osoby s plným zastoupením imunoglobulinů.
IgA jako slizniční imunoglobulin
IgA je tedy nejvýznamnější protilátkou slizničních povrchů [68]. Hlavním fyziologickým úkolem slizničních imunoglobulinů je bránit mikroorganizmům v adhezi na slizniční povrch. IgA se prostřednictvím svých cukerných řetězců (zahrnují i oligosacharidy J-řetězce a sekreční komponenty) váže na lektiny (adheziny) bakterií [48,49]. Tato vazba zabrání kontaktu mikroorganizmu s cukernými řetězci na epiteliích sliznic, adhezi k nim, zánětlivé aktivaci slizničních epitelií a v konečném důsledku rozvoji zánětu [51]. Jiným mechanizmem, kterým IgA brání průniku bakterií do sliznice, je jejich aglutinace. IgA a zejména S-IgA se váže prostřednictvím specifické protilátkové aktivity (a též svých cukerných řetězců) na mnohé bakteriální antigeny a aglutinuje je. S-IgA, na rozdíl od IgG, neaktivuje klasickou cestou komplement, a proto jeho interakce s mikroorganizmy nevyvolává agresivní zánět [51]. Může ovšem aktivovat komplement prostřednictvím proteinu vážícího manózu („mannan-binding protein“ - MBP). U ledvinových onemocnění byla tato cesta aktivace komplementu popsána jenom v několika publikacích [47]. Ve větší míře se však uplatňuje u některých autoimunitních nemocí, jako je revmatoidní artritida a nespecifické střevní záněty. V těchto případech se změněná struktura cukrů na IgG podílí na lokální aktivaci komplementu lektinovou cestou a vede k rozvoji zánětu.
Infekce močových cest (IMC)
IMC je definována jako přítomnost mikroorganizmů (nejčastěji G - bakterií) ve vývodných močových cestách případně v ledvinovém parenchymu a v prostatě. V klinické praxi představuje nejčastější postižení močového traktu. Třídíme ji z několika hledisek:
- a) na komplikovanou a nekomplikovanou podle přítomnosti/absence jiné patologie močového ústrojí (kameny, vezikoureterální reflux apod.) nebo přidružených onemocnění (diabetes mellitus, imunodeficience)
- b) na horní (pyelonefritis) a dolní (uretritis, cystitis, prostatitis) podle lokalizace
- c) na akutní a chronickou podle časového průběhu
- d) na asymptomatickou a symptomatickou z hlediska klinických projevů.
Moč zdravého člověka je sterilní. Hodnota významné (signifikantní) bakteriurie, udávaná jako 100 000 mikrobů/ml moče (CFU - „colony forming units“) byla odvozena empiricky. Nižší koncentrace bakterií je považována za možný důsledek kontaminace moči na konci uretry a distálně od jejího ústí a ev. dalšího pomnožení bakterií v moči před zpracováním. Počet bakterií v moči je však třeba zvažovat kriticky a s ohledem na klinický nález. Podle některých kritérií již 1000 CFU/ml (jediného mikroba) může provázet nekomplikovanou IMC u žen a 10000 CFU/ml je slučitelných s diagnózou pyelonefritidy, zejména u dětí [5,31]. Při IMC pronikají bakterie do močového traktu zdaleka nejčastěji z rezervoáru střevních bakterií v aborální části tlustého střeva přes perineum vzestupnou cestou. IMC začíná kolonizací vaginálního vestibula/předkožkového vaku a následně se infikuje močová trubice, močový měchýř a vzácně ledvinový parenchym a prostata (prostatický sekret má silné baktericidní vlastnosti).
O vzniku IMC rozhoduje jednak virulence mikroba, jednak obranné schopnosti sliznice močového traktu a jedince celkově. Prvním krokem v jejím rozvoji je adherence bakterií ke slizničnímu povrchu, druhým je interakce adherovaných bakterií se slizničními a infiltrujícími buňkami.
Adherence bakterií (E. coli) je nejčastěji zprostředkována jemnými výčnělky na jejich povrchu, tzv. fimbriemi („pili“). Většina IMC je vyvolána právě bakteriemi, které mají fimbrie [22]. Na povrchu fimbrií jsou molekuly bohaté oligosacharidy, kterým říkáme adheziny. Adheziny mají schopnost vázat se na glykoproteiny a glykolipidy sliznice močového, gastrointestinálního a genitálního traktu, a to právě na jejich cukerné řetězce [42]. Mají tedy charakter lektinu, tj. schopnost reagovat s cukernými řetězci různých molekul [17,23]. Častým vazebným místem fimbriemi opatřených bakterií je disacharid složený ze dvou molekul galaktózy [αGal(1-4)-Galβ]. Tento receptor je přítomen na uroepiteliích, v ledvinách a v tlustém střevě, ale ne na leukocytech, což chrání tyto bakterie před fagocytózou. Bylo činěno mnoho pokusů klasifikovat bakterie a jejich fimbrie ve vztahu k rozvoji a typu IMC, dosud však bez valného klinického významu. Nejvýznamnější je třídění fimbrií založené na schopnosti monosacharidu manózy inhibovat jejich vazbu na uroepitelie. Tato inhibice souvisí se skladbou a vlastnostmi jejich cukerných řetězců, které rozeznávají právě manózu (ale i jiné cukry) [42,59] na glykoproteinech a glykolipidech slizničních buněk močového traktu. To má praktický význam v tom, že bakterie s fimbriemi, jejichž vazba na epitelie není inhibována manózou („Type 1 fimbrie“), mají tendenci vyvolat akutní pyelonefritidu [15], zatímco ty, jejichž adherenci manóza inhibuje („Type 2 fimbrie“), jsou častou příčinou méně agresivních IMC.
Adherovaný mikrob vystupňuje činnost svých genů pro virulenci a růst. Při nedostatečně fungujících obranných mechanizmech mohou adherující mikroby prolomit slizniční bariéru a prostřednictvím transmembránových signálů aktivovat buňky sliznice. Tím začíná druhý krok v rozvoji IMC, kterým je sekrece chemokinů, cytokinů a reaktivních radikálů kyslíku [34] buňkami sliznice, s atrakcí zánětotvorných buněk, především neutrofilních leukocytů (např. IL-8 je silným signálem pro atrakci polymorfonukleárních leukocytů) [26]. Následuje rozvoj zánětu.
Při zachované funkci obranných slizničních systémů jsou mikroby po vazbě na S-IgA a jiné vazebné molekuly sliznic [1,56] eliminovány ze slizničního povrchu a proces se vyhojí. K eliminaci bakterií přispívá samotná mikce (dostatečný příjem tekutin s následnou polyurií), antibakteriální vlastnosti moči, osmolarita moče, pH, imunoglobuliny, Tammův-Horsfallův mukoprotein (s O-glykozidickými cukernými řetězci aj). a další obranné schopnosti sliznice (defenziny). V experimentu jsou bakterie eliminovány po jejich instilaci do močového měchýře v průběhu tří dnů. U některých pacientů je druhá fáze (tj. reakce sliznice na adhezi) defektní nebo je vystupňována virulence mikroba a vznikne IMC. Zánět se obvykle vyhojí per defectum a vznikne jizva. Ta predisponuje k recidivám IMC. Příkladem je zjizvení ledvinové tkáně při první atace horní močové infekce u vezikoureterálního refluxu a častý rozvoj chronické intersticiální nefritidy v pozdějším období. V jiné situaci buď správně nefunguje signální systém pro atrakci neutrofilů a/nebo mikroorganizmy neprodukují faktory virulence ve významném množství a vyvíjí se saprofytický vztah mezi hostitelským organizmem a patogenem („friendly co-existence“) [32]. Klinickým výsledkem je stav označovaný jako asymptomatická bakteriurie, častá u žen po menopauze. Není ji třeba léčit. Výjimkou jsou imunosuprimovaní pacienti, diabetici a zejména těhotné ženy, u nichž může přejít v akutní pyelonefritidu.
Z hlediska imunitních procesů hrají základní roli v obraně močového systému proti infekci procesy nespecifické („innate“) imunity, které jsou nezávislé na typu antigenu [8,58]. Většina IMC se vyhojí dříve, než se dostaví specifická imunitní reakce.
V ledvině ani ve sliznici vývodných močových cest není, na rozdíl např. od gastrointestinálního traktu, přítomna preexistující lymfatická tkáň. V mukóze a submukóze se nacházejí jen ojedinělé CD8+ a CD4+ lymfocyty, γ,δ T-buňky tam zcela chybí [29]. Teprve při IMC dávají infiltrující lymfocyty vznik lymfocytárním agregátům [25].
V moči zdravých jedinců se nacházejí v malém množství imunoglobuliny IgA, IgG a IgM [11,19]. Koncentrace IgA v moči se pohybuje v širokém rozmezí od 170 do 1000 ng/ml a IgG od 50 do 535 ng/ml [55]. Devadesát procent IgA v normální moči je polymer, 10 % je v monomerické formě. Jen malé množství močového IgA je IgA2 podtřídy, zatímco IgA1 polymer, obsahující J-řetězec, tvoří 90 % močového IgA [19].
Sérové specifické protilátky stoupají v průběhu IMC u pyelonefritidy způsobené E. coli a jsou namířeny proti O, případně proti K antigenu [30] a dále proti fimbriím, jejichž vazbu manóza neblokuje [14]. Jejich přítomnost je však značně nekonzistentní. Specifické protilátky proti bakteriím, které vyvolaly pyelonefritidu u dětí, byly nalezeny v moči za 7 až 10 dní po infekci a jsou ponejvíce S-IgA typu. Bakterie však mohou v močových cestách dlouhodobě perzistovat navzdory vysoké hladině specifických sérových protilátek [67]. Rovněž to, že IMC není častější při nízké hladině sérového IgA, ani při deficienci jiných imunoglobulinů, svědčí pro nepodstatnou roli specifické imunity při IMC. Vzhledem k těmto údajům je zřejmé, že ani vakcinace nehraje v prevenci a léčbě IMC zásadní roli, navzdory ojediněle popsaným případům úspěšné odezvy. Byly zkoušeny vakcíny proti lipopolysacharidu, kapsulárnímu polysacharidu i proti fimbriím enterobakterií [64], ale vzhledem k rozmanitosti antigenních epitopů vyvolávajících bakterií není vakcinace spolehlivým preventivním ani léčebným zásahem [45].
Jelikož adheze bakterií ke slizničnímu povrchu je prvním krokem ve vývoji IMC, byly činěny pokusy farmakologicky ji odvrátit [53], buď blokádou bakteriálních lektinů nebo znormalizováním bakteriální flóry ve vagíně. Prvním přístupem je např. doporučení požívat plody bohaté manózou, která se naváže na bakteriální lektiny a tím brání adhezi na cukerné řetězce glyko - a lipoproteinů sliznic (fimbrie senzitivní na manózu). Tak např. strava obsahující borůvky a brusinky, která je bohatá manózou, byla úspěšně použita při recidivujících IMC vyvolaných E. coli u starých žen [21,41]. Dalším přístupem tohoto druhu je prevence IMC intravaginální aplikací Lactobacillus, který znormalizuje bakteriální flóru a pH ve vagíně a tím potlačí růst patogenních mikrobů (Pseudomonas, Klebsiella) [43,46].
IgA nefropatie
IgA nefropatie (IgAN) byla popsána v roce 1968 [9] jako glomerulonefritida s nápadnými uloženinami IgA v glomerulárním mezangiu, převažujícími nad uloženinami ostatních imunoglobulinů a komplementu; někdy je IgA jediným imunoglobulinem depozit. Tito pacienti mají v časném stadiu choroby významnou, někdy i krátkodobě makroskopickou erytrocyturii, malou proteinurii (do 1 g/24 h) a zdánlivě benigní prognózu. V pozdějším průběhu však u některých pacientů narůstá proteinurie, objevuje se vyšší krevní tlak a pomalu klesá glomerulární filtrace [16]. Dlouhodobá pozorování ukázala, že za 20 let po diagnóze se u 30 % až 40% pacientů rozvinulo chronické selhání ledvin [16]. Specifická léčba této choroby není známa a proto je její patogeneze usilovně zkoumána. Posledních 15 let přineslo v tomto ohledu mnoho poznatků. Ukazuje se stále zřetelněji, že odchylná skladba cukerných řetězců pantové oblasti IgA1 zde hraje významnou, ne-li zásadní roli [2,28,37,61]. Protože o patogeneze IgAN bylo již v české literatuře pojednáno [35,36,39], uvádíme jen základní poznatky. Již v roce 1988 bylo zjištěno, že lektin jakalin se méně váže na IgA pacientů s IgAN než na IgA zdravých jedinců [4]. Jelikož se tento lektin specificky váže na disacharid N-acetylgalaktozamin-galaktóza, svědčilo to pro to, že tento disacharid, který se běžně vyskytuje u normálních jedinců, chybí u pacientů s IgAN. Takto neúplně syntetizovaný cukerný řetězec končí monosacharidem N-acetylagalaktozamin (GalNAc) místo galaktózou. Proti GalNAc má každý jedinec přirozeně se vyskytující protilátky. Po jejich vazbě na GalNAc se vytvoří imunitní komplexy [2,13,17,62], které cirkulují v plazmě a z dosud ne zcela jasných důvodů se ukládají v glomerulech. Jelikož IgA (na rozdíl od IgG) neaktivuje komplement klasickou cestou, má onemocnění obvykle povahu pomalu progredujícího zánětu, s mírnou hypercelularitou glomerulu. Proces však postupně vyústí ve sklerózu glomerulu a intersticia, provázené postupným úbytkem funkce. Progrese IgAN do renální insuficience je důsledkem postupně zanikajících nefronů a přetížení reziduálních nefronů s glomerulární hypertenzí a zvýšenou sekrecí cytokinů.
IgAN se také - i když jen ojediněle - vyskytuje současně s řadou jiných chorob (dermatitis herpetiformis, chronická jaterní onemocnění, nespecifické střevní záněty, ankylozující spondylitida) [16,18,44]. Není zatím jasné, zda jde pouze o koincidenci [10] nebo o společné patogenetické mechanizmy. O typizaci cukerných řetězců cirkulujícího IgA ani jeho uloženin v ledvinách nejsou u těchto chorob v literatuře zprávy.
V pitevním nálezu osob, kteří neměli klinicky zřejmou IgAN ani jinou ledvinovou chorobu, byla mezangiální depozita IgA náhodným nálezem u 0,6 až 9 % pitvaných [27,54].
Jiné glomerulonefritidy a IgA depozita
Purpura Henochova-Schoenleinova (HSP) je systémová vaskulitida s postižením ledvin morfologicky nerozlišitelným od IgAN [6]. Dalšími orgány, v nichž se ukládají imunitní komplexy obsahující IgA, jsou kůže, gastrointestinální trakt a klouby. Proto je onemocnění provázeno i klinickými projevy ze strany těchto orgánů. Podstatou HSP je stejný defekt „O-glykozidicky vázaných oligosacharidů“ jako u IgAN. Byl však prokázán jen tehdy, když bylo přítomno postižení ledvin [3]. U pacientů, kteří mají jen mimoledvinové projevy, jsou cukerné řetězce pantové oblasti dostavěny stejně, jako u zdravých jedinců.
Glomerulární uloženiny IgA jsou prakticky konstantním nálezem v biopsii ledviny u pacientů se systémovým lupus erythematodes [40]. Dále se nacházejí u akutní glomerulonefritidy (spolu s IgG a C3) [24] a u membranózně-proliferativní glomerulonefritidy (spolu s C3, IgG a ev. IgM), u níž může být IgA dominujícím imunoglobulinem. Onemocnění je potom považováno za vystupňovanou formu IgAN. Zcela výjimečně je IgA dominantním imunoglobulinovým depozitem ve formě granulárních nebo lineárních depozit podél kapilárních kliček u rychle progredující glomerulonefritidy [52,63].
Závěr
Je s podivem, že v současné imunologické i klinické literatuře není úloha IgA, který je u člověka produkován v daleko největší míře ze všech imunoglobulinů, dostatečně zdůrazněna. Navzdory tomu, že u pacientů s deficiencí IgA je výskyt autoimunitních onemocnění a slizničních nádorů zřetelně zvýšen, je třeba zdůraznit, že dominantní funkcí IgA je potlačení zánětlivých reakcí v mukózních a systémových tkáních. Poruchy normální struktury cukerné složky IgA mohou vést k rozvoji závažných chorob, na což jsme se snažili v této publikaci upozornit.
Tato publikace byla podpořena výzkumným záměrem MZd ČR MSM 0021620819 a granty NIH DK 57750 a DK 61525.
prof. MUDr. Karel Matoušovic, DrSc.
www.fnmotol.cz
e-mail: kmatousovic@hotmail.com
Doručeno do redakce: 2. 12. 2005
Přijato po recenzi: 2. 1. 2006
Sources
1. Abraham SN, Duncan MJ, Li G et al. Bacterial penetration of the mucosal barrier by targeting lipid rafts. J Investing Med 2005; 53 : 318-321.
2. Allen AC, Harper SJ, Feehally J. Galactosylation of N - and O-linked carbohydrate moieties if IgA1 and IgG in IgA nephropathy. Clin Exp Immunol 1995; 100 : 470-474.
3. Allen AC, Willis FR, Beattie TJ et al. Abnormal IgA glycosylation in Henoch-Schoenlein purpura restricted to patients with clinical nephritis. Nephrol Dial Transplant 1998; 13 : 930-934.
4. Andre PM, Pogamp P, Chevet P. Impairment of jacalin binding to serum IgA in IgA nephropathy. J Clin Lab Anal 1990; 4 : 115-119.
5. Arav-Boger L, Leibovici L, Danon YL. Urinary tract infection with low and high colony count in young women. Spontaneous remission and single dose vs. multiple-day treatment. Arch Intern Med 1994; 154 : 300-304.
6. Ballinger S. Henoch-Schoenlein purpura. Curr Opin Rheumatol 2003; 15 : 591-594.
7. Barrat J, Feehally J IgA nephropathy. J Am Soc Nephrol 2005; 86 : 2088-2097.
8. Basset C, Holton J, O´Mahony R et al. Innate immunity and pathogen-host interaction. Vaccine 2003; 21 : 12-23.
9. Berger J, Hinglais J. Les depôts intercapillaires d’IgA-IgG. J Urol Nephrol 1968; 74 : 694-695.
10. Berger J, Yaneva H, Nabarra B. Glomerular changes in patients with cirrhosis of the liver. Adv Nephrol Necker Hosp 1977; 7 : 3-14.
11. Bienenstock J, Tomasi TB Jr. Secretory gamma A in normal urine. J Clin Invest 1968; 47 : 1162-1171.
12. Bogers WM, Stad RK, van Es LA et al. Immunoglobulin A: interaction with complement, phagocytic cells and endothelial cells. Complement Inflamm 1991; 8 : 347-358.
13. Coppo R, Amore A. Abberant glycosylation in IgA nephropathy. Kidney Int 2004; 65 : 1544-1547.
14. De Ree JM, Schwillens P, van den Bosch JF. Monoclonal antibodies raised against Pap fimbriae recognize minor component(s) involved in receptor binding. Microb Pathog 1987; 2 : 113-121.
15. Dodson KW, Pinkner JS, Rose T et al. Structural basis of the interaction of the pyelonefritic E. coli adhesion to its human kidney receptor. Cell 2001; 105 : 733-743.
16. Donadio JV. IgA nephropathy. Recent development. N Engl J Med 2002; 347 : 738-748.
17. Eden CS, Leffler H. Glycosfingolipids of human urinary tract epithelial cells as possible receptors for adherig Escherichia coli bacteria. Scand J Infect Dis 1980; Suppl. 24 : 144-147.
18. Forshaw MJ, Guirguis O, Hennigan TW. IgA nephropathy in association with Crohn's disease. J Colorectal Dis 2005; 20 : 463-465.
19. Galla JH, Spotswood MF, Harrison LA et al. Urinary IgA in IgA nephropathy and Henoch-Schoenlein purpura. J Clin Immunol 1985; 5 : 298-306.
20. Garred P, Madsen HO, Marquart H et al. Appendix 1. Collection and processing of human mucosal secretions. In: Mestecky J et al. Mucosal Immunology. 3. ed. Amsterdam: Elsevier Academic Press 2005 : 1829-1839.
21. Garred P, Madsen HO, Marquart H et al. Two edged role of mannose binding lectin in rheumatoid arthritis: a cross sectional study. J Rheumatol 2000; 27 : 26-34.
22. Godaly G, Bergsten G, Fischer H et al. Urinary tract infection and the mucosal immune system. In: Mestecky J et. al. Mucosal Immuniology. 3. ed. Amsterdam: Elsevier Academic Press 2005 : 1601-1612.
23. Goldhar J. Bacterial lectin-like adhesions: Determination and specificity. Methods Enzymol 1994; 236 : 211-231.
24. Haas M. Incidental healed postinfectious glomerulonephritis: a study of 1012 renal biopsy specimens examined by electron microscopy. Hum Pathol 2003, 34 : 3-10.
25. Hanson LA, Ashraf R, Cruz JR et al. Immunity related to exposition and bacterial colonization of the infant. Acta Paediatr Scand Suppl. 1990; 365 : 38-45.
26. Harraoka M, Hang L, Frendeus B et al. Neutrophil recruitment and resistance to urinary tract infection. J Infect Dis 1999; 180 : 1220-1229.
27. Hauer C, Waldherr R, Ritz E. Prevalence of immune complex-associated glomerulonephritis in hypertensive subject. J Hum Hypert 1994; 8 : 181-183.
28. Hiki Y, Horii A, Iwase H et al. O-linked oligosaccharide on IgA1 hinge region in IgA nephropathy. Fundamental study for precise structure and possible role. Contrib Nephrol 1995; 111 : 73-84.
29. Christmas TJ. Lymphocyte sub-populations in the bladder wall in normal bladder, bacterial cystitis and interstitial cystitis. Brit J Urol 1994, 73 : 508-513.
30. Kaijser B, Ahlstedt S. Protective capacity of antibodies against Escherichia coli and K antigens. Infect Immun 1977; 17 : 268-269.
31. Kanellopoulos TA, Vassilakos PJ, Kantzis M et al. Low bacterial count urinary tract infection in infants and young children. Europ J Pediatr 2005; 164 : 355-361.
32. Kass EH. Asymptomatic infections of the urinary tract. J Urol 2002; 167 : 1016-1019.
33. Malhotra R, Wormald MR, Rudd PM et al. Glycosylation changes of IgG associated with rheumatoid arthriris can activate complement via the mannose-binding protein. Nat Med 1995; 1 : 237-243.
34. Mundi H, Bjorksten B, Svanborg C et al. Extracellular release of reactive oxygen species from human neutrophils upon interaction with Escherichia coli strains causing renal scarring. Infect Immun 1991; 59 : 4168-4172.
35. Matoušovic K, Konečný K, Městecký J et al. IgA nefropatie. Význam glykozylace imunoglobulinu A a klinické projevy. Čas Lék Čes 2002; 141 : 729-734.
36. Matoušovic K, Martínek V. IgA nefropatie. Užití moderních laboratorních metod a biopsie ledviny v diagnostice. Vnitř Lék 2003; 49 : 869-973.
37. Mestecky J, Tomana M, Crowley-Nowick PA et al. Defective galactosylation and clearance of IgA1 molecules as a possible etiopathogenic factor in IgA nephropathy. Contrib Nephrol 1993; 104 : 172-182.
38. Mestecky J et al. Mucosal Immunology 3. ed. Amsterdam: Elseviers Academic Press: 2005.
39. Monhart V. IgA nefropatie. Interní medicína pro praxi 2001; 10 : 512-516.
40. Nossent H, Berden J, Swaak T. Renal immunofluorescence in the prediction of renal outcome in patients with proliferative lupus nephritis. Lupus 2000; 9 : 504-510.
41. Ofek I, Goldhar J, Zafriri D et al. Anti-Escherichia coli adhesin activity of cranberry and bluberry juices. N Engl J Med 1991; 324 : 1599.
42. Ofek I, Hasty DL, Abraham SN et al. Role of bacterial lectins in urinary tract infections. Molecular mechanisms for diversification of bacterial surface lectins. Adv Exp Med Biol 2000; 485 : 183-192.
43. Osset J, Bartolome RM, Garcia E et al. Assessment of the capacity of Lactobacillus to inhibit the growth of uropathogens and block their adhesion to vaginal epithelial cells. J Infect Dis 2001, 183 : 485-491.
44. Peeters AJ, van den Wall Bake AW, Daha MR et al. Inflammatory bowell diseases and ankylosing spondylitis associated with cutaneous vasculitis, glomerulonephritis and circulating IgA immune complexes. Ann Rheum 1990; 49 : 638-640.
45. Prát V, Matoušovic K, Horčičková M et al. Prevence recidivující infekce močových cest polymikrobiální vakcínou Solco-Urovac. Čas Lék Čes 1989; 128 : 181-183.
46. Reid G. The potential role of probiotics in pediatric urology. J Urol 2002; 168 : 1512-1517.
47. Roos A, Bouwman LH, van Gijlswijk-Jansen H et al. Human IgA activates the complement system via the mannan-binding lectin pathway. J Immunol 2001; 1 : 2861-2868.
48. Royle L, Roos A, Harvey DJ et al. Secretory IgA N - and O-glycans provide a link between the innate and adaptive immune systems. J Biol Chem 2003; 278 : 20140-20153.
49. Rudd PM, Wormald MR, Dwek RA. Sugar-mediated ligand-receptor interactions in the immune system. Trends Biotechnol 2004; 22 : 524-530.
50. Russell MW, Spotswood MF, Julian BA et al. Detection of food antigen-specific IgA immune complexes in human sera. Adv Exp Med Biol 1987; 216A: 813-820.
51. Russell MW, Sibley DA, Nikolova EB et al. IgA antibody as a non-inflammatory regulator of immunity. Biochem Soc Trans 1997; 25 : 466-470.
52. Shaer AJ, Stewart LR, Cheek R et al. IgA antiglomerular basement membrane nephritis with Crohn´s disease: a case report and review of glomerulonephritis in inflammation bowel disease. Am J Kidney Dis 2003; 41 : 1097-1109.
53. Sharon N, Ofek I. Fighting infectious diseases with inhibitors of microbial adhesion to host tissues. Crit Rev Food Sci Nutr 2002; 42 : 267-272.
54. Suganuma T. Glomerular IgA deposits in an autopsy study. Nippon Jinzo Gakkai Shi 1994; 36 : 813-822.
55. Sxanborg-Edén C, Kulhavy R, Marild S et al. Urinary immunoglobulins in healty individuals and children with acute pyelonephritis. Scand J Immunol 1985; 21 : 305-313.
56. Svanborg-Eden C, Svennerholm AM. Secretory immunoglobulin A and G antibodies prevent adhesion of Escherichia coli to human urinary tract epithelial cells. Infect Immun 1978; 22 : 790-797.
57. Svanborg-Edén C, de Man P, Sandberg T. Renal involvement in urinary tract infection. Kidney Int 1991; 39 : 541-549.
58. Svanborg C, Bergsten G, Fischer H et al. The “innate” response protects and damages the infected urinary tract. Ann Med 2001; 33 : 563-570.
59. Topley N, Steadman R, Mackenzie R et al. Type I fimbriae strains of Escherichia coli initiate renal parenchymal scarring. Kidney Int 1989; 36 : 609-616.
60. Tomana M, Schrohenloher RE, Reveille JD et al. Abnormal galactosylation of serum IgG in patients with systemic lupus erythematosus and members of families with high frequency of autoimmune disease. Rheumatol Int 1992; 12 : 191-194.
61. Tomana M, Matousovic K, Julian BA et al. Galactose-deficient IgA1 in sera of IgA nephropathy patients is present in complexes with IgG. Kidney Int 1997; 52 : 509-516.
62. Tomana M, Novak J, Julian BA et al. Circulating immune complexes in IgA nephropathy consist of IgA1 with galactose-deficient hinge region and antiglycan antibodies. J Clin Invest 1999; 104 : 73-81.
63. Tumlin JA, Lohavichan V, Hennigar R. Crescentic, proliferative IgA nephropathy: clinical and histological response to methylprednisolone and intrsavenous cyclophosphamide. Nephrol Dial Transpl 2003; 18 : 1321-1329.
64. Uehling DT, Balish E. Antibacterial activity of urinary immunoglobulins. Birth Defects Orig Artic Ser 1977; 13 : 421-424.
65. Van den Steen P, Ruud PM, Dwek RA et al. Concepts and principles of O-linked glycosylation. Crit Rev Biochem Mol Biol 1998; 33 : 151-208.
66. Vogt G, Chapgier A, Yang K et al. Gains of glycosylation comprise an unexpectedly large group of pathogenic mutations. Nat Genet 2005; 37 : 692-700.
67. Vosti KI, Monto AS, Rantz LA. Host-parasite interaction in patients with infections due to Escherichia coli. II. Serologic response of the host. J Lab Clin Med 1965; 66 : 613-626.
68. Woof JM, Mestecky J. Mucosal immunoglobulins. In: Mestecky J et. al. Mucosal Immunology, 3. ed. Amsterdam Elsevier Academic Press 2005 : 64-82.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2006 Issue 3
-
All articles in this issue
- Přínos fluorodeoxyglukózové pozitronové emisní tomografie (FDG-PET) u mnohočetného myelomu
- Vliv podání Escherichia coli Nissle (Mutaflor) na střevní osídlení, endotoxemii, funkční stav jater a minimální jaterní encefalopatii u nemocných s jaterní cirhózou
- Vliv vysokodávkované chemoterapie s následnou transplantací krvetvorných buněk na funkci levé komory srdeční u nemocných s maligními lymfomy léčenými doxorubicinem v primární chemoterapii
- Hypertenze v těhotenství
- Srovnání sérových hladin vybraných biologických ukazatelů u monoklonální gamapatie nejistého významu a mnohočetného myelomu
- Neinvazivní ventilační podpora u pacientů s akutní exacerbací chronické obstrukční plicní nemoci (CHOPN)
- Asymetrický dimetylarginin - nový rizikový faktor kardiovaskulárních onemocnění
- Imunoglobulin A a choroby ledvin
- Prodloužení QT intervalu jako důsledek kumulace rizikových faktorů - kazuistika
- Glibenklamid místo inzulinu: nová šance pro pacienty s diabetem MODY 3: kazuistika
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Vliv podání Escherichia coli Nissle (Mutaflor) na střevní osídlení, endotoxemii, funkční stav jater a minimální jaterní encefalopatii u nemocných s jaterní cirhózou
- Prodloužení QT intervalu jako důsledek kumulace rizikových faktorů - kazuistika
- Imunoglobulin A a choroby ledvin
- Glibenklamid místo inzulinu: nová šance pro pacienty s diabetem MODY 3: kazuistika
